Method Article
Üç Boyutlu Eş-Kültür Sistemi Kullanılarak Yumurtalık Kanseri Kök Benzeri Hücrelerin Anjiyogenetik Özelliklerinin Değerlendirilmesi, NICO-1
Bu Makalede
Özet
Yumurtalık kanseri kök hücreleri (OKSK) kanserin başlamasından, nüksetmesinden, terapötik direncinden ve metastazından sorumludur. OCSC vasküler nişinin, OKSC'lerin kendi kendini yenilemesini teşvik ettiği ve kemorezistansa yol açtığı düşünülmektedir. Bu protokol, in vitro olarak tekrarlanabilir bir OCSC vasküler niş model oluşturmak için temel sağlar.
Özet
Kanser kök hücreleri (CSC'ler), bitişik stromal hücrelerden, damarlardan ve hücre dışı matristen oluşan bir mikro ortam oluşturan destekleyici bir niş içinde bulunur. CSC'lerin endotel gelişimine katılma yeteneği, tümörigenez ve tümör metastazı mekanizmalarının genel olarak anlaşılmasına doğrudan katkıda bulunan önemli bir özellik oluşturmaktadır. Bu çalışmanın amacı, yumurtalık kanseri kök hücrelerinin (OKSK) tümör başlatma yeteneğini araştırmak için tekrarlanabilir bir metodoloji oluşturmaktır. Bu çalışmada, endotel hücreleri ve OKSK'ler arasındaki neovaskülarizasyon mekanizması ve endotel hücrelerinin morfolojik değişiklikleri in vitro ko-kültür modeli NICO-1 kullanılarak incelenmiştir. Bu protokol, OKSK'leri çevreleyen neovaskülarizasyon adımının zaman içinde görüntülenmesini sağlar. Bu teknik, tümör metastazında OKSK'lerin anjiyogenetik özellikleri hakkında fikir verebilir.
Giriş
Yumurtalık kanseri, dünya çapında kadınlarda sekizinci en yaygın malignitedir ve yaklaşık 300.000 yeni tanı ve yılda tahmini 180.000 ölüm1. İlk tanıda, yumurtalık kanseri sıklıkla şiddetli semptomlarla ortaya çıkar ve hastaların yaklaşık% 75'i zaten evre III-IV'tedir. Buna göre, 5 yıllık sağkalım oranı% <30'dur ve mortalite oranı jinekolojik kanserler arasında en yüksektir2, yumurtalık kanseri tedavisinin etkinliği, debulking cerrahisinin başarılı bir şekilde gerçekleştirilmesi, kemoterapiye direnç ve ilk tedaviden sonra nüks gibi klinik faktörlere büyük ölçüde bağlıdır.
Yumurtalık kanseri dokuları hiyerarşik olarak organize edilmiştir, tüm tümör bileşenleri eşit derecede torunlar üretemez. Kendi kendini yenileyebilen ve heterojen bir tümör hücresi popülasyonu üretebilen tek hücrenin kanser kök hücrelerini (CSC'ler) temsil ettiği düşünülmektedir3. CSC kendini yenileme ve tümör başlangıcına, destekleyici bir niş sağlamak amacıyla tümör mikro çevresini yeniden şekillendirmek için anjiyogenezin teşvik edilmesi eşlik eder. Bununla birlikte, önceki modeller, çoklu pasajdan sonra sferoidlerin bozulması nedeniyle klinik örneklerden türetilen CSC'lerin yetiştirilmesinin sınırlı tekrarlanabilirliği nedeniyle in vitro analizler için kullanılamamıştır. Daha yakın zamanlarda, hastalardan CSC'leri yetiştirmek için deneysel yöntemlerçeşitli uygulamalar için geliştirilmiştir 4,5,6,7. Özellikle, CSC'lerin serumsuz ortama sahip ultra düşük bağlantı plakalarında sferoidler oluşturarak büyüme özelliğinden yararlanarak, ekili CSC'ler, çok soylu farklılaşma potansiyeline sahip normal tümör hücrelerinde eksprese edilmeyen bir kök hücre yüzey belirtecini ifade etmek için uyarılır 8,9.
Son veriler, peritonda yayılım olarak görselleştirilen uykudaki over (O)CSC'lerin kalıcılığının, tekrarlayan tümörler olarak rejenerasyonları ile ilişkili olduğunu göstermiştir10. OCSC'lerin moleküler ve biyolojik özelliklerinin anlaşılması, bu hücrelerin etkili bir şekilde hedeflenmesine ve eradikasyonuna izin verebilir ve bu da potansiyel tümör remisyonuna neden olabilir. Özellikle, CSC'lerin anjiyogenez11'deki rollerinin hücresel ve moleküler mekanik özellikleri hakkında çok az şey bilinmektedir. Bu nedenle, bu protokolde, klinik ortamda metastatik bölgedeki CSC'lerin ve endotel hücrelerinin tümör mikroortamını taklit edebilen ko-kültür modelini kullanarak endotel hücrelerinin anjiyojenik özelliğini araştırmak için in vitro ortamda hasta kaynaklı OCSC'ler kullandık. Nihayetinde, neovaskülarizasyon, tümör büyümesini ve metastazını desteklemek için gerekli kritik bir süreç oluşturduğundan, mekanizmasının daha iyi anlaşılması, metastatik bölgedeki OKSK'ler için yeni bir hedefleme tedavisinin geliştirilmesine izin verecektir.
Burada, CSC'leri çevreleyen neovaskülarizasyon adımını zaman çizelgesinde görselleştirmek için bir protokol sunuyoruz. Protokolün avantajı, 3D ko-kültür sistemi NICO-1 kullanılarak tamamen tekrarlanabilir araştırmalara izin vermeyi içerir, böylece endotel hücre anjiyogenezi sırasında OKSC kaynaklı tümör başlatma yeteneğinin hastalar üzerindeki etkilerinin gözlemlenmesine izin verir.
Protokol
Tüm prosedürler insan refahı için Etik Kurul tarafından onaylanan protokol kapsamında gerçekleştirilmiştir. Tüm hastalar, örneklerinin araştırma kullanımı için yazılı bilgilendirilmiş onam verdiler ve bu çalışma için dokuların toplanması ve kullanılması, Teikyo Üniversitesi İnsan Genomu, Gen Analizi Araştırma Etik Kurulu tarafından onaylandı.
1. Yumurtalık kanseri kök hücrelerinin (OKSK) izolasyonu ve kültürü Yumurtalık kanseri ve asit hastalarından seviye 2 biyogüvenlik kabininde
- Kanser kök hücrelerini, parasentez yoluyla elde edilen insan yumurtalık kanseri asitlerinden izole edin. Yeterli sayıda kanser kök hücresi almak için hastalardan en az 100-250 mL asit toplayın. Ek olarak, kanser kök hücre belirteçlerinin (yani, EpCAM, Calretinin, CD133, CD44, CD45, ALDH1 ve Oct4) ve yumurtalık kanseri belirteçlerinin (pAX-8, WT-1) ekspresyon profillerini akış sitometrisi ile değerlendirin.
- İnsan yumurtalık kanseri asitlerini asit aspirasyonundan sonra 24 saat içinde oda sıcaklığında 10 dakika boyunca 300 x g'da santrifüj edin.
- Süpernatantı çıkarın ve 2 mL OCSC ortamı ve 8 mL% 30 Histodenz / fosfat tamponlu salin (PBS, pH 7.4) çözeltisi ekleyin.
- OCSC ortamını hazırlayın: StemPro hESC takviyesi, L-glutamin (GlutaMAX ortamı) ile DMEM⁄F-12,% 25 BSA, 100 μM 2-merkaptoetanol, 8 ng / mL FGF BASIC, 10 μM insülin ve 20 μM Y-27632.
- 15 mL'lik bir tüpte 1.1.2 adımında hücre çözeltisine 2 mL OCSC ortamını dikkatlice yerleştirin ve frenlemeden sallanan kova rotorunda oda sıcaklığında 20 dakika boyunca 450 x g'de santrifüj yapın.
- OCSC tabakasını (interfazda bozulmadan) transfer pipeti ile dikkatlice yeni bir 15 mL tüpe aktarın.
- 15 mL'ye kadar PBS ile doldurun. Oda sıcaklığında 5 dakika boyunca 300 x g'da santrifüj yapın ve süpernatanı çıkarın.
- Hücre peletini OCSC ortamında yeniden askıya alın ve ultra düşük tutturmalı bir kültür kabına tohumlayın; kültürler %5 CO2 ile 37 °C'de tutulmalıdır.
- Ortamı her üç günde bir değiştirin. Kültür tabağını yaklaşık 1 dakika boyunca dikkatlice bekletin ve süpernatantın bir kısmını atın ve yeni ortamı ekleyin.
- CSC'lerin geçişi
- OCSC'leri 15 mL'lik bir tüpte toplayın ve oda sıcaklığında 5 dakika boyunca 200 x g'de santrifüj yapın.
- Süper natantı çıkarın, PBS ile doldurun ve oda sıcaklığında 5 dakika boyunca 200 x g'de santrifüj yapın.
- Süpernatanı çıkarın, proteolitik ve kollajenolitik enzimlerden (örneğin, AccuMax) oluşan hücre ayrılma çözeltisinin 1 mL'sini ekleyin ve 10 dakika boyunca 37 ° C'de inkübe edin.
- Pipetleme yaparak iyice karıştırın ve 5 dakika boyunca 37 °C'de inkübe edin. Hücrelerin tek bir süspansiyonda olduğundan emin olun.
- Pipetleme yaparak iyice karıştırın, PBS ile doldurun ve oda sıcaklığında 5 dakika boyunca 300 x g'de santrifüj yapın.
- Süpernatantı çıkarın ve ultra düşük ataşmanlı kültür kaplarında daha sonra tohumlama ve% 5 CO2'de 37 ° C'de bakım için OCSC ortamında hücre peletini yeniden askıya alın.
2. HUEhT-1 endotel hücre kültürü
- HUEhT-1 hücrelerinin geçişi
- HUEhT-1 kültür kabından besini çıkarın ve hücreleri PBS ile yıkayın.
- 1 mL% 0.025 tripsin ekleyin ve oda sıcaklığında 3 dakika kuluçkaya yatırın.
- 5 mL Endotel Hücre Büyüme Ortamı 2 ekleyin, hücreleri 15 mL'lik bir tüpte toplayın ve oda sıcaklığında 5 dakika boyunca 200 x g'de santrifüj yapın.
- Süpernatanı çıkarın, hücre peletini HUEhT-1 ortamında yeniden askıya alın ve hücreleri kollajen kaplı kültür kaplarına tohumlayın, ardından% 5 CO2'de 37 ° C'de bakım yapın.
- Ortamı her üç günde bir değiştirin.
3. HUEhT-1 hücreleri kullanılarak tüp oluşum testi için NICO-1 Kokültür Plakasının hazırlanması
- NICO-1'i ve kaplamayı hücre dışı matris bazlı hidrojel (Matrigel Matrix) ile birleştirin.
- Üreticinin talimatlarını izleyerek NICO-1'in bir tarafını monte edin ve buz üzerinde tutun.
- NICO-1'in yüzeyini 300 μL soğuk PBS ile örtün ve ardından tamponu çıkarın.
- 300 μL soğutulmuş hücre dışı matris bazlı hidrojel ekleyin ve 60 dakika boyunca 37 ° C'de inkübe edin.
- Dengelemek için filtreyi %100 etanol ile batırın, ardından 13 mm'lik bir ICCP Filtresini (0,6 μm) PBS ile 1 dakika yıkayın.
- Hem ana gövde parçaları A (sağ oda) hem de B (sol oda) dahil olmak üzere NICO-1'i, O halkası ve dengeli filtre ile birlikte monte edin.
4. HUEhT-1 Hücrelerinin ve CSC'lerin NICO-1 sistemine tohumlanması
- Hücre monokatmanlarını tripsinize ederek ve endotel hücre büyüme ortamındaki hücreleri% 2 fetal buzağı serumu ile yeniden askıya alarak HUEhT-1 hücre süspansiyonlarını hazırlayın.
- Her hücre dışı matris bazlı hidrojel kaplı kuyuya 1,2 mL hücre süspansiyonu (1,5 x 105 hücre) ekleyin.
- Diğer kuyuya beş gün boyunca kültürlenmiş 1,5 mL OCSC ekleyin.
- NICO-1'i 37 °C'de% 5 CO2'de inkübe edin; Mikroskop altında tüp oluşumu ve dal sayısı ile ölçülen hücre dışı matris bazlı hidrojel üzerinde ağ oluşumu gözlenebilir.
Sonuçlar
Cerrahi veya parasentez sırasında ilerlemiş yumurtalık kanseri olan hastalardan elde edilen asit sıvılarını, sferoidler için uzun süreli stabil bir kültür gerçekleştirmek amacıyla topladık. Burada, CSC1 ve CSC2 olarak adlandırılan yumurtalık CSC'lerinin uzun süreli sferoid kültürü vakalarını sunuyoruz. Her iki hücre hattı da aynı tanı ve histolojik profilleri taşır. OKSK'leri çevreleyen endotel hücrelerinin neovaskülarizasyonunu indüklemek için gerekli olan endotel hücreleri ile etkileşimin altında yatan OKSK'ların mekanik rolleri bilinmemektedir. Bu nedenle, metastatik bölgelerde CSC vasküler niş gelişim süreçlerini açıklığa kavuşturmayı amaçladık. Endotel hücreleri (HUEhT-1) ve OKSK'ler arasındaki etkileşimi in vitro kokültür modeli NICO-1 kullanarak inceledik. Şekil 1 , CSC1 ve CSC2 tarafından indüklenen tüp oluşum aktivitesinin bir karşılaştırmasını göstermektedir. CSC2 ile kokültürde oluşan vasküler tüplerin sayısı zamanla dramatik bir şekilde artmıştır (Şekil 2A). Pozitif kontrol için, CSC2'nin ko-kültürü olmadan VEGF (10 ng / mL) tedavisinden sonra HuEhT-1'in anjiyojenik özelliğini gösteren Şekil 2B'yi sunuyoruz. Şimdi sonucun altında yatan ayrıntılı mekanizmayı açıklığa kavuşturuyoruz. Şekil 3 NICO-1 kullanarak endotel hücreleri ile OCSC'nin kokültür modelinin temsili görüntülerini gösterir. HUEhT-1 hücreleri 20 saat boyunca CSC2 ile birlikte kültürlendi ve hızlandırılmış video görüntüsü yakalandı. Şekil 3A, CSC2'nin 20 saat boyunca kokültürden önce ve sonra fenotipini göstermektedir. Şekil 3B, aynı anda birlikte kültürlenmiş HUEhT-1 hücrelerini göstermektedir. HUEhT-1 hücrelerinin CSC2 ile kokültür sırasında vasküler tüpler oluşturması dikkat çekicidir (Şekil 3C: Video klip)

Şekil 1: OKSK'lerin vasküler niş modeli. OKSK'lerin endotel hücrelerinin tüp oluşumunu (vaskülarizasyonunu) indüklediği mekanik roller bilinmemektedir. Endotel hücreleri (HUEhT-1) ve OKSK'ler arasındaki etkileşimi in vitro ko-kültür modu NICO-1 kullanarak inceledik. Bu sistemin sağ bölmesi, OCSC'leri hücre ortamıyla tutan bir kesici uçtan oluşur. Sol bölme, sağ kuyucuktaki ile aynı ortama sahip endotel hücreleri ve HUVEC'leri içeren bir kuyudan oluşur.

Şekil 2: OKSK'lerin neden olduğu neovaskülarizasyon aktivitelerinin karşılaştırılması. Zamanla, oluşan vasküler tüplerin sayısı, CSC2 ile kokültür üzerine önemli ölçüde artmıştır.
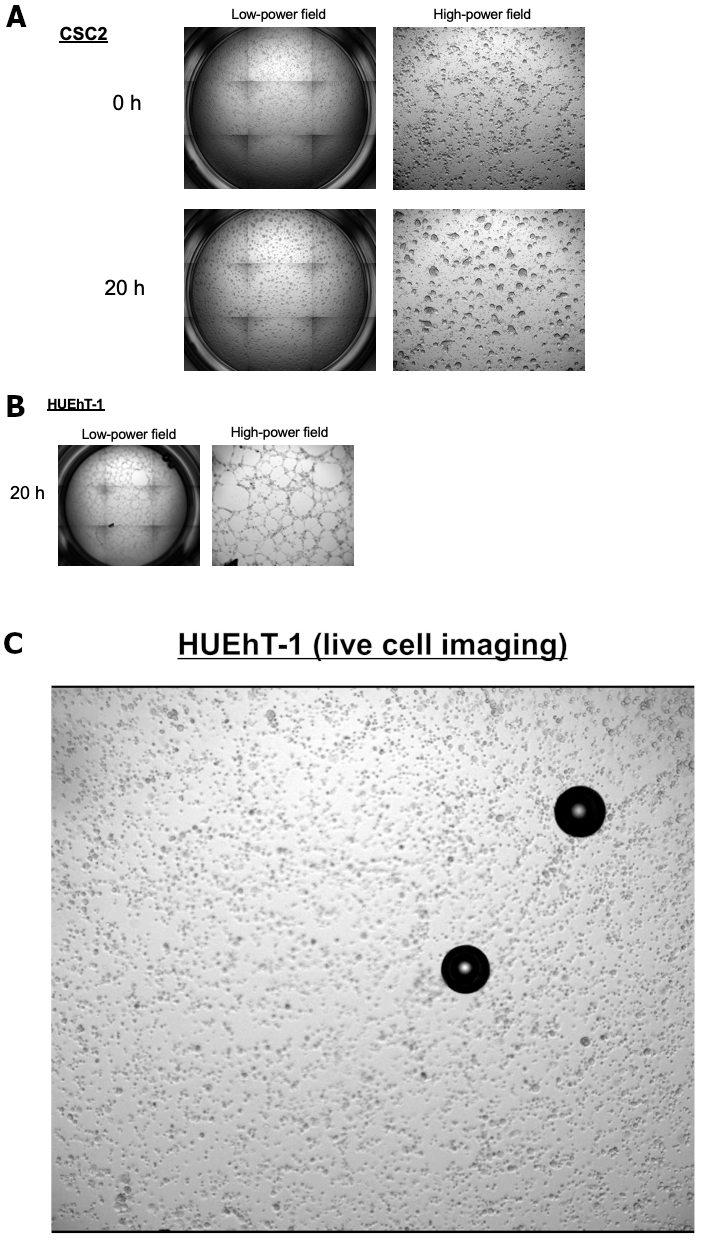
Şekil 3: NICO-1 kullanarak CSC2 ile HUEhT-1 hücrelerinin kokültürüne vasküler oluşumu. HUEhT-1 hücreleri, CSC2 ile kokültür sırasında vasküler tüpler oluşturdu.
Tartışmalar
Sunulan protokol, OCSC'lerin tümör mikroçevresinin in vitro bir ortamda nasıl taklit edileceğini açıklamaktadır. Yöntemin birincil bileşeni, dolaylı bir Transwell ortak kültür sistemi olan NICO-1 sistemi kullanılarak elde edilen yüksek oranda tekrarlanabilir kokültür modelini oluşturur. Şu anda mevcut olan kokültür modellerinin çoğu, doğrudan hücre-hücre temasının kokültürlenmiş hücre popülasyonları üzerindeki etkilerini incelemektedir 12,13,14,15,16,17,18. Ko-kültürün etkilerini incelemek için kullanılabilecek en basit model, iki hücre tipinin doğrudan karıştırılmasıyla çoğalabilir ve heterotipik ve homotipik etkileşimlerin kapsamı, her hücre tipinin tohumlama yoğunluklarını ve alt popülasyonların nispi tohumlama oranını değiştirerek incelenebilir19. Bununla birlikte, OKSC'lerin mikroskobu ile bağımsız olarak kokültürün gözlemlenen etkilerine göreceli katkılarını doğrudan belirlemek, her hücrenin kesin görünmezliği nedeniyle zordur; Bu nedenle, bu çalışmalara genellikle koşullu medya deneyleri paralel olarak eşlik eder. Örneğin, parakrin sinyallemenin tümör mikroçevresi üzerindeki etkilerinin ilgi çekici olduğu çalışmalarda ayrılmış bir kokültür sistemi kullanılabilir19. Buna karşılık, mevcut yöntemde, doğal tümör mikroçevresinin mimarisini taklit eden hücre-hücre teması ve parakrin sinyallemesinin etkilerinin eşzamanlı olarak değerlendirilmesine izin veren bir model tanımlamaktayız.
Anjiyogenez, yumurtalık kanserinin ayırt edici bir özelliği olarak hizmet eder ve kanser hücreleri, endotel hücreleri ve çevresindeki tümör mikroçevresi arasındaki etkileşimleri içeren progresyonunda kritik bir rol oynar20. Bevacizumab, ileri evre over kanseri için kombinasyon kemoterapisinde kullanılmak üzere yaygın olarak kabul edilen önemli bir moleküler hedefleme ilacıdır21. Spesifik olarak, bevacizumab vasküler endotelyal büyüme faktörüne (VEGF) karşı monoklonal bir antikor oluşturur. VEGF, neovaskülarizasyonu teşvik ederek ve vasküler geçirgenliği artırarak ileri over veya periton kanserinde periton karsinomatozis gelişimine ve malign asit oluşumuna katkıda bulunur22. Bu nedenle, VEGF inhibisyonunun asit üretimini ve metastatik bölgede masif tümör büyümesini inhibe ettiği gösterilmiştir. Bu nedenle, tümör mikroçevre düzeyinde VEGF ile uyarılmış vasküler endotel hücrelerini etkili bir şekilde hedef alan daha ileri araştırmalar gereklidir. Bununla birlikte, bu çalışmalar için fare modelleri gibi klinik öncesi modelleri etkili bir şekilde kullanmak zor olabilir. Örneğin, bevacizumab'ın insan VEGF'si için afinitesinin yüksek olduğu, fare proteinininkinin ise23'ün altında olduğu bildirilmiştir. Bu, fare modelleri kullanılarak tespit edildiği gibi, tümör mikro ortamında neovaskülarizasyona yönelik anti-VEGF mekanizmasını daha fazla araştırmak için tasarlanmış deneylerde bevacizumab'ın uygulanmasıyla ilgili bir sınırlama getirmektedir. Bu nedenle, in vivo tümör mikroçevresinin bileşenlerini özetlemek için iyi kontrol edilen mimariye sahip uygun bir modele ihtiyaç vardır. Bu durumda, in vitro kokültür model sistemimizin, hasta kaynaklı OKSK'lerin ve endotel hücrelerinin kültürü boyunca hücre davranışının canlı olarak izlenmesine izin verdiğini ve kokültüre yanıt olarak bu bireysel hücre alt popülasyonlarının incelenmesine izin verdiğini not ediyoruz.
OKSK'lerin ve vasküler nişlerinin rolünün daha iyi anlaşılması, OKSK'lar için terapötik stratejiler geliştirmek için yeni bilgiler sağlayabilir. Temsili deneylerde gösterildiği gibi, modelin güçlü yönleri, klinik ortamlarla kısmen uyumlu görünen ve daha iyi hedeflenmiş ve etkili yeni ilaçların geliştirilmesini ve test edilmesini sağlayan bir çalışma platformu sağlamasıdır. Daha önemli sayıda hasta kaynaklı OKSK'yi içeren sonuçlarımızın doğrudan klinik replikasyonu ile daha ileri çalışmalara ihtiyaç vardır.
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
Bu çalışma, Japonya Eğitim, Bilim ve Kültür Bakanlığı'ndan Bilimsel Araştırma C (K.N.'ye hibe no. 19K09834) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.025% Trypsin | Thermo | R001100 | |
| 10 mL Pipet | Thermo | 170356N | |
| 1250 µL Pipet tip | QSP | T112XLRS-Q | |
| 15 mL tube | Nunc | 339650 | |
| 200 µL Pipet tip | QSP | T110RS-NEW | |
| 2-Mercaptoethanol | Thermo (Gibco) | 21985023 | |
| 5 mL Pipet | Thermo | 170366N | |
| 50 mL tube | Corning | 430290 | |
| AccuMAX | Innovative Cell Technologies | AM105 | |
| BioCoatTM Collagen I 60mm Dish | Corning | 356401 | |
| Centrifuge | KUBOTA | 2800 | |
| Costar 6 Well Clear Flat Bottom Ultra Low Attachment Multiple Well Plates | Corning | 3471 | |
| Endothelial Cell Growth Medium 2 | PromoCell | C-22011 | |
| Ethanol | WAKO | 057-00456 | |
| FGF-Basic | Thermo (Gibco) | PHG0021 | |
| Histodenz | SIGMA | D2158 | |
| HUEhT-1 cell | JCRB Cell Bank | JCRB1458 | |
| ICCP Filter 0.6 µm | Ginrei Lab. | 2525-06 | |
| Insulin, human | SIGMA (Roche) | 11376497001 | |
| Luminometer | PerkinElmer | ARVO MX-flad | |
| Matrigel Matrix | Corning | 356234 | |
| Microscope | Yokogawa | CQ-1 | |
| NICO-1 | Ginrei Lab. | 2501-02 | |
| OptiPlate-96 | PerkinElmer | 6005290 | |
| P1000 Pipet | Gilson | F123602 | |
| P200 Pipet | Gilson | F123601 | |
| PBS | Thermo (Gibco) | 14190-144 | |
| StemPro hESC SFM | Thermo (Gibco) | A1000701 | |
| Transfer Pipet | FALCON | 357575 | |
| Y-27632 | WAKO | 253-00513 |
Referanslar
- Bray, F., et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA, a Cancer Journal for Clinicians. 68, 394-424 (2018).
- Lengyel, E. Ovarian cancer development and metastasis. American Journal of Pathology. 177 (3), 1053-1064 (2010).
- Lytle, N. K., Barber, A. G., Reya, T. Stem cell fate in cancer growth, progression and therapy resistance. Nature Reviews Cancer. 18 (11), 669-680 (2018).
- Dontu, G., et al. In vitro propagation and transcriptional profiling of human mammary stem/progenitor cells. Genes and Development. 17 (10), 1253-1270 (2003).
- Lonardo, E., et al. Nodal/Activin signaling drives selfrenewal and tumorigenicity of pancreatic cancer stem cells and provides a target for combined drug therapy. Cell Stem Cell. 9 (5), 433-446 (2011).
- Ricci-Vitiani, L., et al. Identification and expansion of human colon-cancer-initiating cells. Nature. 445 (7123), 111-115 (2007).
- Ohata, H., et al. Induction of the stem-like cell regulator CD44 by Rho kinase inhibition contributes to the maintenance of colon cancer-initiating cells. Cancer Research. 72 (19), 5101-5110 (2012).
- Ishiguro, T., et al. Establishment and characterization of an in vitro model of ovarian cancer stem-like cells with an enhanced proliferative capacity. Cancer Research. 76 (1), 150-160 (2016).
- Singh, S. K., et al. Identification of a cancer stem cell in human brain tumors. Cancer Research. 63 (18), 5821-5828 (2003).
- Zong, X., Nephew, K. P. Ovarian cancer stem cells: role in metastasis and opportunity for therapeutic targeting. Cancers (Basel). 11 (7), 934(2019).
- Lizárraga-Verdugo, E., et al. Cancer stem cells and its role in angiogenesis and vasculogenic mimicry in gastrointestinal cancers. Frontiers in oncology. 10, 413(2020).
- Renaud, J., Martinoli, M. G. Development of an insert co-culture system of two cellular types in the absence of cell-cell contact. Journal of Visualized Experiments. (113), e54356(2016).
- Richardson, S. M., et al. Intervertebral disc cell-mediated mesenchymal stem cell differentiation. Stem Cells. 24 (3), 707-716 (2006).
- Plotnikov, E. Y., et al. Cell-to-cell cross-talk between mesenchymal stem cells and cardiomyocytes in co-culture. Journal of Cellular and Molecular Medicine. 12 (5), 1622-1631 (2008).
- Sheng, H., et al. A critical role of IFN-gamma in priming MSC-mediated suppression of T cell proliferation through up-regulation of B7-H1. Cell Research. 18 (8), 846-857 (2008).
- Csaki, C., Matis, U., Mobasheri, A., Shakibaei, M. Co-culture of canine mesenchymal stem cells with primary bone-derived osteoblasts promotes osteogenic differentiation. Histochemistry and Cell Biology. 131 (2), 251-266 (2009).
- Aguirre, A., Planell, J. A., Engel, E. Dynamics of bone marrow-derived endothelial progenitor cell/mesenchymal stem cell interaction in co-culture and its implications in angiogenesis. Biochemical and Biophysical Research Communications. 400 (2), 284-291 (2010).
- Proffen, B. L., Haslauer, C. M., Harris, C. E., Murray, M. M. Mesenchymal stem cells from the retropatellar fat pad and peripheral blood stimulate ACL fibroblast migration, proliferation, and collagen gene expression. Connective Tissue Research. 54 (1), 14-21 (2013).
- Goers, L., Freemont, P., Polizzi, K. M. Co-culture systems and technologies: taking synthetic biology to the next level. Journal of the Royal Society & Interface. 11 (96), 20140065(2014).
- De Palma, M., Biziato, D., Petrova, T. Microenvironmental regulation of tumour angiogenesis. Nature Reviews Cancer. 17, 457-474 (2017).
- Burger, R., et al. Incorporation of bevacizumab in the primary treatment of ovarian cancer. New England Journal of Medicine. 365, 2473-2483 (2011).
- Goel, H., Mercurio, A. VEGF targets the tumour cell. Nature Reviews Cancer. 13, 871-882 (2013).
- Yu, L., et al. Interaction between bevacizumab and murine VEGF-A: a reassessment. Investigative Ophthalmology and Visual Science. 49 (2), 522-527 (2008).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır