Method Article
Evaluación de las propiedades angiogenéticas de las células madre similares al cáncer de ovario utilizando el sistema de cocultivo tridimensional, NICO-1
En este artículo
Resumen
Las células madre del cáncer de ovario (OCSC) son responsables de la iniciación, recurrencia, resistencia terapéutica y metástasis del cáncer. Se considera que el nicho vascular OCSC promueve la autorrenovación de las OCSC, lo que lleva a la quimiorresistencia. Este protocolo proporciona la base para establecer un modelo de nicho vascular OCSC reproducible in vitro.
Resumen
Las células madre cancerosas (CSC) residen en un nicho de apoyo, constituyendo un microambiente compuesto por células estromales adyacentes, vasos y matriz extracelular. La capacidad de las CSC para participar en el desarrollo del endotelio constituye una característica importante que contribuye directamente a la comprensión general de los mecanismos de tumorigénesis y metástasis tumorales. El propósito de este trabajo es establecer una metodología reproducible para investigar la capacidad de iniciación tumoral de las células madre del cáncer de ovario (OCSC). En este documento, examinamos el mecanismo de neovascularización entre las células endoteliales y las OCSC junto con los cambios morfológicos de las células endoteliales utilizando el modelo de cocultivo in vitro NICO-1. Este protocolo permite visualizar el paso de neovascularización que rodea a los OCSC en un curso de tiempo. La técnica puede proporcionar información sobre las propiedades angiogenéticas de las OCSC en la metástasis tumoral.
Introducción
El cáncer de ovario es la octava neoplasia maligna más común en mujeres en todo el mundo, con aproximadamente 300.000 nuevos diagnósticos y un estimado de 180.000 muertes anuales1. En el momento del diagnóstico inicial, el cáncer de ovario a menudo se presenta con síntomas graves, con aproximadamente el 75% de las pacientes ya en estadio III-IV. En consecuencia, la tasa de supervivencia a 5 años es del <30% y la tasa de mortalidad es la más alta entre los cánceres ginecológicos2, siendo la eficiencia del tratamiento para el cáncer de ovario altamente dependiente de factores clínicos como la realización exitosa de la cirugía citorreductora, la resistencia a la quimioterapia y la recurrencia después de la terapia inicial.
Los tejidos del cáncer de ovario están organizados jerárquicamente, y no todos los componentes tumorales son igualmente capaces de generar descendientes. Se considera que las únicas células capaces de autorrenovarse y producir una población heterogénea de células tumorales representan células madre cancerosas (CSCs)3. La autorrenovación de CSC y el inicio del tumor se acompañan de la promoción de la angiogénesis para remodelar su microambiente tumoral con el fin de mantener un nicho de apoyo. Sin embargo, los modelos anteriores no pudieron utilizarse para análisis in vitro debido a la limitada reproducibilidad del cultivo de CSC derivadas de muestras clínicas debido a la interrupción de los esferoides después de múltiples pasantías. Más recientemente, se han desarrollado métodos experimentales para cultivar CSCs de pacientes para varias aplicaciones 4,5,6,7. En particular, al explotar la característica de las CSC para crecer formando esferoides en placas de unión ultra bajas con medio libre de suero, las CSC cultivadas son inducidas a expresar un marcador de superficie de células madre que no se expresa en células tumorales normales con potencial de diferenciación multilinaje 8,9.
Datos recientes han demostrado que la persistencia de (O)CSCs ováricas latentes visualizadas como diseminación en el peritoneo está asociada a su regeneración como tumores recurrentes10. Por lo tanto, comprender las características moleculares y biológicas de las OCSC puede permitir una orientación y erradicación efectivas de estas células, lo que resulta en una posible remisión tumoral. En particular, se sabe poco sobre las características mecanicistas celulares y moleculares de los roles de las CSC en la angiogénesis11. Por lo tanto, en el presente protocolo utilizamos OCSC derivadas de pacientes en un entorno in vitro para investigar la propiedad angiogénica de las células endoteliales utilizando el modelo de cocultivo, que puede imitar el microambiente tumoral de las CSC y las células endoteliales en el sitio metastásico en el entorno clínico. En última instancia, como la neovascularización constituye un proceso crítico necesario para apoyar el crecimiento tumoral y la metástasis, una mejor comprensión de su mecanismo permitirá el desarrollo de una nueva terapia dirigida para OCSC en el sitio metastásico.
Aquí, presentamos un protocolo para visualizar el paso de neovascularización que rodea a las CSC de una manera de curso temporal. La ventaja del protocolo incluye permitir investigaciones totalmente reproducibles utilizando el sistema de cocultivo 3D, NICO-1, lo que permite la observación de los efectos en pacientes de la capacidad de iniciación tumoral derivada de OCSC durante la angiogénesis de células endoteliales.
Protocolo
Todos los procedimientos se realizaron bajo el protocolo aprobado por el Comité de Ética para el bienestar humano. Todos los pacientes dieron su consentimiento informado por escrito para el uso de investigación de sus muestras, y la recolección y el uso de tejidos para este estudio fueron aprobados por el Comité de Ética de Investigación del Genoma Humano, Análisis de Genes de la Universidad de Teikyo.
1. Aislamiento y cultivo de células madre de cáncer de ovario (OCSC) de pacientes con cáncer de ovario y ascitis en un gabinete de bioseguridad de nivel 2
- Aislar las células madre del cáncer de ascitis del cáncer de ovario humano obtenidas a través de la paracentesis. Recolectar al menos 100-250 ml de ascitis de los pacientes para tomar suficiente cantidad de células madre cancerosas. Además, evaluar los perfiles de expresión de los marcadores de células madre cancerosas (es decir, EpCAM, Calretinina, CD133, CD44, CD45, ALDH1 y Oct4) y marcadores de cáncer de ovario (pAX-8, WT-1) mediante citometría de flujo.
- Centrifugar la ascitis del cáncer de ovario humano a 300 x g durante 10 min a temperatura ambiente dentro de las 24 h después de la aspiración de ascitis.
- Retire el sobrenadante y agregue 2 ml de medio OCSC y 8 ml de solución salina tamponada con Histodenz/fosfato al 30% (PBS, pH 7.4).
- Prepare el medio OCSC: suplemento StemPro hESC, DMEM⁄F-12 con L-glutamina (medio GlutaMAX), 25% BSA, 100 μM 2-mercaptoetanol, 8 ng/mL FGF BASIC, 10 μM insulina y 20 μM Y-27632.
- Superar cuidadosamente 2 ml de medio OCSC a la solución celular en el paso 1.1.2 en un tubo de 15 ml y centrifugar a 450 x g durante 20 min a temperatura ambiente en un rotor de cangilón oscilante sin frenar.
- Transfiera cuidadosamente la capa OCSC (sin perturbaciones en la interfase) a un nuevo tubo de 15 ml mediante pipeta de transferencia.
- Llene con PBS hasta 15 ml. Centrifugar a 300 x g durante 5 min a temperatura ambiente y retirar el sobrenadante.
- Resuspender el pellet celular en medio OCSC y sembrar en una placa de cultivo de fijación ultrabaja; los cultivos deben mantenerse a 37 °C en un 5% deCO2.
- Cambie el medio cada tres días. Mantenga cuidadosamente el plato de cultivo durante aproximadamente 1 minuto, deseche parte del sobrenadante y agregue el nuevo medio.
- Aprobación de CSC
- Recoger OCSC en un tubo de 15 ml y centrifugar a 200 x g durante 5 min a temperatura ambiente.
- Retire el sobrenadante, llénelo con PBS y centrifugar a 200 x g durante 5 minutos a temperatura ambiente.
- Retirar el sobrenadante, añadir 1 ml de la solución de desprendimiento celular consistente en enzimas proteolíticas y colagenolíticas (p. ej., AccuMax) e incubar a 37 °C durante 10 min.
- Mezclar bien pipeteando e incubar a 37 °C durante 5 min. Asegúrese de que las celdas estén en una sola suspensión.
- Mezclar bien pipeteando, llenar con PBS y centrifugar a 300 x g durante 5 min a temperatura ambiente.
- Retirar el sobrenadante y resuspender el pellet celular en medio OCSC para su posterior siembra en placas de cultivo de fijación ultra baja y mantenimiento a 37 °C enCO2 al 5%.
2. Cultivo de células endoteliales HUEhT-1
- Paso de células HUEhT-1
- Retire el medio de la placa de cultivo de HUEhT-1 y lave las células con PBS.
- Añadir 1 mL de tripsina al 0,025% e incubar durante 3 min a temperatura ambiente.
- Agregue 5 ml de medio de crecimiento celular endotelial 2, recoja las células en un tubo de 15 ml y centrifugar a 200 x g durante 5 minutos a temperatura ambiente.
- Retire el sobrenadante, resuspenda el pellet celular en medio HUEhT-1 y siembre las células en placas de cultivo recubiertas de colágeno seguido de mantenimiento a 37 °C en 5% deCO2.
- Cambie el medio cada tres días.
3. Preparación de la placa de cocultivo de NICO-1 para el ensayo de formación de tubos utilizando células HUEhT-1
- Ensamblar NICO-1 y recubrimiento con el hidrogel basado en matriz extracelular (Matrigel Matrix).
- Montar una cara del NICO-1 siguiendo las instrucciones del fabricante y mantener en hielo.
- Cubra la superficie de NICO-1 con 300 μL de PBS frío y luego retire el tampón.
- Añadir 300 μL de hidrogel refrigerado a base de matriz extracelular e incubar a 37 °C durante 60 min.
- Para equilibrar, sumerja el filtro con etanol al 100%, luego lave un filtro ICCP de 13 mm (0.6 μm) con PBS durante 1 min.
- Ensamble el NICO-1 incluyendo las partes principales del cuerpo A (cámara derecha) y B (cámara izquierda) junto con el anillo O y el filtro equilibrado.
4. Siembra de células HUEhT-1 y CSC en el sistema NICO-1
- Preparar suspensiones de células HUEhT-1 tripsinizando las monocapas celulares y resuspendiendo las células en medio de crecimiento celular endotelial con suero fetal de ternera al 2%.
- Agregue 1.2 ml de la suspensión celular (1.5 x 105 células) a cada pocillo recubierto de hidrogel basado en matriz extracelular.
- Agregue 1.5 ml de OCSC cultivadas durante cinco días al otro pocillo.
- Incubar NICO-1 a 37 °C enCO2 al 5%; La formación de tubos se puede observar bajo el microscopio y la formación de redes en hidrogel basado en matriz extracelular medido por medio del número de ramas.
Resultados
Se recogieron fluidos de ascitis obtenidos de pacientes con cáncer de ovario avanzado durante cirugía o paracentesis con el fin de realizar un cultivo estable a largo plazo para esferoides. Aquí, presentamos casos de un cultivo de esferoides a largo plazo de CSCs ováricas denominadas CSC1 y CSC2. Ambas líneas celulares llevan el mismo diagnóstico y perfiles histológicos. Las funciones mecanicistas de los OCSC que subyacen a la interacción con las células endoteliales necesarias para inducir la neovascularización de las células endoteliales que rodean a las OCSC siguen siendo desconocidas. Por lo tanto, nuestro objetivo fue aclarar los procesos del desarrollo del nicho vascular de la CSC en los sitios metastásicos. Examinamos la interacción entre las células endoteliales (HUEhT-1) y las OCSC utilizando el modelo de cocultivo in vitro NICO-1. La Figura 1 muestra una comparación de la actividad de formación de tubos inducida por CSC1 y CSC2. El número de tubos vasculares formados aumentó dramáticamente con el tiempo en el cocultivo con CSC2 (Figura 2A). Para el control positivo, presentamos la Figura 2B que muestra la propiedad angiogénica de HuEhT-1 después del tratamiento de VEGF (10 ng/mL) sin cocultivo de CSC2. Ahora estamos aclarando el mecanismo detallado que subyace al resultado. Figura 3 muestra imágenes representativas del modelo de cocultivo de OCSC con células endoteliales utilizando el NICO-1. Las células HUEhT-1 se cocultivaron con CSC2 durante 20 horas, y se capturó la imagen de video de lapso de tiempo. La Figura 3A muestra el fenotipo de CSC2 antes y después del cocultivo durante 20 horas. La Figura 3B muestra células HUEhT-1 cocultivadas al mismo tiempo. Cabe destacar que las células HUEhT-1 formaron tubos vasculares durante el cocultivo con CSC2 (Figura 3C: Videoclip)

Figura 1: Modelo de nicho vascular de OCSC. Las funciones mecanicistas por las cuales las OCSC inducen la formación de tubos (vascularización) de las células endoteliales siguen siendo desconocidas. Examinamos la interacción entre las células endoteliales (HUEhT-1) y las OCSC utilizando un modo de cocultivo in vitro, NICO-1. El compartimento derecho de este sistema está compuesto por un inserto, que sujeta OCSC con el medio celular. El compartimento izquierdo consiste en un pocillo que contiene células endoteliales y HUVEC con el mismo medio que en el pocillo derecho.

Figura 2: Comparación de las actividades de neovascularización inducidas por OCSC. Con el tiempo, el número de tubos vasculares formados aumentó dramáticamente tras el cocultivo con CSC2.
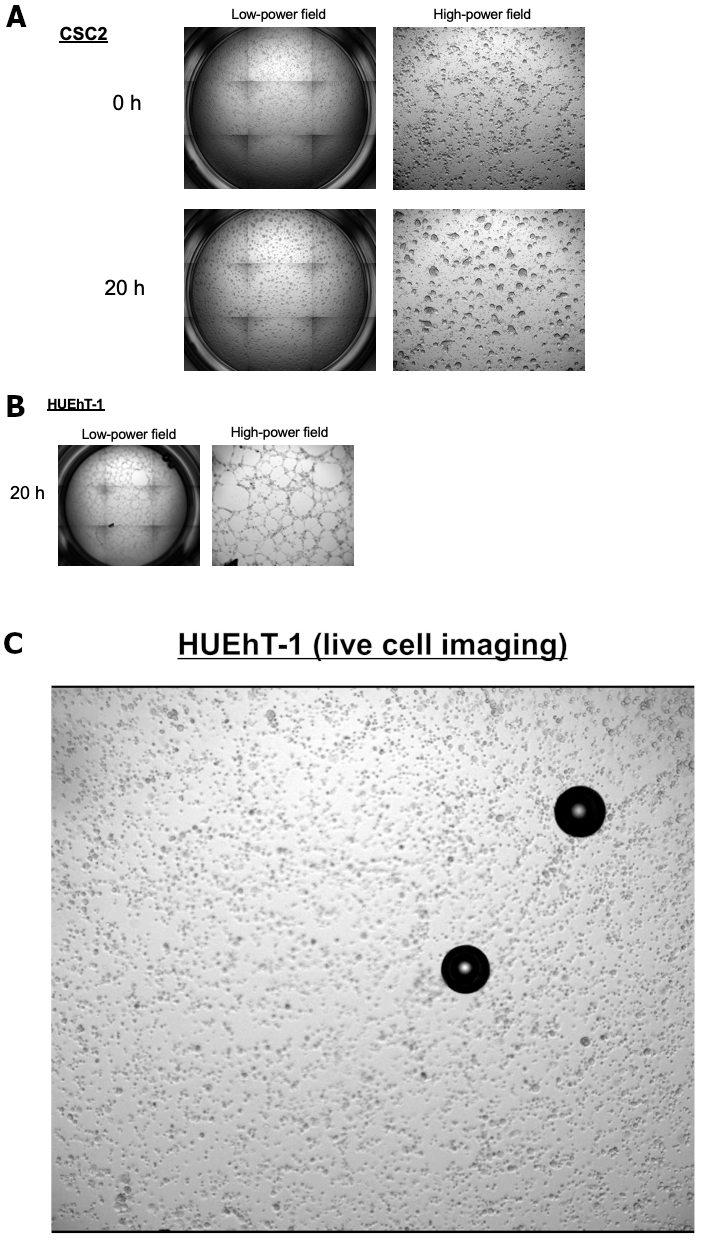
Figura 3: La formación vascular del cocultivo de células HUEhT-1 con CSC2 utilizando NICO-1. Las células HUEhT-1 formaron tubos vasculares durante el cocultivo con CSC2.
Discusión
El protocolo presentado describe cómo imitar el microambiente tumoral de las OCSC en un entorno in vitro. El componente principal del método constituye el modelo de cocultivo altamente reproducible obtenido utilizando el sistema NICO-1, un sistema de cocultivo Transwell indirecto. Muchos de los modelos de cocultivo actualmente disponibles examinan los efectos del contacto directo célula-célula en poblaciones celulares cocultivadas 12,13,14,15,16,17,18. El modelo más simple que puede ser utilizado para examinar los efectos del cocultivo puede reproducirse por la mezcla directa de dos tipos de células, y el grado de interacciones heterotípicas y homotípicas puede ser examinado alterando las densidades de siembra de cada tipo de célula y la relación relativa de siembra de las subpoblaciones19. Sin embargo, es difícil determinar directamente las contribuciones relativas de los OCSC a cualquier efecto observado del cocultivo independientemente por microscopía debido a la invisibilidad precisa de cada célula; Por lo tanto, estos estudios a menudo van acompañados en paralelo por experimentos con medios condicionados. Por ejemplo, un sistema de cocultivo segregado puede ser utilizado en estudios en los que los efectos de la señalización paracrina sobre el microambiente tumoral son de interés19. En comparación, en el presente método describimos un modelo que permite la evaluación simultánea de los efectos del contacto célula-célula y la señalización paracrina, que imitan la arquitectura del microambiente tumoral nativo.
La angiogénesis sirve como un sello distintivo del cáncer de ovario y juega un papel crítico en su progresión, que involucra interacciones entre las células cancerosas, las células endoteliales y el microambiente tumoral circundante20. El bevacizumab es un fármaco molecular dirigido clave que ha sido ampliamente aceptado para su uso en quimioterapia combinada para el cáncer de ovario avanzado21. Específicamente, bevacizumab constituye un anticuerpo monoclonal contra el factor de crecimiento endotelial vascular (VEGF). El VEGF contribuye para el desarrollo de carcinomatosis peritoneal y formación de ascitis maligna en cáncer avanzado de ovario o peritoneal, promoviendo la neovascularización y mejorando la permeabilidad vascular22. Por lo tanto, se ha demostrado que la inhibición del VEGF inhibe la producción de ascitis y el crecimiento tumoral masivo en el sitio metastásico. Por lo tanto, se justifica una investigación adicional que se dirija eficazmente a las células endoteliales vasculares estimuladas por VEGF en el nivel del microambiente tumoral. Sin embargo, puede ser difícil utilizar eficazmente modelos preclínicos, como modelos de ratón, para estos estudios. Por ejemplo, se ha informado que la afinidad de bevacizumab por el VEGF humano es alta, mientras que la de la proteína de ratón es menor23. Esto impone una limitación con respecto a la aplicación de bevacizumab dentro de los experimentos diseñados para investigar más a fondo su mecanismo anti-VEGF hacia la neovascularización en el microambiente tumoral según lo determinado utilizando modelos de ratón. Por lo tanto, se necesita un modelo apropiado con una arquitectura bien controlada para recapitular los componentes del microambiente tumoral in vivo. En tal caso, observamos que nuestro sistema modelo de cocultivo in vitro permite el seguimiento en vivo del comportamiento celular a lo largo del cultivo de las OCSC derivadas del paciente y las células endoteliales y permite el estudio de estas subpoblaciones celulares individuales en respuesta al cocultivo.
Una mejor comprensión del papel de las OCSC y su nicho vascular podría proporcionar nuevos conocimientos para desarrollar estrategias terapéuticas para las OCSC. Como se muestra en los experimentos representativos, los puntos fuertes del modelo son que proporciona una plataforma de estudio que parece ser en parte congruente con los entornos clínicos, lo que permite el desarrollo y la prueba de nuevos fármacos mejor dirigidos y eficaces. Se necesitan estudios adicionales con replicación clínica directa de los resultados que incluyan un número más significativo de OCSC derivadas de pacientes.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por una subvención para la investigación científica C (subvención no. 19K09834 a K.N.) del Ministerio de Educación, Ciencia y Cultura de Japón.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.025% Trypsin | Thermo | R001100 | |
| 10 mL Pipet | Thermo | 170356N | |
| 1250 µL Pipet tip | QSP | T112XLRS-Q | |
| 15 mL tube | Nunc | 339650 | |
| 200 µL Pipet tip | QSP | T110RS-NEW | |
| 2-Mercaptoethanol | Thermo (Gibco) | 21985023 | |
| 5 mL Pipet | Thermo | 170366N | |
| 50 mL tube | Corning | 430290 | |
| AccuMAX | Innovative Cell Technologies | AM105 | |
| BioCoatTM Collagen I 60mm Dish | Corning | 356401 | |
| Centrifuge | KUBOTA | 2800 | |
| Costar 6 Well Clear Flat Bottom Ultra Low Attachment Multiple Well Plates | Corning | 3471 | |
| Endothelial Cell Growth Medium 2 | PromoCell | C-22011 | |
| Ethanol | WAKO | 057-00456 | |
| FGF-Basic | Thermo (Gibco) | PHG0021 | |
| Histodenz | SIGMA | D2158 | |
| HUEhT-1 cell | JCRB Cell Bank | JCRB1458 | |
| ICCP Filter 0.6 µm | Ginrei Lab. | 2525-06 | |
| Insulin, human | SIGMA (Roche) | 11376497001 | |
| Luminometer | PerkinElmer | ARVO MX-flad | |
| Matrigel Matrix | Corning | 356234 | |
| Microscope | Yokogawa | CQ-1 | |
| NICO-1 | Ginrei Lab. | 2501-02 | |
| OptiPlate-96 | PerkinElmer | 6005290 | |
| P1000 Pipet | Gilson | F123602 | |
| P200 Pipet | Gilson | F123601 | |
| PBS | Thermo (Gibco) | 14190-144 | |
| StemPro hESC SFM | Thermo (Gibco) | A1000701 | |
| Transfer Pipet | FALCON | 357575 | |
| Y-27632 | WAKO | 253-00513 |
Referencias
- Bray, F., et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA, a Cancer Journal for Clinicians. 68, 394-424 (2018).
- Lengyel, E. Ovarian cancer development and metastasis. American Journal of Pathology. 177 (3), 1053-1064 (2010).
- Lytle, N. K., Barber, A. G., Reya, T. Stem cell fate in cancer growth, progression and therapy resistance. Nature Reviews Cancer. 18 (11), 669-680 (2018).
- Dontu, G., et al. In vitro propagation and transcriptional profiling of human mammary stem/progenitor cells. Genes and Development. 17 (10), 1253-1270 (2003).
- Lonardo, E., et al. Nodal/Activin signaling drives selfrenewal and tumorigenicity of pancreatic cancer stem cells and provides a target for combined drug therapy. Cell Stem Cell. 9 (5), 433-446 (2011).
- Ricci-Vitiani, L., et al. Identification and expansion of human colon-cancer-initiating cells. Nature. 445 (7123), 111-115 (2007).
- Ohata, H., et al. Induction of the stem-like cell regulator CD44 by Rho kinase inhibition contributes to the maintenance of colon cancer-initiating cells. Cancer Research. 72 (19), 5101-5110 (2012).
- Ishiguro, T., et al. Establishment and characterization of an in vitro model of ovarian cancer stem-like cells with an enhanced proliferative capacity. Cancer Research. 76 (1), 150-160 (2016).
- Singh, S. K., et al. Identification of a cancer stem cell in human brain tumors. Cancer Research. 63 (18), 5821-5828 (2003).
- Zong, X., Nephew, K. P. Ovarian cancer stem cells: role in metastasis and opportunity for therapeutic targeting. Cancers (Basel). 11 (7), 934(2019).
- Lizárraga-Verdugo, E., et al. Cancer stem cells and its role in angiogenesis and vasculogenic mimicry in gastrointestinal cancers. Frontiers in oncology. 10, 413(2020).
- Renaud, J., Martinoli, M. G. Development of an insert co-culture system of two cellular types in the absence of cell-cell contact. Journal of Visualized Experiments. (113), e54356(2016).
- Richardson, S. M., et al. Intervertebral disc cell-mediated mesenchymal stem cell differentiation. Stem Cells. 24 (3), 707-716 (2006).
- Plotnikov, E. Y., et al. Cell-to-cell cross-talk between mesenchymal stem cells and cardiomyocytes in co-culture. Journal of Cellular and Molecular Medicine. 12 (5), 1622-1631 (2008).
- Sheng, H., et al. A critical role of IFN-gamma in priming MSC-mediated suppression of T cell proliferation through up-regulation of B7-H1. Cell Research. 18 (8), 846-857 (2008).
- Csaki, C., Matis, U., Mobasheri, A., Shakibaei, M. Co-culture of canine mesenchymal stem cells with primary bone-derived osteoblasts promotes osteogenic differentiation. Histochemistry and Cell Biology. 131 (2), 251-266 (2009).
- Aguirre, A., Planell, J. A., Engel, E. Dynamics of bone marrow-derived endothelial progenitor cell/mesenchymal stem cell interaction in co-culture and its implications in angiogenesis. Biochemical and Biophysical Research Communications. 400 (2), 284-291 (2010).
- Proffen, B. L., Haslauer, C. M., Harris, C. E., Murray, M. M. Mesenchymal stem cells from the retropatellar fat pad and peripheral blood stimulate ACL fibroblast migration, proliferation, and collagen gene expression. Connective Tissue Research. 54 (1), 14-21 (2013).
- Goers, L., Freemont, P., Polizzi, K. M. Co-culture systems and technologies: taking synthetic biology to the next level. Journal of the Royal Society & Interface. 11 (96), 20140065(2014).
- De Palma, M., Biziato, D., Petrova, T. Microenvironmental regulation of tumour angiogenesis. Nature Reviews Cancer. 17, 457-474 (2017).
- Burger, R., et al. Incorporation of bevacizumab in the primary treatment of ovarian cancer. New England Journal of Medicine. 365, 2473-2483 (2011).
- Goel, H., Mercurio, A. VEGF targets the tumour cell. Nature Reviews Cancer. 13, 871-882 (2013).
- Yu, L., et al. Interaction between bevacizumab and murine VEGF-A: a reassessment. Investigative Ophthalmology and Visual Science. 49 (2), 522-527 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados