Method Article
Avaliando as propriedades angiogenéticas de células-tronco do câncer de ovário usando o Sistema de Cocultura Tridimensional, NICO-1
Neste Artigo
Resumo
As células-tronco do câncer de ovário (OCSC) são responsáveis pelo início, recorrência, resistência terapêutica e metástase do câncer. Considera-se que o nicho vascular do OCSC promove a auto-renovação dos OCSCs, levando à quimiorresistência. Este protocolo fornece a base para o estabelecimento de um modelo de nicho vascular OCSC reprodutível in vitro.
Resumo
As células-tronco cancerígenas (CSCs) residem em um nicho de suporte, constituindo um microambiente composto por células estromais adjacentes, vasos e matriz extracelular. A capacidade das CSCs de participar do desenvolvimento do endotélio constitui uma característica importante que contribui diretamente para a compreensão geral dos mecanismos de tumorigênese e metástase tumoral. O objetivo deste trabalho é estabelecer uma metodologia reprodutível para investigar a capacidade de iniciação tumoral de células-tronco de câncer de ovário (OCSCs). Neste trabalho, examinamos o mecanismo de neovascularização entre células endoteliais e OCSCs, juntamente com as alterações morfológicas das células endoteliais, usando o modelo de co-cultura in vitro NICO-1. Este protocolo permite a visualização da etapa de neovascularização em torno dos OCSCs de forma temporal. A técnica pode fornecer informações sobre as propriedades angiogenéticas dos OCSCs na metástase tumoral.
Introdução
O câncer de ovário é a oitava neoplasia maligna mais comum em mulheres em todo o mundo, com aproximadamente 300.000 novos diagnósticos e uma estimativa de 180.000 mortes anuais1. No diagnóstico inicial, o câncer de ovário geralmente se apresenta com sintomas graves, com cerca de 75% das pacientes já no estágio III-IV. Assim, a taxa de sobrevida em 5 anos é de <30% e a taxa de mortalidade é a mais alta entre os cânceres ginecológicos2, com a eficiência do tratamento para o câncer de ovário sendo altamente dependente de fatores clínicos, como a realização bem-sucedida da cirurgia de debulking, resistência à quimioterapia e recorrência após a terapia inicial.
Os tecidos do câncer de ovário são hierarquicamente organizados, com nem todos os componentes do tumor sendo igualmente capazes de gerar descendentes. As únicas células capazes de se auto-renovar e produzir uma população heterogênea de células tumorais são consideradas como representando células-tronco cancerígenas (CSCs)3. A auto-renovação do CSC e o início do tumor são acompanhados pela promoção da angiogênese para remodelar seu microambiente tumoral com a finalidade de manter um nicho de suporte. No entanto, modelos anteriores não puderam ser utilizados para análises in vitro devido à reprodutibilidade limitada do cultivo de CSCs derivadas de amostras clínicas devido à ruptura de esferoides após múltiplas passagens. Mais recentemente, métodos experimentais para cultivar CSCs de pacientes têm sido desenvolvidos para diversas aplicações 4,5,6,7. Em particular, ao explorar a característica de crescimento das CSCs formando esferoides em placas de fixação ultrabaixa com meio livre de soro, as CSCs cultivadas são induzidas a expressar um marcador de superfície de células-tronco que não é expresso em células tumorais normais com potencial de diferenciação de múltiplas linhagens 8,9.
Dados recentes têm mostrado que a persistência de (O)CSCs ovarianos dormentes visualizados como disseminação no peritônio está associada à sua regeneração como tumores recorrentes10. A compreensão das características moleculares e biológicas dos OCSCs pode, portanto, permitir o direcionamento e a erradicação efetivos dessas células, resultando em potencial remissão tumoral. Em particular, pouco se sabe sobre as características mecanicistas celulares e moleculares dos papéis das CSCs na angiogênese11. Portanto, no presente protocolo, utilizamos OCSCs derivados de pacientes em um ambiente in vitro para investigar a propriedade angiogênica de células endoteliais usando o modelo de cocultura, que pode imitar o microambiente tumoral de CSCs e células endoteliais no local metastático no ambiente clínico. Em última análise, como a neovascularização constitui um processo crítico necessário para apoiar o crescimento e a metástase do tumor, uma melhor compreensão de seu mecanismo permitirá o desenvolvimento de uma nova terapia direcionada para OCSCs no local metastático.
Aqui, apresentamos um protocolo para visualizar a etapa de neovascularização em torno das CSCs de forma temporal. A vantagem do protocolo inclui permitir investigações totalmente reprodutíveis usando o sistema de cocultura 3D, NICO-1, permitindo assim a observação dos efeitos em pacientes da capacidade de iniciação de tumores derivados do OCSC durante a angiogênese de células endoteliais.
Protocolo
Todos os procedimentos foram realizados sob o protocolo aprovado pelo Comitê de Ética para o bem-estar humano. Todos os pacientes forneceram consentimento informado por escrito para o uso em pesquisa de suas amostras, e a coleta e o uso de tecidos para este estudo foram aprovados pelo Comitê de Ética em Pesquisa em Análise de Genes do Genoma Humano, da Universidade de Teikyo.
1. Isolamento e cultura de células-tronco de câncer de ovário (OCSCs) de pacientes com câncer de ovário e ascite em um gabinete de biossegurança de nível 2
- Isole células-tronco cancerígenas da ascite do câncer de ovário humano obtido por paracentese. Colete pelo menos 100-250 mL de ascite de pacientes para tomar um número suficiente de células-tronco cancerígenas. Além disso, avalie os perfis de expressão de marcadores de células-tronco cancerígenas (ou seja, EpCAM, Calretinina, CD133, CD44, CD45, ALDH1 e Oct4) e marcadores de câncer de ovário (pAX-8, WT-1) por citometria de fluxo.
- Centrifugar a ascite do cancro do ovário humano a 300 x g durante 10 minutos à temperatura ambiente no prazo de 24 h após a aspiração da ascite.
- Remover o sobrenadante e adicionar 2 mL de meio OCSC e 8 mL de solução salina tamponada com Histodenz/fosfato a 30% (PBS, pH 7,4).
- Prepare o meio OCSC: suplemento StemPro hESC, DMEM⁄F-12 com L-glutamina (meio GlutaMAX), 25% BSA, 100 μM 2-mercaptoetanol, 8 ng/mL FGF BASIC, 10 μM de insulina e 20 μM Y-27632.
- Sobrepor cuidadosamente 2 ml de meio OCSC à solução celular na fase 1.1.2 num tubo de 15 ml e centrífuga a 450 x g durante 20 minutos à temperatura ambiente num rotor de balde oscilante sem travagem.
- Transfira cuidadosamente a camada OCSC (sem ser perturbada na interfase) para um novo tubo de 15 mL por pipeta de transferência.
- Encha com PBS até 15 mL. Centrifugar a 300 x g durante 5 min à temperatura ambiente e remover o sobrenadante.
- Ressuspender o pellet celular em meio OCSC e semear em um prato de cultura de fixação ultrabaixa; as culturas devem ser mantidas a 37 °C em 5% de CO2.
- Mude o meio a cada três dias. Posicione cuidadosamente o prato de cultura por cerca de 1 minuto, descarte parte do sobrenadante e adicione o novo meio.
- Passagem de CSCs
- Recolher OCSCs num tubo de 15 ml e centrifugar a 200 x g durante 5 min à temperatura ambiente.
- Remova o sobrenadante, encha com PBS e centrifugar a 200 x g por 5 min à temperatura ambiente.
- Remova o sobrenadante, adicione 1 mL da solução de descolamento celular que consiste em enzimas proteolíticas e colagenolíticas (por exemplo, AccuMax) e incube a 37 °C por 10 min.
- Misturar bem por pipetagem e incubar a 37 °C durante 5 min. Certifique-se de que as células estão em uma única suspensão.
- Misture bem por pipetagem, encha com PBS e centrifuga a 300 x g por 5 min à temperatura ambiente.
- Remover o sobrenadante e ressuspender o pellet celular em meio OCSC para posterior semeadura em placas de cultura de fixação ultrabaixa e manutenção a 37 °C em CO2 a 5%.
2. Cultura de células endoteliais HUEhT-1
- Passagem de células HUEhT-1
- Retire o meio da placa de cultura HUEhT-1 e lave as células com PBS.
- Adicionar 1 mL de tripsina a 0,025% e incubar por 3 min à temperatura ambiente.
- Adicionar 5 mL de Meio de Crescimento Celular Endotelial 2, coletar células em um tubo de 15 mL e centrifugar a 200 x g por 5 min à temperatura ambiente.
- Retirar o sobrenadante, ressuspender o pellet celular em meio HUEhT-1 e semear as células em placas de cultura revestidas de colágeno, seguidas de manutenção a 37 °C em 5% de CO2.
- Mude o meio a cada três dias.
3. Preparação da Placa de Cocultura NICO-1 para ensaio de formação de tubos utilizando células HUEhT-1
- Monte NICO-1 e revestimento com o hidrogel à base de matriz extracelular (Matrigel Matrix).
- Monte um lado do NICO-1 seguindo as instruções do fabricante e mantenha-o no gelo.
- Cubra a superfície do NICO-1 com 300 μL de PBS frio e, em seguida, remova o tampão tamponamento.
- Adicionar 300 μL de hidrogel à base de matriz extracelular refrigerado e incubar a 37 °C durante 60 min.
- Para equilibrar, mergulhe o filtro com 100% de etanol e, em seguida, lave um filtro ICCP de 13 mm (0,6 μm) com PBS por 1 min.
- Monte o NICO-1 incluindo as partes principais do corpo A (câmara direita) e B (câmara esquerda), juntamente com o anel O e o filtro equilibrado.
4. Semeando células HUEhT-1 e CSCs no sistema NICO-1
- Preparar suspensões celulares HUEhT-1 tripsinizando as monocamadas celulares e ressuspendendo as células em meio de crescimento celular endotelial com soro fetal de bezerro a 2%.
- Adicione 1,2 mL da suspensão celular (1,5 x 105 células) a cada poço revestido de hidrogel à base de matriz extracelular.
- Adicione 1,5 mL de OCSCs cultivados por cinco dias ao outro poço.
- Incubar NICO-1 a 37 °C em 5% de CO2; a formação de tubos pode ser observada ao microscópio e a formação de redes em hidrogel extracelular à base de matriz, medida por meio do número de ramos.
Resultados
Foram coletados fluidos de ascite obtidos de pacientes com câncer de ovário avançado durante cirurgia ou paracentese com o objetivo de realizar uma cultura estável a longo prazo para esferoides. Aqui, apresentamos casos de uma cultura esferoide de longo prazo de CSCs ovarianos denominadas CSC1 e CSC2. Ambas as linhagens celulares carregam o mesmo diagnóstico e perfis histológicos. Os papéis mecanicistas dos OCSCs subjacentes à interação com as células endoteliais necessárias para induzir a neovascularização das células endoteliais ao redor dos OCSCs permanecem desconhecidos. Portanto, objetivou-se esclarecer os processos de desenvolvimento do nicho vascular CSC nos sítios metastáticos. Examinamos a interação entre células endoteliais (HUEhT-1) e OCSCs usando o modelo de cocultura in vitro NICO-1. A Figura 1 mostra uma comparação da atividade de formação de tubos induzida por CSC1 e CSC2. O número de tubos vasculares formados aumentou drasticamente ao longo do tempo na cocultura com CSC2 (Figura 2A). Para o controle positivo, apresentamos a Figura 2B que mostra a propriedade angiogênica da HuEhT-1 após o tratamento do VEGF (10 ng/mL) sem cocultura de CSC2. Estamos agora a clarificar o mecanismo pormenorizado subjacente ao resultado. Figura 3 mostra imagens representativas do modelo de cocultura de OCSC com células endoteliais utilizando o NICO-1. As células HUEhT-1 foram cocultivadas com CSC2 por 20 horas, e a imagem de vídeo time-lapse foi capturada. A Figura 3A mostra o fenótipo da CSC2 antes e após a cocultura por 20 horas. A Figura 3B mostra as células HUEhT-1 cocultivadas ao mesmo tempo. Ressalta-se que as células HUEhT-1 formaram tubos vasculares durante a cocultura com CSC2 (Figura 3C: Videoclipe)

Figura 1: Modelo de nicho vascular dos OCSCs. Os papéis mecanicistas pelos quais os OCSCs induzem a formação de tubos (vascularização) de células endoteliais permanecem desconhecidos. Examinamos a interação entre células endoteliais (HUEhT-1) e OCSCs usando um modo de co-cultura in vitro, NICO-1. O compartimento direito deste sistema é composto por uma inserção, que contém OCSCs com o meio celular. O compartimento esquerdo consiste em um poço contendo células endoteliais e HUVECs com o mesmo meio que no poço direito.

Figura 2: Comparação das atividades de neovascularização induzidas por OCSCs. Com o tempo, o número de tubos vasculares formados aumentou drasticamente após a cocultura com CSC2.
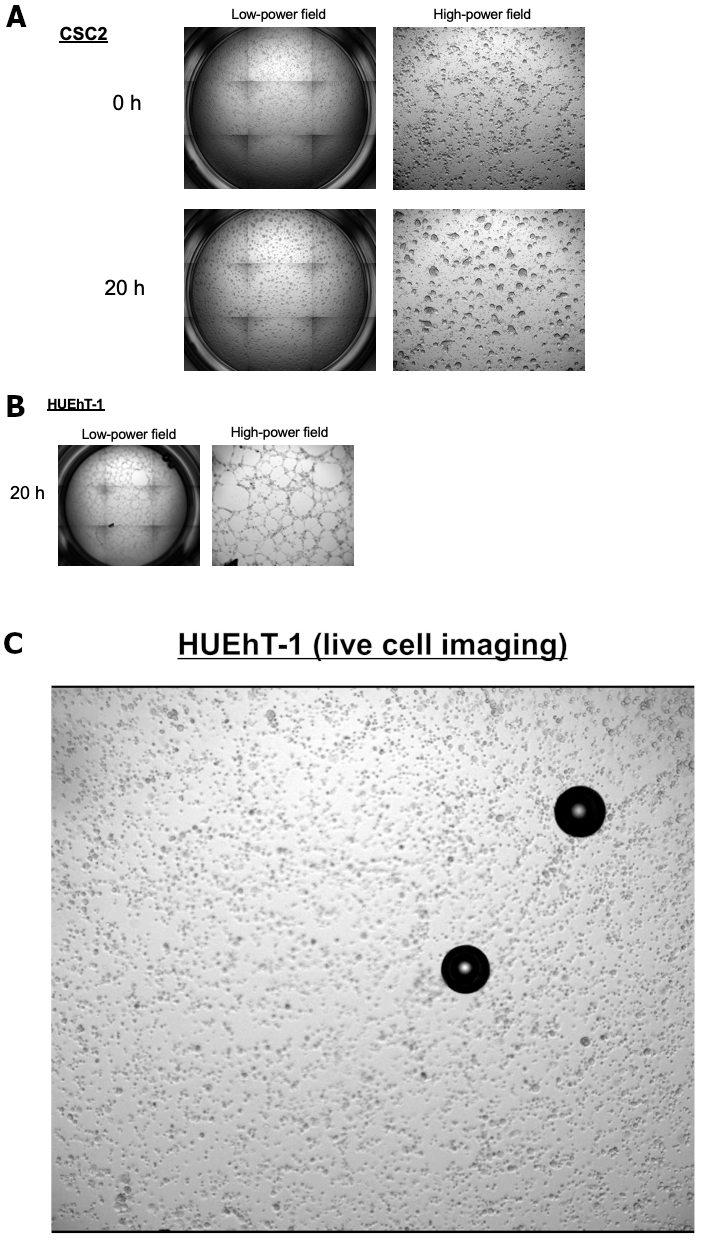
Figura 3: A formação vascular da cocultura de células HUEhT-1 com CSC2 utilizando NICO-1. As células HUEhT-1 formaram tubos vasculares durante a cocultura com CSC2.
Discussão
O protocolo apresentado descreve como imitar o microambiente tumoral de OCSCs em um ambiente in vitro. O componente primário do método constitui o modelo de cocultura altamente reprodutível obtido usando o sistema NICO-1, um sistema de co-cultura Transwell indireto. Muitos dos modelos de cocultura atualmente disponíveis examinam os efeitos do contato direto célula-célula em populações celulares cocultivadas 12,13,14,15,16,17,18. O modelo mais simples que pode ser utilizado para examinar os efeitos da cocultura pode se reproduzir pela mistura direta de dois tipos de células, e a extensão das interações heterotípicas e homotípicas pode ser examinada alterando as densidades de semeadura de cada tipo de célula e a razão relativa de semeadura das subpopulações19. No entanto, determinar diretamente as contribuições relativas dos OCSCs para quaisquer efeitos observados da cocultura independentemente por microscopia é difícil devido à invisibilidade precisa de cada célula; assim, esses estudos são frequentemente acompanhados em paralelo por experimentos de mídia condicionada. Por exemplo, um sistema de cocultura segregado pode ser utilizado em estudos em que os efeitos da sinalização parácrina no microambiente tumoral são de interesse19. Em comparação, no presente método descrevemos um modelo que permite a avaliação simultânea dos efeitos do contato célula-célula e da sinalização parácrina, que imitam a arquitetura do microambiente tumoral nativo.
A angiogênese serve como uma marca registrada do câncer de ovário e desempenha um papel crítico em sua progressão, que envolve interações entre células cancerígenas, células endoteliais e o microambiente tumoral circundante20. O bevacizumabe é um fármaco alvo molecular chave que tem sido amplamente aceito para uso em quimioterapia combinada para câncer de ovário avançado21. Especificamente, o bevacizumab constitui um anticorpo monoclonal contra o fator de crescimento endotelial vascular (VEGF). O VEGF contribui para o desenvolvimento de carcinomatose peritoneal e formação de ascite maligna no câncer de ovário ou peritoneal avançado, promovendo a neovascularização e aumentando a permeabilidade vascular22. Portanto, a inibição do VEGF demonstrou inibir a produção de ascite e o crescimento maciço do tumor no local metastático. Justifica-se, portanto, uma investigação mais aprofundada que vise efetivamente as células endoteliais vasculares estimuladas pelo VEGF no nível do microambiente tumoral. No entanto, pode ser difícil utilizar efetivamente modelos pré-clínicos, como modelos de camundongos, para esses estudos. Por exemplo, foi relatado que a afinidade do bevacizumabe pelo VEGF humano é alta, enquanto a da proteína do camundongo é menor23. Isso reforça uma limitação no que diz respeito à aplicação de bevacizumabe em experimentos projetados para investigar ainda mais seu mecanismo anti-VEGF em direção à neovascularização no microambiente tumoral, conforme verificado usando modelos de camundongos. Um modelo apropriado com arquitetura bem controlada é, portanto, necessário para recapitular os componentes do microambiente tumoral in vivo. Nesse caso, observamos que nosso sistema de modelo de cocultura in vitro permite o rastreamento ao vivo do comportamento celular ao longo da cultura dos OCSCs e células endoteliais derivados do paciente e permite o estudo dessas subpopulações celulares individuais em resposta à cocultura.
Uma melhor compreensão do papel dos OCSCs e seu nicho vascular poderia fornecer novos insights para o desenvolvimento de estratégias terapêuticas para OCSCs. Como mostrado nos experimentos representativos, os pontos fortes do modelo são que ele fornece uma plataforma de estudo que parece ser parcialmente congruente com os ambientes clínicos, permitindo o desenvolvimento e o teste de novos medicamentos mais bem direcionados e eficazes. Mais estudos são necessários com replicação clínica direta de nossos resultados envolvendo um número mais significativo de OCSCs derivados de pacientes.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi apoiado por um Grant-in-Aid for Scientific Research C (grant no. 19K09834 to K.N.) do Ministério da Educação, Ciência e Cultura, Japão.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.025% Trypsin | Thermo | R001100 | |
| 10 mL Pipet | Thermo | 170356N | |
| 1250 µL Pipet tip | QSP | T112XLRS-Q | |
| 15 mL tube | Nunc | 339650 | |
| 200 µL Pipet tip | QSP | T110RS-NEW | |
| 2-Mercaptoethanol | Thermo (Gibco) | 21985023 | |
| 5 mL Pipet | Thermo | 170366N | |
| 50 mL tube | Corning | 430290 | |
| AccuMAX | Innovative Cell Technologies | AM105 | |
| BioCoatTM Collagen I 60mm Dish | Corning | 356401 | |
| Centrifuge | KUBOTA | 2800 | |
| Costar 6 Well Clear Flat Bottom Ultra Low Attachment Multiple Well Plates | Corning | 3471 | |
| Endothelial Cell Growth Medium 2 | PromoCell | C-22011 | |
| Ethanol | WAKO | 057-00456 | |
| FGF-Basic | Thermo (Gibco) | PHG0021 | |
| Histodenz | SIGMA | D2158 | |
| HUEhT-1 cell | JCRB Cell Bank | JCRB1458 | |
| ICCP Filter 0.6 µm | Ginrei Lab. | 2525-06 | |
| Insulin, human | SIGMA (Roche) | 11376497001 | |
| Luminometer | PerkinElmer | ARVO MX-flad | |
| Matrigel Matrix | Corning | 356234 | |
| Microscope | Yokogawa | CQ-1 | |
| NICO-1 | Ginrei Lab. | 2501-02 | |
| OptiPlate-96 | PerkinElmer | 6005290 | |
| P1000 Pipet | Gilson | F123602 | |
| P200 Pipet | Gilson | F123601 | |
| PBS | Thermo (Gibco) | 14190-144 | |
| StemPro hESC SFM | Thermo (Gibco) | A1000701 | |
| Transfer Pipet | FALCON | 357575 | |
| Y-27632 | WAKO | 253-00513 |
Referências
- Bray, F., et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA, a Cancer Journal for Clinicians. 68, 394-424 (2018).
- Lengyel, E. Ovarian cancer development and metastasis. American Journal of Pathology. 177 (3), 1053-1064 (2010).
- Lytle, N. K., Barber, A. G., Reya, T. Stem cell fate in cancer growth, progression and therapy resistance. Nature Reviews Cancer. 18 (11), 669-680 (2018).
- Dontu, G., et al. In vitro propagation and transcriptional profiling of human mammary stem/progenitor cells. Genes and Development. 17 (10), 1253-1270 (2003).
- Lonardo, E., et al. Nodal/Activin signaling drives selfrenewal and tumorigenicity of pancreatic cancer stem cells and provides a target for combined drug therapy. Cell Stem Cell. 9 (5), 433-446 (2011).
- Ricci-Vitiani, L., et al. Identification and expansion of human colon-cancer-initiating cells. Nature. 445 (7123), 111-115 (2007).
- Ohata, H., et al. Induction of the stem-like cell regulator CD44 by Rho kinase inhibition contributes to the maintenance of colon cancer-initiating cells. Cancer Research. 72 (19), 5101-5110 (2012).
- Ishiguro, T., et al. Establishment and characterization of an in vitro model of ovarian cancer stem-like cells with an enhanced proliferative capacity. Cancer Research. 76 (1), 150-160 (2016).
- Singh, S. K., et al. Identification of a cancer stem cell in human brain tumors. Cancer Research. 63 (18), 5821-5828 (2003).
- Zong, X., Nephew, K. P. Ovarian cancer stem cells: role in metastasis and opportunity for therapeutic targeting. Cancers (Basel). 11 (7), 934(2019).
- Lizárraga-Verdugo, E., et al. Cancer stem cells and its role in angiogenesis and vasculogenic mimicry in gastrointestinal cancers. Frontiers in oncology. 10, 413(2020).
- Renaud, J., Martinoli, M. G. Development of an insert co-culture system of two cellular types in the absence of cell-cell contact. Journal of Visualized Experiments. (113), e54356(2016).
- Richardson, S. M., et al. Intervertebral disc cell-mediated mesenchymal stem cell differentiation. Stem Cells. 24 (3), 707-716 (2006).
- Plotnikov, E. Y., et al. Cell-to-cell cross-talk between mesenchymal stem cells and cardiomyocytes in co-culture. Journal of Cellular and Molecular Medicine. 12 (5), 1622-1631 (2008).
- Sheng, H., et al. A critical role of IFN-gamma in priming MSC-mediated suppression of T cell proliferation through up-regulation of B7-H1. Cell Research. 18 (8), 846-857 (2008).
- Csaki, C., Matis, U., Mobasheri, A., Shakibaei, M. Co-culture of canine mesenchymal stem cells with primary bone-derived osteoblasts promotes osteogenic differentiation. Histochemistry and Cell Biology. 131 (2), 251-266 (2009).
- Aguirre, A., Planell, J. A., Engel, E. Dynamics of bone marrow-derived endothelial progenitor cell/mesenchymal stem cell interaction in co-culture and its implications in angiogenesis. Biochemical and Biophysical Research Communications. 400 (2), 284-291 (2010).
- Proffen, B. L., Haslauer, C. M., Harris, C. E., Murray, M. M. Mesenchymal stem cells from the retropatellar fat pad and peripheral blood stimulate ACL fibroblast migration, proliferation, and collagen gene expression. Connective Tissue Research. 54 (1), 14-21 (2013).
- Goers, L., Freemont, P., Polizzi, K. M. Co-culture systems and technologies: taking synthetic biology to the next level. Journal of the Royal Society & Interface. 11 (96), 20140065(2014).
- De Palma, M., Biziato, D., Petrova, T. Microenvironmental regulation of tumour angiogenesis. Nature Reviews Cancer. 17, 457-474 (2017).
- Burger, R., et al. Incorporation of bevacizumab in the primary treatment of ovarian cancer. New England Journal of Medicine. 365, 2473-2483 (2011).
- Goel, H., Mercurio, A. VEGF targets the tumour cell. Nature Reviews Cancer. 13, 871-882 (2013).
- Yu, L., et al. Interaction between bevacizumab and murine VEGF-A: a reassessment. Investigative Ophthalmology and Visual Science. 49 (2), 522-527 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados