Method Article
Valutazione delle proprietà angiogenetiche delle cellule staminali del cancro ovarico utilizzando il sistema di co-coltura tridimensionale, NICO-1
In questo articolo
Riepilogo
Le cellule staminali del cancro ovarico (OCSC) sono responsabili dell'inizio del cancro, della recidiva, della resistenza terapeutica e delle metastasi. Si ritiene che la nicchia vascolare OCSC promuova l'autorinnovamento degli OCSC, portando alla chemioresistenza. Questo protocollo fornisce la base per stabilire un modello di nicchia vascolare OCSC riproducibile in vitro.
Abstract
Le cellule staminali tumorali (CSC) risiedono in una nicchia di supporto, costituendo un microambiente composto da cellule stromali adiacenti, vasi e matrice extracellulare. La capacità delle CSCs di partecipare allo sviluppo dell'endotelio costituisce una caratteristica importante che contribuisce direttamente alla comprensione generale dei meccanismi della tumorigenesi e delle metastasi tumorali. Lo scopo di questo lavoro è quello di stabilire una metodologia riproducibile per studiare la capacità di inizio del tumore delle cellule staminali tumorali ovariche (OCSC). Qui, abbiamo esaminato il meccanismo di neovascolarizzazione tra cellule endoteliali e OCSC insieme ai cambiamenti morfologici delle cellule endoteliali utilizzando il modello di co-coltura in vitro NICO-1. Questo protocollo consente di visualizzare la fase di neovascolarizzazione che circonda gli OCSC in modo temporizzato. La tecnica può fornire informazioni sulle proprietà angiogenetiche degli OCSC nelle metastasi tumorali.
Introduzione
Il cancro ovarico è l'ottavo tumore maligno più comune nelle donne in tutto il mondo, con circa 300.000 nuove diagnosi e circa 180.000 decessi all'anno1. Alla diagnosi iniziale, il carcinoma ovarico si presenta spesso con sintomi gravi, con circa il 75% delle pazienti già allo stadio III-IV. Di conseguenza, il tasso di sopravvivenza a 5 anni è del <30% e il tasso di mortalità è il più alto tra i tumori ginecologici2, con l'efficacia del trattamento per il cancro ovarico che dipende fortemente da fattori clinici come il successo della chirurgia di debulking, la resistenza alla chemioterapia e la recidiva dopo la terapia iniziale.
I tessuti del cancro ovarico sono organizzati gerarchicamente, con non tutti i componenti tumorali ugualmente in grado di generare discendenti. Le uniche cellule in grado di auto-rinnovarsi e produrre una popolazione eterogenea di cellule tumorali sono considerate cellule staminali tumorali (CSCs)3. L'auto-rinnovamento delle CSC e l'iniziazione del tumore sono accompagnati dalla promozione dell'angiogenesi per rimodellare il loro microambiente tumorale allo scopo di mantenere una nicchia di supporto. Tuttavia, i modelli precedenti non potevano essere utilizzati per le analisi in vitro a causa della limitata riproducibilità della coltivazione di CSCs derivate da campioni clinici a causa della rottura degli sferoidi dopo passaggi multipli. Più recentemente, sono stati sviluppati metodi sperimentali per coltivare CSC da pazienti per diverse applicazioni 4,5,6,7. In particolare, sfruttando la caratteristica delle CSCs di crescere formando sferoidi in piastre di attacco ultra-basse con mezzo privo di siero, le CSCs coltivate sono indotte ad esprimere un marcatore di superficie staminale che non è espresso in cellule tumorali normali con potenziale di differenziazione multilineage 8,9.
Dati recenti hanno dimostrato che la persistenza di (O)CSCs ovariche dormienti visualizzate come disseminazione al peritoneo è associata alla loro rigenerazione come tumori ricorrenti10. La comprensione delle caratteristiche molecolari e biologiche degli OCSC può quindi consentire un efficace targeting ed eradicazione di queste cellule, con conseguente potenziale remissione del tumore. In particolare, poco si sa riguardo alle caratteristiche meccanicistiche cellulari e molecolari dei ruoli delle CSCs nell'angiogenesi11. Pertanto, nel presente protocollo abbiamo utilizzato OCSC derivati dal paziente in un setting in vitro per studiare la proprietà angiogenica delle cellule endoteliali utilizzando il modello di co-coltura, che può imitare il microambiente tumorale delle CSCs e delle cellule endoteliali nel sito metastatico in ambito clinico. In definitiva, poiché la neovascolarizzazione costituisce un processo critico necessario per supportare la crescita tumorale e le metastasi, una migliore comprensione del suo meccanismo consentirà lo sviluppo di una nuova terapia mirata per gli OCSC nel sito metastatico.
Qui, presentiamo un protocollo per visualizzare la fase di neovascolarizzazione che circonda le CSC in un modo di tempo. Il vantaggio del protocollo include la possibilità di indagini completamente riproducibili utilizzando il sistema di co-coltura 3D, NICO-1, consentendo così l'osservazione degli effetti sui pazienti della capacità di iniziazione del tumore derivata da OCSC durante l'angiogenesi delle cellule endoteliali.
Protocollo
Tutte le procedure sono state eseguite secondo il protocollo approvato dal Comitato etico per il benessere umano. Tutti i pazienti hanno fornito il consenso informato scritto per l'uso della ricerca dei loro campioni e la raccolta e l'uso dei tessuti per questo studio sono stati approvati dal Comitato etico per la ricerca sul genoma umano, analisi genica dell'Università di Teikyo.
1. Isolamento e coltura di cellule staminali tumorali ovariche (OCSC) da pazienti con carcinoma ovarico e ascite in un armadio di biosicurezza di livello 2
- Isolare le cellule staminali tumorali dall'ascite del cancro ovarico umano ottenuta tramite paracentesi. Raccogliere almeno 100-250 ml di ascite dai pazienti per assumere un numero sufficiente di cellule staminali tumorali. Inoltre, valutare i profili di espressione dei marcatori delle cellule staminali tumorali (cioè EpCAM, Calretinina, CD133, CD44, CD45, ALDH1 e Oct4) e dei marcatori del cancro ovarico (pAX-8, WT-1) mediante citometria a flusso.
- Centrifugare l'ascite del cancro ovarico umano a 300 x g per 10 minuti a temperatura ambiente entro 24 ore dopo l'aspirazione dell'ascite.
- Rimuovere il surnatante e aggiungere 2 mL di terreno OCSC e 8 mL di soluzione salina tamponata Histodenz/fosfato al 30% (PBS, pH 7,4).
- Preparare il terreno OCSC: integratore StemPro hESC, DMEM⁄F-12 con L-glutammina (mezzo GlutaMAX), 25% BSA, 100 μM 2-mercaptoetanolo, 8 ng/mL FGF BASICO, 10 μM insulina e 20 μM Y-27632.
- Sovrapporre accuratamente 2 mL di terreno OCSC alla soluzione cellulare al punto 1.1.2 in una provetta da 15 mL e centrifugare a 450 x g per 20 minuti a temperatura ambiente in un rotore a benna oscillante senza frenare.
- Trasferire con cautela lo strato OCSC (indisturbato all'interfase) in un nuovo tubo da 15 mL mediante pipetta di trasferimento.
- Riempire con PBS fino a 15 ml. Centrifugare a 300 x g per 5 minuti a temperatura ambiente e rimuovere il surnatante.
- Risospendere il pellet cellulare in terreno OCSC e seme su un piatto di coltura a bassissimo attacco; le colture devono essere mantenute a 37 °C in 5% di CO2.
- Cambia il mezzo ogni tre giorni. Tenere attentamente il piatto di coltura per circa 1 minuto, scartare parte del surnatante e aggiungere il nuovo mezzo.
- Passaggio dei CSC
- Raccogliere gli OCSC in una provetta da 15 ml e centrifugare a 200 x g per 5 minuti a temperatura ambiente.
- Rimuovere il surnatante, riempire con PBS e centrifugare a 200 x g per 5 minuti a temperatura ambiente.
- Rimuovere il surnatante, aggiungere 1 mL della soluzione di distacco cellulare costituita da enzimi proteolitici e collagenolitici (ad es. AccuMax) e incubare a 37 °C per 10 minuti.
- Mescolare bene mediante pipettaggio e incubare a 37 °C per 5 minuti. Assicurarsi che le celle siano in un'unica sospensione.
- Mescolare bene mediante pipettaggio, riempire con PBS e centrifugare a 300 x g per 5 minuti a temperatura ambiente.
- Rimuovere il surnatante e risospendere il pellet cellulare in mezzo OCSC per la successiva semina su piastre di coltura a bassissimo attacco e il mantenimento a 37 °C in CO 2 al 5%.
2. Coltura cellulare endoteliale HUEhT-1
- Passaggio delle cellule HUEhT-1
- Rimuovere il terreno dal piatto di coltura HUEhT-1 e lavare le cellule con PBS.
- Aggiungere 1 mL di tripsina allo 0,025% e incubare per 3 minuti a temperatura ambiente.
- Aggiungere 5 ml di Endothelial Cell Growth Medium 2, raccogliere le cellule in una provetta da 15 mL e centrifugare a 200 x g per 5 minuti a temperatura ambiente.
- Rimuovere il surnatante, risospendere il pellet cellulare in mezzo HUEhT-1 e seminare le cellule su piatti di coltura rivestiti di collagene seguiti dal mantenimento a 37 °C in CO 2 al 5%.
- Cambia il mezzo ogni tre giorni.
3. Preparazione della piastra di cocoltura NICO-1 per il saggio di formazione del tubo utilizzando cellule HUEhT-1
- Assemblare NICO-1 e rivestirlo con l'idrogel a base di matrice extracellulare (Matrigel Matrix).
- Assemblare un lato di NICO-1 seguendo le istruzioni del produttore e conservare in ghiaccio.
- Coprire la superficie di NICO-1 con 300 μL di PBS freddo e quindi rimuovere il tampone.
- Aggiungere 300 μL di idrogel refrigerato a base di matrice extracellulare e incubare a 37 °C per 60 minuti.
- Per equilibrare, immergere il filtro con etanolo al 100%, quindi lavare un filtro ICCP da 13 mm (0,6 μm) con PBS per 1 minuto.
- Assemblare il NICO-1 includendo entrambe le parti principali del corpo A (camera destra) e B (camera sinistra) insieme all'O ring e al filtro equilibrato.
4. Semina di cellule HUEhT-1 e CSC sul sistema NICO-1
- Preparare sospensioni cellulari HUEhT-1 tripsinizzando i monostrati cellulari e risospendendo le cellule nel mezzo di crescita delle cellule endoteliali con siero fetale di vitello al 2%.
- Aggiungere 1,2 ml di sospensione cellulare (1,5 x 105 celle) a ciascun pozzetto rivestito di idrogel a base di matrice extracellulare.
- Aggiungere 1,5 ml di OCSC coltivati per cinque giorni all'altro pozzetto.
- Incubare NICO-1 a 37 °C in 5% di CO2; La formazione del tubo può essere osservata al microscopio e la formazione della rete su idrogel a base di matrice extracellulare misurata per mezzo del numero di rami.
Risultati
Abbiamo raccolto fluidi asciti ottenuti da pazienti con carcinoma ovarico avanzato durante l'intervento chirurgico o la paracentesi allo scopo di eseguire una coltura stabile a lungo termine per gli sferoidi. Qui, presentiamo casi di una coltura sferoide a lungo termine di CSCs ovariche denominate CSC1 e CSC2. Entrambe le linee cellulari portano la stessa diagnosi e gli stessi profili istologici. I ruoli meccanicistici degli OCSC alla base dell'interazione con le cellule endoteliali necessarie per indurre la neovascolarizzazione delle cellule endoteliali che circondano gli OCSC rimangono sconosciuti. Pertanto, abbiamo mirato a chiarire i processi di sviluppo della nicchia vascolare CSC nei siti metastatici. Abbiamo esaminato l'interazione tra cellule endoteliali (HUEhT-1) e OCSCs utilizzando il modello di cocoltura in vitro NICO-1. La Figura 1 mostra un confronto tra l'attività di formazione dei tubi indotta da CSC1 e CSC2. Il numero di tubi vascolari formati è aumentato drasticamente nel tempo nella cocoltura con CSC2 (Figura 2A). Per il controllo positivo, presentiamo la Figura 2B che mostra la proprietà angiogenica di HuEhT-1 dopo il trattamento di VEGF (10 ng/mL) senza co-coltura di CSC2. Stiamo ora chiarendo il meccanismo dettagliato alla base del risultato. Figura 3 mostra immagini rappresentative del modello di cocoltura di OCSC con cellule endoteliali utilizzando il NICO-1. Le cellule HUEhT-1 sono state cocoltivate con CSC2 per 20 ore e l'immagine video time-lapse è stata acquisita. La Figura 3A mostra il fenotipo di CSC2 prima e dopo la cocoltura per 20 ore. La figura 3B mostra le cellule HUEhT-1 cocoltivate contemporaneamente. È interessante notare che le cellule HUEhT-1 hanno formato tubi vascolari durante la cocoltura con CSC2 (Figura 3C: Video clip)

Figura 1: Modello di nicchia vascolare OCSCs. I ruoli meccanicistici con cui gli OCSC inducono la formazione del tubo (vascolarizzazione) delle cellule endoteliali rimangono sconosciuti. Abbiamo esaminato l'interazione tra cellule endoteliali (HUEhT-1) e OCSC utilizzando una modalità di co-coltura in vitro, NICO-1. Il vano destro di questo sistema è composto da un inserto, che contiene OCSC con il supporto cellulare. Il compartimento sinistro è costituito da un pozzetto contenente cellule endoteliali e HUVEC con lo stesso mezzo del pozzo destro.

Figura 2: Confronto delle attività di neovascolarizzazione indotte dagli OCSC. Nel corso del tempo, il numero di tubi vascolari formati è aumentato drasticamente dopo la cocoltura con CSC2.
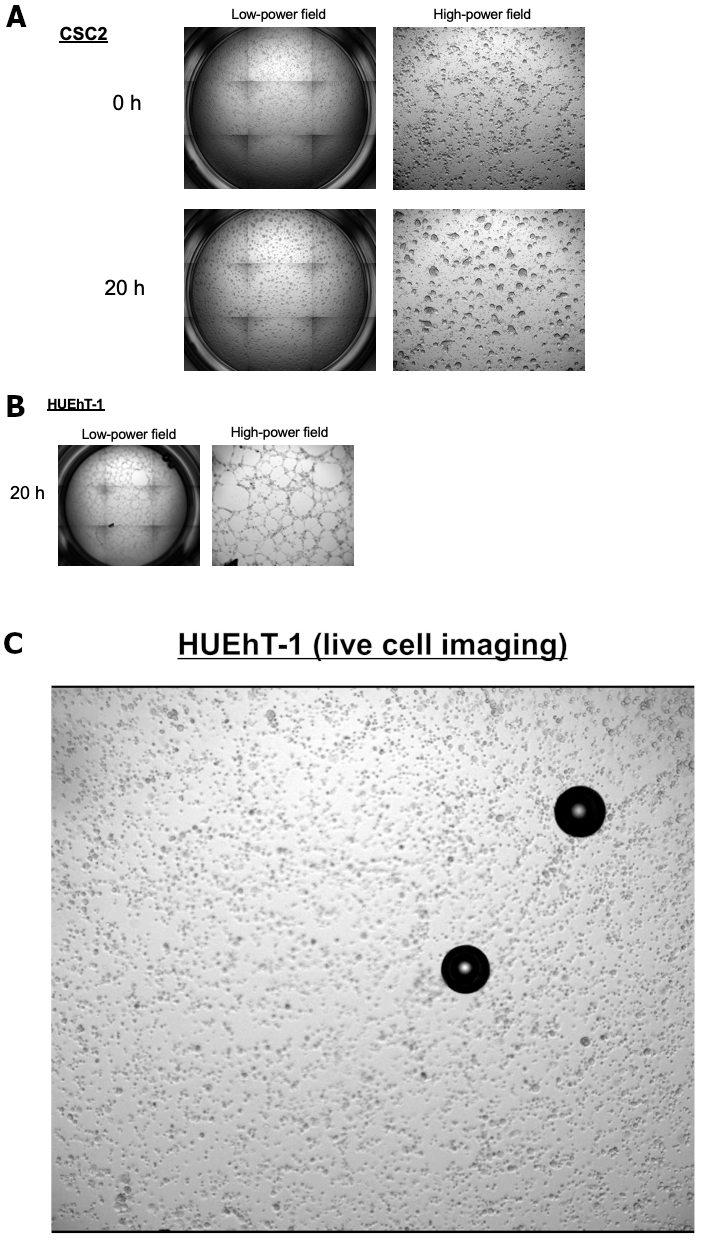
Figura 3: La formazione vascolare delle cellule HUEhT-1 in cocoltura con CSC2 utilizzando NICO-1. Le cellule HUEhT-1 hanno formato tubi vascolari durante la cocoltura con CSC2.
Discussione
Il protocollo presentato descrive come imitare il microambiente tumorale degli OCSC in un ambiente in vitro. La componente principale del metodo è costituita dal modello di cocoltura altamente riproducibile ottenuto utilizzando il sistema NICO-1, un sistema di co-coltura Transwell indiretto. Molti dei modelli di cocoltura attualmente disponibili esaminano gli effetti del contatto diretto cellula-cellula sulle popolazioni cellulari di cocoltura 12,13,14,15,16,17,18. Il modello più semplice che può essere utilizzato per esaminare gli effetti della co-coltura può riprodursi mediante la miscelazione diretta di due tipi cellulari, e l'estensione delle interazioni eterotipiche e omotipiche può essere esaminata alterando le densità di semina di ciascun tipo di cellula e il relativo rapporto di semina delle sottopopolazioni19. Tuttavia, determinare direttamente i contributi relativi degli OCSC a qualsiasi effetto osservato della cocoltura in modo indipendente mediante microscopia è difficile a causa della precisa invisibilità di ciascuna cellula; Pertanto, questi studi sono spesso accompagnati in parallelo da esperimenti sui media condizionati. Ad esempio, un sistema di cocoltura segregato può essere utilizzato in studi in cui gli effetti della segnalazione paracrina sul microambiente tumorale sono di interesse19. In confronto, nel presente metodo descriviamo un modello che consente la valutazione simultanea degli effetti del contatto cellula-cellula e della segnalazione paracrina, che imitano l'architettura del microambiente tumorale nativo.
L'angiogenesi funge da segno distintivo del cancro ovarico e svolge un ruolo fondamentale nella sua progressione, che coinvolge interazioni tra cellule tumorali, cellule endoteliali e il microambiente tumorale circostante20. Bevacizumab è un farmaco chiave a bersaglio molecolare che è stato ampiamente accettato per l'uso nella chemioterapia combinata per il carcinoma ovarico avanzato21. In particolare, bevacizumab costituisce un anticorpo monoclonale contro il fattore di crescita endoteliale vascolare (VEGF). Il VEGF contribuisce allo sviluppo della carcinosi peritoneale e alla formazione di ascite maligna nel carcinoma ovarico o peritoneale avanzato promuovendo la neovascolarizzazione e migliorando la permeabilità vascolare22. Pertanto, l'inibizione del VEGF ha dimostrato di inibire la produzione di ascite e la crescita massiccia del tumore nel sito metastatico. Sono quindi necessarie ulteriori indagini che colpiscano efficacemente le cellule endoteliali vascolari stimolate dal VEGF a livello del microambiente tumorale. Tuttavia, può essere difficile utilizzare efficacemente modelli preclinici, come i modelli murini, per questi studi. Ad esempio, è stato riportato che l'affinità di bevacizumab per il VEGF umano è elevata mentre quella della proteina del topo è inferiorea 23. Ciò impone una limitazione per quanto riguarda l'applicazione di bevacizumab all'interno di esperimenti progettati per studiare ulteriormente il suo meccanismo anti-VEGF verso la neovascolarizzazione nel microambiente tumorale come accertato utilizzando modelli murini. È quindi necessario un modello appropriato con un'architettura ben controllata per ricapitolare le componenti del microambiente tumorale in vivo. In tal caso, notiamo che il nostro sistema modello di cocoltura in vitro consente il monitoraggio in tempo reale del comportamento cellulare durante la coltura degli OCSC derivati dal paziente e delle cellule endoteliali e consente lo studio di queste singole sottopopolazioni cellulari in risposta alla cocoltura.
Una migliore comprensione del ruolo degli OCSC e della loro nicchia vascolare potrebbe fornire nuove intuizioni per lo sviluppo di strategie terapeutiche per gli OCSC. Come mostrato negli esperimenti rappresentativi, i punti di forza del modello sono che fornisce una piattaforma di studio che sembra essere in parte congruente con le impostazioni cliniche, consentendo lo sviluppo e la sperimentazione di nuovi farmaci più mirati ed efficaci. Sono necessari ulteriori studi con replica clinica diretta dei nostri risultati che coinvolgono un numero più significativo di OCSC derivati dal paziente.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto da un Grant-in-Aid for Scientific Research C (grant no. 19K09834 to K.N.) del Ministero dell'Istruzione, della Scienza e della Cultura, Giappone.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.025% Trypsin | Thermo | R001100 | |
| 10 mL Pipet | Thermo | 170356N | |
| 1250 µL Pipet tip | QSP | T112XLRS-Q | |
| 15 mL tube | Nunc | 339650 | |
| 200 µL Pipet tip | QSP | T110RS-NEW | |
| 2-Mercaptoethanol | Thermo (Gibco) | 21985023 | |
| 5 mL Pipet | Thermo | 170366N | |
| 50 mL tube | Corning | 430290 | |
| AccuMAX | Innovative Cell Technologies | AM105 | |
| BioCoatTM Collagen I 60mm Dish | Corning | 356401 | |
| Centrifuge | KUBOTA | 2800 | |
| Costar 6 Well Clear Flat Bottom Ultra Low Attachment Multiple Well Plates | Corning | 3471 | |
| Endothelial Cell Growth Medium 2 | PromoCell | C-22011 | |
| Ethanol | WAKO | 057-00456 | |
| FGF-Basic | Thermo (Gibco) | PHG0021 | |
| Histodenz | SIGMA | D2158 | |
| HUEhT-1 cell | JCRB Cell Bank | JCRB1458 | |
| ICCP Filter 0.6 µm | Ginrei Lab. | 2525-06 | |
| Insulin, human | SIGMA (Roche) | 11376497001 | |
| Luminometer | PerkinElmer | ARVO MX-flad | |
| Matrigel Matrix | Corning | 356234 | |
| Microscope | Yokogawa | CQ-1 | |
| NICO-1 | Ginrei Lab. | 2501-02 | |
| OptiPlate-96 | PerkinElmer | 6005290 | |
| P1000 Pipet | Gilson | F123602 | |
| P200 Pipet | Gilson | F123601 | |
| PBS | Thermo (Gibco) | 14190-144 | |
| StemPro hESC SFM | Thermo (Gibco) | A1000701 | |
| Transfer Pipet | FALCON | 357575 | |
| Y-27632 | WAKO | 253-00513 |
Riferimenti
- Bray, F., et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA, a Cancer Journal for Clinicians. 68, 394-424 (2018).
- Lengyel, E. Ovarian cancer development and metastasis. American Journal of Pathology. 177 (3), 1053-1064 (2010).
- Lytle, N. K., Barber, A. G., Reya, T. Stem cell fate in cancer growth, progression and therapy resistance. Nature Reviews Cancer. 18 (11), 669-680 (2018).
- Dontu, G., et al. In vitro propagation and transcriptional profiling of human mammary stem/progenitor cells. Genes and Development. 17 (10), 1253-1270 (2003).
- Lonardo, E., et al. Nodal/Activin signaling drives selfrenewal and tumorigenicity of pancreatic cancer stem cells and provides a target for combined drug therapy. Cell Stem Cell. 9 (5), 433-446 (2011).
- Ricci-Vitiani, L., et al. Identification and expansion of human colon-cancer-initiating cells. Nature. 445 (7123), 111-115 (2007).
- Ohata, H., et al. Induction of the stem-like cell regulator CD44 by Rho kinase inhibition contributes to the maintenance of colon cancer-initiating cells. Cancer Research. 72 (19), 5101-5110 (2012).
- Ishiguro, T., et al. Establishment and characterization of an in vitro model of ovarian cancer stem-like cells with an enhanced proliferative capacity. Cancer Research. 76 (1), 150-160 (2016).
- Singh, S. K., et al. Identification of a cancer stem cell in human brain tumors. Cancer Research. 63 (18), 5821-5828 (2003).
- Zong, X., Nephew, K. P. Ovarian cancer stem cells: role in metastasis and opportunity for therapeutic targeting. Cancers (Basel). 11 (7), 934(2019).
- Lizárraga-Verdugo, E., et al. Cancer stem cells and its role in angiogenesis and vasculogenic mimicry in gastrointestinal cancers. Frontiers in oncology. 10, 413(2020).
- Renaud, J., Martinoli, M. G. Development of an insert co-culture system of two cellular types in the absence of cell-cell contact. Journal of Visualized Experiments. (113), e54356(2016).
- Richardson, S. M., et al. Intervertebral disc cell-mediated mesenchymal stem cell differentiation. Stem Cells. 24 (3), 707-716 (2006).
- Plotnikov, E. Y., et al. Cell-to-cell cross-talk between mesenchymal stem cells and cardiomyocytes in co-culture. Journal of Cellular and Molecular Medicine. 12 (5), 1622-1631 (2008).
- Sheng, H., et al. A critical role of IFN-gamma in priming MSC-mediated suppression of T cell proliferation through up-regulation of B7-H1. Cell Research. 18 (8), 846-857 (2008).
- Csaki, C., Matis, U., Mobasheri, A., Shakibaei, M. Co-culture of canine mesenchymal stem cells with primary bone-derived osteoblasts promotes osteogenic differentiation. Histochemistry and Cell Biology. 131 (2), 251-266 (2009).
- Aguirre, A., Planell, J. A., Engel, E. Dynamics of bone marrow-derived endothelial progenitor cell/mesenchymal stem cell interaction in co-culture and its implications in angiogenesis. Biochemical and Biophysical Research Communications. 400 (2), 284-291 (2010).
- Proffen, B. L., Haslauer, C. M., Harris, C. E., Murray, M. M. Mesenchymal stem cells from the retropatellar fat pad and peripheral blood stimulate ACL fibroblast migration, proliferation, and collagen gene expression. Connective Tissue Research. 54 (1), 14-21 (2013).
- Goers, L., Freemont, P., Polizzi, K. M. Co-culture systems and technologies: taking synthetic biology to the next level. Journal of the Royal Society & Interface. 11 (96), 20140065(2014).
- De Palma, M., Biziato, D., Petrova, T. Microenvironmental regulation of tumour angiogenesis. Nature Reviews Cancer. 17, 457-474 (2017).
- Burger, R., et al. Incorporation of bevacizumab in the primary treatment of ovarian cancer. New England Journal of Medicine. 365, 2473-2483 (2011).
- Goel, H., Mercurio, A. VEGF targets the tumour cell. Nature Reviews Cancer. 13, 871-882 (2013).
- Yu, L., et al. Interaction between bevacizumab and murine VEGF-A: a reassessment. Investigative Ophthalmology and Visual Science. 49 (2), 522-527 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon