Method Article
Оценка ангиогенетических свойств стволовых клеток рака яичников с использованием трехмерной системы кокультур, NICO-1
В этой статье
Резюме
Стволовые клетки рака яичников (OCSC) ответственны за начало рака, рецидив, терапевтическую резистентность и метастазирование. Считается, что сосудистая ниша OCSC способствует самообновлению OCSC, что приводит к хеморезистентности. Этот протокол обеспечивает основу для создания воспроизводимой модели сосудистой ниши OCSC in vitro.
Аннотация
Раковые стволовые клетки (CSC) находятся в поддерживающей нише, представляя собой микросреду, состоящую из соседних стромальных клеток, сосудов и внеклеточного матрикса. Способность ЦОК участвовать в развитии эндотелия представляет собой важную характеристику, которая непосредственно способствует общему пониманию механизмов опухолевого генеза и метастазирования опухоли. Целью данной работы является создание воспроизводимой методологии исследования опухолевой способности стволовых клеток рака яичников (OCSC). Здесь мы изучили механизм неоваскуляризации между эндотелиальными клетками и OCSC наряду с морфологическими изменениями эндотелиальных клеток с использованием модели совместной культуры in vitro NICO-1. Этот протокол позволяет визуализировать стадию неоваскуляризации, окружающую OCSC, с течением времени. Метод может дать представление об ангиогенетических свойствах OCSC в метастазировании опухоли.
Введение
Рак яичников является восьмым наиболее распространенным злокачественным новообразованием у женщин во всем мире, с примерно 300 000 новых диагнозов и, по оценкам, 180 000 смертей в год1. При первоначальной диагностике рак яичников часто проявляется тяжелыми симптомами, причем около 75% пациенток уже находятся на стадии III-IV. Соответственно, 5-летняя выживаемость составляет <30%, а смертность является самой высокой среди гинекологических раковых заболеваний2, причем эффективность лечения рака яичников сильно зависит от клинических факторов, таких как успешное выполнение операции по удалению, устойчивость к химиотерапии и рецидив после начальной терапии.
Ткани рака яичников иерархически организованы, причем не все опухолевые компоненты одинаково способны генерировать потомков. Считается, что единственные клетки, способные самообновляться и продуцировать гетерогенную популяцию опухолевых клеток, представляют собой раковые стволовые клетки (CSC)3. Самообновление CSC и инициация опухоли сопровождаются продвижением ангиогенеза для ремоделирования их опухолевого микроокружения с целью поддержания поддерживающей ниши. Однако предыдущие модели не могли быть использованы для анализа in vitro из-за ограниченной воспроизводимости культивирования CSC, полученных из клинических образцов, из-за нарушения сфероидов после многократного прохождения. Совсем недавно экспериментальные методы культивирования CSC у пациентов были разработаны для нескольких применений 4,5,6,7. В частности, используя характеристику CSC для роста путем формирования сфероидов в сверхнизких пластинах прикрепления со свободной от сыворотки средой, культивируемые CSC индуцируются к экспрессии маркера поверхности стволовых клеток, который не экспрессируется в нормальных опухолевых клетках с многолинейным потенциалом дифференцировки 8,9.
Последние данные показали, что персистенция спящих яичников (O)CSC, визуализируемых как диссеминация в брюшине, связана с их регенерацией в виде рецидивирующих опухолей10. Таким образом, понимание молекулярных и биологических особенностей OCSC может позволить эффективно нацеливаться и эрадикации этих клеток, что приводит к потенциальной ремиссии опухоли. В частности, мало что известно о клеточных и молекулярно-механистических особенностях ролей ЦОНа в ангиогенезе11. Поэтому в настоящем протоколе мы использовали OCSC, полученные от пациента, в условиях in vitro для исследования ангиогенного свойства эндотелиальных клеток с использованием модели ко-культуры, которая может имитировать микроокружение опухоли CSC и эндотелиальных клеток в метастатическом месте в клинических условиях. В конечном счете, поскольку неоваскуляризация представляет собой критический процесс, необходимый для поддержки роста опухоли и метастазирования, лучшее понимание ее механизма позволит разработать новую таргетную терапию для OCSC в метастатическом месте.
Здесь мы представляем протокол для визуализации шага неоваскуляризации, окружающего CSC, с течением времени. Преимущество протокола включает в себя возможность полностью воспроизводимых исследований с использованием 3D-системы кокультуры NICO-1, что позволяет наблюдать за воздействием на пациентов способности инициации опухоли, полученной из OCSC, во время эндотелиального клеточного ангиогенеза.
протокол
Все процедуры выполнялись в соответствии с протоколом, утвержденным Комитетом по этике благосостояния человека. Все пациенты предоставили письменное информированное согласие на исследовательское использование их образцов, а сбор и использование тканей для этого исследования были одобрены Комитетом по этике исследований генома человека, генного анализа в Университете Тейкё.
1. Выделение и культивирование стволовых клеток рака яичников (OCSC) у пациентов с раком яичников и асцитом в кабинете биобезопасности уровня 2
- Изолируйте раковые стволовые клетки из асцита рака яичников человека, полученного с помощью парацентеза. Соберите не менее 100-250 мл асцита у пациентов, чтобы взять достаточное количество раковых стволовых клеток. Кроме того, оцените профили экспрессии маркеров раковых стволовых клеток (т.е. EpCAM, Calretinin, CD133, CD44, CD45, ALDH1 и Oct4) и маркеров рака яичников (pAX-8, WT-1) с помощью проточной цитометрии.
- Центрифугируют асцит рака яичников человека при 300 х г в течение 10 мин при комнатной температуре в течение 24 ч после аспирации асцита.
- Удалите надосадочный материал и добавьте 2 мл среды OCSC и 8 мл 30% раствора гистоденза/фосфатного буферного физиологического раствора (PBS, pH 7,4).
- Подготовка среды OCSC: добавка StemPro hESC, DMEM⁄F-12 с L-глютамином (среда GlutaMAX), 25% BSA, 100 мкМ 2-меркаптоэтанола, 8 нг/мл FGF BASIC, 10 мкМ инсулина и 20 мкМ Y-27632.
- Осторожно накладывайте 2 мл среды OCSC на раствор ячейки на стадии 1.1.2 в трубку 15 мл и центрифугу при 450 х г в течение 20 мин при комнатной температуре в роторе с качающимся ковшом без торможения.
- Аккуратно перенесите слой OCSC (не нарушенный на межфазе) на новую трубу объемом 15 мл путем перекачки пипетки.
- Наполните PBS до 15 мл. Центрифугу при 300 х г в течение 5 мин при комнатной температуре и удаляют супернатант.
- Повторное суспендирование клеточной гранулы в среде OCSC и семена на чашке для культивирования со сверхнизким прикреплением; культуры следует поддерживать при температуре 37 °C в 5% CO2.
- Меняйте среду каждые три дня. Осторожно выдержите блюдо для культуры около 1 минуты, выбросьте часть супернатанта и добавьте новую среду.
- Прохождение ЦОНов
- Собирают OCSC в пробирке 15 мл и центрифуге при 200 х г в течение 5 мин при комнатной температуре.
- Удалите супернатант, заполните PBS и центрифугируйте при 200 х г в течение 5 мин при комнатной температуре.
- Удалить надосадочный агент, добавить 1 мл раствора для отсоединения клеток, состоящего из протеолитических и коллагенолитических ферментов (например, AccuMax), и инкубировать при 37 °C в течение 10 мин.
- Хорошо перемешать путем пипетки и инкубировать при 37 °C в течение 5 мин. Убедитесь, что клетки находятся в одной суспензии.
- Хорошо перемешать путем пипетки, залить ПБС и центрифугировать при 300 х г в течение 5 мин при комнатной температуре.
- Удалите супернатант и повторно суспендируйте ячейку гранулы в среде OCSC для последующего посева на чашках для культивирования со сверхнизким прикреплением и поддержания при 37 °C в 5% CO2.
2. Культура эндотелиальных клеток HUEhT-1
- Прохождение ячеек HUEhT-1
- Удалите среду из чашки для культивирования HUEhT-1 и вымойте клетки PBS.
- Добавить 1 мл 0,025% трипсина и инкубировать в течение 3 мин при комнатной температуре.
- Добавьте 5 мл среды роста эндотелиальных клеток 2, соберите клетки в пробирку объемом 15 мл и центрифугу при 200 х г в течение 5 мин при комнатной температуре.
- Удалите супернатант, повторно суспендируйте клеточную гранулу в среде HUEhT-1 и посейте клетки на покрытые коллагеном культуральные чашки с последующим поддержанием при 37 °C в 5% CO2.
- Меняйте среду каждые три дня.
3. Подготовка кокультурной пластины NICO-1 для трубообразующего анализа с использованием клеток HUEhT-1
- Собирают NICO-1 и покрывают внеклеточным матриксом на основе гидрогеля (Matrigel Matrix).
- Соберите одну сторону NICO-1 в соответствии с инструкциями производителя и держите на льду.
- Накройте поверхность NICO-1 300 мкл холодного PBS, а затем удалите буфер.
- Добавьте 300 мкл охлажденного гидрогеля на основе внеклеточного матрикса и инкубируйте при 37 °C в течение 60 мин.
- Чтобы уравновесить, погрузите фильтр со 100% этанолом, затем промывайте 13-мм ICCP-фильтр (0,6 мкм) PBS в течение 1 мин.
- Соберите NICO-1, включающий обе основные части корпуса A (правая камера) и B (левая камера), а также кольцо O и уравновешенный фильтр.
4. Посев клеток HUEhT-1 и CSC в систему NICO-1
- Приготовьте клеточные суспензии HUEhT-1 путем трипсинизации клеточных монослоев и повторного использования клеток в среде роста эндотелиальных клеток с 2% сывороткой для телят плода.
- Добавьте 1,2 мл клеточной суспензии (1,5 х 105 клеток) к каждому хорошо покрытому гидрогелевым покрытием на основе внеклеточного матрикса.
- Добавьте 1,5 мл OCSC, культивируемых в течение пяти дней, в другую скважину.
- Инкубировать НИКО-1 при 37 °С в 5%СО2; Образование трубки можно наблюдать под микроскопом, а формирование сети на гидрогеле на основе внеклеточного матрикса измеряется с помощью количества ветвей.
Результаты
Мы собрали асцитовые жидкости, полученные от пациенток с прогрессирующим раком яичников во время операции или парацентеза с целью выполнения долгосрочной стабильной культуры для сфероидов. Здесь мы представляем случаи долгосрочной сфероидной культуры Яичников, называемой CSC1 и CSC2. Обе клеточные линии несут один и тот же диагноз и гистологические профили. Механистические роли OCSC, лежащие в основе взаимодействия с эндотелиальными клетками, необходимыми для индуцирования неоваскуляризации эндотелиальных клеток, окружающих OCSC, остаются неизвестными. Поэтому мы стремились прояснить процессы развития сосудистой ниши ЦОН на метастатических участках. Мы изучили взаимодействие между эндотелиальными клетками (HUEhT-1) и OCSC с использованием модели кокультуры in vitro NICO-1. На рисунке 1 показано сравнение активности трубообразования, индуцированной CSC1 и CSC2. Количество образующихся сосудистых трубок резко увеличивалось с течением времени в кокультуре с CSC2 (рисунок 2A). Для положительного контроля мы представляем рисунок 2B , который показывает ангиогенное свойство HuEhT-1 после обработки VEGF (10 нг/мл) без кокультуры CSC2. Сейчас мы уточняем подробный механизм, лежащий в основе результата. Рисунок 3 показаны репрезентативные изображения кокультурной модели OCSC с эндотелиальными клетками с использованием NICO-1. Клетки HUEhT-1 кокумулировали с CSC2 в течение 20 часов, и было получено покадровое видеоизображение. На рисунке 3А показан фенотип CSC2 до и после кокультуры в течение 20 часов. На рисунке 3B показаны клетки HUEhT-1, кокулируемые одновременно. Примечательно, что клетки HUEhT-1 образовывали сосудистые трубки во время кокультуры с CSC2 (Рисунок 3C: Видеоклип)

Рисунок 1: Модель сосудистой ниши OCSC. Механистические роли, с помощью которых OCSC индуцируют трубчатое образование (васкуляризацию) эндотелиальных клеток, остаются неизвестными. Мы изучили взаимодействие между эндотелиальными клетками (HUEhT-1) и OCSC с использованием режима кокультуры in vitro, NICO-1. Правый отсек этой системы состоит из вставки, которая удерживает OCSC с клеточной средой. Левый отсек состоит из колодца, содержащего эндотелиальные клетки и HUVEC с той же средой, что и в правом колодце.

Рисунок 2: Сравнение неоваскуляризационной деятельности, индуцированной OCSC. Со временем количество образующихся сосудистых трубок резко возросло при кокультуре с CSC2.
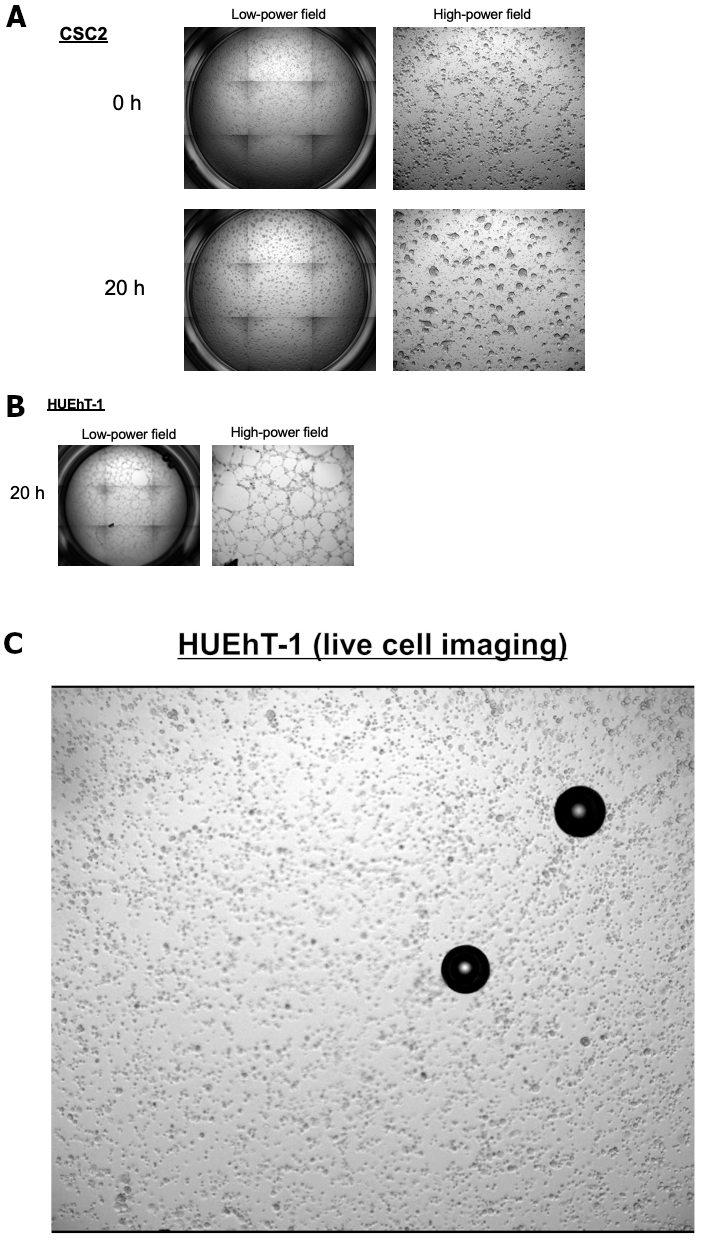
Рисунок 3: Сосудистое образование клеток HUEhT-1, кокультурированных с CSC2 с использованием NICO-1. Клетки HUEhT-1 образовывали сосудистые трубки во время кокультуры с CSC2.
Обсуждение
Представленный протокол описывает, как имитировать микроокружение опухоли OCSC в условиях in vitro. Первичный компонент метода представляет собой высоковоспроизводимую модель кокультуры, полученную с использованием системы NICO-1, косвенной системы кокультур Transwell. Многие из доступных в настоящее время моделей кокультуры изучают влияние прямого клеточного контакта на кокутивируемые клеточные популяции 12,13,14,15,16,17,18. Простейшая модель, которая может быть использована для изучения эффектов кокультуры, может воспроизводиться путем прямого смешивания двух типов клеток, а степень гетеротипических и гомотипических взаимодействий может быть изучена путем изменения плотности посева каждого типа клеток и относительного соотношения посева субпопуляций19. Однако непосредственное определение относительного вклада OCSC в любые наблюдаемые эффекты кокультуры независимо с помощью микроскопии затруднено из-за точной невидимости каждой клетки; таким образом, эти исследования часто сопровождаются параллельно экспериментами с условными средами. Например, сегрегированная система кокультуры может быть использована в исследованиях, в которых эффекты паракринной сигнализации на микроокружение опухоли представляют интерес19. Для сравнения, в настоящем способе описана модель, позволяющая одновременно оценивать эффекты клеточно-клеточного контакта и паракринной сигнализации, которые имитируют архитектуру микроокружения нативной опухоли.
Ангиогенез служит отличительной чертой рака яичников и играет решающую роль в его прогрессировании, которое включает взаимодействия между раковыми клетками, эндотелиальными клетками и окружающим опухолевым микроокружением20. Бевацизумаб является ключевым молекулярным таргетным препаратом, который был широко принят для использования в комбинированной химиотерапии при распространенном раке яичников21. В частности, бевацизумаб представляет собой моноклональное антитело против фактора роста эндотелия сосудов (VEGF). VEGF способствует развитию перитонеального канцероматоза и образованию злокачественного асцита при прогрессирующем раке яичников или брюшины, способствуя неоваскуляризации и повышению проницаемости сосудов22. Таким образом, было показано, что ингибирование VEGF ингибирует выработку асцита и массивный рост опухоли в метастатическом месте. Таким образом, необходимы дальнейшие исследования, которые эффективно нацелены на VEGF-стимулируемые сосудистые эндотелиальные клетки на уровне микроокружения опухоли. Тем не менее, может быть трудно эффективно использовать доклинические модели, такие как мышиные модели, для этих исследований. Например, сообщалось, что сродство бевацизумаба к VEGF человека высокое, тогда как сродство мышиного белка ниже23. Это накладывает ограничение в отношении применения бевацизумаба в экспериментах, предназначенных для дальнейшего изучения его анти-VEGF-механизма в отношении неоваскуляризации в микроокружении опухоли, как установлено с использованием мышиных моделей. Поэтому для рекапитуляции компонентов микроокружения опухоли in vivo необходима соответствующая модель с хорошо контролируемой архитектурой. В таком случае мы отмечаем, что наша модельная система кокультуры in vitro позволяет отслеживать поведение клеток в реальном времени во всей культуре полученных пациентом OCSC и эндотелиальных клеток и позволяет изучать эти отдельные субпопуляции клеток в ответ на кокультуру.
Лучшее понимание роли OCSC и их сосудистой ниши может дать новое понимание для разработки терапевтических стратегий для OCSC. Как показано в репрезентативных экспериментах, сильные стороны модели заключаются в том, что она обеспечивает исследовательскую платформу, которая, по-видимому, частично соответствует клиническим условиям, что позволяет разрабатывать и тестировать более целенаправленные и эффективные новые препараты. Необходимы дальнейшие исследования с прямой клинической репликацией наших результатов с участием более значительного числа OCSC, полученных от пациентов.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана грантом на научные исследования C (грант No 19K09834 для K.N.) от Министерства образования, науки и культуры Японии.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.025% Trypsin | Thermo | R001100 | |
| 10 mL Pipet | Thermo | 170356N | |
| 1250 µL Pipet tip | QSP | T112XLRS-Q | |
| 15 mL tube | Nunc | 339650 | |
| 200 µL Pipet tip | QSP | T110RS-NEW | |
| 2-Mercaptoethanol | Thermo (Gibco) | 21985023 | |
| 5 mL Pipet | Thermo | 170366N | |
| 50 mL tube | Corning | 430290 | |
| AccuMAX | Innovative Cell Technologies | AM105 | |
| BioCoatTM Collagen I 60mm Dish | Corning | 356401 | |
| Centrifuge | KUBOTA | 2800 | |
| Costar 6 Well Clear Flat Bottom Ultra Low Attachment Multiple Well Plates | Corning | 3471 | |
| Endothelial Cell Growth Medium 2 | PromoCell | C-22011 | |
| Ethanol | WAKO | 057-00456 | |
| FGF-Basic | Thermo (Gibco) | PHG0021 | |
| Histodenz | SIGMA | D2158 | |
| HUEhT-1 cell | JCRB Cell Bank | JCRB1458 | |
| ICCP Filter 0.6 µm | Ginrei Lab. | 2525-06 | |
| Insulin, human | SIGMA (Roche) | 11376497001 | |
| Luminometer | PerkinElmer | ARVO MX-flad | |
| Matrigel Matrix | Corning | 356234 | |
| Microscope | Yokogawa | CQ-1 | |
| NICO-1 | Ginrei Lab. | 2501-02 | |
| OptiPlate-96 | PerkinElmer | 6005290 | |
| P1000 Pipet | Gilson | F123602 | |
| P200 Pipet | Gilson | F123601 | |
| PBS | Thermo (Gibco) | 14190-144 | |
| StemPro hESC SFM | Thermo (Gibco) | A1000701 | |
| Transfer Pipet | FALCON | 357575 | |
| Y-27632 | WAKO | 253-00513 |
Ссылки
- Bray, F., et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA, a Cancer Journal for Clinicians. 68, 394-424 (2018).
- Lengyel, E. Ovarian cancer development and metastasis. American Journal of Pathology. 177 (3), 1053-1064 (2010).
- Lytle, N. K., Barber, A. G., Reya, T. Stem cell fate in cancer growth, progression and therapy resistance. Nature Reviews Cancer. 18 (11), 669-680 (2018).
- Dontu, G., et al. In vitro propagation and transcriptional profiling of human mammary stem/progenitor cells. Genes and Development. 17 (10), 1253-1270 (2003).
- Lonardo, E., et al. Nodal/Activin signaling drives selfrenewal and tumorigenicity of pancreatic cancer stem cells and provides a target for combined drug therapy. Cell Stem Cell. 9 (5), 433-446 (2011).
- Ricci-Vitiani, L., et al. Identification and expansion of human colon-cancer-initiating cells. Nature. 445 (7123), 111-115 (2007).
- Ohata, H., et al. Induction of the stem-like cell regulator CD44 by Rho kinase inhibition contributes to the maintenance of colon cancer-initiating cells. Cancer Research. 72 (19), 5101-5110 (2012).
- Ishiguro, T., et al. Establishment and characterization of an in vitro model of ovarian cancer stem-like cells with an enhanced proliferative capacity. Cancer Research. 76 (1), 150-160 (2016).
- Singh, S. K., et al. Identification of a cancer stem cell in human brain tumors. Cancer Research. 63 (18), 5821-5828 (2003).
- Zong, X., Nephew, K. P. Ovarian cancer stem cells: role in metastasis and opportunity for therapeutic targeting. Cancers (Basel). 11 (7), 934(2019).
- Lizárraga-Verdugo, E., et al. Cancer stem cells and its role in angiogenesis and vasculogenic mimicry in gastrointestinal cancers. Frontiers in oncology. 10, 413(2020).
- Renaud, J., Martinoli, M. G. Development of an insert co-culture system of two cellular types in the absence of cell-cell contact. Journal of Visualized Experiments. (113), e54356(2016).
- Richardson, S. M., et al. Intervertebral disc cell-mediated mesenchymal stem cell differentiation. Stem Cells. 24 (3), 707-716 (2006).
- Plotnikov, E. Y., et al. Cell-to-cell cross-talk between mesenchymal stem cells and cardiomyocytes in co-culture. Journal of Cellular and Molecular Medicine. 12 (5), 1622-1631 (2008).
- Sheng, H., et al. A critical role of IFN-gamma in priming MSC-mediated suppression of T cell proliferation through up-regulation of B7-H1. Cell Research. 18 (8), 846-857 (2008).
- Csaki, C., Matis, U., Mobasheri, A., Shakibaei, M. Co-culture of canine mesenchymal stem cells with primary bone-derived osteoblasts promotes osteogenic differentiation. Histochemistry and Cell Biology. 131 (2), 251-266 (2009).
- Aguirre, A., Planell, J. A., Engel, E. Dynamics of bone marrow-derived endothelial progenitor cell/mesenchymal stem cell interaction in co-culture and its implications in angiogenesis. Biochemical and Biophysical Research Communications. 400 (2), 284-291 (2010).
- Proffen, B. L., Haslauer, C. M., Harris, C. E., Murray, M. M. Mesenchymal stem cells from the retropatellar fat pad and peripheral blood stimulate ACL fibroblast migration, proliferation, and collagen gene expression. Connective Tissue Research. 54 (1), 14-21 (2013).
- Goers, L., Freemont, P., Polizzi, K. M. Co-culture systems and technologies: taking synthetic biology to the next level. Journal of the Royal Society & Interface. 11 (96), 20140065(2014).
- De Palma, M., Biziato, D., Petrova, T. Microenvironmental regulation of tumour angiogenesis. Nature Reviews Cancer. 17, 457-474 (2017).
- Burger, R., et al. Incorporation of bevacizumab in the primary treatment of ovarian cancer. New England Journal of Medicine. 365, 2473-2483 (2011).
- Goel, H., Mercurio, A. VEGF targets the tumour cell. Nature Reviews Cancer. 13, 871-882 (2013).
- Yu, L., et al. Interaction between bevacizumab and murine VEGF-A: a reassessment. Investigative Ophthalmology and Visual Science. 49 (2), 522-527 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены