Method Article
Gram-Negatif Bakteriyel Sepsisin Yenidoğan Görüntüleme Modeli
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Neonatal farelerin biyolüminesans E. coli O1:K1:H7 ile enfeksiyonu, önemli pulmoner inflamasyon ve akciğer patolojisi ile septik enfeksiyona neden olur. Burada, sistemik bakteriyel yüklerin numaralandırılmasına paralel olarak uzunlamasına intravital görüntüleme, inflamatuar profilleme ve akciğer histopatolojisi ile birlikte neonatal sepsisin modellenmesi ve incelenmesi için yapılan prosedürleri açıklıyoruz.
Özet
Neonates onlar yaşamın ilk aylarında görüntülemek benzersiz bağışıklık profili nedeniyle bakteriyel sepsis riski altındadır. Yeninelerde yüksek mortalite oranlarından sorumlu bir serotip olan E. coli O1:K1:H7 patogenezinin incelenmesi için bir protokol oluşturduk. Yöntemimizde enfeksiyonun ilerlemesi sırasında farklı zaman noktalarında yenidoğan yavrularının intravital görüntülemesi kullanılmaktadır. Kandaki bakterilerin ölçülmesi, inflamatuar profilleme ve doku histopatolojisi ile paralel lik gösteren bu görüntüleme, sepsis sırasında enfeksiyon dinamiklerini anlamak için titiz bir yaklaşım anlamına gelir. Mevcut raporda, bakteriyel yüklerin karşılaştırılması ve hastalığın şiddetini karşılaştırmak için iki enfeksiyöz inokül modellenmiştir. Subscapular enfeksiyonun enfeksiyon sonrası 10 saat ile yaygın enfeksiyona yol açtığını bulduk. 24 saat, Parlak E. coli enfeksiyonu kan, akciğerler ve diğer periferik dokularda bol oldu. Akciğerlerde inflamatuar sitokinlerin ekspresyonu 24 saat önemlidir, ve bu hücresel infiltrasyon ve enfeksiyöz doz ile artar doku hasarı kanıt takip eder. İntravital görüntülemenin bazı sınırlamaları vardır. Bu bir Parlak sinyal eşiği ve anestezi sırasında neonates ile ortaya çıkabilecek bazı komplikasyonlar içerir. Bazı sınırlamalara rağmen, enfeksiyon modelimizin yenidoğan mürin sepsisi sırasında uzunlamasına enfeksiyon dinamiklerini anlamak için bir fikir verdiğini ve bugüne kadar iyice incelenmediğini görüyoruz. Biz bu model de erken yaşam sırasında diğer kritik bakteriyel enfeksiyonları incelemek için adapte edilebilir bekliyoruz.
Giriş
Bakteriyel sepsisenfeksiyonakarşı yeterli koruma sağlamaz yaşamın ilk günlerinde benzersiz bir bağışıklık profili sergileyen yeniler için önemli bir endişe 1 . Yenidoğan sepsis önemli bir ABD sağlık sorunu sadeceABD'deyılda 75.000 'den fazla vaka için muhasebe olmaya devam ediyor 2 . Bu enfeksiyonları derinlemesine incelemek için, insan hastalığının yönlerini özetleyen yeni hayvan modelleri gereklidir. Biz Escherichia colikullanarak bir neonatal fare enfeksiyonu modeli kurduk , O1:K1:H73. E. coli ABD'de yenidoğan sepsisin ikinci önde gelen nedenidir, ancak sepsis ilişkili mortalite çoğunluğu sorumlu4,5. Ancak, ön dönem ve çok düşük doğum ağırlığı (VLBW) bebekler bağımsızolarak5 olarak kabul edildiğinde önde gelen nedenidir. K1 serotipi en sık invaziv kan dolaşımı enfeksiyonları ve menenjit ile ilişkilidir6,7. Şu anda, antibiyotik ve destekleyici bakım dışında başka bir tedavi seçeneği vardır. Bu arada, antibiyotik direnci oranları birçok patojenik bakteriler için artmaya devam, E. coli bazı suşları ile yaygın tedavide kullanılan antibiyotik çok sayıda dirençli8. Bu nedenle, sepsis ve ev sahibi tepki mekanizmalarını yeniler üzerinde incelemek için yöntemler üretmeye devam etmek zorunludur. Bu sonuçlar mevcut tedaviler ve enfeksiyon sonuçları üzerine geliştirmek için yardımcı olabilir.
Neonatların bağışıklık durumu yetişkinlere göre hem henotibik hem de fonksiyonel farklılıklar ile karakterizedir. Örneğin, interlökin (IL)-10 ve IL-27 gibi anti-inflamatuar ve düzenleyici sitokinlerin yüksek seviyeleri, kordon kanı kaynaklı makrofajlar tarafından üretildiği gösterilmiştir ve9,10,11. Bu, yenidoğan hücrelerinden erişkin retlere göre sıklıkla bildirilen IFN-α, IFN-on, IL-12 ve TNF-α düzeylerinin daha düşük olması ile tutarlıdır10. Ayrıca, neonatal bağışıklık sistemi yetişkinlere göre bir Th2 ve düzenleyici T hücre yanıtı doğru çarpık12. Nötrofil, T hücreleri, B hücreleri, NK hücreleri ve monositlerin yüksek sayıda da neonatlarda mevcuttur, ancak önemli fonksiyonel bozukluklar ile. Bu hücre yüzey belirteçleri ve immaturity13,14,15öneririz antijen sunumu ifade kusurları içerir. Ayrıca, neonatal nötrofiller kemotaktik faktörlere göç etme kabiliyetlerinde önemli ölçüde eksiktir16. Miyeloid türetilmiş baskılayıcı hücreler (MKHK) da neonatlarda yüksek seviyelerde bulunur ve son zamanlarda IL-2711kaynağı olarak gösterilmiştir. MKh'ler T hücrelerine karşı son derece bastırıcıdır17. Bu veriler, yenidoğan bağışıklığında enfeksiyona karşı duyarlılığın artmasına neden olan sınırlamaları toplu olarak göstermektedir.
Neonatal sepsis sırasında bakteriyel yükün ilerlemesini incelemek ve koruyucu konak immün yanıtlarını incelemek için yeni bir enfeksiyon modeli geliştirdik. Yaşamın 3-4 gününde yenidoğan farelerin intraperitoneal uzaya veya kuyruk damarına enjekte etmesi zordur. Bizim modelinde, gün 3 veya 4 yavru skapular bölgeye bakteriyel inoculum veya PBS subkutan olarak uygulanır. Sistemik bir enfeksiyon gelişir ve lüminesanE E. coli O1:K1:H7 kullanarak, periferik dokularda yayılan bakteriyel yükü takip etmek için tek tek yenidoğan farelerini boylamsal olarak görüntüleyebiliriz. Bu, intravital görüntülemeyi kullanarak sepsis sırasında bakterilerin yayılmasının kinetiklerini anlamak için kullanılan ilk rapor edilen modeldir3.
Burada, yenidoğan farelerde septik E. coli enfeksiyonları neden bir protokol tarif3. Bakteriyel inokülün enjeksiyoniçin nasıl hazırlanacağını ve patolojinin değerlendirilmesi için dokunun nasıl hasat edilebildiğini, gen ekspresyonu analizi ile inflamatuar belirteçlerin ölçülmesini ve bakteri yükünün numaralandırmasını anlatıyoruz. Buna ek olarak, enfekte yenidoğan yenidoğanların intravital görüntüleme ve neonatal bağışıklık hücreleri tarafından bakteri öldürme niceliksel için lüminesan E. coli kullanımı da açıklanmıştır. Bu protokoller aynı zamanda yeniniler diğer önemli bakteriyel enfeksiyonları incelemek için adapte edilebilir. Burada sunulan veriler, translatable neonatal sepsis modelinde enfeksiyon dinamiklerini anlamak için genel bir yeni yaklaşımı temsil etmektedir.
Protokol
Tüm prosedürler West Virginia Kurumsal Hayvan Bakım ve Kullanım Komiteleri tarafından onaylanmış ve Ulusal Araştırma Konseyi18tarafından Laboratuvar Hayvanları Bakımı ve Kullanımı Kılavuzu'nun tavsiyeleri doğrultusunda yürütülmüştür.
1. Bakteriyel Inokül Hazırlanması
- Streak bir Tryptic soya agar (TSA) e. coli O1:K1:H7-lux bir dondurucu stok tek bir koloni izolasyon için bir aşılama döngü ile plaka bu stiferase ifade eder ve kanamisin direncitaşır 3. Bir gecede 37 °C'de kuluçkaya yatırın.
- Ertesi gün Luria suyu (LB) oda sıcaklığına (25 °C) bir biyogüvenlik kabininde gelmesine izin verin.
- Bir biyogüvenlik kabine kaputu altında, çizgili plaka tek bir koloni belirlemek ve kanamisin (30 μg / mL) ile birlikte LB 3 mL aşılamak. Gece boyunca 37 °C'de sallayarak (220 rpm) kuluçkaya yatırın. Bu başlangıç kültürüdür.
- Başlangıç kültürünü 1:100'ü biyogüvenlik dolabı kaputu altında taze 3 mL LB'ye seyreltin ve 37 °C'de 2-3 saat sallayarak (220 rpm) kuvöze geri döndürün. Bu stok kültürüdür.
- Bir spektrofotometre kullanarak 600 nm'de hem boş hem de stok kültürünün optik yoğunluğunu (OD) okuyun. 96 iyi düz alt töz plakabir kuyu içine LB (bakteri içeren) 100 μL ekleyin; Bu boş. Daha sonra stok kültüründen ayrı bir kuyuya 100 μL ekleyin. İki ek yineleme için tekrarlayın. Emicilik bir plaka okuyucu kullanılarak okunur.
- Stok kültürü emici değeri (OD değeri) boş emici çıkarın ve bulaşıcı doz hazırlanması için stok kültüründe bakteri yoğunluğu yaklaşık belirlemek için daha önce oluşturulmuş ve doğrulanmış büyüme eğrisi karşılaştırın.
- Araştırma sorusuna bağlı olarak hedef inoküller oluşturun. Bu çalışmada fare başına 2 x 106 (düşük) ve 7 x 106 (yüksek) koloni oluşturan üniteler (CPU) hedef inokül kullanılmıştır.
- Stok tüpünden (VS)gerekli bakteri hacmini elde etmek için fare başına hedef dozu (DozT)stok kültüründeki (Stok) bakterilerin tahmini konsantrasyonuna bölün.
- VS'i, enfeksiyon için gerekli toplam bakteri miktarı artı 5-10 ek doz için yeterli 5-10 ekstra ile birlikte enfekte edilmesi gereken fare sayısı (NM)ile çarpın. Stok tüpünden bu hacmi çıkarın ve yeni bir santrifüj tüpüne ekleyin.
- Aşağıdaki denklemi kullanın:
DozT/Stok = VS x NM = stok tüpünden çıkarılacak bakterilerin toplam hacmi (VT).
- Bakterileri 2.000 x g'de 5 dakika 4 °C'de santrifüj edin ve fare başına 50 μL PBS (pH 7.2-7.6) halinde bakteri peletini yeniden askıya alın (örneğin, her doz 2 x 106 bakterinin 10 dozu için, 2 x 107 bakterinin peleti 500 μL PBS'de yeniden askıya alınır). Yine, gerekli olandan daha fazla inokül hazırlamak için tavsiye edilir. Yalnızca kontrol aşıları için eşit hacimli PBS hazırlayın. Enfeksiyon kadar buz üzerinde enfeksiyöz inoculum ve PBS kontrolü korumak.
- 96 iyi plastik alt seyreltme plakası ile PBS içine yedi on kat seri seyreltme gerçekleştirin ve uygulanan bakterilerin gerçek miktarını doğrulamak için kanamisin (30 μg/mL) ile desteklenen quadrant TSA plakaları üzerine çoğaltılabilir seyreltme lerin plaka 25 μL. Numaralandırmadan önce koloni oluşumu için bir gecede 37 °C'de kuluçkaya yatırın.
2. Hayvan tanımlama
- Çöplerin yaşla eşleşen yavrular için senkronize edilebilmesi için yeterli sayıda üreme çifti düzenleyin. 1 günlük ± yaş değişkenliği kabul edilebilir.
- Gebe bir C57BL/6 dişi fareyi tanımlayın ve yaşı doğru bir şekilde belirlemek için planlanan deneyden önce çöpün doğumuna yönelik monitörü belirleyin.
- Kontrol ve enfekte 3- veya 4 günlük yavrular ayırt etmek için, sadece kontrol yavrularının kuyruklarının uçlarını koparmak için küçük, ince uçlu, iris makas kullanın. Enfekte yavrukuyruk parçacıkları almazlar. Kuyruğu kesmeden önce, % 70 etanol batırılmış bir pamuk topu ile cildi dezenfekte. Gerektiğinde bir pamuk topu veya gazlı bez ile kuyruk sonuna basınç uygulayın.
NOT: Bu işlem biyogüvenlik kabini başlığı altında gerçekleştirilir. Bir inç yaklaşık 1/8 bir kuyruk parçası yeterlidir. - Kontrol ve enfekte gruplar içinde yavru tanımlamak için, yavruların kuyrukları dövme için 28 G x 1'' kalıcı iğne ile 1 mL insülin şırınga kullanın. Dövme önce, bir pamuk topu% 70 etanol batırılmış ile cildi dezenfekte. Bu işlem biyogüvenlik kabini başlığı altında gerçekleştirilir.
- Kuyruk dövme için, iğne ucuna hayvan dövme mürektürü uygulayın. Sonra, dikkatle bir eliyle yavru dizginlemek, kuyrukları tamamen maruz. İğneyi yavaşça derinin altına yerleştirin, yüzeysel bir derinlik seviyesini korurken ve küçük bir işaretleme veya nokta oluşturulana kadar iğneyi deriyle birkaç milimetre paralel hareket ettirin. Derinin altından fazla mürekleden kaçınmak için iğneyi yavaşça derinin altından çıkarmadan önce birkaç saniye bekleyin.
- Gerektiğinde bir pamuk topu veya gazlı bez ile yaraya basınç uygulayın. % 70 etanol ile cilt yüzeyinde aşırı dövme mürekkesi çıkarın.
- Enfekte ve kontrol gruplarında sonraki fareler ile bu işlemi tekrarlayın, her ardışık yavru dövmeli ek bir nokta eklerken (örneğin, yavru 1 kuyruk 1 nokta olacak, yavru 2 kuyruk, vb iki nokta olacak).
NOT: Ek bir tanımlama katmanı için, kontrol ve enfekte gruplar için hayvan dövme mürekkesinin ayrı renkleri kullanılması önerilir.
3. Subscapular aşılama
NOT: Bu çalışma için her deney için belirlenen düşük doz ve yüksek doz grubu ile 2 deney yapılmıştır. İlk deneyde, 7 yavruya düşük doz inokül verildi (kontrol olarak 4 yavru kullanıldı) ve ayrı bir çöpten 5 yavruya yüksek doz verildi (3 yavru kontrol olarak kullanıldı). Deney 1'deki yavrular sadece 24 saat zaman dilimi için veri sağladılar. İkinci deneyde 8 yavruya düşük doz inokül (2 yavru kontrol olarak kullanıldı) ve 6 yavruya yüksek doz inokül verildi (2 yavru kontrol olarak kullanıldı). Deney 2'deki yavrular 0, 10 ve 24 saat zaman noktaları için veri sağladı.
- Yaş maç yavruları 1 gün ≤. Ya düşük doz veya yüksek doz çöp olarak her çöp atayın. Bir çöp içinde rasgele bir kontrol veya enfekte yavru olarak yavru atamak.
- Doğum sonrası 3 veya 4 gün, E. coli-lux veya PBS kontrolü ile aşılamadan önce tüm yavruların rekor ağırlıkları. Bu süre zarfında barajı yavrulardan ayırın ve enfeksiyon sırasında hareket etmediklerinden emin olun.
- Bir insülin iğnesi kullanarak bir biyogüvenlik kabine içinde, PBS veya E. coli-lux inoculum ya aspire. Bu çalışmada fare başına 2 x 106 ve 7 x 106 CPU'lar kullanılmıştır. Subscapular enjeksiyon yoluyla uygulama kadar buz üzerinde hem bulaşıcı inoculum ve PBS tutun.
- Biyogüvenlik kabine kaputunda temiz bir yüzeye yenidoğan yerleştirin ve yavru scruff gibi boyun ense de deri yükseltmek.
- Şimdi deri ve hayvanın kas arasında oluşturulan alanda, iğne eklemek, yukarı yas, sadece deri altında ve enjekte 50 μL PBS veya E. coli-lux. Aynı anda enjeksiyon geri akışını önlemek için cildin sıkıştırılmış kısmını bırakın.
- İğneyi yavaşça ve özenle çıkarın. Enjeksiyonlar bittikten sonra yavruları barajlarla geri yerleştirin.
NOT: Gelişimdeki anatomik evreleri nedeniyle 3-4. Böylece bu çalışma için subscapular enfeksiyon rotası infaz kolaylığı nedeniyle seçilmiştir.
4. Hastalık ve uç nokta kriterlerinin değerlendirilmesi
- Enfeksiyon süresi boyunca günde iki kez yavruizlemek. Görünümdeki anormalliklere dikkat edin.
- Morbiditenin objektif bir ölçümü olarak ağırlıkları kaydedin.
- Ağırlık değişikliklerine ek olarak, dorsal tarafta yenidoğan yerleştirerek kendilerini düzeltmek için yavru yeteneğini test edin. Hasta hayvanlar ventral tarafa ve ayaklara dönemeyecek ya da bu eylemi zorlukla tamamlayacaklar.
- Hayvanları uç nokta kriterlerine yakın işaretlemek için aşağıdakileri kontrol edin: normal vücut ağırlığının %85'inden azı; hareket ve kendilerini düzeltmek için yetersizlik azalması; pembenin aksine cildin renk değişikliği ve daha gri veya şeffaf bir görünüm; dokunmak için serin hissetmek, vücut ısısının azaldığını ve yanlarda hemorajik morlukların göstergesi, aynı zamanda ileri de hastalığın göstergesidir.
NOT: Yeniler iki gün içinde kilo almayı başaramamışsa ve 4.4 adımdaki açıklamalardan herhangi birini sığdırmışsa, uç nokta ölçütlerini karşılamış olurlar. Yüksek doz alan yavrular genellikle 24 saat uç nokta kriterlerini karşılarlar. Kontrol ve deney grupları arasında karşılaştırmalı analiz için düşük ve yüksek doz çöp içinde kontrol yavruları aynı zamanda ötenazi olacaktır. Aşağıdaki ötenazi bölümüne gidin.
5. Bakteriyel yükün in vivo görüntüleme
- Görüntüleme ve sonraki analizler için bir microCT görüntüleyici ve yazılım kullanın.
NOT: Pup cilt rengi görüntüleme kalitesini etkilemez. - Kafesi E. coli-lux-enfekteneonatal fareler ve baraj ile BSL-2 seviye laminar akış kaputuna yerleştirin. Farelerin görüntülenerek çıkarılmasını ve kaputun içindeki saydam bir isoflurane haznesine yerleştirin. Gerekli isofluran miktarını ölçmek için enfekte olmayan kontroller ile başlamak için tavsiye edilir.
- Yazılımı microCT'ye bağlı bilgisayarda açın. Sistemi başlatmayı ve CCD sıcaklığının -90 °C'de kilitlenmesini bekleyin.
- Izofluran buharlaştırıcıyı açın ve kadranı %5 izofluran akışına ayarlayın. Fareleri bu isofluran karışımıyla hareket edene kadar 20-30 s'lik odada tutun; bazı fareler için daha uzun veya daha kısa anestezi maruz kalma süreleri gerekebilir. Fareler hareket etmeyi bıraktıktan sonra yeterince anestezi yedirilirler ve görüntülenebilirler.
- Fareleri mikroCT görüntüleme odasına taşıyın ve burunlar burun konilerine dik bakacak şekilde, eğilimli pozisyondaki görüntüleme kutusuna yerleştirin. Herhangi bir hareketi sınırlamak için görüntüleme kutusunda ki ayakları nazikçe dizginlemek için diş balmumu kullanın. Bir seferde en fazla 4 yenidoğan fare görüntülenebilir.
- Görüntüleme sırasında fareleri anestezi altında tutmak için izofluran buharlaştırıcıyı %2-4 akışa çevirin. MikroCT görüntüleme odasının kapısını kapatın. Birkaç saniye sonra fareleri kontrol et. Eğer hareket etmeye başlarlarsa, bir pamuk topun isoflurane içinde bekletin ve hayvanın burnuna tutun ve 5 saniye boyunca anestezi için hareket ettirin. Görüntüleme sırasında hayvanların yanında pamuk topu tutun. Anestezi ve fareler iyoklamak için dikkatli olun.
- Yazılımı kullanarak, görüntüleme için Luminescent seçeneğini seçin. Blok için ayarlı bir uyarma filtresi ve 500 nm, 520 nm, 560 nm, 580 nm, 600 nm ve 620 nm'yi açmaküzere ayarlanan emisyon filtresikullanın. Parlaklık için ayarlanmış yedi toplam emisyon filtresi olacaktır.
- Fareleri her zaman noktasında (0, 10 ve 24 saat enfeksiyon sonrası [hpi]) görüntüleyin ve tüm görüntüleri her zaman noktası için bir klasöre kaydedin. Yavruları barajla birlikte kafese geri getirin ve tüm yavruların anesteziden kurtulup iyileşmediğini kontrol edin.
- 2B görüntüleri analiz etmek için, yazılımdaki görüntüleri açın. Birimleri Radyant (foton)olarak değiştirin; bu toplam akı (fotonlar / saniye)dönüşecektir.
- Aynı anda birden fazla emisyon filtresi içeren yalnızca bir görüntü kümesini analiz edin. Her görüntü kümesinden, her görüntünün sağ alt köşesinde bulunan minimum ve maksimum parlaklık değerlerine dikkat edin (örneğin, 7 emisyon filtresi varsa, 7 görüntü ve 7 minimum ve maksimum değer olacaktır). Karşılaştırılacak olan her görüntü kümesi için tekrarlayın.
- Tüm görüntüler için değerleri ve Parlaklığı kapsayacak bir ölçek belirlemek için, her görüntü kümesi için en düşük minimum değeri ve en yüksek en yüksek değeri bulun. Bu çalışma için, Açık filtre görüntüleri temsili olarak kullanılmıştır.
- Ölçeği değiştirmek için seçtiğiniz görüntüyü vurgulayın ve açın. AraçPaleti'nde, Resim Ayar sekmesine tıklayın ve Renk Ölçeğini önceden tanımlanan en düşük en küçük ve en yüksek maksimum değerlerle değiştirin. Her görüntüyü TIFF olarak kaydedin. Doğru ölçeğin görüntülendiğinden emin olmak için her zaman noktasını bu şekilde ayrı ayrı analiz edin.
- Her fare için toplam akısı (fare başına parlak sinyal miktarı) ölçmek için, daha önce adım 5.9-5.10'da açıklandığı gibi bir görüntü açın. Araç Paleti'ndeki YG Araçları sekmesini açın ve daire aracını seçin. Bir lüminesans alanını analiz ediyorsanız 1 daire seçin.
- YG'yi parlaklık alanında Yer Kaplamasına taşıyın. Gerekirse YG boyutunu ayarlayın.
NOT: Ayarlama gerekiyorsa, tutarlılığı korumak için diğer görüntülerdeki RO'ları karşılaştırın. Ölçü ROI'larınıseçin. YG Ölçümleri penceresi Toplam Akı (p/s) ,Ortalama Parlaklık (p/s/cm2/sr), Standart Parlaklık Sapma, Minimum Parlaklık ve Maksimum Parlaklıkgörüntüleme açılacaktır. - Her görüntü kümesi için toplam akı ölçümlerini kaydedin. Bu sayı, 2B görüntülerde faredeki parlaklığın niceliksel miktarıdır.
- 3B yeniden mikroCT görüntüleri yapmak için, Araç Paleti'ndeki DLIT 3D Yeniden Yapılandırma panelini açın ve Analiz sekmesinin altına dahil edilecek tüm dalga boylarını kontrol edin.
6. Ötenazi
- Nekropsi ve uygun downstream uygulamaları için ilgi doku/organlar için tüpler hazırlamak ve etiket.
- Biyogüvenlik kabinindeki yenileri barajdan ayırın.
- Veteriner sınıfı isoflurane bir pamuk topu ıslatın ve şeffaf bir çevreleme odası içinde yerleştirin.
- Kan topluyorsanız, bir ucu ile bir P200 mikropipet hazırlayın ve bir antikoagülan olarak 5 mM EDTA 10 μL ile 1.5 mL tüp var. 50-200 μL kan hacmi beklenmektedir.
- Odaya bir yenidoğan yerleştirin ve yavrusu hareketsiz hale gelene kadar izleyin.
- Hızlı bir şekilde, yenidoğan çıkarın ve makas ile decapitate. Uzun bir süre temiz hava solumak için izin verilirse, yavru bilincini geri kazanabilirsiniz. Yeniler yetişkin farelere göre akciğer kapasitesini azaltmıştır, ve bu nedenle, tek başına isofluran e göre ötanazi için yeterince derin nefes yok.
- P200 mikropipet kullanarak başın tabanında gövdeden kan toplayın. Toplanan kan miktarını en üst düzeye çıkarmak için, kafa kesme sonrasında mümkün olduğunca çabuk bu adımı gerçekleştirin. 1.9 adımda açıklandığı gibi seri seyreltme ve standart plaka sayma ile kandaki bakterileri saymak.
- Doku örneklerinin eksizyonu öncesinde% 70 etanol ile tüm yenidoğan sterilize.
7. Doku hasadı
- Bir biyogüvenlik kabini içinde, kontaminasyonu önlemek için% 70 etanol ile yenidoğan douse. Hayvanı sağ tarafına yatırın.
- Forceps kullanarak, karın ve arka sol bacak arasında bir noktada cilt kavramak ve ince uçlu cerrahi makas ile bir kesi yapmak. Geri doğru yukarı doğru hareket eden deri kesmeye devam edin. Tüm dalak açığa çıkana kadar ilerleyin.
- Dalağını kavramak ve karından çıkarmak için, bağ dokusunu kesmek için makas kullanarak forceps kullanın. Dalağını aşağı akım uygulamasına uygun çözeltiye yerleştirin.
- Akciğerleri elde etmek için, tamamen göğüs derisini soyma.
- Göğüs kafesinin tabanına dikey olarak tutulan makaslarla girerek, göğüs kafesi bölünene kadar yukarı doğru kesin.
- Sağ ve sol akciğerleri tek tek kavramak ve göğüs boşluğundan çıkarmak için forceps kullanın. Makasla keserek kalbi akciğer dokusundan çıkarın.
- Akciğeri aşağı akım uygulamasına uygun çözeltiye yerleştirin. RNA izolasyonu için 500 μL guanidin tiyosiyanat/fenol (GTCP) kullanın. Histopatoloji için 5 mL %10 nötr tamponlu formalin kullanın.
8. Gen ekspresyonu için akciğer dokusundan RNA izolasyonu
- Mikrocentrifuge'u 4 °C'ye kadar önceden soğutun.
- GTCP'deki akciğer dokusunu makasla doğrama. Sonra, bir pille çalışan homogenizer ile doku homojenize. Çözüm mümkün olduğunca düzgün olana kadar devam edin. 3-5 dk oda sıcaklığında kuluçka.
- Filtrelenmiş pipet uçlarını kullanarak 100 μL kloroform ekleyin. Tüpü 15 dakika ters çevirin ve oda sıcaklığında 3-5 dk kuluçkaya yatırın.
- 12.000 x g15 dk için santrifüj .
- Dönüş sırasında 1,5 mL'lik tüpler ve %70 etanol 500°L'lik tüpler hazırlayın. RNA izolasyon kitindeki sütunları ve toplama tüplerini birleştirin ve etiketlayın.
- Santrifüj sırasında oluşan interfaz tabakasını rahatsız etmeden üst, sulu katmanı dikkatlice çıkarın. % 70 etanol içeren tüpler de sulu tabaka yerleştirin.
- Etanol ve lysate karışımını toplama tüpündeki kolona taşıyın.
- Bu noktadan itibaren, RNA'nın son elution kadar RNA izolasyon kiti ticari ürün protokolü izleyin.
- Saflık ve miktar için RNA analiz edin. Hemen kullanın veya daha fazla kullanıma kadar -80 °C'de saklayın.
9. cDNA sentezi
- Etiket PCR tüpler ve bir kenara koyun.
- Her numune için cDNA reaksiyon karışımına 1 μg RNA ekleyin.
- CDNA protokolünde açıklandığı gibi reaktifleri ve şablonu PCR tüpüne ekleyin. Enzimi karışıma son olarak ekleyin.
- PCR tüplerini aşağıdaki çalışma ayarlarına sahip bir termocycler yerleştirin: 25 °C'de 5 dk, 42 °C'de 40 dk, 85 °C'de 15 dk ve 4 °C son tutun.
- PCR tüplerini termocycler'dan çıkarın ve bir sonraki kullanıma kadar hemen kullanın veya -20 °C'de saklayın.
10. Gerçek zamanlı nicel PCR (qPCR) döngüsü
- Analiz edilecek genlerin her biri için bir reaksiyon karışımı kokteyl hazırlayın. Her 15 μL PCR reaksiyonu 7,5 μL 2x reaktif karışımı, 0,75 μL 20X 5'-FAM etiketli gen-spesifik astar/prob ve 3,75°L nükleaz içermeyen su gerektirir. Amplicons genellikle 60-120 bp arasında değişmektedir.
- Uygun kuyulara her deney grubu için 3 μL cDNA şablonu ekleyin.
- Uygun kuyulara genlere özgü reaksiyon karışımı kokteylin 12 μL'sini ekleyin.
- Kuyularda oluşmuş olabilecek kabarcıkları gidermek için plakayı 1000 x g'da 1 dk optik yapışkan film ve santrifüj ile kaplayın.
- PCR plakayı gerçek zamanlı PCR termocycler'a yerleştirin.
- Çalışma yöntemini şu şekilde ayarlayın: 95 °C'de 3 dk, 15 s için 95 °C'de 40 devir ve 1 dk için 60 °C.
- 2-ΔΔCt formülü ve sayıların günlük2 dönüşümlerini kullanarak enfekte olmayan kontrol örneklerine göre enfekte örneklerden alınan ilgi genini normalleştirerek verileri analiz edin.
11. Akciğer histopatolojisi
- Yukarıda açıklandığı gibi yenidoğan yavrusu akciğerleri çıkarın.
- Dokuya çözelti oranı 3-7 gün boyunca yaklaşık 20:1 olacak şekilde% 10 nötr tamponlu formalin hacminde doku yerleştirin.
- Parafin katıştırma, kesit ve hematoksilin ve eozin (H&E) boyama için uygun bir histoloji hizmeti ile koordine olun. Bu çalışma için, Batı Virginia Üniversitesi Histopatoloji Core kullanılmıştır. Alternatif olarak, daha önce açıklanan protokolleriizleyin 19.
12. In vitro bakteriyel öldürme tetki
- Yukarıda açıklandığı gibi enfekte olmayan yenidoğan yavrusundan dalağını çıkarın ve steril 60 mm Petri kabının içine 40 μm'lik bir naylon sepete yerleştirin. Bunu ve havuz dalaklarını bir tüp halinde tekrarlayın, hasat edilip homojenize edin.
- %10 FBS ile desteklenen 5 mL PBS ekleyin.
- Tek bir hücre süspansiyonu oluşturulana kadar steril 3 mL şırınga pistonu kullanarak dokuyu ayrıştırın.
- Naylon sepetin dışında tek hücreli süspansiyonu toplayın, 15 mL'lik bir santrifüj tüpüne ve 5 dk için 350 x g'da pelet hücrelerine aktarın.
- Kırmızı kan hücreli lisis tampon hücreleri askıya (7-8 dalak için 2 mL) ve eritrositleri ortadan kaldırmak için oda sıcaklığında 5 dakika bekletin.
- Yukarıdaki gibi PBS ve pelet ile splenositleri yıkayın.
- Beklenen hücre verime göre 0.25 mL PBS'deki splenositleri %0.5 BSA ve 2 mM EDTA ile askıya alın.
- Hemositmetre veya diğer uygun bir uygulama kullanarak splenositleri sayın.
- Üretici protokolüne göre ly6B.2+ (granülositlerin/inflamatuar monositlerin miyeloid popülasyonu) hücreleri immünomanyetik boncuklarla izole edin.
- %10 FBS, 2 mM glutamin ve 25 mM HEPES (komple orta) içeren 0,1 mL DMEM hacminde siyah veya beyaz 96-kuyu plakasında iyi başına 1 x 105 hücre yoğunluğunda 1x 10 + hücreler.
- Bölüm 1'de açıklandığı gibi biyolüminesans E. coli'yi hesaplayın ve bakteriyel inokülü istenilen enfeksiyon çokluğunda (MOI) 0.1 mL'lik son hacimde hazırlayın. Bu en iyi toplu olarak ortak bir MOI tüm kuyular için gerekli olan yaparak yapılır.
- Kontrol olarak 0,1 mL bakteriyel inokül veya tam orta tek başına ekleyin. Çok kuyulu plakayı 37 °C'de ve %5 CO2'yi 1 saat için kuluçkaya yatırın.
- Ortamı bir pipetle hafifçe sökerek ve yeni bir pipet ucuyla taze ortam ekleyerek, 0,2 mL'lik gentamisin (100 μg/mL) içeren taze tam ortamla değiştirin. Ek bir 2 saat için kuluçka için kültür dönün.
- 3 saat sonrası enfeksiyon, bir tabak okuyucu kullanarak alttan kapaklı kültür plakaher kuyulu parlaklık ölçmek ve daha sonra kuluçka için kültür dönmek.
- İstenilen diğer zaman noktalarında lüminesans ölçümlerini tekrarlayın.
Sonuçlar
Bu protokol neonatal farelerde bakteriyel sepsise neden oldu ve hastalığın seyrini incelemek için uzunlamasına intravital görüntüleme, kandaki bakterilerin numaralandırılması, patolojinin histolojik değerlendirmeleri ve inflamatuar sitokin ekspresyon profilleri kullandık. Zaman içinde hem düşük (~2 x 106 CPU) hem de yüksek (~7 x 106 CPU) inokülleri ile enfekte olan yenidoğan yavrularında morbidite belirtileri gözlendi. Daha fazla inokül alan yavrular, hareket kabiliyetinin azalması, duruşlarının düzeltilememesi ve enfeksiyon sonrası 24 saat (hpi) ile dik pozisyonunu koruyabilme yeteneğinin bozulması gibi daha belirgin sıkıntı belirtileri gösterdiler. Ancak bazı yavrular diğerlerinden daha kötü göründükçe bir dizi morbidite vardı. Enfeksiyondan hemen sonra, bir düşük doz hayvan bazal oluşturmak için bir görüntüleme oturumu sırasında isoflurane maruz kalma nedeniyle öldü. 24 hpi ile, altı yüksek doz hayvanların ikisi sistemik enfeksiyona yenik düştü (%33.3 mortalite). Yüksek veya düşük doz inokül alan enfekte yavrular 24 hpi'deki kontrol çöplerinden önemli ölçüde daha az tartılır(Şekil 1A,B). Yüksek inokül alan tüm yavrular 24 hpi uç nokta kriterlerini karşıladı. Bu nedenle, bu gruptaki tüm enfekte yavrular görüntüleme sonrasında ötenazi yapıldı. Kandaki bakteriler, alt inokül alan farelerin bir alt kümesi için numaralandırılmış, ve hepsi ötenazi olduğundan daha yüksek inokül alan tüm hayvanlar için. Benzer şekilde yapılan iki deneyin sonuçları, hayvanların çoğunun 24 hpi'de kanda yüksek bakteri düzeylerine (CPU/mL) sahip olmasına, bazı hayvanların kanda tespit edilebilen bakterilere sahip olmadığını göstermektedir(Şekil 1C). İkincisi bu zaman diliminde enfeksiyonu temizlediklerini gösteriyor. Beklendiği gibi, yüksek inokül alınan yavrular düşük doz inokül(Şekil 1C)alınan yavrular göre 24 hpi de büyüklük daha CUK / mL yaklaşık üç sipariş vardı .
Parlak bakterilerin canlı hayvan görüntülemesi bakterilerin yayılmasını ve yenidoğan yavrularında zamanla 10 ve 24 hpi'de büyümeyi doğrulamıştır(Şekil 2 ve Şekil 3). Ayrıca, mikroCT ile intravital görüntüleme kullanarak, beyin(Şekil 2B),akciğerler (Şekil 2B, Şekil 3A,B), ve diğer periferik dokular da dahil olmak üzere enfeksiyon foci tespit başardık (Şekil 2B). Bazı yüksek enfekte farelerin akciğerleri, parlak bakteriyel sinyale eş lokalize inflamatuar konsolidasyon ile uyumlu opak bölgeler gösterdi(Şekil 3A). Bu enfekte olmayan eksüda bölgeleri enfekte olmayan kontrol akciğerlerinde bulunmaz(Şekil 3A). Enfekte yavruların akciğerlerinde belirgin inflamatuar sitokin yanıtının daha fazla kanıt IL-1β, IL-6 ve TNF-α gen ekspresyonu analizi ile gösterilmiştir. Hem düşük hem de yüksek inokül gruplarında her üç sitokinde kontrollere göre ekspresyonda anlamlı bir artış gözlendi(Şekil 4A). Akciğerhistopatolojisi de kontrol ve enfekte yavru 24 hpi incelendi. Benzer inflamatuar sitokin profillerine rağmen, patolojide ilerleyici bir artış genellikle alt ten yüksek inoküle doğru gözlendi. Enfekte olmayan kontrollerden elde edilen dokuile karşılaştırıldığında, enfekte yavruların akciğerlerinde belirgin inflamatuar değişiklikler, alveoler duvarın kalınlaşması, alveoler kanamanın artması ve inflamatuar infiltrasyon(Şekil 4B)gösterilmiştir. En ağır enfeksiyonlarda, akciğer tıkanıklığı ve kanama alanları açık hava alanında büyük bir azalmaya katkıda bulunmuştur(Şekil 4B). Bu sonuçlar, erken başlangıçlı neonatal sepsis modelimizde, parlak bakterilerin yayılmasının zaman içinde subskapular aşılama bölgesinden önemli enfeksiyon odaklarına kadar takip edilebilmiş ve ciddi enfekte hayvanlarda önemli inflamasyon ve patolojiye neden olabileceğini göstermektedir.
Monositler, makrofajlar ve nötrofiller gibi doğuştan gelen bağışıklık hücrelerinin bakteri ölümüne katkıda bulunan konak faktörleri incelemek için, bakteri lağvetini ölçmek için hassas bir in vitro tsay geliştirdik. Ly6B.2+ yenidoğan farelerin dalaklarından izole edilen hücreler, 1 saat boyunca çeşitli MOI'larda biyolüminesans E. coli ile enfekte olmuş ve hücre dışı bakterileri öldürmek için gentamisin ile tedavi edilmiştir. 3, 6, 20 ve 48 hpi'de hücre içi parlaklık çok modlu okuyucu ile ölçüldü. Beklendiği gibi, artan MOI ile, daha parlak sinyal kaydedildi 3 h(Şekil 5). Yavaş yavaş, bu sinyal, bakteriyel açıklık göstergesi kayboldu(Şekil 5). Bu tsay takviye sitokinler için münasip olduğunu, salgılanan efektörlerin nötralizasyonu, ve bakteri temizliği teşvik edebilir ve burada açıklanan neonatal sepsis modelinde sonuçları iyileştirmek için hizmet müdahaleleri incelemek için hücresel yolların farmakolojik inhibitörleri eklenmesi.

Şekil 1: Septik neonatal farelerde vücut ağırlığı ve bakteri replikasyonundaki değişiklikler.
(A,B) Bir grup içindeki tek tek fare ağırlıkları (düşük ve yüksek) çöp elekyavrularının ortalama ağırlığının yüzdesi olarak ifade edilir. Veriler ortalama yüzde ± SEM olarak sunulur. Her enfeksiyon sonrası zaman noktasında ki bireysel t-testleri, kontrol yavruları ile düşük inoculumu(p<0.0001)(A)alan kontrol yavruları ve yüksek inoculum(p=0.0031) (B) alan kontrol yavruları ve yavruları arasında 24 saat arasında anlamlı farklılıklar ortaya koymaktadır. (C) CFU/mL kanda 24 hpi log dönüştürülmüş ve ortalama ± SEM. Mann-Whitney testi düşük ve yüksek doz inoculums(p=0.0882) arasında anlamlılık eğilimi ortaya koymaktadır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: İntravital görüntüleme, yenidoğan farelerde bakterilerin zaman içinde yayıldığı gösterilmiştir.
(A) ~2 x 106 CPU'luk bir inokül le enfekte olan temsili bir yenidoğan faresi (#1) 0, 10 ve 24 hpi zamanda gösterilir. Her zaman noktası için saat başına minimum ve maksimum parlaklık değerlerine sahip kolorimetrik ölçek görüntülenir. 0 ve 10 saat fareler zaman içinde bakteri üremedeğişiklikleri göstermek için hem zaman noktası ölçeği nde hem de 24 saat ölçekte görüntülenir. (B) Aynı yenidoğan faresinin 10 ve 24 hpi'de yeniden yapılandırış mikroCT görüntüleri gösterilir. Her zaman noktası havai, transaksiyel ve koronal perspektiflerde görüntüler vardır. 24 hpi'deki transaksiyel görüntüde, düzlem periferik dokularda enfeksiyon odaklarını daha iyi görüntülemek için farenin çevresine doğru hareket etti. Beyaz oklar beyin ve böbrek gösterir 10 hpi ve böbrek ve akciğer 24 hpi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
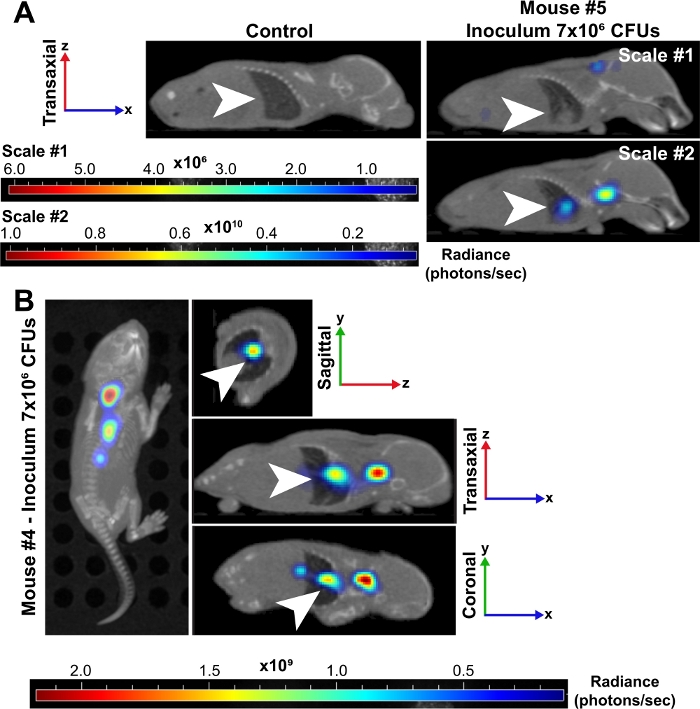
Şekil 3: Akciğerler, neonatlarda bakteriyel sepsis sırasında büyük bir enfeksiyon bölgesidir.
(A) ~7 x 106 CPU'luk bir inokül ile enfekte olan yenidoğan faresinin (#5) yeniden yapılandırılan 3D mikroCT görüntüleri, enfekte olmayan bir kontrole kıyasla 24 hpi'de gösterilir. Her iki fare de transaksiyel perspektifte görüntülenir ve akciğerler beyaz oklarla gösterilir. Enfekte fare iki parlaklık (foton/sn) ölçekler üzerine yerleştirildi. Ölçek #1 tüm 6 dalga boylarını (500, 520, 560, 580, 600, 620 nm) ve ölçek #2 sadece 500, 520 ve 560 nm dalga boylarını içerir. Bu ikinci ölçek, akciğerlerdeki bakterilerde artan bir sinyali görselleştirmemizi sağladı çünkü daha düşük dalga boyları doku tarafından daha yüksek oranda emilir ve daha güçlü bir sinyal üretir. (B) ~7 x 106 CPU'luk bir inokül ile enfekte olan yenidoğan faresinin (#4) temsili 3D yeniden mikroCT görüntüleri 24 hpi'de gösterilir. Bu zaman noktası havai, sagittal, transaxial ve koronal perspektiflerde görüntüler vardır. Beyaz oklar akciğerlerde enfeksiyon odakları olduğunu gösteriyor. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
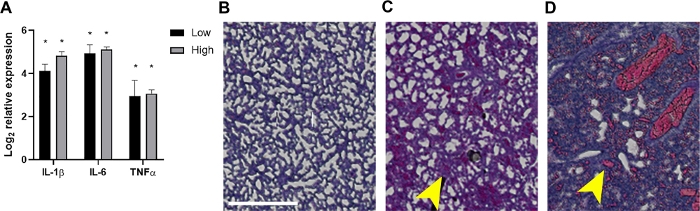
Şekil 4: Septik neonatların akciğerlerinde inflamasyon ve ilişkili histopatolojik bulgular.
24 hpi'de akciğerler ~ 2 x 106 veya 7 x 106 CPU veya enfekte olmayan kontroller alan yavrulardan hasat edildi. (A) RNA izole edildi ve IL-1β, IL-6 veya TNF-α ifadesi, formül 2-ΔΔCtkullanılarak kantitatif gerçek zamanlı PCR tarafından enfekte edilmemiş kontrollere göre belirlenir. Veriler, belirtilen her inoculum için ifade ± SEM'de dönüştürülmüş ortalama günlük2 olarak gösterilir. İstatistiksel anlamlılık, %95 güven aralığında tek tek sitokin genleri ile iç kontrol arasındaki ΔCt değerlerinin eşleşmemiş t-testleri kullanılarak belirlendi. Yıldız işaretleri p<0.01'i gösterir. (B-D) H&E lekeli akciğer dokularının histopatolojik bölümleri (20x, kırpma maskesi içine inşa edilmiş ve netlik için genişlemiş ilgi alanı) gösterilmiştir. Akciğer dokuları bir temsili enfekte olmayan kontrol (B) veya enfekte yenidoğan düşük (C) veya yüksek (D) inokül gösterilir. Sarı oklar alveoler kalınlaşma(C)veya kanama(D)gösterir. Ölçek çubuğu = 500 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
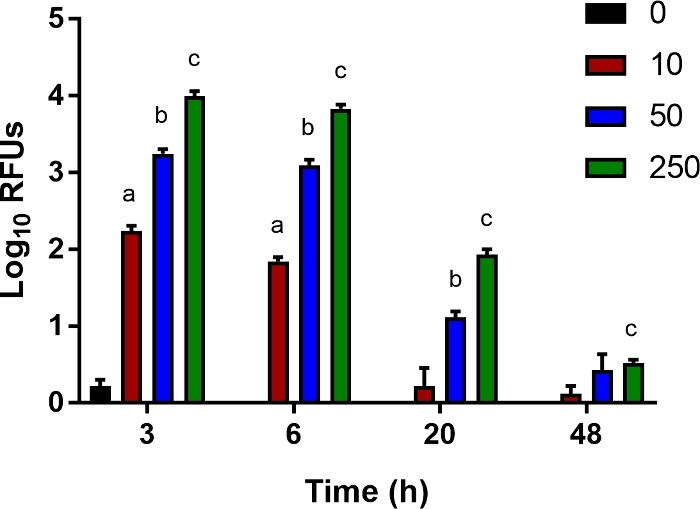
Şekil 5: Bakteriyel açıklık için bir in vitro tsay.
Ly6B.2+ hücreler enfekte olmayan kontrol neonatlarının dalaklarından izole edildi. Hücreler 96 kuyuplakasında tohumlanmış ve belirtildiği gibi 10, 50 veya 250'lik çoksayıda enfeksiyon (MOI) ile luciferase ifade eden E. coli O1:K1:H7 ile enfekte olmuşlardır. 1 saat sonra ortam, gentamisin (100 μg/mL) içeren taze ile değiştirildi. Ortalama göreli ışık birimleri (RLU) ± SE için birden fazla tek bir deney temsilcisi gösterilir. %95 güven aralığında istatistiksel anlamlılık Welch'in düzeltmesi ile eşleşmemiş t testleri kullanılarak belirlendi; yıldız işaretleri p<0.05'i gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Neonatal farelerde bakteriyel sepsisi indükleyen subskapular enfeksiyon modelimiz, bakteriyel patojenlerin uzunlamasına yayılmasını gerçek zamanlı olarak incelemek için yeni bir yöntemdir. İntravital görüntüleme, bakteriyel yayılmayı gerçek zamanlı olarak yenini keşfetme fırsatı sağlar. Bu bakteriyel yayma kinetik anlamak ve daha fazla hastalığın uygun aşamasında konak yanıt ve hasar çalışma için önemlidir. Fare yavrularına bakteriyel inokülin subskapular enjeksiyonu deri altı, subskapular enjeksiyonuygulanır. Bu enjeksiyon tekniği, bir enjeksiyon bölgesi içinde daha az hassasiyet gerektirdiğinden, kuyruk damarı ve intraperitoneal enfeksiyonlar gibi yaygın olarak kullanılan diğer alternatiflere göre daha basittir. Bu yavruküçük boyutu göz önüne alındığında önemlidir. İntravital görüntüleme, hayvankurban gerek kalmadan zaman içinde periferik dokular ve merkezi sinir sistemi içine bakteriyel proliferasyon ve yayma uzunlamasına bir değerlendirme sağlar. Benzer görüntüleme yaklaşımları ve teknolojileri kanser biyolojisi ve metastaz çalışmaları için kullanılmıştır20,21. Ayrıca, başka bir çalışmada neonatal sıçanlarda E. coli enfeksiyonu sırasında biyolüminesans görüntüleme kullanımı gösterdiiken 22, Burada, biz neonatal fareler için yaklaşım uyguladık, bizim metodoloji ürinen sepsis sırasında bakteriyel kinetik değerlendirilmesi sağlar nerede. Bakterilerin görselleştirilmesi, hayvanın içindeki bakterilerden (örn. bakteriyel luciferase aktivitesi) çeşitli dalga boylarında biyolüminesans ışığın salınımına dayanır. Biyolüminesans daha sonra soğutulmuş şarjlı bir cihaz (CCD) kamera ile görselleştirilir. Elde edilen görselleştirilmiş biyolüminesans daha sonra bir hayvan içinde bakterilerin hem mekansal hem de zamansal bağımlı etkilerini gösteren bir 3D görüntü içine yeniden inşa edilebilir. Veri toplama ek, daha nüanslı bir tabaka için, kuyruk dövme ile başarılı hayvan tanımlama zaman içinde bireysel yavru tekrarlanan önlemler değerlendirme ve belirli bir deneysel grup içinde olası aykırı belirlenmesi için izin verir.
Açıklanan modelin en başarılı uygulaması bakteriyel inokül hazırlanmasında doğruluk gerektirir. Burada, hedef ve gerçek inokül arasındaki değişimi azaltan önceden belirlenmiş ve doğrulanmış E. coli büyüme eğrisi kullanarak bakteri hazırlığı için optimize edilmiş bir yöntemi tanımlıyoruz. Bu amaçlanan bir inokül de deneysel tekrarlanabilirlik sağlar. Modelimize iki inokülün dahil edilmesinde kan CPU'larında doza bağlı sonuçlar, mortalite ve akciğer patolojisi saptandi. Ancak, hastalığın yörüngesinin bazı yönleri doza bağlı değildi. Enfekte hayvanlarda kilo alamaması 24 hpi'deki inoküle bağlı değildi. Ayrıca akciğerde her iki inokülde enfeksiyona yanıt olarak benzer inflamatuar sitokin ekspresyonu düzeyleri gözlendi. Bu örüntörün böbrek, karaciğer, dalak ve beyin gibi bakterilerin gözlemlendiği tüm dokularda kopyalanıp çoğaltılmayacağı henüz belirlenmemiştir. Sepsise ek olarak, E. coli O1:K1:H7 yenidoğan popülasyonunda menenjit ile ilişkilidir23. Bu beyin enfeksiyonu, çevredeki bakterilerin kan beyin bariyerini istila edip delmesinde meydana gelir. Gelecekteki çalışmalar sıkı kavşak protein ekspresyonundaki değişikliklerin analizi yoluyla modelin bu yönünü araştıracak, hem de bakteriyel inoküllerin farklı aralıklarını test edecektir. İntravital görüntüleme sırasında ek bir değişiklik tekil bir pamuk topu eklenmesi içerir, isoflurane ıslatılmış, görüntüleme sırasında farelerden yaklaşık 2-3 inç uzaklıkta yerleştirilir. Yenidoğan yavrularının görüntüleme seansı sırasında bilincini yeniden kazandığı ve doğru görüntü ediniminin engellendiği önceki deneylere yanıt olarak, şimdi pamuk topunu farelere görüntüleme sırasında sürekli anestezi yapacak kadar yakına yerleştiriyoruz. Ancak, bu anestezi kurtarmak için başarısız bu kadar yakın yapılmaz önemlidir.
Çeşitli hayvan ve hastalık modellerinde farklı bakterilerin kinetik çalışmaları için esnek ve kolay uyarlanabilir olmasına rağmen, protokolümüz dikkate alınması gereken bazı sınırlamalar vardır. Göz önünde bulundurulması gereken ilk sınırlama, bulaşmanın subscapular rota iletim doğal bir rota yansıtmadığıdır. Ancak, modelimizin gelişiminde en başından beri temel amaç, insan hastalığının yönlerini taklit eden sistemik bir enfeksiyon oluşturmak için kullanılabilecek kolayca tekrarlanabilir bir teslim şekli oluşturmaktı. Bu nedenle, bu raporda, biz insan erken başlangıçlı sepsis hastalığı sendromu bir model değil, doğal iletim bir model açıklar. Neonatal sıçanlarda yaygın insan iletiminin bazı yönlerini taklit eden, alimentary kanalda E. coli enfeksiyonunun ilk kolonizasyonu ve beyin 22 dahil olmak üzere kan dolaşımı ve periferik dokulara daha sonra yayılması gibi oral doğumun yerleşik bir modeli vardır22. Witcomb ve meslektaşları tarafından kurulan model aynı zamanda biyolüminesans E. coli ve intravital görüntüleme içerir. Ayrıca, isoflurane maruziyetini en aza indirmek, hem yeniler hem de barajlar için stres düzeylerini azaltmak amacıyla tekniklerin doğruluğundan ve hassasiyetinden ödün vermeden yavrulara mümkün olan en kısa sürede enjekte etmek, kuyruk dövmesi ve kullanımı yapmak çok önemlidir. Bazı durumlarda, eğer yavrular gelişmiş insan kaynaklı ve/veya deneysel manipülasyonlar yaşarlarsa, barajlar emzirmeyi ve yavruların bakımını durdurabilir ve enfeksiyonla ilgisi olmayan sağkalımda azalmaya neden olabilir. Benzer şekilde, bir görüntüleme seansının yaklaşık 10 dakikasını aşan uzun süre isoflurana maruz kalan yavruların ölüm riski artmaktadır; bu nedenle fareleri yeterince anestezik edecek kadar isofluran sağlamak çok önemlidir, ancak onları ötenazi yeyebilecek kadar değil. Son bir dikkat noktası duyarlılık sınırıdır. Görüntüleme yazılımındakullanılan ölçekleme yöntemine göre,10'dan az 4 CPU/mL E. coli numaralandırılan dokular, tespit edilebilir aralığın en düşük ucunda ki Parlak sinyale denk geliyor 3 . Böylece, bazı dokular bakteri düşük seviyelerde kolonize olabilir ama görünür biyolüminesans olmadan görünür.
Şu anda, çoğu çalışma da intraperitoneal (yani) ve kuyruk damar enjeksiyonları gibi bakteriyel yayma yetişkin yöntemleri kullanmak yeniniler için. Pluschke ve Pelkonen i.p., kuyruk damarı ve oral enfeksiyonlar24ile yenidoğan fareler üzerinde E. coli K1 etkisini analiz . Bu çalışma, immün yetmezlikleri olan farelerin farklı genotiplerinin K1 türüne daha yatkın olduğunu göstermiştir; ancak, enfeksiyona konak bağışıklık yanıtı birçok yönü yanı sıra bakteriyel yayılma mekanizmaları ele alınmadan bırakılır. Deshmukh ve arkadaşları e. coli K1 veya K. pneumoniae ile intraperitoneally neonatal fareler enfekte ve dalak ve karaciğer CPU ölçülen 72 hpi25. Bu çalışma da antibiyotiklere farelerin ön maruz kalma dayalı enfeksiyona konak yanıt bazı yönlerini analiz etti. Ancak, aynı dokuda inflamatuar profilleme paralel olarak periferik dokuve kana zaman içinde bakteriyel yayma ayrıntılı araştırma (granülositoz dışında) ele alınmadı. Staphylococcus aureus, Staphylococcus epidermidis,Grup B Streptococcusve E. coli ile farelerde yenidoğan sepsis diğer çalışmalar enfeksiyona yanıt olarak konak bağışıklık sisteminin değişen yönlerini keşfetmek. Ancak, Bu çalışmaların hiçbiri bakteriyel yayma veya enfeksiyon foci23lokalizasyonukinetiği keşfetmek için intravital görüntüleme kullanmak ,25,26,27. Enfeksiyon ve intravital görüntüleme yöntemimiz, bakteriyel yük değerlendirmesi ve periferik dokuların inflamatuar profillemeile birleştiğinde, hem konak hem de patojenin enfeksiyon sırasındaki yönlerini kapsamlı bir şekilde incelememize olanak sağlayarak sepsis sırasında konak-patojen etkileşiminin daha hassas bir şekilde anlaşılmasını sağlar.
Biz erken başlangıçlı neonatal sepsis erken başlangıçlı neonatal sepsis grubu B streptokok, K. pneuomoniaeve Listeria monocytogenesdahil olmak üzere, yenidoğanlarda sepsis sorumlu çeşitli kullanarak anlayışımızı daha fazla bu enfeksiyon ve görüntüleme modeli kullanmak niyetindeyiz. Bu enfeksiyon modeli, yenilenlerdeki konak yanıtına paralel olarak farklı bakteriyel patojenlerin yayılmasını uzunlamasına karşılaştırmamızı sağlayacaktır. Buna ek olarak, bu model enfeksiyon sitelerine göç ve konak yanıt ve bakterilerin kontrolü üzerinde sonraki etkisi kendi göç çalışma için belirli (floresan konjuge) bağışıklık hücresi türlerinin benimsenen transferi için uyarlanabilir. Bu daha önce gösterilmiş değil şekilde erken yaşamsepsis sırasında meydana gelen konak-patojen etkileşimleri daha iyi anlamak için fırsat verir.
Açıklamalar
Yazarların ifşa etmesi gereken çıkar çatışmaları yok.
Teşekkürler
Bu çalışma Kurumsal Fonlar tarafından C.M.R.'ye destek ve.M.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 mL Insulin Syringe | Coviden | 1188128012 | Inoculum or PBS injection |
| 10% Neutral Buffered Formalin | VWR | 89370-094 | Histopathology |
| ACK Lysis Buffer | Gibco | LSA1049201 | Bacterial clearance assay |
| Animal Tattoo Ink Paste | Ketchum | KI1482039 | Animal identification |
| Animal Tattoo Ink Green Paste | Ketchum | KI1471039 | Animal identification |
| Anti-Ly-6B.2 Microbeads | Miltenyi Biotec | 130-100-781 | Cell isolation |
| Escherichia coli O1:K1:H7 | ATCC | 11775 | |
| Escherichia coli O1:K1:H7-lux (expresses luciferase) | N/A | N/A | Constructed in-house at WVU |
| E.Z.N.A. HP Total Extraction RNA Kit | Omega Bio-tek | R6812 | RNA extration |
| DPBS, 1X | Corning | 21-031-CV | |
| Difco Tryptic Soy Agar | Becton, Dickinson and Company | 236950 | Bacterial growth |
| IL-1 beta Primer/Probe (Mm00434228) | Thermo Fisher Scientific | 4331182 | Cytokine expression qPCR |
| IL-6 Primer/Probe (Mm00446190) | Thermo Fisher Scientific | 4331182 | Cytokine expression qPCR |
| iQ Supermix | Bio-Rad | 1708860 | Real-time quantitative PCR |
| iScript cDNA Synthesis Kit | Bio-Rad | 1708891 | cDNA synthesis |
| Isolation Buffer | Miltenyi Biotec | N/A | Bacterial clearance assay |
| IVIS Spectrum CT and Living Image 4.5 Software | Perkin Elmer | N/A | Intravital imaging |
| LB Broth, Lennox | Fisher BioReagents | BP1427-500 | Bacterial growth |
| EASYstrainer (Nylon Basket) | Greiner Bio-one | 542 040 | Cell strainer |
| SpectraMax iD3 | Molecular Devices | N/A | Plate reader |
| Pellet Pestle Motor | Grainger | 6HAZ6 | Tissue homogenization |
| Polypropylene Pellet Pestles | Grainger | 6HAY5 | Tissue homogenization |
| Prime Thermal Cycler | Techne | 3PRIMEBASE/02 | cDNA synthesis |
| TNF-alpha Primer/Probe (Mm00443258) | Thermo Fisher Scientific | 4331182 | Cytokine expression qPCR |
| TriReagent (GTCP) | Molecular Research Center | TR 118 | RNA extration |
Referanslar
- Qazi, S. A., Stoll, B. J. Neonatal sepsis: a major global public health challenge. Pediatr Infect Dis J. 28, 1-2 (2009).
- Simonsen, K. A., Anderson-Berry, A. L., Delair, S. F., Davies, H. D. Early-onset neonatal sepsis. Clinical Microbiology Reviews. 27 (1), 21-47 (2014).
- Seman, B. G., et al. Elevated levels of interleukin-27 in early life compromise protective immunity in a mouse model of Gram-negative neonatal sepsis. Infections and Immunity. , (2019).
- Schrag, S. J., et al. Epidemiology of Invasive Early-Onset Neonatal Sepsis, 2005 to 2014. Pediatrics. 138 (6), 20162013(2016).
- Stoll, B. J., et al. Early onset neonatal sepsis: the burden of group B Streptococcal and E. coli disease continues. Pediatrics. 127 (5), 817-826 (2011).
- Weston, E. J., et al. The burden of invasive early-onset neonatal sepsis in the United States, 2005-2008. Pediatrics and Infectious Disease Journal. 30 (11), 937-941 (2011).
- Hornik, C. P., et al. Early and late onset sepsis in very-low-birth-weight infants from a large group of neonatal intensive care units. Early Human Development. , Suppl 2 69(2012).
- Vergnano, S., Sharland, M., Kazembe, P., Mwansambo, C., Heath, P. T. Neonatal sepsis: an international perspective. Archives of Disease in Childhood: Fetal and Neonatal Edition. 90 (3), 220-224 (2005).
- Kraft, J. D., et al. Neonatal macrophages express elevated levels of interleukin-27 that oppose immune responses. Immunology. 139 (4), 484-493 (2013).
- Basha, S., Surendran, N., Pichichero, M. Immune responses in neonates. Expert Reviews of Clinical Immunology. 10 (9), 1171-1184 (2014).
- Gleave Parson, M., et al. Murine myeloid-derived suppressor cells are a source of elevated levels of interleukin-27 in early life and compromise control of bacterial infection. Immunology and Cell Biology. 97 (5), 445-446 (2018).
- Adkins, B., Leclerc, C., Marshall-Clarke, S. Neonatal adaptive immunity comes of age. Nature Reviews Immunology. 4 (7), 553-564 (2004).
- Kim, S. K., Keeney, S. E., Alpard, S. K., Schmalstieg, F. C. Comparison of L-selectin and CD11b on neutrophils of adults and neonates during the first month of life. Pediatrics Research. 53 (1), 132-136 (2003).
- Velilla, P. A., Rugeles, M. T., Chougnet, C. A. Defective antigen-presenting cell function in human neonates. Clinical Immunology. 121 (3), 251-259 (2006).
- Le Garff-Tavernier, M., et al. Human NK cells display major phenotypic and functional changes over the life span. Aging Cell. 9 (4), 527-535 (2010).
- Weinberger, B., et al. Mechanisms underlying reduced responsiveness of neonatal neutrophils to distinct chemoattractants. Journal of Leukocyte Biology. 70 (6), 969-976 (2001).
- Gabrilovich, D. I., Nagaraj, S. Myeloid-derived suppressor cells as regulators of the immune system. Nature Reviewss Immunology. 9 (3), 162-174 (2009).
- National Research Council. Guide for the care and use of laboratory animals, 8th ed. , National Academies Press. Washington, DC. (2011).
- Tucker, D. K., Foley, J. F., Bouknight, S. A., Fenton, S. E. Sectioning Mammary Gland Whole Mounts for Lesion Identification. Journal of Visualized Experiments. (125), e55796(2017).
- Bayarmagnai, B., Perrin, L., Esmaeili Pourfarhangi, K., Gligorijevic, B. Intravital Imaging of Tumor Cell Motility in the Tumor Microenvironment Context. Methods in Molecular Biology. 1749, 175-193 (2018).
- Beerling, E., Ritsma, L., Vrisekoop, N., Derksen, P. W., van Rheenen, J. Intravital microscopy: new insights into metastasis of tumors. Journal of Cell Science. 124, Pt 3 299-310 (2011).
- Witcomb, L. A., Collins, J. W., McCarthy, A. J., Frankel, G., Taylor, P. W. Bioluminescent Imaging Reveals Novel Patterns of Colonization and Invasion in Systemic Escherichia coli K1 Experimental Infection in the Neonatal Rat. Infection and Immunity. 83 (12), 4528(2015).
- Singh, K., et al. Inter-alpha inhibitor protein administration improves survival from neonatal sepsis in mice. Pediatric Research. 68 (3), 242-247 (2010).
- Pluschke, G., Pelkonen, S. Host factors in the resistance of newborn mice to K1 Escherichia coli infection. Microb. Patho. , 93-102 (1988).
- Mancuso, G., et al. Role of interleukin 12 in experimental neonatal sepsis caused by group B streptococci. Infections and Immunity. 65 (9), 3731-3735 (1997).
- Thammavongsa, V., Rauch, S., Kim, H. K., Missiakas, D. M., Schneewind, O. Protein A-neutralizing monoclonal antibody protects neonatal mice against Staphylococcus aureus. Vaccine. 33 (4), 523-526 (2015).
- Andrade, E. B., et al. TLR2-induced IL-10 production impairs neutrophil recruitment to infected tissues during neonatal bacterial sepsis. Journal of Immunology. 191 (9), 4759-4768 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır