Method Article
グラム陰性細菌敗血症の新生児画像モデル
* これらの著者は同等に貢献しました
要約
新生児マウスの生物発光 性大腸菌 O1:K1:H7感染は、著しい肺炎症および肺病理を伴う敗血症感染をもたらす。ここでは、全身性細菌の負担の列挙、炎症プロファイリング、肺組織病理学と並行して縦方向の生体内イメージングを用いて新生児敗血症をモデル化し、さらに研究する手順について述べた。
要約
新生児は、生後数ヶ月で表示されるユニークな免疫プロファイルのために細菌敗血症のリスクが高くなります。私たちは、新生児の高い死亡率を担う血清型である 大腸菌 O1:K1:H7の病因を研究するためのプロトコルを確立しました。我々の方法は、感染の進行時に異なる時点で新生児の出生時の生体内画像を利用する。このイメージングは、血液中の細菌の測定、炎症プロファイリング、および組織組織組織病理学によって平行して、敗血症中の感染ダイナミクスを理解するための厳格なアプローチを意味する。現在の報告書では、細菌の負担と疾患の重症度を比較するための2つの感染性接種をモデル化する。我々は、皮下感染が感染後10時間までに感染を広めることにつながることを発見した。24時間までに、血液、肺、およびその他の末梢組織に発光 性大腸菌 の感染が豊富であった。肺の炎症性サイトカインの発現は24時間で有意であり、その後に細胞浸潤および感染性用量で増加する組織損傷の証拠が続く。インビタルイメージングには、いくつかの制限があります。これには、発光シグナル閾値と麻酔中に新生児で生じる可能性のあるいくつかの合併症が含まれます。いくつかの制限にもかかわらず、私たちの感染モデルは、これまで徹底的に調べられていない新生児マウス敗血症中の縦方向感染ダイナミクスを理解するための洞察を提供することがわかりました。このモデルは、初期の間に他の重要な細菌感染を研究するためにも適応できると期待しています。
概要
細菌敗血症は、感染からの十分な保護を提供しない生後の最初の日にユニークな免疫プロファイルを示す新生児にとって重要な懸念事項である1。新生児敗血症は、米国だけで毎年75,000例以上を占める米国の重大な医療問題であり続けています2.これらの感染症を深く研究するためには、ヒト疾患の側面を再現する新しい動物モデルが必要である。我々は、Eシェリヒア大腸菌、O1:K1:H73を用いて新生児マウス感染モデルを確立した。大腸菌は、米国における新生児敗血症の第2の主要な原因であるが、敗血症関連死亡率4、5の大部分を占める。しかし、それは、前期および非常に低い出生体重(VLBW)の赤ちゃんが独立して5と考えられる主な原因である。K1血清型は、新生児6,7における侵襲性血流感染および髄膜炎に最も頻繁に関連している。現在、抗生物質や支援ケア以外の治療法はありません。一方、多くの病原性細菌に対する抗生物質耐性の割合は上昇し続け、治療8で一般的に使用される多数の抗生物質に耐性のある大腸菌の株もある。したがって、新生児における敗血症のメカニズムと宿主応答を研究する方法を作り続けることが不可欠です。これらの結果は、現在の治療と感染結果を改善するのに役立ちます.
新生児の免疫状態は、成人と比較して、触語と機能的な違いの両方によって特徴付けられる。例えば、インターロイキン(IL)-10およびIL-27のような抗炎症および調節性サイトカインの上昇レベルは、臍帯血由来のマクロファージによって産生され、マウス新生児9、10、11の血清中でより大きなレベルで存在することが示されている。これは、成人の対応物10と比較して新生児細胞から頻繁に報告されるIFN-α、IFN-ɣ、IL-12、およびTNF-αの低レベルと一致する。さらに、新生児免疫系は、成人12と比較してTh2および調節性T細胞応答に向かって歪んでいる。好中球、T細胞、B細胞、NK細胞、および単球の増加数も新生児に存在するが、著しい機能的障害を有する。これには、細胞表面マーカーの発現における欠陥および非成熟性13、14、15を示唆する抗原提示が含まれる。さらに、新生児好中球は、化学戦術因子16に移行する能力が著しく欠損している。骨髄由来のサプレッサー細胞(MDSC)は、新生児の上昇レベルでも見られ、最近IL-2711の供給源であることが示されている。MDSC は T 細胞17に対して非常に抑制性が高い。総称して、これらのデータは、感染に対する感受性の増加に役立つ新生児免疫の限界を示している。
新生児敗血症時の細菌の負担の進行と保護宿主免疫応答の解剖を研究するために、我々は新しい感染モデルを開発した。新生児マウスは、3〜4日目の生命において、腹腔内腔または尾静脈に注入することが困難である。我々のモデルでは、3日目または4日目の子犬は、細菌の接種またはPBSを皮下領域に投与する。全身感染が発症し、発光性大腸菌O1:K1:H7を用いて、個々の新生児マウスを縦断的に画像化し、末梢組織における播種された細菌負担に従うことができる。これは、マウス新生児3における敗血症時の細菌の普及の動態を理解するために、生体内画像化を利用する最初の報告されたモデルである。
ここでは、新生児マウス3における敗血症性大腸菌感染症を誘導するプロトコルについて説明する。注射用の細菌接種を調製する方法、病理評価のための組織の採取方法、遺伝子発現解析による炎症マーカーの測定、細菌負担の列挙方法について説明する。また、新生児免疫細胞による細菌殺死の活性化および細菌の定量化に対する発光性大腸菌の使用についても説明する。これらのプロトコルはまた、新生児における他の重要な細菌感染を研究するために適応され得る。ここに示すデータは、翻訳可能な新生児敗血症モデルにおける感染ダイナミクスを理解するための全体的な新しいアプローチを表しています。
プロトコル
すべての手続きは、ウェストバージニア州の施設動物のケアと使用委員会によって承認され、国立研究評議会による実験動物のケアと使用のためのガイドからの勧告に従って行われました18.
1. 細菌性接種の調製
- トリプティック大豆寒天(TSA)プレートを、単一コロニーを大腸菌O1:K1:H7-luxの冷凍庫から隔離するためのインノキュレーティングループを有し、ルシファーゼを安定して発現し、カナマイシン耐性を有する3を運ぶ。37°Cで一晩インキュベートする。
- 翌日、ルリアブロス(LB)はバイオセーフティキャビネットで室温(25°C)に来ることを可能にします。
- バイオセーフティキャビネットフードの下で、縞模様のプレートから単一のコロニーを特定し、カナマイシン(30 μg/mL)を補充したLBの3mLで接種します。振るとともに37°Cで一晩インキュベート(220rpm)。これがスターターカルチャーです。
- スターター培養液1:100をバイオセーフティキャビネットフードの下のLBの新鮮な3mLに希釈し、37°Cで2〜3時間(220rpm)のインキュベーターに戻します。これがストックカルチャーです。
- 分光光度計を用いて、600 nmのブランクおよびストック培養の両方の光学密度(OD)を読み取ります。LB(細菌を含まず)の100 μLを96ウェルフラットボトムアッセイプレートの1つの井戸に加えます。これは空白です。その後、ストック培養から別のウェルに100 μLを加えます。2 つの追加のレプリケートに対して繰り返します。吸光度は、プレートリーダーを使用して読み取られます。
- 在庫培養吸光度値(OD値)からブランク吸光度を差し引き、以前に生成され検証された成長曲線と比較して、感染量の調製のためのストック培養中の細菌密度の近似値を決定する。
- 研究課題に応じてターゲットの接種を生成します。この研究では、マウス(/マウス)あたり2 x 106( 低)および7 x 106( 高)コロニー形成ユニット(CFUs)の接種を用いた。
- マウスあたりの標的用量(用量T)をストック培養中の細菌の推定濃度(Stock)で割り、ストックチューブから必要な細菌の量を得る(VS)。
- 感染に必要な細菌の総量に対して5〜10個のエキストラに十分な量と共に感染する必要があるマウスの数(NM)と5〜10回の追加用量をVSに掛けます。ストックチューブからこのボリュームを取り出し、新しい遠心管に追加します。
- 次の数式を使用します。
用量T/Stock= VS x NM = ストックチューブから除去される細菌の総容積 (VT)です。
- 4°Cで5分間2,000xgの細菌を遠心分離し、感染するマウスあたり50μL(pH 7.2-7.6)で細菌ペレットを再懸濁する(例えば、1回の2 x 106細菌の10用量の場合、2x107細菌のペレットは500μLで再懸濁される)。 繰り返しますが、必要以上に接種を準備することをお勧めします。コントロール接種のためだけにPBSの等量を準備します。感染するまで氷上で感染性の接種およびPBSコントロールを維持する。
- 96ウェルプラスチック底希釈板でPBSに7つの10倍の連続希釈を行い、かつカナマイシン(30μg/mL)を加えた象限TSAプレートに複素二重の希釈液のプレート25μLを行い、投与された細菌の実際の量を列挙します。列挙前にコロニー形成のために一晩37°Cでインキュベートする。
2. 動物の識別
- 年齢に合わせた子犬のためにごみが同期されるように、十分な数の繁殖ペアを手配してください。1日±年齢変動は許容される。
- 妊娠中のC57BL / 6メスマウスを特定し、正確に年齢を決定するために計画された実験の前にごみの誕生を監視します。
- コントロールと感染した3日または4日の古い子犬を区別するには、小さな、細かい先端の虹彩はさみを使用して、コントロールの子犬の尾の端だけを切り取ります。感染した子犬は尾の切り取りを受け取りません。尾を切る前に、70%エタノールで使用綿球で皮膚を消毒する。必要に応じて綿球またはガーゼで尾の端に圧力を加えます。
注: この手順は、バイオセーフティ キャビネット フードの下で実行されます。1インチの約1/8のテールスニップで十分です。 - コントロールおよび感染したグループ内の子犬を識別するには、28 G x 1/2''永久針を持つ1mLインスリン注射器を使用して、子犬の尾に入れ墨を入れ入れる。入れ墨の前に、70%エタノールで使用綿ボールで皮膚を消毒します。この手順は、バイオセーフティキャビネットフードの下で行われます。
- 尾を入れ墨するには、針の先端に動物の入れ墨インクを適用します。次に、尾を完全に露出して、片手で慎重に子犬を拘束します。表面的な深さを保ちながら針を皮膚の下にそっと挿入し、小さなマーキング(ドット)が作成されるまで針を数ミリメートル皮膚と平行に動かします。皮膚の下から余分なインクが放出されないように、皮膚の下からゆっくりと針を取り除く前に数秒待ちます。
- 必要に応じて綿球またはガーゼで傷口に圧力をかける。70%エタノールで皮膚の表面に余分な入れ墨インクを除去します。
- 感染したマウスと対照群の後続のマウスでこのプロセスを繰り返し、連続した子犬の入れ墨ごとに追加のドットを追加します(例えば、子犬1は尾に1ドット、子犬2は尾に2つのドットを持ちます)。
注: 追加の識別層の場合は、コントロールと感染したグループに動物のタトゥー インクの別々の色を使用することをお勧めします。
3. 肩甲骨の接種
注:この研究では、各実験に対して指定された低用量および高用量群で2つの実験を行った。最初の実験では、7つの子犬に低用量接種(4つの子犬がコントロールとして使用された)を与え、別のごみから5つの子犬が高用量を与えられた(3つの子犬がコントロールとして使用された)。実験1の子犬は、24時間のタイムポイントについてのみデータを提供した。2番目の実験では、8つの子犬に低用量接種(2つの子犬をコントロールとして使用した)を与え、6つの子犬は高用量接種接種を与えられた(2つの子犬がコントロールとして使用された)。実験2の子犬は、0、10、および24時間のタイムポイントのデータを提供した。
- 年齢マッチの子犬は1日≤。各ごみを低用量または高用量のごみとして割り当てます。ごみの中でランダムにコントロールまたは感染した子犬として子犬を割り当てます。
- 3日目または4日目の出生後に、 大腸菌ルクス またはPBSコントロールで接種する前にすべての子犬の体重を記録する。この間に子犬からダムを分離して、感染中に移動しないようにします。
- インスリン針を用いたバイオセーフティキャビネット内で、PBSまたは 大腸菌-lux 接種のいずれかを吸引する。この作業では、マウスあたり2 x 106 および7 x 106 CFUsの接種器が使用されました。感染性の接種とPBSの両方を氷上に保管し、肩甲骨注射を介して投与する。
- バイオセーフティキャビネットフードのきれいな表面に新生児を置き、子犬をこするかのように首のうなじで皮膚を上げます。
- 今、動物の皮膚と筋肉の間に作成された空間では、針を挿入し、ベベルアップ、皮膚のすぐ下に、PBSまたは 大腸菌ルクスの50 μLを注入します。同時に注入の逆流を防ぐために、皮膚のピンチ部分を解放します。
- ゆっくりと、注意して針を取り外します。注射が終了した後、ダムで戻って子犬を配置します。
注:開発中の解剖段階のために、3-4日目に新生児の子犬に尾静脈または腹腔内注射を投与することは技術的に困難です。従って、この研究では、実行のしやすさから、下垂体感染経路が選択された。
4. 疾患とエンドポイントの基準の評価
- 感染期間中、1日2回子犬を監視します。外観の異常に注意してください。
- 罹患率の客観的な測定として重みを記録する。
- 体重の変化に加えて、後側に新生児を配置することによって、自分自身を右に子犬の能力をテストします。病気の動物は腹側と足に引き渡すことができないか、困難でこのアクションを完了します。
- エンドポイント基準に近い動物をマークするには、次のチェックをしてください: 正常体重の 85% 未満;動きが減少し、自分自身を正しくすることができない。ピンクとは対照的に、皮膚の変色と、より灰色または透明な外観;触り心地が良く、体温の低下と側面に沿った出血性の打撲傷を示し、また、進行した病気を示す。
注: 新生児が 2 日間にわたって体重を増やずず、手順 4.4 の説明のいずれかに適合している場合、エンドポイントの基準を満たしています。高用量を受ける子犬は、しばしば24時間でエンドポイント基準を満たす。低用量および高用量のごみ内の制御子犬は、制御群と実験群の間の比較分析を可能にするために同時に安楽死させる。以下の安楽死セクションに進みます。
5. 細菌の負担のインビボイメージング
- イメージングと後続の解析には、microCT イメージャーとソフトウェアを使用します。
注: 子犬の肌の色は、イメージング品質に影響しません。 - 大腸菌-ルクス感染新生児マウスとダムとケージをBSL-2レベルの層流フードに入れます。画像化するマウスを取り除き、ボンネット内の透明なイオブルランチャンバーに入れます。必要なイオブルランの量を測定するために、感染していないコントロールから始めることをお勧めします。
- microCTに接続されているコンピュータ上のソフトウェアを開きます。システムを初期化し、CCD温度が-90 °Cでロックされるまで待ちます。
- イオブルラン気化器をオンにし、ダイヤルを5%のイオブルランフローに調整します。彼らは動きを停止するまで20〜30 sのこのイオブルラン混合物でチャンバーにマウスを保ちます。一部のマウスでは、より長いまたは短い麻酔の暴露時間が必要になることがあります。マウスが動かなくなると、十分に麻酔が行われ、画像化が可能になります。
- マウスをmicroCTイメージングチャンバーに移動させ、鼻が鼻コーンに垂直に向いている傾向のある位置のイメージングボックスに置きます。歯科ワックスを使用して、画像処理ボックスの足を静かに拘束し、動きを制限します。一度に最大4匹の新生児マウスを画像化できます。
- イオブルラン気化器を2~4%の流れに下げて、イメージング中にマウスを麻酔し続けます。マイクロCTイメージングチャンバーのドアを閉めます。数秒後にマウスを確認してください。動き始めた場合は、イゾフルランで綿のボールを使用し、麻酔をするために5秒間動く動物の鼻にそれを保持します。イメージング中に動物の近くに綿のボールを保管してください。マウスを麻酔して終了しないように注意してください。
- ソフトウェアを使用して、イメージング用の [ルミネセント ]オプションを選択します。[ ブロック ]に設定した励起フィルタを使用し、放出フィルタを [開く]、[500 nm]、[520 nm]、[560 nm]、[580 nm]、[600 nm]、および 620 nm に設定します。発光用に7つの合計エミッションフィルタがセットされます。
- 各時点でマウスを画像化し(0、10、および24時間感染後[hpi])、すべての画像を各時点のフォルダに保存します。ダムとケージに子犬を返し、すべての子犬が麻酔から回復したことを確認してください。
- 2D画像を解析するには、ソフトウェアで画像を開きます。単位を ラディアンス (フォトン)に変更します。これは 総流束(フォトン/秒)に変わります。
- 複数のエミッション フィルタを使用して一度に 1 つのイメージ セットのみを解析します。各画像セットから、各画像の右下隅にある輝度の最小値と最大値をメモします(例えば、7つのエミッションフィルタがある場合は、7つの画像と7つの最小値と最大値があります)。比較する各イメージ セットに対して繰り返します。
- すべての画像の値と発光を包含するスケールを決定するには、各画像セットの最小値と最大値を最も小さい値にします。この調査では 、Open フィルター画像を代表として使用しました。
- 選択した画像をハイライト表示して開き、スケールを変更します。ツール パレットで、[ イメージ 調整]タブをクリックし、[ カラー スケール ]を、以前に特定した最小値と最大値の最小値に変更します。各イメージ セットを TIFF として保存します。この方法で各時間ポイントを個別に分析し、正しい縮尺が表示されるようにします。
- 個々のマウスの総フラックス(マウス当たりの発光信号量)を定量化するには、ステップ5.9-5.10で前述したとおりに画像を開きます。ツール パレットの[ROI ツール] タブを開き、円ツールを選択します。発光の 1 つの領域を分析する場合は、1つの円を選択します。
- 発光領域の オーバーレイ に ROI を移動します。必要に応じて ROI のサイズを調整します。
注: 調整が必要な場合は、他の画像の ROI を調整して一貫性を維持します。[ROI の測定] を選択します。ROI 測定ウィンドウが開き、総流束 (p/s)、平均輝度 (p/s/cm2/sr)、放射度の標準偏差、最小放射輝度、最大輝度が表示されます。 - 各画像セットの総フラックス測定値を記録します。この数値は、2D 画像におけるマウスの発光量を定量化した値です。
- 3D 再構成された microCT イメージを作成するには、ツール パレットのDLIT 3D 再構築パネルを開き、[解析]タブに含まれるすべての波長を確認します。
6. 安楽死
- 壊死および適切な下流の適用のために目的の組織/器官のための管を準備し、ラベルを付ける。
- バイオセーフティキャビネットで新生児をダムから分離します。
- 綿のボールを獣医グレードのイゾフルランに浸し、透明な封じ込めチャンバーの中に置きます。
- 血液を採取する場合は、P200マイクロピペットをチップで調製し、抗凝固剤として10 μLの5mM EDTAを有する1.5 mLチューブを有する。血液の50-200 μLの容積が予想される。
- チャンバーに新生児を置き、動かなくなるまで子犬を監視します。
- すぐに、新生児を取り除き、はさみで首を切ります。長期間新鮮な空気を吸い込むことができれば、子犬は意識を取り戻すことができます。新生児は、成体マウスに対して肺容量を低下させ、したがって、イオブルラン単独で安楽死のために十分に深く呼吸しない。
- P200マイクロピペットを使用して、頭部の基部のトランクから血液を採取する。採血量を最大化するには、切断後できるだけ早くこのステップを実行します。ステップ1.9に記載されているように、連続希釈および標準プレートカウントによって血液中の細菌を列挙する。
- 組織サンプルの切除前に70%エタノールで新生児全体を殺菌します。
7. 組織収穫
- バイオセーフティキャビネット内で、汚染を防ぐために70%エタノールで新生児を使用してください。動物を右側に置きます。
- 鉗子を使用して、腹部と後部左足の間の点で皮膚をつかみ、細かい先端の外科用ハサミで切開を行う。背中に向かって上向きに動く皮膚を切り取り続けます。脾臓全体が露出するまでの進行。
- 鉗子を使用して脾臓をつかみ、腹部から取り除き、はさみを使用して結合組織を切断します。下流アプリケーションに適したソリューションに脾臓を配置します。
- 肺を得るために、胸部の皮膚を完全に剥がす。
- 胸骨の基部に縦に保持されたはさみで入り、リブケージが分割されるまで上向きに切断する。
- 鉗子を使用して右肺と左肺を個別に把握し、胸腔から取り除く。はさみで切断することによって肺組織から心臓を取り除きます。
- 下流のアプリケーションに適した溶液に肺を置きます。RNAの単離のために、グアニジンチオシアネート/フェノール(GTCP)の500 μLを使用してください。組織病理学のために、10%中性緩衝ホルマリンの5 mLを使用してください。
8. 遺伝子発現のための肺組織からのRNAの分離
- マイクロ遠心分離機を4°Cに予冷します。
- はさみでGTCPの肺組織をミンチ。次に、電池式ホモジナイザーで組織を均質化する。溶液ができるだけ均一になるまで続けます。室温で3~5分間インキュベートします。
- フィルター処理されたピペットチップを使用して、クロロホルムを100 μL加えます。チューブを15 sで反転させ、室温で3〜5分インキュベートします。
- 12,000 x gで 15 分間の遠心分離機 .
- スピン中に、70%エタノールの500 μLで1.5 mLチューブを準備します。RNA分離キットからカラムとコレクションチューブを組み立て、ラベル付けします。
- 遠心分離の際に形成された相間層を乱すことなく、上層水層を慎重に除去する。水層を70%エタノールを含むチューブに入れます。
- エタノールとライセート混合物をコレクションチューブ内のカラムに移動します。
- この時点から、RNAの最終的な溶出まで、RNA分離キットの市販製品プロトコルに従ってください。
- RNAの純度と量を分析します。すぐに使用するか、さらに使用するまで-80°Cで保存してください。
9. cDNA合成
- PCRチューブにラベルを付け、脇に置きます。
- 各サンプルのcDNA反応混合物に1μgのRNAを加えます。
- cDNA プロトコルに記載されているように、PCR チューブに試薬とテンプレートを追加します。最後に酵素を混合物に加えます。
- PCRチューブをサーモサイクラーに入れ、25°Cで5分、42°Cで40分、85°Cで15分、4°Cの最終ホールドを行います。
- サーモサイクラーからPCRチューブを取り除き、すぐに使用するか、さらに使用するまで-20°Cで保存してください。
10. リアルタイム定量PCR(qPCR)サイクル
- 分析する各遺伝子に反応ミックスカクテルを用意します。15 μL PCR 反応ごとに、7.5 μL の 2x 試薬ミックス、20X 5'-FAM 標識遺伝子特異的プライマー/プローブの 0.75 μL、ヌクレアーゼを含まない水 3.75 μL が必要です。アンプリコンは通常60-120 bpの範囲です。
- 各実験グループに対して3μLのcDNAテンプレートを適切なウェルに追加します。
- 適切なウェルに12μLの遺伝子特異的反応ミックスカクテルを加えます。
- プレートに光学粘着フィルムと遠心分離機を1,000 x g で1分間覆い、ウェルに形成された気泡を除去します。
- リアルタイム PCR サーモサイクラーに PCR プレートを配置します。
- 実行方法は95°Cで3分、15sの95°Cの40サイクル、1分間は60°Cと続きます。
- 対象遺伝子を内部制御に正規化してデータを分析し、2-ΔΔCt 式と数値のlog2 変換を用いて、感染していない対照サンプルに対する感染サンプルからのデータを表現する。
11. 肺組織病理学
- 上記のように新生児の子犬から肺を取り除く。
- 組織に対する溶液の比率が約20:1になるように、10%中性緩衝ホルマリンの体積に組織を入れます。
- パラフィン埋め込み、切除、ヘマトキシリンおよびエオシン(H&E)染色のための適切な神学サービスとの連携。この研究のために、ウェストバージニア大学組織病理学コアを利用しました。あるいは、前述のプロトコル19に従ってください。
12. インビトロ細菌殺滅アッセイ
- 上記のように感染していない新生児の子犬から脾臓を取り出し、滅菌60 mmペトリ皿内の40 μmナイロンバスケットに入れます。これを繰り返し、一緒に収穫し、均質化するために1つのチューブに脾臓をプールします。
- 10%FBSで補ったPBSの5 mLを加えます。
- 単一の細胞懸濁液が作成されるまで滅菌3 mLシリンジプランジャーを使用して組織を分解する。
- ナイロンバスケットの外側の単細胞懸濁液を回収し、15 mL遠心チューブに移し、ペレット細胞を350 x g で5分間回収します。
- 赤血球のリシスバッファー(最大7-8脾臓の場合は2 mL)で細胞を中断し、赤血球を除去するために室温で5分間放置します。
- 上記のようにPBSとペレットで脾細胞を洗浄します。
- 期待される細胞収量に従って0.5%BSAおよび2 mM EDTAを補充するPBSの0.25 mLで脾細胞を中断する。
- 血球計または他の適切なアプリケーションを使用して脾細胞をカウントします。
- メーカーのプロトコルに従って、Ly6B.2+ (顆粒球/炎症性単球の骨髄性の集団) 細胞を免疫磁気ビーズで分離します。
- シードLy6B.2+ 10%FBS、2 mMグルタミン、および25 mM HEPES(完全培地)を含むDMEMの0.1 mLの体積で、黒または白の96ウェルプレートでウェルあたり1 x 105 細胞の密度で細胞をシードします。
- セクション1に記載されている生物発光 大腸菌 を列挙し、0.1mLの最終容積で所望の多重性感染(MOI)で細菌接種を調製する。これは、一括で共通のMOIですべての井戸に必要なものを作ることによって最もよく行われます。
- 0.1 mLの細菌接種または完全な培地をコントロールとして加えます。マルチウェルプレートを37°Cで、CO2 を5%で1時間インキュベートします。
- ピペットで静かにメディアを取り出し、新しいピペットチップでフレッシュメディアを追加することで、ゲンタマイシン(100 μg/mL)を含む0.2 mLの新鮮な完全なメディアに交換してください。培養液を2時間分培養に戻す。
- 3時間のポスト感染時に、プレートリーダーを用いて蓋付き培養プレートの各ウェルの発光を下から測定し、培養液を培養に戻す。
- 他の所望の時間ポイントで発光の測定を繰り返す。
結果
このプロトコルは新生児マウスで細菌敗血症を誘発し、縦方向のインビタルイメージング、血液中の細菌の列挙、病理の組織学的評価、炎症性サイトカイン発現プロファイルを使用して疾患の経過を研究した。病態の徴候は、低い(2 x 106 CFU)および高い(7 x 106 CFU)の両方に感染した新生児の子犬で、時間の経過とともに大腸菌の接種を観察した。より大きな接種を受けた子犬は、移動性の低下、姿勢の矯正ができないこと、感染後24時間(hpi)までに直立した位置を維持する能力の障害を含む、より顕著な苦痛の兆候を示した。しかし、一部の子犬は他の子犬よりも悪く見えたので、罹患率の範囲がありました。感染直後、1匹の低用量動物が、ベースラインを確立するためにイメージングセッション中にイオブルラン暴露のために死亡した。24 hpiによって、6匹の高用量動物のうち2匹が全身感染に屈した(死亡率は33.3%)。高用量または低用量の接種接種を受けた感染した子犬は、24 hpiでコントロールリッターメイトよりも有意に少ない重量を量った(図1A,B)。より高い接種を受けたすべての子犬は、24 hpiでエンドポイント基準を満たしました。したがって、この群のすべての感染した子犬は、イメージング後に安楽死させた。血液中の細菌は、下の接種を受けたマウスのサブセットと、それらがすべて安楽死したので、より高い接種を受けたすべての動物について列挙された。同様に行われた2つの実験の結果は、ほとんどの動物が24 hpiで血液中の細菌(CFUs/mL)のレベルが高いが、一部の動物は血液中に検出可能な細菌を有していなかったことを示している(図1C)。後者は、彼らがこの時点までに感染をクリアしたことを示唆している。予想通り、より高い接種を受けた子犬は、低用量接種接種を受けた子犬に対して24 hpiでほぼ3桁多くのCFUs/mLを有していた(図1C)。
発光細菌の生きた動物イメージングは、10および24hpiで経時の新生児の増殖と細菌の播種および成長の増加を更に確認した(図2および図3)。さらに、microCTを用いた生体内イメージングを用いて、脳(図2B)、肺(図2B、図3A、B)、およびその他の末梢組織を含む感染病巣を同定することができた(図2B)。感染性の高いマウスの肺は、発光性細菌シグナルに同局化した炎症性の統合と一致する不透明な領域を示した(図3A)。これらの推定炎症性滲出物の領域は、感染していないコントロール肺には見つからない(図3A)。感染した子犬の肺内の顕著な炎症性サイトカイン応答のさらなる証拠は、IL-1β、IL-6、およびTNF-αの遺伝子発現解析によって実証される。コントロールに対する発現の有意な増加は、低および高の接種群の両方で3つのサイトカインすべてについて観察された(図4A)。肺の病理組織学的にも、コントロールおよび感染した子犬の24 hpiで検査された。同様の炎症性サイトカインプロファイルにもかかわらず、病理学の進行性の増加は、一般的に低いから高い接種に観察された。感染していないコントロールからの組織と比較して、感染した子犬の肺は顕著な炎症変化、歯槽壁の肥厚、肺胞出血の増加、および炎症性浸潤を示した(図4B)。最も重篤な感染症では、肺の鬱血と出血の領域は、野外空間の大幅な減少に寄与した(図4B)。総称して、これらの結果は、早期発症新生児敗血症のモデルにおいて、精細管内挿部位から重要な感染病巣に時間をかけて発光細菌の播種が追跡され、重度感染した動物に重大な炎症および病理を引き起こすことを示している。
単球、マクロファージ、好中球などの自然免疫細胞による細菌の死滅に寄与する宿主因子を研究するために、細菌クリアランスを測定するための高感度なインビトロアッセイを開発しました。新生児マウスの脾臓から分離されたLy6B.2+細胞は、MOIの範囲で生物発光大腸菌に1時間感染し、その後、細胞外細菌を殺すためにゲンタマイシンで処理した。3,6,20,48hpiにて、細胞内発光をマルチモードリーダーで測定した。予想通り、MOIが増加すると、より多くの発光信号が3hで記録された(図5)。徐々に、このシグナルは消失し、細菌クリアランスを示す(図5)。このアッセイは、補足されたサイトカイン、分泌されたエフェクターの中和、および細菌クリアランスを促進し、ここで説明する新生児敗血症モデルの結果を改善するのに役立つ介入を研究するための細胞経路の薬理学的阻害剤の追加に適している。

図1:敗血症性新生児マウスにおける体重および細菌複製の変化。
(A,B)グループ内の個々のマウスウェイト(低および高)は、littermateコントロール子犬の平均重量に対する割合で表される。データはSEM±平均パーセンテージとして提示され、感染後の各時点での個々のt検定は、低接種を受けたコントロールの子犬と子犬(p<0.0001)(A)の間、または高い接種を受けたコントロールの子犬と子犬の間で24時間で有意な差を明らかにする( p =0.0031) (B)(C) 24 hpi での血液中の CFU/mL は、SEM ±平均として変換され、提示された。この図の大きなバージョンを表示するには、ここをクリックしてください。

図2:生体内イメージングは、新生児マウスにおける細菌の経時の普及を示す。
(A)〜2 x 106 CFUの接種に感染した代表的な新生児マウス(#1)が、時間0、10、および24 hpiで示されている。各時間ポイントに対して、時間ポイントあたりの最小輝度値と最大輝度値を持つカラーメトリック スケールが表示されます。0および10時間のマウスは、時間の経過とともに細菌の成長の変化を示すために、そのタイムポイントスケールと24時間スケールの両方で表示されます。(B)10,24hpiで同じ新生児マウスの3D再構成されたマイクロCT画像を代表して示す。各時点には、オーバーヘッド、半軸、コロナの視点で画像が表示されます。24 hpiの半軸画像では、末梢組織の感染病巣をよりよく表示するために、平面はマウスの周辺に向かって移動している。白い矢印は、脳と腎臓を示します 10 hpi で 24 hpi で腎臓と肺.この図の大きなバージョンを表示するには、ここをクリックしてください。
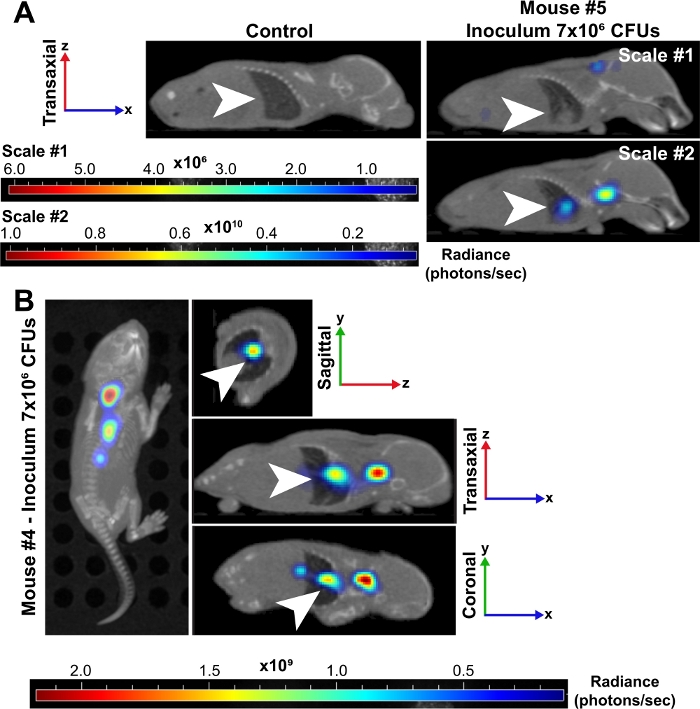
図3:肺は新生児の細菌敗血症の間に主要な感染部位である。
(A)7 x 106 CFUの接種に感染した新生児マウス(#5)の代表的な3D再構成されたマイクロCT画像は、感染していないコントロールと比較して24 hpiで示されている。両マウスは半軸方向に表示され、肺は白い矢印で示される。感染したマウスを2つの輝度(光子/秒)スケールに置いた。スケール#1は、全6波長(500、520、560、580、600、620nm)を含み、スケール#2は500、520、560nmの波長のみを含みます。この第2のスケールは、低波長が組織によってより高く吸収され、より強い信号を生成するので、肺の細菌の増加した信号を視覚化することができました。(B)7x 106 CFUの接種に感染した新生児マウス(#4)の代表的な3D再構成されたマイクロCT画像は、24 hpiで示されている。この時点では、オーバーヘッド、矢状、経軸、およびコロナの視点に画像が含まれています。白い矢印は、肺の感染病巣を示す。この図の大きなバージョンを表示するには、ここをクリックしてください。
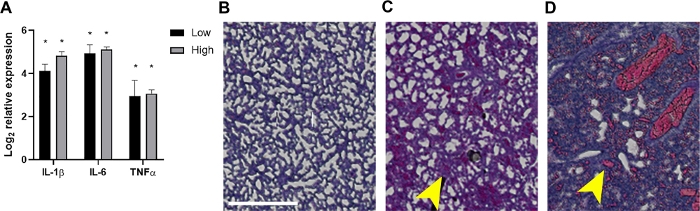
図4:敗血症性新生児の肺における炎症および関連する病理組織学的所見。
24 hpiでは、肺は〜2 x 106 または7 x 106 CFUsまたは感染していないコントロールを受けた子犬から採取された。(A)RNAを単離し、IL-1β、IL-6、またはTNF-αの発現を、式2-ΔΔCtを用いた定量的リアルタイムPCRにより未感染制御に対して決定した。データは、示された各接種± SEM の式の変化を平均ログ2 として示します。統計的有意性は、95%信頼区間における個々のサイトカイン遺伝子と内部制御との間のΔCt値の非対t検定を用いて決定した。アスタリスクは 、p<0.01 を示します。(B-D)H&E染色された肺組織の病理組織学的部分(20倍、クリッピングマスクに構築された対象領域、および明確にするために拡大された領域)が示されている。代表的な未感染コントロール(B)または低(C)または高(D)の新生物由来の肺組織が示されている。黄色い矢印は、歯槽肥厚(C)または出血(D)を示す。スケールバー= 500 μm この図の大きなバージョンを表示するには、ここをクリックしてください。
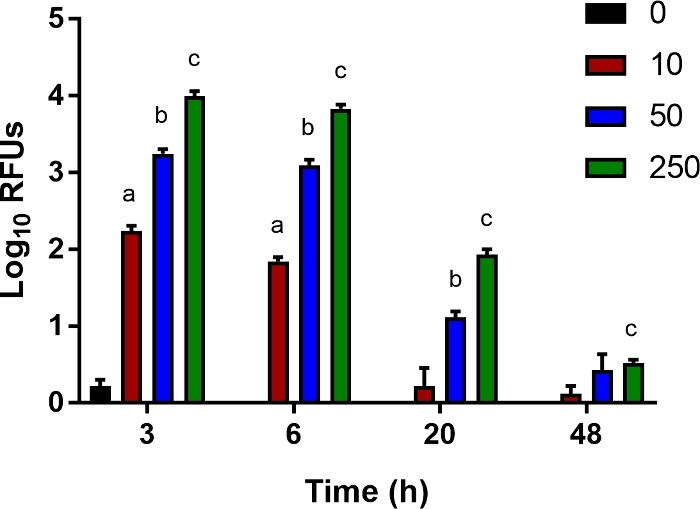
図5:細菌クリアランスのためのインビトロアッセイ。
Ly6B.2+ 細胞は、未感染制御新生児の脾臓から単離した。細胞を96ウェルプレートに播種し、示された10、50、または250の多重度の感染(MOI)でルシファーゼ発現大腸菌O1:K1:H7に感染した。1時間後、培地はゲンタマイシン(100 μg/mL)を含む新鮮な培地に置き換えられました。複数の個々の実験代表の平均相対光単位(RLU)±SEが示されている。95%信頼区間における統計的有意性は、ウェルチの補正を伴う非対t検定を用いて決定された。アスタリスクは、p<0.05 を示します。この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
新生児マウスで細菌敗血症を誘導する当社の肩甲膜感染モデルは、細菌病原体の縦方向の広がりをリアルタイムで研究する新しい方法です。インビタルイメージングは、新生児における細菌の播体拡散をリアルタイムで探索する機会を提供します。これは、細菌の普及の運動学を理解し、病気の適切な段階で宿主の応答および損傷をさらに研究するために重要である。マウスの子犬は、細菌の接種の皮下、肩甲骨下注射を投与される。この注射技術は、注射部位内の精度が低く、尾静脈や腹腔内感染などの他の一般的に使用される代替手段よりも簡単です。これは、子犬の小さなサイズを考えると重要です。生体内イメージングにより、動物を犠牲にすることなく、末梢組織や中枢神経系への細菌増殖と普及の縦断評価が可能になります。同様のイメージング手法と技術が癌生物学と転移の研究のために使用されている20,21.さらに、新生児ラット22における大腸菌感染時の生物発光イメージングの使用を挙げている別の研究では、ここでは新生児マウスにアプローチを適用し、我々の方法論ではマウス敗血症時の細菌動態の評価が可能である。細菌の可視化は、動物の中の細菌(例えば、細菌のルシファーゼ活性)から様々な波長での生物発光の放出に基づいている。その後、生物発光を冷却された充電された結合デバイス(CCD)カメラを介して可視化されます。その結果生じる視覚化された生物発光は、動物内の細菌の空間的および時間的依存的な影響を示す3D画像に再構築することができる。データ取得のより微妙な層のために、テールタトゥーを介して成功した動物識別は、時間を超えて個々の子犬の繰り返し測定評価と特定の実験グループ内の可能な外れ値の識別を可能にします。
記載されたモデルの最も成功した適用は細菌接種の準備の正確さを必要とする。ここでは、標的と実際の接種間の変動を減少させる、事前に確立され、検証された 大腸菌 成長曲線を用いた細菌製剤の最適化方法について述べた。これにより、意図した接種での実験再現性が可能になります。我々のモデルに2つの接種体を含めることは、血液CfUs、死亡率および肺病理における用量依存的な結果を示した。しかし、疾患軌道のいくつかの側面は用量依存ではなかった。感染した動物の体重増加の失敗は、24 hpiの接種に依存しなかった。さらに、両方の接種物による感染に応答して、同様のレベルの炎症性サイトカイン発現が肺で観察された。このパターンが腎臓、肝臓、脾臓、脳などの細菌が観察されたすべての組織で複製されるかどうかはまだ決定されていない。敗血症に加えて、 大腸菌 O1:K1:H7は新生児集団23における髄膜炎に関連している。この脳感染は、周辺からの細菌が侵入し、血液脳関門に浸透するときに発生します。今後の研究では、タイトな接合タンパク質発現の変化の分析を通じてモデルのこの側面を探求し、細菌接種の異なる範囲をテストします。インビタルイメージング中の追加の変更には、イメージング中にマウスから約2〜3インチ離れた場所に置かれるイゾフルランで使用される単数の綿球の添加が含まれる。新生児の子犬がイメージングセッション中に意識を取り戻し、正確な画像取得を防いだという以前の実験に対して、綿球をマウスの近くに置き、イメージング中に継続的に麻酔を受け続けるようになりました。しかし、これは麻酔から回復できないほど近くで行われないようにすることが重要です。
様々な動物や疾患モデルにおける異なる細菌の運動学の研究に柔軟かつ容易に適応可能であるが、我々のプロトコルは考慮すべきいくつかの制限がある。最初に考慮すべき制限は、感染の下垂路が自然な伝達経路を反映していないということです。しかし、当初から私たちのモデルの開発における主な目的は、人間の病気の側面を複製する全身感染を確立するために使用することができる簡単に再現可能な送達モードを確立することであった。そこで本報告では、自然感染のモデルではなく、ヒト早期発症敗血症症候群のモデルについて述べている。新生児ラットには、一般的なヒト感染のいくつかの側面を複製する確立されたモデルがあり、例えば、脳22を含む、脳22を含む、その後の血流および末梢組織への普及の最初のコロニー形成など、 一般的なヒト感染のいくつかの側面がある。Witcombたちの研究グループは、生物発光大腸菌と生体内イメージングも組み込んでいます。さらに、イオブルラン暴露を最小限に抑えるとともに、新生児とダムの両方のストレスレベルを軽減するために、技術の精度と精度を損なうことなく、できるだけ早く子犬を注入、尾の入れ墨、および処理することが重要です。場合によっては、子犬が人間の誘発および/または実験的操作を強化した場合、ダムは看護や子犬の世話を停止することができ、感染とは無関係の生存率が低下する。同様に、イオフルランに長期間曝露された子犬は、イメージングセッションのおよそ10分を超えて死亡リスクが高くなります。したがって、マウスを十分に麻酔するのに十分なイゼルランを供給することは重要ですが、安楽死させるのに十分ではありません。最終的な検討点は、感度の限界です。10 4 CFUs/mL E.大腸菌未満が記録された発光信号を列挙した組織は、検出可能範囲の下端に落下し、撮像ソフトウェア3で使用されるスケーリング方法に従う。したがって、いくつかの組織は、細菌の低レベルでコロニー形成されてもよいが、目に見える生物発光なしで表示されます。
現在、ほとんどの研究では、新生物の腹腔内(i.p.)および尾静脈注射などの細菌播種の成人法を利用しています。プルシュケとペルコネンは、i.p.、尾静脈、および口腔感染症24を通じて新生児マウスに対する大腸菌K1の影響を分析した。この研究は、免疫不全を有するマウスの異なる遺伝子型がK1株に対してより感受性が高いことを実証した。しかし、感染に対する宿主免疫応答の多くの側面と細菌の広がりのメカニズムは解決されていないままである。Deshmukhたちは、新生児マウスを大腸菌K1またはK.肺炎と腹腔内に感染させ、脾臓および肝臓のCFUsを72 hpi25で測定した。本研究はまた、マウスの抗生物質への曝露前に基づいて、感染に対する宿主応答のいくつかの側面を分析した。しかし、同じ組織における炎症プロファイリング(顆粒球症以外)と並行して、末梢組織および血液への細菌播種の徹底的な調査は行われなかった。黄色ブドウ球菌、ブドウ球菌、グループBレンサ球菌、および大腸菌を有するマウスにおける新生児敗血症の他の研究は、感染に応答して宿主免疫系のさまざまな側面を探る。しかし、これらの研究のいずれも、細菌感染病巣23、25、26、27の細菌播種または局在の運動を探索するために、生体内イメージングを利用していない。我々の感染および生体内イメージングの方法は、細菌負担評価および末梢組織の炎症プロファイリングと組み合わせることで、感染時の宿主および病原体の両方の側面を包括的に調べることができ、敗血症時の宿主病原体間遊びをより正確に理解することができます。
この感染と画像化モデルを利用して、B群連鎖球菌 、K.プネウオクチー、 リステリア単球遺伝子など、新生児における敗血症に一般的に関与する様々な病原性細菌を用いて早期発症新生児敗血症の理解をさらに深めるつもりです。この感染モデルは、異なる細菌病原体の播種を新生物における宿主応答と並行して縦断的に比較することを可能にする。さらに、このモデルは、特定の(蛍光共役)免疫細胞タイプの導入に適応可能であり、感染部位への移行とその後の細菌の応答および制御への影響を研究する。これは、以前に実証されていない方法で初期の人生で敗血症の間に起こる宿主と病原体の相互作用をよりよく理解する機会を与える。
開示事項
著者らは開示する利益相反を持っていません。
謝辞
この仕事は、C.M.Rへの機関資金によって支えられた。
資料
| Name | Company | Catalog Number | Comments |
| 1 mL Insulin Syringe | Coviden | 1188128012 | Inoculum or PBS injection |
| 10% Neutral Buffered Formalin | VWR | 89370-094 | Histopathology |
| ACK Lysis Buffer | Gibco | LSA1049201 | Bacterial clearance assay |
| Animal Tattoo Ink Paste | Ketchum | KI1482039 | Animal identification |
| Animal Tattoo Ink Green Paste | Ketchum | KI1471039 | Animal identification |
| Anti-Ly-6B.2 Microbeads | Miltenyi Biotec | 130-100-781 | Cell isolation |
| Escherichia coli O1:K1:H7 | ATCC | 11775 | |
| Escherichia coli O1:K1:H7-lux (expresses luciferase) | N/A | N/A | Constructed in-house at WVU |
| E.Z.N.A. HP Total Extraction RNA Kit | Omega Bio-tek | R6812 | RNA extration |
| DPBS, 1X | Corning | 21-031-CV | |
| Difco Tryptic Soy Agar | Becton, Dickinson and Company | 236950 | Bacterial growth |
| IL-1 beta Primer/Probe (Mm00434228) | Thermo Fisher Scientific | 4331182 | Cytokine expression qPCR |
| IL-6 Primer/Probe (Mm00446190) | Thermo Fisher Scientific | 4331182 | Cytokine expression qPCR |
| iQ Supermix | Bio-Rad | 1708860 | Real-time quantitative PCR |
| iScript cDNA Synthesis Kit | Bio-Rad | 1708891 | cDNA synthesis |
| Isolation Buffer | Miltenyi Biotec | N/A | Bacterial clearance assay |
| IVIS Spectrum CT and Living Image 4.5 Software | Perkin Elmer | N/A | Intravital imaging |
| LB Broth, Lennox | Fisher BioReagents | BP1427-500 | Bacterial growth |
| EASYstrainer (Nylon Basket) | Greiner Bio-one | 542 040 | Cell strainer |
| SpectraMax iD3 | Molecular Devices | N/A | Plate reader |
| Pellet Pestle Motor | Grainger | 6HAZ6 | Tissue homogenization |
| Polypropylene Pellet Pestles | Grainger | 6HAY5 | Tissue homogenization |
| Prime Thermal Cycler | Techne | 3PRIMEBASE/02 | cDNA synthesis |
| TNF-alpha Primer/Probe (Mm00443258) | Thermo Fisher Scientific | 4331182 | Cytokine expression qPCR |
| TriReagent (GTCP) | Molecular Research Center | TR 118 | RNA extration |
参考文献
- Qazi, S. A., Stoll, B. J. Neonatal sepsis: a major global public health challenge. Pediatr Infect Dis J. 28, 1-2 (2009).
- Simonsen, K. A., Anderson-Berry, A. L., Delair, S. F., Davies, H. D. Early-onset neonatal sepsis. Clinical Microbiology Reviews. 27 (1), 21-47 (2014).
- Seman, B. G., et al. Elevated levels of interleukin-27 in early life compromise protective immunity in a mouse model of Gram-negative neonatal sepsis. Infections and Immunity. , (2019).
- Schrag, S. J., et al. Epidemiology of Invasive Early-Onset Neonatal Sepsis, 2005 to 2014. Pediatrics. 138 (6), 20162013(2016).
- Stoll, B. J., et al. Early onset neonatal sepsis: the burden of group B Streptococcal and E. coli disease continues. Pediatrics. 127 (5), 817-826 (2011).
- Weston, E. J., et al. The burden of invasive early-onset neonatal sepsis in the United States, 2005-2008. Pediatrics and Infectious Disease Journal. 30 (11), 937-941 (2011).
- Hornik, C. P., et al. Early and late onset sepsis in very-low-birth-weight infants from a large group of neonatal intensive care units. Early Human Development. , Suppl 2 69(2012).
- Vergnano, S., Sharland, M., Kazembe, P., Mwansambo, C., Heath, P. T. Neonatal sepsis: an international perspective. Archives of Disease in Childhood: Fetal and Neonatal Edition. 90 (3), 220-224 (2005).
- Kraft, J. D., et al. Neonatal macrophages express elevated levels of interleukin-27 that oppose immune responses. Immunology. 139 (4), 484-493 (2013).
- Basha, S., Surendran, N., Pichichero, M. Immune responses in neonates. Expert Reviews of Clinical Immunology. 10 (9), 1171-1184 (2014).
- Gleave Parson, M., et al. Murine myeloid-derived suppressor cells are a source of elevated levels of interleukin-27 in early life and compromise control of bacterial infection. Immunology and Cell Biology. 97 (5), 445-446 (2018).
- Adkins, B., Leclerc, C., Marshall-Clarke, S. Neonatal adaptive immunity comes of age. Nature Reviews Immunology. 4 (7), 553-564 (2004).
- Kim, S. K., Keeney, S. E., Alpard, S. K., Schmalstieg, F. C. Comparison of L-selectin and CD11b on neutrophils of adults and neonates during the first month of life. Pediatrics Research. 53 (1), 132-136 (2003).
- Velilla, P. A., Rugeles, M. T., Chougnet, C. A. Defective antigen-presenting cell function in human neonates. Clinical Immunology. 121 (3), 251-259 (2006).
- Le Garff-Tavernier, M., et al. Human NK cells display major phenotypic and functional changes over the life span. Aging Cell. 9 (4), 527-535 (2010).
- Weinberger, B., et al. Mechanisms underlying reduced responsiveness of neonatal neutrophils to distinct chemoattractants. Journal of Leukocyte Biology. 70 (6), 969-976 (2001).
- Gabrilovich, D. I., Nagaraj, S. Myeloid-derived suppressor cells as regulators of the immune system. Nature Reviewss Immunology. 9 (3), 162-174 (2009).
- National Research Council. Guide for the care and use of laboratory animals, 8th ed. , National Academies Press. Washington, DC. (2011).
- Tucker, D. K., Foley, J. F., Bouknight, S. A., Fenton, S. E. Sectioning Mammary Gland Whole Mounts for Lesion Identification. Journal of Visualized Experiments. (125), e55796(2017).
- Bayarmagnai, B., Perrin, L., Esmaeili Pourfarhangi, K., Gligorijevic, B. Intravital Imaging of Tumor Cell Motility in the Tumor Microenvironment Context. Methods in Molecular Biology. 1749, 175-193 (2018).
- Beerling, E., Ritsma, L., Vrisekoop, N., Derksen, P. W., van Rheenen, J. Intravital microscopy: new insights into metastasis of tumors. Journal of Cell Science. 124, Pt 3 299-310 (2011).
- Witcomb, L. A., Collins, J. W., McCarthy, A. J., Frankel, G., Taylor, P. W. Bioluminescent Imaging Reveals Novel Patterns of Colonization and Invasion in Systemic Escherichia coli K1 Experimental Infection in the Neonatal Rat. Infection and Immunity. 83 (12), 4528(2015).
- Singh, K., et al. Inter-alpha inhibitor protein administration improves survival from neonatal sepsis in mice. Pediatric Research. 68 (3), 242-247 (2010).
- Pluschke, G., Pelkonen, S. Host factors in the resistance of newborn mice to K1 Escherichia coli infection. Microb. Patho. , 93-102 (1988).
- Mancuso, G., et al. Role of interleukin 12 in experimental neonatal sepsis caused by group B streptococci. Infections and Immunity. 65 (9), 3731-3735 (1997).
- Thammavongsa, V., Rauch, S., Kim, H. K., Missiakas, D. M., Schneewind, O. Protein A-neutralizing monoclonal antibody protects neonatal mice against Staphylococcus aureus. Vaccine. 33 (4), 523-526 (2015).
- Andrade, E. B., et al. TLR2-induced IL-10 production impairs neutrophil recruitment to infected tissues during neonatal bacterial sepsis. Journal of Immunology. 191 (9), 4759-4768 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved