Method Article
革兰阴性细菌败血症的新生儿成像模型
摘要
新生儿小鼠感染生物发光大肠杆菌O1:K1:H7导致败血症感染,引起严重的肺部炎症和肺部病理。 在这里,我们描述了使用纵向病毒内成像对新生儿败血症进行建模和进一步研究的程序,同时列举全身细菌负担、炎症特征分析和肺组织病理学。
摘要
新生儿在生命最初几个月表现出独特的免疫特征,因此患细菌败血症的风险增加。我们已经建立了一个协议,用于研究 大肠杆菌 O1:K1:H7的发病机制,这是一种对新生儿高死亡率负责的血清型。我们的方法利用在感染过程中不同时间点的新生儿幼崽的病毒内成像。这种成像与血液中细菌的测量、炎症特征和组织组织病理学的测量平行,意味着对败血症期间的感染动态的严格理解。在本报告中,我们模拟了两种传染性接种,以比较细菌负担和疾病严重程度。我们发现,亚皮外感染导致感染后10小时传播感染。到24小时,发光 大肠杆菌的感染在 血液、肺和其他周围组织中是丰富的。肺部炎症细胞因子的表达在24小时时显著,随后是细胞渗透和组织损伤的证据,随着感染剂量的增加。病毒内成像确实有一些局限性。这包括发光信号阈值和麻醉期间新生儿可能出现的一些并发症。尽管存在一些局限性,我们发现我们的感染模型为了解新生儿毛虫败血症期间的纵向感染动态提供了见解,而迄今为止,这种感染模型尚未经过彻底检查。我们预计这个模型也可以适应研究其他关键的细菌感染在早期生活。
引言
细菌败血症是新生儿的一个重大关注,在生命的最初几天表现出独特的免疫特征,不能提供足够的保护,免受感染1。新生儿败血症仍然是美国严重的医疗保健问题,仅美国每年就有75,000多例。为了深入研究这些感染,需要新的动物模型来概括人类疾病的各个方面。我们已经建立了一个新生儿小鼠感染模型使用大肠杆菌,O1:K1:H73。大肠杆菌是导致美国新生儿败血症的第二大原因,但占败血症相关死亡率的4,5。然而,当早产儿和极低出生体重(VLBW)婴儿被独立考虑5时,这是主要的原因。K1血清型最常与侵入性血液感染和脑膜炎在新生儿6,7。目前,除了抗生素和支持性护理之外,没有其他治疗选择。同时,许多致病菌的抗生素耐药率继续上升,一些大肠杆菌菌株对治疗中常用的多种抗生素具有耐药性。因此,我们必须继续制定方法,研究新生儿败血症的机制和宿主反应。这些结果可以帮助改善目前的治疗和感染结果。
与成人相比,新生儿的免疫状态具有表型和功能差异的特点。例如,抗炎和调节细胞因子的升高水平,如白细胞间(IL)-10和IL-27,已被证明由脐带血衍生的巨噬细胞产生,并存在于更高水平的穆林新生儿9,10,11。这与与成人10 α中经常报告的Α、IFN-ɣ、IL-12和TNF-α水平一致。此外,与12岁的成年人相比,新生儿免疫系统偏向于Th2和调节T细胞反应。新生儿中也存在增加的嗜中性粒细胞、T细胞、B细胞、NK细胞和单核细胞,但有显著的功能损伤。这包括细胞表面标记和抗原表达的缺陷,表明不成熟13,14,15。此外,新生儿中性粒细胞在迁移到化疗因子16的能力上明显不足。骨髓源抑制细胞(MDSC)在新生儿的高水平也被发现,最近被证明是IL-2711的来源。MDSC对T细胞17具有很强的抑制性。总的来说,这些数据表明新生儿免疫力有限,增加了感染的易感性。
为了研究新生儿败血症期间细菌负担的进展和保护性宿主免疫反应,我们开发了一种新的感染模型。新生儿小鼠在3-4天的生活是很难注射在内皮内空间或尾静脉。在我们的模型中,第3天或第4天幼崽被施用细菌注射或PBS皮下到肩骨区域。全身感染的发展和使用发光 大肠杆菌 O1:K1:H7,我们可以纵向成像个别新生儿小鼠,以遵循周围组织传播的细菌负担。这是首次报告模型,利用病毒内成像,以了解在穆林新生儿3败血症期间传播细菌的动力学。
在这里,我们描述了一个在新生儿小鼠3 中 诱导化粪池大肠杆菌感染的协议。我们描述了如何为注射准备细菌注射的内分,以及如何收获组织以评估病理学,通过基因表达分析测量炎症标记,并枚举细菌负担。此外,还介绍了使用发光 大肠杆菌对 受感染的新生儿进行病毒内成像和新生儿免疫细胞细菌杀伤的定量。这些协议也可以适应研究新生儿的其他重要的细菌感染。此处提供的数据代表了在可翻译的新生儿败血症模型中理解感染动态的总体新方法。
研究方案
所有程序都经西弗吉尼亚机构动物护理和使用委员会批准,并根据国家研究委员会18日根据《实验室动物护理和使用指南》的建议进行。
1. 细菌性内分的制备
- 条纹一个尝试大豆糖(TSA)板与接种循环隔离从大肠杆菌O1:K1:H7-lux的冰柜库存的单个菌落,稳定地表达荧光酶和携带卡那霉素抵抗3。在37°C下孵育过夜。
- 第二天,让 Luria 肉汤 (LB) 进入生物安全柜中的室温 (25 °C)。
- 在生物安全柜罩下,从条纹板中识别单个菌落,并在 3 mL LB 中接种,并辅以卡那霉素(30 μg/mL)。在37°C下孵育,震动(220转/秒)。这是启动文化。
- 在生物安全柜罩下将起动机培养物 1:100 稀释成新鲜 3 mL 的 LB,并在 37 °C 下以摇动(220 rpm)将启动培养素返回孵化器 2-3 小时。这就是股票文化。
- 使用分光光度计读取 600 nm 处的空白和库存培养的光学密度 (OD)。将100μL(不含细菌)加入96井平底检测板的一个井中;这是空白。然后从库存培养中添加 100 μL 到单独的井中。重复两个额外的复制。使用板读卡器读取吸光度。
- 从库存培养量吸收值(OD 值)中减去空白吸收度,并与以前生成和验证的生长曲线进行比较,以确定库存培养剂中细菌密度的近似值,以制备传染性剂量。
- 根据研究问题生成目标接种。研究使用了每只小鼠(/小鼠)2 x 106 和7 x10 6( 高)菌落形成单位(CCU)的目标内分。
- 将每只小鼠的目标剂量(DoseT)除以库存培养物(库存)中细菌的估计浓度,以从库存管(VS)获取所需的细菌量。
- 乘以需要 感染的小鼠数量(NM),以及足够5-10个额外的细菌,感染所需的细菌总量加上5-10个额外的剂量。从库存管中去除此体积,并将其添加到新的离心管中。
- 使用以下等式:
剂量T/Stock = VS x NM = 从库存管中去除的细菌总量 (VT)。
- 在 4 °C 下以 2,000 x g 离心 5 分钟,并每只小鼠将细菌颗粒重新在 50 μL PBS (pH 7.2-7.6) 中重新被感染(例如, 对于每剂量10剂2 x 106 细菌,2 x 107 细菌的颗粒将在500μL PBS中重新产生。同样,建议准备比需要的更多的幼崽。仅为控制接种准备等量的 PBS。保持冰上传染性 inoulum 和 PBS 控制,直到感染。
- 在 96 孔塑料底部稀释板中对 PBS 进行七次 10 倍连续稀释,将 25 μL 的稀释板重复到象限 TSA 板上,并辅以卡那霉素(30 μg/mL),以列举所施用细菌的实际数量。在37°C下孵育,在枚举前孵育殖民地形成。
2. 动物鉴定
- 安排足够数量的育种对,以便为年龄匹配的幼崽同步散落一地。年龄变化±1天是可以接受的。
- 确定怀孕的C57BL/6雌性小鼠,并在计划实验之前监测垃圾的出生情况,以准确确定年龄。
- 要区分对照和受感染的3天或4天大幼崽,使用一对小,细尖的虹膜剪刀,只狙击控制幼崽的尾巴的末端。受感染的幼崽不会收到尾部狙击。在切割尾巴之前,用70%乙醇中喷洒的棉球对皮肤进行消毒。根据需要用棉球或纱布对尾部的尾部施加压力。
注:此过程在生物安全柜罩下执行。大约1/8英寸的尾部剪一只就足够了。 - 要识别对照组和受感染群体中的幼崽,请使用 1 mL 胰岛素注射器,用 28 G x 1/2' 永久针头纹身幼崽的尾巴。在纹身之前,用70%乙醇的棉球对皮肤进行消毒。此过程在生物安全机柜罩下执行。
- 要纹身尾巴,请将动物纹身墨水涂抹在针尖上。接下来,用一只手小心地约束小狗,尾巴完全露出来。轻轻地将针头插入皮肤下,同时保持表面的深度,并将针头与皮肤平行移动几毫米,直到创建一个小标记或点。等待几秒钟,然后慢慢从皮肤下取出针头,以避免多余的墨水从皮肤下释放。
- 根据需要用棉球或纱布对伤口施加压力。用70%乙醇去除皮肤表面多余的纹身墨水。
- 重复这个过程与随后的小鼠在感染组和控制组,同时添加一个额外的点与每一个连续的小狗纹身(例如,小狗1将有1点在他们的尾巴,小狗2将有两个点在他们的尾巴,等等)。
注:对于额外的识别层,建议对控制和受感染群体使用单独的动物纹身墨水颜色。
3. 接种次帽
注:本研究用每个实验指定的低剂量和高剂量组进行了2次实验。在第一个实验中,7只幼崽被给予低剂量接种(4只幼崽用作对子),5只幼崽被给予高剂量(3只幼崽用作对子)。实验1的幼崽只提供了24小时时间点的数据。在第二个实验中,8只幼崽接受了低剂量接种(2只幼崽用作对子),6只幼崽接受了高剂量接种(2只幼崽用作对子)。实验 2 的小狗提供了 0、10 和 24 小时时间点的数据。
- 年龄匹配幼≤ 1 天。将每个垃圾分配为低剂量或高剂量垃圾。在垃圾中随机分配幼崽作为控制或受感染的幼崽。
- 在产后第 3 天或第 4 天,记录接种大肠杆菌或 PBS 控制之前所有幼崽的重量。在此期间,将大坝与幼崽分开,以确保它们在感染期间不会移动。
- 在使用胰岛素针的生物安全柜内,吸气 PBS 或 大肠杆菌。对于这项工作,使用每只鼠标2 x 106 和7 x 106 CFP的接种。将传染性注射液和 PBS 均留在冰上,直到通过亚胶囊注射进行管理。
- 将新生儿放在生物安全柜罩的干净表面上,将皮肤放在颈部的尿布上,就像擦伤幼崽一样。
- 在现在动物的皮肤和肌肉之间创造的空间,插入针头,斜上,就在皮肤下面,并注射50μL的PBS或 大肠杆菌。同时释放皮肤的夹紧部分,以防止注射回流。
- 缓慢而小心地取出针头。注射完成后,用水坝将幼崽放回去。
注:由于其解剖阶段的发展,这是技术上的挑战,管理尾静脉或内皮酮注射新生儿幼崽在第3-4天。因此,由于易于执行,因此为本研究选择了亚帽感染途径。
4. 疾病和终点标准的评价
- 在整个感染期间,每天监测两次幼崽。注意外观的任何异常。
- 记录权重,作为发病率的客观测量。
- 除了重量变化外,还通过将新生儿定位在后侧来测试幼崽自我定位的能力。生病的动物将无法转向腹侧和脚上,或将完成这个动作困难。
- 检查以下情况以标记动物接近终点标准:不到正常体重的85%;运动减少,无法自我选择;皮肤变色,外观更灰暗或透明,而不是粉红色;感觉凉爽的触摸, 指示体温下降和出血性淤青沿两侧, 也指示提前疾病。
注:如果新生儿在两天内没有增加体重,并且符合步骤 4.4 中的任何描述,则它们符合端点标准。接受高剂量的小狗通常达到终点标准24小时。低剂量和高剂量垃圾中的对照幼崽将同时被安乐死,以便对照组和实验组进行比较分析。转到下面的安乐死部分。
5. 细菌负担的体内成像
- 使用 microCT 成像仪和软件进行成像和后续分析。
注:小狗肤色不会影响成像质量。 - 将笼内 与大肠杆菌-lux感染的新生儿小鼠和大坝放入BSL-2级层状流罩中。取出要成像的小鼠,并放入罩内的透明异氟烃室中。建议从未感染的对控制开始,以测量所需的异氟兰量。
- 打开连接到 microCT 的计算机上的软件。初始化系统并等待CCD温度锁定在-90°C。
- 打开异氟蒸发器,将表盘调整为 5% 等氟兰流量。将小鼠与这种异氟混合物保持20-30 s,直到它们停止移动;某些小鼠可能需要更长或更短的麻醉暴露时间。一旦小鼠停止移动,它们就足够麻醉,并且可以成像。
- 将小鼠移入 microCT 成像室,并将它们放置在易发位置的成像盒上,鼻子朝向垂直于鼻锥体。使用牙蜡轻轻约束成像盒上的脚,以限制任何运动。一次最多可以成像4只新生儿小鼠。
- 将异氟蒸发器向下转动至2-4%的流量,使小鼠在成像过程中保持麻醉。关闭微CT成像室门。几秒钟后检查小鼠。如果他们开始移动,用异氟将棉球放在异氟中,并按住动物的鼻子移动5秒钟麻醉。在成像过程中,将棉球放在动物附近。小心不要过度麻醉和终止小鼠。
- 使用该软件,选择用于成像的"发光"选项。使用"阻塞"的激励滤波器,将发射滤波器设置为"打开",520 nm、560 nm、580 nm、600 nm 和 620 nm。 将有七个用于发光的总排放过滤器。
- 在每个时间点(0、10 和 24 h 感染后 [hpi])对鼠标进行图像成像,并保存每个时间点的所有图像到文件夹。把幼崽和水坝一起回到笼子里,检查所有的幼崽都已经从麻醉中恢复过来。
- 要分析 2D 图像,请打开软件中的图像。将单位更改为辐射(光子);这将变成总通量(光子/秒)。
- 一次仅分析一个图像集及其多个发射滤波器。在每个图像集中,记下位于每个图像右下角的最小和最大辐射值(例如,如果有 7 个发射滤镜,则有 7 个图像,以及 7 个最小值和最大值)。对要比较的每个图像集重复。
- 要确定包含所有图像的值和亮度的刻度,请找到每个图像集的最低最小值和最高最大值。在这项研究中, 使用开放 滤镜图像作为代表性。
- 突出显示并打开选择的图像以更改比例。在" 工具调色板"上,单击 "图像调整 "选项卡, 将"颜色比例 "更改为以前标识的最低最小值和最大值。将每个图像集另存为 TIFF。以这种方式单独分析每个时间点,以确保显示正确的比例。
- 要量化每只鼠标的总通量(每只鼠标的发光信号量),请打开步骤 5.9-5.10 中前面描述的图像。打开工具 调色板上的 ROI 工具选项卡 并选择圆圈工具。如果 分析一 个发光区域,请选择 1 个圆。
- 将 ROI 移动到 发光区域的叠加。如有必要,调整 ROI 的大小。
注:如果需要调整,请比较地调整其他图像中的 RBI 以保持一致性。选择度量值 PI。ROI 测量窗口将打开,显示总通量 (p/s),平均辐射(p/s/cm2/sr),辐射标准偏差,最小辐射和最大辐射。 - 记录每个图像集的总通量测量值。此数字是 2D 图像中鼠标中亮度的量化量。
- 要制作 3D 重建微CT图像,请打开工具调色板上的DLIT 3D 重建面板,并检查要包含在"分析"选项卡下的所有波长。
6. 安乐死
- 为有关组织/器官准备和标记管,用于进行尸检和适当的下游应用。
- 将新生儿与大坝分离在生物安全柜中。
- 将棉球浸泡在兽医级异氟烃中,并放在透明密封室内。
- 如果采集血液,准备一个P200微管与尖端,并具有一个1.5 mL管与10μL的5 mM EDTA作为抗凝剂。预计血液量为50-200微升。
- 将新生儿放在室内,并监控幼崽,直到它变得一动不动。
- 快速,用剪刀清除新生儿并斩首。如果允许长时间呼吸新鲜空气,幼崽可以恢复知觉。与成年小鼠相比,新生儿的肺活量已经下降,因此,仅靠异氟作用对安乐死呼吸不够深。
- 使用 P200 微管从头部底部的树干收集血液。为了最大限度地增加采集的血液量,在斩首后尽快执行此步骤。如步骤1.9所述,通过连续稀释和标准板计数来枚举血液中的细菌。
- 在切除组织样本之前,用70%的乙醇对整个新生儿进行消毒。
7. 组织收获
- 在生物安全柜内,用70%乙醇给新生儿注入乙醇,以防止污染。把动物放在它的右边。
- 使用钳子,抓住腹部和左后腿之间的一个点的皮肤,用细尖的手术剪刀做切口。继续切割皮肤向上朝背部移动。进展,直到整个脾脏暴露。
- 使用钳子抓住脾脏,然后从腹部取出,用剪刀断开结缔组织。将脾脏放在适合其下游应用的溶液中。
- 要获得肺,完全剥回胸部的皮肤。
- 进入胸骨底部,用剪刀垂直保持,向上切割,直到肋骨笼分裂。
- 使用钳子分别抓住左右肺,并将其从胸腔中去除。用剪刀切掉心脏。
- 将肺放在适合其下游应用的溶液中。对于RNA分离,使用500μL的瓜尼丁硫氰酸酯/苯酚(GTCP)。对于病理学,使用 5 mL 的 10% 中性缓冲形式。
8. 从肺组织分离用于基因表达的RNA
- 将微离心预冷却至4°C。
- 用剪刀在GTCP中切碎肺组织。接下来,使用电池供电的均质器使组织均质化。继续,直到解决方案尽可能均匀。在室温下孵育3-5分钟。
- 使用过滤移液器尖端,加入100μL的氯仿。反转管15秒,在室温下孵育3-5分钟。
- 在 12,000 x g 下离心 15 分钟。
- 在旋转过程中,用 500 μL 的 70% 乙醇制备 1.5 mL 管。从RNA隔离试剂盒中组装并标记柱和收集管。
- 小心地去除顶部水层,而不会干扰离心过程中形成的相间层。将水层放在含有70%乙醇的管子中。
- 将乙醇和糖分离混合物移动到收集管中的柱。
- 从这一点开始,遵循RNA分离试剂盒商业产品协议,直到RNA最终洗脱。
- 分析RNA的纯度和数量。立即使用或在 -80 °C 下存放,直到进一步使用。
9. cDNA合成
- 给 PCR 管贴上标签并放在一边。
- 在每个样品的cDNA反应混合物中加入1μgRNA。
- 如cDNA协议所述,将试剂和模板添加到PCR管中。最后将酶加入混合物中。
- 将 PCR 管放在具有以下运行设置的热循环器中:25 °C 时 5 分钟,42 °C 时 40 分钟,85 °C 下 15 分钟,最终保持 4 °C。
- 从热循环器中拆下 PCR 管,立即使用或储存在 -20°C,直到进一步使用。
10. 实时定量 PCR (qPCR) 循环
- 为要分析的每个基因准备一种反应混合鸡尾酒。每个 15 μL PCR 反应需要 7.5 μL 的 2x 试剂混合物、0.75 μL 的 20X 5' -FAM 标记基因特异性底流器/探针,以及 3.75 μL 无核酸酶水。安普利森通常范围从 60-120 bp。
- 将每个实验组的3μLcDNA模板添加到相应的油井中。
- 将12μL的基因特异性反应混合混合物加入适当的井中。
- 用光学胶粘膜盖住板,离心机1分钟,1,000 x g, 以清除在井中可能形成的任何气泡。
- 将 PCR 板放在实时 PCR 热循环器中。
- 将运行方法设置为如下:95 °C 时为 3 分钟,40 个周期为 95 °C,15 秒,然后是 60°C 1 分钟。
- 通过将感兴趣的基因规范化到内部控制,并使用 2-++Ct公式和数字的对数转换来分析受感染样本中与未受感染的控制样本的数据。
11. 肺组织学
- 如上文所述,从新生儿幼崽中去除肺部。
- 将组织放在10%中性缓冲的甲醛体积中,使溶液与组织的比例在3-7天内约为20:1。
- 与适当的组织学服务协调石蜡嵌入、切块、赤氧林和 eosin (H&E) 染色。为这项工作,西弗吉尼亚大学历史学核心被利用。或者,按照前面描述的协议19。
12. 体外细菌杀菌测定
- 如上文所述,从未感染的新生儿幼崽中取出脾脏,并将其放在无菌 60 mm 培养皿内的 40 μm 尼龙篮子中。重复这一点,将水池池化成一根管子,以收获并一起均质。
- 添加 5 mL 的 PBS,辅以 10% FBS。
- 使用无菌 3 mL 注射器柱塞分解组织,直到创建单个细胞悬浮液。
- 收集尼龙篮外的单细胞悬浮液,转移到 15 mL 离心管,以 350 x g 的颗粒细胞进行 5 分钟。
- 将细胞悬浮在红血球解液缓冲液中(2 mL,最多7-8个样本),让它在室温下站立5分钟,以消除红细胞。
- 如上文所述,用 PBS 和颗粒清洗飞溅细胞。
- 根据预期细胞产量,在0.25 mL的PBS中悬浮飞毛细胞,并辅以0.5%BSA和2 mM EDTA。
- 使用血细胞计或其他适当的应用计算血小板。
- 根据制造商协议,用免疫磁珠分离 Ly6B.2= (粒细胞/炎症单核细胞的骨髓体群体) 细胞。
- 种子Ly6B.2– 每井密度为1×105 细胞的细胞,在黑色或白色96井板中,体积为0.1 mL,含有10%FBS、2mM谷氨酰胺和25mM HEPES(完整介质)。
- 列举第 1 节中描述的 生物发光大肠杆菌,并在 0.1 mL 的最终体积内以所需的感染倍数 (MOI) 准备细菌性。这是最好的完成,通过使所有井在一个共同的MOI批量所需的。
- 添加0.1 mL的细菌加入或单独完整培养基作为控制。在37°C和5%CO2下孵育多井板 1小时。
- 用含有根霉素 (100 μg/mL) 的 0.2 mL 新完整介质更换介质,用移液器轻轻去除介质,并添加新移液器尖端的新鲜介质。将培养本再孵育2小时。
- 感染后3小时,使用板读卡器从底部测量盖有培养板每井的发光度,然后将培养本返回孵化。
- 在其他所需时间点重复测量亮度。
结果
该协议诱导新生儿小鼠的细菌败血症,我们使用纵向体内成像,在血液中的细菌枚举,病理学的组织学评估和炎症细胞因子表达配置文件,以研究疾病的过程。在感染大肠杆菌的低(+2 x 106 CCO)和高(+7 x 106 CCO)的新生儿幼崽中观察到发病迹象。 接受较大幼崽的小狗表现出更突出的求救迹象,包括行动不便、无法纠正姿势,以及感染后24小时保持直立姿势的能力受损(hpi)。然而,由于一些幼崽看起来比另一些幼崽更严重,因此出现了一系列发病率。感染后,一只低剂量动物在成像过程中因异氟化物暴露死亡,以建立基线。到24马力,六种高剂量动物中,有两只死于全身感染(死亡率为33.3%)。接受高剂量或低剂量接种的受感染的幼崽体重明显低于其控制垃圾伴侣在24 hpi(图1A,B)。所有接受较高 inolum 的幼崽在 24 hpi 时都符合端点标准。因此,这个群体中所有受感染的幼崽在成像后都被安乐死。血液中的细菌被列举为接受低供血的小鼠的子集,以及所有因被安乐死而接受较高幼崽的动物。两项实验的结果表明,虽然大多数动物血液中的细菌含量(CFUs/mL)在24马力,但有些动物血液中没有可检测到的细菌(图1C)。后者建议,他们清除了感染的时间点。正如所料,接受较高接种的幼崽在24 hpi时比接受低剂量接种的幼崽多三个数量级(图1C)。
发光细菌的活生动物成像进一步证实了细菌的传播和新生儿幼崽的生长在10和24马力基(图2和图3)。此外,使用微CT的病毒内成像,我们能够识别感染源,包括大脑(图2B)、肺(图2B,图3A,B)和其他外围组织(图2B)。一些高度感染的小鼠的肺部表现出与炎症合并一致的不透明区域,这些区域与发光细菌信号共同定化(图3A)。这些假定的炎症性排泄区域在未受感染的对照肺中未发现(图3A)。通过IL-1+、IL-6和TNF-α的基因表达分析,证明了受感染幼崽肺部明显炎症性细胞α。观察到低供细胞和高供产组所有三个细胞因子的表达相对于对控显著增加(图4A)。肺的病理学也检查在24马力在控制和感染的幼崽。尽管类似的炎症细胞因子配置文件,通常观察到病理从低到高的 inulum 的渐进性增加。与未感染对基组织相比,受感染幼崽的肺部有明显的炎症变化,肺叶壁变厚,肺功能出血增加,炎症渗透(图4B)。在最严重的感染中,肺阻塞和出血面积导致露天空间大量减少(图4B)。这些结果共同证明,在我们的新生儿早期败血症模型中,发光细菌的传播可以随着时间的推移从亚细胞接种点到重要的感染源,并在严重感染的动物中引起严重的炎症和病理。
为了研究由先天免疫细胞(如单核细胞、巨噬细胞和中性粒细胞)导致细菌杀菌的宿主因素,我们开发了一种敏感的体外测定法来测量细菌的间隙。Ly6B.2–从新生儿小鼠的血中分离出的细胞在MOIs范围内感染生物发光大肠杆菌1小时,然后用根霉素治疗,以杀死细胞外细菌。在 3、6、20 和 48 hpi 时,使用多模读卡器测量细胞内发光。正如预期的那样,随着MOI的增加,在3小时时记录更多的发光信号(图5)。渐渐地,这个信号丢失了,表示细菌清除(图5)。这种测定可以补充细胞因子,中分效应器,并添加细胞通路药理抑制剂,以研究可能促进细菌清除的干预措施,并改善这里描述的新生儿败血症模型的结果。

图1:败血性新生儿小鼠体重和细菌复制的变化。
(A,B)一组内(低和高)内的单个小鼠重量,以垃圾伴侣控制幼崽平均重量的百分比表示。数据以平均百分比 ± SEM. 每个感染后时间点的个别 t 检验显示,接受低 inoculum(p<0.0001) (A)或接受高幼崽(p =0.0031)(B)的控制幼崽和幼崽之间在 24 小时时存在显著差异。(C) 血液中的CFU/mL在24马力基被日志转换,并呈现为均值± SEM. 曼-惠特尼测试揭示了低剂量和高剂量内分泌(p=0.0882)之间的显著性趋势。 请单击此处查看此图的较大版本。

图2:病毒内成像显示,随着时间的推移,细菌在新生儿小鼠中传播。
(A) 一种具有代表性的新生儿小鼠(#1)感染了+2 x 106 CCU的孵化,在时间0、10和24 hpi时显示。每个时间点将显示具有最小和最大辐射值的色度刻度。0 小时和 10 小时时的实验显示在其时间点刻度和 24 小时刻度上,以演示细菌随时间变化的变化。(B) 显示10和24 hpi下同一只新生儿小鼠的代表性3D重建微CT图像。每个时间点都有位于开销、跨轴和日冕透视的图像。在 24 hpi 的跨轴图像中,平面已向鼠标外围移动,以更好地显示周围组织中的感染源。白色箭头表示大脑和肾脏在 10 hpi, 肾脏和肺在 24 hpi. 请单击此处查看此图的较大版本。
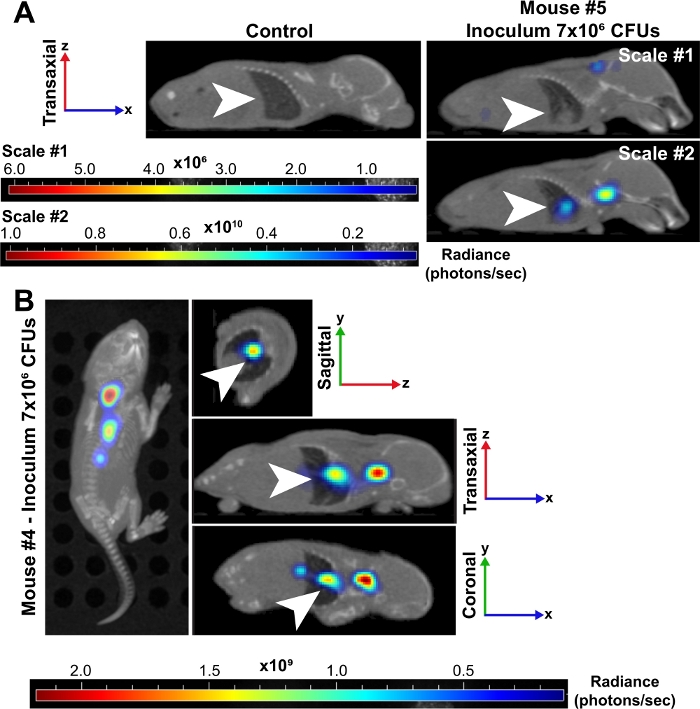
图3:肺是新生儿细菌败血症的主要感染点。
(A) 与未感染的对照组相比,新生儿小鼠 (#5) 的 3D重建微CT图像以 24 hpi 显示。两只小鼠均以转轴透视显示,肺由白色箭头表示。受感染的小鼠被放置在两个辐射(光子/秒)的尺度上。刻度 #1 包括所有 6 个波长(500、520、560、580、600、620 nm),刻度 #2 仅包括 500、520 和 560 nm 波长。第二个比例使我们能够想象肺部细菌中信号的增加,因为较低的波长被组织吸收的更强,并产生更强的信号。(B) 新生儿小鼠 (#4) 感染的 inculum 的 3D 重建微CT 图像显示在 24 hpi。此时间点在头顶、下垂、跨轴和日冕视角有图像。白色箭头表示肺部感染。请单击此处查看此图的较大版本。
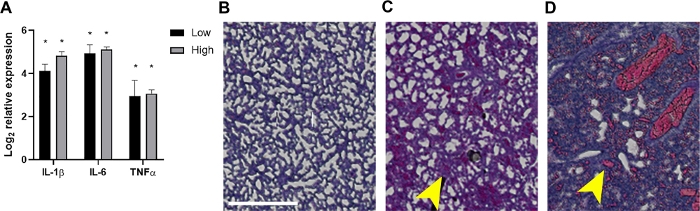
图4:败血症新生儿肺部的炎症及相关组织病理学发现。
在24马力,肺从接受+2×106或 7×106 CFO或未感染的对子的幼崽中采集。(A) RNA被分离,IL-1°、IL-6或TNF-α的表达是使用公式2-+Ct通过定量实时PCR确定与未感染的对联。数据显示为指示中每个 in分的表达式和 sem ±日志2 转换更改。统计显著性是使用单个细胞因子基因和95%置信区间内内部控制之间的+Ct值的未配对t检验确定的。星号表示 p<0.01。(B-D)显示H&E染色肺组织的组织病理学部分(20倍,在剪裁面膜中构建并放大,以进行放大)。。显示来自代表性未受感染对照的肺组织 (B) 或受感染的新生儿在低 (C) 或高 (D) 的内分量。黄色箭头表示肺增厚 (C) 或出血 (D).比例线 = 500 μm。 请单击此处查看此图的较大版本。
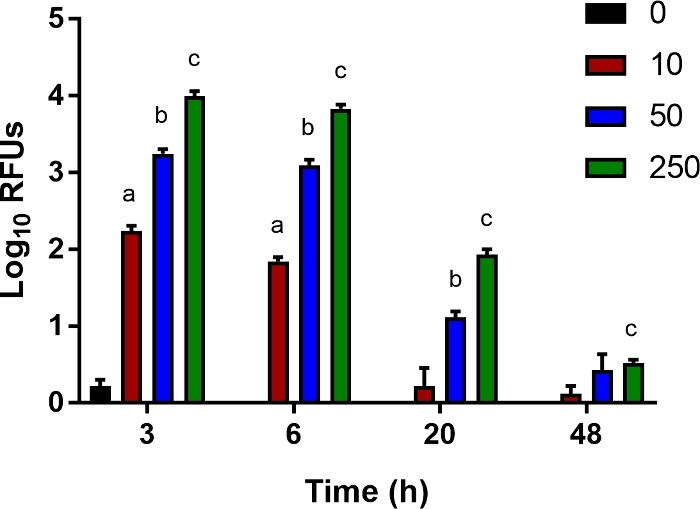
图5:细菌清除的体外测定。
Ly6B.2=细胞从未感染对照新生儿的血红色分离。细胞在96孔板中播种,并感染荧光酶表达大肠杆菌O1:K1:H7在多种感染(MOI)10,50,或250如指示。 1 小时后,介质被含有根霉素 (100 μg/mL) 的新鲜介质所取代。显示了代表多个实验的单个实验±相对光单位 (RLU) 和 SE。95% 置信区间的统计显著性是使用与韦尔奇修正的未配对 t 测试确定的;星号表示p<0.05。请单击此处查看此图的较大版本。
讨论
我国诱导新生儿小鼠细菌败血症的亚帽感染模型是实时研究细菌病原体纵向传播的一种新方法。病毒内成像为探索新生儿中细菌实时传播提供了机会。这对于了解细菌传播的动力学和进一步研究宿主反应和疾病适当阶段的损伤至关重要。小鼠幼崽被施用皮下,下皮注射细菌性结节。这种注射技术比其他常用的替代品(如尾静脉和内皮内感染)更简单,因为它在注射部位内需要的精度较低。考虑到幼崽的体型较小,这一点很重要。病毒内成像允许对细菌增殖和传播到周围组织和中枢神经系统的纵向评估,而无需牺牲动物。类似的成像方法和技术已被用于癌症生物学和转移20,21的研究。此外,虽然另一项研究引用了在22日新生儿感染大肠杆菌时使用生物发光成像的方法,但在这里,我们应用了新生儿小鼠的方法,其中我们的方法允许评估穆林败血症期间的细菌动力学。细菌的可视化基于动物内部细菌不同波长的生物发光光(例如细菌荧光酶活性)的发射。然后,通过冷却带电耦合设备 (CCD) 摄像机进行生物发光可视化。然后,生成的可视化生物发光可以重建为 3D 图像,显示动物内部细菌的时空依赖效应。对于一个补充的,更微妙的数据采集层,通过尾部纹身成功识别动物,可以跨时间对单个幼崽进行重复测量评估,并识别给定实验组中可能的异常值。
所述模型最成功的应用需要准确制备细菌的内分。在这里,我们描述一个优化的细菌制备方法,使用预先建立和 验证的 大肠杆菌生长曲线,减少靶点和实际内分体之间的变异。这允许在预定的内分中进行实验可重复性。在我们的模型中包括两个接种,证明了血液C扑、死亡率和肺病理学的剂量依赖结果。然而,疾病轨迹的某些方面与剂量没有相关。在受感染的动物中,体重增加的失败并不依赖于24hpi的幼崽。此外,在肺部观察到类似的炎症细胞因子表达水平,以回应两种内分泌的感染。这种模式是否会在观察到细菌的所有组织中复制,如肾脏、肝脏、脾脏和大脑,仍有待确定。除败血症外, 大肠杆菌 O1:K1:H7与23新生儿脑膜炎有关。当来自外围的细菌侵入并穿透血脑屏障时,这种脑部感染就发生。未来的研究将探索该模型的这一方面,通过分析紧密结点蛋白表达的变化,以及测试不同范围的细菌内分泌。在病毒内成像期间,额外的修改包括添加一个奇异的棉球,用异氟化物,在成像过程中放置在距离小鼠约2-3英寸的地方。针对之前的实验,新生儿幼崽在成像过程中恢复了知觉,防止了准确的图像采集,我们现在将棉球靠近小鼠,使它们在成像过程中持续麻醉。然而,重要的是,这是不要做这么近,他们不能从麻醉恢复。
虽然对于研究各种动物和疾病模型中不同细菌的动力学是灵活和容易适应的,但我们的协议有一些局限性需要考虑。需要考虑的第一个限制是,感染的亚帽途径并不反映自然的传播途径。然而,从一开始就开发我们的模型的主要目标是建立一种易于重复的交付模式,可用于建立一种系统感染,复制人类疾病的各个方面。因此,在这份报告中,我们描述了人类早期发病败血症综合征的模型,而不是自然传播的模型。新生儿大鼠的口腔分娩模式可以复制人类常见传播的某些方面,例如大肠杆菌感染在输液管中的初始殖民化,以及随后传播到血液和周围组织,包括大脑22。由Witcomb及其同事建立的模型还包括生物致发光大肠杆菌和病毒内成像。此外,在不影响技术精度和精度的情况下,尽可能减少异氟素暴露,以及注射、尾部纹身和处理幼崽,以努力减轻新生儿和水坝的压力水平,这一点至关重要。在某些情况下,如果幼崽经历增强的人类诱导和/或实验操作,水坝可以停止护理和照顾幼崽,导致与感染无关的生存率下降。同样,在成像期约10分钟后长时间接触异氟的幼崽死亡风险增加;因此,必须提供足够足够的异氟烷来充分麻醉小鼠,但不足以对它们进行安乐死。最后一点考虑是敏感性的极限。根据成像软件3中使用的缩放方法,对记录下来的发光信号落在可检测范围的低端的大肠杆菌进行统计的组织。因此,一些组织可能殖民与低水平的细菌,但出现没有明显的生物发光。
目前,大多数研究都使用成人细菌传播的方法,如新生儿的内皮内酮(即)和尾静脉注射。Pluschke和Pelkonen通过第一、尾静脉和口腔感染24分析了大肠杆菌K1对新生儿小鼠的影响。这项研究表明,免疫缺陷小鼠的不同基因型更容易受到K1菌株的影响;然而,宿主对感染的免疫反应以及细菌传播机制的许多方面都未得到解决。德什穆赫及其同事用大肠杆菌K1或K.肺炎在内感染新生儿小鼠,并在72马力25测量脾脏和肝脏中的CCO。这项研究还根据小鼠对抗生素的暴露前,分析了宿主对感染反应的某些方面。然而,对细菌传播到周围组织和血液的彻底调查,以及同一组织(粒体细胞增多症以外的)的炎症性分析,并没有得到解决。其他研究对小鼠的新生儿败血症与金黄色葡萄球菌,金黄色葡萄球菌表皮,B组链球菌和大肠杆菌探索宿主免疫系统的不同方面,以回应感染。然而,这些研究都没有利用病毒内成像来探索细菌传播或感染源23、25、26、27的定位动力学。我们的感染和病毒内成像方法,结合细菌负担评估和周围组织的炎症分析,使我们能够全面检查感染期间的宿主和病原体的各个方面,从而更准确地了解败血症期间的宿主-病原体相互作用。
我们打算利用这种感染和成像模型,以进一步了解早期发作的新生儿败血症使用各种致病细菌通常负责败血症的新生儿,包括B组链球菌,K.pneuomoniae,和李斯特菌单细胞基因。这种感染模型将使我们能够纵向比较不同细菌病原体的传播与新生儿宿主反应的平行传播。此外,该模型还可适应特定(荧光结合)免疫细胞类型的采用转移,以研究它们向感染点的迁移以及随后对宿主反应和细菌控制的影响。这允许人们有机会以以前没有证明的方式更好地了解早期败血症期间发生的宿主-病原体相互作用。
披露声明
作者没有利益冲突要披露。
致谢
这项工作得到了C.R..M的支持。
材料
| Name | Company | Catalog Number | Comments |
| 1 mL Insulin Syringe | Coviden | 1188128012 | Inoculum or PBS injection |
| 10% Neutral Buffered Formalin | VWR | 89370-094 | Histopathology |
| ACK Lysis Buffer | Gibco | LSA1049201 | Bacterial clearance assay |
| Animal Tattoo Ink Paste | Ketchum | KI1482039 | Animal identification |
| Animal Tattoo Ink Green Paste | Ketchum | KI1471039 | Animal identification |
| Anti-Ly-6B.2 Microbeads | Miltenyi Biotec | 130-100-781 | Cell isolation |
| Escherichia coli O1:K1:H7 | ATCC | 11775 | |
| Escherichia coli O1:K1:H7-lux (expresses luciferase) | N/A | N/A | Constructed in-house at WVU |
| E.Z.N.A. HP Total Extraction RNA Kit | Omega Bio-tek | R6812 | RNA extration |
| DPBS, 1X | Corning | 21-031-CV | |
| Difco Tryptic Soy Agar | Becton, Dickinson and Company | 236950 | Bacterial growth |
| IL-1 beta Primer/Probe (Mm00434228) | Thermo Fisher Scientific | 4331182 | Cytokine expression qPCR |
| IL-6 Primer/Probe (Mm00446190) | Thermo Fisher Scientific | 4331182 | Cytokine expression qPCR |
| iQ Supermix | Bio-Rad | 1708860 | Real-time quantitative PCR |
| iScript cDNA Synthesis Kit | Bio-Rad | 1708891 | cDNA synthesis |
| Isolation Buffer | Miltenyi Biotec | N/A | Bacterial clearance assay |
| IVIS Spectrum CT and Living Image 4.5 Software | Perkin Elmer | N/A | Intravital imaging |
| LB Broth, Lennox | Fisher BioReagents | BP1427-500 | Bacterial growth |
| EASYstrainer (Nylon Basket) | Greiner Bio-one | 542 040 | Cell strainer |
| SpectraMax iD3 | Molecular Devices | N/A | Plate reader |
| Pellet Pestle Motor | Grainger | 6HAZ6 | Tissue homogenization |
| Polypropylene Pellet Pestles | Grainger | 6HAY5 | Tissue homogenization |
| Prime Thermal Cycler | Techne | 3PRIMEBASE/02 | cDNA synthesis |
| TNF-alpha Primer/Probe (Mm00443258) | Thermo Fisher Scientific | 4331182 | Cytokine expression qPCR |
| TriReagent (GTCP) | Molecular Research Center | TR 118 | RNA extration |
参考文献
- Qazi, S. A., Stoll, B. J. Neonatal sepsis: a major global public health challenge. Pediatr Infect Dis J. 28, 1-2 (2009).
- Simonsen, K. A., Anderson-Berry, A. L., Delair, S. F., Davies, H. D. Early-onset neonatal sepsis. Clinical Microbiology Reviews. 27 (1), 21-47 (2014).
- Seman, B. G., et al. Elevated levels of interleukin-27 in early life compromise protective immunity in a mouse model of Gram-negative neonatal sepsis. Infections and Immunity. , (2019).
- Schrag, S. J., et al. Epidemiology of Invasive Early-Onset Neonatal Sepsis, 2005 to 2014. Pediatrics. 138 (6), 20162013(2016).
- Stoll, B. J., et al. Early onset neonatal sepsis: the burden of group B Streptococcal and E. coli disease continues. Pediatrics. 127 (5), 817-826 (2011).
- Weston, E. J., et al. The burden of invasive early-onset neonatal sepsis in the United States, 2005-2008. Pediatrics and Infectious Disease Journal. 30 (11), 937-941 (2011).
- Hornik, C. P., et al. Early and late onset sepsis in very-low-birth-weight infants from a large group of neonatal intensive care units. Early Human Development. , Suppl 2 69(2012).
- Vergnano, S., Sharland, M., Kazembe, P., Mwansambo, C., Heath, P. T. Neonatal sepsis: an international perspective. Archives of Disease in Childhood: Fetal and Neonatal Edition. 90 (3), 220-224 (2005).
- Kraft, J. D., et al. Neonatal macrophages express elevated levels of interleukin-27 that oppose immune responses. Immunology. 139 (4), 484-493 (2013).
- Basha, S., Surendran, N., Pichichero, M. Immune responses in neonates. Expert Reviews of Clinical Immunology. 10 (9), 1171-1184 (2014).
- Gleave Parson, M., et al. Murine myeloid-derived suppressor cells are a source of elevated levels of interleukin-27 in early life and compromise control of bacterial infection. Immunology and Cell Biology. 97 (5), 445-446 (2018).
- Adkins, B., Leclerc, C., Marshall-Clarke, S. Neonatal adaptive immunity comes of age. Nature Reviews Immunology. 4 (7), 553-564 (2004).
- Kim, S. K., Keeney, S. E., Alpard, S. K., Schmalstieg, F. C. Comparison of L-selectin and CD11b on neutrophils of adults and neonates during the first month of life. Pediatrics Research. 53 (1), 132-136 (2003).
- Velilla, P. A., Rugeles, M. T., Chougnet, C. A. Defective antigen-presenting cell function in human neonates. Clinical Immunology. 121 (3), 251-259 (2006).
- Le Garff-Tavernier, M., et al. Human NK cells display major phenotypic and functional changes over the life span. Aging Cell. 9 (4), 527-535 (2010).
- Weinberger, B., et al. Mechanisms underlying reduced responsiveness of neonatal neutrophils to distinct chemoattractants. Journal of Leukocyte Biology. 70 (6), 969-976 (2001).
- Gabrilovich, D. I., Nagaraj, S. Myeloid-derived suppressor cells as regulators of the immune system. Nature Reviewss Immunology. 9 (3), 162-174 (2009).
- National Research Council. Guide for the care and use of laboratory animals, 8th ed. , National Academies Press. Washington, DC. (2011).
- Tucker, D. K., Foley, J. F., Bouknight, S. A., Fenton, S. E. Sectioning Mammary Gland Whole Mounts for Lesion Identification. Journal of Visualized Experiments. (125), e55796(2017).
- Bayarmagnai, B., Perrin, L., Esmaeili Pourfarhangi, K., Gligorijevic, B. Intravital Imaging of Tumor Cell Motility in the Tumor Microenvironment Context. Methods in Molecular Biology. 1749, 175-193 (2018).
- Beerling, E., Ritsma, L., Vrisekoop, N., Derksen, P. W., van Rheenen, J. Intravital microscopy: new insights into metastasis of tumors. Journal of Cell Science. 124, Pt 3 299-310 (2011).
- Witcomb, L. A., Collins, J. W., McCarthy, A. J., Frankel, G., Taylor, P. W. Bioluminescent Imaging Reveals Novel Patterns of Colonization and Invasion in Systemic Escherichia coli K1 Experimental Infection in the Neonatal Rat. Infection and Immunity. 83 (12), 4528(2015).
- Singh, K., et al. Inter-alpha inhibitor protein administration improves survival from neonatal sepsis in mice. Pediatric Research. 68 (3), 242-247 (2010).
- Pluschke, G., Pelkonen, S. Host factors in the resistance of newborn mice to K1 Escherichia coli infection. Microb. Patho. , 93-102 (1988).
- Mancuso, G., et al. Role of interleukin 12 in experimental neonatal sepsis caused by group B streptococci. Infections and Immunity. 65 (9), 3731-3735 (1997).
- Thammavongsa, V., Rauch, S., Kim, H. K., Missiakas, D. M., Schneewind, O. Protein A-neutralizing monoclonal antibody protects neonatal mice against Staphylococcus aureus. Vaccine. 33 (4), 523-526 (2015).
- Andrade, E. B., et al. TLR2-induced IL-10 production impairs neutrophil recruitment to infected tissues during neonatal bacterial sepsis. Journal of Immunology. 191 (9), 4759-4768 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。