Method Article
Um modelo de imagem neonatal de sepse bacteriana gram-negativa
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
A infecção de camundongos neonatais com bioluminescente E. coli O1:K1:H7 resulta em uma infecção séptica com inflamação pulmonar significativa e patologia pulmonar. Aqui, descrevemos procedimentos para modelar e estudar mais a sepse neonatal utilizando imagens intravitais longitudinais em paralelo com a enumeração de cargas bacterianas sistêmicas, perfil inflamatório e histopatologia pulmonar.
Resumo
Os recém-nascidos têm um risco aumentado de sepse bacteriana devido ao perfil imunológico único que apresentam nos primeiros meses de vida. Estabelecemos um protocolo para estudar a patogênese de E. coli O1:K1:H7, um sorotipo responsável pelas altas taxas de mortalidade em recém-nascidos. Nosso método utiliza imagens intravitais de filhotes neonatais em diferentes momentos durante a progressão da infecção. Essa imagem, paralelamente pela medição de bactérias no sangue, perfil inflamatório e histopatologia tecidual, significa uma abordagem rigorosa para entender a dinâmica da infecção durante a sepse. No relatório atual, modelamos dois inóculos infecciosos para comparação de cargas bacterianas e gravidade da doença. Descobrimos que a infecção subescapular leva à infecção disseminada por 10h após a infecção. Às 24 horas, a infecção da E. coli luminescente era abundante no sangue, pulmões e outros tecidos periféricos. A expressão de citocinas inflamatórias nos pulmões é significativa às 24h, sendo seguida por infiltração celular e evidência de danos teciduais que aumentam com a dose infecciosa. A imagem intravital tem algumas limitações. Isso inclui um limiar de sinal luminescente e algumas complicações que podem surgir com recém-nascidos durante a anestesia. Apesar de algumas limitações, descobrimos que nosso modelo de infecção oferece uma visão para entender a dinâmica da infecção longitudinal durante a sepse murina neonatal, que não foi completamente examinada até o momento. Esperamos que este modelo também possa ser adaptado para estudar outras infecções bacterianas críticas durante o início da vida.
Introdução
A sepse bacteriana é uma preocupação significativa para os recém-nascidos que exibem um perfil imunológico único nos primeiros dias de vida que não fornece proteção adequada contra infecção1. A sepse neonatal continua a ser um problema significativo de saúde nos EUA, representando mais de 75.000 casos anualmente apenas nos EUA2. Para estudar essas infecções em profundidade, novos modelos animais que recapitulam aspectos da doença humana são necessários. Estabelecemos um modelo de infecção por camundongos neonatais usando Escherichia coli, O1:K1:H73. E. coli é a segunda principal causa de sepse neonatal nos EUA, mas responsável pela maioria da mortalidade associada à sepse4,5. No entanto, é a principal causa quando os bebês pré-termo e muito baixo peso ao nascer (VLBW) são considerados independentemente5. O sorotipo K1 é mais frequentemente associado com infecções invasivas da corrente sanguínea e meningite em recém-nascidos6,7. Atualmente, não há outras opções de tratamento além de antibióticos e cuidados de apoio. Enquanto isso, as taxas de resistência a antibióticos continuam a aumentar para muitas bactérias patogênicas, com algumas cepas de E. coli resistentes a uma infinidade de antibióticos comumente usados no tratamento8. Assim, é imprescindível que continuemos a gerar métodos para estudar os mecanismos da sepse e a resposta do hospedeiro em recém-nascidos. Esses resultados podem ajudar a melhorar os tratamentos atuais e os desfechos de infecção.
O estado imunológico dos recém-nascidos é caracterizado por diferenças fenotípicas e funcionais em comparação com os adultos. Por exemplo, níveis elevados de citocinas anti-inflamatórias e regulatórias, como a interleucina (IL)-10 e IL-27, mostraram-se produzidas por macrófagos derivados do sangue do cordão umbilical e estão presentes em níveis maiores no soro dos recém-nascidos murinos9,10,11. Isso é consistente com níveis mais baixos de IFN-α, IFN-ɣ, IL-12 e TNF-α que são frequentemente relatados a partir de células neonatais em comparação com as contrapartes adultas10. Além disso, o sistema imunológico neonatal é inclinado para uma resposta celular T Th2 e regulamentar em comparação com adultos12. Números elevados de neutrófilos, células T, células B, células NK e monócitos também estão presentes em recém-nascidos, mas com prejuízos funcionais significativos. Isso inclui defeitos na expressão de marcadores de superfície celular e apresentação de antígeno que sugerem imaturidade13,14,15. Além disso, os neutrófilos neonatais são significativamente deficientes em sua capacidade de migrar para fatores quimotacticos16. As células supressoras derivadas de meloides (MDSCs) também são encontradas em níveis elevados em recém-nascidos e recentemente mostradas como fonte de IL-2711. Os MDSCs são altamente supressivos em relação às célulasT 17. Coletivamente, esses dados demonstram limitações na imunidade neonatal que dão ao aumento da suscetibilidade à infecção.
Para estudar a progressão da carga bacteriana e dissecar as respostas imunes protetoras durante a sepse neonatal, desenvolvemos um novo modelo de infecção. Camundongos neonatais nos dias 3-4 da vida são difíceis de injetar no espaço intraperitoneal ou veia da cauda. Em nosso modelo, dia 3 ou 4 filhotes são administrados o inóculo bacteriano ou PBS subcutâneamente na região escárcula. Uma infecção sistêmica desenvolve-se e utilizando e. coli luminescente O1:K1:H7, podemos imagem longitudinalmente de camundongos neonatais individuais para seguir a carga bacteriana disseminada em tecidos periféricos. Este é o primeiro modelo relatado para utilizar imagens intravitais para entender a cinética da disseminação de bactérias durante a sepse em recém-nascidos murinos3.
Aqui, descrevemos um protocolo para induzir infecções sépticas de E. coli em camundongos neonatais3. Descrevemos como preparar o inóculo bacteriano para injeção, e como colher tecido para avaliação da patologia, medição de marcadores inflamatórios por análise de expressão genética e enumeração da carga bacteriana. Além disso, também é descrito o uso de E. coli luminescente para imagens intravitais de recém-nascidos infectados e quantificação da matança bacteriana por células imunes neonatais. Esses protocolos também podem ser adaptados para estudar outras infecções bacterianas importantes em recém-nascidos. Os dados aqui apresentados representam uma nova abordagem geral para a compreensão da dinâmica da infecção em um modelo de sepse neonatal traduzível.
Protocolo
Todos os procedimentos foram aprovados pelos Comitês Institucionais de Atenção e Uso de Animais da Virgínia Ocidental e realizados de acordo com as recomendações do Guia de Cuidado e Uso de Animais de Laboratório pelo Conselho Nacional de Pesquisa18.
1. Preparação do Inóculo Bacteriano
- Listrar uma placa de ágar de soja tripptic (TSA) com um laço inoculante para isolamento de uma única colônia de um estoque congelador de E. coli O1:K1:H7-lux que expressa a luciferase e carrega resistência à kanamicina3. Incubar durante a noite a 37 °C.
- No dia seguinte, permita que o caldo de Luria (LB) chegue à temperatura ambiente (25 °C) em um armário de biossegurança.
- Sob um capuz de armário de biossegurança, identifique uma única colônia a partir da placa listrada e inocula-a em 3 mL de LB complementada com kanamicina (30 μg/mL). Incubar durante a noite a 37 °C com agitação (220 rpm). Esta é a cultura inicial.
- Diluir a cultura inicial 1:100 em um fresco 3 mL de LB sob um capô de armário de biossegurança e devolvê-lo à incubadora por 2-3 h a 37 °C com agitação (220 rpm). Esta é a cultura das ações.
- Leia a densidade óptica (OD) da cultura em branco e do estoque a 600 nm usando um espectrômetro. Adicione 100 μL de LB (sem bactérias) em um poço de uma placa de ensaio inferior bem plana; este é o vazio. Em seguida, adicione 100 μL da cultura de estoque a um poço separado. Repita para duas réplicas adicionais. A absorvência é lida usando um leitor de placas.
- Subtraia a absorvância em branco do valor de absorção da cultura de estoque (o valor de OD) e compare a uma curva de crescimento previamente gerada e validada para determinar uma aproximação da densidade bacteriana na cultura do estoque para a preparação de dose infecciosa.
- Gerar inóculos de alvo dependendo da questão da pesquisa. Foram utilizadas para este estudo inóculo-alvo de 2 x10 6 (baixo) e 7 x 106 (alta) unidades formadoras de colônias (CFUs) por rato (/mouse).
- Divida a dose alvo por camundongo (DoseT) pela concentração estimada de bactérias na cultura do estoque (Estoque) para obter o volume de bactérias necessárias do tubo de estoque (VS).
- Multiplique VS pelo número de camundongos (NM) que precisam ser infectados junto com o suficiente para 5-10 extras para a quantidade total de bactérias necessárias para a infecção mais 5-10 doses adicionais. Remova este volume do tubo de estoque e adicione-o a um novo tubo de centrífuga.
- Use a equação abaixo:
DoseT/Estoque = VS x NM = volume total (VT) de bactérias a serem removidas do tubo de estoque.
- Centrifugar a bactéria a 2.000 x g por 5 min a 4 °C e resuspensar a pelota bacteriana em 50 μL de PBS (pH 7.2-7.6) por rato a ser infectado (por exemplo, para 10 doses de 2 x 106 bactérias cada dose, a pelota de 2 x 107 bactérias seria resuspendida em 500 μL PBS). Mais uma vez, recomenda-se preparar mais inóculo do que o necessário. Prepare um volume igual de PBS apenas para inoculações de controle. Mantenha o controle infeccioso de inóculo e PBS no gelo até a infecção.
- Realize sete diluições de série dez vezes em PBS em uma placa de diluição de fundo de plástico de 96 poços, e placa 25 μL das diluições em duplicação em placas TSA quadrantes suplementadas com kanamicina (30 μg/mL) para enumerar a quantidade real de bactérias administradas. Incubar a 37 °C durante a noite para formação de colônias antes da enumeração.
2. Identificação animal
- Organize um número suficiente de pares de reprodução de modo que as ninhadas possam ser sincronizadas para filhotes com correspondência etária. A variabilidade etária de ± 1 dia é aceitável.
- Identifique um camundongo fêmea C57BL/6 grávida e monitore para o nascimento da ninhada antes do experimento planejado para determinar com precisão a idade.
- Para distinguir entre controle e filhotes infectados de 3 ou 4 dias, use um par de tesouras de íris pequenas, de ponta fina para cortar as extremidades das caudas apenas dos filhotes de controle. Os filhotes infectados não recebem cortes de cauda. Antes de cortar a cauda, desinfete a pele com uma bola de algodão torcida em 70% de etanol. Aplique pressão na extremidade da cauda com uma bola de algodão ou gaze conforme necessário.
NOTA: Este procedimento é realizado sob um capô de armário de biossegurança. Um corte de cauda de aproximadamente 1/8 de polegada é suficiente. - Para identificar filhotes dentro dos grupos de controle e infectados, use uma seringa de insulina de 1 mL com uma agulha permanente de 28 G x 1/2'' para tatuar as caudas dos filhotes. Antes de tatuar, desinfete a pele com uma bola de algodão torcida em 70% de etanol. Este procedimento é realizado sob um capuz de armário de biossegurança.
- Para tatuar a cauda, aplique tinta de tatuagem animal na ponta da agulha. Em seguida, contenha cuidadosamente o filhote com uma mão, com a cauda totalmente exposta. Insira suavemente a agulha sob a pele, mantendo um nível superficial de profundidade, e mova a agulha paralelamente com a pele alguns milímetros até que uma pequena marcação, ou ponto, tenha sido criada. Espere alguns segundos antes de remover lentamente a agulha debaixo da pele, para evitar o excesso de tinta liberada sob a pele.
- Aplique pressão na ferida com uma bola de algodão ou gaze conforme necessário. Remova o excesso de tinta de tatuagem na superfície da pele com 70% de etanol.
- Repita este processo com camundongos subsequentes nos grupos infectados e de controle, enquanto adiciona um ponto adicional a cada filhote sucessivo tatuado (por exemplo, o filhote 1 terá 1 ponto na cauda, o filhote 2 terá dois pontos na cauda, etc.).
NOTA: Para uma camada adicional de identificação, recomenda-se usar cores separadas de tinta de tatuagem animal para o controle e grupos infectados.
3. Inoculação subscapular
NOTA: Para este estudo, foram realizados 2 experimentos com um grupo de baixa dose e alta dose designado para cada experimento. No primeiro experimento, 7 filhotes receberam a baixa dose inóculo (4 filhotes foram usados como controles), e 5 filhotes de uma ninhada separada receberam a alta dose (3 filhotes foram usados como controles). Os filhotes do experimento 1 forneceram dados para apenas o ponto de tempo de 24 horas. No segundo experimento, 8 filhotes receberam a baixa dose inóculo (2 filhotes foram usados como controles), e 6 filhotes receberam a alta dose de inóculo (2 filhotes foram usados como controles). Filhotes do experimento 2 forneceram dados para os pontos de tempo de 0, 10 e 24 horas.
- Filhotes de idade ≤ 1 dia. Atribua cada ninhada como uma dose baixa ou uma ninhada de alta dose. Dentro de uma ninhada aleatoriamente atribui filhotes como um controle ou filhote infectado.
- No dia 3 ou 4 pós-natal, regiscões recordes de todos os filhotes antes da inoculação com E. coli-lux ou controle PBS. Separe a represa dos filhotes durante este tempo para garantir que eles não sejam movidos durante a infecção.
- Dentro de um armário de biossegurança usando uma agulha de insulina, aspirar pbs ou o E. coli-lux inóculo. Para este trabalho foram utilizados inóculos de 2 x 106 e 7 x 106 CFUs por mouse. Mantenha tanto o inóculo infeccioso quanto o PBS no gelo até a administração através da injeção subescapular.
- Coloque o recém-nascido em uma superfície limpa na capa do armário de biossegurança e levante a pele na nuca como se para esfolar o filhote.
- No espaço agora criado entre a pele e o músculo do animal, insira a agulha, bisbida para cima, logo abaixo da pele e injete 50 μL de PBS ou E. coli-lux. Solte simultaneamente a porção beliscada da pele para evitar o fluxo de injeção.
- Remova a agulha lentamente e com cuidado. Coloque os filhotes de volta com barragens depois que as injeções estiverem terminadas.
NOTA: Devido ao seu estágio anatômico em desenvolvimento, é tecnicamente desafiador administrar uma veia da cauda ou injeção intraperitoneal para filhotes neonatais no dia 3-4. Assim, a rota de infecção subscapular foi escolhida para este estudo devido à facilidade de execução.
4. Avaliação dos critérios de doença e endpoint
- Monitore os filhotes duas vezes ao dia durante a duração da infecção. Note qualquer anormalidade na aparência.
- Recorde de pesos como medida objetiva de morbidade.
- Além das mudanças de peso, teste a capacidade dos filhotes de se corrigirem posicionando o recém-nascido no lado dorsal. Animais doentes não poderão se virar para o lado ventral e para os pés ou completarão esta ação com dificuldade.
- Verifique a seguir para marcar os animais próximos aos critérios de ponto final: menos de 85% do peso corporal normal; diminuição do movimento e incapacidade de se corrigir; descoloração da pele e uma aparência mais cinza ou transparente em oposição ao rosa; sentindo-se frio ao toque, indicativo de diminuição da temperatura corporal e hematomas hemorrágicos ao longo dos lados, também indicativo de doença avançada.
NOTA: Se os recém-nascidos não conseguiram ganhar peso ao longo de dois dias e se encaixam em qualquer uma das descrições nas etapas 4.4, eles atenderam aos critérios de ponto final. Os filhotes que recebem a alta dose geralmente atendem aos critérios de ponto final até 24 horas. Os filhotes de controle dentro das ninhadas de baixa e alta dose serão eutanizados ao mesmo tempo para permitir a análise comparativa entre o controle e os grupos experimentais. Vá para a seção de eutanásia abaixo.
5. Imagem in vivo de carga bacteriana
- Use um imager microCT e um software para imagens e análises subsequentes.
NOTA: A cor da pele do filhote não afeta a qualidade da imagem. - Coloque a gaiola com camundongos neonatais infectados por E. coli-luxe a barragem em uma coifa de fluxo de nível BSL-2. Remova os ratos para serem imagens e coloque em uma câmara de isoflurane transparente dentro do capô. Recomenda-se começar com controles não infectados para medir a quantidade de isoflurane necessário.
- Abra o software no computador conectado ao microCT. Inicialize o sistema e aguarde que a temperatura do CCD seque a -90 °C.
- Ligue o vaporizador isoflurane e ajuste o mostrador para 5% de fluxo isoflurane. Mantenha os ratos na câmara com esta mistura de isoflurane por 20-30 s até que eles parem de se mover; podem ser necessários tempos de exposição de anestesia mais longos ou mais curtos para alguns camundongos. Uma vez que os ratos param de se mover, eles são suficientemente anestesiados, e podem ser imagens.
- Mova os ratos para a câmara de imagem microCT e coloque-os na caixa de imagem na posição propensa, com narizes voltados perpendiculares para cones do nariz. Use cera dentária para conter suavemente os pés na caixa de imagem para limitar qualquer movimento. Até 4 camundongos neonatais podem ser imagens por vez.
- Abaixe o vaporizador isoflurane para 2-4% de fluxo para manter os ratos anestesiados durante a imagem. Feche a porta da câmara de imagem microCT. Verifique os ratos alguns segundos depois. Se eles começarem a se mover, desistam de uma bola de algodão em isoflurane e segure-a no nariz do animal movendo-se por 5 segundos para anestesiar. Mantenha a bola de algodão perto dos animais durante a imagem. Tenha cuidado para não anestesiar demais e acabar com os ratos.
- Usando o software, escolha a opção Luminescent para imagem. Use um filtro de excitação definido para bloquear e o filtro de emissão definido para abrir, 500 nm, 520 nm, 560 nm, 580 nm, 600 nm e 620 nm. Haverá sete filtros totais de emissão definidos para luminescência.
- Imagem dos ratos em cada ponto de tempo (0, 10 e 24 h pós-infecção [hpi]) e salve todas as imagens em uma pasta para cada ponto de tempo. Devolva os filhotes para a gaiola com a represa e verifique se todos os filhotes se recuperaram da anestesia.
- Para analisar imagens 2D, abra imagens no software. Mudar unidades para Radiance (fótons); isso se transformará no Fluxo Total (fótons/segundo).
- Apenas analise um conjunto de imagens com seus múltiplos filtros de emissão por vez. A partir de cada conjunto de imagens, anote os valores mínimos e máximos de brilho localizados no canto inferior direito de cada imagem (por exemplo, se houver 7 filtros de emissão, haverá 7 imagens, e 7 valores mínimos e máximos). Repita para cada conjunto de imagens a ser comparado.
- Para determinar uma escala que englobará os valores e a luminescência de todas as imagens, localize o menor valor mínimo e o maior valor máximo para cada conjunto de imagens. Para este estudo, as imagens do filtro Aberto foram utilizadas como representativas.
- Destaque e abra a imagem escolhida para alterar a escala. Na Paleta de ferramentas,clique na guia Ajustar a imagem e altere a Escala de cores para os menores valores mínimos e mais altos máximos identificados anteriormente. Salve cada conjunto de imagens como um TIFF. Analise individualmente cada ponto de tempo desta maneira para garantir que a escala correta seja exibida.
- Para quantificar o fluxo total (quantidade de sinal luminescente por mouse) para cada mouse individual, abra uma imagem como descrito anteriormente na etapa 5.9-5.10. Abra a guia Ferramentas do ROI na Paleta de ferramentas e selecione a ferramenta círculo. Escolha 1 círculo se analisar uma área de luminescência.
- Mova o ROI para sobreposição na área de luminescência. Ajuste o tamanho do ROI, se necessário.
NOTA: Se for necessário o ajuste, ajuste os ROIs em outras imagens comparativamente para manter a consistência. Escolha A medida ROIs. A janela de medições do ROI abrirá exibindo Fluxo Total (p/s), Radiance médio (p/s/cm2/sr), Desvio Padrão de Radiance, Radiance Mínimo e Radiance Máxima. - Regissão total do fluxo para cada conjunto de imagens. Este número é a quantidade quantificada de luminescência no mouse em imagens 2D.
- Para fazer imagens microCT reconstruídas em 3D, abra o painel de reconstrução 3D DLIT na Paleta de ferramentas e verifique todos os comprimentos de onda a serem incluídos na guia Analisar. Selecione Reconstruir.
6. Eutanásia
- Preparar e rotular tubos para tecidos/órgãos de interesse para necropsia e aplicações adequadas a jusante.
- Separe os recém-nascidos da represa em um armário de biossegurança.
- Mergulhe uma bola de algodão em isoflurane de grau veterinário e coloque dentro de uma câmara de contenção transparente.
- Se coletar sangue, prepare uma micropipette P200 com uma ponta e tenha um tubo de 1,5 mL com 10 μL de 5 mM EDTA como anticoagulante. Um volume de 50-200 μL de sangue é esperado.
- Coloque um recém-nascido na câmara e monitore o filhote até que ele fique imóvel.
- Rapidamente, remova o recém-nascido e decapite com uma tesoura. Se for permitido respirar ar fresco por um período prolongado, o filhote pode recuperar a consciência. Os recém-nascidos reduziram a capacidade pulmonar em relação aos camundongos adultos e, portanto, não respiram profundamente o suficiente para a eutanásia apenas por isoflurane.
- Coletar sangue do tronco na base da cabeça usando uma micropipette P200. Para maximizar a quantidade de sangue coletada, realize esta etapa o mais rápido possível após a decapitação. Enumerar bactérias no sangue por diluição serial e contagem de placas padrão, conforme descrito na etapa 1.9.
- Esterilize todo o recém-nascido com 70% de etanol antes da excisão de amostras de tecido.
7. Colheita de tecidos
- Dentro de um armário de biossegurança, douque o recém-nascido com 70% de etanol para evitar contaminação. Coloque o animal do lado direito.
- Usando fórceps, segure a pele em um ponto entre o abdômen e a perna esquerda traseira e faça uma incisão com uma tesoura cirúrgica de ponta fina. Continue a cortar a pele para cima em direção às costas. Progresso até que todo o baço seja exposto.
- Use os fórceps para agarrar o baço e removê-lo do abdômen, usando uma tesoura para desconectar o tecido conjuntivo. Coloque o baço na solução apropriada para sua aplicação a jusante.
- Para obter os pulmões, retire completamente a pele do peito.
- Entrando na base do esterno com a tesoura presa verticalmente, corte para cima até que a caixa torácica seja dividida.
- Use fórceps para agarrar os pulmões direito e esquerdo individualmente e removê-los da cavidade torácica. Remova o coração do tecido pulmonar cortando com uma tesoura.
- Coloque o pulmão na solução apropriada para sua aplicação a jusante. Para isolamento de RNA, use 500 μL de guanidine tiocianato/fenol (GTCP). Para histopatologia, use 5 mL de formalina tamponada neutra de 10%.
8. Isolamento de RNA do tecido pulmonar para expressão genética
- Pré-esfrie a microcentrifuagem a 4 °C.
- Pique o tecido pulmonar em GTCP com uma tesoura. Em seguida, homogeneize o tecido com um homogeneizador alimentado por bateria. Continue até que a solução seja o mais uniforme possível. Incubar em temperatura ambiente por 3-5 min.
- Usando pontas filtradas de pipeta, adicione 100 μL de clorofórmio. Inverta o tubo para 15 s e incubar 3-5 min em temperatura ambiente.
- Centrífuga por 15 min a 12.000 x g.
- Durante o giro, prepare tubos de 1,5 mL com 500 μL de 70% de etanol. Monte e rotule as colunas e tubos de coleta do kit de isolamento do RNA.
- Remova cuidadosamente a camada superior e aquosa sem perturbar a camada interfásica que se formou durante a centrifugação. Coloque a camada aquosa nos tubos contendo 70% de etanol.
- Mova o etanol e a mistura de lise para a coluna no tubo de coleta.
- A partir deste ponto, siga o protocolo de produto comercial do kit de isolamento RNA até a eluição final do RNA.
- Analise o RNA para obter pureza e quantidade. Use imediatamente ou armazene a -80 °C até que use mais.
9. síntese cDNA
- Rotule os tubos PCR e reserve.
- Adicione 1 μg de RNA à mistura de reação cDNA para cada amostra.
- Adicione os reagentes e o modelo ao tubo PCR conforme descrito no protocolo cDNA. Adicione a enzima à mistura por último.
- Coloque os tubos PCR em um termociclador com as seguintes configurações de execução: 5 min a 25 °C, 40 min a 42 °C, 15 min a 85 °C e 4 °C de espera final.
- Remova os tubos PCR do termociclador e use imediatamente ou armazene a -20 °C até que use mais.
10. Ciclo quantitativo de PCR (qPCR) em tempo real
- Prepare um coquetel de mistura de reação para cada um dos genes a serem analisados. Cada reação pcr de 15 μL requer 7,5 μL de mistura de reagente de 2x, 0,75 μL de primer/sonda específica de genes com 5'-FAM e 3,75 μL de água sem nuclease. Os amplicons normalmente variam de 60-120 bp.
- Adicione 3 μL de modelo cDNA para cada grupo experimental aos poços apropriados.
- Adicione 12 μL do coquetel de mistura de reação específico do gene aos poços apropriados.
- Cubra a placa com película adesiva óptica e centrífuga por 1 min a 1.000 x g para remover quaisquer bolhas que possam ter se formado nos poços.
- Coloque a placa PCR em um termociclizador PCR em tempo real.
- Defina o método de execução da seguinte forma: 3 min a 95 °C, 40 ciclos de 95 °C para 15 s seguido de 60 °C para 1 min.
- Analise os dados normalizando o gene de interesse para um controle interno e expresse dados de amostras infectadas em relação a amostras de controle não infectadas usando a fórmula 2-ΔΔCt e uma transformação do log2 dos números.
11. Histopatologia pulmonar
- Remova os pulmões do filhote neonatal como descrito acima.
- Coloque o tecido em um volume de formalina tamponada neutra de 10% para que a razão da solução para o tecido seja de aproximadamente 20:1 por 3-7 dias.
- Coordene com um serviço de histologia apropriado para incorporação de parafina, secção e hematoxilina e eosina (H&E) coloração. Para este trabalho, foi utilizado o Núcleo de Histopatologia da Universidade da Virgínia Ocidental. Alternativamente, siga os protocolos descritos anteriormente19.
12. Ensaio de morte bacteriana in vitro
- Remova o baço do filhote neonatal não infectado como descrito acima e coloque-o em uma cesta de nylon de 40 μm dentro de uma placa de Petri estéril de 60 mm. Repita isso e o baço da piscina em um tubo a ser colhido e homogeneizado juntos.
- Adicione 5 mL de PBS suplementado com 10% de FBS.
- Desagregar o tecido usando um êmbolo de seringa estéril de 3 mL até que uma única suspensão celular seja criada.
- Colete a suspensão unicelular fora da cesta de nylon, transfira para um tubo de centrífuga de 15 mL e células de pelota a 350 x g por 5 min.
- Suspenda as células no tampão de lise de glóbulos vermelhos (2 mL para até 7-8 baços) e deixe-o ficar por 5 minutos à temperatura ambiente para eliminar os eritrócitos.
- Lave os esplenócitos com PBS e pelotas como acima.
- Suspender os esplenócitos em 0,25 mL de PBS suplementados com 0,5% de BSA e 2 mM EDTA de acordo com o rendimento celular esperado.
- Conte os esplenócitos usando um hemócito ou outra aplicação apropriada.
- Isolar células Ly6B.2+ (população mieloide de granulócitos/monócitos inflamatórios) com contas imunomagnéticas de acordo com o protocolo do fabricante.
- Semente Ly6B.2+ células a uma densidade de 1 x 105 células por poço em uma placa preta ou branca de 96 poços em um volume de 0,1 mL de DMEM que contém 10% FBS, 2 mM de glutamina e 25 mM HEPES (meio completo).
- Enumerate bioluminescente E. coli como descrito na seção 1 e preparar o inóculo bacteriano na multiplicidade desejada de infecção (MOI) em um volume final de 0,1 mL. Isso é melhor feito fazendo o que é necessário para todos os poços em um MOI comum em lote.
- Adicione 0,1 mL de inóculo bacteriano ou meio completo sozinho como controle. Incubar a placa multi-poço a 37 °C e 5% de CO2 por 1 h.
- Substitua a mídia por 0,2 mL de mídia completa fresca que contém gentamicina (100 μg/mL) removendo suavemente a mídia com uma pipeta e adicionando mídia fresca com uma nova ponta de pipeta. Devolva a cultura à incubação por mais 2h.
- Às 3h pós-infecção, meça a luminescência em cada poço da placa de cultura tampada a partir do fundo usando um leitor de placas e, em seguida, devolva a cultura à incubação.
- Repita as medidas de luminescência em outros pontos de tempo desejados.
Resultados
Este protocolo induziu a sepse bacteriana em camundongos neonatais, e utilizamos imagens intravitais longitudinais, enumeração de bactérias no sangue, avaliações histológicas da patologia e perfis inflamatórios de expressão de citocinas para estudar o curso da doença. Foram observados sinais de morbidade em filhotes neonatais infectados com inóculos baixos (~2 x 106 CFUs) e altos (~7 x 106 UFC) de E.coli ao longo do tempo. Os filhotes que receberam o maior inóculo apresentaram sinais mais proeminentes de angústia que incluíam mobilidade reduzida, a incapacidade de corrigir sua postura e a capacidade prejudicada de manter uma posição vertical por 24h após a infecção (hpi). Havia, no entanto, uma gama de morbidade, pois alguns filhotes pareciam piores do que outros. Imediatamente após a infecção, um animal de baixa dose morreu devido à exposição a isoflurano durante uma sessão de imagem para estabelecer a linha de base. Por 24 hpi, dois dos seis animais de alta dose sucumbiram à infecção sistêmica (33,3% de mortalidade). Os filhotes infectados que receberam uma dose alta ou baixa de inóculo pesava significativamente menos do que seus companheiros de controle a 24 hpi (Figura 1A,B). Todos os filhotes que receberam o maior inóculo atenderam aos critérios de ponto final em 24 hpi. Como tal, todos os filhotes infectados neste grupo foram eutanizados após a imagem. Bactérias no sangue foram enumeradas para um subconjunto de camundongos que receberam o inóculo inferior, e para todos os animais que receberam o maior inóculo desde que todos foram eutanizados. Os resultados de dois experimentos realizados da mesma forma indicam que, enquanto a maioria dos animais apresentava altos níveis de bactérias no sangue (UFC/mL) a 24 hpi, alguns animais não tinham bactérias detectáveis no sangue(Figura 1C). Este último sugere que eles limparam a infecção por este ponto de tempo. Como esperado, os filhotes que receberam o inóculo superior tinham quase três ordens de magnitude mais UFC/mL a 24 hpi em relação aos filhotes que receberam a baixa dose inóculo(Figura 1C).
Imagens animais vivas de bactérias luminescentes confirmaram ainda mais a disseminação de bactérias e o aumento do crescimento de filhotes neonatais ao longo do tempo em 10 e 24 hpi (Figura 2 e Figura 3). Além disso, utilizando imagens intravitais com o microCT, conseguimos identificar focos de infecção, incluindo o cérebro (Figura 2B),pulmões(Figura 2B, Figura 3A,B) e outros tecidos periféricos(Figura 2B). Os pulmões de alguns camundongos altamente infectados demonstraram regiões opacas consistentes com consolidação inflamatória que co-localizou o sinal bacteriano luminescente(Figura 3A). Estas regiões de exsudato inflamatório presumido não são encontradas em pulmões de controle não infectados(Figura 3A). Outra evidência de uma resposta pronunciada de citocina inflamatória dentro dos pulmões de filhotes infectados é demonstrada pela análise de expressão genética de IL-1β, IL-6 e TNF-α. Observou-se aumento significativo da expressão em relação aos controles para as três citocinas nos grupos de baixo e alto ânculo(Figura 4A). A histopatologia do pulmão também foi examinada a 24 hpi no controle e filhotes infectados. Apesar de perfis inflamatórios semelhantes, um aumento progressivo da patologia foi comumente observado do menor para o maior inóculo. Comparados com tecidos de controles não infectados, os pulmões dos filhotes infectados apresentaram notáveis alterações inflamatórias, espessamento da parede alveolar, aumento da hemorragia alveolar e infiltração inflamatória(Figura 4B). Nas infecções mais graves, o congestionamento pulmonar e as áreas de hemorragia contribuíram para uma redução maciça do espaço ao ar livre(Figura 4B). Coletivamente, esses resultados demonstram que, em nosso modelo de sepse neonatal precoce, a disseminação de bactérias luminescentes pode ser acompanhada ao longo do tempo de um local de inoculação subscapular para importantes focos de infecção e causar inflamação e patologia significativas em animais gravemente infectados.
Para estudar fatores hospedeiros que contribuem para a matança bacteriana por células imunes inatas, como monócitos, macrófagos e neutrófilos, desenvolvemos um ensaio in vitro sensível para medir o acesso bacteriano. Ly6B.2+ células isoladas dos baços de camundongos neonatais foram infectadas com e. coli bioluminescente em uma faixa de MOIs por 1 h e depois tratadas com gentamicina para matar bactérias extracelulares. Aos 3, 6, 20 e 48 cvi, a luminescência intracelular foi medida com um leitor multimode. Como esperado, com o aumento do MOI, sinal mais luminescente foi registrado às 3h(Figura 5). Aos poucos, esse sinal foi perdido, indicativo de desobstrução bacteriana(Figura 5). Este ensaio é favorável a citocinas suplementadas, neutralização de efeitos secretados e a adição de inibidores farmacológicos de vias celulares para estudar intervenções que possam promover o despejo bacteriano e servir para melhorar os resultados no modelo de sepse neonatal descrito aqui.

Figura 1: Alterações no peso corporal e replicação bacteriana em camundongos neonatais sépticos.
(A,B) Pesos individuais do rato dentro de um grupo (baixo e alto) expressos como uma porcentagem do peso médio dos filhotes de controle de ninhada. Os dados são apresentados como percentual médio ± SEM. Testes individuais em cada ponto de tempo pós-infecção revelam diferenças significativas em 24h entre filhotes de controle e filhotes que receberam o baixo inóculo (p<0,0001) (A), ou entre filhotes de controle e filhotes que receberam o alto inóculo (p=0,0031) (B). (C) CFU/mL no sangue a 24 hpi foram transformados e apresentados como a média ± teste SEM. Mann-Whitney revela uma tendência de significância entre os inóculos de baixa e alta dose(p=0,0882). Clique aqui para ver uma versão maior desta figura.

Figura 2: A imagem intravital demonstra a disseminação de bactérias em camundongos neonatais ao longo do tempo.
(A) Um camundongo neonatal representativo (#1) infectado com um inóculo de ~2 x 106 UFC é mostrado no tempo 0, 10 e 24 hpi. Uma escala colorimétrica com os valores mínimos e máximos de brilho por ponto de tempo são exibidos para cada ponto de tempo. Camundongos a 0 e 10h são exibidos tanto em sua escala de ponto de tempo quanto na escala de 24h para demonstrar mudanças no crescimento bacteriano ao longo do tempo. (B) São mostradas imagens de microCT reconstruídas representativas 3D do mesmo rato neonatal de 10 e 24 hpi. Cada ponto de tempo tem imagens em perspectivas aéreas, transaxiais e coronais. Na imagem transaxial de 24 hpi, o avião se moveu em direção à periferia do mouse para melhor exibir focos de infecção nos tecidos periféricos. As setas brancas indicam o cérebro e o rim a 10 hpi e o rim e pulmão a 24 hpi. Clique aqui para ver uma versão maior desta figura.
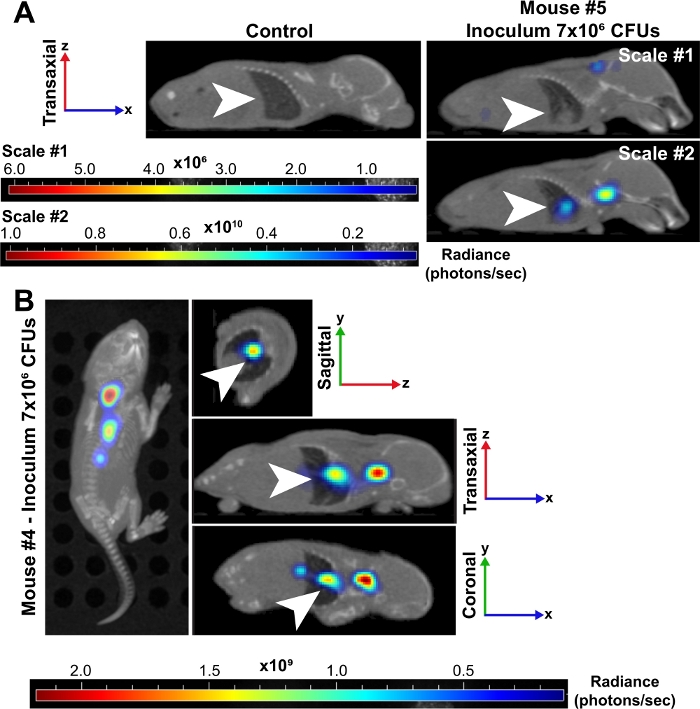
Figura 3: Os pulmões são um local de infecção grave durante a sepse bacteriana em recém-nascidos.
(A) As imagens de microCT reconstruídas por 3D de um camundongo neonatal (#5) infectadas com um inóculo de ~7 x 106 CFUs são mostradas a 24 hpi em comparação com um controle não infectado. Ambos os camundongos são exibidos na perspectiva transaxial e os pulmões são indicados por setas brancas. O rato infectado foi colocado em duas escamas de brilho (fótons/seg). A escala #1 inclui todos os 6 comprimentos de onda (500, 520, 560, 580, 600, 620 nm) e #2 de escala inclui apenas 500, 520 e 560 nm comprimentos de onda. Esta segunda escala nos permitiu visualizar um sinal aumentado em bactérias nos pulmões porque comprimentos de onda mais baixos são mais altamente absorvidos pelo tecido e produzem sinais mais fortes. (B) As imagens microCT reconstruídas pelo representante 3D de um camundongo neonatal (#4) infectadas com um inóculo de ~7 x 106 CFUs são mostradas a 24 hpi. Este ponto de tempo tem imagens nas perspectivas aérea, sagital, transaxial e coronal. Setas brancas indicam focos de infecção nos pulmões. Clique aqui para ver uma versão maior desta figura.
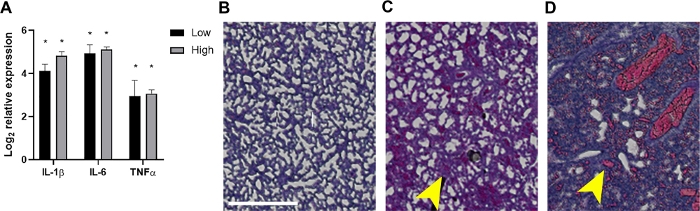
Figura 4: Inflamação e achados histopatológicos associados nos pulmões de recém-nascidos sépticos.
A 24 hpi os pulmões foram colhidos de filhotes que receberam ~2 x 106 ou 7 x 106 CFUs ou controles não infectados. ( A )ORNA foi isolado e a expressão de IL-1β, IL-6 ou TNF-α como determinada em relação aos controles não infectados por PCR quantitativo em tempo real usando a fórmula 2-ΔΔCt. Os dados são mostrados como a alteração média do log2 transformado na expressão ± SEM para cada inóculo como indicado. A significância estatística foi determinada utilizando-se testes t não pagos de valores ΔCt entre genes citocinas individuais e o controle interno no intervalo de confiança de 95%. Asteriscos indicam p<0.01. (B-D) Seções histopatológicas de tecidos pulmonares manchados de H&E (20x, área de interesse construída em máscara de recorte e ampliada para clareza) são mostradas. Tecidos pulmonares de um controle não infectado representativo(B) ou recém-nascidos infectados no baixo (C) ou alto(D) inóculo são mostrados. As setas amarelas indicam espessamento alveolar(C)ou hemorragia(D). Barra de escala = 500 μm. Clique aqui para ver uma versão maior desta figura.
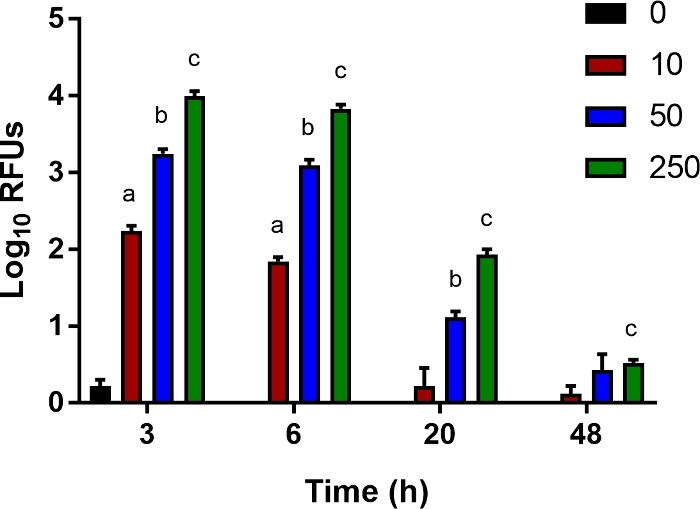
Figura 5: Um ensaio in vitro para liberação bacteriana.
Ly6B.2+ as células foram isoladas dos baços de recém-nascidos de controle não infectados. As células foram semeadas em placas de 96 poços e infectadas com e. coli expressing luciferase expressando E. coli O1:K1:H7 em uma multiplicidade de infecção (MOI) de 10, 50 ou 250, como indicado. Após 1h, o meio foi substituído por fresco que continha gentamicina (100 μg/mL). Unidades de luz relativas médias (RLU) ± SE para um experimento individual representativo de múltiplos são mostrados. A significância estatística no intervalo de confiança de 95% foi determinada por meio de testes t não pagos com correção de Welch; asteriscos indicam p<0.05. Clique aqui para ver uma versão maior desta figura.
Discussão
Nosso modelo de infecção subscapular para induzir a sepse bacteriana em camundongos neonatais é um novo método para estudar a disseminação longitudinal de patógenos bacterianos em tempo real. A imagem intravital oferece a oportunidade de explorar a disseminação bacteriana em tempo real em recém-nascidos. Isso é fundamental para entender a cinética da disseminação bacteriana e estudar melhor a resposta e os danos do hospedeiro na fase apropriada da doença. Filhotes de rato são administrados uma injeção subcutânea e subscapular de inóculo bacteriano. Esta técnica de injeção é mais simples do que outras alternativas comumente utilizadas, como a veia da cauda e infecções intraperitoneais, pois requer menos precisão dentro de um local de injeção. Isso é importante dado o pequeno tamanho dos filhotes. A imagem intravital permite uma avaliação longitudinal da proliferação e disseminação bacteriana em tecidos periféricos e no sistema nervoso central ao longo do tempo sem a necessidade de sacrificar o animal. Abordagens e tecnologias de imagem semelhantes têm sido utilizadas para o estudo da biologia do câncer e metástase20,21. Além disso, enquanto outro estudo citou o uso de imagens bioluminescentes durante uma infecção por E. coli em ratos neonatais22, aqui, aplicamos a abordagem a camundongos neonatais, onde nossa metodologia permite a avaliação da cinética bacteriana durante a sepse murina. A visualização da bactéria é baseada na emissão de luz bioluminescente em vários comprimentos de onda de bactérias (por exemplo, atividade luciferase bacteriana) dentro do animal. A bioluminescência é então visualizada através de uma câmera de dispositivo acoplado (CCD) com resfriada. A bioluminescência visualizada resultante pode então ser reconstruída em uma imagem 3D que mostra efeitos espaciais e temporais dependentes de bactérias dentro de um animal. Para uma camada adicional, mais matizada de aquisição de dados, a identificação bem sucedida de animais através da tatuagem da cauda permite uma avaliação repetida de medidas de filhotes individuais ao longo do tempo e a identificação de possíveis outliers dentro de um determinado grupo experimental.
A aplicação mais bem sucedida do modelo descrito requer precisão na preparação do inóculo bacteriano. Aqui, descrevemos um método otimizado para preparação bacteriana usando uma curva de crescimento E. coli pré-estabelecida e validada que reduz a variação entre o alvo e o inóculo real. Isso permite a reprodutibilidade experimental em um inóculo pretendido. A inclusão de dois inóculos em nosso modelo demonstrou desfechos dependentes de dose em UFCs sanguíneos, mortalidade e patologia pulmonar. No entanto, alguns aspectos da trajetória da doença não eram dependentes de dose. A não perda de peso em animais infectados não dependia do inóculo em 24 hpi. Além disso, níveis semelhantes de expressão de citocina inflamatória foram observados no pulmão em resposta à infecção com ambos os inóculos. Se esse padrão seria ou não replicado em todos os tecidos onde as bactérias foram observadas, como o rim, fígado, baço e cérebro, permanece a ser determinado. Além da sepse, E. coli O1:K1:H7 está associada à meningite na população neonatal23. Esta infecção cerebral ocorre quando bactérias da periferia invadem e penetram na barreira cerebral do sangue. Estudos futuros explorarão esse aspecto do modelo através da análise de mudanças na expressão proteica de junção apertada, bem como testarão diferentes faixas de inóculos bacterianos. Uma modificação adicional durante a imagem intravital inclui a adição de uma bola de algodão singular, doused em isoflurane, que é colocado aproximadamente 2-3 polegadas de distância dos ratos durante a imagem. Em resposta a experimentos anteriores em que os filhotes neonatais recuperaram a consciência durante a sessão de imagem, impedindo a aquisição precisa de imagens, agora colocamos a bola de algodão perto o suficiente dos ratos para mantê-los continuamente anestesiados durante a imagem. No entanto, é importante que isso não seja feito tão perto que eles não se recuperem da anestesia.
Embora flexível e facilmente adaptável para o estudo da cinética de diferentes bactérias em vários modelos de animais e doenças, nosso protocolo tem algumas limitações a considerar. A primeira limitação a considerar é que a via subscapular da infecção não espelha uma rota natural de transmissão. No entanto, um objetivo primordial no desenvolvimento do nosso modelo desde o início foi estabelecer um modo de parto facilmente reprodutível que pudesse ser usado para estabelecer uma infecção sistêmica que replica aspectos da doença humana. Portanto, neste relatório, descrevemos um modelo de síndrome da doença de sepse precoce, não um modelo de transmissão natural. Existe um modelo estabelecido de parto oral em ratos neonatais que replica alguns aspectos da transmissão humana comum, como a colonização inicial da infecção por E. coli no canal alimentar e posterior disseminação na corrente sanguínea e tecidos periféricos, incluindo o cérebro22. O modelo estabelecido pela Witcomb e colegas também incorpora a bioluminescente E. coli e a imagem intravital. Além disso, é crucial minimizar a exposição ao isoflurane, bem como injetar, tatuar a cauda e manusear filhotes o mais rápido possível sem comprometer a precisão e precisão das técnicas na tentativa de mitigar os níveis de estresse tanto para os recém-nascidos quanto para as barragens. Em alguns casos, se os filhotes experimentarem manipulações induzidas pelo homem e/ou experimentais, as barragens podem parar de amamentar e cuidar dos filhotes, resultando em diminuição da sobrevida não relacionada à infecção. Da mesma forma, os filhotes expostos à isoflurano por períodos prolongados além dos 10 minutos aproximados de uma sessão de imagem têm um risco aumentado de morte; portanto, é crucial fornecer apenas isoflurane suficiente para anestesiar suficientemente os ratos, mas não o suficiente para eutanásia-los. Um ponto final de consideração é o limite de sensibilidade. Tecidos nos quais menos de 104 UFC/mL E. coli foram enumerados o sinal luminescente registrado quedas na extremidade baixa da faixa detectável, de acordo com o método de dimensionamento utilizado no software de imagem3. Assim, alguns tecidos podem ser colonizados com baixos níveis de bactérias, mas aparecem sem bioluminescência visível.
Atualmente, a maioria dos estudos utiliza métodos adultos de disseminação bacteriana, como injeções intraperitoneais (i.p.) e veias traseiras para recém-nascidos. Pluschke e Pelkonen analisaram o efeito de E. coli K1 em camundongos neonatais através de i.p., veia traseira e infecções orais24. Este estudo demonstrou que diferentes genótipos de camundongos com imunodeficiências são mais suscetíveis à cepa K1; no entanto, muitos aspectos da resposta imune do hospedeiro à infecção, bem como os mecanismos de propagação bacteriana são deixados sem endereço. Deshmukh e colegas infectaram camundongos neonatais intraperitonealmente com E. coli K1 ou K. pneumoniae e mediram CFUs no baço e fígado a 72 hpi25. Este estudo também analisou alguns aspectos da resposta do hospedeiro à infecção com base na pré-exposição de camundongos a antibióticos. No entanto, não foi abordada uma investigação minuciosa da disseminação bacteriana em tecidos periféricos e sangue ao longo do tempo, paralelamente ao perfil inflamatório no mesmo tecido (além da granulocitose). Outros estudos de sepse neonatal em camundongos com Staphylococcus aureus, Staphylococcus epidermidis, Grupo B Streptococcuse E. coli exploram diferentes aspectos do sistema imunológico hospedeiro em resposta à infecção. No entanto, nenhum desses estudos utiliza imagens intravitais para explorar a cinética da disseminação bacteriana ou localização de focos de infecção23,25,26,27. Nosso método de infecção e imagem intravital, combinado com avaliação da carga bacteriana e perfil inflamatório de tecidos periféricos, nos permite examinar de forma abrangente aspectos do hospedeiro e do patógeno durante a infecção, proporcionando uma compreensão mais precisa da interação hospedeira-patógeno durante a sepse.
Pretendemos utilizar esse modelo de infecção e imagem para aprofundar nossa compreensão da sepse neonatal de início precoce utilizando uma variedade de bactérias patogênicas comumente responsáveis pela sepse em recém-nascidos, incluindo estreptococos do Grupo B, K. pneuomoniaee Listeria monocytogenes. Este modelo de infecção nos permitirá comparar longitudinalmente a disseminação de diferentes patógenos bacterianos em paralelo com a resposta do hospedeiro em recém-nascidos. Além disso, este modelo é adaptável à transferência adotiva de tipos específicos (fluorescente conjugados) de células imunes para estudar sua migração para locais de infecção e subsequente influência na resposta e controle do hospedeiro das bactérias. Isso confere a oportunidade de entender melhor as interações hospedeiro-patógeno que ocorrem durante a sepse no início da vida de maneiras que não foram previamente demonstradas.
Divulgações
Os autores não têm conflitos de interesse para divulgar.
Agradecimentos
Este trabalho foi apoiado por fundos institucionais para c.M.R.
Materiais
| Name | Company | Catalog Number | Comments |
| 1 mL Insulin Syringe | Coviden | 1188128012 | Inoculum or PBS injection |
| 10% Neutral Buffered Formalin | VWR | 89370-094 | Histopathology |
| ACK Lysis Buffer | Gibco | LSA1049201 | Bacterial clearance assay |
| Animal Tattoo Ink Paste | Ketchum | KI1482039 | Animal identification |
| Animal Tattoo Ink Green Paste | Ketchum | KI1471039 | Animal identification |
| Anti-Ly-6B.2 Microbeads | Miltenyi Biotec | 130-100-781 | Cell isolation |
| Escherichia coli O1:K1:H7 | ATCC | 11775 | |
| Escherichia coli O1:K1:H7-lux (expresses luciferase) | N/A | N/A | Constructed in-house at WVU |
| E.Z.N.A. HP Total Extraction RNA Kit | Omega Bio-tek | R6812 | RNA extration |
| DPBS, 1X | Corning | 21-031-CV | |
| Difco Tryptic Soy Agar | Becton, Dickinson and Company | 236950 | Bacterial growth |
| IL-1 beta Primer/Probe (Mm00434228) | Thermo Fisher Scientific | 4331182 | Cytokine expression qPCR |
| IL-6 Primer/Probe (Mm00446190) | Thermo Fisher Scientific | 4331182 | Cytokine expression qPCR |
| iQ Supermix | Bio-Rad | 1708860 | Real-time quantitative PCR |
| iScript cDNA Synthesis Kit | Bio-Rad | 1708891 | cDNA synthesis |
| Isolation Buffer | Miltenyi Biotec | N/A | Bacterial clearance assay |
| IVIS Spectrum CT and Living Image 4.5 Software | Perkin Elmer | N/A | Intravital imaging |
| LB Broth, Lennox | Fisher BioReagents | BP1427-500 | Bacterial growth |
| EASYstrainer (Nylon Basket) | Greiner Bio-one | 542 040 | Cell strainer |
| SpectraMax iD3 | Molecular Devices | N/A | Plate reader |
| Pellet Pestle Motor | Grainger | 6HAZ6 | Tissue homogenization |
| Polypropylene Pellet Pestles | Grainger | 6HAY5 | Tissue homogenization |
| Prime Thermal Cycler | Techne | 3PRIMEBASE/02 | cDNA synthesis |
| TNF-alpha Primer/Probe (Mm00443258) | Thermo Fisher Scientific | 4331182 | Cytokine expression qPCR |
| TriReagent (GTCP) | Molecular Research Center | TR 118 | RNA extration |
Referências
- Qazi, S. A., Stoll, B. J. Neonatal sepsis: a major global public health challenge. Pediatr Infect Dis J. 28, 1-2 (2009).
- Simonsen, K. A., Anderson-Berry, A. L., Delair, S. F., Davies, H. D. Early-onset neonatal sepsis. Clinical Microbiology Reviews. 27 (1), 21-47 (2014).
- Seman, B. G., et al. Elevated levels of interleukin-27 in early life compromise protective immunity in a mouse model of Gram-negative neonatal sepsis. Infections and Immunity. , (2019).
- Schrag, S. J., et al. Epidemiology of Invasive Early-Onset Neonatal Sepsis, 2005 to 2014. Pediatrics. 138 (6), 20162013(2016).
- Stoll, B. J., et al. Early onset neonatal sepsis: the burden of group B Streptococcal and E. coli disease continues. Pediatrics. 127 (5), 817-826 (2011).
- Weston, E. J., et al. The burden of invasive early-onset neonatal sepsis in the United States, 2005-2008. Pediatrics and Infectious Disease Journal. 30 (11), 937-941 (2011).
- Hornik, C. P., et al. Early and late onset sepsis in very-low-birth-weight infants from a large group of neonatal intensive care units. Early Human Development. , Suppl 2 69(2012).
- Vergnano, S., Sharland, M., Kazembe, P., Mwansambo, C., Heath, P. T. Neonatal sepsis: an international perspective. Archives of Disease in Childhood: Fetal and Neonatal Edition. 90 (3), 220-224 (2005).
- Kraft, J. D., et al. Neonatal macrophages express elevated levels of interleukin-27 that oppose immune responses. Immunology. 139 (4), 484-493 (2013).
- Basha, S., Surendran, N., Pichichero, M. Immune responses in neonates. Expert Reviews of Clinical Immunology. 10 (9), 1171-1184 (2014).
- Gleave Parson, M., et al. Murine myeloid-derived suppressor cells are a source of elevated levels of interleukin-27 in early life and compromise control of bacterial infection. Immunology and Cell Biology. 97 (5), 445-446 (2018).
- Adkins, B., Leclerc, C., Marshall-Clarke, S. Neonatal adaptive immunity comes of age. Nature Reviews Immunology. 4 (7), 553-564 (2004).
- Kim, S. K., Keeney, S. E., Alpard, S. K., Schmalstieg, F. C. Comparison of L-selectin and CD11b on neutrophils of adults and neonates during the first month of life. Pediatrics Research. 53 (1), 132-136 (2003).
- Velilla, P. A., Rugeles, M. T., Chougnet, C. A. Defective antigen-presenting cell function in human neonates. Clinical Immunology. 121 (3), 251-259 (2006).
- Le Garff-Tavernier, M., et al. Human NK cells display major phenotypic and functional changes over the life span. Aging Cell. 9 (4), 527-535 (2010).
- Weinberger, B., et al. Mechanisms underlying reduced responsiveness of neonatal neutrophils to distinct chemoattractants. Journal of Leukocyte Biology. 70 (6), 969-976 (2001).
- Gabrilovich, D. I., Nagaraj, S. Myeloid-derived suppressor cells as regulators of the immune system. Nature Reviewss Immunology. 9 (3), 162-174 (2009).
- National Research Council. Guide for the care and use of laboratory animals, 8th ed. , National Academies Press. Washington, DC. (2011).
- Tucker, D. K., Foley, J. F., Bouknight, S. A., Fenton, S. E. Sectioning Mammary Gland Whole Mounts for Lesion Identification. Journal of Visualized Experiments. (125), e55796(2017).
- Bayarmagnai, B., Perrin, L., Esmaeili Pourfarhangi, K., Gligorijevic, B. Intravital Imaging of Tumor Cell Motility in the Tumor Microenvironment Context. Methods in Molecular Biology. 1749, 175-193 (2018).
- Beerling, E., Ritsma, L., Vrisekoop, N., Derksen, P. W., van Rheenen, J. Intravital microscopy: new insights into metastasis of tumors. Journal of Cell Science. 124, Pt 3 299-310 (2011).
- Witcomb, L. A., Collins, J. W., McCarthy, A. J., Frankel, G., Taylor, P. W. Bioluminescent Imaging Reveals Novel Patterns of Colonization and Invasion in Systemic Escherichia coli K1 Experimental Infection in the Neonatal Rat. Infection and Immunity. 83 (12), 4528(2015).
- Singh, K., et al. Inter-alpha inhibitor protein administration improves survival from neonatal sepsis in mice. Pediatric Research. 68 (3), 242-247 (2010).
- Pluschke, G., Pelkonen, S. Host factors in the resistance of newborn mice to K1 Escherichia coli infection. Microb. Patho. , 93-102 (1988).
- Mancuso, G., et al. Role of interleukin 12 in experimental neonatal sepsis caused by group B streptococci. Infections and Immunity. 65 (9), 3731-3735 (1997).
- Thammavongsa, V., Rauch, S., Kim, H. K., Missiakas, D. M., Schneewind, O. Protein A-neutralizing monoclonal antibody protects neonatal mice against Staphylococcus aureus. Vaccine. 33 (4), 523-526 (2015).
- Andrade, E. B., et al. TLR2-induced IL-10 production impairs neutrophil recruitment to infected tissues during neonatal bacterial sepsis. Journal of Immunology. 191 (9), 4759-4768 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados