Method Article
Un modello di imaging neonatale di sepsi batterica gram-negativa
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
L'infezione di topi neonatale con bioluminescente E. coli O1:K1:H7 provoca un'infezione settica con significativa infiammazione polmonare e patologia polmonare. Qui descriviamo le procedure per modellare e studiare ulteriormente la sepsi neonatale utilizzando l'imaging intravitale longitudinale in parallelo con l'enumerazione dei fardelli batterici sistemici, la profilazione infiammatoria e l'istopatologia polmonare.
Abstract
I neonati sono a maggior rischio di sepsi batterica a causa del profilo immunitario unico che mostrano nei primi mesi di vita. Abbiamo stabilito un protocollo per lo studio della patogenesi di E. coli O1:K1:H7, un sierotipo responsabile degli alti tassi di mortalità nei neonati. Il nostro metodo utilizza l'imaging intravitale dei cuccioli neonatale in diversi punti di tempo durante la progressione dell'infezione. Questa imaging, parallela alla misurazione dei batteri nel sangue, al profilo infiammatorio e all'istopatologia tissutale, significa un approccio rigoroso alla comprensione della dinamica dell'infezione durante la sepsi. Nell'attuale relazione, modelliamo due inoculi infettivi per il confronto dei fardelli batterici e della gravità della malattia. Scopriamo che l'infezione subscapulare porta alla diffusione dell'infezione da 10 h dopo l'infezione. A 24 ore, l'infezione da E. coli luminescente era abbondante nel sangue, nei polmoni e in altri tessuti periferici. L'espressione delle citochine infiammatorie nei polmoni è significativa a 24 ore, e questo è seguito da infiltrazioni cellulari e prove di danni ai tessuti che aumentano con la dose infettiva. L'imaging intravitale ha alcune limitazioni. Ciò include una soglia del segnale luminescente e alcune complicazioni che possono insorgere con i neonati durante l'anestesia. Nonostante alcune limitazioni, scopriamo che il nostro modello di infezione offre una visione per comprendere la dinamica dell'infezione longitudinale durante la sepsi murina neonatale, che non è stata esaminata a fondo fino ad oggi. Ci aspettiamo che questo modello possa anche essere adattato per studiare altre infezioni batteriche critiche durante la prima infanzia.
Introduzione
La sepsi batterica è una preoccupazione significativa per i neonati che mostrano un profilo immunitario unico nei primi giorni di vita che non fornisce un'adeguata protezione dall'infezione1. La sepsi neonatale continua ad essere un problema sanitario significativo negli Stati Uniti, rappresentando oltre 75.000 casi all'anno solo negli StatiUniti 2. Per studiare queste infezioni in profondità, sono necessari nuovi modelli animali che ricapitolano aspetti della malattia umana. Abbiamo stabilito un modello di infezione neonatale del topo utilizzando Escherichia coli, O1:K1:H73. E. coli è la seconda causa principale di sepsi neonatale negli Stati Uniti, ma responsabile della maggior parte della mortalità associata alla sepsi4,5. Tuttavia, è la causa principale quando i bambini pre-termine e molto bassi di peso alla nascita (VLBW) sono considerati indipendentemente5. Il sierotipo K1 è più frequentemente associato a infezioni invasive del flusso sanguigno e meningite nei neonati6,7. Attualmente, non ci sono altre opzioni di trattamento oltre agli antibiotici e alle cure di supporto. Nel frattempo, i tassi di resistenza agli antibiotici continuano ad aumentare per molti batteri patogeni, con alcuni ceppi di E. coli resistenti a una moltitudine di antibiotici comunemente usati nel trattamento8. Pertanto, è imperativo continuare a generare metodi per studiare i meccanismi della sepsi e la risposta dell'ospite nei neonati. Questi risultati possono aiutare a migliorare i trattamenti attuali e gli esiti delle infezioni.
Lo stato immunitario dei neonati è caratterizzato da differenze fenotipiche e funzionali rispetto agli adulti. Ad esempio, elevati livelli di citochine antinfiammatorie e regolatorie, come l'interleuchina (IL)-10 e l'IL-27, hanno dimostrato di essere prodotti da macrofagi derivati dal sangue del cordone ombelicale e sono presenti a livelli maggiori nel siero dei neonati murini9,10,11. Ciò è coerente con i livelli più bassi di IFN-α, IFN-ɣ, IL-12 e TNF-α che sono frequentemente segnalati dalle cellule neonatale rispetto alle controparti adulte10. Inoltre, il sistema immunitario neonatale è inclinato verso una risposta cellulare T Th2 e regolatore rispetto agli adulti12. Un numero elevato di neutrofili, cellule T, cellule B, cellule NK e monociti sono presenti anche nei neonati, ma con notevoli compromissioni funzionali. Ciò include difetti nell'espressione dei marcatori di superficie cellulare e presentazione dell'antigene che suggeriscono immaturità13,14,15. Inoltre, i neutrofili neonatale sono significativamente carenti nella loro capacità di migrare a fattori chemiotattici16. Le cellule soppressori derivate da mieloidi (MSC) si trovano anche a livelli elevati nei neonati e recentemente hanno dimostrato di essere una fonte di IL-2711. Gli MSM sono altamente soppressivi nei confronti delle celleT 17. Collettivamente, questi dati dimostrano limitazioni nell'immunità neonatale che conferiscono una maggiore suscettibilità alle infezioni.
Per studiare la progressione del carico batterico e sezionare le risposte immunitarie protettive dell'ospite durante la sepsi neonatale, abbiamo sviluppato un nuovo modello di infezione. Topi neonatale a giorni 3-4 di vita sono difficili da iniettare nello spazio intraperitoneale o nella vena della coda. Nel nostro modello, ai cuccioli del giorno 3 o 4 viene somministrato l'inoculo batterico o pbs per via sottocutanea nella regione scapolare. Un'infezione sistemica si sviluppa e utilizzando luminescente E. coli O1:K1:H7, possiamo immaginare longitudinalmente singoli topi neonatale per seguire il carico batterico diffuso nei tessuti periferici. Questo è il primo modello segnalato ad utilizzare l'imaging intravitale per comprendere la cinetica della diffusione dei batteri durante la sepsi nei neonati murini3.
Qui descriviamo un protocollo per indurre infezioni settiche di E. coli nei topi neonatale3. Descriviamo come preparare l'inoculo batterico per l'iniezione e come raccogliere il tessuto per la valutazione della patologia, la misurazione dei marcatori infiammatori mediante l'analisi dell'espressione genica e l'enumerazione del carico batterico. Inoltre, viene descritto anche l'uso di E. coli luminescente per l'imaging intravitale di neonati infetti e la quantificazione dell'uccisione batterica da parte delle cellule immunitarie neonatale. Questi protocolli possono anche essere adattati per studiare altre importanti infezioni batteriche nei neonati. I dati qui presentati rappresentano un nuovo approccio generale alla comprensione della dinamica dell'infezione in un modello di sepsi neonatale traducibile.
Protocollo
Tutte le procedure sono state approvate dai comitati istituzionali per la cura e l'uso degli animali della Virginia Occidentale e condotte in conformità con le raccomandazioni della Guida per la cura e l'uso degli animali da laboratorio da parte del Consiglio Nazionale delleRicerche 18.
1. Preparazione dell'inoculo batterico
- Striare una piastra di agar di soia triptica (TSA) con un anello inoculato per l'isolamento di una singola colonia da uno stock congelatore di E. coli O1:K1:H7-lux che esprime stabilmente luciferasi e porta resistenza alla kanamicina3. Incubare durante la notte a 37 °C.
- Il giorno seguente consente al brodo di Luria (LB) di arrivare a temperatura ambiente (25 °C) in un armadio per la biosicurezza.
- Sotto una cappa di armadio biosicurezza, identificare una singola colonia dalla piastra striata e inocularla in 3 mL di LB integrata con kanamicina (30 μg / mL). Incubare durante la notte a 37 °C con agitazione (220 giri/min). Questa è la cultura di partenza.
- Diluire la coltura iniziale 1:100 in un fresco 3 mL di LB sotto una cappa per armadi biosicurezza e restituirla all'incubatrice per 2-3 ore a 37 °C con scuotimento (220 giri/min). Questa è la cultura delle azioni.
- Leggere la densità ottica (OD) delle impostazioni cultura del bianco e del materiale grezzo a 600 nm utilizzando uno spettrofotometro. Aggiungere 100 μL di LB (senza batteri) in un pozzo di una piastra di dosaggio del fondo ben piatta 96; questo è il vuoto. Quindi aggiungere 100 μL dalla coltura stock a un pozzo separato. Ripetere l'attività per due repliche aggiuntive. L'assorbanza viene letta utilizzando un lettore di lastre.
- Sottrarre l'assorbanza in bianco dal valore di assorbanza della coltura stock (il valore OD) e confrontarla con una curva di crescita precedentemente generata e convalidata per determinare un'approssimazione della densità batterica nella coltura stock per la preparazione della dose infettiva.
- Genera inoculi target a seconda della domanda di ricerca. Per questo studio sono stati utilizzati inoculo bersaglio di 2 x10 6 (basso) e 7 x10 6 unità (alte) di formazione di colonie (CTU) per topo (/topo).
- Dividere la dose bersaglio per topo (DoseT)per la concentrazione stimata di batteri nella coltura stock (Stock) per ottenere il volume di batteri necessari dal tubo di stoccaggio (VS).
- Moltiplicare VS per il numero di topi (NM) che devono essere infettati insieme a abbastanza per 5-10 extra per la quantità totale di batteri necessari per l'infezione più 5-10 dosi aggiuntive. Rimuovere questo volume dal tubo di serie e aggiungerlo a un nuovo tubo di centrifuga.
- Usa l'equazione seguente:
DoseT/Stock = VS x NM = volume totale (VT)di batteri da rimuovere dal tubo di stoccaggio.
- Centrifugare i batteri a 2.000 x g per 5 minuti a 4 °C e rimescolare il pellet batterico in 50 μL di PBS (pH 7,2-7,6) per topo da infettare (ad esempio, per 10 dosi di 2 x 106 batteri ciascuna dose, il pellet di 2 x 107 batteri sarebbe rimorsi in PBS da 500 μL). Ancora una volta, si consiglia di preparare più inoculo di quanto sia necessario. Preparare un volume uguale di PBS solo per le inoculazioni di controllo. Mantenere l'inoculo infettivo e il controllo PBS sul ghiaccio fino all'infezione.
- Eseguire sette diluizioni seriali dieci volte in PBS in una piastra di diluizione inferiore in plastica da 96 po ', e la piastra 25 μL delle diluizioni in duplicato su piastre TSA quadrante integrate con kanamicina (30 μg / mL) per enumerare la quantità effettiva di batteri somministrati. Incubare a 37 °C durante la notte per la formazione della colonia prima dell'enumerazione.
2. Identificazione degli animali
- Disporre un numero sufficiente di coppie riproduttive in modo che le cucciolate possano essere sincronizzate per i cuccioli abbinati all'età. La variabilità dell'età ± 1 giorno è accettabile.
- Identificare un topo femmina C57BL/6 incinta e monitorare la nascita della lettiera prima dell'esperimento pianificato per determinare con precisione l'età.
- Per distinguere tra il controllo e i cuccioli infetti di 3 o 4 giorni, usa un paio di piccole forbici per iris dalla punta fine per tagliare solo le estremità delle code dei cuccioli di controllo. I cuccioli infetti non ricevono tagli di coda. Prima di tagliare la coda, disinfettare la pelle con un batuffolo di cotone covato in etanolo al 70%. Applicare pressione all'estremità della coda con un batuffolo di cotone o una garza in base alle esigenze.
NOTA: Questa procedura viene eseguita sotto una cappa per armadi biosicurezza. È sufficiente un taglio di coda di circa 1/8 di pollice. - Per identificare i cuccioli all'interno del controllo e i gruppi infetti, utilizzare una siringa per insulina da 1 ml con un ago permanente da 28 G x 1/2 '' per tatuare le code dei cuccioli. Prima di tatuare, disinfettare la pelle con un batuffolo di cotone covato in etanolo al 70%. Questa procedura viene eseguita sotto una cappa dell'armadio biosicurezza.
- Per tatuare la coda, applicare l'inchiostro del tatuaggio animale sulla punta dell'ago. Successivamente, trattenere attentamente il cucciolo con una mano, con la coda completamente esposta. Inserire delicatamente l'ago sotto la pelle, pur mantenendo un livello superficiale di profondità, e spostare l'ago parallelo con la pelle di pochi millimetri fino a quando non è stata creata una piccola marcatura, o punto. Attendere alcuni secondi prima di rimuovere lentamente l'ago da sotto la pelle, per evitare che l'inchiostro in eccesso si rilasci da sotto la pelle.
- Applicare pressione sulla ferita con un batuffolo di cotone o una garza in base alle esigenze. Rimuovere l'inchiostro del tatuaggio in eccesso sulla superficie della pelle con il 70% di etanolo.
- Ripeti questo processo con i topi successivi nei gruppi infetti e di controllo, aggiungendo un punto aggiuntivo con ogni cucciolo successivo tatuato (ad esempio, il cucciolo 1 avrà 1 punto sulla coda, il cucciolo 2 avrà due punti sulla coda, ecc.).
NOTA: Per un ulteriore livello di identificazione, si consiglia di utilizzare colori separati di inchiostro per tatuaggi animali per il controllo e gruppi infetti.
3. Inoculazione subscapulare
NOTA: Per questo studio sono stati eseguiti 2 esperimenti con un gruppo a basse dosi e ad alte dosi designato per ciascun esperimento. Nel primo esperimento, a 7 cuccioli è stato somministrato l'inoculo a bassa dose (4 cuccioli sono stati usati come controlli) e 5 cuccioli da una cucciolata separata hanno ricevuto la dose elevata (3 cuccioli sono stati usati come controlli). I cuccioli dell'esperimento 1 hanno fornito dati solo per il punto di tempo 24 ore su 24. Nel secondo esperimento, a 8 cuccioli è stato somministrato l'inoculo a bassa dose (2 cuccioli sono stati usati come controlli) e a 6 cuccioli è stato somministrato l'inoculo ad alta dose (2 cuccioli sono stati usati come controlli). I cuccioli dell'esperimento 2 hanno fornito dati per i punti di tempo 0, 10 e 24 ore.
- I cuccioli di età ≤ 1 giorno. Assegnare ogni lettiera come una lettiera a bassa dose o ad alta dose. All'interno di una cucciolata assegnare casualmente i cuccioli come un cucciolo di controllo o infetto.
- Il giorno 3 o 4 postnatale, registrare i pesi di tutti i cuccioli prima dell'inoculazione con E. coli-lux o il controllo PBS. Separare la diga dai cuccioli durante questo periodo per assicurarsi che non vengano spostati durante l'infezione.
- All'interno di un armadio per la biosicurezza che utilizza un ago per insulina, aspirare pbs o e. coli-lux inoculo. Per questo lavoro sono stati utilizzati inoculi di 2 x10 6 e 7 x10 6 CFC per topo. Mantenere sia l'inoculo infettivo che il PBS sul ghiaccio fino alla somministrazione tramite iniezione subscapulare.
- Posizionare il neonato su una superficie pulita nel cappuccio dell'armadio della biosicurezza e sollevare la pelle sulla nuca come per scruffare il cucciolo.
- Nello spazio ora creato tra la pelle e il muscolo dell'animale, inserire l'ago, smussare, appena sotto la pelle e iniettare 50 μL di PBS o E. coli-lux. Rilasciare contemporaneamente la porzione pizzicata della pelle per evitare il riflusso dell'iniezione.
- Rimuovere l'ago lentamente e con cura. Riposizionare i cuccioli con le dighe dopo che le iniezioni sono finite.
NOTA: A causa del loro stadio anatomico di sviluppo, è tecnicamente difficile somministrare una vena di coda o un'iniezione intraperitoneale ai cuccioli neonatale al giorno 3-4. Pertanto, la via di infezione sottoscapulare è stata scelta per questo studio a causa della facilità di esecuzione.
4. Valutazione della malattia e dei criteri degli endpoint
- Monitorare i cuccioli due volte al giorno per tutta la durata dell'infezione. Si notano eventuali anomalie nell'aspetto.
- Registra pesi come misura oggettiva della morbilità.
- Oltre ai cambiamenti di peso, testare la capacità dei cuccioli di destrarsi posizionando il neonato sul lato dorsale. Gli animali malati non saranno in grado di girare sul lato ventrale e sui piedi o completeranno questa azione con difficoltà.
- Verificare quanto segue per contrassegnare gli animali in base ai criteri dell'endpoint: meno dell'85% del peso corporeo normale; diminuzione del movimento e incapacità di destra se stessi; scolorimento della pelle e aspetto più grigio o trasparente rispetto al rosa; sensazione di freschezza al tatto, indicativa di diminuzione della temperatura corporea e lividi emorragici lungo i lati, anche indicativi di malattia anticipata.
NOTA: se i neonati non sono riusciti ad ingrassare per due giorni e adattarsi a una qualsiasi delle descrizioni dei passaggi 4.4, hanno soddisfatto i criteri dell'endpoint. I cuccioli che ricevono la dose elevata spesso soddisfano i criteri dell'endpoint di 24 ore. I cuccioli di controllo all'interno delle cucciolate a bassa e alta dose saranno eutanasiati allo stesso tempo per consentire un'analisi comparativa tra i gruppi di controllo e sperimentali. Procedere alla sezione eutanasia qui sotto.
5. Imaging in vivo del carico batterico
- Utilizzare un imager e un software microCT per l'imaging e l'analisi successiva.
NOTA: il colore della pelle del cucciolo non intasa la qualità dell'imaging. - Posizionare la gabbia con topi neonatali infetti da E. coli-luxe la diga in una cappa di flusso laminare di livello BSL-2. Rimuovere i topi da imageizzare e posizionarsi in una camera isoflurana trasparente all'interno del cofano. Si consiglia di iniziare con controlli non infetti per misurare la quantità di isoflurane necessaria.
- Aprire il software sul computer collegato al microCT. Inizializzare il sistema e attendere che la temperatura ccd si blocchi a -90 °C.
- Accendere il vaporizzatore di isoflurane e regolare il quadrante al flusso di isoflurane al 5%. Tenere i topi nella camera con questa miscela di isoflurane per 20-30 s fino a quando non smettono di muoversi; per alcuni topi possono essere necessari tempi di esposizione all'anestesia più lunghi o più brevi. Una volta che i topi smettono di muoversi, sono sufficientemente anestetizzati e possono essere immagini.
- Spostare i topi nella camera di imaging microCT e posizionarli sulla scatola di imaging in posizione prona, con nasi rivolti perpendicolarmente ai coni del naso. Utilizzare la cera dentale per trattenere delicatamente i piedi sulla scatola di imaging per limitare qualsiasi movimento. È possibile visualizzare fino a 4 topi neonatale alla volta.
- Abbassare il vaporizzatore di isoflurane al flusso del 2-4% per mantenere i topi anestetizzati durante l'imaging. Chiudere la porta della camera di imaging microCT. Controlla i topi pochi secondi dopo. Se iniziano a muoversi, cova un batuffolo di cotone in isoflurane e tienilo al naso dell'animale che si muove per 5 secondi per anestetizzare. Tenere il batuffolo di cotone vicino agli animali durante l'imaging. Fare attenzione a non anestetizzare e terminare e terminare i topi.
- Utilizzando il software, scegliere l'opzione Luminescente per l'imaging. Utilizzare un filtro di eccitazione impostato su Blocca e il filtro di emissione impostato su Apri, 500 nm, 520 nm, 560 nm, 580 nm, 600 nm e 620 nm. Ci saranno sette filtri di emissione totali impostati per la luminescenza.
- Immagini i topi in ogni punto di tempo (0, 10 e 24 ore dopo l'infezione [hpi]) e salva tutte le immagini in una cartella per ogni punto di tempo. Riportare i cuccioli nella gabbia con la diga e verificare che tutti i cuccioli si siano ripresi dall'anestesia.
- Per analizzare le immagini 2D, aprire le immagini nel software. Modificare le unità in Radiance (fotoni); questo si trasformerà nel Flusso Totale (fotoni/secondo).
- Analizza un solo set di immagini con i suoi filtri a più emissioni alla volta. Da ogni set di immagini, prendi nota dei valori minimi e massimi di luminosità situati nell'angolo in basso a destra di ogni immagine (ad esempio, se ci sono 7 filtri di emissione, ci saranno 7 immagini e 7 valori minimi e massimi). Ripetere l'immagine per ogni set di immagini da confrontare.
- Per determinare una scala che comprenda i valori e la luminescenza per tutte le immagini, individuare il valore minimo più basso e il valore massimo più alto per ogni set di immagini. Per questo studio, le immagini del filtro Aperto sono state utilizzate come rappresentative.
- Evidenziare e aprire l'immagine preferita per modificare la scala. Nella tavolozza degli strumentifare clic sulla scheda Regolazione immagine e modificare la scala dei colori con i valori massimi minimi e massimi più alti identificati in precedenza. Salvare ogni set di immagini come TIFF. Analizza individualmente ogni punto di tempo in questo modo per assicurarti che la scala corretta sia visualizzata.
- Per quantificare il flusso totale (quantità di segnale luminescente per mouse) per ogni singolo mouse, aprire un'immagine come descritto in precedenza nel passaggio 5.9-5.10. Aprire la scheda Strumenti ROI nella tavolozza degli strumenti e selezionare lo strumento cerchio. Scegliere 1 cerchio se si analizza un'area di luminescenza.
- Spostare il ROI su Sovrapposizione sull'area di luminescenza. Regolare le dimensioni del ROI, se necessario.
NOTA: se è necessaria una regolazione, regolare le ROM in altre immagini in modo comparabile per mantenere la coerenza. Scegliere Misura ROM. Verrà visualizzata la finestra Misurazioni ROI con visualizzazione del flusso totale (p/s),della luminosità media (p/s/cm2/sr), della deviazione standard della luminosità,della luminosità minima e della luminosità massima. - Registrare le misurazioni del flusso totale per ogni set di immagini. Questo numero è la quantità quantificata di luminescenza nel mouse nelle immagini 2D.
- Per creare immagini microCT ricostruite in 3D, aprire il pannello Ricostruzione 3D DLIT sulla tavolozza degli strumenti e controllare tutte le lunghezze d'onda da includere nella scheda Analizza. Selezionare Ricostruisci.
6. Eutanasia
- Preparare ed etichettare tubi per tessuti/organi di interesse per la necroscopia e le applicazioni appropriate a valle.
- Separare i neonati dalla diga in un armadio per la biosicurezza.
- Immergere un batuffolo di cotone in isoflurane di livello veterinario e posizionarlo all'interno di una camera di contenimento trasparente.
- Se si raccoglie sangue, preparare una micropipetta P200 con una punta e avere un tubo da 1,5 ml con 10 μL di EDTA da 5 mM come anticoagulante. Si prevede un volume di 50-200 μL di sangue.
- Posizionare un neonato nella camera e monitorare il cucciolo fino a quando non diventa immobile.
- Rapidamente, rimuovere il neonato e decapitare con le forbici. Se gli viene permesso di respirare aria fresca per un periodo prolungato, il cucciolo può riprendere conoscenza. I neonati hanno una ridotta capacità polmonare rispetto ai topi adulti e, quindi, non respirano abbastanza profondamente per l'eutanasia solo dall'isoflurane.
- Raccogliere il sangue dal tronco alla base della testa usando una micropipetta P200. Per massimizzare la quantità di sangue raccolto, eseguire questo passaggio il più rapidamente possibile dopo la decapitazione. Enumerare i batteri nel sangue mediante diluizione seriale e conteggio standard delle lastre come descritto al passaggio 1.9.
- Sterilizzare l'intero neonato con il 70% di etanolo prima dell'escissione di campioni di tessuto.
7. Raccolta dei tessuti
- All'interno di un armadio di biosicurezza, utilizzare il neonato con il 70% di etanolo per prevenire la contaminazione. Appoggia l'animale sul lato destro.
- Usando le forcep, afferrare la pelle in un punto tra l'addome e la gamba sinistra posteriore e fare un'incisione con forbici chirurgiche a punta fine. Continuare a tagliare la pelle spostandosi verso l'alto verso la schiena. Progredire fino a quando l'intera milza non viene esposta.
- Utilizzare le forcep per afferrare la milza e rimuoverla dall'addome, usando le forbici per scollegare il tessuto connettivo. Posizionare la milza nella soluzione appropriata per la sua applicazione downstream.
- Per ottenere i polmoni, sbucciare completamente la pelle del torace.
- Entrando alla base dello sterno con forbici tenute verticalmente, tagliare verso l'alto fino a quando la gabbia toracica non viene divisa.
- Utilizzare le forcep per afferrare singolarmente i polmoni destro e sinistro e rimuoverli dalla cavità toracica. Rimuovere il cuore dal tessuto polmonare tagliando con le forbici.
- Posizionare il polmone nella soluzione appropriata per la sua applicazione a valle. Per l'isolamento dell'RNA, utilizzare 500 μL di tiocianato/fenolo di guanidina (GTCP). Per l'istopatologia, utilizzare 5 mL di formalina tamponata al 10%.
8. Isolamento dell'RNA dal tessuto polmonare per l'espressione genica
- Pre-raffreddare il microcentrifugo a 4 °C.
- Tritare il tessuto polmonare in GTCP con le forbici. Successivamente, omogeneizzare il tessuto con un omogeneizzatore alimentato a batteria. Continuare fino a quando la soluzione non è il più uniforme possibile. Incubare a temperatura ambiente per 3-5 minuti.
- Utilizzando punte di pipetta filtrate, aggiungere 100 μL di cloroformio. Invertire il tubo per 15 s e incubare 3-5 minuti a temperatura ambiente.
- Centrifuga per 15 min a 12.000 x g.
- Durante lo spin, preparare tubi da 1,5 ml con 500 μL di 70% di etanolo. Assemblare ed etichettare le colonne e i tubi di raccolta dal kit di isolamento dell'RNA.
- Rimuovere con cura lo strato superiore acquoso senza disturbare lo strato interfase che si è formato durante la centrifugazione. Posizionare lo strato acquoso nei tubi contenenti il 70% di etanolo.
- Spostare la miscela di etanolo e lysate nella colonna nel tubo di raccolta.
- Da questo momento in su, seguire il protocollo del prodotto commerciale del kit di isolamento dell'RNA fino all'eluizione finale dell'RNA.
- Analizzare l'RNA per purezza e quantità. Utilizzare immediatamente o conservare a -80 °C fino a un ulteriore utilizzo.
9. sintesi cDNA
- Etichettare i tubi PCR e mettere da parte.
- Aggiungere 1 μg di RNA alla miscela di reazione cDNA per ogni campione.
- Aggiungere i reagenti e il modello al tubo PCR come descritto nel protocollo cDNA. Aggiungere l'enzima alla miscela per ultimo.
- Posizionare i tubi PCR in un termociclo con le seguenti impostazioni di corsa: 5 min a 25 °C, 40 min a 42 °C, 15 min a 85 °C e 4 °C di tenuta finale.
- Rimuovere i tubi PCR dal termociclo e utilizzare immediatamente o conservare a -20 °C fino a un ulteriore utilizzo.
10. Ciclo quantitativo PCR (qPCR) in tempo reale
- Preparare un cocktail di mix di reazioni per ciascuno dei geni da analizzare. Ogni reazione PCR da 15 μL richiede 7,5 μL di miscela di reagenti 2x, 0,75 μL di primer/sonda specifica del gene con etichetta 20X 5'-FAM e 3,75 μL di acqua priva di nucleasi. Gli ampliconi in genere vanno da 60 a 120 bp.
- Aggiungere 3 μL di modello cDNA per ogni gruppo sperimentale ai pozzi appropriati.
- Aggiungere 12 μL del cocktail mix di reazione specifico del gene ai pozzi appropriati.
- Coprire la piastra con pellicola adesiva ottica e centrifuga per 1 minuto a 1.000 x g per rimuovere eventuali bolle che potrebbero aver formato nei pozzi.
- Posizionare la piastra PCR in un termociclore PCR in tempo reale.
- Impostare il metodo di esecuzione come segue: 3 min a 95 °C, 40 cicli di 95 °C per 15 s seguiti da 60 °C per 1 min.
- Analizzare i dati normalizzando il gene di interesse per un controllo interno ed esprimere i dati da campioni infetti relativi a campioni di controllo non infetti utilizzando la formula 2-ΔΔCt e una trasformazione log2 dei numeri.
11. Istopatologia polmonare
- Rimuovere i polmoni dal cucciolo neonatale come descritto sopra.
- Posizionare il tessuto in un volume di formalina tamponata a neutro al 10% in modo che il rapporto tra soluzione e tessuto sia di circa 20:1 per 3-7 giorni.
- Coordinarsi con un servizio istologico appropriato per l'incorporamento di paraffina, il sessatura e la colorazione di ematossilina ed eosina (H&E). Per questo lavoro è stato utilizzato il West Virginia University Histopathology Core. In alternativa, seguire i protocolli19 descritti in precedenza.
12. Saggio di uccisione batterica in vitro
- Rimuovere la milza dal cucciolo neonatale non infetto come descritto sopra e posizionare in un cesto di nylon da 40 μm all'interno di una piastra di Petri sterile da 60 mm. Ripetere questo e la piscina si splesa in un unico tubo da raccogliere e omogeneizzare insieme.
- Aggiungere 5 mL di PBS integrati con FBS al 10%.
- Disaggregate il tessuto utilizzando uno stantuffo sterile per siringhe da 3 ml fino a creare una singola sospensione cellulare.
- Raccogliere la sospensione a cella singola all'esterno del cestello di nylon, trasferirli in un tubo di centrifuga da 15 ml e celle a pellet a 350 x g per 5 minuti.
- Sospendere i globuli nel tampone di lysis dei globuli rossi (2 mL per un massimo di 7-8 milza) e lasciarlo riposare per 5 minuti a temperatura ambiente per eliminare gli eriociti.
- Lavare gli splenociti con PBS e pellet come sopra.
- Sospendere gli splenociti in 0,25 mL di PBS integrati con 0,5% BSA e 2 mM EDTA in base alla resa cellulare prevista.
- Contare gli splenociti usando un emocitometro o un'altra applicazione appropriata.
- Isolare le cellule Ly6B.2+ (popolazione mieloide di granulociti / monociti infiammatori) con perline immunomagnetiche secondo il protocollo del produttore.
- Seme Ly6B.2+ cellule ad una densità di 1 x 105 celle per pozzo in una piastra nera o bianca da 96 porri in un volume di 0,1 mL di DMEM che contiene 10% FBS, 2 mM glutammina e 25 mM HEPES (mezzo completo).
- Enumerare il bioluminescente E. coli come descritto nella sezione 1 e preparare l'inoculo batterico alla molteplicità di infezione desiderata (MOI) in un volume finale di 0,1 mL. Questo è meglio fare facendo ciò che è necessario per tutti i pozzi in un MOI comune in batch.
- Aggiungere 0,1 mL di inoculo batterico o mezzo completo da solo come controllo. Incubare la piastra multi-pozzo a 37 °C e 5% CO2 per 1 h.
- Sostituire il supporto con 0,2 mL di supporti freschi completi che contengono gentamicina (100 μg/mL) rimuovendo delicatamente i supporti con una pipetta e aggiungendo supporti freschi con una nuova punta di pipetta. Riportare la coltura all'incubazione per ulteriori 2 ore.
- A 3 ore dopo l'infezione, misurare la luminescenza in ogni pozzo della piastra di coltura lidded dal basso usando un lettore di piastre e quindi riportare la coltura all'incubazione.
- Ripetere le misurazioni della luminescenza in altri punti di tempo desiderati.
Risultati
Questo protocollo ha indotto la sepsi batterica nei topi neonatale e abbiamo usato l'imaging intravitale longitudinale, l'enumerazione dei batteri nel sangue, le valutazioni istologiche della patologia e i profili di espressione della citochina infiammatoria per studiare il decorso della malattia. Segni di morbilità sono stati osservati nei cuccioli neonatale infettati sia da inoculi bassi (~2 x10 6 CFU) che alti (~7 x10 6 CFU) di E.coli nel tempo. I cuccioli che hanno ricevuto il maggiore inoculo mostravano segni più prominenti di angoscia che includevano una mobilità ridotta, l'incapacità di correggere la postura e la ridotta capacità di mantenere una posizione eretta di 24 ore dopo l'infezione (hpi). C'era, tuttavia, una serie di morbilità poiché alcuni cuccioli apparivano peggio di altri. Immediatamente dopo l'infezione, un animale a basse dosi è morto a causa dell'esposizione all'isoflurane durante una sessione di imaging per stabilire la linea di base. Con 24 hpi, due dei sei animali ad alte dosi hanno ceduto all'infezione sistemica (33,3% di mortalità). I cuccioli infetti che hanno ricevuto un inoculo ad alta o bassa dose pesavano significativamente meno dei loro compagni di controllo a 24 hpi (Figura 1A,B). Tutti i cuccioli che hanno ricevuto l'inoculo più alto hanno soddisfatto i criteri endpoint a 24 hpi. Come tale, tutti i cuccioli infetti in questo gruppo sono stati eutanasiati dopo l'imaging. I batteri nel sangue sono stati enumerati per un sottoinsieme di topi che hanno ricevuto l'inoculo inferiore e per tutti gli animali che hanno ricevuto l'inoculo più alto poiché erano tutti eutanasiati. I risultati di due esperimenti effettuati in modo analogo indicano che, mentre la maggior parte degli animali aveva alti livelli di batteri nel sangue (CFC/mL) a 24 hpi, alcuni animali non avevano batteri rilevabili nel sangue (Figura 1C). Questi ultimi suggeriscono che hanno eliminato l'infezione entro questo momento. Come previsto, i cuccioli che hanno ricevuto l'inoculo più alto avevano quasi tre ordini di grandezza più CFU/mL a 24 hpi rispetto ai cuccioli che hanno ricevuto l'inoculo a bassa dose (Figura 1C).
L'imaging animale vivo di batteri luminescenti ha ulteriormente confermato la diffusione di batteri e l'aumento della crescita dei cuccioli neonatale nel tempo a 10 e 24 hpi (Figura 2 e Figura 3). Inoltre, utilizzando l'imaging intravitale con il microCT, siamo stati in grado di identificare i focolai di infezione, tra cui ilcervello (Figura 2B),i polmoni (Figura 2B, Figura 3A,B) e altri tessuti periferici (Figura 2B). I polmoni di alcuni topi altamente infetti hanno dimostrato regioni opache coerenti con il consolidamento infiammatorio che co-localizzato al segnale batterico luminescente (Figura 3A). Queste regioni di presunto essudato infiammatorio non si trovano nei polmoni di controllo non infetti (Figura 3A). Ulteriori prove di una pronunciata risposta infiammatoria della citochina all'interno dei polmoni dei cuccioli infetti sono dimostrate dall'analisi dell'espressione genica di IL-1β, IL-6 e TNF-α. Un aumento significativo dell'espressione rispetto ai controlli è stato osservato per tutte e tre le citochine sia nei gruppi inoculo bassi che in quello alto (figura 4A). L'istopatologia del polmone è stata anche esaminata a 24 hpi in controllo e cuccioli infetti. Nonostante simili profili citochine infiammatorie, è stato comunemente osservato un progressivo aumento della patologia dall'inoculo inferiore a quello superiore. Rispetto ai tessuti provenienti da controlli non infetti, i polmoni dei cuccioli infetti hanno mostrato notevoli cambiamenti infiammatori, ispessimento della parete alveolare, aumento dell'emorragia alveolare e infiltrazione infiammatoria (Figura 4B). Nelle infezioni più gravi, la congestione polmonare e le aree di emorragia hanno contribuito ad una massiccia riduzione dello spazio all'aperto (figura 4B). Collettivamente, questi risultati dimostrano che nel nostro modello di sepsi neonatale ad esordio precoce, la diffusione di batteri luminescenti può essere seguita nel tempo da un sito di inoculazione subscapulare a importanti focolai di infezione e causare infiammazione e patologia significative negli animali gravemente infetti.
Per studiare i fattori ospiti che contribuiscono all'uccisione batterica da parte di cellule immunitarie innate come monociti, macrofagi e neutrofili, abbiamo sviluppato un saggio in vitro sensibile per misurare la clearance batterica. Ly6B.2+ le cellule isolate dalle milza dei topi neonatale sono state infettate da E. coli bioluminescente a una gamma di MOI per 1 h e quindi trattate con gentamicina per uccidere i batteri extracellulari. A 3, 6, 20 e 48 hpi, la luminescenza intracellulare è stata misurata con un lettore multimodale. Come previsto, con l'aumento del MOI, è stato registrato un segnale più luminescente a 3 ore(figura 5). A poco a poco, questo segnale è stato perso, indicativo di gioco batterico (Figura 5). Questo saggio è suscettibile di citochine integrate, neutralizzazione di effettiatori secreti e l'aggiunta di inibitori farmacologici delle vie cellulari per studiare interventi che possono promuovere la clearance batterica e servire a migliorare i risultati nel modello di sepsi neonatale qui descritto.

Figura 1: Cambiamenti nel peso corporeo e nella replicazione batterica nei topi neonatale settici.
(A,B) I singoli pesi del topo all'interno di un gruppo (basso e alto) espressi in percentuale del peso medio dei cuccioli di controllo dei littermate. I dati sono presentati come percentuale media ± SEM. I singoli test t in ogni momento post-infezione rivelano differenze significative a 24 ore tra cuccioli di controllo e cuccioli che hanno ricevuto il basso inoculo (p<0.0001) (A), o tra cuccioli di controllo e cuccioli che hanno ricevuto l'alto inoculo (p=0,0031) (B). (C) Il CFU/mL nel sangue a 24 hpi è stato trasformato in log e presentato come il test medio ± SEM. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: L'imaging intravitale dimostra la diffusione di batteri nei topi neonatale nel tempo.
(A) Un topo neonatale rappresentativo (#1) infetto da un inoculo di ~2 x 106 CFU è mostrato ai tempi 0, 10 e 24 hpi. Per ogni punto di tempo viene visualizzata una scala colorimetrica con i valori di luminosità minima e massima per punto di tempo. I topi a 0 e 10 ore vengono visualizzati sia sulla loro scala dei punti di tempo che sulla scala di 24 ore per dimostrare i cambiamenti nella crescita batterica nel tempo. (B) Sono mostrate immagini microCT rappresentative ricostruite in 3D dello stesso mouse neonatale a 10 e 24 hpi. Ogni punto di tempo ha immagini in alto, prospettive transassiali e coronali. Nell'immagine transassiale a 24 hpi, il piano si è spostato verso la periferia del mouse per visualizzare meglio i focolai di infezione nei tessuti periferici. Le frecce bianche indicano il cervello e il rene a 10 hpi e il rene e il polmone a 24 hpi. Clicca qui per visualizzare una versione più grande di questa figura.
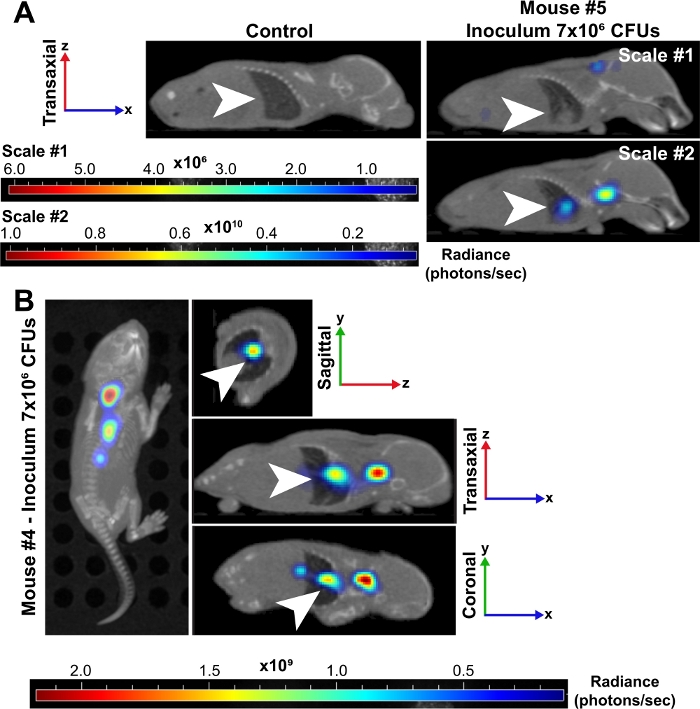
Figura 3: I polmoni sono un sito di grave infezione durante la sepsi batterica nei neonati.
(A) Le immagini rappresentative in microCT ricostruite in 3D di un topo neonatale (#5) infettato da un inoculo di ~7 x 106 CFU sono mostrate a 24 hpi rispetto a un controllo non infetto. Entrambi i topi sono visualizzati nella prospettiva transassiale e i polmoni sono indicati da frecce bianche. Il topo infetto è stato posizionato su due scale di luminosità (fotoni/sec). Scale #1 include tutte e 6 le lunghezze d'onda (500, 520, 560, 580, 600, 620 nm) e la scala #2 include solo lunghezze d'onda 500, 520 e 560 nm. Questa seconda scala ci ha permesso di visualizzare un segnale aumentato nei batteri nei polmoni perché le lunghezze d'onda più basse sono più assorbite dai tessuti e producono un segnale più forte. (B) Le immagini microCT rappresentative ricostruite in 3D di un topo neonatale (#4) infettato da un inoculo di ~7 x 106 CFU sono mostrate a 24 hpi. Questo punto di tempo ha immagini in alto, sagittale, transassiale e coronale. Le frecce bianche indicano focolai di infezione nei polmoni. Clicca qui per visualizzare una versione più grande di questa figura.
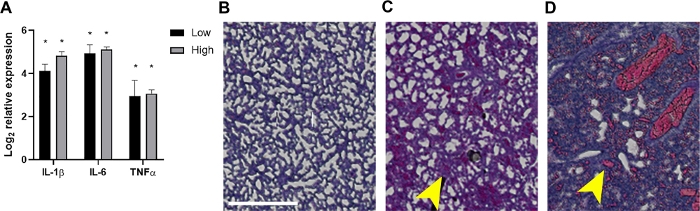
Figura 4: Infiammazione e risultati istopatologici associati nei polmoni dei neonati settici.
A 24 hpi i polmoni sono stati raccolti da cuccioli che hanno ricevuto ~ 2 x 106 o 7 x 106 CFC o controlli non infetti. (A) L'RNA è stato isolato e l'espressione di IL-1β, IL-6 o TNF-α come determinato rispetto ai controlli non infetti da PCR quantitativo in tempo reale usando la formula 2-ΔΔCt. I dati sono mostrati come la modificatrasformata media del log 2 nell'± SEM per ogni inoculo come indicato. La significatività statistica è stata determinata utilizzando test t non accoppiati di valori ΔCt tra i singoli geni della citochina e il controllo interno nell'intervallo di confidenza del 95%. Gli asterischi indicano p<0.01. (B-D) Vengono mostrate sezioni istopatologiche dei tessuti polmonari macchiati di H&E (20x, area di interesse costruita in maschera di ritaglio e ingrandita per chiarezza). Sono mostrati tessuti polmonari provenienti da un controllo rappresentativo non infetto (B) o da un neonato infetto all'inoculo basso (C) o alto (D). Le frecce gialle indicano ispessimento alveolare (C) o emorragia (D). Barra di scala = 500 μm. Clicca qui per visualizzare una versione più grande di questa figura.
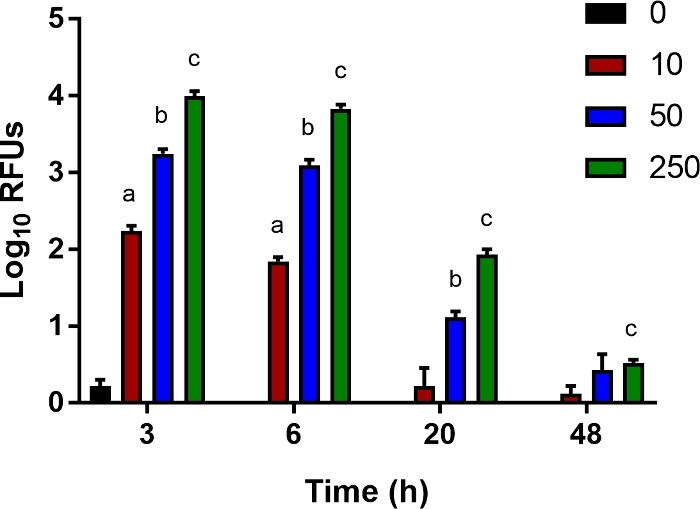
Figura 5: Un saggio in vitro per la clearance batterica.
Le cellule Ly6B.2+ sono state isolate dalle milza dei neonati di controllo non infetti. Le cellule sono state seminate in piastre a 96 potte e infettate da E. coli O1:K1:H7 che esprime luciferasi ad una molteplicità di infezione (MOI) di 10, 50 o 250 come indicato. Dopo 1 h, il mezzo è stato sostituito con fresco che conteneva gentamicina (100 μg/ mL). Vengono mostrate unità di luce relativa media (RLU) ± SE per un singolo esperimento rappresentativo del multiplo. La significatività statistica nell'intervallo di confidenza del 95% è stata determinata utilizzando test t non accoppiati con la correzione di Welch; gli asterischi indicano p<0.05. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Il nostro modello di infezione subscapulare per indurre sepsi batterica nei topi neonatale è un nuovo metodo per studiare la diffusione longitudinale degli agenti patogeni batterici in tempo reale. L'imaging intravitale offre l'opportunità di esplorare la diffusione batterica in tempo reale nei neonati. Questo è fondamentale per comprendere la cinetica della diffusione batterica e per studiare ulteriormente la risposta e il danno dell'ospite nella fase appropriata della malattia. Ai cuccioli di topo viene somministrata un'iniezione sottocutanea e sottoscapulare di inoculo batterico. Questa tecnica di iniezione è più semplice di altre alternative comunemente utilizzate, come la vena della coda e le infezioni intraperitoneali, in quanto richiede meno precisione all'interno di un sito di iniezione. Questo è importante date le piccole dimensioni dei cuccioli. L'imaging intravitale consente una valutazione longitudinale della proliferazione batterica e della diffusione nei tessuti periferici e nel sistema nervoso centrale nel tempo senza la necessità di sacrificare l'animale. Approcci e tecnologie di imaging simili sono stati utilizzati per lo studio della biologia del cancro e dellametastasi 20,21. Inoltre, mentre un altro studio ha citato l'uso dell'imaging bioluminescente durante un'infezione da E. coli nei ratti neonatali22, qui, abbiamo applicato l'approccio ai topi neonatale, in cui la nostra metodologia consente la valutazione della cinetica batterica durante la sepsi murina. La visualizzazione dei batteri si basa sull'emissione di luce bioluminescente a varie lunghezze d'onda dai batteri (ad esempio, attività batterica della luciferasi) all'interno dell'animale. La bioluminescenza viene quindi visualizzato attraverso una telecamera CCD (Charged Coupled Device) raffreddata. La bioluminescenza visualizzata risultante può quindi essere ricostruita in un'immagine 3D che mostra effetti sia spaziali che temporale-dipendenti dei batteri all'interno di un animale. Per un ulteriore strato più sfumato di acquisizione dei dati, l'identificazione degli animali di successo attraverso il tatuaggio della coda consente una valutazione ripetuta delle misure dei singoli cuccioli nel tempo e l'identificazione di possibili outlier all'interno di un determinato gruppo sperimentale.
L'applicazione di maggior successo del modello descritto richiede precisione nella preparazione dell'inoculo batterico. Qui descriviamo un metodo ottimizzato per la preparazione batterica utilizzando una curva di crescita E. coli prestabilita e convalidata che riduce la variazione tra il bersaglio e l'inoculo effettivo. Ciò consente la riproducibilità sperimentale in un inoculo previsto. L'inclusione di due inoculi nel nostro modello ha dimostrato esiti dose-dipendenti nei CFC del sangue, mortalità e patologia polmonare. Tuttavia, alcuni aspetti della traiettoria della malattia non dipendevano dalla dose. Il mancato aumento di peso negli animali infetti non dipendeva dall'inoculo a 24 hpi. Inoltre, livelli simili di espressione infiammatoria della citochina sono stati osservati nel polmone in risposta all'infezione da entrambi gli inoculi. Resta da determinare se questo modello sarebbe stato replicato o meno in tutti i tessuti in cui sono stati osservati batteri, come il rene, il fegato, la milza e il cervello. Oltre alla sepsi, E. coli O1:K1:H7 è associato alla meningite nella popolazione neonatale23. Questa infezione cerebrale si verifica quando i batteri della periferia invadono e penetrano nella barriera ematica. Studi futuri esploreranno questo aspetto del modello attraverso l'analisi dei cambiamenti nell'espressione delle proteine di giunzione stretta, oltre a testare diverse gamme di inoculi batterici. Un'ulteriore modifica durante l'imaging intravitale include l'aggiunta di un singolare batuffolo di cotone, covato in isoflurane, che viene posizionato a circa 2-3 pollici di distanza dai topi durante l'imaging. In risposta a precedenti esperimenti in cui i cuccioli neonatale hanno ripreso conoscenza durante la sessione di imaging, impedendo un'accurata acquisizione di immagini, ora posizionare il batuffolo di cotone abbastanza vicino ai topi da mantenerli continuamente anestetizzati durante l'imaging. Tuttavia, è importante che questo non sia fatto così vicino che non riescono a riprendersi dall'anestesia.
Sebbene flessibile e facilmente adattabile per lo studio della cinetica di diversi batteri in vari modelli di animali e malattie, il nostro protocollo ha alcune limitazioni da considerare. La prima limitazione da considerare è che la via subscapulare dell'infezione non rispecchia una via naturale di trasmissione. Tuttavia, un obiettivo primario nello sviluppo del nostro modello fin dall'inizio era quello di stabilire un modo di parto facilmente riproducibile che potesse essere utilizzato per stabilire un'infezione sistemica che replica aspetti della malattia umana. Pertanto, in questa relazione, descriviamo un modello di sindrome della sepsi a esordio precoce umano, non un modello di trasmissione naturale. Esiste un modello consolidato di somministrazione orale nei ratti neonatali che replica alcuni aspetti della trasmissione umana comune, come la colonizzazione iniziale dell'infezione da E. coli nel canale alimentare e la successiva diffusione al flusso sanguigno e ai tessuti periferici, incluso ilcervello 22. Il modello stabilito da Witcomb e colleghi incorpora anche bioluminescenti E. coli e imaging intravitale. Inoltre, è fondamentale ridurre al minimo l'esposizione all'isoflurane, così come iniettare, tatuare la coda e gestire i cuccioli il più rapidamente possibile senza compromettere l'accuratezza e la precisione delle tecniche nel tentativo di mitigare i livelli di stress sia per i neonati che per le dighe. In alcuni casi, se i cuccioli sperimentano manipolazioni migliorate indotte dall'uomo e / o sperimentali, le dighe possono smettere di allattare e prendersi cura dei cuccioli, con conseguente diminuzione della sopravvivenza non correlata all'infezione. Allo stesso modo, i cuccioli che sono esposti all'isoflurane per periodi prolungati oltre i circa 10 minuti di una sessione di imaging hanno un aumento del rischio di morte; pertanto è fondamentale fornire un isoflurane sufficiente per anestetizzare sufficientemente i topi, ma non abbastanza per eutanasiarli. Un ultimo punto di riflessione è il limite della sensibilità. Tessuti in cui sono stati enumerati meno di10 4 CFC/mL E. coli il segnale luminescente registrato cade nella fascia bassa dell'intervallo rilevabile, secondo il metodo di ridimensionamento utilizzato nel software di imaging3. Pertanto, alcuni tessuti possono essere colonizzati con bassi livelli di batteri ma appaiono senza bioluminescenza visibile.
Attualmente, la maggior parte degli studi utilizza metodi adulti di diffusione batterica, come iniezioni intraperitoneali (i.p.) e delle vene della coda per i neonati. Pluschke e Pelkonen hanno analizzato l'effetto di E. coli K1 sui topi neonatale attraverso i.p., vena di coda e infezioni orali24. Questo studio ha dimostrato che diversi genotipi di topi con immunodeficienze sono più suscettibili al ceppo K1; tuttavia, molti aspetti della risposta immunitaria dell'ospite all'infezione e i meccanismi per la diffusione batterica non vengono indirizzati. Deshmukh e colleghi hanno infettato i topi neonatali intraperitonealmente con E. coli K1 o K. pneumoniae e hanno misurato i CFU nella milza e nel fegato a 72 hpi25. Questo studio ha anche analizzato alcuni aspetti della risposta dell'ospite all'infezione basata sulla pre-esposizione dei topi agli antibiotici. Tuttavia, non è stata affrontata un'indagine approfondita sulla diffusione batterica ai tessuti periferici e al sangue nel tempo in parallelo con la profilazione infiammatoria nello stesso tessuto (diversa dalla granulocitosi). Altri studi sulla sepsi neonatale nei topi con Staphylococcus aureus, Staphylococcus epidermidis,Gruppo B Streptococcused E. coli esplorano vari aspetti del sistema immunitario ospite in risposta all'infezione. Tuttavia, nessuno di questi studi utilizza l'imaging intravitale per esplorare la cinetica della diffusione batterica o della localizzazione dei focolaidi infezione 23,25,26,27. Il nostro metodo di infezione e imaging intravitale, combinato con la valutazione del carico batterico e la profilazione infiammatoria dei tessuti periferici, ci consente di esaminare in modo completo aspetti sia dell'ospite che dell'agente patogeno durante l'infezione, fornendo una comprensione più precisa dell'interazione ospite-patogeno durante la sepsi.
Intendiamo utilizzare questo modello di infezione e imaging per promuovere la nostra comprensione della sepsi neonatale ad esordio precoce utilizzando una varietà di batteri patogeni comunemente responsabili della sepsi nei neonati, tra cui streptococchi del gruppo B, K. pneuomoniaee Listeria monocytogenes. Questo modello di infezione ci permetterà di confrontare longitudinalmente la diffusione di diversi agenti patogeni batterici in parallelo con la risposta dell'ospite nei neonati. Inoltre, questo modello è adattabile al trasferimento adottivo di specifici tipi di cellule immunitarie (coniugate fluorescentmente) per studiare la loro migrazione verso siti di infezione e la successiva influenza sulla risposta dell'ospite e sul controllo dei batteri. Ciò offre l'opportunità di comprendere meglio le interazioni ospite-patogeno che si verificano durante la sepsi nella prima infanzia in modi che non sono stati precedentemente dimostrati.
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto da fondi istituzionali a C.M.R.
Materiali
| Name | Company | Catalog Number | Comments |
| 1 mL Insulin Syringe | Coviden | 1188128012 | Inoculum or PBS injection |
| 10% Neutral Buffered Formalin | VWR | 89370-094 | Histopathology |
| ACK Lysis Buffer | Gibco | LSA1049201 | Bacterial clearance assay |
| Animal Tattoo Ink Paste | Ketchum | KI1482039 | Animal identification |
| Animal Tattoo Ink Green Paste | Ketchum | KI1471039 | Animal identification |
| Anti-Ly-6B.2 Microbeads | Miltenyi Biotec | 130-100-781 | Cell isolation |
| Escherichia coli O1:K1:H7 | ATCC | 11775 | |
| Escherichia coli O1:K1:H7-lux (expresses luciferase) | N/A | N/A | Constructed in-house at WVU |
| E.Z.N.A. HP Total Extraction RNA Kit | Omega Bio-tek | R6812 | RNA extration |
| DPBS, 1X | Corning | 21-031-CV | |
| Difco Tryptic Soy Agar | Becton, Dickinson and Company | 236950 | Bacterial growth |
| IL-1 beta Primer/Probe (Mm00434228) | Thermo Fisher Scientific | 4331182 | Cytokine expression qPCR |
| IL-6 Primer/Probe (Mm00446190) | Thermo Fisher Scientific | 4331182 | Cytokine expression qPCR |
| iQ Supermix | Bio-Rad | 1708860 | Real-time quantitative PCR |
| iScript cDNA Synthesis Kit | Bio-Rad | 1708891 | cDNA synthesis |
| Isolation Buffer | Miltenyi Biotec | N/A | Bacterial clearance assay |
| IVIS Spectrum CT and Living Image 4.5 Software | Perkin Elmer | N/A | Intravital imaging |
| LB Broth, Lennox | Fisher BioReagents | BP1427-500 | Bacterial growth |
| EASYstrainer (Nylon Basket) | Greiner Bio-one | 542 040 | Cell strainer |
| SpectraMax iD3 | Molecular Devices | N/A | Plate reader |
| Pellet Pestle Motor | Grainger | 6HAZ6 | Tissue homogenization |
| Polypropylene Pellet Pestles | Grainger | 6HAY5 | Tissue homogenization |
| Prime Thermal Cycler | Techne | 3PRIMEBASE/02 | cDNA synthesis |
| TNF-alpha Primer/Probe (Mm00443258) | Thermo Fisher Scientific | 4331182 | Cytokine expression qPCR |
| TriReagent (GTCP) | Molecular Research Center | TR 118 | RNA extration |
Riferimenti
- Qazi, S. A., Stoll, B. J. Neonatal sepsis: a major global public health challenge. Pediatr Infect Dis J. 28, 1-2 (2009).
- Simonsen, K. A., Anderson-Berry, A. L., Delair, S. F., Davies, H. D. Early-onset neonatal sepsis. Clinical Microbiology Reviews. 27 (1), 21-47 (2014).
- Seman, B. G., et al. Elevated levels of interleukin-27 in early life compromise protective immunity in a mouse model of Gram-negative neonatal sepsis. Infections and Immunity. , (2019).
- Schrag, S. J., et al. Epidemiology of Invasive Early-Onset Neonatal Sepsis, 2005 to 2014. Pediatrics. 138 (6), 20162013(2016).
- Stoll, B. J., et al. Early onset neonatal sepsis: the burden of group B Streptococcal and E. coli disease continues. Pediatrics. 127 (5), 817-826 (2011).
- Weston, E. J., et al. The burden of invasive early-onset neonatal sepsis in the United States, 2005-2008. Pediatrics and Infectious Disease Journal. 30 (11), 937-941 (2011).
- Hornik, C. P., et al. Early and late onset sepsis in very-low-birth-weight infants from a large group of neonatal intensive care units. Early Human Development. , Suppl 2 69(2012).
- Vergnano, S., Sharland, M., Kazembe, P., Mwansambo, C., Heath, P. T. Neonatal sepsis: an international perspective. Archives of Disease in Childhood: Fetal and Neonatal Edition. 90 (3), 220-224 (2005).
- Kraft, J. D., et al. Neonatal macrophages express elevated levels of interleukin-27 that oppose immune responses. Immunology. 139 (4), 484-493 (2013).
- Basha, S., Surendran, N., Pichichero, M. Immune responses in neonates. Expert Reviews of Clinical Immunology. 10 (9), 1171-1184 (2014).
- Gleave Parson, M., et al. Murine myeloid-derived suppressor cells are a source of elevated levels of interleukin-27 in early life and compromise control of bacterial infection. Immunology and Cell Biology. 97 (5), 445-446 (2018).
- Adkins, B., Leclerc, C., Marshall-Clarke, S. Neonatal adaptive immunity comes of age. Nature Reviews Immunology. 4 (7), 553-564 (2004).
- Kim, S. K., Keeney, S. E., Alpard, S. K., Schmalstieg, F. C. Comparison of L-selectin and CD11b on neutrophils of adults and neonates during the first month of life. Pediatrics Research. 53 (1), 132-136 (2003).
- Velilla, P. A., Rugeles, M. T., Chougnet, C. A. Defective antigen-presenting cell function in human neonates. Clinical Immunology. 121 (3), 251-259 (2006).
- Le Garff-Tavernier, M., et al. Human NK cells display major phenotypic and functional changes over the life span. Aging Cell. 9 (4), 527-535 (2010).
- Weinberger, B., et al. Mechanisms underlying reduced responsiveness of neonatal neutrophils to distinct chemoattractants. Journal of Leukocyte Biology. 70 (6), 969-976 (2001).
- Gabrilovich, D. I., Nagaraj, S. Myeloid-derived suppressor cells as regulators of the immune system. Nature Reviewss Immunology. 9 (3), 162-174 (2009).
- National Research Council. Guide for the care and use of laboratory animals, 8th ed. , National Academies Press. Washington, DC. (2011).
- Tucker, D. K., Foley, J. F., Bouknight, S. A., Fenton, S. E. Sectioning Mammary Gland Whole Mounts for Lesion Identification. Journal of Visualized Experiments. (125), e55796(2017).
- Bayarmagnai, B., Perrin, L., Esmaeili Pourfarhangi, K., Gligorijevic, B. Intravital Imaging of Tumor Cell Motility in the Tumor Microenvironment Context. Methods in Molecular Biology. 1749, 175-193 (2018).
- Beerling, E., Ritsma, L., Vrisekoop, N., Derksen, P. W., van Rheenen, J. Intravital microscopy: new insights into metastasis of tumors. Journal of Cell Science. 124, Pt 3 299-310 (2011).
- Witcomb, L. A., Collins, J. W., McCarthy, A. J., Frankel, G., Taylor, P. W. Bioluminescent Imaging Reveals Novel Patterns of Colonization and Invasion in Systemic Escherichia coli K1 Experimental Infection in the Neonatal Rat. Infection and Immunity. 83 (12), 4528(2015).
- Singh, K., et al. Inter-alpha inhibitor protein administration improves survival from neonatal sepsis in mice. Pediatric Research. 68 (3), 242-247 (2010).
- Pluschke, G., Pelkonen, S. Host factors in the resistance of newborn mice to K1 Escherichia coli infection. Microb. Patho. , 93-102 (1988).
- Mancuso, G., et al. Role of interleukin 12 in experimental neonatal sepsis caused by group B streptococci. Infections and Immunity. 65 (9), 3731-3735 (1997).
- Thammavongsa, V., Rauch, S., Kim, H. K., Missiakas, D. M., Schneewind, O. Protein A-neutralizing monoclonal antibody protects neonatal mice against Staphylococcus aureus. Vaccine. 33 (4), 523-526 (2015).
- Andrade, E. B., et al. TLR2-induced IL-10 production impairs neutrophil recruitment to infected tissues during neonatal bacterial sepsis. Journal of Immunology. 191 (9), 4759-4768 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon