Method Article
Ein neonatales Bildgebungsmodell der gramnegativen bakteriellen Sepsis
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Die Infektion von neonatalen Mäusen mit biolumineszierendem E. coli O1:K1:H7 führt zu einer septischen Infektion mit signifikanter Lungenentzündung und Lungenpathologie. Hier beschreiben wir Verfahren zur Modellierung und weiteren Untersuchung der neonatalen Sepsis unter Verwendung von längsinaler intravitaler Bildgebung parallel zur Aufzählung systemischer bakterieller Belastungen, entzündlicher Profilierung und Lungenhistopathologie.
Zusammenfassung
Neonate haben ein erhöhtes Risiko für bakterielle Sepsis aufgrund des einzigartigen Immunprofils, das sie in den ersten Lebensmonaten zeigen. Wir haben ein Protokoll zur Untersuchung der Pathogenese von E. coli O1:K1:H7, einem Serotyp, der für hohe Sterblichkeitsraten bei Neonaten verantwortlich ist, erstellt. Unsere Methode nutzt intravitale Bildgebung von neonatalen Welpen zu verschiedenen Zeitpunkten während des Fortschreitens der Infektion. Diese Bildgebung, parallel zur Messung von Bakterien im Blut, entzündliche Profilierung und Gewebehistopathologie, bedeutet einen strengen Ansatz zum Verständnis der Infektionsdynamik während der Sepsis. Im aktuellen Bericht modellieren wir zwei infektiöse Inokulaums zum Vergleich der bakteriellen Belastungen und der Schwere der Krankheit. Wir stellen fest, dass subscapulare Infektion führt zu einer disseminierten Infektion durch 10 h Post-Infektion. Bis 24 h war eine Infektion mit lumineszierendem E. coli im Blut, in der Lunge und anderen peripheren Geweben reichlich vorhanden. Die Expression von entzündlichen Zytokinen in der Lunge ist bei 24 h signifikant, gefolgt von einer zellulären Infiltration und Hinweisen auf Gewebeschäden, die mit der infektiösen Dosis zunehmen. Intravital-Bildgebung hat einige Einschränkungen. Dazu gehören eine leuchtende Signalschwelle und einige Komplikationen, die bei Neonaten während der Anästhesie auftreten können. Trotz einiger Einschränkungen stellen wir fest, dass unser Infektionsmodell einen Einblick bietet, um die Dynamik der Längsinfektion bei neonataler muriner Sepsis zu verstehen, die bis heute nicht gründlich untersucht wurde. Wir erwarten, dass dieses Modell auch angepasst werden kann, um andere kritische bakterielle Infektionen im frühen Leben zu untersuchen.
Einleitung
Bakterielle Sepsis ist ein wichtiges Anliegen für Neonate, die ein einzigartiges Immunprofil in den ersten Tagen des Lebens aufweisen, die keinen angemessenen Schutz vorInfektionenbieten 1 . Neonatale Sepsis ist nach wie vor ein erhebliches US-Gesundheitsproblem, das mehr als 75.000 Fälle pro Jahr allein in den USA ausmacht2. Um diese Infektionen eingehend zu untersuchen, sind neuartige Tiermodelle erforderlich, die Aspekte menschlicher Krankheiten rekapitulieren. Wir haben ein neonatales Mausinfektionsmodell mit Escherichia coli, O1:K1:H73. E. coli ist die zweithäufigste Ursache für neonatale Sepsis in den USA, ist aber für die Mehrheit der Sepsis-assoziierten Sterblichkeit4,5verantwortlich. Es ist jedoch die Hauptursache, wenn Vor- und sehr niedrige Geburtsgewicht (VLBW) Babys unabhängig betrachtet werden5. Der K1-Serotyp wird am häufigsten mit invasiven Blutkreislaufinfektionen und Meningitis bei Neonaten6,7in Verbindung gebracht. Derzeit gibt es keine anderen Behandlungsmöglichkeiten als Antibiotika und unterstützende Pflege. In der Zwischenzeit steigen die Antibiotikaresistenzraten für viele pathogene Bakterien weiter an, wobei einige Stämme von E. coli gegen eine Vielzahl von Antibiotika resistent sind, die häufig in der Behandlung verwendet werden8. Daher ist es unerlässlich, dass wir weiterhin Methoden generieren, um die Mechanismen der Sepsis und die Wirtsreaktion in Neonaten zu untersuchen. Diese Ergebnisse können dazu beitragen, aktuelle Behandlungen und Infektionsergebnisse zu verbessern.
Der Immunzustand von Neonaten ist sowohl durch phänotypische als auch funktionelle Unterschiede im Vergleich zu Erwachsenen gekennzeichnet. Zum Beispiel, erhöhte Konzentrationen von entzündungshemmenden und regulatorischen Zytokinen, wie Interleukin (IL)-10 und IL-27, haben gezeigt, dass durch Nabelschnurblut-abgeleitete Makrophagen produziert werden und sind in höheren Konzentrationen im Serum der murinen Neonate9,10,11. Dies stimmt mit niedrigeren IFN-α-, IFN-ɣ-, IL-12- und TNF-α überein, die häufig von neonatalen Zellen im Vergleich zu erwachsenen Pendants berichtet werden10. Darüber hinaus ist das neonatale Immunsystem in Richtung einer Th2 und regulatorischen T-Zell-Antwort im Vergleich zu Erwachsenen12verzerrt. Erhöhte Anzahl von Neutrophilen, T-Zellen, B-Zellen, NK-Zellen und Monozyten sind auch in Neonaten vorhanden, aber mit erheblichen funktionellen Beeinträchtigungen. Dazu gehören Defekte in der Expression von Zelloberflächenmarkern und Antigendarstellungen, die auf Unreife13,14,15hindeuten. Darüber hinaus sind neonatale Neutrophile signifikant mangelhaft in ihrer Fähigkeit, zu chemotaktischen Faktoren zu migrieren16. Myeloide-abgeleitete Suppressorzellen (MDSCs) sind auch auf erhöhten Niveaus in Neonaten gefunden und vor kurzem gezeigt, dass eine Quelle von IL-2711. MDSCs sind gegenüber T-Zellen17stark unterdrückend. Zusammen zeigen diese Daten Einschränkungen der neonatalen Immunität, die eine erhöhte Anfälligkeit für Infektionen verleihen.
Um das Fortschreiten der bakteriellen Belastung zu untersuchen und schützende Wirtsimmunreaktionen während einer neonatalen Sepsis zu sezieren, haben wir ein neuartiges Infektionsmodell entwickelt. Neonatale Mäuse an den Tagen 3-4 des Lebens sind schwierig, in den intraperitonealen Raum oder Schwanz Vene zu injizieren. In unserem Modell werden Tag 3 oder 4 Welpen das bakterielle inokulum oder PBS subkutan in den Skapulierbereich verabreicht. Eine systemische Infektion entwickelt sich und mit lumineszierenden E. coli O1:K1:H7 können wir einzelne neonatale Mäuse längs abbilden, um der verbreiteten bakteriellen Belastung in peripheren Geweben zu folgen. Dies ist das erste gemeldete Modell, um intravitale Bildgebung zu nutzen, um die Kinetik der Verbreitung von Bakterien während der Sepsis in murinen Neonaten zu verstehen3.
Hier beschreiben wir ein Protokoll zur Induzieren septischer E. coli-Infektionen bei neonatalen Mäusen3. Wir beschreiben, wie man das bakterielle Inokulum für die Injektion vorbereitet und wie man Gewebe für die Beurteilung der Pathologie, die Messung von Entzündungsmarkern durch Genexpressionsanalyse und die Aufzählung der bakteriellen Belastung erntet. Darüber hinaus wird die Verwendung von lumineszierendem E. coli für die intravitale Bildgebung infizierter Neugeborenen und die Quantifizierung der bakteriellen Tötung durch neonatale Immunzellen beschrieben. Diese Protokolle können auch angepasst werden, um andere wichtige bakterielle Infektionen bei Neonaten zu untersuchen. Die hier vorgestellten Daten stellen einen neuartigen Gesamtansatz zum Verständnis der Infektionsdynamik in einem übersetzbaren neonatalen Sepsismodell dar.
Protokoll
Alle Verfahren wurden von den West Virginia Institutional Animal Care and Use Committees genehmigt und in Übereinstimmung mit den Empfehlungen des Guide for the Care and Use of Laboratory Animals durch den National Research Council18durchgeführt.
1. Herstellung von bakteriellem Inokulum
- Streifen Sie eine Tryptic Soja-Agar -Platte (TSA) mit einer Impfschlaufe zur Isolierung einer einzelnen Kolonie aus einem Gefrierbestand von E. coli O1:K1:H7-lux, die stabil luziferase ausdrückt und Kanamycin-Widerstandträgt 3. Über Nacht bei 37 °C inkubieren.
- Am nächsten Tag kann die Luria-Brühe (LB) in einem Biosicherheitsschrank auf Raumtemperatur (25 °C) kommen.
- Identifizieren Sie unter einer Biosicherheits-Schrankhaube eine einzelne Kolonie aus der gestreiften Platte und impfen Sie sie in 3 ml LB, ergänzt mit Kanamycin (30 g/ml). Über Nacht bei 37 °C mit Schütteln (220 Rpm) inkubieren. Das ist die Starterkultur.
- Die Starterkultur 1:100 in eine frische 3 ml LB unter einer Biosicherheits-Schrankhaube verdünnen und bei 37 °C mit Schütteln (220 U/min) für 2-3 h in den Inkubator zurückgeben. Das ist die Aktienkultur.
- Lesen Sie die optische Dichte (OD) sowohl der Rohlings- als auch der Bestandskultur bei 600 nm mit einem Spektralphotometer. Fügen Sie 100 l LB (ohne Bakterien) in einen Brunnen einer 96 gut flachen Boden-Assay-Platte; Dies ist das Leerzeichen. Dann fügen Sie 100 l aus der Bestandskultur zu einem separaten Brunnen hinzu. Wiederholen Sie diesen Vorgang für zwei weitere Replikationen. Die Absorption wird mit einem Plattenleser abgelesen.
- Subtrahieren Sie die Leerabsorption vom Absorptionswert der Bestandskultur (dem OD-Wert) und vergleichen Sie mit einer zuvor generierten und validierten Wachstumskurve, um eine Annäherung der Bakteriendichte in der Bestandskultur zur Herstellung einer infektiösen Dosis zu bestimmen.
- Generieren Sie Zielinokulume in Abhängigkeit von der Forschungsfrage. Für diese Studie wurden Zielinokulum von 2 x 106 (niedrig) und 7 x 106 (hohe) koloniebildende Einheiten (KBE) pro Maus (/Maus) verwendet.
- Dividieren Sie die Zieldosis pro Maus (DoseT) durch die geschätzte Konzentration von Bakterien in der Bestandskultur (Bestand), um das Volumen der Bakterien aus dem Stockrohr (VS) zu erhalten.
- Multiplizieren Sie VS mit der Anzahl der Mäuse (NM), die infiziert werden müssen, zusammen mit genug für 5-10 Extras für die Gesamtmenge der Bakterien, die für die Infektion benötigt werden, plus 5-10 zusätzliche Dosen. Entfernen Sie dieses Volumen aus dem Lagerrohr und fügen Sie es einem neuen Zentrifugenrohr hinzu.
- Verwenden Sie die folgende Gleichung:
DosisT/Stock = VS x NM = Gesamtvolumen (VT) von Bakterien, die aus dem Stockrohr entfernt werden sollen.
- Zentrifugieren Sie die Bakterien bei 2.000 x g für 5 min bei 4 °C und setzen Sie das bakterielle Pellet in 50 l PBS (pH 7,2-7,6) pro zu befallender Maus wieder auf (z. B. für 10 Dosen von 2 x 106 Bakterien pro Dosis würde das Pellet von 2 x 107 Bakterien in 500 l PBS resuspendiert werden). Auch hier wird empfohlen, mehr Inokulum als erforderlich vorzubereiten. Bereiten Sie ein gleiches PBS-Volumen nur für Steuerelementimpfungen vor. Halten Sie die infektiöse Inokulum- und PBS-Kontrolle auf Eis bis zur Infektion aufrecht.
- Führen Sie sieben zehnfache serielle Verdünnungen in PBS in einer 96 gut Kunststoffbodenverdünnungsplatte und Platte 25 l der Verdünnungen in doppelter Aufweise auf Quadranten-TSA-Platten, ergänzt mit Kanamycin (30 g/ml), um die tatsächliche Menge der verabreichten Bakterien aufzuzählen. Bei 37 °C über Nacht für die Koloniebildung vor der Aufzählung inkubieren.
2. Tieridentifikation
- Ordnen Sie eine ausreichende Anzahl von Brutpaaren so an, dass Würfe für altersgerechte Welpen synchronisiert werden können. Altersvariabilität von ± 1 Tag ist akzeptabel.
- Identifizieren Sie eine schwangere C57BL/6 weibliche Maus und überwachen Sie die Geburt des Wurfs vor dem geplanten Experiment, um das Alter genau zu bestimmen.
- Um zwischen Kontrolliert und infizierten 3- oder 4-Tage-Welpen zu unterscheiden, verwenden Sie ein Paar kleine, feingekippte Irisschere, um die Enden der Schwänze der Kontrollwelpen nur zu schnippen. Die infizierten Welpen erhalten keine Schwanzschnipsen. Vor dem Schneiden des Schwanzes, desinfizieren Sie die Haut mit einer Baumwollkugel in 70% Ethanol doused. Wenden Sie druck auf das Ende des Schwanzes mit einer Wattekugel oder Gaze nach Bedarf.
HINWEIS: Dieses Verfahren wird unter einer Biosicherheits-Schrankhaube durchgeführt. Ein Schwanzschnipsel von ca. 1/8 Zoll genügt. - Um Welpen innerhalb der Kontroll- und infizierten Gruppen zu identifizieren, verwenden Sie eine 1 ml Insulinspritze mit einer 28 G x 1/2'' permanenten Nadel, um die Schwänze der Welpen zu tätowieren. Vor dem Tätowieren die Haut mit einer Indizierten Baumwollkugel mit 70% Ethanol desinfizieren. Dieses Verfahren wird unter einer Biosicherheits-Schrankhaube durchgeführt.
- Um den Schwanz zu tätowieren, tragen Sie Tier-Tattoo-Tinte auf die Spitze der Nadel auf. Als nächstes, vorsichtig halten Sie den Welpen mit einer Hand, mit ihrem Schwanz vollständig ausgesetzt. Setzen Sie die Nadel vorsichtig unter die Haut, wobei sie eine oberflächliche Tiefe beibehält, und bewegen Sie die Nadel parallel zur Haut ein paar Millimeter, bis eine kleine Markierung oder ein Punkt erstellt wurde. Warten Sie einige Sekunden, bevor Sie die Nadel langsam unter der Haut entfernen, um zu vermeiden, dass überschüssige Tinte unter der Haut freigesetzt wird.
- Drücken Sie bei Bedarf mit einer Watteoder Gaze auf die Wunde. Entfernen Sie überschüssige Tätowierfarbe auf der Hautoberfläche mit 70% Ethanol.
- Wiederholen Sie diesen Vorgang mit nachfolgenden Mäusen in den infizierten und Kontrollgruppen, während Sie einen zusätzlichen Punkt mit jedem aufeinanderfolgenden Welpen tätowiert hinzufügen (z.B. hat Der Pup 1 1 Punkt auf dem Schwanz, Der Pup 2 hat zwei Punkte auf dem Schwanz usw.).
HINWEIS: Für eine zusätzliche Identifikationsschicht wird empfohlen, separate Farben der Tier-Tattoo-Tinte für die Kontrolle und infizierte Gruppen zu verwenden.
3. Subkapitulare Impfung
HINWEIS: Für diese Studie wurden 2 Experimente mit einer für jedes Experiment bestimmten Niedrig- und Hochdosisgruppe durchgeführt. Im ersten Experiment erhielten 7 Welpen das niedrig dosierte Inokulum (4 Welpen wurden als Kontrollen verwendet), und 5 Welpen aus einem separaten Wurf erhielten die hohe Dosis (3 Welpen wurden als Kontrollen verwendet). Die Welpen aus Experiment 1 lieferten Daten nur für den 24-Stunden-Zeitpunkt. Im zweiten Experiment erhielten 8 Welpen das niedrig dosierte Inokulum (2 Welpen wurden als Kontrollen verwendet), und 6 Welpen erhielten das hochdosierte Inokulum (2 Welpen wurden als Kontrollen verwendet). Welpen aus Experiment 2 lieferten Daten für die 0-, 10- und 24-Stunden-Zeitpunkte.
- Alter Match Welpen ≤ 1 Tag. Weisen Sie jeden Wurf entweder als niedrige Dosis oder als hochdosierten Wurf zu. Innerhalb eines Wurfs nach dem Zufalls zuordnen Welpen als Kontrolle oder infizierten Welpen.
- Am Tag 3 oder 4 postnatal, Rekordgewichte aller Welpen vor der Impfung mit E. coli-lux oder der PBS-Kontrolle. Trennen Sie den Damm von den Welpen während dieser Zeit, um sicherzustellen, dass sie während der Infektion nicht bewegt werden.
- In einem Biosicherheitsschrank mit einer Insulinnadel entweder PBS oder das E. coli-lux Inoculum aspirieren. Für diese Arbeit wurden Inokulume von 2 x 106 und 7 x 106 KBE pro Maus verwendet. Halten Sie sowohl infektiöse inoculum und PBS auf Eis bis zur Verabreichung über subscapulare Injektion.
- Legen Sie das Neugeborene auf eine saubere Oberfläche in der Biosicherheits-Schrankhaube und heben Sie die Haut am Nacken, als ob sie den Welpen zerschwirre.
- In dem Raum, der jetzt zwischen der Haut und dem Muskel des Tieres geschaffen wird, legen Sie die Nadel ein, verschrägen Sie sich direkt unter der Haut und injizieren Sie 50 l PBS oder E. coli-lux. Geben Sie gleichzeitig den eingeklemmten Teil der Haut frei, um einen Injektionsrückfluss zu verhindern.
- Entfernen Sie die Nadel langsam und mit Sorgfalt. Legen Sie Welpen zurück mit Dämmen, nachdem die Injektionen abgeschlossen sind.
HINWEIS: Aufgrund ihres anatomischen Entwicklungsstadiums ist es technisch schwierig, an Tag 3-4 eine Schwanzvene oder intraperitoneale Injektion an neonatale Welpen zu verabreichen. So wurde der subscapuläre Infektionsweg für diese Studie aufgrund der einfachen Ausführung gewählt.
4. Bewertung von Krankheits- und Endpunktkriterien
- Überwachen Sie die Welpen zweimal täglich während der Dauer der Infektion. Beachten Sie alle Anomalien im Aussehen.
- Erfassen Sie Gewichte als objektive Messung der Morbidität.
- Zusätzlich zu Gewichtsänderungen, testen Sie die Fähigkeit der Welpen, sich selbst zu recht, indem Sie das Neugeborene auf der dorsalen Seite positionieren. Kranke Tiere können sich nicht auf die ventrale Seite und auf die Füße umdrehen oder diese Aktion mit Mühe abschließen.
- Überprüfen Sie, ob die Tiere den Endpunktkriterien nahe sind: weniger als 85 % des normalen Körpergewichts; verminderte Bewegung und Unfähigkeit, sich selbst zu rechtzumachen; Verfärbung der Haut und ein graueres oder transparenteres Aussehen im Gegensatz zu rosa; sich kühl anfühlend, was auf eine verminderte Körpertemperatur und hämorrhagische Blutergüsse an den Seiten hindeutet, was ebenfalls auf eine Vorerkrankung hindeutet.
HINWEIS: Wenn die Neonate über zwei Tage nicht an Gewicht zugenommen haben und eine der Beschreibungen in Schritt 4.4 passen, haben sie die Endpunktkriterien erfüllt. Welpen, die die hohe Dosis erhalten, erfüllen oft Endpunktkriterien von 24 h. Kontrollwelpen innerhalb der niedrig- und hochdosierten Würfe werden gleichzeitig eingeschläfert, um eine vergleichende Analyse zwischen der Kontroll- und der Versuchsgruppe zu ermöglichen. Fahren Sie mit dem Abschnitt Euthanasie weiter unten fort.
5. In-vivo-Bildgebung der bakteriellen Belastung
- Verwenden Sie einen MicroCT-Imager und eine Software für die Bildgebung und anschließende Analyse.
HINWEIS: Die Farbe der Haut von Pup hat keinen Einfluss auf die Bildqualität. - Legen Sie den Käfig mit E. coli-lux-infiziertenNeonatalen Mäusen und Mutterin in eine BSL-2-Level laminare Flow Haube. Entfernen Sie die zu bebilderten Mäuse und legen Sie sie in eine transparente Isoflurankammer innerhalb der Kapuze. Es wird empfohlen, mit nicht infizierten Kontrollen zu beginnen, um die Menge an Isofluran zu messen, die benötigt wird.
- Öffnen Sie die Software auf dem Computer, der an das microCT angeschlossen ist. Initialisieren Sie das System und warten Sie, bis die CCD-Temperatur bei -90 °C gesperrt ist.
- Drehen Sie den Isofluran-Verdampfer ein und stellen Sie das Zifferblatt auf 5% Isofluran-Fluss ein. Halten Sie Mäuse in der Kammer mit dieser Isofluran-Mischung für 20-30 s, bis sie aufhören, sich zu bewegen; für einige Mäuse können längere oder kürzere Anästhesie-Expositionszeiten erforderlich sein. Sobald sich Mäuse nicht mehr bewegen, sind sie ausreichend beästhetisiert und können abgebildet werden.
- Bewegen Sie Mäuse in die mikroCT-Bildgebungskammer und legen Sie sie in der anfälligen Position auf die Bildbox, wobei die Nasen senkrecht zu Denasten ausgerichtet sind. Verwenden Sie Zahnwachs, um die Füße auf der Bildbox sanft zurückzuhalten, um jede Bewegung zu begrenzen. Es können bis zu 4 neonatale Mäuse gleichzeitig abgebildet werden.
- Drehen Sie den Isofluran-Verdampfer auf 2-4% Durchfluss, um Mäuse während der Bildgebung anästhesiert zu halten. Schließen Sie die MikroCT-Bildkammertür. Überprüfen Sie die Mäuse ein paar Sekunden später. Wenn sie anfangen sich zu bewegen, douse eine Baumwollkugel in Isoflurane und halten Sie es an die Nase des Tieres bewegen für 5 Sekunden zu beästhesieren. Halten Sie die Baumwollkugel während der Bildgebung in der Nähe der Tiere. Achten Sie darauf, die Mäuse nicht zu beästhesieren und zu beenden.
- Wählen Sie mit der Software die Luminescent-Option für die Bildgebung aus. Verwenden Sie einen Anregungsfilter, der auf Block und der Emissionsfilter auf Öffnen,500 nm, 520 nm, 560 nm, 580 nm, 600 nm und 620 nm eingestellt ist. Für die Lumineszenz werden insgesamt sieben Emissionsfilter eingesetzt.
- Stellen Sie die Mäuse zu jedem Zeitpunkt (0, 10 und 24 h nach der Infektion [hpi]) auf und speichern Sie alle Bilder in einem Ordner für jeden Zeitpunkt. Bringen Sie die Welpen mit dem Damm in den Käfig zurück und überprüfen Sie, ob sich alle Welpen von der Anästhesie erholt haben.
- Um 2D-Bilder zu analysieren, öffnen Sie Bilder in der Software. Einheiten in Radiance (Photonen)ändern; dies wird in den Total Flux (Photonen/Sekunde)umschlagen.
- Analysieren Sie nur einen Bildsatz mit seinen mehreren Emissionsfiltern gleichzeitig. Beachten Sie in jedem Bildsatz die minimalen und maximalen Strahlungswerte in der unteren rechten Ecke jedes Bildes (z. B. wenn es 7 Emissionsfilter gibt, gibt es 7 Bilder und 7 Minimale und Maximale Werte). Wiederholen Sie dies für jeden Zufall, der verglichen werden soll.
- Um einen Maßstab zu bestimmen, der die Werte und Lumineszenz für alle Bilder umfasst, suchen Sie den niedrigsten Minimalwert und den höchsten Maximalwert für jeden Bildsatz. Für diese Studie wurden die Open-Filter-Bilder als repräsentativ verwendet.
- Markieren und öffnen Sie das Bild ihrer Wahl, um die Skalierung zu ändern. Klicken Sie in der Werkzeugpaletteauf die Registerkarte Bildanpassung, und ändern Sie die Farbskala auf die niedrigsten minimalen und höchsten maximal identifizierten Werte. Speichern Sie jedes Bildalsset als TIFF. Analysieren Sie jeden Zeitpunkt auf diese Weise individuell, um sicherzustellen, dass die richtige Skala angezeigt wird.
- Um den Gesamtfluss (Menge des Leuchtsignals pro Maus) für jede einzelne Maus zu quantifizieren, öffnen Sie ein Bild, wie zuvor in Schritt 5.9-5.10 beschrieben. Öffnen Sie die Registerkarte ROI-Werkzeuge in der Werkzeugpalette, und wählen Sie das Kreiswerkzeug aus. Wählen Sie 1 Kreis, wenn Sie einen Bereich der Lumineszenz analysieren.
- Verschieben Sie den ROI nach Overlay auf dem Bereich der Lumineszenz. Passen Sie bei Bedarf die Größe des ROI an.
HINWEIS: Wenn eine Anpassung erforderlich ist, passen Sie ROIs in anderen Bildern vergleichbar an, um die Konsistenz aufrechtzuerhalten. Wählen Sie Measure ROIs. Das Fenster ROI-Messungen öffnet sich mit Gesamtstrom (p/s), Durchschnittliche Strahlung (p/s/cm2/sr), Standardabweichung der Strahlung, Minimale Strahlung und maximale Strahlung. - Zeichnen Sie die Gesamtflussmessungen für jeden Bildsatz auf. Diese Zahl ist die quantifizierte Lumineszenzmenge in der Maus in 2D-Bildern.
- Um 3D-rekonstruierte microCT-Bilder zu erstellen, öffnen Sie das DLIT 3D-Rekonstruktionspanel auf der Werkzeugpalette und überprüfen Sie alle Wellenlängen, die unter der Registerkarte Analysieren enthalten sein sollen. Wählen Sie Reconstructaus.
6. Euthanasie
- Rohrrohre für Gewebe/Organe von Interesse für Nekropsie und geeignete nachgelagerte Anwendungen vorbereiten und beschriften.
- Trennen Sie die Neonate vom Damm in einem Biosicherheitsschrank.
- Eine Baumwollkugel in tierärztlicher Isoflurane einweichen und in eine transparente Rückhaltekammer legen.
- Bei der Blutentnahme bereiten Sie eine P200-Mikropipette mit einer Spitze vor und haben ein 1,5 ml-Rohr mit 10 l von 5 ml EDTA als Antikoagulans. Es wird ein Volumen von 50-200 l Blut erwartet.
- Legen Sie ein Neugeborenes in die Kammer und überwachen Sie den Welpen, bis er regungslos wird.
- Entfernen Sie schnell Neugeborenes und enthaupten Sie mit einer Schere. Wenn es erlaubt ist, über einen längeren Zeitraum frische Luft zu atmen, kann der Welpen das Bewusstsein wiedererlangen. Neonate haben die Lungenkapazität im Vergleich zu erwachsenen Mäusen reduziert und atmen daher nicht tief genug für die Euthanasie durch Isofluran allein.
- Sammeln Sie Blut aus dem Rumpf an der Basis des Kopfes mit einer P200 Mikropipette. Um die Menge des gesammelten Blutes zu maximieren, führen Sie diesen Schritt so schnell wie möglich nach der Enthauptung durch. Aufzählbakterien im Blut durch serielle Verdünnung und Standardplattenzählung, wie in Schritt 1.9 beschrieben.
- Sterilisieren Sie das gesamte Neugeborene mit 70% Ethanol vor der Exzision von Gewebeproben.
7. Gewebeernte
- Verwenden Sie das Neugeborene in einem Biosicherheitsschrank mit 70 % Ethanol, um eine Kontamination zu verhindern. Legen Sie das Tier auf die rechte Seite.
- Mit Zangen, greifen Sie die Haut an einem Punkt zwischen dem Bauch und hinteren linken Bein und machen einen Schnitt mit feinspitzen chirurgischen Schere. Schneiden Sie die Haut weiter und bewegen Sie sich nach oben nach hinten. Fortschritt, bis die gesamte Milz freigelegt wird.
- Verwenden Sie die Zange, um die Milz zu greifen und entfernen Sie sie aus dem Bauch, mit einer Schere, um das Bindegewebe zu trennen. Legen Sie die Milz in die Lösung, die für die nachgelagerte Anwendung geeignet ist.
- Um die Lunge zu erhalten, schälen Sie die Haut der Brust vollständig zurück.
- Betreten an der Basis des Brustbeins mit schere vertikal gehalten, nach oben geschnitten, bis der Rippenkäfig geteilt wird.
- Verwenden Sie Zangen, um die rechte und linke Lunge einzeln zu erfassen und aus der Brusthöhle zu entfernen. Entfernen Sie das Herz aus dem Lungengewebe, indem Sie mit einer Schere schneiden.
- Legen Sie die Lunge in die Lösung, die für ihre nachgelagerte Anwendung geeignet ist. Für die RNA-Isolierung verwenden Sie 500 l Guanidinthiocyanat/Phenol (GTCP). Für die Histopathologie 5 ml von 10% neutral gepuffertem Formalin verwenden.
8. RNA-Isolierung aus Lungengewebe zur Genexpression
- Die Mikrozentrifuge auf 4 °C vorkühlen.
- Das Lungengewebe in GTCP mit einer Schere zerkleinern. Als nächstes homogenisieren Sie das Gewebe mit einem batteriebetriebenen Homogenisator. Fahren Sie fort, bis die Lösung so einheitlich wie möglich ist. Bei Raumtemperatur für 3-5 min inkubieren.
- Fügen Sie mit gefilterten Pipettenspitzen 100 l Chloroform hinzu. Invertieren Sie das Rohr für 15 s und inkubieren 3-5 min bei Raumtemperatur.
- Zentrifuge für 15 min bei 12.000 x g.
- Während der Drehung 1,5 ml-Rohre mit 500 l 70% Ethanol zubereiten. Montieren und beschriften Sie die Säulen und Sammelrohre aus dem RNA-Isolationskit.
- Entfernen Sie vorsichtig die obere wässrige Schicht, ohne die Interphasenschicht zu stören, die sich während der Zentrifugation gebildet hat. Legen Sie die wässrige Schicht in die Rohre, die 70% Ethanol enthalten.
- Das Ethanol- und Lysatgemisch in die Säule im Sammelrohr verschieben.
- Von diesem Zeitpunkt an folgen Sie dem kommerziellen Produktprotokoll des RNA-Isolationskits bis zur endgültigen Elution der RNA.
- Analysieren Sie die RNA auf Reinheit und Quantität. Sofort verwenden oder bei -80 °C bis zur weiteren Verwendung lagern.
9. cDNA-Synthese
- PCR-Rohre beschriften und beiseite stellen.
- Fügen Sie dem cDNA-Reaktionsgemisch für jede Probe 1 g RNA hinzu.
- Fügen Sie die Reagenzien und die Vorlage in die PCR-Röhre, wie im cDNA-Protokoll beschrieben. Fügen Sie das Enzym zuletzt in die Mischung ein.
- PCR-Röhren in einen Thermocycler mit folgenden Laufeinstellungen legen: 5 min bei 25 °C, 40 min bei 42 °C, 15 min bei 85 °C und 4 °C Endraum.
- PCR-Rohre vom Thermocycler entfernen und sofort verwenden oder bei -20 °C bis zur weiteren Verwendung aufbewahren.
10. Echtzeit-quantitativer PCR-Zyklus (qPCR)
- Bereiten Sie einen Reaktionsmix-Cocktail für jedes der zu analysierenden Gene vor. Jede 15-L-PCR-Reaktion erfordert 7,5 l 2x Reagenzienmischung, 0,75 l 20X 5'-FAM-markierte genspezifische Primer/Sonde und 3,75 l nukleasefreies Wasser. Amplicons reichen in der Regel von 60-120 bp.
- Fügen Sie den entsprechenden Brunnen 3 L cDNA-Vorlage für jede Versuchsgruppe hinzu.
- 12 L des genspezifischen Reaktionsmixcocktails in die entsprechenden Brunnen geben.
- Bedecken Sie die Platte mit optischem Klebefilm und Zentrifuge für 1 min bei 1.000 x g, um blasen zu entfernen, die sich in den Brunnen gebildet haben könnten.
- Legen Sie die PCR-Platte in einen Echtzeit-PCR-Thermocycler.
- Stellen Sie die Laufmethode wie folgt ein: 3 min bei 95 °C, 40 Zyklen von 95 °C für 15 s, gefolgt von 60 °C für 1 min.
- Analysieren Sie Daten, indem Sie das Gen von Interesse für eine interne Kontrolle normalisieren und Daten aus infizierten Proben relativ zu nicht infizierten Kontrollproben mit der2-Ct-Formel und einerLog-2-Transformation der Zahlen ausdrücken.
11. Lungenhistopathologie
- Entfernen Sie die Lunge aus dem neugeborenen Welpen wie oben beschrieben.
- Legen Sie das Gewebe in ein Volumen von 10% neutral gepuffertem Formalin, so dass das Verhältnis von Lösung zu Gewebe etwa 20:1 für 3-7 Tage beträgt.
- Koordinieren Sie sich mit einem geeigneten Histologie-Service für Paraffineinbettung, Schnitt- und Hämatoxylin- und Eosin- (H&E)-Färbung. Für diese Arbeit wurde der West Virginia University Histopathology Core verwendet. Alternativ können Sie zuvor beschriebene Protokolle19befolgen.
12. In-vitro-Bakterien-Tötungstest
- Entfernen Sie die Milz aus dem nicht infizierten neonatalen Welpen, wie oben beschrieben, und legen Sie sie in einen 40-mm-Nylonkorb in eine sterile 60 mm Petrischale. Wiederholen Sie dies und Pool Milz in einem Rohr geerntet und homogenisiert zusammen.
- Fügen Sie 5 ml PBS hinzu, ergänzt durch 10% FBS.
- Disaggregieren Sie das Gewebe mit einem sterilen 3 ml Spritzenkolben, bis eine einzellige Suspension entsteht.
- Sammeln Sie die einzellige Suspension außerhalb des Nylonkorbes, übertragen Sie sie in ein 15 ml Zentrifugenrohr und Pelletzellen bei 350 x g für 5 min.
- Setzen Sie die Zellen im Lysepuffer der roten Blutkörperchen (2 ml für bis zu 7-8 Milz) aus und lassen Sie sie 5 min bei Raumtemperatur stehen, um Erythrozyten zu beseitigen.
- Splenozyten wie oben mit PBS und Pellet waschen.
- Setzen Sie die Splenozyten in 0,25 ml PBS aus, ergänzt durch 0,5% BSA und 2 mM EDTA entsprechend der erwarteten Zellausbeute.
- Zählen Sie die Splenozyten mit einem Hämozytometer oder einer anderen geeigneten Anwendung.
- Isolat Ly6B.2+ (myeloische Population von Granulozyten/entzündlichen Monozyten) Zellen mit immunmagnetischen Perlen nach Herstellerprotokoll.
- Seed Ly6B.2+ Zellen mit einer Dichte von 1 x 105 Zellen pro Brunnen in einer schwarzen oder weißen 96-Well-Platte in einem Volumen von 0,1 ml DMEM, das 10% FBS, 2 mM Glutamin und 25 mM HEPES (komplettes Medium) enthält.
- Aufzähle biolumineszierende E. coli wie in Abschnitt 1 beschrieben und bereite das bakterielle Inokulum bei der gewünschten Infektionsvielfalt (MOI) in einem Endvolumen von 0,1 ml vor. Dies geschieht am besten, indem man das Notwendige für alle Brunnen an einem gemeinsamen MOI in Chargen macht.
- Fügen Sie 0,1 ml bakterielles Inokulum oder komplettes Medium allein als Kontrolle hinzu. Inkubieren Sie die Multi-Well-Platte bei 37 °C und 5%CO2 für 1 h.
- Ersetzen Sie das Medium durch 0,2 ml frisches Komplettmedium, das Gentamicin (100 g/ml) enthält, indem Sie die Medien vorsichtig mit einer Pipette entfernen und frische Medien mit einer neuen Pipettenspitze hinzufügen. Bringen Sie die Kultur für weitere 2 h in die Inkubation zurück.
- Bei 3 h nach der Infektion, messen Sie die Lumineszenz in jedem Brunnen der Deckelkulturplatte von unten mit einem Plattenleser und dann die Kultur in die Inkubation zurück.
- Wiederholen Sie die Messung der Lumineszenz an anderen gewünschten Zeitpunkten.
Ergebnisse
Dieses Protokoll induzierte bakterielle Sepsis bei neonatalen Mäusen, und wir verwendeten Längsinalintravital-Bildgebung, Aufzählung von Bakterien im Blut, histologische Bewertungen der Pathologie und entzündliche Zytokin-Expressionsprofile, um den Krankheitsverlauf zu untersuchen. Anzeichen einer Morbidität wurden bei neonatalen Welpen beobachtet, die sowohl mit niedrigen (2 x 106 KBE) als auch mit hohen E.coli-Inokulumen (ca. 7 x 106 KBE) infiziert waren. Welpen, die das größere Inokulum erhielten, zeigten prominentere Anzeichen von Bedrängnis, die eingeschränkte Beweglichkeit, die Unfähigkeit, ihre Körperhaltung zu korrigieren, und eine eingeschränkte Fähigkeit, eine aufrechte Position um 24 h nach der Infektion (hpi) zu halten. Es gab jedoch eine Reihe von Morbidität, da einige Welpen schlimmer erschienen als andere. Unmittelbar nach der Infektion starb ein niedrig dosiertes Tier an isoflurane-Exposition während einer Bildgebungssitzung, um die Ausgangsbasis zu bestimmen. Mit 24 PSi erlagen zwei von sechs hochdosierten Tieren der systemischen Infektion (33,3% Sterblichkeit). Infizierte Welpen, die entweder eine hohe oder niedrige Dosis Inokulum erhielten, wogen mit 24 PS deutlich weniger als ihre Kontroll-Wurfgenossen(Abbildung 1A,B). Alle Welpen, die das höhere Inokulum erhielten, erfüllten die Endpunktkriterien bei 24 PSi. Als solche, alle infizierten Welpen in dieser Gruppe wurden nach der Bildgebung eingeschläfert. Bakterien im Blut wurden für eine Untergruppe von Mäusen aufgezählt, die das untere Inokulum erhielten, und für alle Tiere, die das höhere Inokulum erhielten, da sie alle eingeschläfert wurden. Die Ergebnisse zweier experimentenischer Experimente deuten in ähnlicher Weise darauf hin, dass die meisten Tiere zwar einen hohen Bakteriengehalt im Blut (KBE/ml) bei 24 PSi hatten, einige Tiere jedoch keine nachweisbaren Bakterien im Blut hatten(Abbildung 1C). Letztere deuten darauf hin, dass sie die Infektion zu diesem Zeitpunkt gelöscht haben. Wie erwartet, welpen, die das höhere Inokulum erhielten, hatten fast drei Größenordnungen mehr CfUs/ml bei 24 PSi im Vergleich zu Welpen, die die niedrige Dosis Inoculum erhielten (Abbildung 1C).
Die Live-Tierbildgebung von leuchtmbissigen Bakterien bestätigte die Verbreitung von Bakterien und das Wachstum von Neugeborenenwelpen im Laufe der Zeit mit 10 und 24 PSi(Abbildung 2 und Abbildung 3). Zusätzlich konnten wir mit intravitaler Bildgebung mit dem microCT Infektionsherde identifizieren, einschließlich des Gehirns (Abbildung 2B), der Lunge (Abbildung 2B, Abbildung 3A,B) und anderer peripherer Gewebe (Abbildung 2B). Die Lunge einiger hochinfizierter Mäuse zeigte undurchsichtige Regionen, die mit der entzündlichen Konsolidierung im Einklang stehen und das zu einem leuchtenden bakteriellen Signal kolokalisiert sind (Abbildung 3A). Diese Regionen mit vermutetem entzündlichem Exulat finden sich nicht in nicht infizierten Kontrolllungen (Abbildung 3A). Weitere Hinweise auf eine ausgeprägte entzündliche Zytokin-Reaktion in der Lunge infizierter Welpen werden durch genexpression-Analyse von IL-1, IL-6 und TNF-α nachgewiesen. Für alle drei Zytokine sowohl in den unteren als auch in den hohen Inokulumgruppen wurde ein signifikanter Anstieg der Expression im Verhältnis zu den Kontrollen beobachtet (Abbildung 4A). Die Histopathologie der Lunge wurde auch bei 24 PSi unter Kontrolle und infizierten Welpen untersucht. Trotz ähnlicher entzündlicher Zytokinprofile wurde häufig eine fortschreitende Zunahme der Pathologie vom unteren zum höheren Inokulum beobachtet. Im Vergleich zu Gewebe aus nicht infizierten Kontrollen zeigten die Lungen infizierter Welpen bemerkenswerte entzündliche Veränderungen, Verdickung der Alveolarwand, erhöhte Alveolarblutungen und entzündliche Infiltration (Abbildung 4B). Bei den schwersten Infektionen trugen die Lungenverstopfung und Blutungsgebiete zu einer massiven Verringerung des Freiraumes bei (Abbildung 4B). Zusammen zeigen diese Ergebnisse, dass in unserem Modell der früh auftretenden neonatalen Sepsis die Verbreitung von Lumineszierenden Bakterien im Laufe der Zeit von einer subskaulären Impfstelle bis hin zu wichtigen Infektionsherden verfolgt werden kann und bei schwer infizierten Tieren signifikante Entzündungen und Pathologien verursachen kann.
Um Wirtsfaktoren zu untersuchen, die zur bakteriellen Tötung durch angeborene Immunzellen wie Monozyten, Makrophagen und Neutrophilen beitragen, haben wir einen empfindlichen In-vitro-Assay entwickelt, um die bakterielle Clearance zu messen. Ly6B.2+ Zellen, die aus den Milz von neonatalen Mäusen isoliert wurden, wurden mit biolumineszierenden E. coli in einer Reihe von MOIs für 1 h infiziert und dann mit Gentamicin behandelt, um extrazelluläre Bakterien abzutöten. Bei 3, 6, 20 und 48 PSi wurde die intrazelluläre Lumineszenz mit einem Multimode-Reader gemessen. Wie erwartet wurde mit steigendem MOI bei 3 h mehr Leuchtsignal aufgezeichnet (Abbildung 5). Allmählich ging dieses Signal verloren, was auf eine bakterielle Clearance hindeutet (Abbildung 5). Dieser Test ist für ergänzte Zytokine, Neutralisierung von abgesonderten Effektoren und die Zugabe von pharmakologischen Inhibitoren von zellulären Bahnen zugänglich, um Interventionen zu untersuchen, die die bakterielle Clearance fördern und dazu dienen können, die Ergebnisse im hier beschriebenen neonatalen Sepsis-Modell zu verbessern.

Abbildung 1: Veränderungen des Körpergewichts und der bakteriellen Replikation bei septischen neonatalen Mäusen.
(A,B) Individuelle Mausgewichte innerhalb einer Gruppe (niedrig und hoch) ausgedrückt als Prozentsatz des mittleren Gewichts der Wurfmate-Kontrollwelpen. Die Daten werden als mittlerer Prozentsatz ± SEM dargestellt. Einzelne T-Tests an jedem Zeitpunkt nach der Infektion zeigen signifikante Unterschiede bei 24 h zwischen Kontrollwelpen und Welpen, die das niedrige Inokulum (p<0.0001) (A) erhielten, oder zwischen Kontrollwelpen und Welpen, die das hohe Inokulum erhielten (p=0,0031) (B). (C) CFU/ml im Blut mit 24 PS wurden log transformiert und als mittelwertiger ± SEM dargestellt. Mann-Whitney-Test zeigt einen Trend zur Signifikanz zwischen den niedrigen und hohen Inokulumen (p=0,0882). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Intravitale Bildgebung zeigt die Verbreitung von Bakterien bei neonatalen Mäusen im Laufe der Zeit.
(A) Eine repräsentative Neonatalmaus (#1), die mit einem Inokulum von 2 x 106 KBE infiziert ist, wird zum Zeitpunkt 0, 10 und 24 PSi angezeigt. Für jeden Zeitpunkt wird eine farbmetrische Skala mit den minimalen und maximalen Strahlungswerten pro Zeitpunkt angezeigt. Mäuse bei 0 und 10 h werden sowohl auf ihrer Zeitpunktskala als auch auf der 24-Stunden-Skala angezeigt, um Veränderungen des Bakterienwachstums im Laufe der Zeit zu demonstrieren. (B) Repräsentative 3D rekonstruierte MikroCT-Bilder derselben Neonatalmaus mit 10 und 24 PSi werden gezeigt. Jeder Zeitpunkt hat Bilder an Overhead-, transaxialen und koronalen Perspektiven. Im transaxialen Bild mit 24 PSi hat sich die Ebene in Richtung der Peripherie der Maus bewegt, um Infektionsherde im peripheren Gewebe besser anzuzeigen. Weiße Pfeile zeigen das Gehirn und die Niere bei 10 PSi und die Niere und Lunge bei 24 PSi an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
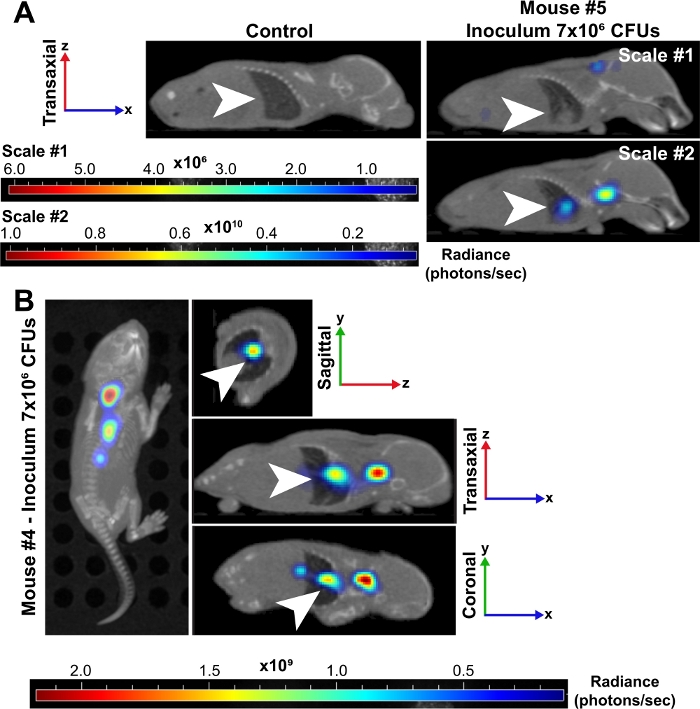
Abbildung 3: Lunge ist ein Ort der großen Infektion während der bakteriellen Sepsis in Neonaten.
(A) Repräsentative 3D-rekonstruierte MikroCT-Bilder einer neonatalen Maus (#5), die mit einem Inokulum von 7 x 106 KBE infiziert ist, werden mit 24 PSi im Vergleich zu einer nicht infizierten Kontrolle gezeigt. Beide Mäuse werden in der transaxialen Perspektive angezeigt und die Lunge wird durch weiße Pfeile angezeigt. Die infizierte Maus wurde auf zwei Strahlstufen (Photonen/Sek.) gesetzt. Maßstab #1 umfasst alle 6 Wellenlängen (500, 520, 560, 580, 600, 620 nm) und #2 umfasst nur 500, 520 und 560 nm Wellenlängen. Diese zweite Skala ermöglichte es uns, ein erhöhtes Signal in Bakterien in der Lunge zu visualisieren, weil niedrigere Wellenlängen stärker vom Gewebe absorbiert werden und ein stärkeres Signal erzeugen. (B) Repräsentative 3D-rekonstruierte MikroCT-Bilder einer neonatalen Maus (#4), die mit einem Inokulum von 7 x 106 KBE infiziert ist, werden mit 24 PSi gezeigt. Dieser Zeitpunkt hat Bilder an den Overhead-, sagittalen, transaxialen und koronalen Perspektiven. Weiße Pfeile weisen auf Infektionsherde in der Lunge hin. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
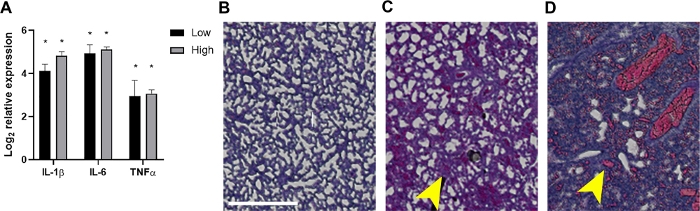
Abbildung 4: Entzündung und damit verbundene histopathologische Befunde in der Lunge septischer Neonate.
Bei 24 PS i wurden die Lungen von Welpen geerntet, die 2 x 106 oder 7 x 106 KBE oder nicht infizierte Kontrollen erhielten. (A) RNA wurde isoliert und die Expression von IL-1, IL-6 oder TNF-α wie im Verhältnis zu nicht infizierten Kontrollen durch quantitative Echtzeit-PCR unter Verwendung der Formel 2- Ctbestimmt. Die Daten werden als die mittlere Log2 transformierte Änderung des Ausdrucks ± SEM für jedes Inokulum wie angegeben angezeigt. Die statistische Signifikanz wurde anhand ungepaarter T-Tests von Ct-Werten zwischen einzelnen Zytokingenen und der internen Kontrolle im 95%-Konfidenzintervall ermittelt. Sternchen zeigen p<0.01 an. (B-D) Histopathologische Abschnitte von H&E gebeizten Lungengeweben (20x, Interessenbereich in Clipping-Maske konstruiert und zur Klarheit vergrößert) werden gezeigt. Gezeigt werden Lungengewebe aus einer repräsentativen nicht infizierten Kontrolle (B) oder infiziertem Neugeborenen am niedrigen (C) oder hohen (D) Inokulum. Gelbe Pfeile zeigen Alveolare Verdickung (C) oder Blutungen (D). Skalenbalken = 500 m. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
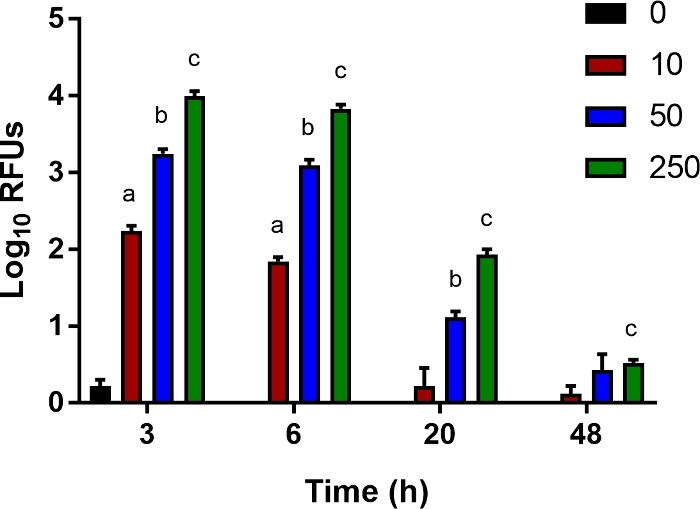
Abbildung 5: Ein In-vitro-Test für die bakterielle Clearance.
Ly6B.2+ Zellen wurden aus den Milz ens von nicht infizierten Kontroll-Neonaten isoliert. Die Zellen wurden in 96-Well-Platten gesät und mit luziferase-exezierenden E. coli O1:K1:H7 bei einer Vielzahl von Infektionen (MOI) von 10, 50 oder 250 wie angegeben infiziert. Nach 1 h wurde das Medium durch frisches, das Gentamicin enthielt (100 g/ml), ersetzt. Für ein einzelnes Experiment, das für mehrere repräsentativ ist, werden mittlere relative Lichteinheiten (RLU) ± SE gezeigt. Die statistische Signifikanz im 95%-Konfidenzintervall wurde anhand von ungepaarten t-Tests mit Welchs Korrektur ermittelt; Sternchen zeigen p<0.05 an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Unser subskapulares Infektionsmodell zur Induktion von bakteriellen Sepsis bei neonatalen Mäusen ist eine neuartige Methode, um die Längsausbreitung bakterieller Krankheitserreger in Echtzeit zu untersuchen. Intravital-Bildgebung bietet die Möglichkeit, die bakterielle Verbreitung in Echtzeit in Neonaten zu erforschen. Dies ist entscheidend, um die Kinetik der bakteriellen Verbreitung zu verstehen und die Reaktion und den Schaden des Wirts in der entsprechenden Krankheitsphase weiter zu untersuchen. Mauswelpen wird eine subkutane, subskapuliere Injektion von bakteriellem Inokulum verabreicht. Diese Injektionstechnik ist einfacher als andere häufig verwendete Alternativen, wie die Schwanzvene und intraperitoneale Infektionen, da es weniger Präzision innerhalb einer Injektionsstelle erfordert. Dies ist wichtig angesichts der geringen Größe der Welpen. Die intravitale Bildgebung ermöglicht eine Längsauswertung der bakteriellen Proliferation und Verbreitung in peripheren Geweben und dem zentralen Nervensystem im Laufe der Zeit, ohne dass das Tier geopfert werden muss. Ähnliche bildgebende Ansätze und Technologien wurden für das Studium der Krebsbiologie und Metastasierung20,21verwendet. Während eine andere Studie die Verwendung von biolumineszierender Bildgebung während einer E. coli-Infektion bei neonatalen Ratten22zitiert hat, haben wir hier den Ansatz auf neonatale Mäuse angewendet, wobei unsere Methodik die Bewertung der bakteriellen Kinetik während der murinen Sepsis ermöglicht. Die Visualisierung der Bakterien basiert auf der Emission von biolumineszierendem Licht bei verschiedenen Wellenlängen von Bakterien (z.B. bakterielle Luziferase-Aktivität) innerhalb des Tieres. Die Biolumineszenz wird dann durch eine gekühlte charged coupled device (CCD) Kamera visualisiert. Die daraus resultierende visualisierte Biolumineszenz kann dann zu einem 3D-Bild rekonstruiert werden, das sowohl räumlich- als auch zeitlich abhängige Wirkungen von Bakterien innerhalb eines Tieres zeigt. Für eine zusätzliche, differenziertere Datenerfassungsschicht ermöglicht eine erfolgreiche Tieridentifikation durch Schwanztätowierung eine wiederholte Messbewertung einzelner Welpen über die Zeit und die Identifizierung möglicher Ausreißer innerhalb einer bestimmten Versuchsgruppe.
Die erfolgreichste Anwendung des beschriebenen Modells erfordert Genauigkeit bei der Herstellung des bakteriellen Inokulums. Hier beschreiben wir eine optimierte Methode zur bakteriellen Präparation mit einer vorab etablierten und validierten E. coli-Wachstumskurve, die die Variation zwischen dem Ziel und dem tatsächlichen Inokulum reduziert. Dies ermöglicht die experimentelle Reproduzierbarkeit an einem beabsichtigten Inokulum. Die Aufnahme von zwei Inokulumen in unser Modell zeigte dosisabhängige Ergebnisse bei LEINEN, Sterblichkeit und Lungenpathologie. Einige Aspekte des Krankheitsverlaufs waren jedoch nicht dosisabhängig. Das Versäumnis, bei infizierten Tieren an Gewicht zu gewinnen, war bei 24 PSi nicht vom Inokulum abhängig. Zusätzlich wurden ähnliche Konzentrationen der entzündlichen Zytokinexpression in der Lunge als Reaktion auf eine Infektion mit beiden Inokulumen beobachtet. Ob sich dieses Muster in allen Geweben, in denen Bakterien beobachtet wurden, wie Niere, Leber, Milz und Gehirn, wiederholen würde, bleibt abzuwarten. Neben der Sepsis ist E. coli O1:K1:H7 mit Meningitis bei der neonatalen Population23assoziiert. Diese Gehirninfektion tritt auf, wenn Bakterien aus der Peripherie eindringen und in die Blut-Hirn-Schranke eindringen. Zukünftige Studien werden diesen Aspekt des Modells durch die Analyse von Veränderungen in der engen Junction-Proteinexpression untersuchen und verschiedene Bereiche von bakteriellen Inokulumen testen. Eine zusätzliche Modifikation während der intravitalen Bildgebung umfasst die Zugabe einer einzigartigen Baumwollkugel, die in Isofluran dosiert wird und während der Bildgebung etwa 2-3 Zoll von den Mäusen entfernt platziert wird. Als Reaktion auf frühere Experimente, bei denen die neugeborenen Welpen während der Bildgebung das Bewusstsein wiedererlangt haben, wodurch eine genaue Bildaufnahme verhindert wurde, platzieren wir nun die Baumwollkugel nah genug an die Mäuse, um sie während der Bildgebung kontinuierlich anästhesiert zu halten. Es ist jedoch wichtig, dass dies nicht so nah geschieht, dass sie sich nicht von der Anästhesie erholen.
Obwohl flexibel und leicht anpassungsfähig für die Untersuchung der Kinetik verschiedener Bakterien in verschiedenen Tier- und Krankheitsmodellen, hat unser Protokoll einige Einschränkungen zu berücksichtigen. Die erste zu berücksichtigende Einschränkung ist, dass der subskapitare Infektionsweg nicht einen natürlichen Übertragungsweg widerspiegelt. Ein vorrangiges Ziel bei der Entwicklung unseres Modells war jedoch von Anfang an, eine leicht reproduzierbare Art der Verabreichung zu etablieren, die verwendet werden könnte, um eine systemische Infektion zu etablieren, die Aspekte menschlicher Krankheiten repliziert. Daher beschreiben wir in diesem Bericht ein Modell des menschlichen Sepsis-Syndroms, nicht ein Modell der natürlichen Übertragung. Es gibt ein etabliertes Modell der oralen Verabreichung bei neonatalen Ratten, die einige Aspekte der gemeinsamen menschlichen Übertragung repliziert, wie die anfängliche Besiedlung der E. coli-Infektion im Nahrungskanal und die anschließende Verbreitung an den Blutkreislauf und periphere Gewebe, einschließlich des Gehirns22. Das von Witcomb und Kollegen erstellte Modell beinhaltet auch biolumineszierende E. coli und intravitale Bildgebung. Darüber hinaus ist es entscheidend, die Exposition von Isofluran e.H. zu minimieren sowie Die Injizieren, Schwanztätowierung und Welpen so schnell wie möglich zu behandeln, ohne die Genauigkeit und Präzision der Techniken zu beeinträchtigen, um den Stresspegel sowohl für die Neonate als auch für die Dämme zu verringern. In einigen Fällen, wenn die Welpen erleben verbesserte menscheninduzierte und /oder experimentelle Manipulationen, die Dämme können aufhören, pflege und pflege die Welpen, was zu einem verminderten Überleben, das nichts mit der Infektion zusammenhängt. In ähnlicher Weise haben Welpen, die Isofluran über einen längeren Zeitraum über die ungefähr 10 Minuten einer Bildgebungssitzung hinaus ausgesetzt sind, ein erhöhtes Sterberisiko; daher ist es entscheidend, gerade genug Isofluran zu liefern, um die Mäuse ausreichend zu beästhesieren, aber nicht genug, um sie einzuschläfern. Ein letzter Aspekt ist die Grenze der Sensibilität. Gewebe, in denen weniger als 104 KBE/ml E. coli aufgezählt wurden, die lumineszierenden Signal-Stürze am unteren Ende des nachweisbaren Bereichs, entsprechend der Skalierungsmethode, die in der Bildgebungssoftware verwendet wird3. So können einige Gewebe mit niedrigen Bakterienkonzentrationen besiedelt werden, erscheinen aber ohne sichtbare Biolumineszenz.
Derzeit, die meisten Studien nutzen erwachsene Methoden der bakteriellen Verbreitung, wie intraperitoneal (i.p.) und Schwanz Veneninjektionen für Neonomen. Pluschke und Pelkonen analysierten die Wirkung von E. coli K1 auf neonatale Mäuse durch i.p., Schwanzvene und orale Infektionen24. Diese Studie zeigte, dass verschiedene Genotypen von Mäusen mit Immundefekten anfälliger für den K1-Stamm sind; viele Aspekte der Wirtsimmunantwort auf Infektionen sowie die Mechanismen für die bakterielle Ausbreitung bleiben jedoch unadressiert. Deshmukh und Kollegen infizierten neonatale Mäuse intraperitoneal mit E. coli K1 oder K. pneumoniae und maßen KBE in Milz und Leber bei 72 psi25. Diese Studie analysierte auch einige Aspekte der Wirtsreaktion auf Infektionen basierend auf der Vorexposition von Mäusen mit Antibiotika. Eine gründliche Untersuchung der bakteriellen Verbreitung an peripheren Geweben und Blut im Laufe der Zeit parallel zur entzündlichen Profilierung im selben Gewebe (außer Granulozytose) wurde jedoch nicht angesprochen. Andere Studien zur neonatalen Sepsis bei Mäusen mit Staphylococcus aureus, Staphylococcus epidermidis, Gruppe B Streptococcusund E. coli untersuchen verschiedene Aspekte des Wirtsimmunsystems als Reaktion auf eine Infektion. Jedoch, keine dieser Studien nutzen intravitale Bildgebung, um die Kinetik der bakteriellen Verbreitung oder Lokalisierung von Infektionsherden23,25,26,27zu erforschen. Unsere Methode der Infektion und intravitale Bildgebung, kombiniert mit bakteriellen Belastungsbewertungen und entzündlicher Profilierung von peripheren Geweben, ermöglicht es uns, Aspekte des Wirts und des Erregers während der Infektion umfassend zu untersuchen, was ein genaueres Verständnis des Wirts-Pathogen-Zusammenspiels während der Sepsis ermöglicht.
Wir beabsichtigen, dieses Infektions- und Bildgebungsmodell zu nutzen, um unser Verständnis der früh einsetzenden neonatalen Sepsis unter Verwendung einer Vielzahl von pathogenen Bakterien zu fördern, die häufig für Sepsis in Neugeborenen verantwortlich sind, einschließlich Streptokokken der Gruppe B, K. pneuomoniaeund Listeria monocytogenes. Dieses Infektionsmodell wird es uns ermöglichen, die Verbreitung verschiedener bakterieller Krankheitserreger parallel zur Wirtsreaktion bei Neonaten längs zu vergleichen. Darüber hinaus ist dieses Modell anpassungsfähig an den Adoptivtransfer spezifischer (fluoreszierend konjugierter) Immunzelltypen, um deren Migration an Infektionsstellen und anschließenden Einfluss auf die Wirtsreaktion und -kontrolle von Bakterien zu untersuchen. Dies bietet die Möglichkeit, die Wirts-Pathogen-Wechselwirkungen, die während der Sepsis im frühen Leben auftreten, auf eine Weise besser zu verstehen, die bisher nicht nachgewiesen wurde.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Diese Arbeit wurde durch institutionelle Mittel an C.M.R. unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 1 mL Insulin Syringe | Coviden | 1188128012 | Inoculum or PBS injection |
| 10% Neutral Buffered Formalin | VWR | 89370-094 | Histopathology |
| ACK Lysis Buffer | Gibco | LSA1049201 | Bacterial clearance assay |
| Animal Tattoo Ink Paste | Ketchum | KI1482039 | Animal identification |
| Animal Tattoo Ink Green Paste | Ketchum | KI1471039 | Animal identification |
| Anti-Ly-6B.2 Microbeads | Miltenyi Biotec | 130-100-781 | Cell isolation |
| Escherichia coli O1:K1:H7 | ATCC | 11775 | |
| Escherichia coli O1:K1:H7-lux (expresses luciferase) | N/A | N/A | Constructed in-house at WVU |
| E.Z.N.A. HP Total Extraction RNA Kit | Omega Bio-tek | R6812 | RNA extration |
| DPBS, 1X | Corning | 21-031-CV | |
| Difco Tryptic Soy Agar | Becton, Dickinson and Company | 236950 | Bacterial growth |
| IL-1 beta Primer/Probe (Mm00434228) | Thermo Fisher Scientific | 4331182 | Cytokine expression qPCR |
| IL-6 Primer/Probe (Mm00446190) | Thermo Fisher Scientific | 4331182 | Cytokine expression qPCR |
| iQ Supermix | Bio-Rad | 1708860 | Real-time quantitative PCR |
| iScript cDNA Synthesis Kit | Bio-Rad | 1708891 | cDNA synthesis |
| Isolation Buffer | Miltenyi Biotec | N/A | Bacterial clearance assay |
| IVIS Spectrum CT and Living Image 4.5 Software | Perkin Elmer | N/A | Intravital imaging |
| LB Broth, Lennox | Fisher BioReagents | BP1427-500 | Bacterial growth |
| EASYstrainer (Nylon Basket) | Greiner Bio-one | 542 040 | Cell strainer |
| SpectraMax iD3 | Molecular Devices | N/A | Plate reader |
| Pellet Pestle Motor | Grainger | 6HAZ6 | Tissue homogenization |
| Polypropylene Pellet Pestles | Grainger | 6HAY5 | Tissue homogenization |
| Prime Thermal Cycler | Techne | 3PRIMEBASE/02 | cDNA synthesis |
| TNF-alpha Primer/Probe (Mm00443258) | Thermo Fisher Scientific | 4331182 | Cytokine expression qPCR |
| TriReagent (GTCP) | Molecular Research Center | TR 118 | RNA extration |
Referenzen
- Qazi, S. A., Stoll, B. J. Neonatal sepsis: a major global public health challenge. Pediatr Infect Dis J. 28, 1-2 (2009).
- Simonsen, K. A., Anderson-Berry, A. L., Delair, S. F., Davies, H. D. Early-onset neonatal sepsis. Clinical Microbiology Reviews. 27 (1), 21-47 (2014).
- Seman, B. G., et al. Elevated levels of interleukin-27 in early life compromise protective immunity in a mouse model of Gram-negative neonatal sepsis. Infections and Immunity. , (2019).
- Schrag, S. J., et al. Epidemiology of Invasive Early-Onset Neonatal Sepsis, 2005 to 2014. Pediatrics. 138 (6), 20162013(2016).
- Stoll, B. J., et al. Early onset neonatal sepsis: the burden of group B Streptococcal and E. coli disease continues. Pediatrics. 127 (5), 817-826 (2011).
- Weston, E. J., et al. The burden of invasive early-onset neonatal sepsis in the United States, 2005-2008. Pediatrics and Infectious Disease Journal. 30 (11), 937-941 (2011).
- Hornik, C. P., et al. Early and late onset sepsis in very-low-birth-weight infants from a large group of neonatal intensive care units. Early Human Development. , Suppl 2 69(2012).
- Vergnano, S., Sharland, M., Kazembe, P., Mwansambo, C., Heath, P. T. Neonatal sepsis: an international perspective. Archives of Disease in Childhood: Fetal and Neonatal Edition. 90 (3), 220-224 (2005).
- Kraft, J. D., et al. Neonatal macrophages express elevated levels of interleukin-27 that oppose immune responses. Immunology. 139 (4), 484-493 (2013).
- Basha, S., Surendran, N., Pichichero, M. Immune responses in neonates. Expert Reviews of Clinical Immunology. 10 (9), 1171-1184 (2014).
- Gleave Parson, M., et al. Murine myeloid-derived suppressor cells are a source of elevated levels of interleukin-27 in early life and compromise control of bacterial infection. Immunology and Cell Biology. 97 (5), 445-446 (2018).
- Adkins, B., Leclerc, C., Marshall-Clarke, S. Neonatal adaptive immunity comes of age. Nature Reviews Immunology. 4 (7), 553-564 (2004).
- Kim, S. K., Keeney, S. E., Alpard, S. K., Schmalstieg, F. C. Comparison of L-selectin and CD11b on neutrophils of adults and neonates during the first month of life. Pediatrics Research. 53 (1), 132-136 (2003).
- Velilla, P. A., Rugeles, M. T., Chougnet, C. A. Defective antigen-presenting cell function in human neonates. Clinical Immunology. 121 (3), 251-259 (2006).
- Le Garff-Tavernier, M., et al. Human NK cells display major phenotypic and functional changes over the life span. Aging Cell. 9 (4), 527-535 (2010).
- Weinberger, B., et al. Mechanisms underlying reduced responsiveness of neonatal neutrophils to distinct chemoattractants. Journal of Leukocyte Biology. 70 (6), 969-976 (2001).
- Gabrilovich, D. I., Nagaraj, S. Myeloid-derived suppressor cells as regulators of the immune system. Nature Reviewss Immunology. 9 (3), 162-174 (2009).
- National Research Council. Guide for the care and use of laboratory animals, 8th ed. , National Academies Press. Washington, DC. (2011).
- Tucker, D. K., Foley, J. F., Bouknight, S. A., Fenton, S. E. Sectioning Mammary Gland Whole Mounts for Lesion Identification. Journal of Visualized Experiments. (125), e55796(2017).
- Bayarmagnai, B., Perrin, L., Esmaeili Pourfarhangi, K., Gligorijevic, B. Intravital Imaging of Tumor Cell Motility in the Tumor Microenvironment Context. Methods in Molecular Biology. 1749, 175-193 (2018).
- Beerling, E., Ritsma, L., Vrisekoop, N., Derksen, P. W., van Rheenen, J. Intravital microscopy: new insights into metastasis of tumors. Journal of Cell Science. 124, Pt 3 299-310 (2011).
- Witcomb, L. A., Collins, J. W., McCarthy, A. J., Frankel, G., Taylor, P. W. Bioluminescent Imaging Reveals Novel Patterns of Colonization and Invasion in Systemic Escherichia coli K1 Experimental Infection in the Neonatal Rat. Infection and Immunity. 83 (12), 4528(2015).
- Singh, K., et al. Inter-alpha inhibitor protein administration improves survival from neonatal sepsis in mice. Pediatric Research. 68 (3), 242-247 (2010).
- Pluschke, G., Pelkonen, S. Host factors in the resistance of newborn mice to K1 Escherichia coli infection. Microb. Patho. , 93-102 (1988).
- Mancuso, G., et al. Role of interleukin 12 in experimental neonatal sepsis caused by group B streptococci. Infections and Immunity. 65 (9), 3731-3735 (1997).
- Thammavongsa, V., Rauch, S., Kim, H. K., Missiakas, D. M., Schneewind, O. Protein A-neutralizing monoclonal antibody protects neonatal mice against Staphylococcus aureus. Vaccine. 33 (4), 523-526 (2015).
- Andrade, E. B., et al. TLR2-induced IL-10 production impairs neutrophil recruitment to infected tissues during neonatal bacterial sepsis. Journal of Immunology. 191 (9), 4759-4768 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten