Method Article
Un modèle néonatal d’imagerie de la septicémie bactérienne gramnégative
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
L’infection des souris néonatales avec E. coli bioluminescent O1:K1:H7 a comme conséquence une infection septique avec l’inflammation pulmonaire significative et la pathologie pulmonaire. Ici, nous décrivons des procédures pour modéliser et étudier davantage la septicémie néonatale utilisant la formation image intravitale longitudinale en parallèle avec l’énumération des charges bactériennes systémiques, du profilage inflammatoire, et de l’histopathologie de poumon.
Résumé
Les nouveau-nés sont à un risque accru de septicémie bactérienne en raison du profil immunitaire unique qu’ils affichent dans les premiers mois de la vie. Nous avons établi un protocole pour étudier la pathogénie de E. coli O1:K1:H7, un sérotype responsable des taux de mortalité élevés chez les nouveau-nés. Notre méthode utilise l’imagerie intravitale des chiots néonatals à différents moments au cours de la progression de l’infection. Cette imagerie, parallèlement à la mesure des bactéries dans le sang, le profilage inflammatoire et l’histopathologie tissulaire, signifie une approche rigoureuse pour comprendre la dynamique de l’infection pendant la septicémie. Dans le présent rapport, nous modélisons deux inoculums infectieux pour la comparaison des fardeaux bactériens et de la gravité de la maladie. Nous constatons que l’infection subscapulaire mène à l’infection disséminée par 10 h après infection. À 24 h, l’infection d’E. coli luminescent était abondante dans le sang, les poumons et d’autres tissus périphériques. L’expression des cytokines inflammatoires dans les poumons est significative à 24 h, et ceci est suivi par l’infiltration cellulaire et l’évidence des dommages de tissu qui augmente avec la dose infectieuse. L’imagerie intravitale a certaines limites. Ceci inclut un seuil de signal luminescent et quelques complications qui peuvent surgir avec des nouveau-nés pendant l’anesthésie. En dépit de quelques limitations, nous trouvons que notre modèle d’infection offre un aperçu pour comprendre la dynamique longitudinale d’infection pendant le sepsis murin néonatal, qui n’a pas été soigneusement examiné jusqu’ici. Nous nous attendons à ce que ce modèle puisse également être adapté pour étudier d’autres infections bactériennes critiques au début de la vie.
Introduction
La septicémie bactérienne est une préoccupation importante pour les nouveau-nés qui présentent un profil immunitaire unique dans les premiers jours de la vie qui ne fournit pas une protection adéquate contre l’infection1. La septicémie néonatale continue d’être un problème de santé important aux États-Unis, représentant plus de 75 000 cas par année aux États-Unisseulement 2. Pour étudier ces infections en profondeur, de nouveaux modèles animaux qui récapitulent des aspects de la maladie humaine sont nécessaires. Nous avons établi un modèle néonatal d’infection de souris utilisant Escherichia coli, O1:K1:H73. E. coli est la deuxième cause de septicémie néonatale aux États-Unis, mais responsable de la majorité de la mortalité associée à la septicémie4,5. Cependant, c’est la cause principale quand les bébés prématurés et très bas de naissance-poids (VLBW) sont considérés indépendamment5. Le sérotype K1 est le plus souvent associé à des infections invasives de la circulation sanguine et à la méningite chez lesnouveau-nés 6,7. À l’heure actuelle, il n’existe pas d’autres options de traitement que les antibiotiques et les soins de soutien. Pendant ce temps, les taux de résistance aux antibiotiques continuent d’augmenter pour de nombreuses bactéries pathogènes, certaines souches d’E. coli résistantes à une multitude d’antibiotiques couramment utilisés dans le traitement8. Ainsi, il est impératif que nous continuions à générer des méthodes pour étudier les mécanismes de la septicémie et la réponse de l’hôte chez les nouveau-nés. Ces résultats peuvent aider à améliorer les traitements actuels et les résultats de l’infection.
L’état immunitaire des nouveau-nés se caractérise à la fois par des différences phénotypiques et fonctionnelles par rapport aux adultes. Par exemple, des niveaux élevés de cytokines anti-inflammatoires et réglementaires, tels que l’interleukine (IL)-10 et l’IL-27, se sont montrés produits par des macrophages dérivés du sang de cordon ombilical et sont présents à des niveaux plus élevés dans le sérum des nouveau-nés murins9,10,11. Ceci est compatible avec les niveaux inférieurs d’IFN-α, IFN-ɣ, IL-12, et TNF-α qui sont fréquemment rapportés des cellules néonatales comparées aux pendants adultes10. En outre, le système immunitaire néonatal est biaisé vers une réponse th2 et réglementaire des cellules T par rapport aux adultes12. Un nombre élevé de neutrophiles, de lymphocytes T, de cellules B, de cellules NK et de monocytes sont également présents chez les nouveau-nés, mais avec des déficiences fonctionnelles significatives. Ceci inclut des défauts dans l’expression des marqueurs de surface de cellules et de la présentation d’antigène qui suggèrent l’immaturité13,14,15. En outre, les neutrophiles néonatals sont significativement déficients dans leur capacité à migrer vers des facteurs chemotactic16. Les cellules suppressrices dérivées des myéloïdes (MDSC) se trouvent également à des niveaux élevés chez les nouveau-nés et se sont récemment révélés être une source d’IL-2711. Les MDSC sont très suppressifs envers les cellules T17. Collectivement, ces données démontrent des limites dans l’immunité néonatale qui prêtent à la susceptibilité accrue à l’infection.
Pour étudier la progression de la charge bactérienne et disséquer les réponses immunitaires protectrices de l’hôte pendant la septicémie néonatale, nous avons développé un nouveau modèle d’infection. Les souris néonatales aux jours 3-4 de la vie sont difficiles à injecter dans l’espace intraperitoneal ou la veine de queue. Dans notre modèle, le jour 3 ou 4 chiots sont administrés l’inoculum bactérien ou PBS sous-cutanée dans la région scapulaire. Une infection systémique se développe et en utilisant luminescent E. coli O1:K1:H7, nous pouvons longitudilement image souris néonatales individuelles pour suivre la charge bactérienne disséminée dans les tissus périphériques. C’est le premier modèle rapporté à utiliser l’imagerie intravitale pour comprendre la cinétique de la dissémination des bactéries pendant la septicémie chez les nouveau-nés murins3.
Ici, nous décrivons un protocole pour induire des infections septiques d’E. coli chez les souris néonatales3. Nous décrivons comment préparer l’inoculum bactérien pour l’injection, et comment récolter le tissu pour l’évaluation de la pathologie, la mesure des marqueurs inflammatoires par l’analyse d’expression de gène, et l’énumération de la charge bactérienne. En outre, l’utilisation d’E. coli luminescent pour l’imagerie intravitale des nouveau-nés infectés et la quantification de la mise à mort bactérienne par les cellules immunitaires néonatales sont également décrites. Ces protocoles peuvent également être adaptés pour étudier d’autres infections bactériennes importantes chez les nouveau-nés. Les données présentées ici représentent une approche globale nouvelle pour comprendre la dynamique d’infection dans un modèle néonatal traduisible de septicémie.
Protocole
Toutes les procédures ont été approuvées par les Comités institutionnels de soins et d’utilisation des animaux de Virginie-Occidentale et menées conformément aux recommandations du Guide for the Care and Use of Laboratory Animals par le National Research Council18.
1. Préparation de l’inoculum bactérien
- Striez une plaque tryptique d’agar de systique (TSA) avec une boucle inoculante pour isoler une seule colonie d’un stock de congélateur de E. coli O1:K1:H7-lux qui exprime habilement la luciferase et porte la résistance à la kanamycine3. Incuber toute la nuit à 37 °C.
- Le lendemain, laissez le bouillon Luria (LB) arriver à température ambiante (25 °C) dans une armoire de biosécurité.
- Sous un capot d’armoire de biosécurité, identifiez une seule colonie de la plaque striée et inoculez-la en 3 mL de LB complétée par de la kanamycine (30 μg/mL). Incuber toute la nuit à 37 °C en secouant (220 rpm). C’est la culture de départ.
- Diluer la culture de démarrage 1:100 dans un frais 3 mL de LB sous un capot d’armoire de biosécurité et le retourner à l’incubateur pour 2-3 h à 37 °C avec secousses (220 rpm). C’est la culture des stocks.
- Lisez la densité optique (OD) de la culture du blanc et du stock à 600 nm à l’aide d’un spectrophotomètre. Ajouter 100 μL de LB (sans bactéries) dans un puits d’une plaque d’analyse de fond bien plate de 96 puits; c’est le blanc. Ajouter ensuite 100 μL de la culture des stocks à un puits séparé. Répétez l’répétition pour deux répliques supplémentaires. L’absorption est lue à l’aide d’un lecteur de plaque.
- Soustrayez l’absorption vierge de la valeur d’absorption de la culture des stocks (la valeur od) et comparez à une courbe de croissance précédemment générée et validée pour déterminer une approximation de la densité bactérienne dans la culture des stocks pour la préparation de la dose infectieuse.
- Générer des inoculums cibles en fonction de la question de recherche. L’inoculum cible de 2 x 106 (faible) et de 7 x10 6 unités de formation de colonies (hautes) par souris (/souris) a été utilisé pour cette étude.
- Diviser la dose cible par souris (DoseT) par la concentration estimée de bactéries dans la culture des stocks (Stock) pour obtenir le volume de bactéries nécessaires à partir du tube de stock (VS).
- Multipliez le VS par le nombre de souris (NM) qui doivent être infectées avec suffisamment pour 5-10 extras pour la quantité totale de bactéries nécessaires pour l’infection plus 5-10 doses supplémentaires. Retirez ce volume du tube de stock et ajoutez-le à un nouveau tube de centrifugeuse.
- Utilisez l’équation ci-dessous :
DoseT/Stock = VS x NM = volume total (VT)de bactéries à retirer du tube de stock.
- Centrifuger la bactérie à 2 000 x g pendant 5 min à 4 °C et réutiliser la pastille bactérienne dans 50 μL de PBS (pH 7,2-7,6) par souris à infecter (p. ex., pour 10 doses de 2 x 106 bactéries par dose, la pastille de 2 x10 7 bactéries serait résuspendée en 500 μL PBS). Encore une fois, il est recommandé de préparer plus d’inoculum que nécessaire. Préparez un volume égal de PBS uniquement pour les inoculations de contrôle. Maintenir le contrôle infectieux de l’inoculum et du PBS sur la glace jusqu’à l’infection.
- Effectuez sept dilutions en série décuplées dans pbs dans une plaque de dilution du fond en plastique de 96 puits, et plaque 25 μL des dilutions en double sur les plaques de quadrant TSA complétées par de la kanamycine (30 μg/mL) pour énumérer la quantité réelle de bactéries administrées. Incuber à 37 °C pendant la nuit pour la formation de colonies avant l’énumération.
2. Identification des animaux
- Disposer un nombre suffisant de couples reproducteurs de sorte que les portées puissent être synchronisées pour les chiots appariés par âge. La variabilité de l’âge ±'un jour est acceptable.
- Identifier une souris femelle C57BL/6 enceinte et surveiller la naissance de la litière avant l’expérience prévue afin de déterminer avec précision l’âge.
- Pour faire la distinction entre les petits de 3 ou 4 jours infectés, utilisez une paire de petits ciseaux d’iris à bout fin pour couper les extrémités des queues des chiots de contrôle seulement. Les chiots infectés ne reçoivent pas de snips de queue. Avant de couper la queue, désinfecter la peau avec une boule de coton aspergée à 70% d’éthanol. Appliquer une pression à l’extrémité de la queue avec une boule de coton ou une gaze au besoin.
REMARQUE : Cette procédure est effectuée sous un capot d’armoire de biosécurité. Un snip de queue d’environ 1/8 de pouce est suffisant. - Pour identifier les chiots dans le contrôle et les groupes infectés, utilisez une seringue à insuline de 1 mL avec une aiguille permanente de 28 G x 1/2'' pour tatouer la queue des chiots. Avant le tatouage, désinfecter la peau avec une boule de coton aspergée à 70% d’éthanol. Cette procédure est effectuée sous une hotte d’armoire de biosécurité.
- Pour tatouer la queue, appliquez de l’encre de tatouage d’animal sur le bout de l’aiguille. Ensuite, retenez soigneusement le chiot d’une main, la queue entièrement exposée. Insérez doucement l’aiguille sous la peau, tout en maintenant un niveau superficiel de profondeur, et déplacez l’aiguille parallèlement à la peau de quelques millimètres jusqu’à ce qu’un petit marquage, ou point, ait été créé. Attendez quelques secondes avant d’enlever lentement l’aiguille sous la peau, pour éviter que l’encre ne se libère sous la peau.
- Appliquez une pression sur la plaie à l’aide d’une boule de coton ou d’une gaze au besoin. Enlever l’excès d’encre de tatouage sur la surface de la peau avec 70% d’éthanol.
- Répétez ce processus avec les souris suivantes dans les groupes infectés et témoins, tout en ajoutant un point supplémentaire avec chaque chiot successif tatoué (par exemple, le chiot 1 aura 1 point sur la queue, le chiot 2 aura deux points sur leur queue, etc.).
REMARQUE : Pour une couche d’identification supplémentaire, il est recommandé d’utiliser des couleurs distinctes d’encre de tatouage animale pour les groupes de contrôle et infectés.
3. Inoculation subscapulaire
REMARQUE : Pour cette étude, 2 expériences ont été réalisées avec un groupe à faible dose et à forte dose désigné pour chaque expérience. Dans la première expérience, 7 chiots ont reçu la faible dose d’inoculum (4 chiots ont été utilisés comme témoins), et 5 chiots d’une portée séparée ont reçu la dose élevée (3 chiots ont été utilisés comme témoins). Les chiots de l’expérience 1 n’ont fourni des données que pour le point de temps de 24 h. Dans la deuxième expérience, 8 chiots ont reçu l’inoculum de faible dose (2 chiots ont été utilisés comme témoins), et 6 chiots ont reçu l’inoculum à forte dose (2 chiots ont été utilisés comme témoins). Les chiots de l’expérience 2 ont fourni des données pour les points de temps de 0, 10 et 24 h.
- Les chiots de match d’âge ≤ 1 jour. Attribuez chaque litière à une faible dose ou à une portée à forte dose. Dans une litière, assigner aléatoirement des chiots comme un chiot de contrôle ou infecté.
- Le jour 3 ou 4 postnatal, enregistrez le poids de tous les chiots avant l’inoculation avec E. coli-lux ou le contrôle de PBS. Séparez le barrage des petits pendant ce temps pour s’assurer qu’ils ne sont pas déplacés pendant l’infection.
- Dans une armoire de biosécurité à l’aide d’une aiguille à insuline, aspirer soit PBS ou l’inoculum E. coli-lux. Pour ce travail, des inoculums de 2 x 106 et 7 x 106 CFUs par souris ont été utilisés. Garder l’inoculum infectieux et le PBS sur la glace jusqu’à l’administration par injection subscapulaire.
- Placez le nouveau-né sur une surface propre dans le capot de l’armoire de biosécurité et soulevez la peau à la nuque comme pour débrailler le chiot.
- Dans l’espace maintenant créé entre la peau et le muscle de l’animal, insérez l’aiguille, biseauté, juste sous la peau et injectez 50 μL de PBS ou E. coli-lux. Relâchez simultanément la partie pincée de la peau pour éviter le flux arrière d’injection.
- Retirer l’aiguille lentement et avec soin. Remettre les chiots avec des barrages une fois les injections terminées.
REMARQUE : En raison de leur stade anatomique dans le développement, il est techniquement difficile d’administrer une veine de queue ou une injection intraperitoneal aux chiots néonatals au jour 3-4. Ainsi, la voie d’infection subscapulaire a été choisie pour cette étude en raison de la facilité d’exécution.
4. Évaluation des critères de maladie et de point de terminaison
- Surveillez les chiots deux fois par jour pendant toute la durée de l’infection. Notez toute anomalie en apparence.
- Enregistrer les poids comme mesure objective de la morbidité.
- En plus des changements de poids, tester la capacité des chiots à se droiter en positionnant le nouveau-né sur le côté dorsal. Les animaux malades ne pourront pas se retourner vers le côté ventral et sur les pieds ou termineront cette action avec difficulté.
- Vérifiez ce qui suit pour marquer les animaux à proximité des critères de point final : moins de 85 % du poids corporel normal; diminution du mouvement et incapacité de se droiter; décoloration de la peau et un aspect plus gris ou transparent par opposition au rose; se sentir frais au toucher, ce qui indique une diminution de la température corporelle et des ecchymoses hémorragiques le long des côtés, ce qui indique également une maladie avancée.
REMARQUE : Si les nouveau-nés n’ont pas pris de poids pendant deux jours et ne correspondent à aucune des descriptions des étapes 4.4, ils ont satisfait aux critères de point de terminaison. Les chiots qui reçoivent la dose élevée répondent souvent aux critères de point final de 24 h. Les petits de contrôle dans les portées à faible et à forte dose seront euthanasiés en même temps pour permettre une analyse comparative entre les groupes de contrôle et les groupes expérimentaux. Procédez à la section euthanasie ci-dessous.
5. Imagerie in vivo de la charge bactérienne
- Utilisez un imageur et un logiciel microCT pour l’imagerie et l’analyse subséquente.
REMARQUE : La couleur de la peau des chiots n’a pas d’impact sur la qualité de l’imagerie. - Placez la cage avec des souris néonatales infectées par E. coli-luxet endicez-la dans un capot d’écoulement laminaire de niveau BSL-2. Retirez les souris pour les imager et placez-les dans une chambre isoflurane transparente à l’intérieur du capot. Il est recommandé de commencer par des contrôles non infectés pour évaluer la quantité d’isoflurane nécessaire.
- Ouvrez le logiciel sur l’ordinateur attaché au microCT. Initialisez le système et attendez que la température du CCD se verrouille à -90 °C.
- Allumez le vaporisateur d’isoflurane et ajustez le cadran à 5 % de débit d’isoflurane. Gardez les souris dans la chambre avec ce mélange d’isoflurane pendant 20-30 s jusqu’à ce qu’elles cessent de bouger; des temps d’exposition à l’anesthésie plus longs ou plus courts peuvent être nécessaires pour certaines souris. Une fois que les souris cessent de bouger, elles sont suffisamment anesthésiées et peuvent être photographiées.
- Déplacez les souris dans la chambre d’imagerie microCT et placez-les sur la boîte d’imagerie en position couchée, le nez faisant face à des cônes perpendiculaires au nez. Utilisez de la cire dentaire pour retenir doucement les pieds sur la boîte d’imagerie pour limiter tout mouvement. Jusqu’à 4 souris néonatales peuvent être photographiées à la fois.
- Baisser le vaporisateur d’isoflurane à 2-4% de flux pour garder les souris anesthésiés pendant l’imagerie. Fermez la porte de la chambre d’imagerie microCT. Vérifiez les souris quelques secondes plus tard. S’ils commencent à bouger, utilisez une boule de coton dans l’isoflurane et maintenez-la au nez de l’animal se déplaçant pendant 5 secondes pour anesthésier. Gardez la boule de coton près des animaux pendant l’imagerie. Veillez à ne pas trop anesthésier et mettre fin aux souris.
- À l’aide du logiciel, choisissez l’option Luminescent pour l’imagerie. Utilisez un filtre d’excitation réglé sur Block et le filtre d’émission réglé pour ouvrir,500 nm, 520 nm, 560 nm, 580 nm, 600 nm et 620 nm. Il y aura sept filtres d’émission totaux réglés pour la luminescence.
- Imagez les souris à chaque point de temps (0, 10 et 24 h après l’infection [hpi]) et enregistrez toutes les images dans un dossier pour chaque point de temps. Retournez les chiots à la cage avec le barrage et vérifiez que tous les chiots se sont remis de l’anesthésie.
- Pour analyser les images 2D, ouvrez des images dans le logiciel. Changer d’unité en Radiance (photons); cela se transformera en flux total (photons/seconde).
- N’analysez qu’une seule image définie avec ses filtres à émissions multiples à la fois. À partir de chaque ensemble d’images, notez les valeurs d’éclat minimales et maximales situées au coin inférieur droit de chaque image (p. ex., s’il y a 7 filtres d’émission, il y aura 7 images et 7 valeurs minimales et maximales). Répétez l’répétition pour chaque ensemble d’images à comparer.
- Pour déterminer une échelle qui englobera les valeurs et la luminescence de toutes les images, localisez la valeur minimale la plus basse et la valeur maximale la plus élevée pour chaque ensemble d’images. Pour cette étude, les images du filtre Open ont été utilisées comme représentatives.
- Mettez en surbrillance et ouvrez l’image de choix pour modifier l’échelle. Sur la palette d’outils,cliquez sur l’onglet Ajuster l’image et modifiez l’échelle de couleur aux valeurs maximales minimales et maximales les plus basses et les plus élevées précédemment identifiées. Enregistrez chaque image définie comme un TIFF. Analyser individuellement chaque point de temps de cette manière pour s’assurer que l’échelle correcte est affichée.
- Pour quantifier le flux total (quantité de signal luminescent par souris) pour chaque souris, ouvrez une image telle qu’elle a été décrite précédemment à l’étape 5.9-5.10. Ouvrez l’onglet Roi Tools sur la palette d’outils et sélectionnez l’outil cercle. Choisissez 1 cercle si vous analysez une zone de luminescence.
- Déplacez le retour sur investissement vers la superposition sur la zone de luminescence. Ajustez la taille du retour sur investissement si nécessaire.
REMARQUE : Si un ajustement est nécessaire, ajustez les IA dans d’autres images de façon comparable pour maintenir la cohérence. Choisissez des ROM de mesure. La fenêtre De mesures de ROI s’ouvrira affichant flux total (p/s), éclat moyen (p/s/cm2/sr), déviation standard de rayonnement, éclat minimum et éclat maximum. - Enregistrez des mesures de flux total pour chaque ensemble d’images. Ce nombre est la quantité quantifiée de luminescence dans la souris dans les images 2D.
- Pour réaliser des images microCT reconstruites en 3D, ouvrez le panneau de reconstruction 3D DLIT sur la palette d’outils et vérifiez toutes les longueurs d’onde à inclure sous l’onglet Analyser. Sélectionnez Reconstruire.
6. Euthanasie
- Préparer et étiqueter les tubes pour les tissus/organes d’intérêt pour l’autopsie et les applications appropriées en aval.
- Séparez les nouveau-nés du barrage dans une armoire de biosécurité.
- Tremper une boule de coton dans de l’isoflurane de qualité vétérinaire et placer à l’intérieur d’une chambre de confinement transparente.
- Si vous collectez du sang, préparez une micropipette P200 avec une pointe et avoir un tube de 1,5 mL avec 10 μL de 5 mM EDTA comme anticoagulant. Un volume de 50-200 μL de sang est prévu.
- Placez un nouveau-né dans la chambre et surveillez le chiot jusqu’à ce qu’il devienne immobile.
- Retirer rapidement le nouveau-né et le décapiter à l’aide de ciseaux. S’il est autorisé à respirer de l’air frais pendant une période prolongée, le chiot peut reprendre conscience. Les nouveau-nés ont une capacité pulmonaire réduite par rapport aux souris adultes et, par conséquent, ne respirent pas assez profondément pour l’euthanasie par l’isoflurane seulement.
- Recueillir le sang du tronc à la base de la tête à l’aide d’une micropipette P200. Pour maximiser la quantité de sang recueillie, effectuez cette étape le plus rapidement possible après la décapitation. Énumérer les bactéries présentes dans le sang par dilution en série et comptage standard des plaques tel que décrit à l’étape 1.9.
- Stériliser l’ensemble du nouveau-né avec 70% d’éthanol avant l’excision des échantillons de tissus.
7. Récolte de tissus
- Dans une armoire de biosécurité, utilisez le nouveau-né avec 70% d’éthanol pour prévenir la contamination. Mentent l’animal sur le côté droit.
- À l’aide de forceps, saisir la peau à un point entre l’abdomen et la jambe gauche arrière et faire une incision avec des ciseaux chirurgicaux à pointe fine. Continuer à couper la peau en se déplaçant vers le haut vers le dos. Progressez jusqu’à ce que toute la rate soit exposée.
- Utilisez les forceps pour saisir la rate et l’enlever de l’abdomen, à l’aide de ciseaux pour déconnecter le tissu conjonctif. Placez la rate dans la solution appropriée à son application en aval.
- Pour obtenir les poumons, peler complètement la peau de la poitrine.
- Entrer à la base du sternum avec des ciseaux maintenus verticalement, couper vers le haut jusqu’à ce que la cage thoracique soit fendue.
- Utilisez des forceps pour saisir les poumons droit et gauche individuellement et les retirer de la cavité thoracique. Retirer le cœur du tissu pulmonaire en coupant avec des ciseaux.
- Placez le poumon dans la solution appropriée à son application en aval. Pour l’isolement de l’ARN, utilisez 500 μL de guanidine thiocyanate/phénol (GTCP). Pour l’histopathologie, utilisez 5 mL de formaline à tampon neutre de 10 %.
8. Isolement d’ARN du tissu pulmonaire pour l’expression de gène
- Pré-refroidir la microcentrifugeuse à 4 °C.
- Hacher le tissu pulmonaire en GTCP avec des ciseaux. Ensuite, homogénéisez le tissu avec un homogénéisateur alimenté par batterie. Continuez jusqu’à ce que la solution soit aussi uniforme que possible. Incuber à température ambiante pendant 3-5 min.
- À l’aide de pointes de pipette filtrées, ajouter 100 μL de chloroforme. Inverser le tube pendant 15 s et incuber 3-5 min à température ambiante.
- Centrifugeuse pendant 15 min à 12.000 x g.
- Pendant la rotation, préparer des tubes de 1,5 mL avec 500 μL d’éthanol à 70 %. Assemblez et étiquetez les colonnes et les tubes de collecte du kit d’isolation ARN.
- Retirez soigneusement la couche supérieure et aqueuse sans perturber la couche interphase qui s’est formée pendant la centrifugation. Placer la couche aqueuse dans les tubes contenant 70% d’éthanol.
- Déplacez le mélange d’éthanol et de lysate dans la colonne du tube de collecte.
- À partir de ce moment, suivez le protocole du produit commercial du kit d’isolation de l’ARN jusqu’à l’élitution finale de l’ARN.
- Analyser l’ARN pour la pureté et la quantité. Utiliser immédiatement ou conserver à -80 °C jusqu’à nouvel usage.
9. synthèse cDNA
- Étiqueter les tubes PCR et réserver.
- Ajouter 1 μg d’ARN au mélange de réaction de l’ADN pour chaque échantillon.
- Ajoutez les réacoleurs et le modèle au tube PCR tel que décrit dans le protocole cDNA. Ajouter l’enzyme au mélange en dernier.
- Placez les tubes PCR dans un thermocycleur avec les réglages de course suivants : 5 min à 25 °C, 40 min à 42 °C, 15 min à 85 °C et 4 °C de prise finale.
- Retirer les tubes PCR du thermocycleur et les utiliser immédiatement ou les conserver à -20 °C jusqu’à nouvel usage.
10. Cycle quantitatif en temps réel de PCR (qPCR)
- Préparez un cocktail de mélange de réaction pour que chacun des gènes soit analysé. Chaque réaction PCR de 15 μL nécessite 7,5 μL de mélange de 2 x réagentine, 0,75 μL d’amorce/sonde 20X 5'-FAM-labeled gene-specific primer/probe, et 3.75 μL d’eau nucléase-libre. Amplicons vont généralement de 60-120 bp.
- Ajouter 3 μL de modèle cDNA pour chaque groupe expérimental aux puits appropriés.
- Ajouter 12 μL du cocktail de mélange de réaction spécifique aux gènes aux puits appropriés.
- Couvrir la plaque d’un film adhésif optique et d’une centrifugeuse pendant 1 min à 1 000 x g pour éliminer les bulles qui pourraient s’être formées dans les puits.
- Placez la plaque PCR dans un thermocycleur PCR en temps réel.
- Réglez la méthode de course comme suit : 3 min à 95 °C, 40 cycles de 95 °C pour 15 s suivis de 60 °C pendant 1 min.
- Analyser les données en normalisant le gène d’intérêt pour un contrôle interne et exprimer les données provenant d’échantillons infectés par rapport à des échantillons de contrôle non infectés à l’aide de laformule 2 -ΔΔCt et d’une transformation du journal2 des nombres.
11. Histopathologie pulmonaire
- Retirez les poumons du chiot néonatal tel que décrit ci-dessus.
- Placez le tissu dans un volume de formaline à tampon neutre de 10 % de sorte que le rapport de solution aux tissus soit d’environ 20:1 pendant 3-7 jours.
- Coordonner avec un service d’histologie approprié pour l’intégration paraffine, la sectionnement, et l’hématoxyline et l’éosine (H & E) coloration. Pour ce travail, le noyau d’histopathologie de l’Université de Virginie-Occidentale a été utilisé. Vous pouvez également suivre les protocoles précédemment décrits19.
12. Analyse de mise à mort bactérienne in vitro
- Retirez la rate du chiot néonatal non infecté tel que décrit ci-dessus et placez-la dans un panier en nylon de 40 μm dans une boîte de Pétri stérile de 60 mm. Répétez ceci et la rate de piscine dans un tube pour être récoltée et homogénéisée ensemble.
- Ajouter 5 mL de PBS complété par 10% de FBS.
- Désagréger le tissu à l’aide d’un piston stérile de seringue de 3 mL jusqu’à ce qu’une seule suspension cellulaire soit créée.
- Recueillir la suspension à cellule unique à l’extérieur du panier en nylon, transférer dans un tube de centrifugeuse de 15 mL et les cellules à granulés à 350 x g pendant 5 min.
- Suspendre les cellules dans le tampon de lyse des globules rouges (2 mL jusqu’à 7-8 rates) et laisser reposer pendant 5 min à température ambiante pour éliminer les érythrocytes.
- Lavez les splenocytes avec du PBS et des granulés comme ci-dessus.
- Suspendre les splenocytes dans 0,25 mL de PBS complété par 0,5% BSA et 2 mM EDTA selon le rendement cellulaire prévu.
- Comptez les splenocytes à l’aide d’un hémomètre ou d’une autre application appropriée.
- Isoler Ly6B.2+ (population myéloïde de granulocytes/monocytes inflammatoires) cellules avec des perles immunomagnétiques selon le protocole du fabricant.
- Graine Ly6B.2+ cellules à une densité de 1 x 105 cellules par puits dans une plaque noire ou blanche de 96 puits dans un volume de 0,1 mL de DMEM qui contient 10% de FBS, 2 mM de glutamine et 25 mM HEPES (milieu complet).
- Énumérer e. coli bioluminescent tel que décrit dans la section 1 et préparer l’inoculum bactérien à la multiplicité désirée de l’infection (MOI) dans un volume final de 0,1 mL. Il est préférable de le faire en faisant ce qui est nécessaire pour tous les puits à un MOI commun en lot.
- Ajouter 0,1 mL d’inoculum bactérien ou compléter le milieu seul comme un contrôle. Incuber la plaque multi-puits à 37 °C et 5 % de CO2 pendant 1 h.
- Remplacez le média par 0,2 mL de supports complets frais contenant de la gentamicine (100 μg/mL) en enlevant doucement les supports à l’aide d’une pipette et en ajoutant des supports frais avec une nouvelle pointe de pipette. Remettre la culture en incubation pour 2 h supplémentaires.
- À 3 h après l’infection, mesurer la luminescence dans chaque puits de la plaque de culture lidded à partir du fond à l’aide d’un lecteur de plaque, puis retourner la culture à l’incubation.
- Répétez les mesures de la luminescence à d’autres points de temps désirés.
Résultats
Ce protocole a induit le sepsis bactérien chez les souris néonatales, et nous avons employé la formation image intravitale longitudinale, l’énumération des bactéries dans le sang, les évaluations histologiques de la pathologie, et les profils inflammatoires d’expression de cytokine pour étudier le cours de la maladie. Des signes de morbidité ont été observés chez les chiots néonatals infectés par des inoculums faibles (~2 x10 6 FC) et élevés (~7 x10 6 FCUs) d’E.coli au fil du temps. Les chiots qui ont reçu l’inoculum plus grand ont montré des signes plus proéminents de détresse qui ont inclus la mobilité réduite, l’incapacité de corriger leur posture, et la capacité altérée de maintenir une position verticale par 24 h après infection (hpi). Il y avait, cependant, une gamme de morbidité car quelques chiots sont apparus pires que d’autres. Immédiatement après l’infection, un animal à faible dose est mort des suites d’une exposition à l’isoflurane au cours d’une séance d’imagerie afin d’établir la ligne de base. Par 24 hpi, deux des six animaux à forte dose ont succombé à l’infection systémique (mortalité de 33,3%). Les chiots infectés qui ont reçu une dose élevée ou faible d’inoculum pesaient beaucoup moins que leurs compagnons de litière de contrôle à 24 hpi(figure 1A,B). Tous les chiots qui ont reçu l’inoculum plus élevé répondaient aux critères de point de terminaison à 24 hpi. En tant que tel, tous les chiots infectés dans ce groupe ont été euthanasiés après formation image. Des bactéries dans le sang ont été énumérées pour un sous-ensemble de souris qui ont reçu l’inoculum inférieur, et pour tous les animaux qui ont reçu l’inoculum plus élevé puisqu’ils ont tous été euthanasiés. Les résultats de deux expériences réalisées de la même façon indiquent que même si la plupart des animaux avaient des niveaux élevés de bactéries dans le sang (CFUs/mL) à 24 hpi, certains animaux n’avaient pas de bactéries détectables dans le sang (figure 1C). Ces derniers suggèrent qu’ils ont effacé l’infection à ce moment-là. Comme prévu, les petits qui ont reçu l’inoculum plus élevé avaient près de trois ordres de grandeur plus de CFUs/mL à 24 hpi par rapport aux chiots qui ont reçu l’inoculum de faible dose (figure 1C).
L’imagerie animale vivante des bactéries luminescentes a confirmé la dissémination des bactéries et l’augmentation de la croissance chez les chiots néonatals au fil du temps à 10 et 24 hpi (figure 2 et figure 3). De plus, grâce à l’imagerie intravitale avec le microCT, nous avons pu identifier les foyers d’infection, y compris le cerveau (figure 2B), les poumons (figure 2B, figure 3A,B) et d’autres tissus périphériques (figure 2B). Les poumons de certaines souris fortement infectées ont démontré des régions opaques compatibles avec la consolidation inflammatoire qui a co-localisé au signal bactérien luminescent (Figure 3A). Ces régions d’exsudate inflammatoire présumé ne se trouvent pas dans les poumons de contrôle non infectés (figure 3A). D’autres preuves d’une réponse inflammatoire prononcée de cytokine dans les poumons des chiots infectés sont démontrées par l’analyse d’expression de gène d’IL-1β, IL-6, et TNF-α. Une augmentation significative de l’expression par rapport aux témoins a été observée pour les trois cytokines dans les groupes d’inoculum faibles et élevés (figure 4A). L’histopathologie du poumon a également été examinée à 24 hpi dans le contrôle et les chiots infectés. En dépit des profils inflammatoires semblables de cytokine, une augmentation progressive de la pathologie a été généralement observée de l’inoculum inférieur au plus élevé. Comparés aux tissus des contrôles non infectés, les poumons des chiots infectés ont montré des changements inflammatoires notables, épaississement de la paroi alvéolaire, hémorragie alvéolaire accrue, et infiltration inflammatoire (figure 4B). Dans les infections les plus graves, la congestion pulmonaire et les zones d’hémorragie ont contribué à une réduction massive de l’espace en plein air (figure 4B). Collectivement, ces résultats démontrent que dans notre modèle de septicémie néonatale de début tôt, la diffusion des bactéries luminescentes peut être suivie au fil du temps d’un emplacement subscapulaire d’inoculation aux foyers importants d’infection et causent l’inflammation et la pathologie significatives chez les animaux sévèrement infectés.
Pour étudier les facteurs hôtes qui contribuent à la mise à mort bactérienne par des cellules immunitaires innées telles que les monocytes, les macrophages et les neutrophiles, nous avons mis au point un test in vitro sensible pour mesurer le dégagement bactérien. Ly6B.2+ les cellules isolées de la rate des souris néonatales ont été infectées par E. coli bioluminescent à une gamme d’IOS pendant 1 h, puis traitées avec de la gentamicine pour tuer les bactéries extracellulaires. À 3, 6, 20, et 48 hpi, la luminescence intracellulaire a été mesurée avec un lecteur multimode. Comme prévu, avec l’augmentation de moi, le signal plus luminescent a été enregistré à 3 h( figure 5). Peu à peu, ce signal a été perdu, ce qui indique un dégagement bactérien( figure 5). Cet essai est aimable aux cytokines complétées, à la neutralisation des effecteurs sécrétés, et à l’addition des inhibiteurs pharmacologiques des voies cellulaires pour étudier des interventions qui peuvent favoriser le dégagement bactérien et servir à améliorer des résultats dans le modèle néonatal de septicémie décrit ici.

Figure 1 : Changements dans le poids corporel et la réplication bactérienne chez les souris néonatales septiques.
(A,B) Poids individuels de la souris au sein d’un groupe (faible et élevé) exprimé en pourcentage du poids moyen des chiots de contrôle littermate. Les données sont présentées comme pourcentage moyen ± SEM. Les t-tests individuels à chaque point de temps post-infection révèlent des différences significatives à 24 h entre les chiots de contrôle et les chiots qui ont reçu le faible inoculum(p<0,0001) (A), ou entre les chiots de contrôle et les chiots qui ont reçu l’inoculumélevé (p=0,0031) (B). (C) CFU/mL dans le sang à 24 hpi ont été transformés en rondins et présentés comme le test moyen ± SEM. Mann-Whitney révèle une tendance vers l’importance entre les inoculums à faible et à haute dose (p= 0,0882). S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.

Figure 2 : L’imagerie intravitale démontre la dissémination des bactéries chez les souris néonatales au fil du temps.
(A) Une souris néonatale représentative (#1) infectée par un inoculum de ~2 x 106 CFUs est montrée à l’heure 0, 10, et 24 hpi. Une échelle colorimétrique avec les valeurs d’éclat minimales et maximales par point de temps sont affichées pour chaque point de temps. Les souris à 0 et 10 h sont affichées à la fois sur leur échelle de temps et sur l’échelle de 24 h pour démontrer les changements dans la croissance bactérienne au fil du temps. (B) Des images microCT reconstruites en 3D représentatives de la même souris néonatale à 10 et 24 hpi sont affichées. Chaque point de temps a des images aux perspectives aériennes, transaxiales et coronaires. Dans l’image transaxiale à 24 hpi, le plan s’est déplacé vers la périphérie de la souris pour mieux afficher les foyers d’infection dans les tissus périphériques. Les flèches blanches indiquent le cerveau et le rein à 10 hpi et le rein et le poumon à 24 hpi. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
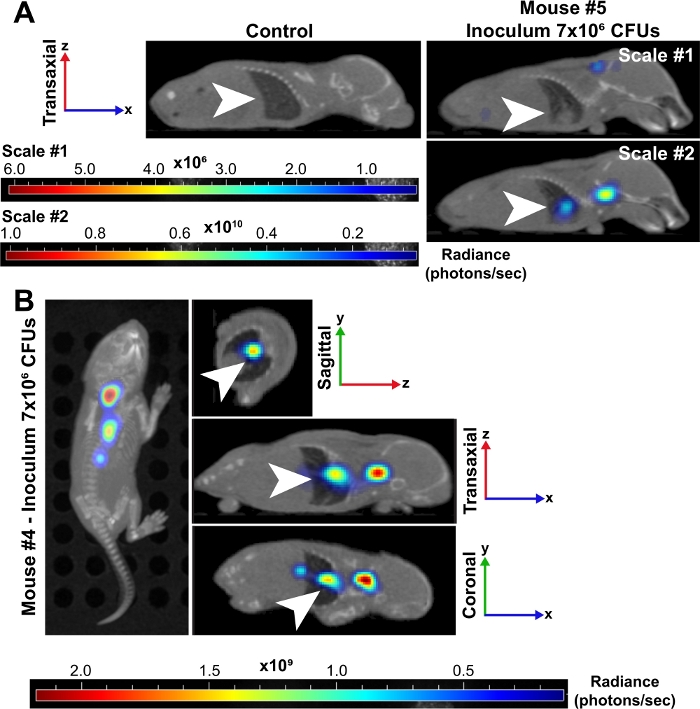
Figure 3 : Les poumons sont un site d’infection majeure pendant la septicémie bactérienne chez les nouveau-nés.
(A) Les images microCT reconstruites représentatives en 3D d’une souris néonatale (#5) infectée par un inoculum d’environ 7 x10 6 UC sont affichées à 24 hpi par rapport à un contrôle non infecté. Les deux souris sont affichées dans la perspective transaxiale et les poumons sont indiqués par des flèches blanches. La souris infectée a été placée sur deux écailles d’éclat (photons/sec). Scale #1 comprend les 6 longueurs d’onde (500, 520, 560, 580, 600, 620 nm) et l’échelle #2 ne comprend que 500, 520 et 560 longueurs d’onde nm. Cette deuxième échelle nous a permis de visualiser un signal accru chez les bactéries dans les poumons parce que les longueurs d’onde inférieures sont plus fortement absorbées par les tissus et produisent un signal plus fort. (B) Les images microCT reconstruites représentatives en 3D d’une souris néonatale (#4) infectée par un inoculum d’environ 7 x 106 UC sont affichées à 24 hpi. Ce point de temps a des images aux perspectives aériennes, sagittales, transaxiales et coronaires. Les flèches blanches indiquent les foyers d’infection dans les poumons. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
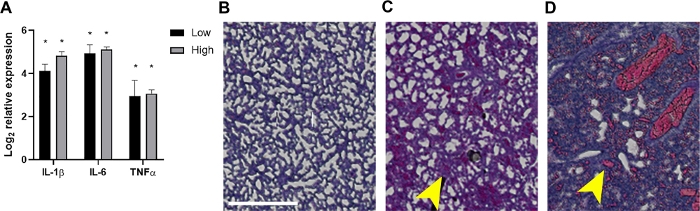
Figure 4 : Inflammation et résultats histopathologiques associés dans les poumons des nouveau-nés septiques.
À 24 hpi les poumons ont été récoltés à partir de chiots qui ont reçu ~2 x10 6 ou 7 x 106 CFUs ou contrôles non infectés. (A) L’ARN a été isolé et l’expression d’IL-1β, IL-6, ou TNF-α comme déterminé par rapport aux contrôles non infectés par PCR quantitative en temps réel en utilisant la formule 2-ΔΔCt. Les données sont affichées comme le journal moyen2 transformé changement d’expression ± SEM pour chaque inoculum comme indiqué. La signification statistique a été déterminée à l’aide de t-tests non appraux des valeurs ΔCt entre les gènes de cytokine individuels et le contrôle interne dans l’intervalle de confiance de 95 %. Les astérisques indiquent p<0.01. (B-D) Des sections histopathologiques des tissus pulmonaires tachés de H&E (20x, zone d’intérêt construite en masque de découpage et agrandie pour plus de clarté) sont montrées. Les tissus pulmonaires d’un contrôle représentatif non infecté (B) ou le nouveau-né infecté à la basse (C) ou élevé (D) inoculum sont montrés. Les flèches jaunes indiquent l’épaississement alvéolaire (C) ou l’hémorragie (D). Barre d’échelle = 500 μm. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
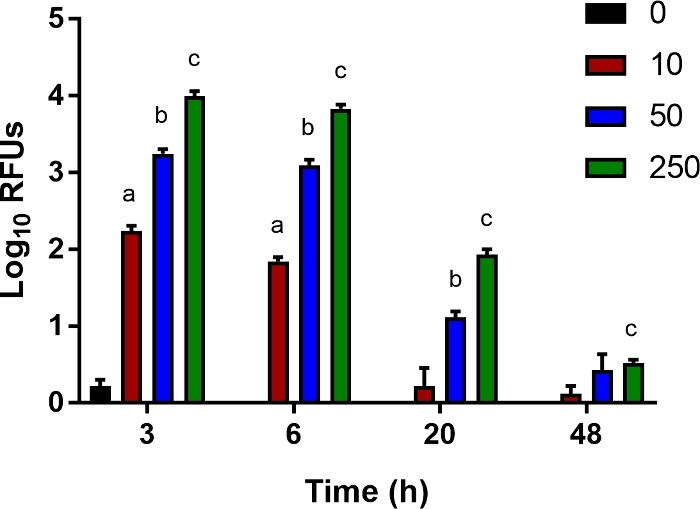
Figure 5 : Un essai in vitro pour le dégagement bactérien.
Ly6B.2+ les cellules ont été isolées de la rate des nouveau-nés de contrôle non infectés. Les cellules ont été ensemencées dans des plaques de 96 puits et infectées par E. coli O1:K1:H7 exprimant la luciferase à une multiplicité d’infection (MOI) de 10, 50 ou 250 comme indiqué. Après 1 h, le milieu a été remplacé par de la gentamicine fraîche (100 μg/mL). Des unités de lumière relative moyenne (RLU) ± SE pour une expérience individuelle représentative de plusieurs sont montrées. La signification statistique dans l’intervalle de confiance de 95% a été déterminée utilisant des essais non apprired de t avec la correction de Welch ; les astérisques indiquent p<0.05. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
Discussion
Notre modèle d’infection subscapulaire pour induire la septicémie bactérienne chez les souris néonatales est une nouvelle méthode pour étudier la propagation longitudinale des pathogènes bactériens en temps réel. L’imagerie intravitale offre l’occasion d’explorer la dissémination bactérienne en temps réel chez les nouveau-nés. Ceci est essentiel pour comprendre la cinétique de la dissémination bactérienne et pour étudier plus avant la réponse de l’hôte et les dommages à la phase appropriée de la maladie. Les chiots souris sont administrés une injection sous-cutanée et subscapulaire d’inoculum bactérien. Cette technique d’injection est plus simple que d’autres alternatives couramment utilisées, telles que la veine de la queue et les infections intraperitoneal, car elle nécessite moins de précision dans un site d’injection. Ceci est important étant donné la petite taille des chiots. L’imagerie intravitale permet une évaluation longitudinale de la prolifération bactérienne et de la dissémination dans les tissus périphériques et le système nerveux central au fil du temps sans avoir besoin de sacrifier l’animal. Des approches et des technologies d’imagerie similaires ont été utilisées pour l’étude de la biologie du cancer et de lamétastase 20,21. En outre, alors qu’une autre étude a cité l’utilisation de l’imagerie bioluminescente lors d’une infection à E. coli chez les rats néonatals22, ici, nous avons appliqué l’approche aux souris néonatales, dans lequel notre méthodologie permet l’évaluation de la cinétique bactérienne pendant la septicémie murine. La visualisation de la bactérie est basée sur l’émission de lumière bioluminescente à différentes longueurs d’onde provenant de bactéries (p. ex., l’activité bactérienne de la luciferase) chez l’animal. La bioluminescence est ensuite visualisée à l’aide d’une caméra couplée chargée refroidie (CCD). La bioluminescence visualisée qui en résulte peut ensuite être reconstruite en une image 3D qui montre à la fois les effets spatiaux et temporels des bactéries chez un animal. Pour une couche supplémentaire et plus nuancée d’acquisition de données, l’identification réussie d’animaux par tatouage de queue permet une évaluation répétée des mesures des chiots individuels à travers le temps et l’identification des valeurs aberrantes possibles au sein d’un groupe expérimental donné.
L’application la plus réussie du modèle décrit exige l’exactitude en préparation de l’inoculum bactérien. Ici, nous décrivons une méthode optimisée pour la préparation bactérienne à l’aide d’une courbe de croissance préé établie et validée d’E. coli qui réduit la variation entre la cible et l’inoculum réel. Cela permet la reproductibilité expérimentale à un inoculum prévu. L’inclusion de deux inoculums dans notre modèle a démontré des résultats dose-dépendants dans les CFUs de sang, la mortalité, et la pathologie pulmonaire. Cependant, certains aspects de la trajectoire de la maladie n’étaient pas dépendants de la dose. L’incapacité de prendre du poids chez les animaux infectés n’était pas dépendante de l’inoculum à 24 hpi. En outre, des niveaux semblables d’expression inflammatoire de cytokine ont été observés dans le poumon en réponse à l’infection avec les deux inoculums. Reste à déterminer si ce modèle serait reproduit dans tous les tissus où des bactéries ont été observées, comme le rein, le foie, la rate et le cerveau. En plus de la septicémie, E. coli O1:K1:H7 est associé à la méningite dans la population néonatale23. Cette infection cérébrale se produit lorsque des bactéries de la périphérie envahissent et pénètrent la barrière héto-encéphalique. Les études futures exploreront cet aspect du modèle à travers l’analyse des changements dans l’expression des protéines à jonction serrée, ainsi que tester différentes gammes d’inoculums bactériens. Une modification supplémentaire au cours de l’imagerie intravitale comprend l’ajout d’une boule de coton singulier, aspergée d’isoflurane, qui est placé à environ 2-3 pouces des souris pendant l’imagerie. En réponse à des expériences précédentes dans lequel les chiots néonatals ont repris conscience au cours de la séance d’imagerie, empêchant l’acquisition d’images précises, nous placeons maintenant la boule de coton assez près des souris pour les garder continuellement anesthésiés pendant l’imagerie. Cependant, il est important que cela ne se fasse pas si près qu’ils ne parviennent pas à se remettre de l’anesthésie.
Bien que flexible et facilement adaptable pour l’étude de la cinétique de différentes bactéries dans divers modèles animaux et de maladies, notre protocole a certaines limites à considérer. La première limite à considérer est que la voie subscapulaire de l’infection ne reflète pas une voie naturelle de transmission. Cependant, l’un des principaux objectifs dans l’élaboration de notre modèle dès le départ était d’établir un mode de prestation facilement reproductible qui pourrait être utilisé pour établir une infection systémique qui reproduit des aspects de la maladie humaine. Par conséquent, dans ce rapport, nous décrivons un modèle du syndrome humain de maladie de septicémie tôt, pas un modèle de transmission naturelle. Il existe un modèle établi d’accouchement oral chez les rats néonatals qui reproduit certains aspects de la transmission humaine commune, tels que la colonisation initiale de l’infection à E. coli dans le canal alimentaire et la diffusion subséquente dans le sang et les tissus périphériques, y compris le cerveau22. Le modèle établi par Witcomb et ses collègues intègre également la bioluminescente E. coli et l’imagerie intravitale. En outre, il est crucial de minimiser l’exposition aux isofluranes, ainsi que d’injecter, tatouage de queue, et manipuler les chiots aussi rapidement que possible sans compromettre la précision et la précision des techniques dans une tentative d’atténuer les niveaux de stress pour les nouveau-nés et les barrages. Dans certains cas, si les chiots éprouvent des manipulations améliorées induites par l’homme et/ou expérimentales, les mères peuvent cesser de allaiter et de s’occuper des chiots, ce qui entraîne une diminution de la survie sans rapport avec l’infection. De même, les petits qui sont exposés à l’isoflurane pendant de longues périodes au-delà des 10 minutes approximatives d’une séance d’imagerie ont un risque accru de décès; il est donc crucial de fournir juste assez d’isoflurane pour anesthésier suffisamment les souris, mais pas assez pour les euthanasier. Un dernier point à considérer est la limite de sensibilité. Tissus dans lesquels moins de 104 FC/mL E. coli ont été recensés le signal luminescent enregistré tombe à l’extrémité inférieure de la plage détectable, selon la méthode d’échelle utilisée dans le logiciel d’imagerie3. Ainsi, certains tissus peuvent être colonisés avec de faibles niveaux de bactéries, mais apparaissent sans bioluminescence visible.
À l’heure actuelle, la plupart des études utilisent des méthodes adultes de dissémination bactérienne, comme les injections intrapénitérales (c.-à-d.) et les injections de veines de queue pour les nouveau-nés. Pluschke et Pelkonen ont analysé l’effet d’E. coli K1 sur les souris néonatales par i.p., veine de queue, et infectionsorales 24. Cette étude a démontré que différents génotypes de souris immunodéficiences sont plus sensibles à la souche K1; cependant, de nombreux aspects de la réponse immunitaire de l’hôte à l’infection ainsi que les mécanismes de propagation bactérienne ne sont pas abordés. Deshmukh et ses collègues ont infecté des souris néonatales intraperitoneally avec E. coli K1 ou K. pneumoniae et ont mesuré des CFUs dans la rate et le foie à 72 hpi25. Cette étude a également analysé certains aspects de la réponse de l’hôte à l’infection en fonction de la préexposition des souris aux antibiotiques. Cependant, l’investigation complète de la diffusion bactérienne aux tissus périphériques et au sang au fil du temps en parallèle avec le profilage inflammatoire dans le même tissu (autre que la granulocytose) n’a pas été abordée. D’autres études sur la septicémie néonatale chez la souris avec Staphylococcus aureus, Staphylococcus epidermidis, Streptococcus du groupeB et E. coli explorent divers aspects du système immunitaire hôte en réponse à l’infection. Cependant, aucune de ces études n’utilise l’imagerie intravitale pour explorer la cinétique de la dissémination bactérienne ou la localisation des foyersd’infection 23,25,26,27. Notre méthode d’infection et d’imagerie intravitale, combinée à l’évaluation du fardeau bactérien et au profilage inflammatoire des tissus périphériques, nous permet d’examiner en profondeur les aspects de l’hôte et de l’agent pathogène pendant l’infection, en fournissant une compréhension plus précise de l’interaction hôte-pathogène pendant la septicémie.
Nous avons l’intention d’utiliser ce modèle d’infection et d’imagerie pour mieux comprendre la septicémie néonatale précoce en utilisant une variété de bactéries pathogènes généralement responsables de la septicémie chez les nouveau-nés, y compris le streptocoque du groupe B, K. pneuomoniae, et Listeria monocytogenes. Ce modèle d’infection nous permettra de comparer longitudiinally la diffusion de différents pathogènes bactériens en parallèle avec la réponse de l’hôte chez les nouveau-nés. En outre, ce modèle est adaptable au transfert adoptif de types spécifiques (conjugués fluorescentement) de cellules immunitaires pour étudier leur migration vers les sites d’infection et l’influence subséquente sur la réponse de l’hôte et le contrôle des bactéries. Cela donne l’occasion de mieux comprendre les interactions hôte-pathogène qui se produisent pendant la septicémie au début de la vie d’une manière qui n’a pas été démontrée auparavant.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Ces travaux ont été appuyés par des fonds institutionnels .M C.R.
matériels
| Name | Company | Catalog Number | Comments |
| 1 mL Insulin Syringe | Coviden | 1188128012 | Inoculum or PBS injection |
| 10% Neutral Buffered Formalin | VWR | 89370-094 | Histopathology |
| ACK Lysis Buffer | Gibco | LSA1049201 | Bacterial clearance assay |
| Animal Tattoo Ink Paste | Ketchum | KI1482039 | Animal identification |
| Animal Tattoo Ink Green Paste | Ketchum | KI1471039 | Animal identification |
| Anti-Ly-6B.2 Microbeads | Miltenyi Biotec | 130-100-781 | Cell isolation |
| Escherichia coli O1:K1:H7 | ATCC | 11775 | |
| Escherichia coli O1:K1:H7-lux (expresses luciferase) | N/A | N/A | Constructed in-house at WVU |
| E.Z.N.A. HP Total Extraction RNA Kit | Omega Bio-tek | R6812 | RNA extration |
| DPBS, 1X | Corning | 21-031-CV | |
| Difco Tryptic Soy Agar | Becton, Dickinson and Company | 236950 | Bacterial growth |
| IL-1 beta Primer/Probe (Mm00434228) | Thermo Fisher Scientific | 4331182 | Cytokine expression qPCR |
| IL-6 Primer/Probe (Mm00446190) | Thermo Fisher Scientific | 4331182 | Cytokine expression qPCR |
| iQ Supermix | Bio-Rad | 1708860 | Real-time quantitative PCR |
| iScript cDNA Synthesis Kit | Bio-Rad | 1708891 | cDNA synthesis |
| Isolation Buffer | Miltenyi Biotec | N/A | Bacterial clearance assay |
| IVIS Spectrum CT and Living Image 4.5 Software | Perkin Elmer | N/A | Intravital imaging |
| LB Broth, Lennox | Fisher BioReagents | BP1427-500 | Bacterial growth |
| EASYstrainer (Nylon Basket) | Greiner Bio-one | 542 040 | Cell strainer |
| SpectraMax iD3 | Molecular Devices | N/A | Plate reader |
| Pellet Pestle Motor | Grainger | 6HAZ6 | Tissue homogenization |
| Polypropylene Pellet Pestles | Grainger | 6HAY5 | Tissue homogenization |
| Prime Thermal Cycler | Techne | 3PRIMEBASE/02 | cDNA synthesis |
| TNF-alpha Primer/Probe (Mm00443258) | Thermo Fisher Scientific | 4331182 | Cytokine expression qPCR |
| TriReagent (GTCP) | Molecular Research Center | TR 118 | RNA extration |
Références
- Qazi, S. A., Stoll, B. J. Neonatal sepsis: a major global public health challenge. Pediatr Infect Dis J. 28, 1-2 (2009).
- Simonsen, K. A., Anderson-Berry, A. L., Delair, S. F., Davies, H. D. Early-onset neonatal sepsis. Clinical Microbiology Reviews. 27 (1), 21-47 (2014).
- Seman, B. G., et al. Elevated levels of interleukin-27 in early life compromise protective immunity in a mouse model of Gram-negative neonatal sepsis. Infections and Immunity. , (2019).
- Schrag, S. J., et al. Epidemiology of Invasive Early-Onset Neonatal Sepsis, 2005 to 2014. Pediatrics. 138 (6), 20162013(2016).
- Stoll, B. J., et al. Early onset neonatal sepsis: the burden of group B Streptococcal and E. coli disease continues. Pediatrics. 127 (5), 817-826 (2011).
- Weston, E. J., et al. The burden of invasive early-onset neonatal sepsis in the United States, 2005-2008. Pediatrics and Infectious Disease Journal. 30 (11), 937-941 (2011).
- Hornik, C. P., et al. Early and late onset sepsis in very-low-birth-weight infants from a large group of neonatal intensive care units. Early Human Development. , Suppl 2 69(2012).
- Vergnano, S., Sharland, M., Kazembe, P., Mwansambo, C., Heath, P. T. Neonatal sepsis: an international perspective. Archives of Disease in Childhood: Fetal and Neonatal Edition. 90 (3), 220-224 (2005).
- Kraft, J. D., et al. Neonatal macrophages express elevated levels of interleukin-27 that oppose immune responses. Immunology. 139 (4), 484-493 (2013).
- Basha, S., Surendran, N., Pichichero, M. Immune responses in neonates. Expert Reviews of Clinical Immunology. 10 (9), 1171-1184 (2014).
- Gleave Parson, M., et al. Murine myeloid-derived suppressor cells are a source of elevated levels of interleukin-27 in early life and compromise control of bacterial infection. Immunology and Cell Biology. 97 (5), 445-446 (2018).
- Adkins, B., Leclerc, C., Marshall-Clarke, S. Neonatal adaptive immunity comes of age. Nature Reviews Immunology. 4 (7), 553-564 (2004).
- Kim, S. K., Keeney, S. E., Alpard, S. K., Schmalstieg, F. C. Comparison of L-selectin and CD11b on neutrophils of adults and neonates during the first month of life. Pediatrics Research. 53 (1), 132-136 (2003).
- Velilla, P. A., Rugeles, M. T., Chougnet, C. A. Defective antigen-presenting cell function in human neonates. Clinical Immunology. 121 (3), 251-259 (2006).
- Le Garff-Tavernier, M., et al. Human NK cells display major phenotypic and functional changes over the life span. Aging Cell. 9 (4), 527-535 (2010).
- Weinberger, B., et al. Mechanisms underlying reduced responsiveness of neonatal neutrophils to distinct chemoattractants. Journal of Leukocyte Biology. 70 (6), 969-976 (2001).
- Gabrilovich, D. I., Nagaraj, S. Myeloid-derived suppressor cells as regulators of the immune system. Nature Reviewss Immunology. 9 (3), 162-174 (2009).
- National Research Council. Guide for the care and use of laboratory animals, 8th ed. , National Academies Press. Washington, DC. (2011).
- Tucker, D. K., Foley, J. F., Bouknight, S. A., Fenton, S. E. Sectioning Mammary Gland Whole Mounts for Lesion Identification. Journal of Visualized Experiments. (125), e55796(2017).
- Bayarmagnai, B., Perrin, L., Esmaeili Pourfarhangi, K., Gligorijevic, B. Intravital Imaging of Tumor Cell Motility in the Tumor Microenvironment Context. Methods in Molecular Biology. 1749, 175-193 (2018).
- Beerling, E., Ritsma, L., Vrisekoop, N., Derksen, P. W., van Rheenen, J. Intravital microscopy: new insights into metastasis of tumors. Journal of Cell Science. 124, Pt 3 299-310 (2011).
- Witcomb, L. A., Collins, J. W., McCarthy, A. J., Frankel, G., Taylor, P. W. Bioluminescent Imaging Reveals Novel Patterns of Colonization and Invasion in Systemic Escherichia coli K1 Experimental Infection in the Neonatal Rat. Infection and Immunity. 83 (12), 4528(2015).
- Singh, K., et al. Inter-alpha inhibitor protein administration improves survival from neonatal sepsis in mice. Pediatric Research. 68 (3), 242-247 (2010).
- Pluschke, G., Pelkonen, S. Host factors in the resistance of newborn mice to K1 Escherichia coli infection. Microb. Patho. , 93-102 (1988).
- Mancuso, G., et al. Role of interleukin 12 in experimental neonatal sepsis caused by group B streptococci. Infections and Immunity. 65 (9), 3731-3735 (1997).
- Thammavongsa, V., Rauch, S., Kim, H. K., Missiakas, D. M., Schneewind, O. Protein A-neutralizing monoclonal antibody protects neonatal mice against Staphylococcus aureus. Vaccine. 33 (4), 523-526 (2015).
- Andrade, E. B., et al. TLR2-induced IL-10 production impairs neutrophil recruitment to infected tissues during neonatal bacterial sepsis. Journal of Immunology. 191 (9), 4759-4768 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon