Method Article
X-Ray Kristalografi Thermotoga maritima M42 Aminopeptidaz TmPep1050 Oligomerik Devlet Geçiş Çalışma
Bu Makalede
Özet
Bu protokol, yapısal düzeyde bir M42 aminopeptidaz olan TmPep1050'nin dimer-dodecamer geçişini incelemek için geliştirilmiştir. Protein arınması ile X-ışını veri işlemeye kadar basit bir boru hattıdır. Crystallogenezis, veri seti indeksasyonu ve moleküler replasman çalışma bir olgu ile vurgulanmıştır, TmPep1050H60A H307A varyantı.
Özet
M42 aminopeptidazlar 12 alt birimden oluşan fonksiyonel olarak aktif kompleksler oluştururlar. Montaj süreci, dimer-dodecamer geçişini tetikleyen metal iyon kofaktörleri tarafından düzenleniyor gibi görünüyor. Metal iyon bağlama üzerine, aktif sitede ve etkileşim arabiriminde çeşitli yapısal değişiklikler meydana gelir ve dimerleri kendi kendini birleştirmeyi teşvik etmek için şekillendirir. Bu tür değişiklikleri gözlemlemek için, kararlı oligomerler yapısal çalışma dan önce izole edilmelidir. Burada bildirilen tmPep1050 kararlı dodecamers ve dimers arınma sağlayan bir yöntemdir, T. maritimabir M42 aminopeptidaz , ve X-ışını kristalografisi ile yapı tayini. Dimers bir şelat ajanı ile metal iyonları kaldırarak dodecamers hazırlanmıştır. Onların cofactor olmadan, dodecamers daha az kararlı oldu ve tamamen ısıtma üzerine ayrıştı. Oligomerik yapılar basit moleküler değiştirme yaklaşımı ile çözüldü. Metodolojiyi göstermek için, metal iyon bağlama da tamamen bozulmuş bir TmPep1050 varyantının yapısı, monomerler için dimerlerin daha fazla dökümünü göstermeden sunulmuştur.
Giriş
Oligomerizasyon birçok proteinin biyolojik fonksiyonlarını belirleyen baskın bir süreçtir. Escherichia coli'deproteinlerin sadece %35'inin monomerik1olduğu tahmin edilmektedir. Morfin adı verilen bazı proteinler, her oligomerik durumda farklı bir yapıya sahip alt birimlere sahip birkaç oligomerik durumu bile benimseyebilir2. Onların oligomerik durumları arasındaki geçiş genellikle her oligomerik devlet farklı bir özel aktivite veya fonksiyon olabilir gibi protein aktivitesini düzenlemek için bir ortalamadır. Çeşitli morfin örnekleri literatürde iyi belgelenmiştir, özellikle porfobilinojen synthase3, HPr kiazaz /fosfataz4, Lon proteaz5, laktat dehidrogenaz6, gliserindehit-3-fosfat dehidrogenaz7, piruvat kiaz8, sitrat synthase9, veribonu10. Son zamanlarda, m42 aminopeptidaz TmPep1050, olan aktivitesi oligomerik devletlere bağlıdır morfin benzeri davranış, enzim başka bir örnek açıklanan11. Oligomerik durumları arasındaki geçiş, alt birimlerin çeşitli yapısal değişikliklerine neden olan metalik kofaktörleri tarafından aracılık edilir.
M42 aminopeptidaz ailesi MH klan12aittir ,13, ve yaygın Bakteri ve Archaea arasında dağıtılır14. M42 aminopeptidazlar, peptidleri 35 amino asit kalıntısına kadar bozan gerçek dinükleer enzimlerdir15. Aktif alanları bir iç kaviteye doğru yönlendirilmiş 12 alt birimden oluşan, tetrahedron şeklinde tuhaf bir yapı benimserler. Böyle bir düzenleme genellikle kontrolsüz proteoziz önlemek için aktivitenin nano-bölümleme olarak tanımlanır. M42 aminopeptidazların fizyolojik fonksiyonu proteozom ile ilişkili olabilir, protein yıkımı sonucu peptidler hidrolize16,17. Pyrococcus horikoshii dört M42 aminopeptidaz, her farklı ama tamamlayıcı özellikleri18sunan sahip,19,20,21. Tekil olarak, alt birimlerin iki farklı türde yapılan heterokompleksler P. horikoshiitarif edilmiştir , peptidasome kompleksleri varlığını düşündüren22,23.
M42 aminopeptidazların çeşitli yapıları literatürde tanımlanmıştır11,16,18,19,20,24,25,26. Alt birim iki farklı etki alanı, bir katalitik etki alanı ve bir dimerization etki alanından oluşur. Katalitik etki alanı tüm MH klan korunmuş ortak bir α / β kat benimser, archetypal katalitik etki Vibrio proteolyticus aminopeptidaz Ap1 vibrio proteolyticus27olmak. Dimerization etki alanı bir PDZ benzeri kat16 benimser ve olabilir, oliomerizasyon rolüne ek olarak, substrat erişim kontrol ve iç boşluğunda bağlama bir rol11. Temel yapı taşı bir dimer olduğu için, dodecamer genellikle altı dimer ilişkisi olarak tanımlanır, her dimer tetrahedron16her kenarında konumlandırılmış olmak. M42 aminopeptidazlarının oliomerizasyonu metal kofaktörlerinin bulunabilirliğine dayanır. Divalent metal iyonları, genellikle Zn2 + ve Co2+,katalitik peptit bağlama ve hidroliz katılır. Onlar iki ayrı bağlama siteleri, yani M1 ve M2 siteleri bulunur. İki metal iyonları da sürücü ve ince PhTET2, PhTET3, PfTET3 ve TmPep105011,24,28,29için gösterildiği gibi oligomerizasyon ayarlayın. Metal kofaktörtü tükendiğinde, dodecamer PhTET2, PhTET3 ve TmPep105011,16,28,hatta monomerler gibi dimers içine demonte, PhTET2 ve PfTET324,29gibi .
Burada sunulan TmPep1050 oligomerlerin yapılarını incelemek için kullanılan bir protokoldür. Bu protokol protein saflaştırma, proteolitik aktivite taraması, kristalizasyon, X-ışını kırınımı ve moleküler replasman gibi ortak yöntemler kümesidir. Metalloenzimlerle başa çıkmanın getirdiği incelikler, protein oligomerizasyonu, protein kristalizasyonu ve moleküler replasman vurgulanır. TmPep1050 dodecamers daha monomerler içine ayrıştırmak ya da olmadığını göstermek için bir çalışma olgusu da sunulmaktadır. Bu soruyu gidermek için, bir TmPep1050 varyantı, TmPep1050H60A H307A, olan metal bağlama siteleri Ala kalıntılar His-60 (M2 site) ve His-307 (M1 site) mutasyona uğratarak bozulur çalışılmıştır. Bu protokol, morfin benzeri davranışlı diğer M42 aminopeptidazları veya metalloenzimleri incelemek için uygun olabilir.
Protokol
1. Rekombinant TmPep1050 üretimi ve arınması
NOT: Bundan sonra bir öncekiçalışma1adapte vahşi tip TmPep1050 klonlama prosedürü ve arınma açıklanmıştır. Alternatif olarak, klonlama sentetik bir gen kullanılarak yapılabilir. TmPep1050 varyantları oluşturmak için, site yönelimli mutagenez aşağıdaki yapılabilir, örneğin, paralel protokol tek astar reaksiyonları (SPRINP) yöntemi30. Arınma protokolü TmPep1050 türevleri için kullanılabilir. Metal iyon bağlamaile engel olduğu için O-tag kullanımından kaçınılmalıdır.
- İfade vektör tasarımı
- Thermotoga maritima MSB8 (ATCC 43589) veya TmCD00089984 (Yapısal Genomik Ortak Merkezi) genomik DNA'sını edinin.
- Genomik DNA veya şablon plazmid kullanarak TM_1050 açık okuma çerçevesi (ORF) yükseltmek, yüksek sadakatli DNA polimeraz ve aşağıdaki astarlar: ocej419 (5'- TTTAACTTTAAGAAGGAGATATACATACCCATGAAGGAACTATATCAGAAAGCTG) ve ocej420 (5'- ATCCGCCAAAAAAAACACCAAGCTGGAGACCGTTTACCcAGATATTGATGAG). Polimeraz zincir reaksiyonu (PCR) taramasını aşağıdaki şemaya göre çalıştırın: 95 °C'de 5 dk, 3 adımda 30 devir (95 °C'de 30 s, 55 °C'de 30 s, 72 °C'de 90 s ve son adım olarak 72 °C'de 10 dk.
- PcR parçasını, SLiceprotokolü31'egöre E. coli'de homolog rekombinasyon (Şekil 1)ile uygun bir ifade vektörü(Malzeme Tablosu)klonlamak. Doğrusallaştırılmış vektörün 50 ng'sine, 10 μL'lik parçanın vektöre 10:1 molar oranına, 1 μL PPY gerinim ekstresine, 50 mM Tris-HCl pH 7,5, 100 mM MgCl2,10 mM DITHIOthreitol (DTT) 10 μL'lik bir hacim için 10 μL'lik bir hacim ekleyin.
- 1 μL rekombinasyon reaksiyonu ile kimyasal olarak yetkin E. coli XL1 mavi suşu (veya herhangi bir recA- uygun suş) dönüştürün. Hücreleri 100 μg/mL ampisilin içeren LB ortamına plakalayın. Plakaları bir gecede 37 °C'de kuluçkaya yatırın.
- 100 μg/mL ampisilin ile taze LB plakaları üzerinde koloniler seçin. Plakaları en az 8 saat boyunca 37 °C'de kuluçkaya yatırın.
- Uygun astar çifti (5'- ATGCCATAGCATTTTATCC ve 5'- ATTTAATCTGTATCAGGC eğer Malzeme Tablosu'ndalistelenen önerilen vektör ü kullanılarak koloni PCR tarafından pozitif adaylar için ekran ). Mikro uç ile, seçilmiş bir koloniyi çizin ve hücreleri her astarDan 0,5 μM ve ticari bir Taq DNA polimeraz karışımının 10 μL'lik reaksiyon karışımına aktarın.
- PCR taramasını aşağıdaki şemaya göre çalıştırın: denatürasyon adımı olarak 95 °C'de 5 dk, 3 adımda 30 s (95 °C'de 30 s, 55 °C'de 30 s, 72 °C'de 90 s) ve son adım olarak 72 °C'de 10 dk.
NOT: PCR reaksiyonları bir gecede 12 °C'de PCR makinesinde saklanabilir. - Tris-asetat-EDTA (TAE) tamponunda hazırlanan %0,8 agarose jelinüzerine her PCR reaksiyonunun 10 μL'sini yükleyin. Elektroforezi 100 V'de 25 dakika çalıştırın.
NOT: 1.1 kbp amplicon beklenmektedir. - Ticari bir kit(Malzeme Tablosu)kullanarak adaylardan plazmidleri ayıklayın ve adım 1.1.6'da kullanılan aynı astar çiftini kullanarak sıralayın.
- Hücre kültürü
NOT: Uygun bir aday sıralama ile belirlendiğinde, klon önerilen vektör(Malzeme Tablosu)kullanılıyorsa doğrudan ifade olarak kullanılabilir. Bu durumda, ifade arabinose-indükleyici PBAD organizatörü tarafından kontrol edilir32.- 100 μg/mL ampisilin içeren 10 mL LB ortasını adayla aşıla ve prekültür'ü bir gecede 37 °C'de orbital sallayarak kuluçkaya yatırın. 100 μg/mL ampisilin ile 1 L LB ortamına 5 mL prekültür ekleyin. Bir havaile sıvı oranı3'e saygı gösterin.
- Hücrelerin orbital sallayarak altında 37 °C'de büyümesine izin verin. Optik yoğunluğu 660 nm (OD660)seviyesinde izleyin.
- OD660 0,5−0,6'ya ulaştığında, kültürü 5 dakika buzüzerinde hızla soğutun ve 18 °C'ye ayarlanmış bir kuluçka makinesine aktarın.
- Gen ekspresyonunu indüklemek için 0,2 g/L arabinose ekleyin ve 18 °C'de 12−18 saat kuluçkaya yatırın.
- 4 °C'de 30 dk için 6.000 x g'de kültürü santrifüj ederek hasat hücreleri. 100 mL%0,9 (w/v) NaCl ile süpernatant ve yıkama hücrelerini atın.
- 4 °C'de 15 dakika boyunca 6.000 x g'de tekrar santrifüj edin ve süpernatantı atın.
NOT: Hücre peletleri doğrudan protein ekstraksiyonu için kullanılabilir veya -80 °C'de depolanabilir.
- Protein arınması
- Hücre peletlerinin 40 mL'lik 50 mM MOPS, 1 mM CoCl2, pH 7.2'de yeniden askıya alınması. 1 μL 25 U/μL DNA/RNA ensonükleaz ve EDTA içermeyen bir tablet proteaz inhibitörü kokteyli ekleyin. 30 dakika boyunca soğutma altında darbe modunda süspansiyon sonicate.
- Ham ekstresi 20.000 x g'de 30 dk 4 °C'de santrifüj edin. Supernatant toplayın ve 10 dakika boyunca 70 °C'de bir su banyosunda ısıtın.
- Denatüre hücre ekstresini 4 °C'de 30 dakika boyunca 20.000 x g'de santrifüj edin ve arınma için süpernatanttoplayın.
- ~15 mL hacimli bir sütunda paketlenmiş uygun aniyon değişimi reçinesini(Malzeme Tablosu)kullanın. Çalışma akışı hızı ve kolon basınç sınırı için üreticinin önerilerine bakın. Rekarnı 50 mM MOPS, 1 mM CoCl2, pH 7.2 ile dengeleyin.
- Adım 1.3.3'ten toplanan supernatant'ı sütuna yükleyin. Eluate absorbansını 280 nm'de izleyin. Taban çizgisine ulaştığında, elution'a doğru ilerleyin.
- 50 mM MOPS'de 0 ila 0,5 M NaCl, 5 sütun hacmi (CV) için 1 mM CoCl2, pH 7,2 degrade uygulayın. İletkenlik stabilize olana ve absorbans taban çizgisine ulaşana kadar bekleyin.
- 50 mM MOPS'da 0,5 ila 1 M NaCl, 1 mM CoCl2, pH 7,2 1 CV için son degrade uygulayın.
- Sodyum dodecyl sülfat poliakrilamid jel elektroforez (SDS-PAGE) tarafından bazı fraksiyonları analiz edin (rehberlik için Şekil 2A'ya bakınız).
NOT: TmPep1050, Coomassie boyama dan sonra 36 kDa bandı olarak görünür. Alternatif olarak, TmPep1050 varlığı aktivite tsay ile teyit edilebilir (bölüm 2.1 bakınız). Bu adımda kesirler bir gecede 4 °C'de depolanabilir. - Havuz TmPep1050 içeren kesirler ve ince zemin tozu ekleyin (NH4)2SO4 konsantrasyonu elde etmek için 1.5 M (NH4)2SO4. Tüpü ters çevirerek, tamamen çözünene kadar hafifçe karıştırın.
- ~30 mL hacimli bir sütunda paketlenmiş hidrofobik etkileşim reçinesi(Malzeme Tablosu)kullanın. Çalışma akışı hızı ve kolon basınç sınırı için üreticinin önerilerine bakın. Rekarni 50 mM MOPS, 1,5 M (NH4)2SO4,1 mM CoCl2, pH 7,2 ile dengeleyin.
- Numuneyi kolona yükleyin ve elüt'ün emnesini 280 nm'de izleyin. Absorbans taban çizgisine ulaştığında, 1,5 M'den 0 M 'ye (NH4)2SO4 50 mM MOPS, 1 mM CoCl2, pH 7.2 5 CV için bir degrade uygulayarak bağlı proteinler.
- SDS-PAGE tarafından bazı kesirleri analiz edin (kılavuz için Şekil 2B'ye bakın).
NOT: TmPep1050, Coomassie boyama dan sonra 36 kDa bandı olarak görünür. Alternatif olarak, TmPep1050 varlığı aktivite tsay ile teyit edilebilir (bölüm 2.1 bakınız). Bu adımda kesirler bir gecede 4 °C'de depolanabilir. - TmPep1050 içeren kesirleri havuzve 30 kDa kesme(Malzeme Tablosu)ile ultrafiltrasyon üniteleri kullanarak 2 mL konsantre. Moleküler ağırlığı belirlemek için bölüm 1.4'e gidin.
- Boyut dışlama kromatografisi
- ~120 mL hacimli bir sütunda paketlenmiş boyut dışlama reçinesini(Malzeme Tablosu)kullanın. Çalışma akışı hızı ve kolon basınç sınırı için üreticinin önerilerine bakın. Rekarni 50 mM MOPS, 0,5 M (NH4)2SO4,1 mM CoCl2, pH 7,2 ile dengeleyin.
- Numuneyi kolona yükleyin ve elüt'ün emnesini 280 nm'de izleyin. Sütun ölü hacminden (~0,33 CV) elüsyon sonuna kadar kesirli (1 CV).
- Gözlenen her tepe için elüsyon hacmini ölçün.
NOT: Rehberlik için, dodecameric TmPep1050 elutes ~ 82 mL(Şekil 3A) mevcut deneysel koşullar altında, dimeric TmPep1050, TmPep1050H60A H307A varyant gibi, ~ 95 mL de elutes (Şekil 3B). Bazı TmPep1050, TmPep1050H60A (Şekil 3C)gibi her iki oligomerik formu da benimseyebilir. - SDS-PAGE kullanarak gözlenen zirvelerin maksimasına ve kuyruklarına karşılık gelen kesirleri analiz edin.
NOT: TmPep1050, Coomassie boyama dan sonra 36 kDa bandı olarak görünür. - ~ 300 μM konsantrasyonu elde etmek için 30 kDa kesme(Malzeme Tablosu)ile ultrafiltrasyon üniteleri kullanarak her tepenin kesirlerini havuzve konsantre.
- Bir nano hacim spektrofotometre de 280 nm emicilik ölçün ve 18.910 M-1 cm-1moleküler yok olma katsayısı kullanarak konsantrasyonhesaplamak.
- Saflaştırılmış proteini -18 °C'de saklayın.
- Moleküler ağırlığı belirlemek için, moleküler ağırlık standartlarını(Tablo Malzemeler)kullanarak boyut dışlama kromatografisi (SEC) sütunu kalibre edin. Çalışan tampon olarak 50 mM MOPS, 0,5 M (NH4)2SO4, 1 mM CoCl2 pH 7,2 kullanarak standartları analiz edin.
2. Aktivite teşpleri ve apo-enzim hazırlığı
NOT: Başlangıçta, apo-enzim 2.1 M malik asit pH 10 hacimli TmPep1050 1 hacmi seyreltilmesi ve diyaliz11önce 1 hacmine geri konsantre tarafından hazırlanmıştır. Aşağıda 1,10-phenanthroline, bir metal iyon şelatörü kullanarak alternatif bir prosedür sunulmaktadır. Bu işlem protein kaybını azaltır ve daha önce yayınlanan yönteme göre aynı sonuçları verir.
- Faaliyet tsası
- Metanolde 100 mM L-L-Leucine-p-nitroanilide(Malzeme Tablosu)bir stok çözeltisi hazırlayın.
- 50 mM MOPS 965 μL, 250 μM CoCl2, pH 7.2, 10% metanol 100 mM L-L-l- nitroanilide 25 μL ekleyin. Reaksiyon karışımını 75 °C'de kuru bir banyoda preincubate edin.
- Enzimi 50 mM MOPS pH 7.2'deki 1 μM konsantrasyona seyreltin. Reaksiyon karışımına, girdap ve 75 °C'de sarımsı olana veya 1 saat boyunca kuluçkaya yatırın.
- % 20 asetik asit 1 mL ekleyerek reaksiyonu durdurun. Girdap iyi ve oda sıcaklığına soğumasını bekleyin.
- Reaksiyon karışımını spektrofotometre hücresinde aktarın. Negatif kontrole karşı 410 nm'de emiciliği okuyun (enzim olmadan inkübe reaksiyon karışımı).
- Apo-enzim preparatı
- Etanol1 M 1,10-fenanthroline bir stok çözeltisi hazırlayın. 50 mM MOPS, 0,5 M (NH4)2SO4, pH 7,2 890 μL'ye 1,10-fenanthroline stok çözeltisi 10 μL ekleyin. 100 μL saftın TmPep1050 (300 μM−1 mM konsantrasyon) ekleyin.
- Reaksiyon karışımına CoCl2 eklemeden bölüm 2.1'de açıklanan etkinlik hatasını kullanarak etkinlik kaybını kontrol edin.
- Örneği diyaliz tüpüne aktarın. 50 mM MOPS 200 mL, 0,5 M (NH4)2SO4, pH 7,2 4 °C'de diyaliz. 48 saat diyaliz sırasında taze tampon ile üç kez dialysate değiştirin.
- 30 kDa kesme(Malzeme Tablosu)ile ultrafiltrasyon üniteleri kullanarak diyaliz tüpünden numuneyi toplayın ve 100 μL'ye geri konsantre olun. Bir nano hacim spektrofotometre kullanarak 280 nm de emici okuyarak konsantrasyonu kontrol edin.
- Dimer hazırlık
- Apo enzimini 50 mM MOPS, 0,5 M (NH4)2SO4,pH 7,2'de 1 μM konsantrasyona seyreltin. Kuru bir banyoda 75 °C'de 2 saat kuluçkaya yatırın, ardından numunenin oda sıcaklığına kadar soğumasını bekleyin.
- Numuneyi en az 50 μM'lik bir enzim konsantrasyonuna yoğunlaştırın. Elüsyon zirvesi ~82 mL'den ~95 mL'ye (mevcut deneysel koşullar altında) kaymalıdır.
3. TmPep1050 kristalizasyon
NOT: Çok faktörlü bir olgu olduğu için protein kristalizasyonu ampirik bir bilim olarak kalır33. Bazı parametreler tanımlanıp kontrol edilebilirken (sıcaklık, pH, çökeltme maddesi konsantrasyonu gibi), diğerleri kristalizasyonu (protein ve kimyasal saflık, proteoliz, numune öyküsü gibi) etkileyebilir. Günümüzde protein kristalizasyonu, bir grup ticari kristalizasyon tarama koşulları ve otomasyonu sayesinde rasyonel ve sistematik bir şekilde ele alilmektedir. Ancak, bir kristalizasyon koşulunun optimizasyonu çoğunlukla deneme yanılma yaklaşımına dayanır. Bundan sonra proteinlerin kristalize için bir plan ve kristalizasyon koşulları optimize etmek için çeşitli ipuçları açıklanmıştır.
- Kristalizasyon taraması
NOT: Ticari kristalizasyon kitleri kullanılarak, 2,2 M DL-malik asit pH 7.0, 0.1 M Bis-Tris propan pH 7.0 ve 0.18 M tri-amonyum sitrat, %20 polietilen glikol (PEG) 3350'de dodecameric TmPep1050 kristalleri elde edilmiştir. Dimerik TmPep1050 kristalleri 0.1 M sodyum sitrat pH 5.6, 0.2 M amonyum asetat, %30 PEG4000 elde edilmiştir. Dodecamers kristalleri bir hafta içinde görünür ve bir ay içinde tam boyutuna ulaşır. Dimers kristalleri genellikle içinde görünür 24 saat ve bir hafta içinde tam boyuta büyür.- Birkaç ticari kristalizasyon kitleri edinin (örnekler için Malzeme Tablosu'na bakın).
- Asılı bırakma yöntemi için kristalizasyon plakaları(Malzeme Tablosu)ayarlayın. Kuyuları kristalizasyon tarama kitinin her çözeltisinin 500 μL'si ile doldurun.
- Her kuyu için bir kristalizasyon desteği ayarlayın. Destek üzerine, saflaştırılmış protein (genellikle ~ 10 mg /mL) 1 μL damla mevduat.
- Hemen boru 1 μL kristalizasyon çözeltisi kuyudan. Protein damla dikkatlice ekleyin ve baş aşağı üç kez pipetleme tarafından yavaşça karıştırın. Damla herhangi bir kabarcıklar olmadan semispherical kalmalıdır.
- Desteği ilgili kuyunun üzerine vidala. Tüm kit için işlemi tekrarlayın.
- Plakaları kurduktan sonra, bir dürbün ile her damla gözlemleyin. Yorumlama için kristalizasyon kiti kullanım kılavuzuna bakın (açık bırakma, faz ayırma, çökelti, iğneler, vb.).
- Plakaları 20 °C'de kuluçkaya yatırın. Plakaları ilk hafta boyunca günde bir kez ve daha sonra haftada bir kez kontrol edin.
- Skor her iyi skor sayfası ve kristalizasyon kitleri ile sağlanan kullanım kılavuzu nu kullanarak.
- Kristalizasyon optimizasyonu
NOT: Dodecameric TmPep1050'nin ilk kristalizasyon koşulları 2,1 M DL-malik asit pH 6.75 ve 0.18 M tri-amonyum sitrat pH 7.5 olarak optimize edilmiştir, Dimerik TmPep1050'nin kristalizasyon durumu 0,1 M sodyum sitrat pH 6.0, %10 (w/v) PEG3350'ye kaydırılırken %40 (w/v) PEG3350. Tohumlama bir döngü kristallik geliştirmek için gerekli olmuştur. Bundan sonra TmPep1050H60A H307A varyantının kristalizasyonunun nasıl optimize edildiği açıklanmıştır.- Farklı pH (4,5, 5,2 ve 6,0) ve %50 (w/v) PEG3350 çözeltisi ile 0,5 M sodyum sitrat tamponu stok çözeltilerini hazırlayın.
- PH vs yağış ajan matrisi olarak bir kristalizasyon plakası ayarlayın (Bkz. Şekil 4A).
- Plakayı 20 °C'de kuluçkaya yatırın. Bir hafta boyunca günde bir kez dürbün ile her iyi gözlemleyin.
- Kristal büyüklüğü ve şekline göre her iyi puan. En az 50 μm kristalveren bir koşul seçin. Mikro tohumlama devam edin.
- Mikro tohumlama
NOT: Mikrotohumlama, protein kristallerinin şeklini, boyutunu ve kristalliğini geliştirmek için güçlü bir yöntemdir34. Daha hızlı bir tohumlama yaklaşımı bir kedi bıyık kullanarak seri tohumlama olduğunu. Şekil 4'e göre kristalizasyon optimizasyonu ve mikrotohumlama TmPep1050H60A H307Aiçin kristal şekil ve boyutunu nasıl iyileştirmiştir.- Adım 3.2.4 seçilen iyi kullanarak tohumları hazırlayın.
- Kuyudan kristalizasyon çözeltisi ekleyerek kristaliçeren bir damlanın hacmini 10°L'ye yükseltin. Damlayı borulayın ve kuyudan 90 μL kristalizasyon çözeltisi ekleyin. Girdap iyice ve buz üzerinde tohum tutun.
- Tohumların birkaç seyreltme hazırlayın: 1x, 10x, 25x, ve 100x. Girdap iyi borulama önce tohumları. Seyreltmeleri buzda tut.
- Her tohum seyreltmesi için, pH vs yağış ajan bir matris olarak bir kristalizasyon plakası kurmak (Şekil 4Bbakınız). Adım 3.2.1'de hazırlanan stok çözümlerini kullanın.
- Damlayı düşürürken, 2 μL'lik bir damla için 0,2 μL tohum ekleyin. Plakayı 20 °C'de kuluçkaya yatırın. Bir hafta boyunca günde bir kez dürbün ile her iyi gözlemleyin.
NOT: Kristal boyutu dağılımı ve şekli geliştirilmelidir, Bkz. Şekil 4C, TmPep1050H60A H307A'yaörnek olarak. Daha fazla kullanım için tohumlar -20 °C'de saklanabilir.
4. X-ışını kırınımı
- Kristal toplama
NOT: Numune hazırlama x-ışını kaynak tesisine (ev tesisi vs. senkrotron) bağlıdır. Buna göre depolama aygıtları (şişeler ve şişe tutucu sepet) kullanın. Kriyoprotektif eklenmesi (gliserol gibi) tuz / yağış ajan konsantrasyonuna bağlı olarak gerekli olabilir. TmPep1050 kristalleri için PEG veya tampon konsantrasyonu su kristallerinden kaçınmak için yeterince yüksek olduğundan kriyoprotektif gerekli değildir.- Sıvı nitrojen dolu bir banyo hazırlayın, numune işleme için kullanılan herhangi bir şişe veya sepet dalma.
- Farklı boyutlarda numune toplama döngüleri ayarlayın: 100, 150 ve 200 μm(Malzeme Tablosu). Kristal boyutuna göre boyutları seçin.
- Dürbün kullanarak, kristaller ve nokta izole kristaller (almak için en kolay) içeren damla kontrol edin. Bir döngü ile, yavaşça alttan bir kristal seçin. Hemen sıvı nitrojen döngü dalma ve uygun bir şişe içinde döngü yerleştirin.
- Veri toplama
NOT: Veri toplama x-ışını kaynağına (ev tesisi vs senkrotron) ve dedektör hassasiyetine bağlı olarak büyük ölçüde değişebilir. Toplama stratejisi, çözünürlüğe, nokta yoğunluğuna, uzay grubuna vb. bağlı olarak bir örnekten diğerine büyük farklılıklar gösterebilir. Konu dauter35tarafından kapsamlı bir şekilde gözden geçirilmiştir.- Difraktometrenin goniometre başına kristaltaşıyan döngümonte.
- Kristali X-ışını yolu ile hizalamak için XYZ eksenleri boyunca goniometer kafasını ayarlayın.
- Dalga boyunu 0,98 Å'a ayarlayın ve dedektörü hareket ettirin ve 2 şçözünürlük elde edin.
- En az iki farklı kristal yönde niçin görüntü edinerek kısa bir veri toplama başlatın. 0° ve 90°'de 10 görüntü (0,1°) alın.
- Toplanan görüntüleri uygun yazılımla (örneğin, ADXV, XDS-Viewer veya Albula Viewer) kontrol edin. Nokta yoğunluğunu ve noktaların görüldüğü en yüksek çözünürlüğü belirleyin. Monokristalliği ve nokta ayrımını da kontrol edin.
- Sonuç olarak, dedektör konumunu daha yüksek veya daha düşük çözünürlükte ve gözleme uygun olarak pozlama süresini değiştirerek 4.2.3−4.2.5 adımlarını tekrarlayın.
- 0,1° başına 1 görüntü çekilen veri toplamayı 360° civarında başlatın. Dedektör konumunu ve pozlama süresini en iyi şekilde ayarlamayı unutmayın.
5. İndekslenme, moleküler değiştirme ve model oluşturma
- Indeksleme
NOT: İndeksasyon, kırınım noktalarının yoğunluğunu ölçmek için kullanılan bir yöntemdir ve yapı faktörlerinin genliklerini verir36. Dört yazılım paketleri genellikle toplanan görüntüleri işlemek için kullanılır: Mosflm37, HKL200038, DIALS39, ve XDS40. İkincisi TmPep1050 kristal kırınım elde edilen veri kümeleri dizin için kullanılmıştır.- XDS paketi ve XDSME41yükleyin. HDF5 dosyalarını işliyorsanız, XDS Neggia eklentisi yükleyin (Dectris web sitesinde mevcuttur). Daha fazla bilgi için, https://github.com/legrandp/xdsme XDS wiki web sayfası https://strucbio.biologie.uni-konstanz.de/xdswiki/index.php/Main_Page ve XDSME web sayfasını ziyaret edin.
- Verileri işlemeden önce, XDS'nin çalıştırılan bir klasör oluşturun. Görüntülere giden yolu bulun.
- XDSME çalıştırmak için terminal penceresinde xdsme /path_to_images/image.extension yazın.
- XDS işi bitirdikten sonra DOĞRU'yu kontrol edin. LP dosyası. Uzay grubu belirleme olasılığına, veri bütünlüğüne, en yüksek çözünürlüğe, kristal mozaiğine ve veri kalitesine dikkat edin. Uzay gruplarının olasılığını elde etmek için XDS_pointless.log de kontrol edin.
NOT: Çıktı örneği olarak Şekil 5'e bakınız. - XDS'nin önerdiği farklı uzay grubu çözümleriyle XDSME'yi önceki işlemin üzerine yazmayı önlemek için ayrı bir klasörde yeniden çalıştırın. Xdsme -s space_group_name -c "unit_cell_parameters" /path_to_images/image.extension (örneğin, xdsme -s P21 -c "43.295 137.812 61.118 90.000 110.716 90.000).
- DOĞRU'yu kontrol edin. LP dosyaları ve veri istatistiklerine dayalı en iyi çözümü seçin.
- xscale'i xscale.py XDS_ASCII yazarak çalıştırın. HKL. XSCALE xdsconv.py yazarak XDSCONV çalıştırın. HKL ccp4.
NOT: Bazı durumlarda, XDSME uzay grubunu tanımlayamaz veya çözünürlük aralığını düzgün bir şekilde kesemezse veya garip veri istatistikleri oluşturur. Böyle bir sorunla karşılaşılırsa, XDS'yi yerel olarak çalıştırmaya değer. XDS'de çeşitli parametreler tanıtılmalıdır. INP başlatma dosyası (bkz. XDS wiki sayfası). XDS kullanırken, olası alan gruplarının olasılığı, CCP4 paketinin42'ninbir parçası olan Pointless kullanılarak kontrol edilebilir. Veri seti çözünürlüğünü kesmek için, Rmeas < 60% ve I/ σ ~ 2 yaygın olarak en yüksek çözünürlük43belirlemek için kabul edilir. Ancak moleküler replasman ve model iyileştirme, çözünürlüğü I/σ ~0,5−1,5 ve CC1/2'den 0,2−0,444'ekadar uzatarak geliştirilebilir.
- Moleküler değiştirme
NOT: Deneysel veriler yapısal faktörlerin genliğine erişim sağlamakla birlikte, fazı bilmeden işe yaramazlar. Faz deneysel olarak anormal bir sinyale (örneğin ağır bir atomdan) dayanan farklı yöntemlerle belirlenebilir45. Moleküler replasman anormal bir saçılma atomu46,47olmadan faz belirlemek için başka bir yöntemdir. Bu yöntem, fazı yinelemeli olarak bulmak ve iyileştirmek için ilgili molekülün koordinatlarını kullanır. Moleküler replasman için Phenix GUI49'da Phaser48 kullanıyoruz.- 4P6Y koordinatlarını kullanarak moleküler değiştirme için başlangıç modelini hazırlayın. PDB dosyasından, Phenix PDB dosya düzenleyicisi kullanarak alanin içinde monomer A ayıklayın ve aminoasitleri doruncate (Model araçları sekmesi altında).
- Xtriage'ı Phenix'te (Veri analizi sekmesi altında) XDSCONV (5.1.9) tarafından oluşturulan yansıma dosyası ve giriş olarak sırayla çalıştırın.
- Xtriage'daki günlük dosyasını kontrol et. Asimetrik birimdeki alt birimlerin sayısı, anizotropi, buz halkalarının varlığı ve eşleştirme oluşumuna dikkat edin.
- Yansıma dosyasını, sırasını ve ilk 4P6Y modelini kullanarak moleküler değiştirme için Phenix'te (Moleküler değiştirme sekmesi altında) Fazr-MR çalıştırın ve poli alanin (adım 5.2.1) kesilmiş tir.
- Tamamlandıktan sonra, bir model bulundu ve moleküler değiştirme puanı kontrol edin. En az 8 olan bir çeviri faktörü Z-skoru (TFZ), çözümün kesin olarak doğru olduğunu gösterir.
- Model oluşturma
NOT: Moleküler replasman ile faz belirlendikten sonra, model inşa edilmeli ve rafine edilmelidir. Bu protokol otomatik bina ve yinelemeli iyileştirmeler için Phenix GUI49 ve manuel yapı oluşturma ve arıtma için Coot50 kullanır.- Phenix'te Phase-MR kullanarak moleküler değiştirmeden sonra, Autobuild'i çalıştır'ıseçin. Gerekli tüm dosyalar otomatik olarak eklenecektir. Autobuild'i başlatmak için Çalıştır'a basmanız yeterlidir.
- Tamamlandıktan sonra, Coot modeli kontrol edin. Coot'taki elektron yoğunluğu haritasına göre modeli elle oluşturun ve geliştirin.
- Modeli, sırayı ve kırınım verilerini girdi olarak kullanarak Phenix'te (Ayrıntılandırma sekmesinde) el ile seçilmiş modeli hassaslaştırın. Phenix doğru strateji seçmek için yardım bakın.
- Arıtmadan sonra, sonuçları kontrol edin: Rfree ve Rçalışması azalmalı, Molprobity51 göstergelerini saymalı ve düşük gerçek alan korelasyonuna sahip aykırılar sınırlandırılmalıdır.
- En iyi rafine model oluşturulana kadar adımları 5.3.2−5.3.4'ün tekrarlayın.
- Molprobity'i sunucuda çalıştırın: http://molprobity.biochem.duke.edu/. Molprobity tarafından tanımlanan herhangi bir outliers göz atın.
- En iyi rafine model elde edilene kadar 5.3.2−5.3.6 adımlarını tekrarlayın.
Sonuçlar
TmPep1050 monomerler içine olası bir dodecamer dissociation çalışma için, His-60 ve His-307 kodonlar sentetik bir gen kullanılarak alanin kodon ile değiştirildi. Bu gen daha sonra ifade ve daha sonra TmPep1050H60A H307Aadlı ilgili TmPep1050 varyantı saflaştırma için pBAD vektörklonlandı. Boyut dışlama kromatografisi(Şekil 3B)saflaştırılmış proteinin 56 kDa (monomerin molekül ağırlığı 36.0 kDa) belirgin bir molekül ağırlığına sahip olduğunu göstermiştir. Benzer bir görünür molekül ağırlığı, 52 kDa, TmPep1050 dimer11için bildirilmiştir. Bu nedenle, TmPep1050H60A H307A oligomerik devlet dimeric olarak çıkarılabilir. TmPep1050H60A H307A, spesifik aktivitesi ile ilgili olarak kobalt iyonlarının varlığında bile L-Leu-p NA'da substrat olarak tamamen inaktifti. Bu sonuç, varyantların herhangi bir metal iyonlarını bağlayamayacağını kuvvetle göstermektedir.
TmPep1050H60A H307A'nın kristalizasyon durumu, dimer 'in (yani 0,1 M sodyum sitrat pH 6.0%10 PEG3350) etrafında pH ve PEG konsantrasyonu(Şekil 4)değişen şekilde optimize edilmiştir. TmPep1050H60A H307A'nın en iyi kristalleri 0,1 M sodyum sitrat pH %5.2 20 PEG3350'de elde edildi ve monokristalliği artırmak için bir döngü mikrotohumlama ile. Proxima 2 beamline (SOLEIL synchrotron) 2.36 ş(Tablo 1)çözünürlükte tam bir veri seti toplandı. Veri indekslemesi, TmPep1050H60A H307A kristalinin uzay grubunun C2221 olduğunu, ancak XDS'nin başka bir çözüm önerdiğinigösterdi, m P uzay grubu (bkz. Şekil 5). Pointless'a göre C2221 ve P21 uzay gruplarının olma olasılığı sırasıyla 0.711 ve 0.149 idi. Veri kalitesi analizine göre asimetrik birimde iki monomer bulunur. Xtriage tarafından yapılan analiz, veri kümesinin muhtemelen ikiz olduğunu, ancak C2221 uzay grubunda eşleştirmenin52olası olmadığını ortaya koymuştur. Birkaç kesin etki alanının birbirine paralel olarak kafes yönlerinden bazılarına sahip olduğu kristal büyüme anomalisi ile eşleştirme sonuçları53. Eşleştirme, hatalı bir veri dizini gösteren daha yüksek bir kristal simetriden de kaynaklanabilir. Bu nedenle, bir psödo-merohedral ikiz bir P21 kristal kafes bir C2221gibi görünüyor böylece var olabilir. Veri seti daha sonra p21 uzay grubunda indekslendi ve moleküler değiştirme test edildi. P21'de indekslenen veri setinin xtriage analizi, h, -k, -h-l.
Ddecameric TmPep1050 (PDB kodu 4P6Y) bir monomer koordinatları kullanılarak, sadece P21'de endeksli veri kümesi için 28,9 TFZ puanı ile moleküler değiştirme çözümü bulundu. Bu nedenle, kırınım verileri model oluşturma için ikiz veri kümesi olarak kabul edildi. Moleküler değiştirme önyargısını en aza indirmek için phenix.autobuild54,55kullanılarak ilk model üretildi. TmPep1050H60A H307A'nın yapısı Phenix ve Coot'ta(Tablo 1 ve Şekil 6A)birkaç döngü otomatik ve manuel arıtmadan sonra tamamlanmıştır. Yapı, PDBe Pisa56tarafından hesaplanan 1.710 ş2 arayüz yüzeyi ile hem monomerler hem de ΔiG -16.2 kcal mol-1 arasında bir arayüz yüzeyi ile oligomerik durumu doğruladı. Buna karşılık, dimeric TmPep10502-mer arayüzyüzeyive Δ i G 1.673 ş2 ve -16.7 kcal mol-1,sırasıyla.
TmPep1050H60A H307A yapısı, hizalama üzerine 0.774 şRMS ile yabani tip dimer yapısına oldukça benzer. Daha da önemlisi, her iki yapıda da aynı yapısal değişiklikler gözlenmektedir: α8 ve α10 heliklerin yüksek esnekliği, düzensiz aktif bölge Gln-196-Val-202 ve Lys-229-Ala-235 ve Lys-247-Ser 254'ün yer değiştirmesi. Bu değişiklikler daha önce metal kofaktör11yokluğunda dodecamer oluşumunun engeli ile korelasyon edildi. Ancak His-60 ve His-307'nin iki mutasyonu Asp-168 ve Asp-62'nin yan zincirleri üzerinde hafif bir etki yarattı. Yabani tip dimer'den farklı bir konformasyona kilitlenmiş gibi göründüler (Şekil 6B). Asp-168 karboksilit, His-60 ve His-307'nin yokluğundan dolayı 40° döndürülür. Bu nedenle her iki histidin artıkları iki metal iyonları köprü için doğru Asp-168 karbokside konumlandırma için önemlidir. Asp-62 yan zinciri katalitik alanın dışında Glu-18 karboksiata doğru yönlendirilir. Asp-62, His-60'ın pKa'sını modüle etmek ve böylece M2 bölgesinde metal iyon bağlamayı etkilediği varsayıldığı için katalizde önemli bir role sahip olabilir. Buna ek olarak, yapısal olarak metal iyon bağlama üzerine katalitik alanın stabilizasyonu nda, dodecamer oluşumu lehine karıştığı olabilir.

Şekil 1: TM_1050 ORF klonlamanın homolog rekombinasyon ile pBAD vektörüne dönüştürülmesi.
ORF organizatör BAD sonuna ve sıra yukarı PmeI kısıtlama sitesine iki 30 bp dizileri homolog ile çevrilidir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
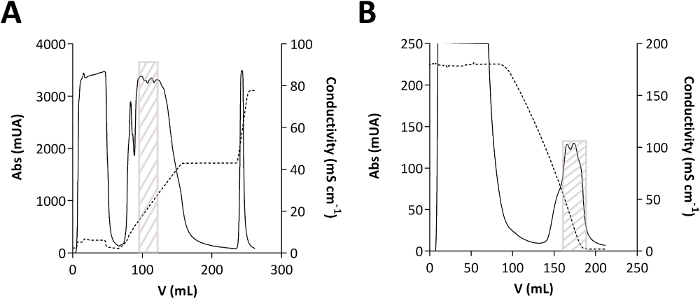
Şekil 2: TmPep1050 arınma kromatatisi.
(A) Aniyon değişimi kromatografisi. (B) Hidrofobik etkileşim kromatografisi. Emicilik (Abs), emici milibirimler ifade (mUA), düz çizgi gösterilir. mS cm-1'deifade edilen iletkenlik kesikli çizgide gösterilir. Gri kutu, TmPep1050'nin kromatogramlarda nereye yedirdiği gösterilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Boyut dışlama kromatografisi (A) TmPep1050 dodecamer, (B) TmPep1050H60A H307A, ve (C) TmPep1050H60A.
Numuneler 120 mL'lik bir kolonda paketlenmiş SEC reçinesi kullanılarak analiz edildi. Absorbans (Abs) emici milibirimler cinsinden ifade edilir (mUA). (D) Standart olarak thyroglobulin (T), ferritin (F), aldolase (Ald), conalbumin (C) ve albumin (Alb) kullanılarak SEC sütununun kalibrasyonu. Bağıl kütlenin logaritması ile elüsyon hacmi arasındaki korelasyon doğrusalolup R2 ve 0,91'dir. %95 güven aralıkları nokta olarak temsil edilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: TmPep1050H60A H307A kristalizasyon optimizasyonu.
(A) İlk optimizasyon stratejisi değişen pH (4.5 ve 6.0 arasında) ve PEG3350 konsantrasyonu (%5 ile %25 arasında) oluşur. Kristalizasyon plakası şematize edilir ve kuyular renk kodludur: çökeltme için kırmızı, polikristaller için sarı ve monokristaller için yeşil. (B) İkinci optimizasyon stratejisi, pH ve PEG3350'nin daha dar bir varyasyonu ile seyreltilmiş 25x tohumların kullanımını içerir. (C) Kristal şekil ve boyut önce (üst görüntü) ve sonra (alt görüntü) kristalizasyon optimizasyonu ve mikrotohumlama. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: Günlük çıktısından alıntılar DOĞRU. XDS tarafından TmPep1050H60A H307A veri indekslendirmesi LP.
Üst panel, olası Bravais kafesleri, büyük olasılıkla m C, mP ve oC. Orta panel, C2221 uzay grubunda endeksli verilerin genel istatistikleri. Alt panel, P21 uzay grubunda dizine alınan verilerin genel istatistikleri. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 6: TmPep1050H60A H307Ayapısı.
(A) Bir TmPep1050H60A H307A alt biriminin yapısal hizalaması (kırmızı, PDB kodu 5NE9) ve bir dodecamer alt birimi (beyaz, PDB kodu 6NW5) ve dimer alt birimi (mavi, PDB kodu 5NE6). Oklar, dincamer'lar ve dimerler arasındaki yapısal farklılıklara işaret eder. (B) TmPep1050H60A H307A aktif sitenin (kırmızı) yakın çekimtiz TmPep1050 dimer (mavi) ve dodecamer (beyaz) aktif siteye göre. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| TmPep1050H60A H307A | |
| Veri toplama | |
| Sıcaklık (K) | 100 |
| Radyasyon kaynağı | SOLEIL Proxima 2 |
| Dalga boyu (Å) | 0.9801 |
| Dedektörü | Dectris Eiger X 9M |
| Salınım aralığı (°) | 0.1 |
| Pozlama süresi (ler) | 0.025 |
| Uzay grubu | P 1 21 1 |
| Birim hücre parametreleri | |
| α, β, γ (°) | 90.00, 110.69, 90.00 |
| a, b, c (Å) | 43.24, 137.79, 61.11 |
| Çözünürlük | 43.99 – 2.37 (2.52-2.37) |
| Benzersiz yansımalar | 26.902 |
| Rmerge (%) | 0.14 |
| Yedeklilik | 6,815 |
| 8.64 (2.12) | |
| Bütünlük (%) | 99.6 (97.9) |
| CC1/2 (%) | 99.2 (84.1) |
| Arıtma | |
| Çözünürlük | 43.99 – 2.37 |
| Yansımalar | 26.9 |
| Rserbest set test sayısı | 1345 |
| Riş/Rücretsiz | 0.206/0.234 |
| ASU başına protein molekülleri | 2 |
| VM (ş3/Da) | 2.37 |
| Çözücü içeriği (%) | 49.0 |
| Protein/çözücü atomları | 4,559/96 |
| r.m.s.d. tahvil uzunlukları (Å) | 0.31 |
| r.m.s.d. bağ açıları (°) | 0.51 |
| Ortalama B-faktörleri (ş2) | 57.0 |
| Tercih edilen/izin verilmeyen Ramachandran φ/ψ (%) | 95.02 / 0.17 |
| İkiz hukuk | h, -k, -h-l |
| PDB kodu | 5NE9 |
Tablo 1: Veri toplama ve iyileştirme istatistikleri. Parantez içinde değerler en yüksek çözünürlüklü kabuk içindir.
Tartışmalar
Burada açıklanan protokol, TmPep1050'nin yapısal düzeydeki dimer-dodecamer geçişini anlamanızı sağlar. Metodoloji daha önce hem TmPep1050 oligomers11yapısını belirlemek için deneyimli oldu. En zorlu adım, dodecamer'ların istikrarlı dimers'a dönüşmesini teşvik eden koşulları bulmaktı. Bu tür koşullar metal iyon kofaktör eklendiğinde dimers dodecamers içine yeniden birliğini izin vermek için yeterince hafif olması gerekiyordu. Yapısal çalışmaları ve daha fazla biyokimyasal karakterizasyonu (örneğin, Co2+çeşitli dozlarda dodecamer yeniden birleşmesi çalışma koşulları gibi oligomerlerin ayrılması da kritik bir adım oldu. Moleküler replasman, faz tayini için kanıtlanmış bir yöntem, TmPep1050 oligomerler ve varyantları yapıları çözmek için kullanılmıştır. Önerilen protokol, oligomerizasyon durumları metal kofaktörlerinin kullanılabilirliğine bağlı olan diğer metallo-enzimleri incelemek üzere uyarlanabilir.
Protokolü göstermek için, bir çalışma örneği sunuldu, TmPep1050H60A H307A olan metal bağlama siteleri Alanine His-60 ve His-307 mutasyona uğratılarak bozuldu. Bu kalıntılar sırasıyla M2 ve M1 sahalarında Co2+ bağlar. Metal bağlanmasına müdahale etmek oligomerizasyon durumunu bozabilirdi ve monomerler halinde tam bir kopuşu niçin yol açabilirdi. Böyle bir fenomenin kanıtları PhTET2 ve PfTET3, P. horikoshii ve P. furiosusiki M42 aminopeptidaz için bildirilmiştir , sırasıyla24,29. TmPep1050H60A H307A bu varyant sadece dimers oluşan beklendiği gibi görünmüyordu. Yapısı vahşi tip dimer ile aynı değişiklikleri gösterdi ama iki küçük istisna dışında. Nitekim, Asp-168 ve Asp-62 yan zincirleri aktif sitenin istikrarını engelleyen alışılmadık bir yönelim kilitli olduğu ortaya çıktı. Bu tür değişiklikler tek nokta mutasyon varyantlarında gözlenmedi gibi onların oryantasyon His-60 ve His-307 tarafından empoze gibi görünüyordu.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Martine Roovers'a bu yazıyı doğruldurda ve yapıcı yorumlar da yaptığı için teşekkür ederiz. Proxima 2 beamline 'a (SOLEIL senkrotron) erişim Blok Ayırma Grupları 20151139 içinde ydi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1,10-phenanthroline | Sigma-Aldrich | 13, 137-7 | |
| Amicon Ultra 0.5 ml Centrifugal Filters Ultracel 30K | Merck Millipore | UFC503096 | |
| Amicon Ultra 15 Centrifugal Filters Ultracel 30K | Merck Millipore | UFC903024 | |
| Benzonase Nuclease | Merck Millipore | 70664-3 | |
| CCP4 | N/A | visit http://www.ccp4.ac.uk/ | |
| cOmplete EDTA-free | Roche | 5056489001 | |
| Coot | N/A | visit https://www2.mrc-lmb.cam.ac.uk/personal/pemsley/coot/ | |
| Crystal Screen I | Hampton Research | HR2-110 | |
| Crystal Screen II | Hampton Research | HR2-112 | |
| DreamTaq Green PCR Master Mix | ThermoFisher Scientific | K1082 | |
| EasyXtal 15-well tool | NeXtal | 132007 | |
| Escherichia coli PPY strain | N/A | see reference 31 | |
| Escherichia coli XL1 blue strain | Agilent | 200249 | |
| Gel Filtration Calibration Kit HMW | GE Healthcare Life Sciences | 28-4038-42 | |
| Gel Filtration Calibration Kit LMW | GE Healthcare Life Sciences | 28-4038-41 | |
| Gel Filtration Standard | Biorad | 1511901 | |
| GeneJET Plasmid Miniprep Kit | ThermoFisher Scientific | K0503 | |
| Index | Hampton Research | HR2-144 | |
| Litholoops | Molecular Dimensions | ||
| L-leucine-p-nitroanilide | Bachem AG | 40010720025 | |
| Natrix 1 | Hampton Research | HR2-116 | |
| Natrix 2 | Hampton Research | HR2-117 | |
| Neggia plugin | Dectris | N/A | visit https://www.dectris.com/ |
| NeXtal Tubes JCSG Core Suite I | NeXtal | 130724 | |
| NeXtal Tubes JCSG Core Suite II | NeXtal | 130725 | |
| NeXtal Tubes JCSG Core Suite III | NeXtal | 130726 | |
| NeXtal Tubes JCSG Core Suite IV | NeXtal | 130727 | |
| pBAD-TOPO | ThermoFisher Scientific | K430001 | |
| Phenix | N/A | visit https://www.phenix-online.org/ | |
| Phusion High-Fidelity DNA polymerase | ThermoFisher Scientific | F-530L | |
| Salt RX 1 | Hampton Research | HR2-107 | |
| Salt RX 2 | Hampton Research | HR2-109 | |
| SnakeSkin Dialysis Tubing, 3.5K MWCO | ThermoFisher Scientific | 88242 | |
| Source 15Phe | GE Healthcare Life Sciences | 17014702 | |
| Source 15Q | GE Healthcare Life Sciences | 17094705 | |
| Superdex 200 prep grade | GE Healthcare Life Sciences | 17104301 | |
| Thermotoga maritima MSB8 strain | American Type Culture Collection | ATCC 43589 | |
| TmCD00089984 | DNASU Plasmid Repository | N/A | |
| XDS | N/A | visit http://xds.mpimf-heidelberg.mpg.de/ | |
| xdsme | N/A | visit https://github.com/legrandp/xdsme |
Referanslar
- Levy, E. D., Teichmann, S. A. Structural, Evolutionary, and Assembly Principles of Protein Oligomerization. Progress in Molecular Biology and Translational Science. 117, 25-51 (2013).
- Selwood, T., Jaffe, E. K. Dynamic dissociating homo-oligomers and the control of protein function. Archives of Biochemistry and Biophysics. 519 (2), 131-143 (2012).
- Jaffe, E. K. The Remarkable Character of Porphobilinogen Synthase. Accounts of Chemical Research. 49 (11), 2509-2517 (2016).
- Ramström, H., et al. Properties and Regulation of the Bifunctional Enzyme HPr Kinase/Phosphatase in Bacillus subtilis. Journal of Biological Chemistry. 278 (2), 1174-1185 (2003).
- Rudyak, S. G., Brenowitz, M., Shrader, T. E. Mg2+-Linked Oligomerization Modulates the Catalytic Activiy of the Lon (La) Protease from Mycobacterium smegmatis. Biochemistry. 40 (31), 9317-9323 (2001).
- Yamamoto, S., Storey, K. B. Dissociation-Association of lactate dehydrogenase Isozymes: Influences on the formation of tetramers vs. dimers of M4-LDH and H4-LDH. International Journal of Biochemistry. 20 (11), 1261-1265 (1988).
- Sirover, M. A. Structural analysis of glyceraldehyde-3-phosphate dehydrogenase functional diversity. The International Journal of Biochemistry & Cell Biology. 57, 20-26 (2014).
- Gupta, V., Bamezai, R. N. K. Human pyruvate kinase M2: A multifunctional protein: Multifunctional Human PKM2. Protein Science. 19 (11), 2031-2044 (2010).
- Wiegand, G., Remington, S. J. Citrate synthase: Structure, Control, and Mechanism. Annual Review of Biophysics and Biophysical Chemistry. 15, 97-117 (1986).
- Libonati, M., Gotte, G. Oligomerization of bovine ribonuclease A: structural and functional features of its multimers. Biochemical Journal. 380 (2), 311-327 (2004).
- Dutoit, R., et al. How metal cofactors drive dimer-dodecamer transition of the M42 aminopeptidase TmPep1050 of Thermotoga maritima. Journal of Biological Chemistry. 294 (47), 17777-17789 (2019).
- Rawlings, N. D., et al. The MEROPS database of proteolytic enzymes, their substrates and inhibitors in 2017 and a comparison with peptidases in the PANTHER database. Nucleic Acids Research. 46 (1), 624-632 (2018).
- Neuwald, A. F., Liu, J. S., Lipman, D. J., Lawrence, C. E. Extracting protein alignment models from the sequence database. Nucleic Acids Research. 25 (9), 1665-1677 (1997).
- Dutoit, R., Brandt, N., Legrain, C., Bauvois, C. Functional Characterization of Two M42 Aminopeptidases Erroneously Annotated as Cellulases. PLoS ONE. 7 (11), 50639(2012).
- Franzetti, B., et al. Tetrahedral aminopeptidase: a novel large protease complex from archaea. The EMBO Journal. 21 (9), 2132-2138 (2002).
- Borissenko, L., Groll, M. Crystal Structure of TET Protease Reveals Complementary Protein Degradation Pathways in Prokaryotes. Journal of Molecular Biology. 346 (5), 1207-1219 (2005).
- Appolaire, A., et al. TET peptidases: A family of tetrahedral complexes conserved in prokaryotes. Biochimie. 122, 188-196 (2016).
- Russo, S., Baumann, U. Crystal Structure of a Dodecameric Tetrahedral-shaped Aminopeptidase. Journal of Biological Chemistry. 279 (49), 51275-51281 (2004).
- Schoehn, G., et al. An Archaeal Peptidase Assembles into Two Different Quaternary Structures: A tetrahedron and a giant octahedron. Journal of Biological Chemistry. 281 (47), 36327-36337 (2006).
- Durá, M. A., et al. The structural and biochemical characterizations of a novel TET peptidase complex from Pyrococcus horikoshii reveal an integrated peptide degradation system in hyperthermophilic Archaea: Characterization of P. horikoshii TET3 peptidase. Molecular Microbiology. 72 (1), 26-40 (2009).
- Basbous, H., Appolaire, A., Girard, E., Franzetti, B. Characterization of a Glycyl-Specific TET Aminopeptidase Complex from Pyrococcus horikoshii. Journal of Bacteriology. 200 (17), 00059(2018).
- Appolaire, A., et al. Small-angle neutron scattering reveals the assembly mode and oligomeric architecture of TET, a large, dodecameric aminopeptidase. Acta Crystallographica Section D Biological Crystallography. 70 (11), 2983-2993 (2014).
- Appolaire, A., et al. The TET2 and TET3 aminopeptidases from P yrococcus horikoshii form a hetero-subunit peptidasome with enhanced peptide destruction properties: TET aminopeptidase multi-subunit complex. Molecular Microbiology. 94 (4), 803-814 (2014).
- Colombo, M., Girard, E., Franzetti, B. Tuned by metals: the TET peptidase activity is controlled by 3 metal binding sites. Scientific Reports. 6 (1), 20876(2016).
- Petrova, T. E., et al. Structure of the dodecamer of the aminopeptidase APDkam598 from the archaeon Desulfurococcus kamchatkensis. Acta Crystallographica Section F Structural Biology Communications. 71 (3), 277-285 (2015).
- Kim, D., et al. Structural basis for the substrate specificity of PepA from Streptococcus pneumoniae, a dodecameric tetrahedral protease. Biochemical and Biophysical Research Communications. 391 (1), 431-436 (2010).
- Chevrier, B., et al. Crystal structure of Aeromonas proteolytica aminopeptidase: a prototypical member of the co-catalytic zinc enzyme family. Structure. 2, 283-291 (1994).
- Rosenbaum, E., Ferruit, M., Durá, M. A., Franzetti, B. Studies on the parameters controlling the stability of the TET peptidase superstructure from Pyrococcus horikoshii revealed a crucial role of pH and catalytic metals in the oligomerization process. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics. 1814 (10), 1289-1294 (2011).
- Macek, P., et al. Unraveling self-assembly pathways of the 468-kDa proteolytic machine TET2. Science Advances. 3 (4), 1601601(2017).
- Edelheit, O., Hanukoglu, A., Hanukoglu, I. Simple and efficient site-directed mutagenesis using two single-primer reactions in parallel to generate mutants for protein structure-function studies. BMC Biotechnology. 9 (1), 61(2009).
- Zhang, Y., Werling, U., Edelmann, W. SLiCE: a novel bacterial cell extract-based DNA cloning method. Nucleic Acids Research. 40 (8), 55(2012).
- Schleif, R. AraC protein, regulation of the l-arabinose operon in Escherichia coli, and the light switch mechanism of AraC action. FEMS Microbiology Reviews. 34 (5), 779-796 (2010).
- McPherson, A., Gavira, J. A. Introduction to protein crystallization. Acta Crystallographica Section F Structural Biology Communications. 70 (1), 2-20 (2014).
- Bergfors, T. Seeds to crystals. Journal of Structural Biology. 142 (1), 66-76 (2003).
- Dauter, Z. Collection of X-Ray Diffraction Data from Macromolecular Crystals. Protein Crystallography. 1607, 165-184 (2017).
- Powell, H. R. X-ray data processing. Bioscience Reports. 37 (5), 0227(2017).
- Battye, T. G. G., Kontogiannis, L., Johnson, O., Powell, H. R., Leslie, A. G. W. iMOSFLM a new graphical interface for diffraction-image processing with MOSFLM. Acta Crystallographica Section D Biological Crystallography. 67 (4), 271-281 (2011).
- Otwinowski, Z., Minor, W. Processing of X-ray diffraction data collected in oscillation mode. Methods in Enzymology. 276, 307-326 (1997).
- Clabbers, M. T. B., Gruene, T., Parkhurst, J. M., Abrahams, J. P., Waterman, D. G. Electron diffraction data processing with DIALS. Acta Crystallographica Section D Structural Biology. 74 (6), 506-518 (2018).
- Kabsch, W. XDS. Acta Crystallographica Section D Biological Crystallography. 66 (2), 125-132 (2010).
- Legrand, P. legrandp/xdsme: March 2019 version working with the latest XDS version. , Jan 26, 2018. Zenodo (2019).
- Evans, P. Scaling and assessment of data quality. Acta Crystallographica Section D Biological Crystallography. 62 (1), 72-82 (2006).
- Wlodawer, A., Minor, W., Dauter, Z., Jaskolski, M. Protein crystallography for non-crystallographers, or how to get the best (but not more) from published macromolecular structures: Protein crystallography for non-crystallographers. FEBS Journal. 275 (1), 1-21 (2008).
- Karplus, P. A., Diederichs, K. Assessing and maximizing data quality in macromolecular crystallography. Current Opinion in Structural Biology. 34, 60-68 (2015).
- Taylor, G. L. Introduction to phasing. Acta Crystallographica Section D Biological Crystallography. 66 (4), 325-338 (2010).
- Rossmann, M. G., Blow, D. M. The detection of sub-units within the crystallographic asymmetric unit. Acta Crystallographica. 15, 24-31 (1962).
- Rossmann, M. G. The molecular replacement method. Acta Crystallographica Section A Foundations of Crystallography. 46 (2), 73-82 (1990).
- McCoy, A. J., et al. Phaser crystallographic software. Journal of Applied Crystallography. 40 (4), 658-674 (2007).
- Adams, P. D., et al. PHENIX: a comprehensive Python-based system for macromolecular structure solution. Acta Crystallographica Section D Biological Crystallography. 66 (2), 213-221 (2010).
- Emsley, P., Lohkamp, B., Scott, W. G., Cowtan, K. Features and development of Coot. Acta Crystallographica Section D Biological Crystallography. 66 (4), 486-501 (2010).
- Chen, V. B., et al. MolProbity: all-atom structure validation for macromolecular crystallography. Acta Crystallographica Section D Biological Crystallography. 66 (1), 12-21 (2010).
- Zwart, P. H., Grosse-Kunstleve, R. W., Lebedev, A. A., Murshudov, G. N., Adams, P. D. Surprises and pitfalls arising from (pseudo)symmetry. Acta Crystallographica Section D Biological Crystallography. 64 (1), 99-107 (2008).
- Yeates, T. O. Detecting and overcoming crystal twinning. Methods in Enzymology. 276, 344-358 (1997).
- Terwilliger, T. C. Using prime-and-switch phasing to reduce model bias in molecular replacement. Acta Crystallographica Section D Biological Crystallography. 60 (12), 2144-2149 (2004).
- Terwilliger, T. C., et al. Iterative model building, structure refinement and density modification with the PHENIX AutoBuild wizard. Acta Crystallographica Section D Biological Crystallography. 64 (1), 61-69 (2008).
- Krissinel, E., Henrick, K. Inference of Macromolecular Assemblies from Crystalline State. Journal of Molecular Biology. 372 (3), 774-797 (2007).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır