Method Article
קריסטלוגרפיה רנטגן כדי ללמוד את המעבר המדינה אוליגומרית של Thermotoga maritima M42 Aminopeptidase TmPep1050
In This Article
Summary
פרוטוקול זה פותח כדי ללמוד את המעבר dimer-dodecamer של TmPep1050, M42 aminopeptidase, ברמה המבנית. זהו צינור פשוט החל מטיהור חלבונים לעיבוד נתוני רנטגן. Crystallogenesis, אינדקס סט נתונים, והחלפה מולקולרית הודגמו באמצעות מקרה של מחקר, TmPep1050H60A H307A משתנה.
Abstract
M42 aminopeptidases יוצרים מתחמים פעילים מבחינה פונקציונלית המורכבים מ-12 יחידות משנה. נראה שתהליך ההרכבה שלהם מוסדר על ידי התורמים היונים המתכתיים שלהם, מה שמפעיל מעבר של דימר-דוקאמר. עם כריכת יון מתכת, מספר שינויים מבניים מתרחשים באתר הפעיל ובממשק האינטראקציה, מעצבים עמעום לקידום ההרכבה העצמית. כדי לצפות בשינויים כאלה, אוליגומרים יציבים חייבים להיות מבודדים לפני מחקר מבני. דווח כאן היא שיטה המאפשרת טיהור של dodecamers יציבים ועמומים של TmPep1050, M42 aminopeptidase של T. maritima, ואת קביעת המבנה שלהם על ידי קריסטלוגרפיה רנטגן. דימרים הוכנו מ-dodecamers על ידי הסרת יונים מתכת עם סוכן chelating. ללא קופקטור שלהם, dodecamers הפך פחות יציב ונתק לחלוטין עם החימום. המבנים האוליגומריים נפתרו על ידי גישת ההחלפה המולקולרית הפשוטה. כדי להמחיש את המתודולוגיה, המבנה של גרסה TmPep1050, פגום לחלוטין בכריכת יון מתכת, מוצג לא מראה פירוט נוסף של dimers מונומרים.
Introduction
אוליגומרציה היא תהליך דומיננטי המכתיב את הפונקציות הביולוגיות של חלבונים רבים. ב Escherichia קולי, ההערכה היא כי רק 35% של חלבונים הם מונומריים1. חלבונים מסוימים, הנקראים מורפיינים, יכולים אפילו לאמץ מספר מצבים אוליגומריים עם יחידות משנה בעל מבנה נפרד בכל מצב אוליגומרי2. המעבר בין מצבם האוליגומרי הוא לעתים קרובות מתכוון לווסת את פעילות החלבון כמו כל מצב אוליגומרי עשוי להיות פעילות או פונקציה ספציפית שונה. מספר דוגמאות למורפיין תועדו היטב בספרות, במיוחד את סינתאזפורפובילינוגן 3, HPr קינאז/פוספטאז4, פרוטאזלון 5, להקטאט דהידג'נאז6, גליצרלדהיד-3-פוספט דהידג'נאז7, פירווט קינאז8, סינתזיטציטראט 9, וריבנוקלאז A10. לאחרונה, תיארנו M42 aminopeptidase TmPep1050, דוגמה נוספת של אנזים עם התנהגות כמו מורפיין, שפעילותו תלויה במצבים האוליגומרייםשלה 11. המעבר בין המדינות האוליגומריות שלה מתווכת על ידי הגורמים המתכתיים שלה, מה שגורמים למספר שינויים מבניים של יחידות המשנה.
משפחת M42 aminopeptidase שייכת לשבט MH12,13, והיא מחולקת באופן נרחב בקרב חיידקים וארכאה14. M42 aminopeptidases הם אנזימים די-גרעין אמיתיים משפיל פפטידים עד 35 שאריות חומצת אמינובאורך 15. הם מאמצים מבנה מוזר בצורת טטריהדרון עשוי מ-12 יחידות משנה עם האתרים הפעילים שלהם הכיוון לחלל הפנימי. הסדר כזה מתואר לעתים קרובות בשם ננו-מידור של הפעילות כדי למנוע פרוטאוליזה בלתי מבוקרת. הפונקציה הפיזיולוגית של M42 aminopeptidases עשוי להיות קשור פרוטאזום, פפטידים הידרוליזההנובעים מירידהבחלבון 16,17. Pyrococcus horikoshii בעל ארבעה M42 aminopeptidases, כל אחד מציג ייחודי אך משליםפרטים 18,19,20,21. באופן ייחודי, תסביכות הטרוסקסואליות המורכבות משני סוגים שונים של יחידות משנה תוארו בפ. horikoshii, מה שמצביע על קיומם שלמתחמים פפטידים 22,23.
בספרות תוארו מספר מבנים של M42 aminopeptidases11,16,18,19,20,24,25,26. תחום המשנה מורכב משני תחומים נפרדים, קבוצת מחשבים קתטית ותחום דימיטים. התחום הקתליטי מאמץ פיפול α/β משותף שנצמר בכל שבט MH, התחום הקטליטי הארכיטיפי הוא ה-Ap1 של Vibrio proteolyticus27. תחום dimerization מאמצת קיפול PDZ כמו16 ואולי יש, בנוסף לתפקידה oligomerization, תפקיד בשליטה על גישה למצע ואיגוד בחלל הפנימי11. מכיוון שאבן הבניין הבסיסית היא עמומה יותר, מתואר ה-dodecamer לעתים קרובות כשיוך של שישה דימרים, שכל אחד מהם ממוקם בכל קצה של טטרהדרון16. אוליגומרציה של M42 aminopeptidases מסתמך על הזמינות של cofactors מתכת שלה. יונים מתכת Divalent, לעתים קרובות Zn2+ ו Co2+, מעורבים באופן קטליטי בכריכת פפטיד והידרוליזה. הם נמצאים בשני אתרי איגוד נפרדים, כלשהם אתרי M1 ו-M2. שני יונים מתכת גם לנהוג ולכוונן היטב את oligomerization כפי שהוכח עבור PhTET2, PhTET3, PfTET3, ו TmPep105011,24,28,29. כאשר cofactors מתכת מתרוקן, dodecamer מתפרק לתוך dimers, כמו PhTET2, PhTET3, ו TmPep105011,16,28,או אפילו מונומרים, כמו PhTET2 ו PfTET324,29.
מוצג כאן פרוטוקול המשמש לחקר המבנים של TmPep1050 אוליגומרים. פרוטוקול זה הוא קבוצה של שיטות נפוצות כולל טיהור חלבונים, הקרנת פעילות פרוטאוליטית, התגבשות, מפזר רנטגן, והחלפת מולקולרית. הדקויות הטמונות בהתמודדות עם מטאלואנזימים, אוליגומריזציה של חלבונים, התגבשות חלבונים והחלפת מולקולרית מודגשות. מקרה של מחקר מוצג גם כדי להראות אם TmPep1050 dodecamers עשויים עוד יותר לנתק לתוך מונומרים או לא. כדי לטפל בשאלה זו, גרסה TmPep1050, TmPep1050H60A H307A, נחקרה שאתרי כריכת המתכת שלהם נפגעים על ידי מוטציה שלו-60 (אתר M2) ו His-307 (אתר M1) כדי Ala שאריות. פרוטוקול זה עשוי להיות מתאים ללמוד aminopeptidases M42 אחרים או כל מטאלואנזימים עם התנהגות כמו מורפיין.
Protocol
1. ייצור וטיהור של TmPep1050 רקומביננטי
הערה: להלן מתוארים הליך השיבוט וטיהור של TmPep1050 מסוג פראי מותאם ממחקרקודם 11. לחלופין, ניתן לעשות את השיבוט באמצעות גן סינתטי. כדי ליצור גרסאות TmPep1050, אתר בבימויו mutagenesis ניתן לבצע בעקבות, למשל, תגובות פריימר יחיד בשיטה פרוטוקול מקבילי (SPRINP)30. ניתן להשתמש בפרוטוקול הטיהור עבור משתני TmPep1050. יש להימנע מהשימוש בתג שלו, כי הוא מפריע לכריכת יון מתכת.
- עיצוב וקטור ביטוי
- לרכוש DNA גנומי של Thermotoga maritima MSB8 (ATCC 43589) או TmCD00089984 (המרכז המשותף לגנומיקה מבנית).
- להגביר TM_1050 מסגרת קריאה פתוחה (ORF) באמצעות DNA גנומי או פלסמיד תבנית, פולימראז DNA באיכות גבוהה, ואת פריימרים הבאים: ocej419 (5'- TTTAACTTTAAGAAGAAGAAGAAGATAACACACACGAAGAGGATGAGAGAGAAGAGAGAGAGAGG) ו ocej420 (5'- ATCCGCCAAAACAGCCAAGCTAGACCCTCTCTACCACCACCAGATACCTACCTGAG). הפעל את תגובת שרשרת פולימראז (PCR) הקרנה על פי התוכנית הבאה: 5 דקות ב 95 °C, 30 מחזורים של 3 שלבים (30 s ב 95 °C, 30 s ב 55 ° C, 90 s ב 72 ° C), ו 10 דקות ב 72 ° C כצעד האחרון.
- שכפול את שבר PCR לתוך וקטור ביטוי מתאים (טבלת חומרים) על ידי שילוב הומולוגי (איור 1) ב E. coli על פי פרוטוקול SLiCE31. כדי 50 ng של וקטור ליניארי, להוסיף קטע PCR ביחס 10:1 טוחנת של שבר לוקטור, 1 μL של תמצית זן PPY, 50 mM Tris-HCl pH 7.5, 100 mM MgCl2, 10 mM ATP, ו 10 mM dithiothreitol (DTT) עבור נפח תגובה של 10 μL. דגירה עבור 1 שעות ב 37 °C.
- להפוך כימית מוסמך E. coli XL1 זן כחול (או כל recA- זן מתאים) עם 1 μL של תגובת שילוב מחדש. לוח התאים על LB בינוני המכיל 100 μg / מ"ל אאמפיצילין. דגירה את הצלחות לילה ב 37 מעלות צלזיוס.
- לקטוף מושבות על צלחות LB טרי עם 100 μg / מ"ל אאמפיצילין. דגירה את הצלחות ב 37 ° C לפחות 8 שעות.
- מסך למועמדים חיוביים על ידי מושבה PCR באמצעות זוג פריימר מתאים (5'- ATGCCATAGCATTTTTATCC ו 5 '- ATTTAATCTGTATCAGGC אם באמצעות וקטור מומלץ המפורטים בטבלת חומרים). עם קצה microtip, לגרד מושבה הרים ולהעביר את התאים 20 μL של תמהיל תגובה המכיל 0.5 μM של כל פריימר ו 10 μL של תערובת פולימראז DNA Taq מסחרי.
- הפעל את ההקרנה PCR בהתאם לתכנית הבאה: 5 דקות ב 95 °C כצעד denaturation, 30 מחזורים של 3 שלבים (30 s ב 95 °C, 30 s ב 55 ° C, 90 s ב 72 °C), ו 10 דקות ב 72 ° C כצעד האחרון.
הערה: ניתן לאחסן את תגובות PCR במהלך הלילה במכון PCR ב- 12 °C. - טען 10 μL של כל תגובת PCR על ג'ל agarose 0.8% מוכן ב- Tris-אצטט-EDTA (TAE) מאגר. הפעל את האלקטרופורזה במשך 25 דקות ב-100 וי.
הערה: צפוי אמפליקון של 1.1 kbp. - לחלץ פלסמידים ממועמדים באמצעות ערכה מסחרית (טבלת חומרים) ולרצף אותם באמצעות אותו זוג פריימר המשמש בשלב 1.1.6.
- תרבות תאים
הערה: כאשר זוהה מועמד מתאים על-ידי רצף, ניתן להשתמש ישירות במשכפל כביטוי אם משתמשים בוקטור המומלץ(טבלת חומרים). במקרה זה, הביטוי נשלט על ידי היזם PBAD 32.- לחסן 10 מ"ל של LB בינוני המכיל 100 μg / מ"ל אמפוצילין עם המועמד דגירה preculture לילה ב 37 ° C תחת רעד מסלולי. הוסף 5 מ"ל של preculture 1 L של LB בינוני עם 100 μg / מ"ל אאמפיצילין. אכפת לכבד את היחס האוויר לנוזל של 3.
- תנו לתאים לגדול ב-37 מעלות צלזיוס תחת רעידות מסלוליות. לפקח על הצפיפות האופטית ב 660 נה"מ (OD660).
- כאשר OD660 הגיע ל- 0.5-0.6, קירור מהיר של התרבות למשך 5 דקות על קרח והעבר אותה לאקובטור המוכן ל- 18°C.
- הוסף 0.2 גרם/L arabinose כדי לגרום ביטוי גנים דגירה עבור 12-18 שעות ב 18 °C.
- תאים קציר על ידי צנטריפוגה התרבות ב 6,000 x g עבור 30 דקות ב 4 ° C. השליכו את תאי העל והשטיפת עם 100 מ"ל של 0.9% (w/v) NaCl.
- צנטריפוגה שוב ב 6,000 x g במשך 15 דקות ב 4 מעלות צלזיוס ולזרוק את supernatant.
הערה: ניתן להשתמש כדורי תאים ישירות להפקת חלבון או לאחסן ב-80 °C.
- טיהור חלבונים
- תולה מחדש את כדורי התא ב 40 מ"ל של 50 mM MOPS, 1 mM CoCl2,pH 7.2. להוסיף 1 μL של 25 U /μL DNA / RNA endonuclease וטבליה אחת של קוקטייל מעכב פרוטאז שאינו מכיל EDTA. Sonicate את המתלים במצב דופק תחת קירור במשך 30 דקות.
- צנטריפוגה התמצית הגולמית ב 20,000 x g עבור 30 דקות ב 4 ° C. אוספים את הסופרנט וחממים אותו באמבט מים ב-70 מעלות צלזיוס במשך 10 דקות.
- צנטריפוגה תמצית התא denatured ב 20,000 x g עבור 30 דקות ב 4 ° C ולאסוף את supernatant לטיהור.
- השתמש שרף חילופי אניון מתאים(טבלת חומרים) ארוזבעמודה של ~ 15 מ"ל של נפח. עיין בהמלצות היצרן עבור קצב זרימת העבודה ומגבלת הלחץ של העמודה. לצייד את ה-resin עם 50 mM MOPS, 1 mM CoCl2, pH 7.2.
- טען את supernatant שנאסף מ- 1.3.3 לתוך העמודה. לפקח על ספיגת ההברה ב 280 00 00:00. כאשר הוא הגיע לקו הבסיס, המשך אל ההתמהמה.
- החלת מעבר צבע מ- 0 עד 0.5 M NaCl ב- 50 mM MOPS, 1 mM CoCl2, pH 7.2 עבור 5 אמצעי אחסון עמודה (CV). המתן עד שהמוך יתייצב והספיגה הגיעה לקו הבסיס.
- החל מעבר צבע סופי מ- 0.5 ל- 1 M NaCl ב- 50 mM MOPS, 1 mM CoCl2, pH 7.2 עבור קורות חיים 1.
- נתח כמה שברים (ראה איור 2A להדרכה) על ידי נתרן dodecyl סולפט פוליקרילאמיד ג'ל electro electrophoresis (SDS-PAGE).
הערה: TmPep1050 מופיעה כלהקת 36 kDa לאחר הכתמת Coomassie. לחלופין, ניתן לאשר את הנוכחות של TmPep1050 על-ידי פעילות (ראה סעיף 2.1). בשלב זה, ניתן לאחסן שברים ב- 4 °C בן לילה. - מאגר השברים המכילים TmPep1050 ולהוסיף אבקהטחון דקשל (NH 4 )2SO 4 כדי להשיג ריכוז של 1.5 M (NH4)2אז4. מערבבים בעדינות על-ידי הפיכת הצינור הפוך עד לפירוק מלא.
- השתמש שרף אינטראקציה הידרופובית(טבלת חומרים)ארוז בעמודה של ~ 30 מ"ל של נפח. עיין בהמלצות היצרן עבור קצב זרימת העבודה ומגבלת הלחץ של העמודה. לצייד את שרף עם 50 mM MOPS, 1.5 M (NH4)2אז 4, 1 mM CoCl2, pH 7.2.
- טען את הדגימה על העמודה ונטר את ספיגת ההברה במהירות של 280 00 00 00 00:00. כאשר הספיגה הגיעה לקו הבסיס, חלבונים מאוגדים באלגנטיות על ידי החלת מעבר צבע מ 1.5 M כדי 0 M (NH4)2אז4 ב 50 mM MOPS, 1 mM CoCl2, pH 7.2 עבור 5 קורות חיים.
- נתח שברים מסוימים (ראה איור 2B לקבלת הדרכה) לפי SDS-PAGE.
הערה: TmPep1050 מופיעה כלהקת 36 kDa לאחר הכתמת Coomassie. לחלופין, ניתן לאשר את הנוכחות של TmPep1050 על-ידי פעילות (ראה סעיף 2.1). בשלב זה, ניתן לאחסן שברים ב- 4 °C בן לילה. - מאגר השברים המכילים TmPep1050 ולהתרכז 2 מ"ל באמצעות יחידות אולטרה סינון עם 30 kDa לחתוך(טבלת חומרים). המשך לסעיף 1.4 כדי לקבוע את המשקל המולקולרי.
- כרומטוגרפיה של אי-הכללת גודל
- השתמש שרף אי-הכללה גודל (טבלת חומרים) ארוז בעמודה של ~ 120 מ"ל של נפח. עיין בהמלצות היצרן עבור קצב זרימת העבודה ומגבלת הלחץ של העמודה. לצייד את שרף עם 50 mM MOPS, 0.5 M (NH4)2אז 4, 1 mM CoCl2, pH 7.2.
- טען את הדגימה על העמודה ונטר את ספיגת ההברה במהירות של 280 00 00 00 00:00. החלק מנפח מת עמודה (~ 0.33 CV) עד סוף ההתבליט (1 קורות חיים).
- מדוד את נפח ההתמהמה עבור כל שיא שנצפה.
הערה: לקבלת הדרכה, dodecameric TmPep1050 elutes ב ~ 82 מ"ל (איור 3A) בתנאים ניסיוניים נוכחיים, בעוד TmPep1050 dimeric, כגון TmPep1050H60A H307A משתנה, elutes ב ~ 95 mL (איור 3B). TmPep1050 מסוימים עשויים לאמץ את שתי הצורות האוליגומריות, כגון TmPep1050H60A (איור 3C). - נתח שברים המתאימים למקסימום וזנבות של פסגות שנצפו באמצעות SDS-PAGE.
הערה: TmPep1050 מופיעה כלהקת 36 kDa לאחר הכתמת Coomassie. - מאגר השברים של כל שיא ולהתרכז באמצעות יחידות אולטרה סינון עם 30 kDa לחתוך (טבלת חומרים) כדי להשיג ריכוז של ~ 300 μM.
- למדוד את הספיגה ב 280 ננומטר על ספקטרופוטומטר ננו נפח ולחשב את הריכוז באמצעות מקדם הכחדה מולקולרית של 18,910 M-1 ס"מ -1.
- לאחסן את החלבון המטוהר ב -18 °C.
- כדי לקבוע את המשקל המולקולרי, כייל את העמודה הכרומטוגרפיה של החרגת הגודל (SEC) באמצעות תקני משקל מולקולריים(Table of Materials). נתח את הסטנדרטים באמצעות MOPS של 50 מ"מ, 0.5 מ' (NH4)2SO4, 1 mM CoCl2 pH 7.2 כמאגר הפועל.
2. הכנת פעילות ואנזים אפו-אנזים
הערה: במקור, האנזים אפו-אנזים הוכן על ידי דילול 1 נפח של TmPep1050 ב 10 כרכים של 2.1 M חומצה מאלית pH 7.0 וריכוז חזרה 1 נפח לפני דיאליזה11. להלן מוצג הליך חלופי באמצעות 1,10-phenanthroline, כלאטור יון מתכת. הליך זה מפחית אובדן חלבון ונותן את אותן תוצאות מאשר השיטה שפורסמה בעבר.
- פעילות תסוואי
- הכנת תמיסת מניות של 100 מ'-L-Leucine-p-nitroanilide(טבלת חומרים)במתנול.
- להוסיף 25 μL של 100 mM L-Leucine- p-nitroanilide ב μL 965 μL של 50 mM MOPS, 250 μM CoCl2, pH 7.2, 10% מתנול. מנקים מראש את תערובת התגובה ב-75 מעלות צלזיוס באמבטיה יבשה.
- לדלל את האנזים ב 50 mM MOPS pH 7.2 לריכוז של 1 μM. להוסיף 10 μL לתערובת התגובה, מערבולת, דגירה ב 75 ° C או עד שהוא הפך צהבהב או במשך 1 שעות.
- לעצור את התגובה על ידי הוספת 1 מ"ל של 20% חומצה אצטית. מערבולת היטב ולתת לו להתקרר לטמפרטורת החדר.
- העבר את תערובת התגובה בתא ספקטרופוטומטר. קרא את הספיגה ב 410 00 00 00:00 מול שליטה שלילית (תגובת דגירה לערבב ללא אנזים).
- הכנת אפו-אנזים
- הכן פתרון מניות של 1 M 1,10-phenanthroline באתנול. הוסף 10 μL של 1,10-phenanthroline פתרון מניות 890 μL של 50 mM MOPS, 0.5 M (NH4)2אז 4, pH 7.2. הוסף 100 μL של TmPep1050 מטוהר (300 μM-1 mM ריכוז).
- בדוק את אובדן הפעילות באמצעות הודעה הפעילות המתוארת בסעיף 2.1 מבלי להוסיף CoCl2 בתמהיל התגובה.
- העבר את הדגימה בצינור דיאליזה. דיאליזה נגד 200 מ"ל של 50 mM MOPS, 0.5 M (NH4)2אז4, pH 7.2 ב 4 ° C. החלף שלוש פעמים את הדיאליזה עם חוצץ טרי במהלך דיאליזה 48 שעות.
- לאסוף את הדגימה מצינור הדיאליזה ולהתרכז בחזרה 100 μL באמצעות יחידות אולטרה סינון עם 30 kDa לחתוך(טבלת חומרים). בדוק את הריכוז על ידי קריאת הספיגה ב 280 ננומטר באמצעות ספקטרופוטומטר ננו נפח.
- הכנת דימר
- לדלל את האנזים אפו לריכוז של 1 μM ב 50 mM MOPS, 0.5 M (NH4)2אז 4, pH 7.2. מדגירה במשך 2 שעות ב 75 °C באמבטיה יבשה, ואז לתת את הדגימה להתקרר עד טמפרטורת החדר.
- רכז את הדגימה לריכוז אנזימים של לפחות 50 μM. בדוק את המשקל המולקולרי על ידי SEC (ראה סעיף 1.4). שיא ההתבליט חייב לעבור מ-82 מ"ל ל-95 מ"ל (בתנאים הניסיוניים הנוכחיים).
3. התגבשות TmPep1050
הערה: התגבשות חלבון נשאר מדע אמפירי כפי שהוא תופעה רב-תכליתית33. בעוד פרמטרים מסוימים ניתן לזהות ולשלוט (כגון טמפרטורה, pH, ריכוז סוכן משקעים), אחרים עשויים להשפיע באופן חמקמק על התגבשות (כגון חלבון וטוהר כימי, פרוטאוליזה, היסטוריית מדגם). כיום התגבשות החלבון מטופלת באופן רציונלי ושיטתי הודות לחבורה של תנאי סינון התגבשות מסחריים ואוטומציה. עם זאת, המיטוב של מצב התגבשות מסתמך בעיקר על גישת ניסוי וטעייה. להלן מתוארים תוכנית לגבש חלבונים וכמה טיפים למיטוב תנאי ההתגבשות.
- הקרנת התגבשות
הערה: באמצעות ערכות התגבשות מסחריות, גבישים של TmPep1050 dodecameric הושגו ב 2.2 M DL-malic חומצה pH 7.0, 0.1 M Bis-Tris פרופן pH 7.0 ו 0.18 M tri-אמוניום ציטראט, 20% פוליאתילן גליקול (PEG) 3350. גבישים של TmPep1050 dimeric הושגו 0.1 M נתרן ציטראט pH 5.6, 0.2 M אמוניום אצטט, 30% PEG4000. גבישים של dodecamers מופיעים בתוך שבוע ולהגיע לגודל המלא שלהם בחודש. גבישים של דימרים מופיעים בדרך כלל בתוך 24 שעות וגדלים לגודל מלא בשבוע.- רכש מספר ערכות התגבשות מסחריות (ראה טבלת חומרים לדוגמה).
- כוונן לוחות התגבשות(טבלת חומרים) עבורשיטת הירידה התלויה. מלא את בארות עם 500 μL של כל פתרון של ערכת הקרנה התגבשות.
- עבור כל באר, הגדר תמיכה התגבשות. על התמיכה, להפקיד טיפה 1 μL של חלבון מטוהר (בדרך כלל ~ 10 מ"ג / מ"ל).
- מיד pipet 1 μL של פתרון התגבשות מהבאר. מוסיפים אותו בזהירות לטיפת החלבון ומערבבים בעדינות על ידי התפתלות הפוכה שלוש פעמים. הירידה חייבת להישאר חצי כדורית ללא בועות.
- לעזאזל עם התמיכה בנוסף לבאר המתאימה. חזור על הפעולה עבור כל הערכה.
- לאחר הגדרת הצלחות, לצפות בכל טיפה עם משקפת. עיין במדריך למשתמש של ערכת התגבשות לפרשנות (ירידה ברורה, הפרדת פאזה, משקעים, מחטים וכו').
- דגירה את הצלחות ב 20 מעלות צלזיוס. בדקו את הצלחות פעם ביום במהלך השבוע הראשון ופעם בשבוע לאחר מכן.
- ציון כל טוב באמצעות גליון התוצאות ואת המדריך למשתמש המסופק עם ערכות התגבשות.
- מיטוב התגבשות
הערה: תנאי ההתגבשות הראשונית של TmPep1050 dodecameric ממוטבים ל- 2.1 M DL-malic חומצה pH 6.75 ו 0.18 M tri-אמוניום ציטראט pH 7.5, 40% (w /v) PEG3350 בעוד מצב התגבשות של TmPep1050 dimeric הותאם ל- 0.1 M נתרן ציטראט pH 6.0, 10% (w / v) PEG3350. מחזור אחד של זריעה היה הכרחי כדי לשפר את הגבישיות. להלן מתואר כיצד התגבשות של TmPep1050H60A H307A משתנה אופטימיזציה.- הכן פתרונות מלאי של מאגר ציטראט נתרן ב-0.5 M ב- pH שונה (4.5, 5.2 ו- 6.0) ופתרון PEG3350 של 50% (w/v).
- הגדר צלחת התגבשות כמטריצה של pH לעומת סוכן משקעים (ראה איור 4A).
- דגירה את הצלחת ב 20 מעלות צלזיוס. שימו לב לכל באר עם משקפת פעם ביום במהלך שבוע.
- ציון כל טוב לפי גודל קריסטל וצורה. בחר תנאי המעניק גבישים של לפחות 50 μm. המשך למיקרו-זרעים.
- מיקרו-זרעים
הערה: Microseeding היא שיטה רבת עוצמה לשיפור הצורה, הגודל והקריסטליות של גבישי חלבון34. גישה מהירה יותר של זריעה היא זריעה של פס באמצעות שפם חתול. ראה איור 4 כדוגמה כיצד מיטוב התגבשות ומיקרו-זרעים שיפרו את הצורה והגודל של הגביש עבור TmPep1050H60A H307A.- הכן את הזרעים באמצעות הבאר שנבחרה בשלב 3.2.4.
- הגדל את נפח הירידה המכילה גבישים ל- 10 μL על-ידי הוספת פתרון התגבשות מהבאר. צינור הטיפה ולהוסיף 90 μL של פתרון התגבשות מהבאר. מערבולת ביסודיות ולשמור את הזרעים על קרח.
- הכן מספר דילולים של הזרעים: 1x, 10x, 25x, ו 100x. מערבולת גם הזרעים לפני pipetting. שמור את דילול על קרח.
- עבור כל דילול זרעים, להגדיר צלחת התגבשות כמטריצה של pH לעומת סוכן משקעים (ראה איור 4B). השתמש בפתרונות המלאי שהוכנו בשלב 3.2.1.
- בעת ביצוע הירידה, להוסיף 0.2 μL של זרעים עבור טיפה 2 μL. דגירה את הצלחת ב 20 מעלות צלזיוס. שימו לב לכל באר עם משקפת פעם ביום במהלך שבוע.
הערה: יש לשפר את ההתפלגות והצורה של גודל הבדולח, ראה איור 4C כדוגמה עבור TmPep1050H60A H307A. עבור שימושים נוספים, זרעים ניתן לאחסן ב -20 °C.
4. מפזר רנטגן
- קטיף קריסטל
הערה: הכנת מדגם תלויה במתקן מקור רנטגן (מתקן ביתי לעומת synchrotron). השתמש בהתקני אחסון (בקבוקונים וסלסלת מחזיק בקבוקון) בהתאם. התוספת של cryoprotectant (כגון גליטרול) עשוי להידרש בהתאם לריכוז סוכן מלח/משקעים. עבור גבישי TmPep1050, cryoprotectant אינו הכרחי כמו PEG או ריכוז מאגר הוא גבוה מספיק כדי למנוע גבישי מים.- הכינו אמבטיה מלאה בחנקן נוזלי, תצלמו בקבוקונים או סל המשמשים לטיפול בדגימה.
- הגדרת לולאות איסוף לדוגמה בגדלים שונים: 100, 150 ו- 200 μm(טבלת חומרים). בחר את הגדלים בהתאם לגודל הגביש.
- באמצעות משקפת, בדקו את הטיפה המכילה גבישים ובדקושים מבודדים (הקל ביותר לקטוף). עם לולאה, בחר בעדינות גביש מלמטה. מיד לצלול את הלולאה חנקן נוזלי ולמקם את הלולאה במבען מתאים.
- איסוף נתונים
הערה: איסוף הנתונים עשוי להשתנות במידה רבה בהתאם למקור קרני הרנטגן (מתקן ביתי לעומת synchrotron) ורגישות הגלאי. אסטרטגיית האיסוף עשויה גם להיות שונה מאוד מדגימה לאחרת, בהתאם לרזולוציה, עוצמת הספוט, קבוצת החלל וכו'. הנושא נבדק בהרחבה על ידי Dauter35.- הר הלולאה נושאת את הגביש על ראש goniometer של diffractometer.
- כוונן את ראש הגוניומטר לאורך צירי XYZ כדי ליישר את הגביש עם נתיב קרן הרנטגן.
- הגדר את אורך הגל ל- 0.98 Å והזז את הגלאי כדי לקבל 2 Å של רזולוציה.
- התחל איסוף נתונים קצר על-ידי רכישת תמונות בשני כיווני גביש שונים לפחות. לצלם 10 תמונות (תמונה אחת לכל 0.1°) ב- 0° ו- 90°.
- בדוק את התמונות שנאספו עם תוכנה מתאימה (לדוגמה, ADXV, XDS-Viewer או אלאבולה Viewer). קבע את עוצמת הספוט ואת הרזולוציה הגבוהה ביותר שבה ניתן לראות נקודות. בדוק גם את המונוקריסטליות ואת הפרדת ספוט.
- בסופו של דבר, חזור על שלבים 4.2.3-4.2.5 על-ידי שינוי מיקום הגלאי לרזולוציה גבוהה יותר או נמוכה יותר וזמן החשיפה בהתאם לתצפית.
- התחל איסוף נתונים בסביבות 360° עם תמונה אחת שצולמה לכל 0.1°. זכור להגדיר את מיקום הגלאי ואת זמן החשיפה בצורה אופטימלית.
5. יצירת אינדקס, החלפה מולקולרית ובניית מודלים
- יצירת אינדקס
הערה: יצירת אינדקס היא שיטה למדידת עוצמת נקודות מפזר, המעניקה למשרעת של גורמי מבנה36. ארבע חבילות תוכנה משמשות בדרך כלל לעיבוד תמונות שנאספו: Mosflm37, HKL200038, DIALS39ו- XDS40. האחרון שימש לאינדקס ערכות הנתונים שהתקבלו TmPep1050 פירוק גביש.- התקן את חבילת XDS ואת XDSME41. אם עיבוד קבצי HDF5, להתקין XDS Neggia תוסף (זמין באתר האינטרנט של Dectris). לקבלת מידע נוסף, בקר בדף האינטרנט של XDS wiki https://strucbio.biologie.uni-konstanz.de/xdswiki/index.php/Main_Page ודף האינטרנט XDSME https://github.com/legrandp/xdsme.
- לפני עיבוד הנתונים, צור תיקיה ממנה יו פועל XDS. אתר את הנתיב לתמונות.
- כדי להפעיל את XDSME, הקלד xdsme /path_to_images/image.extension בחלון מסוף.
- לאחר ש- XDS סיים את העבודה, בדוק את התקן. קובץ דיקור מותני. שים לב להסתברות של קביעת קבוצת החלל, שלמות הנתונים, הרזולוציה הגבוהה ביותר, פסיפס קריסטל ואיכות נתונים. בדוק XDS_pointless.log כדי להשיג את הסבירות של קבוצות חלל.
הערה: ראה איור 5 כדוגמה לפלט. - הפעלה מחדש של XDSME עם פתרונות שונים של קבוצת רווח המוצעים על-ידי XDS בתיקיה נפרדת כדי להימנע מהחלפת התהליך הקודם. הקלד xdsme -s space_group_name -c "unit_cell_parameters" /path_to_images/image.extension (לדוגמה, xdsme -s P21 -c "43.295 137.812 61.118 90.000 110.716 90.000).
- בדוק את הנכון. קבצי LP ובחר את הפתרון הטוב ביותר בהתבסס על סטטיסטיקת נתונים.
- הפעל את XSCALE על-ידי הקלדת xscale.py XDS_ASCII. HKL. הפעל XDSCONV על-ידי הקלדת xdsconv.py XSCALE. המק"ס 4.
הערה: במקרים מסוימים, XDSME נכשל בזיהוי קבוצת הרווח או נכשל לחתוך את טווח הרזולוציה כראוי או יוצר סטטיסטיקת נתונים מוזרה. אם בעיה כזו נתקלת, כדאי להפעיל XDS באופן מקורי. יש להציג מספר פרמטרים ב- XDS. קובץ אתחול INP (ראה דף Wiki של XDS). בעת שימוש ב- XDS, ניתן לבדוק את הסבירות של קבוצות חלל אפשריות באמצעות חסר טעם, חלק מחבילת CCP442. כדי לחתוך את רזולוציית סט הנתונים, Rmeas < 60% ו- I/σ ~ 2 מתקבלים בדרך כלל כדי לקבוע את הרזולוציההגבוהה ביותר 43. עם זאת, ניתן לשפר את התחליף המולקולרי ואת עידון המודל על-ידי הרחבת הרזולוציה ל- I/σ ~ 0.5-1.5 ו- CC1/2 עד 0.2-0.444.
- החלפה מולקולרית
הערה: נתונים ניסיוניים מעניקים גישה למשרעת של גורמים מבניים, אך מבלי לדעת את השלב, הם חסרי תועלת. ניתן לקבוע את השלב באופן ניסיוני על ידי שיטות שונות המסתמכות על אות חריג (מאתום כבד, למשל)45. החלפה מולקולרית היא שיטה נוספת לקביעת השלב ללא אטוםפיזור חריג 46,47. שיטה זו משתמשת הקואורדינטות של מולקולה קשורה כדי למצוא ולשפר את השלב באופן זמני. אנו משתמשים Phaser48 בPhenix GUI49 להחלפה מולקולרית.- הכן את המודל ההתחלתי להחלפה מולקולרית באמצעות קואורדינטות 4P6Y. מקובץ pdb, לחלץ את מונומר A ולקצץ aminoacids שלה באלנין באמצעות עורך קובץ PDB בPhenix (תחת הכרטיסיה כלי מודל).
- הפעל Xtriage ב- Phenix (תחת הכרטיסיה ניתוח נתונים) עם קובץ ההשתקפות שנוצר על-ידי XDSCONV (5.1.9) והרצף כקלט.
- בדוק את קובץ יומן הרישום מ- Xtriage. שים לב לשלמות, למספר יחידות המשנה ביחידה האסימטרית, לאניסטרופיה, לנוכחות טבעות קרח ולתופעה התאומות.
- הפעל Phaser-MR ב- Phenix (תחת הכרטיסיה החלפה מולקולרית) עבור החלפה מולקולרית באמצעות קובץ ההשתקפות, הרצף ואת המודל ההתחלתי 4P6Y נחתך בפולי אלנין (שלב 5.2.1).
- עם השלמת, בדוק אם נמצא דגם ואת הציון של ההחלפה המולקולרית. גורם תרגום Z-score (TFZ) של לפחות 8 מציין שהפתרון נכון בהחלט.
- בניית דגמים
הערה: לאחר קביעת השלב על-ידי החלפה מולקולרית, יש לבנות את המודל ולחדד אותו. פרוטוקול זה משתמש Phenix GUI49 עבור בנייה אוטומטית ועידון איטרטיבי, ו Coot50 עבור מבנה ידני בניין ועידון.- לאחר החלפה מולקולרית באמצעות Phase-MR ב- Phenix, בחר הפעל בונים אוטומטיים. כל הקבצים הדרושים יתווספו באופן אוטומטי. פשוט הקש על הפעל כדי להתחיל בהתקניות אוטומטית.
- עם השלמת, בדוק את הדגם בקוט. לבנות ולחדד את המודל באופן ידני על פי מפת צפיפות אלקטרונים ב Coot.
- מקד את הדגם שנערך באופן ידני ב- Phenix (בכרטיסיה עידון) באמצעות המודל, הרצף ונתוני עקיפה כקלט. עיין בעזרה של Phenix כדי לבחור את האסטרטגיה הנכונה.
- לאחר עידון, בדוק אתהתוצאות: R חינםועבודה R חייב להקטין, Molprobity51 אינדיקטורים חייב להיות מכובד, וחריגים עם מתאם שטח אמיתי נמוך חייב להיות מוגבל.
- חזור על שלבים 5.3.2-5.3.4 עד להפקת הדגם המעודן הטוב ביותר.
- הפעל Molprobity בשרת: http://molprobity.biochem.duke.edu/. בדוק את כל החריגים שזוהו על ידי Molprobity.
- בסופו של דבר חזור על שלבים 5.3.2-5.3.6 עד לקבלת הדגם המעודן הטוב ביותר.
תוצאות
כדי ללמוד ניתק dodecamer אפשרי לתוך מונומרים ב TmPep1050, שלו-60 ו שלו-307 codons הוחלפו על ידי אלנין קודון באמצעות גן סינתטי. גן זה שוכפל לאחר מכן בוקטור pBAD עבור ביטוי וטיהור של המשתנה המתאים TmPep1050 לאחר מכן בשם TmPep1050H60A H307A. הכרומטוגרפיה שלהחרגת גודל (איור 3B)הראתה כי לחלבון המטוהר היה משקל מולקולרי לכאורה של 56 kDa (משקל מולקולרי של המונומר הוא 36.0 kDa). משקל מולקולרי דומה לכאורה, 52 kDa, דווח עבור TmPep1050 dimer11. לפיכך, המצב האוליגומרי של TmPep1050H60A H307A יכול להיות להסיק כעמום. לגבי הפעילות הספציפית שלה, TmPep1050H60A H307A היה פעיל לחלוטין על L-Leu-pNA כמצע, אפילו בנוכחות של יונים קובלט. תוצאה זו מצביעה על כך שהגרסאות אינן יכולות לאגד יונים מתכתיים.
מצב ההתגבשות של TmPep1050H60A H307A היה אופטימיזציה על ידי ריכוז pH משתנה לעומת PEG (איור 4) סביב המצב של dimer (כלומר, 0.1 M נתרן ציטראט pH 6.0 10% PEG3350). הגבישים הטובים ביותר של TmPep1050H60A H307A הושגו ב 0.1 M נתרן ציטראט pH 5.2 20% PEG3350 עם מחזור אחד של microseeding לשיפור monocrystallinity. סט נתונים מלא נאסף ב- Proxima 2 קו הקרן (סוליי synchrotron) ברזולוציה 2.36 Å(טבלה 1). יצירת אינדקס נתונים הראתה כי קבוצת החלל של גבישH307A H60A H60A TmPep1050 הוא C222 1 אך XDS הציעפתרון אחר, קבוצת החלל mP (ראה איור 5). לפי "חסר טעם", הסבירות של קבוצות חלל C2221 ו-P21 הייתה 0.711 ו-0.149, בהתאמה. על פי ניתוח איכות הנתונים, שני מונומרים נמצאים ביחידה האסימטרית. הניתוח על ידי Xtriage גילה כי סט הנתונים הוא כנראה התאום אבל twinning ב C2221 קבוצת החלל הוא לאסביר 52. Twinning נובע אנומליה צמיחה גביש שבו מספר תחומים מובהקים יש כמה כיווני סריג שלהם מקבילים זה לזה53. Twinning עשוי גם לנבוע סימטריית גביש גבוהה יותר, המציין יצירת אינדקס נתונים לא נכון. לפיכך, תאום פסאודו-merohedral עשוי להתקיים כך סריג גביש P21 נראה כמו C2221. לאחר מכן, קבוצת הנתונים הייתה באינדקס בקבוצת החלל P21 ונבדקה בתחליף מולקולרי. ניתוח Xtriage של סט הנתונים באינדקס P21 גילה תאום פסאודו-merohedral בעקבות חוק תאום h, -k, -h-l.
באמצעות הקואורדינטות של מונומר מ- Dodecameric TmPep1050 (קוד PDB 4P6Y), נמצא פתרון החלפה מולקולרית עבור סט הנתונים באינדקס P2 1 בלבד, עםציון TFZ של 28.9. לכן, נתוני ההתפלה טופלו כסט נתונים טווין לבניית מודל. כדי למזער את ההטיה של החלפה מולקולרית, נבנה דגם ראשון באמצעות phenix.autobuild54,55. המבנה של TmPep1050H60A H307A הושלם לאחר מספר מחזורים של עידון אוטומטי וידני בPhenix ו Coot(טבלה 1 ואיור 6A). המבנה אישר את המצב אוליגומרי עם משטח ממשק של 1,710 Å2 בין שני מונומרים ו Ic i Gשל-16.2 ק"למול -1 כפי שחושב על ידי PDBe Pisa56. לשם השוואה, משטחהממשק ו-300 tmPep10502-mer הם 1,673 Å2 ו-16.7ק"ל מול -1, בהתאמה.
המבנה של TmPep1050H60A H307A דומה מאוד למבנה דימר מסוג פראי עם RMS של 0.774 Å בעת יישור. חשוב לציין, אותם שינויים מבניים נצפו בשני המבנים: גמישות גבוהה של α8 ו α10 helices, אתר פעיל מופרע Gln-196-Val-202, ועקירת Lys-229-Ala-235 ו Lys-247-Ser 254. שינויים אלה היו מתואמים בעבר עם המכשול של היווצרות dodecamer בהיעדר cofactor מתכת שלה11. שתי המוטציות של שלו-60 ו-307 שלו, לעומת זאת, השפיעו קלות על שרשראות הצד של Asp-168 ו-Asp-62. נראה שהם היו נעולים בהתאמה שונה מהדמר הפראי(איור 6B). ה-Asp-168 carboxylate מסתובב ב-40 מעלות בשל היעדרם של ה-60 וה-307 שלו. לכן שני שאריות היסטידין חשובים למיקום קרבוקסילאט Asp-168 כראוי עבור גישור שני יונים מתכת. השרשרת הצדדית Asp-62 היא מונחה לכיוון Glu-18 carboxylate, מחוץ לאתר קטלאטי. Asp-62 עשוי להיות תפקיד חשוב בקליזה כפי שהוא הניח לווסת pKa של שלו-60, ובכך, להשפיע על מתכת יון כריכה באתר M2. בנוסף, זה יכול להיות מעורב מבחינה מבנית בייצוב האתר הקטליטי על כריכת יון מתכת, העדפת היווצרות של dodecamer.

איור 1: ייצוג סכמטי של TM_1050 ORF שוכפל לוקטור PBAD על-ידי שילוב הומולוגי.
ORF הוא מוקף על ידי שני רצפי 30 bp הומולוגי לסוף רע היזם ואת הרצף במעלה הזרם Pmeאני הגבלת אתר. לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.
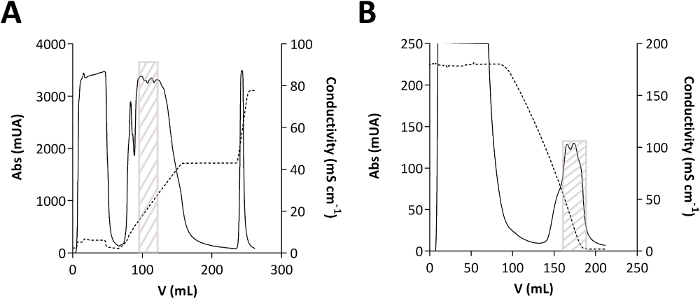
איור 2: כרומטוגרמות של טיהור TmPep1050.
(א)כרומטוגרפיה חילופי אניון. (ב)כרומטוגרפיה של אינטראקציה הידרופובית. הספיגה (Abs), המתבטאת במילי יחידות של ספיגה (mUA), מוצגת בשורה פשוטה. מוליכות, המובעת ב- mScm -1, מוצגת בקו מקווקו. התיבה האפורה מציינת היכן TmPep1050 חומק על הכרומטוגרמות. לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.

איור 3: הכרומטוגרפיה של (A) TmPep1050 dodecamer, (ב) TmPep1050H60A H307Aו- (ג) TmPep1050H60A.
הדגימות נותחו באמצעות שרף SEC ארוז בעמודה 120 מ"ל. ספיגה (Abs) באה לידי ביטוי במילי יחידות של ספיגה (mUA). (D)כיול עמודת ה-SEC באמצעות ת'ירוגלובולין (T), פריטין (F), אלדולאז (Ald), קון(ג) ואלבומין (Alb) כסטנדרטים. המתאם בין הלוגאריתם של המסה היחסית לבין אמצעי האחסון של ההתנתקות הוא ליניארי, עם R2 של 0.91. מרווחי הביטחון של 95% מיוצגים כנקודות. לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.

איור 4: אופטימיזציה של התגבשותTmPep1050 H60A H307A.
(א)אסטרטגיית האופטימיזציה הראשונה מורכבת מ- pH משתנה (בין 4.5 ל- 6.0) לעומת ריכוז PEG3350 (בין 5% ל-25%). צלחת התגבשות היא chematized, ואת הבארות מקודדות בצבע: אדום עבור משקעים, צהוב עבור polycrystals, וירוק עבור monocrystals. (ב)אסטרטגיית האופטימיזציה השנייה כוללת שימוש בזרעים מדוללים פי 25 עם וריאציה צרה יותר של pH לעומת PEG3350. (ג)צורה וגודל גביש לפני (תמונה עליונה) ואחרי (תמונה נמוכה) מיטוב התגבשות microseeding. לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.

איור 5: קטעים מתוך פלט יומן הרישום CORRECT. LP של יצירת אינדקס נתונים TmPep1050H60A H307A על-ידי XDS.
הפאנל העליון, lattices Bravais אפשרי, הסביר ביותר להיות mC, mP, ו oC. לוח אמצעי, סטטיסטיקה כוללת של נתונים באינדקס C2221 קבוצת רווח. לוח תחתון, סטטיסטיקה כוללת של נתונים באינדקס בקבוצת רווח P21. לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.

איור 6: מבנה TmPep1050H60A H307A.
(A) יישור מבני של יחידת משנה של TmPep1050H60A H307A (אדום, קוד PDB 5NE9) לעומת יחידת משנה של dodecamer (לבן, קוד PDB 6NW5) ו- יחידת משנה עמומה יותר (כחול, קוד PDB 5NE6). החצים מצביעים על ההבדלים המבניים בין dodecamers ועמומים. (ב)תקריב של אתר פעיל TmPep1050H60A H307A (אדום) בהשוואה לאתר הפעיל של TmPep1050 dimer (כחול) ו- dodecamer (לבן). לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.
| TmPep1050H60A H307A | |
| איסוף נתונים | |
| טמפרטורת (K) | 100 |
| מקור קרינה | סוליי פרוקסימה 2 |
| אורך גל (Å) | 0.9801 |
| גלאי | דטריס אייגר X 9M |
| טווח תנודות (°) | 0.1 |
| זמן חשיפה (ים) | 0.025 |
| קבוצת רווח | P 1 211 1 |
| פרמטרים של תא יחידה | |
| α, β, γ (°) | 90.00, 110.69, 90.00 |
| a, b, c (Å) | 43.24, 137.79, 61.11 |
| ברזולוציה | 43.99 – 2.37 (2.52-2.37) |
| השתקפויות ייחודיות | 26.902 |
| רמרג',מה(%) | 0.14 |
| יתירות | 6,815 |
| 8.64 (2.12) | |
| שלמות (%) | 99.6 (97.9) |
| CC1/2 (%) | 99.2 (84.1) |
| עידון | |
| ברזולוציה | 43.99 – 2.37 |
| השתקפויות | 26.9 |
| Rספירת בדיקה של סט חינם | 1345 |
| Rעבודה/ Rחינם | 0.206/0.234 |
| מולקולות חלבון לכל ASU | 2 |
| VM (Å3/Da) | 2.37 |
| תוכן ממס (%) | 49.0 |
| אטומי חלבון/ממס | 4,559/96 |
| אורכי .m"ח ר.ס.ד. (Å) | 0.31 |
| זוויות .m"ח ר.ס.ד(°) | 0.51 |
| ממוצע B-גורמים (Å2) | 57.0 |
| מועדף/אסור ראמאצ'φ/ψ (%) | 95.02 / 0.17 |
| חוק התאומים | h, -k, -h-L |
| קוד PDB | 5NE9 (10) |
טבלה 1: סטטיסטיקת איסוף נתונים ועידון. ערכים בסוגריים הם עבור המעטפת ברזולוציה הגבוהה ביותר.
Discussion
הפרוטוקול המתואר בזאת מאפשר הבנת המעבר של דמר-dodecamer של TmPep1050 ברמה המבנית. המתודולוגיה מנוסה בעבר לקביעת המבנה של שני TmPep1050 אוליגומרים11. הצעד המאתגר ביותר היה למצוא תנאים המקדמים את הניתקות של dodecamers לעמומים יציבים. תנאים כאלה היו צריכים להיות קלים מספיק כדי לאפשר שיוך מחדש של דימרים לתוך dodecamers כאשר cofactor יון מתכת נוספה. ההפרדה של אוליגומרים היה גם צעד קריטי כפי שהוא תנאי מחקרים מבניים אפיון ביוכימי נוסף (למשל, לימוד ההתרועעות dodecamer במינונים שונים של Co2+). ההחלפה המולקולרית, שיטה מוכחת לקביעת שלב, שימשה לפתרון המבנים של אוליגומרים TmPep1050 וגרסאותיו. הפרוטוקול המוצע עשוי להיות מותאם לחקר אנזימי מטאלו אחרים שמדינות האוליגומריזציה שלהם תלויות בזמינות של התורמים המתכתיים שלהם.
כדי להמחיש את הפרוטוקול, הוצג מקרה של מחקר, TmPep1050H60A H307A שאתרי כריכת המתכת שלו נפגעו על ידי מוטציה שלו-60 ו שלו-307 אלנין. שאריות אלה מקשרות את Co2+ באתרי M2 ו- M1, בהתאמה. התערבות בכריכת מתכת יכלה להוביל למצב האוליגומריזציה ולהוביל לניתוח מוחלט של מונומרים. עדויות לתופעה כזו דווחו עבור PhTET2 ו-PfTET3, שני m42 aminopeptidases מ P. horikoshii ו P. furiosus,בהתאמה 24,29. TmPep1050H60A H307A לא התנהג כצפוי כמו גרסה זו נוצרה דימרים בלבד. המבנה שלו הראה את אותם שינויים כמו דימר מסוג פראי אבל עם שני יוצאים מן הכלל קטנים. ואכן, הרשתות הצדדיות של Asp-168 ו-Asp-62 נראו נעולות בכיוון לא קונבנציונלי המונע את ייצוב האתר הפעיל. נראה כי הנטייה שלהם נכפתה על ידי ה-60 וה-307 שלו, כיוון ששינויים כאלה לא נצפו בגרסאות המוטציה של נקודה אחת.
Disclosures
לסופרים אין מה לחשוף.
Acknowledgements
אנו מודים למרטין רובר על הגהה של המאמר הזה ועל מתן הערות מועילות. הגישה לקו הקרן של Proxima 2 (SOLEIL synchrotron) הייתה בתוך קבוצות הקצאת בלוקים 20151139.
Materials
| Name | Company | Catalog Number | Comments |
| 1,10-phenanthroline | Sigma-Aldrich | 13, 137-7 | |
| Amicon Ultra 0.5 ml Centrifugal Filters Ultracel 30K | Merck Millipore | UFC503096 | |
| Amicon Ultra 15 Centrifugal Filters Ultracel 30K | Merck Millipore | UFC903024 | |
| Benzonase Nuclease | Merck Millipore | 70664-3 | |
| CCP4 | N/A | visit http://www.ccp4.ac.uk/ | |
| cOmplete EDTA-free | Roche | 5056489001 | |
| Coot | N/A | visit https://www2.mrc-lmb.cam.ac.uk/personal/pemsley/coot/ | |
| Crystal Screen I | Hampton Research | HR2-110 | |
| Crystal Screen II | Hampton Research | HR2-112 | |
| DreamTaq Green PCR Master Mix | ThermoFisher Scientific | K1082 | |
| EasyXtal 15-well tool | NeXtal | 132007 | |
| Escherichia coli PPY strain | N/A | see reference 31 | |
| Escherichia coli XL1 blue strain | Agilent | 200249 | |
| Gel Filtration Calibration Kit HMW | GE Healthcare Life Sciences | 28-4038-42 | |
| Gel Filtration Calibration Kit LMW | GE Healthcare Life Sciences | 28-4038-41 | |
| Gel Filtration Standard | Biorad | 1511901 | |
| GeneJET Plasmid Miniprep Kit | ThermoFisher Scientific | K0503 | |
| Index | Hampton Research | HR2-144 | |
| Litholoops | Molecular Dimensions | ||
| L-leucine-p-nitroanilide | Bachem AG | 40010720025 | |
| Natrix 1 | Hampton Research | HR2-116 | |
| Natrix 2 | Hampton Research | HR2-117 | |
| Neggia plugin | Dectris | N/A | visit https://www.dectris.com/ |
| NeXtal Tubes JCSG Core Suite I | NeXtal | 130724 | |
| NeXtal Tubes JCSG Core Suite II | NeXtal | 130725 | |
| NeXtal Tubes JCSG Core Suite III | NeXtal | 130726 | |
| NeXtal Tubes JCSG Core Suite IV | NeXtal | 130727 | |
| pBAD-TOPO | ThermoFisher Scientific | K430001 | |
| Phenix | N/A | visit https://www.phenix-online.org/ | |
| Phusion High-Fidelity DNA polymerase | ThermoFisher Scientific | F-530L | |
| Salt RX 1 | Hampton Research | HR2-107 | |
| Salt RX 2 | Hampton Research | HR2-109 | |
| SnakeSkin Dialysis Tubing, 3.5K MWCO | ThermoFisher Scientific | 88242 | |
| Source 15Phe | GE Healthcare Life Sciences | 17014702 | |
| Source 15Q | GE Healthcare Life Sciences | 17094705 | |
| Superdex 200 prep grade | GE Healthcare Life Sciences | 17104301 | |
| Thermotoga maritima MSB8 strain | American Type Culture Collection | ATCC 43589 | |
| TmCD00089984 | DNASU Plasmid Repository | N/A | |
| XDS | N/A | visit http://xds.mpimf-heidelberg.mpg.de/ | |
| xdsme | N/A | visit https://github.com/legrandp/xdsme |
References
- Levy, E. D., Teichmann, S. A. Structural, Evolutionary, and Assembly Principles of Protein Oligomerization. Progress in Molecular Biology and Translational Science. 117, 25-51 (2013).
- Selwood, T., Jaffe, E. K. Dynamic dissociating homo-oligomers and the control of protein function. Archives of Biochemistry and Biophysics. 519 (2), 131-143 (2012).
- Jaffe, E. K. The Remarkable Character of Porphobilinogen Synthase. Accounts of Chemical Research. 49 (11), 2509-2517 (2016).
- Ramström, H., et al. Properties and Regulation of the Bifunctional Enzyme HPr Kinase/Phosphatase in Bacillus subtilis. Journal of Biological Chemistry. 278 (2), 1174-1185 (2003).
- Rudyak, S. G., Brenowitz, M., Shrader, T. E. Mg2+-Linked Oligomerization Modulates the Catalytic Activiy of the Lon (La) Protease from Mycobacterium smegmatis. Biochemistry. 40 (31), 9317-9323 (2001).
- Yamamoto, S., Storey, K. B. Dissociation-Association of lactate dehydrogenase Isozymes: Influences on the formation of tetramers vs. dimers of M4-LDH and H4-LDH. International Journal of Biochemistry. 20 (11), 1261-1265 (1988).
- Sirover, M. A. Structural analysis of glyceraldehyde-3-phosphate dehydrogenase functional diversity. The International Journal of Biochemistry & Cell Biology. 57, 20-26 (2014).
- Gupta, V., Bamezai, R. N. K. Human pyruvate kinase M2: A multifunctional protein: Multifunctional Human PKM2. Protein Science. 19 (11), 2031-2044 (2010).
- Wiegand, G., Remington, S. J. Citrate synthase: Structure, Control, and Mechanism. Annual Review of Biophysics and Biophysical Chemistry. 15, 97-117 (1986).
- Libonati, M., Gotte, G. Oligomerization of bovine ribonuclease A: structural and functional features of its multimers. Biochemical Journal. 380 (2), 311-327 (2004).
- Dutoit, R., et al. How metal cofactors drive dimer-dodecamer transition of the M42 aminopeptidase TmPep1050 of Thermotoga maritima. Journal of Biological Chemistry. 294 (47), 17777-17789 (2019).
- Rawlings, N. D., et al. The MEROPS database of proteolytic enzymes, their substrates and inhibitors in 2017 and a comparison with peptidases in the PANTHER database. Nucleic Acids Research. 46 (1), 624-632 (2018).
- Neuwald, A. F., Liu, J. S., Lipman, D. J., Lawrence, C. E. Extracting protein alignment models from the sequence database. Nucleic Acids Research. 25 (9), 1665-1677 (1997).
- Dutoit, R., Brandt, N., Legrain, C., Bauvois, C. Functional Characterization of Two M42 Aminopeptidases Erroneously Annotated as Cellulases. PLoS ONE. 7 (11), 50639(2012).
- Franzetti, B., et al. Tetrahedral aminopeptidase: a novel large protease complex from archaea. The EMBO Journal. 21 (9), 2132-2138 (2002).
- Borissenko, L., Groll, M. Crystal Structure of TET Protease Reveals Complementary Protein Degradation Pathways in Prokaryotes. Journal of Molecular Biology. 346 (5), 1207-1219 (2005).
- Appolaire, A., et al. TET peptidases: A family of tetrahedral complexes conserved in prokaryotes. Biochimie. 122, 188-196 (2016).
- Russo, S., Baumann, U. Crystal Structure of a Dodecameric Tetrahedral-shaped Aminopeptidase. Journal of Biological Chemistry. 279 (49), 51275-51281 (2004).
- Schoehn, G., et al. An Archaeal Peptidase Assembles into Two Different Quaternary Structures: A tetrahedron and a giant octahedron. Journal of Biological Chemistry. 281 (47), 36327-36337 (2006).
- Durá, M. A., et al. The structural and biochemical characterizations of a novel TET peptidase complex from Pyrococcus horikoshii reveal an integrated peptide degradation system in hyperthermophilic Archaea: Characterization of P. horikoshii TET3 peptidase. Molecular Microbiology. 72 (1), 26-40 (2009).
- Basbous, H., Appolaire, A., Girard, E., Franzetti, B. Characterization of a Glycyl-Specific TET Aminopeptidase Complex from Pyrococcus horikoshii. Journal of Bacteriology. 200 (17), 00059(2018).
- Appolaire, A., et al. Small-angle neutron scattering reveals the assembly mode and oligomeric architecture of TET, a large, dodecameric aminopeptidase. Acta Crystallographica Section D Biological Crystallography. 70 (11), 2983-2993 (2014).
- Appolaire, A., et al. The TET2 and TET3 aminopeptidases from P yrococcus horikoshii form a hetero-subunit peptidasome with enhanced peptide destruction properties: TET aminopeptidase multi-subunit complex. Molecular Microbiology. 94 (4), 803-814 (2014).
- Colombo, M., Girard, E., Franzetti, B. Tuned by metals: the TET peptidase activity is controlled by 3 metal binding sites. Scientific Reports. 6 (1), 20876(2016).
- Petrova, T. E., et al. Structure of the dodecamer of the aminopeptidase APDkam598 from the archaeon Desulfurococcus kamchatkensis. Acta Crystallographica Section F Structural Biology Communications. 71 (3), 277-285 (2015).
- Kim, D., et al. Structural basis for the substrate specificity of PepA from Streptococcus pneumoniae, a dodecameric tetrahedral protease. Biochemical and Biophysical Research Communications. 391 (1), 431-436 (2010).
- Chevrier, B., et al. Crystal structure of Aeromonas proteolytica aminopeptidase: a prototypical member of the co-catalytic zinc enzyme family. Structure. 2, 283-291 (1994).
- Rosenbaum, E., Ferruit, M., Durá, M. A., Franzetti, B. Studies on the parameters controlling the stability of the TET peptidase superstructure from Pyrococcus horikoshii revealed a crucial role of pH and catalytic metals in the oligomerization process. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics. 1814 (10), 1289-1294 (2011).
- Macek, P., et al. Unraveling self-assembly pathways of the 468-kDa proteolytic machine TET2. Science Advances. 3 (4), 1601601(2017).
- Edelheit, O., Hanukoglu, A., Hanukoglu, I. Simple and efficient site-directed mutagenesis using two single-primer reactions in parallel to generate mutants for protein structure-function studies. BMC Biotechnology. 9 (1), 61(2009).
- Zhang, Y., Werling, U., Edelmann, W. SLiCE: a novel bacterial cell extract-based DNA cloning method. Nucleic Acids Research. 40 (8), 55(2012).
- Schleif, R. AraC protein, regulation of the l-arabinose operon in Escherichia coli, and the light switch mechanism of AraC action. FEMS Microbiology Reviews. 34 (5), 779-796 (2010).
- McPherson, A., Gavira, J. A. Introduction to protein crystallization. Acta Crystallographica Section F Structural Biology Communications. 70 (1), 2-20 (2014).
- Bergfors, T. Seeds to crystals. Journal of Structural Biology. 142 (1), 66-76 (2003).
- Dauter, Z. Collection of X-Ray Diffraction Data from Macromolecular Crystals. Protein Crystallography. 1607, 165-184 (2017).
- Powell, H. R. X-ray data processing. Bioscience Reports. 37 (5), 0227(2017).
- Battye, T. G. G., Kontogiannis, L., Johnson, O., Powell, H. R., Leslie, A. G. W. iMOSFLM a new graphical interface for diffraction-image processing with MOSFLM. Acta Crystallographica Section D Biological Crystallography. 67 (4), 271-281 (2011).
- Otwinowski, Z., Minor, W. Processing of X-ray diffraction data collected in oscillation mode. Methods in Enzymology. 276, 307-326 (1997).
- Clabbers, M. T. B., Gruene, T., Parkhurst, J. M., Abrahams, J. P., Waterman, D. G. Electron diffraction data processing with DIALS. Acta Crystallographica Section D Structural Biology. 74 (6), 506-518 (2018).
- Kabsch, W. XDS. Acta Crystallographica Section D Biological Crystallography. 66 (2), 125-132 (2010).
- Legrand, P. legrandp/xdsme: March 2019 version working with the latest XDS version. , Jan 26, 2018. Zenodo (2019).
- Evans, P. Scaling and assessment of data quality. Acta Crystallographica Section D Biological Crystallography. 62 (1), 72-82 (2006).
- Wlodawer, A., Minor, W., Dauter, Z., Jaskolski, M. Protein crystallography for non-crystallographers, or how to get the best (but not more) from published macromolecular structures: Protein crystallography for non-crystallographers. FEBS Journal. 275 (1), 1-21 (2008).
- Karplus, P. A., Diederichs, K. Assessing and maximizing data quality in macromolecular crystallography. Current Opinion in Structural Biology. 34, 60-68 (2015).
- Taylor, G. L. Introduction to phasing. Acta Crystallographica Section D Biological Crystallography. 66 (4), 325-338 (2010).
- Rossmann, M. G., Blow, D. M. The detection of sub-units within the crystallographic asymmetric unit. Acta Crystallographica. 15, 24-31 (1962).
- Rossmann, M. G. The molecular replacement method. Acta Crystallographica Section A Foundations of Crystallography. 46 (2), 73-82 (1990).
- McCoy, A. J., et al. Phaser crystallographic software. Journal of Applied Crystallography. 40 (4), 658-674 (2007).
- Adams, P. D., et al. PHENIX: a comprehensive Python-based system for macromolecular structure solution. Acta Crystallographica Section D Biological Crystallography. 66 (2), 213-221 (2010).
- Emsley, P., Lohkamp, B., Scott, W. G., Cowtan, K. Features and development of Coot. Acta Crystallographica Section D Biological Crystallography. 66 (4), 486-501 (2010).
- Chen, V. B., et al. MolProbity: all-atom structure validation for macromolecular crystallography. Acta Crystallographica Section D Biological Crystallography. 66 (1), 12-21 (2010).
- Zwart, P. H., Grosse-Kunstleve, R. W., Lebedev, A. A., Murshudov, G. N., Adams, P. D. Surprises and pitfalls arising from (pseudo)symmetry. Acta Crystallographica Section D Biological Crystallography. 64 (1), 99-107 (2008).
- Yeates, T. O. Detecting and overcoming crystal twinning. Methods in Enzymology. 276, 344-358 (1997).
- Terwilliger, T. C. Using prime-and-switch phasing to reduce model bias in molecular replacement. Acta Crystallographica Section D Biological Crystallography. 60 (12), 2144-2149 (2004).
- Terwilliger, T. C., et al. Iterative model building, structure refinement and density modification with the PHENIX AutoBuild wizard. Acta Crystallographica Section D Biological Crystallography. 64 (1), 61-69 (2008).
- Krissinel, E., Henrick, K. Inference of Macromolecular Assemblies from Crystalline State. Journal of Molecular Biology. 372 (3), 774-797 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved