Method Article
التصوير البلوري بالأشعة السينية لدراسة انتقال الدولة أوليغومريك من Thermotoga maritima M42 أمينوببتيداسي TmPep1050
In This Article
Summary
وقد تم تطوير هذا البروتوكول لدراسة التحول dimer-dodecamer من TmPep1050، M42 aminopeptidase، على المستوى الهيكلي. وهو خط أنابيب مباشر يبدأ من تنقية البروتين إلى معالجة بيانات الأشعة السينية. وقد تم التأكيد على كريستالودينسيس، فهرسة مجموعة البيانات، واستبدال الجزيئية من خلال حالة من الدراسة، TmPep1050H60A H307A البديل.
Abstract
تشكل M42 aminopeptidases مجمعات نشطة وظيفيًا مصنوعة من 12 وحدة فرعية. ويبدو أن عملية التجميع الخاصة بهم تخضع للتنظيم من قبل العوامل المساعدة في أيونات المعادن مما يؤدي إلى انتقال أكثر ظُنًا. عند ربط أيونات المعادن، تحدث عدة تعديلات هيكلية في الموقع النشط وعلى واجهة التفاعل، وتشكيل الخافتات لتعزيز التجمع الذاتي. ولمراقبة هذه التعديلات، يجب عزل القلة المستقرة قبل إجراء دراسة هيكلية. ذكرت هنا هو الأسلوب الذي يسمح لتنقية dodecamers مستقرة وdamers من TmPep1050, M42 aminopeptidase من T. maritima, وتحديد هيكلها بواسطة التصوير البلوري بالأشعة السينية. تم إعداد الديممرات من dodecamers عن طريق إزالة الأيونات المعدنية مع عامل chelating. دون عاملهم المساعد، أصبحت dodecamers أقل استقرارا وتم فصلها تماما عند التدفئة. تم حل الهياكل القلة من خلال نهج الاستبدال الجزيئي المباشر. لتوضيح المنهجية ، يتم عرض هيكل متغير TmPep1050 ، ضعيف تمامًا في ربط الأيونات المعدنية ، يظهر عدم وجود مزيد من الأعطال من الخافضات إلى مونومرات.
Introduction
10- التنشئة القلائية هي عملية سائدة تملي الوظائف البيولوجية للعديد من البروتينات. في الإشريكية القولونية، ويقدر أن 35٪ فقط من البروتينات هيأحادية 1. بعض البروتينات، ودعا morpheeins، يمكن أن تعتمد حتى العديد من الدول القلة مع وحدات فرعية وجود بنية متميزة في كل دولة أوليغومريك2. الانتقال بين حالاتهم القلة غالبا ما يعني تنظيم نشاط البروتين حيث أن كل ولاية من الدول القلة قد يكون لها نشاط أو وظيفة مختلفة محددة. وقد تم توثيق العديد من الأمثلة على morpheeins جيدا في الأدب ، لا سيما في الporphobilinogen synthase3, HPr kinase /phosphatase4, لون بروتياز5, لاكتات dehydrogenase6, الجلسرينالدهيدي -3-الفوسفات dehydrogenase7, بيروفات كيناز8, سيترات synthase9, وpponuclease A10. في الآونة الأخيرة، وصفنا M42 aminopeptidase TmPep1050، مثال آخر من الانزيم مع سلوك مثل مورفيين، الذي يعتمد نشاطه على الدول القلةلها 11. ويتوسط الانتقال بين دولها القلة من قبل العوامل المساعدة المعدنية التي تحفز العديد من التعديلات الهيكلية لالوحدات الفرعية.
تنتمي عائلة M42 aminopeptidase إلى عشيرة MH12,13, ويتم توزيعها على نطاق واسع بين البكتيريا والارشمية14. و M42 aminopeptidases هي إنزيمات دينوكليار حقيقية الببتيدات المهينة تصل إلى 35 بقايا الأحماض الأمينية في طول15. أنها تعتمد على هيكل غريب على شكل رباعي الهيدرون مصنوعة من 12 وحدات فرعية مع مواقعهم النشطة الموجهة نحو تجويف داخلي. وكثيرا ما يوصف مثل هذا الترتيب بأنه تقسيم نانو للنشاط لتجنب انحلال البروتيل غير المنضبط. قد تكون مرتبطة الوظيفة الفسيولوجية من أمينوببتيداسيس M42 مع البروتيم، الببتيدات التحلل الناجمة عن تدهور البروتين16،17. Pyrococcus horikoshii تمتلك أربعة M42 أمينوببتيداسيس، كل عرض خصوصيات متميزة ولكن متكاملة18,19,20,21. فريد, وقد وصفت هيتيروكوميكس مصنوعة من نوعين مختلفين من الوحدات الفرعية في p. horikoshii, مما يشير إلى وجود مجمعات ببتيداسوم22,23.
وقد وصفت عدة هياكل من M42 أمينوببتيداسيس في الأدب11،16،18،19،20،24،25،26. وتتألف هذه الunit من مجالين مختلفين، مجال حفاز ومجال اتم. المجال الحفاز يعتمد α المشتركة / β أضعاف محفوظة في عشيرة MH كله، والمجال الحفاز الأركيولوجية يجري أمينوببتيداز Ap1 من فيبريو proteolyticus27. يعتمد المجال الديمّر طية تشبه PDZ16 وقد يكون لها دور في oligomerization ، بالإضافة إلى دورها في التحكم في الوصول الركازة والتجليد في التجويف الداخلي11. كما اللبنة الأساسية هو أكثر خافة، وغالبا ما يوصف dodecamer بأنها رابطة من ستة خافمات، كل خافض يجري وضعها في كل حافة من tetrahedron16. يعتمد احتكار أعضاء M42 aminopeptidases على توافر العوامل المساعدة المعدنية. أيونات المعادن المبرومة، وغالباً ما زن2 + وCo2+، وتشارك بشكل تحفيزي في الربط الببتيد والتحلل المائي. وهي موجودة في موقعين مختلفين للربط، وهما موقعي M1 و M2. أيونات معدنية اثنين أيضا محرك وصقل االتائح كما هو موضح لPhTET2، PhTET3، PfTET3، وTmPep105011،24،28،29. عندما تنضب العوامل المساعدة المعدنية، وdedecamer تفكيك في العتيمات، كما هو الحال في PhTET2، PhTET3، وTmPep105011،16،28، أو حتى مونومرات، كما هو الحال في PhTET2 وPfteT324،29.
هنا هو بروتوكول يستخدم لدراسة هياكل oligomers TmPep1050. هذا البروتوكول هو مجموعة من الطرق الشائعة بما في ذلك تنقية البروتين، وفحص نشاط البروتيوليك، والتبلور، وانعراج الأشعة السينية، والاستبدال الجزيئي. وأكد على الدقة الكامنة في التعامل مع metalloenzymes، oligomerization البروتين، وبلورة البروتين واستبدال الجزيئية. كما يتم عرض حالة من الدراسة لإظهار ما إذا كان dodecamers TmPep1050 قد تتفكك إلى مونومرات أم لا. لمعالجة هذا السؤال، تم دراسة متغير TmPep1050، TmPep1050H60A H307A، مواقع ربط المعادن التي تضعف من قبل تحور له -60 (موقع M2) وه - 307 (موقع M1) إلى بقايا علاء. قد يتم استيعاب هذا البروتوكول لدراسة أخرى M42 أمينوببتيداسيس أو أي metalloenzymes مع سلوك مثل morpheein.
Protocol
1. إنتاج وتنقية من TmPep1050 المؤتلف
ملاحظة: ويرد أدناه وصف إجراء الاستنساخ وتنقية من نوع البرية TmPep1050 مقتبس من دراسة سابقة11. وبدلاً من ذلك، يمكن إجراء الاستنساخ باستخدام جين اصطناعي. لتوليد المتغيرات TmPep1050، يمكن تنفيذ الطفرات الموقع الموجهة التالية، على سبيل المثال، ردود الفعل التمهيدي واحد في بروتوكول مواز (SPRINP) الأسلوب30. ويمكن استخدام بروتوكول تنقية لمتغيرات TmPep1050. وينبغي تجنب استخدام العلامة له كما يتداخل مع ربط أيون المعادن.
- تصميم متجه التعبير
- الحصول على الحمض النووي الجينومي من Thermotoga maritima MSB8 (ATCC 43589) أو TmCD00089984 (المركز المشترك للجينوم الهيكلي).
- تضخيم TM_1050 إطار القراءة المفتوحة (ORF) باستخدام إما الحمض النووي الجينومي أو قالب plasmid، بوليميراز حمض نووي عالي الدقة، والشعبيات التالية: ocej419 (5'- TTTAACTTTAGAGAGATGATATACATGAGAGAGAACTAAGCTG) وocej420 (5'- ATCCGCCAAAAAAAAGGGGGGAGAGACCCCCCACCACCACTTGATGAG). تشغيل تفاعل البوليميراز سلسلة (PCR) فحص وفقا للمخطط التالي: 5 دقيقة في 95 درجة مئوية، 30 دورات من 3 خطوات (30 s في 95 درجة مئوية، 30 s في 55 درجة مئوية، 90 s في 72 °C)، و 10 دقيقة في 72 °C كخطوة نهائية.
- استنساخ جزء PCR في ناقل تعبير مناسب (جدول المواد) بواسطة إعادة التركيب المتماثل(الشكل 1)في الإشريكية القولونية وفقا لبروتوكول SLiCE31. إلى 50 نانوغرام من المتجه الخطي، إضافة جزء PCR في نسبة 10:1 من الشظايا إلى المتجه، 1 ميكرولتر من استخراج سلالة PPY، 50 mM تريس-HCl درجة ح H 7.5، 100 mM MgCl2،10 mM ATP، و 10 mM dithiothrel (DTT) لحجم تفاعل 10 ميكرولتر. Incubate لمدة 1 ساعة عند 37 درجة مئوية.
- تحويل مؤهل كيميائيا E. القولونية XL1 سلالة زرقاء (أو أي recA- سلالة مناسبة) مع 1 ميكرولتر من رد فعل إعادة الكومبينيشن. لوحة الخلايا على متوسطة LB تحتوي على 100 ميكروغرام / مل أمبيسيلين. احتضان لوحات بين عشية وضحاها في 37 درجة مئوية.
- اختيار المستعمرات على لوحات LB الطازجة مع 100 ميكروغرام / مل أمبيسيلين. احتضان لوحات في 37 درجة مئوية لمدة 8 ساعة على الأقل.
- شاشة للمرشحين إيجابية من قبل PCR مستعمرة باستخدام زوج التمهيدي مناسبة (5'- ATGCCATAGCATTTATTATTATTATCC و 5'- ATTTAATCTGTATCAGGC إذا باستخدام ناقلات الموصى بها المدرجة في جدول المواد). مع نهاية التلميح الصغير، خدش مستعمرة منتقى ونقل الخلايا إلى 20 ميكرولتر من مزيج التفاعل التي تحتوي على 0.5 μM من كل التمهيدي و 10 ميكرولتر من مزيج البوليميراز طق الحمض النووي التجاري.
- تشغيل فحص PCR وفقا للمخطط التالي: 5 دقيقة في 95 درجة مئوية كخطوة denaturation، 30 دورات من 3 خطوات (30 s في 95 °C، 30 s عند 55 °C، 90 s في 72 °C)، و 10 دقيقة في 72 °C كخطوة نهائية.
ملاحظة: يمكن تخزين التفاعلات PCR بين عشية وضحاها في جهاز PCR عند 12 درجة مئوية. - تحميل 10 ميكرولتر من كل تفاعل PCR على 0.8٪ agarose هلام أعدت في تريس-خلات-EDTA (TAE) العازلة. تشغيل الكهرباء لمدة 25 دقيقة في 100 V.
ملاحظة: من المتوقع أن يكون 1.1 كيلو بايت في الثانية. - استخراج البلازميدات من المرشحين باستخدام مجموعة تجارية(جدول المواد)وتسلسل لهم باستخدام نفس زوج التمهيدي المستخدمة في الخطوة 1.1.6.
- استزراع الخلية
ملاحظة: عند تحديد مرشح مناسب من خلال التسلسل، يمكن استخدام المستنسخة مباشرةً كتعبير إذا كان يستخدم المتجه الموصى به(جدول المواد). في هذه الحالة، يتم التحكم في التعبير من قبل المروّج PBAD غير القابل للاختراق32.- تلقيح 10 مل من متوسطة LB تحتوي على 100 ميكروغرام/مل أمبيسيلين مع المرشح وتحتضن الاستزراع المسبق بين عشية وضحاها عند 37 درجة مئوية تحت الهز المداري. إضافة 5 مل من الزراعة المسبقة إلى 1 لتر من LB المتوسطة مع 100 ميكروغرام / مل أمبيسيلين. العقل لاحترام نسبة الهواء إلى السائل من 3.
- اسمحوا الخلايا تنمو في 37 درجة مئوية تحت اهتزاز المداري. مراقبة الكثافة البصرية في 660 نانومتر (OD660).
- عندما تصل660 OD 0.5-0.6، بسرعة تبريد الثقافة لمدة 5 دقائق على الجليد ونقلها إلى حاضنة تعيينها إلى 18 درجة مئوية.
- إضافة 0.2 غرام /L arabinose للحث على التعبير الجيني واحتضان ل12-18 ساعة في 18 درجة مئوية.
- حصاد الخلايا عن طريق الطرد المركزي للثقافة في 6000 س ز لمدة 30 دقيقة في 4 درجة مئوية. تخلص من الخلايا المُتفَجرة و غسلها بـ 100 مل من 0.9% (ث/الخامس) NaCl.
- مرة أخرى في الطرد المركزي 6000 س ز لمدة 15 دقيقة في 4 درجة مئوية والتخلص من الفائق.
ملاحظة: يمكن استخدام كريات الخلايا مباشرة لاستخراج البروتين أو تخزينها في -80 درجة مئوية.
- تنقية البروتين
- Resuspend الكريات الخلية في 40 مل من 50 مل من MOPS، 1 mM CoCl2،pH 7.2. أضف 1 ميكرولتر من 25 U/μL DNA/RNA endonuclease و قرص واحد من كوكتيل مثبطات البروتياز الذي لا يحتوي على EDTA. Sonicate تعليق في وضع نبض تحت التبريد لمدة 30 دقيقة.
- الطرد المركزي استخراج الخام في 20،000 س ز لمدة 30 دقيقة عند 4 درجة مئوية. جمع ناطحة والحرارة في حمام مائي في 70 درجة مئوية لمدة 10 دقيقة.
- الطرد المركزي استخراج الخلية المشوهة في 20،000 س ز لمدة 30 دقيقة في 4 درجة مئوية وجمع افرا من أجل تنقية.
- استخدام مناسبة anion تبادل الراتنج (جدول المواد) معبأة في عمود من ~ 15 مل من حجم. الرجوع إلى توصيات الشركة المصنعة لمعدل تدفق العمل والحد من ضغط العمود. اكويريبرات الراتنج مع 50 MM MOPS، 1 MCl2،pH 7.2.
- تحميل supernatant التي تم جمعها من الخطوة 1.3.3 في العمود. مراقبة امتصاص من الويات في 280 نانومتر. عندما تصل إلى خط الأساس، انتقل إلى elution.
- تطبيق تدرج من 0 إلى 0.5 M NaCl في 50 mM MOPS، 1 mM CoCl2،7.2 pH ل 5 مجلدات العمود (السيرة الذاتية). الانتظار حتى يتم تثبيت الموصلية وامتصاص وصلت إلى خط الأساس.
- تطبيق تدرج النهائي من 0.5 إلى 1 M NaCl في 50 M MOPS، 1 mM CoCl2،7.2 pH ل1 السيرة الذاتية.
- تحليل بعض الكسور (انظر الشكل 2A للحصول على التوجيه) بواسطة الصوديوم دوديسيل كبريتات بولي أكريلاميد هلام الكهرباء (SDS-PAGE).
ملاحظة: TmPep1050 يظهر كـ 36 kDa الفرقة بعد تلطيخ Coomassie. وبدلاً من ذلك، يمكن تأكيد وجود TmPep1050 عن طريق إجراء فحص النشاط (انظر القسم 2-1). في هذه الخطوة، يمكن تخزين الكسور في 4 درجة مئوية بين عشية وضحاها. - تجمع الكسور التي تحتوي على TmPep1050 وإضافة مسحوق الأرض ناعما من (NH4)2SO4 للحصول على تركيز 1.5 M (NH4)2SO4. مزيج بلطف عن طريق عكس أنبوب رأسا على عقب حتى حل كامل.
- استخدام راتنج التفاعل المائية (جدول المواد) معبأة في عمود من ~ 30 مل من حجم. الرجوع إلى توصيات الشركة المصنعة لمعدل تدفق العمل والحد من ضغط العمود. اكويبيل الراتنج مع 50 mM MOPS، 1.5 M (NH4)2SO4، 1 mM CoCl2، pH 7.2.
- تحميل العينة على العمود ورصد امتصاص من eluate في 280 نانومتر. عندما يصل الامتصاص إلى خط الأساس، البروتينات المُقيدة من خلال تطبيق تدرج من 1.5 م إلى 0 M (NH4)2SO4 في 50 mM MOPS، 1 mM CoCl2،pH 7.2 ل 5 السيرة الذاتية.
- تحليل بعض الكسور (انظر الشكل 2B للحصول على التوجيه) من قبل SDS-PAGE.
ملاحظة: TmPep1050 يظهر كـ 36 kDa الفرقة بعد تلطيخ Coomassie. وبدلاً من ذلك، يمكن تأكيد وجود TmPep1050 عن طريق إجراء فحص النشاط (انظر القسم 2-1). في هذه الخطوة، يمكن تخزين الكسور في 4 درجة مئوية بين عشية وضحاها. - تجمع الكسور التي تحتوي على TmPep1050 والتركيز على 2 مل باستخدام وحدات الترشيح الفائق مع 30 كيلو ادا قطع(جدول المواد). انتقل إلى القسم 1.4 لتحديد الوزن الجزيئي.
- حجم استبعاد الكروماتوغرافيا
- استخدام الراتنج استبعاد حجم (جدول المواد) معبأة في عمود من ~ 120 مل من حجم. الرجوع إلى توصيات الشركة المصنعة لمعدل تدفق العمل والحد من ضغط العمود. اكويبيل الراتنج مع 50 mM MOPS، 0.5 M (NH4)2SO4،1 MCL2،pH 7.2.
- تحميل العينة على العمود ورصد امتصاص من eluate في 280 نانومتر. كسور من حجم العمود dead (~0.33 CV) حتى نهاية elution (1 CV).
- قياس حجم elution لكل ذروة لوحظ.
ملاحظة: للحصول على التوجيه، dodecameric TmPep1050 في ~ 82 مل (الشكل 3A) في ظل الظروف التجريبية الحالية، في حين أن dimeric TmPep1050، مثل TmPep1050H60A H307A البديل، elutes في ~ 95 مل (الشكل 3B). بعض TmPep1050 قد تعتمد كلا أشكال القلة ، مثل TmPep1050H60A (الشكل 3C). - تحليل الكسور المقابلة للمكسيم وذيول القمم الملاحظة باستخدام SDS-PAGE.
ملاحظة: TmPep1050 يظهر كـ 36 kDa الفرقة بعد تلطيخ Coomassie. - تجمع الكسور من كل ذروة والتركيز باستخدام وحدات الترشيح الفائق مع قطع 30 كيلو Da(جدول المواد)للحصول على تركيز ~ 300 μM.
- قياس الامتصاص في 280 نانومتر على مقياس طيفي بحجم نانو وحساب التركيز باستخدام معامل الانقراض الجزيئي من 18910 M-1 سم-1.
- تخزين البروتين النقي في -18 درجة مئوية.
- لتحديد الوزن الجزيئي، ومعايرة حجم استبعاد اللوني العمود (SEC) باستخدام معايير الوزن الجزيئية (جدول المواد). تحليل المعايير باستخدام 50 mM MOPS، 0.5 M (NH4)2SO4،1 م م CoCl2 7.2 pH كما المخزن المؤقت قيد التشغيل.
2. تحليل النشاط وإعداد إنزيم apo
ملاحظة: في الأصل، تم إعداد إنزيم أبو عن طريق تخفيف حجم 1 من TmPep1050 في 10 مجلدات من 2.1 M حمض ماليك 7.0 والتركيز مرة أخرى إلى 1 وحدة تخزين قبل غسيل الكلى11. ويرد أدناه إجراء بديل باستخدام 1,10-phenanthroline, chelator أيونات معدنية. هذا الإجراء يقلل من فقدان البروتين ويعطي نفس النتائج من الطريقة التي نشرت سابقا.
- فحص النشاط
- إعداد حل الأسهم من 100 M L-Leucine-ع-النيترويانيلي(جدول المواد)في الميثانول.
- إضافة 25 μL من 100 مل L-Leucine-ف-النيترويانيلي في 965 ميكرولتر من 50 مل م 50 م 2M COCl2،pH 7.2، 10٪ الميثانول. Preincubate مزيج رد الفعل في 75 درجة مئوية في حمام جاف.
- تخفيف الانزيم في 50 mM MOPS درجة ح H 7.2 إلى تركيز 1 μM. إضافة 10 ميكرولتر إلى مزيج التفاعل، دوامة، واحتضان في 75 درجة مئوية إما حتى تحولت مصفر أو ل 1 ساعة.
- وقف رد الفعل بإضافة 1 مل من 20٪ حمض الخليك. دوامة جيدا والسماح لها تبرد إلى درجة حرارة الغرفة.
- نقل مزيج التفاعل في خلية مقياس الطيف. قراءة امتصاص في 410 نانومتر ضد السيطرة السلبية (مزيج التفاعل المحتضنة دون انزيم).
- إعداد إنزيم Apo
- إعداد حل الأسهم من 1 M 1،10-phenanthroline في الإيثانول. إضافة 10 ميكرولتر من 1،10-phenanthroline الأسهم الحل إلى 890 ميكرولتر من 50 مل من MOPS، 0.5 M (NH4)2SO4،pH 7.2. أضف 100 ميكرولتر من TmPep1050 المنقى (تركيز 300 ميكرومتر−1 مل).
- تحقق من فقدان النشاط باستخدام مقايسة النشاط الموضحة في القسم 2.1 دون إضافة CoCl2 في مزيج التفاعل.
- نقل العينة في أنبوب غسيل الكلى. Dialyze مقابل 200 مل من 50 مل م، 0.5 M (NH4)2SO4،درجة حَسْ 7.2 في 4 درجة مئوية. تبادل ثلاث مرات في dialysate مع عازلة جديدة خلال غسيل الكلى 48 ح.
- جمع العينة من أنبوب غسيل الكلى والتركيز مرة أخرى إلى 100 ميكرولتر باستخدام وحدات الترشيح الفائق مع قطع 30 كيلو Da(جدول المواد). تحقق من التركيز عن طريق قراءة الامتصاص في 280 نانومتر باستخدام مقياس طيفي بحجم النانو.
- إعداد الديممر
- تخفيف إنزيم أبو إلى تركيز 1 μM في 50 M MOPS، 0.5 M (NH4)2SO4، درجة ال H 7.2. احتضان لمدة 2 ساعة في 75 درجة مئوية في حمام جاف، ثم السماح للعينة تبرد إلى درجة حرارة الغرفة.
- تركيز العينة على تركيز انزيم لا يقل عن 50 ميكرومتر. تحقق من الوزن الجزيئي من قبل لجنة الأوراق المالية والبورصة (انظر القسم 1.4). يجب أن تتحول ذروة elution من ~ 82 مل إلى ~ 95 مل (في ظل الظروف التجريبية الحالية).
3. TmPep1050 تبلور
ملاحظة: لا يزال تبلور البروتين هو علم تجريبي لأنه ظاهرة متعددة العوامل33. في حين يمكن تحديد بعض المعلمات والتحكم فيها (مثل درجة الحرارة، ودرجة الحرارة، وتركيز عامل هطول الأمطار)، قد تؤثر عوامل أخرى على التبلور بعيد المنال (مثل البروتين والنقاء الكيميائي، وتحلل البروتين، وتاريخ العينة). في الوقت الحاضر يتم التعامل مع تبلور البروتين بطريقة عقلانية ومنهجية بفضل مجموعة من ظروف فحص التبلور التجاري والأتمتة. ومع ذلك، يعتمد تحسين حالة التبلور في الغالب على نهج التجربة والخطأ. ويرد فيما بعد مخطط لبلورة البروتينات ونصائح عديدة لتحسين ظروف التبلور.
- فحص التبلور
ملاحظة: باستخدام مجموعات التبلور التجارية، تم الحصول على بلورات من dodecameric TmPep1050 في 2.2 M DL-malic حمض pH 7.0، 0.1 M Bis-Tris pH 7.0 و 0.18 M ثلاثي الأمونيوم سيترات، 20٪ البولي ايثيلين جلايكول (PEG) 3350. تم الحصول على بلورات من بلورات من TmPep1050 في 0.1 M الصوديوم citrate 5.6، 0.2 M خلات الأمونيوم، 30٪ PEG4000. بلورات من dodecamers تظهر في غضون أسبوع وتصل إلى حجمها الكامل في شهر. بلورات من الخافتات تظهر عادة في غضون 24 ساعة وتنمو إلى حجم كامل في أسبوع.- الحصول على عدة مجموعات تبلور تجارية (انظر جدول المواد للاطلاع على أمثلة).
- إعداد لوحات التبلور (جدول المواد) لأسلوب إسقاط شنقا. ملء الآبار مع 500 μL من كل حل من مجموعة فحص التبلور.
- لكل بئر، قم بإعداد دعم التبلور. على الدعم، إيداع 1 ميكرولتر قطرة من البروتين النقي (عادة ~ 10 ملغ / مل).
- على الفور pipet 1 ميكرولتر من محلول التبلور من البئر. إضافته بعناية إلى انخفاض البروتين ويخلط بلطف عن طريق الأنابيب رأسا على عقب ثلاث مرات. يجب أن يبقى القطر نصف نصف كروي دون أي فقاعات.
- المسمار الدعم على رأس البئر المقابلة. كرر العملية للطقم بأكمله.
- بعد إعداد لوحات، ومراقبة كل قطرة مع منظار. الرجوع إلى دليل المستخدم طقم التبلور للتفسير (إسقاط واضح، فصل المرحلة، الترسب، الإبر، الخ).
- احتضان لوحات في 20 درجة مئوية. تحقق من اللوحات مرة واحدة في اليوم خلال الأسبوع الأول ومرة واحدة في الأسبوع بعد ذلك.
- يسجل كل بئر باستخدام ورقة النتيجة ودليل المستخدم المقدمة مع مجموعات التبلور.
- تحسين التبلور
ملاحظة: تم تحسين ظروف التبلور الأولية للـ dodecameric TmPep1050 إلى 2.1 M DL-malic حمض pH 6.75 و 0.18 M ثلاثي الأمونيوم citrate 7.5، 40٪ (ث / الخامس) PEG3350 في حين تم تحويل حالة تبلور من TmPep1050 ديميركم إلى 0.1 M سيترات الصوديوم 6.0، 10٪ (ث / الخامس) PEG3350. دورة واحدة من البذر كان ضروريا لتحسين البلورية. ويرد فيما بعد كيف تم تحسين تبلور TmPep1050H60A H307A البديل.- إعداد حلول الأسهم من 0.5 M الصوديوم سيترات العازلة في مختلف س.س (4.5، 5.2، و 6.0)، و 50٪ (ث / الخامس) حل PEG3350.
- إعداد لوحة تبلور كمصفوفة من الرقم الH مقابل عامل هطول الأمطار (انظر الشكل 4A).
- احتضان لوحة في 20 درجة مئوية. مراقبة كل بئر مع منظار مرة واحدة في اليوم خلال أسبوع.
- يسجل كل بشكل جيد وفقا لحجم الكريستال والشكل. حدد حالة إعطاء بلورات من 50 ميكرومتر على الأقل. انتقل إلى الميكروس.
- اِيُسَر الصغر
ملاحظة: Microseeding هو وسيلة قوية لتحسين شكل وحجم وبلورية من بلورات البروتين34. نهج البذر أسرع هو البذر المتتالية باستخدام شعيرات القط. انظر الشكل 4 كمثال على كيفية تحسين التحسين التبلور و microseeding الشكل والحجم الكريستال ل TmPep1050H60A H307A.- إعداد البذور باستخدام جيدا المحدد في الخطوة 3.2.4.
- زيادة حجم قطرة تحتوي على بلورات إلى 10 ميكرولتر بإضافة محلول التبلور من البئر. Pipet قطرة وإضافة 90 ميكرولتر من محلول التبلور من البئر. دوامة جيدا والحفاظ على البذور على الجليد.
- إعداد عدة تخفيفات من البذور: 1x، 10x، 25x، و 100x. دوامة جيدا البذور قبل pipetting. الحفاظ على التخفيف على الجليد.
- لكل تخفيف البذور، إعداد لوحة تبلور كمصفوفة من الرقم الH مقابل عامل هطول الأمطار (انظر الشكل 4B). استخدم حلول المخزون المعدة في الخطوة 3.2.1.
- عند إجراء الانخفاض، إضافة 0.2 μL من البذور ل2 μL قطرة. احتضان لوحة في 20 درجة مئوية. مراقبة كل بئر مع منظار مرة واحدة في اليوم خلال أسبوع.
ملاحظة: يجب تحسين توزيع حجم الكريستال والشكل، انظر الشكل 4C كمثال لـ TmPep1050H60A H307A. لاستخدامات أخرى، يمكن تخزين البذور في -20 درجة مئوية.
4- الحيود بالأشعة السينية
- الكريستال قطف
ملاحظة: إعداد العينة يعتمد على مرفق مصدر الأشعة السينية (مرفق المنزل مقابل السنكروترون). استخدام أجهزة التخزين (قارورة وسلة حامل قارورة) وفقا لذلك. قد تكون هناك حاجة إلى إضافة المواد المبردة (مثل الجلسرين) اعتمادا على تركيز عامل الملح / هطول الأمطار. بالنسبة لبلورات TmPep1050 ، فإن الحماية من البروتيكات المبردة ليست ضرورية لأن تركيز الراس أو العازلة مرتفع بما يكفي لتجنب بلورات الماء.- إعداد حمام مملوءة بالنيتروجين السائل، يغرق أي قوارير أو سلة تستخدم في التعامل مع العينة.
- إعداد عينات من حلقات الانتقاء من مختلف الأحجام: 100 و 150 و 200 ميكرومتر (جدول المواد). اختيار الأحجام وفقا لحجم الكريستال.
- باستخدام منظار، تحقق من القطرة التي تحتوي على بلورات وبلورات معزولة موضعية (أسهل في الانتقاء). مع حلقة، واختيار بلطف الكريستال من أسفل. يغرق على الفور في حلقة في النيتروجين السائل ووضع حلقة في قارورة مناسبة.
- جمع البيانات
ملاحظة: قد تختلف عملية جمع البيانات بشكل كبير حسب مصدر الأشعة السينية (المرفق المنزلي مقابل السنكروترون) وحساسية الكاشف. وقد تختلف استراتيجية الجمع أيضا اختلافا كبيرا من عينة إلى أخرى، تبعا للدقة، وكثافة البقعة، والمجموعة الفضائية، وما إلى ذلك. وقد تم استعراض هذا الموضوع على نطاق واسع من قبل Dauter35.- جبل حلقة تحمل الكريستال على رئيس goniometer من مقياس الدوران.
- قم بضبط رأس goniometer على طول محاور XYZ لمحاذاة البلورة مع مسار شعاع الأشعة السينية.
- تعيين الطول الموجي إلى 0.98 Å وتحريك كاشف للحصول على 2 ه من القرار.
- ابدأ عملية جمع بيانات قصيرة من خلال الحصول على صور في اتجاهين بلوريين مختلفين على الأقل. التقاط 10 صور (صورة 1 لكل 0.1 درجة) عند 0 درجة و90 درجة.
- تحقق من الصور التي تم جمعها باستخدام برامج مناسبة (مثل ADXV أو XDS-Viewer أو Albula Viewer). تحديد كثافة البقعة وأعلى دقة حيث يتم رؤية البقع. تحقق أيضا من أحادية البلورة وفصل بقعة.
- وفي النهاية، كرر الخطوات 4.2.3−4.2.5 عن طريق تغيير موضع الكاشف بدقة أعلى أو أقل ووقت التعرض وفقاً للمراقبة.
- بدء جمع البيانات حول 360 درجة مع صورة 1 مأخوذة لكل 0.1 درجة. تذكر لضبط موقع الكاشف ووقت التعرض على النحو الأمثل.
5. الفهرسة، واستبدال الجزيئية وبناء نموذج
- المقايسه
ملاحظة: الفهرسة هي طريقة لقياس كثافة بقع الانعراج ، مما يعطي السعات من عوامل الهيكل36. وتستخدم حزم البرمجيات الأربعة عادة لمعالجة الصور التي تم جمعها : موسفلم37، HKL200038، DIALS39، وXDS40. وقد استخدم هذا الأخير لفهرسة مجموعات البيانات التي تم الحصول عليها من الحيود الكريستال TmPep1050.- تثبيت حزمة XDS وXDSME41. إذا كان تجهيز ملفات HDF5، تثبيت XDS Neggia المساعد (المتاحة على موقع ديكريس). لمزيد من المعلومات، قم بزيارة صفحة ويب ويب https://strucbio.biologie.uni-konstanz.de/xdswiki/index.php/Main_Page وXDSME https://github.com/legrandp/xdsme.
- قبل معالجة البيانات، قم بإنشاء مجلد من حيث سيتم تشغيل XDS. حدد موقع المسار إلى الصور.
- لتشغيل XDSME، اكتب xdsme /path_to_images/image.extension في إطار المحطة الطرفية.
- بعد أن انتهت XDS المهمة، تحقق من الصحيح. LP الملف. لاحظ احتمال تحديد مجموعة الفضاء واكتمال البيانات ودقة الدقة الأعلى وفسيفساء البلورة وجودة البيانات. تحقق أيضا XDS_pointless.log للحصول على احتمال وجود مجموعات الفضاء.
ملاحظة: راجع الشكل 5 كمثال الإخراج. - إعادة تشغيل XDSME مع حلول مجموعة الفضاء المختلفة المقترحة من قبل XDS في مجلد منفصل لتجنب الكتابة فوق العملية السابقة. نوع xdsme -s space_group_name -c "unit_cell_parameters" / path_to_images / image.extension (على سبيل المثال، xdsme -s P21 -c "43.295 137.812 61.118 90.000 110.716 90.000).
- تحقق من الصحيح. LP الملفات واختيار أفضل حل استنادا إلى إحصاءات البيانات.
- تشغيل XSCALE بكتابة xscale.py XDS_ASCII. HKL. تشغيل XDSCONV بكتابة xdsconv.py XSCALE. HKL CCP4.
ملاحظة: في بعض الحالات، XDSME فشل في تحديد مجموعة المساحة أو فشل في قص نطاق دقة بشكل صحيح أو ينشئ إحصائيات بيانات غريبة. إذا تمت مصادفة مثل هذه المشكلة، فإنه يستحق تشغيل XDS أصلاً. يجب إدخال عدة معلمات في XDS. INP بدء الملف (انظر صفحة ويكي XDS). عند استخدام XDS، يمكن التحقق من احتمال وجود مجموعات الفضاء المحتملة باستخدام بلا جدوى، جزء من حزمة CCP442. لقطع دقة مجموعة البيانات، Rmeas < 60% و I/σ ~ 2 مقبولة عادة لتحديد أعلى دقة43. ومع ذلك، يمكن تحسين الاستبدال الجزيئي وصقل النموذج من خلال توسيع نطاق القرار إلى I/σ ~0.5−1.5 و CC1/2 وصولاً إلى 0.2−0.444.
- الاستبدال الجزيئي
ملاحظة: البيانات التجريبية تتيح الوصول إلى سعة العوامل الهيكلية ولكن، دون معرفة المرحلة، فهي عديمة الفائدة. ويمكن تحديد المرحلة تجريبيا من خلال أساليب مختلفة تعتمد على إشارة شاذة (من ذرة ثقيلة، على سبيل المثال)45. الاستبدال الجزيئي هو طريقة أخرى لتحديد المرحلة دون ذرة مبعثرة شاذة46،47. يستخدم هذا الأسلوب إحداثيات جزيء ذات الصلة للعثور على المرحلة وتحسينها بشكل متكرر. نحن نستخدم Phaser48 في فينيكس GUI49 لاستبدال الجزيئية.- إعداد نموذج البداية لاستبدال الجزيئية باستخدام إحداثيات 4P6Y. من ملف pdb، استخراج أحادية A و اقتطاع aminoacids في ألانين باستخدام محرر ملف PDB في فينيكس (تحت علامة التبويب أدوات النموذج).
- تشغيل Xtriage في فينيكس (تحت علامة التبويب تحليل البيانات) مع ملف انعكاس التي تم إنشاؤها بواسطة XDSCONV (5.1.9) والتسلسل كمدخلات.
- تحقق من ملف السجل من Xtriage. لاحظ الاكتمال، وعدد الوحدات الفرعية في الوحدة غير المتماثلة، ونظائر، ووجود حلقات الجليد، وحدوث التوأمة.
- تشغيل Phaser-MR في فينيكس (تحت علامة التبويب استبدال الجزيئية) لاستبدال الجزيئية باستخدام ملف الانعكاس، والتسلسل ونموذج 4P6Y ابتداء من اقتطاع في ألانين بولي (الخطوة 5.2.1).
- عند الانتهاء، تحقق إذا تم العثور على نموذج ودرجة الاستبدال الجزيئي. يشير عامل الترجمة Z-score (TFZ) على الأقل إلى 8 إلى أن الحل صحيح بشكل نهائي.
- نموذج بناء
ملاحظة: بعد تحديد المرحلة عن طريق الاستبدال الجزيئي، يجب بناء النموذج وصقله. يستخدم هذا البروتوكول فينيكس GUI49 للمبنى التلقائي والتحسينات المتكررة ، وCoot50 لبناء الهيكل اليدوي والصقل.- بعد الاستبدال الجزيئي باستخدام المرحلة-MR في فينيكس، حدد تشغيل Autobuild. سيتم إضافة كافة الملفات المطلوبة تلقائياً. ببساطة اضغط تشغيل لبدء autobuild.
- عند الانتهاء، تحقق من النموذج في Coot. بناء وصقل النموذج يدويا وفقا لخريطة كثافة الإلكترون في Coot.
- قم بصقل النموذج المنسق يدويًا في فينيكس (في علامة التبويب الصقل) باستخدام النموذج والتسلسل وبيانات الانعراج كمدخلات. راجع مساعدة فينيكس لاختيار الاستراتيجية الصحيحة.
- بعد الصقل، والتحقق من النتائج: Rالحرة وRالعمل يجب أن تنخفض، يجب احترام مؤشرات Molprobity51، ويجب أن تكون محدودة القيم المتطرفة مع انخفاض الارتباط الحقيقي الفضاء.
- كرر الخطوات 5.3.2−5.3.4 حتى يتم إنشاء أفضل نموذج مُنقَّح.
- تشغيل Molprobity على الملقم: http://molprobity.biochem.duke.edu/. تحقق من أي القيم المتطرفة التي تم تحديدها من قبل Molprobity.
- في نهاية المطاف كرر الخطوات 5.3.2−5.3.6 حتى يتم الحصول على أفضل نموذج المكرر.
النتائج
لدراسة احتمال تفكك dodecamer في مونومر في TmPep1050، تم استبدال codons له-60 و 307 له من قبل الين كودون باستخدام جين الاصطناعية. ثم تم استنساخ هذا الجين في ناقلات pBAD للتعبير وتنقية من البديل TmPep1050 المقابلة اسمه لاحقا TmPep1050H60A H307A. أظهر الكروماتوغرافيا استبعاد الحجم (الشكل 3B) أن البروتين المنقى له وزن جزيئي واضح 56 كيلو أم ادا (الوزن الجزيئي للمونومر هو 36.0 كيلوDa). وقد تم الإبلاغ عن وزن جزيئي واضح مماثل، 52 كيلو Da، لـ TmPep105011. وبالتالي، يمكن الاستدلال على الدولة القلة من TmPep1050H60A H307A كما dimeric. وفيما يتعلق بنشاطها المحدد، كان TmPep1050H60A H307A غير نشط تماما على L-Leu-p NA كركيزة، حتى في وجود أيونات الكوبالت. هذه النتيجة تشير بقوة إلى أن المتغيرات لا يمكن ربط أي أي أيونات معدنية.
تم تحسين حالة التبلور لـ TmPep1050H60A H307A من خلال اختلاف درجة ح H vs. PEG(الشكل 4)حول حالة الغمّة (أي 0.1 M سيترات الصوديوم PH 6.0 10٪ PEG3350). تم الحصول على أفضل بلورات من TmPep1050H60A H307A في 0.1 M الصوديوم citrate 5.2 20٪ PEG3350 مع دورة واحدة من microseeding لتحسين أحادية البلورات. تم جمع مجموعة كاملة من البيانات في خط الحزم Proxima 2 (SOLEIL synchrotron) في قرار 2.36 Å(الجدول 1). وأظهرت فهرسة البيانات أن المجموعة الفضائية لبلورةH60A H307A H60A H607A هي C2221 ولكن XDS اقترحت حلا آخر، هو مجموعة الفضاء MP (انظر الشكل 5). ووفقاً لـ "لا طائل" من احتمال أن تكون المجموعتان الفضائيتان الفضائيتان C2221 وP21 0.711 و0.149 على التوالي. وفقا لتحليل جودة البيانات، تم العثور على اثنين من مونومر في وحدة غير المتماثلة. وكشف التحليل الذي أجراه Xtriage أن مجموعة البيانات ربما توأمة ولكن التوأمة في المجموعة الفضائية C2221 من غير المرجح52. التوأمة النتائج من شذوذ النمو الكريستال حيث العديد من المجالات محددة لديها بعض من اتجاهات شعرية موازية لبعضها البعض53. التوأمة قد تنتج أيضا عن تناظر بلوري أعلى، مما يدل على فهرسة بيانات خاطئة. وبالتالي، قد يتواجد توأم زائف-ميروهيرال بحيث تبدو شعرية بلورية P21 مثل C2221. وفيما بعد، تم فهرسة مجموعة البيانات في المجموعة الفضائية P21 واختُرِبَت في عملية استبدال جزيئية. Xtriage تحليل مجموعة البيانات المفهرسة في P21 كشفت الزائفة merohedral التوأم بعد القانون التوأم ح، -k، -h-l.
باستخدام إحداثيات مونومر من dodcameric TmPep1050 (رمز PDB 4P6Y) ، تم العثور على حل الاستبدال الجزيئي لمجموعة البيانات المفهرسة في P21 فقط ، مع درجة TFZ 28.9. ولذلك، تم التعامل مع بيانات الحيود على أنها مجموعة بيانات توأمة لبناء النموذج. للحد من التحيز من استبدال الجزيئية، تم بناء النموذج الأول باستخدام فينيكس.autobuild54،55. تم الانتهاء من هيكلH600A H307A هيكل TmPep1050 بعد عدة دورات من الصقل الآلي واليدوي في فينيكس وكوت(الجدول 1 والشكل 6A). وأكد الهيكل الدولة oligomeric مع سطح واجهة من 1710Å 2 بين كل من مونومر و ΔiG من -16.2 كالوري مول-1 كما حسبت من قبل PDBe بيزا56. وبالمقارنة، فإن سطح الواجهة و ΔIG من ثنائي غمبيب 10502-mer هو 1,673Å 2 و-16.7 كيلو كالوريمول -1, على التوالي.
هيكل من TmPep1050H60A H307A يشبه إلى حد كبير إلى الهيكل الخافت من النوع البرية مع RMS من 0.774 Å على المحاذاة. الأهم من ذلك، ويلاحظ نفس التعديلات الهيكلية في كل من الهيكل: مرونة عالية من الهليكوات α8 وα10، والموقع النشط المضطرب Gln-196-Val-202، وتشريد Lys-229-Ala-235 وLys-247-Ser 254. وقد ارتبطت هذه التعديلات سابقا مع عرقلة تشكيل dodecamer في غياب عاملها المساعدالمعدنية 11. ومع ذلك، كان للطفرات اثنين من له-60 وه-307، تأثير طفيف على السلاسل الجانبية من Asp-168 و Asp-62. ويبدو أنها مؤمنة في التشكل مختلفة عن dimer من نوع البرية(الشكل 6B). و Asp-168 carboxylate استدارة بنسبة 40 درجة بسبب غياب له-60 وه-307. وبالتالي كل من بقايا الهستيدين مهمة لتحديد المواقع في Asp-168 carboxylate بشكل صحيح لسد أيونات المعدن اثنين. وSP-62 سلسلة الجانب موجهة نحو غلو- 18 carboxylate، خارج الموقع الحفاز. قد يكون لـ Asp-62 دور مهم في الحفز حيث يفترض أن تعدل PKa من His-60 وبالتالي تؤثر على أيونات معدنية ملزمة في موقع M2. بالإضافة إلى ذلك ، يمكن أن تكون متورطة هيكليا في تثبيت الموقع الحفاز على أيونات معدنية ملزمة ، لصالح تشكيل dodecamer.

الشكل 1: التمثيل التخطيطي TM_1050 استنساخ ORF في متجه pBAD بواسطة إعادة التركيب المتماثلة.
ويحيط ORF من قبل اثنين من 30 بت تسلسل homologous إلى نهاية سيئة المروج وتسلسل المنبع Pmeالأول موقع القيد. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
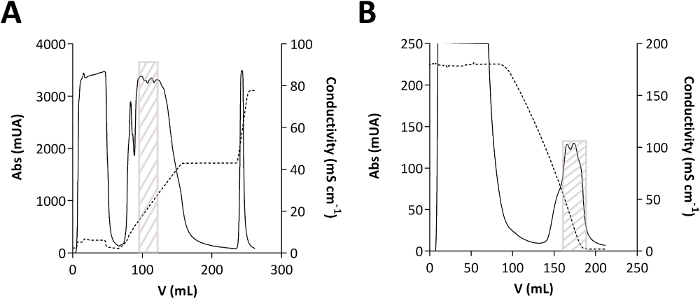
الشكل 2: الكروماتوغرام من TmPep1050 تنقية.
(أ) anion تبادل الكروماتوغرافيا. (ب) التفاعل الهدّاموري اللوني. يتم عرض الامتصاص (Abs) ، المعبر عنه بالميليونات من الامتصاص (mUA) ، في خط عادي. التوصيلية، التي أعرب عنها في سم-1mS، هو مبين في خط متقطع. يشير المربع الرمادي إلى حيث يُفرّج TmPep1050 على الكروماتوغرام. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: الكروماتوغرافيا استبعاد الحجم من (أ) TmPep1050 dodecamer، (ب) TmPep1050H60A H307A، و (C) TmPep1050H60A.
تم تحليل العينات باستخدام راتنج SEC معبأة في عمود 120 مل. يتم التعبير عن الامتصاص (Abs) بالميليونات من الامتصاص (mUA). (د)معايرة عمود لجنة الأوراق المالية والبورصة باستخدام thyroglobulin (T)، الفيريتين (F)، aldolase (Ald)، conalbumin (C)، والزبالين (Alb) كمقاييس. العلاقة بين لوغاريتم الكتلة النسبية وحجم elution خطية، مع R2 من 0.91. يتم تمثيل فواصل الثقة 95% على أنها نقاط. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: تحسين TmPep1050H60A H307A تبلور.
(أ)تتكون استراتيجية التحسين الأولى من درجة PH متفاوتة (بين 4.5 و 6.0) مقابل تركيز PEG3350 (بين 5٪ و 25٪). يتم تخطيط لوحة التبلور ، ويتم ترميز الآبار باللون: الأحمر للعجلة والأصفر للبوليبلورات والأخضر للبلورات الأحادية. (B) وتشمل استراتيجية التحسين الثانية استخدام البذور المخففة 25x مع تباين أضيق من درجة PH مقابل PEG3350. (C) الشكل البلوري والحجم قبل (الصورة العليا) وبعد (الصورة السفلى) تحسين التبلور و microseeding. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: مقتطفات من سجل الإخراج الصحيح. LP من TmPep1050H60A H307A فهرسة البيانات بواسطة XDS.
اللوحة العلوية، وlattices برافيه ممكن، والأكثر احتمالا هو mC، mP، و oC. لوحة الأوسط، والإحصاءات الإجمالية للبيانات المفهرسة في C2221 مجموعة الفضاء. اللوحة السفلى، والإحصاءات الإجمالية للبيانات المفهرسة في مجموعة الفضاء P21. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: هيكل من TmPep1050H60A H307A.
(أ) محاذاة هيكلية من TmPep1050H60A H307A الوحدة الفرعية (أحمر، رمز PDB 5NE9) مقابل a dodecamer الوحدة الفرعية (أبيض، رمز PDB 6NW5) و الوحدة الفرعية أدنى (الأزرق، رمز PDB 5NE6). تشير الأسهم إلى أوجه الاختلاف الهيكلية بين الـddecamers و dimers. (ب) عن قرب من TmPep1050H60A H307A بالموقع النشط (الأحمر) مقارنة بالموقع النشط من TmPep1050 dimer (الأزرق) وddecamer (أبيض). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| TmPep1050H60A H307A | |
| جمع البيانات | |
| درجة الحرارة (K) | 100 |
| مصدر الإشعاع | سولي بروكسيما 2 |
| الطول الموجي (Å) | 0.9801 |
| كاشف | ديكريس إيغر X 9M |
| نطاق التذبذب (°) | 0.1 |
| وقت التعرض (ق) | 0.025 |
| مجموعة الفضاء | P 1 21 1 |
| معلمات خلية الوحدة | |
| α, β, γ (°) | 90.00, 110.69, 90.00 |
| أ، ب، ج (Å) | 43.24, 137.79, 61.11 |
| القرار | 43.99 – 2.37 (2.52-2.37) |
| تأملات فريدة من نوعها | 26.902 |
| Rmerge (%) | 0.14 |
| التكرار | 6,815 |
| 8.64 (2.12) | |
| اكتمال (%) | 99.6 (97.9) |
| CC1/2 (%) | 99.2 (84.1) |
| صقل | |
| القرار | 43.99 – 2.37 |
| انعكاسات | 26.9 |
| Rمجموعة حرة اختبار عدد | 1345 |
| R العمل/ Rمجانا | 0.206/0.234 |
| جزيئات البروتين لكل وحدة من ASU | 2 |
| VM (Å 3/ دا) | 2.37 |
| محتوى المذيبات (٪ ) | 49.0 |
| ذرات البروتين/المذيبات | 4,559/96 |
| r.m.s.d. أطوال السندات (Å) | 0.31 |
| r.m.s.d. زوايا السندات (°) | 0.51 |
| متوسط العوامل ب (Å2) | 57.0 |
| يفضل /غير مسموح راماشاندران φ/ψ (%) | 95.02 / 0.17 |
| القانون المزدوج | h, -k, -h-l |
| رمز PDB | 5NE9 |
الجدول 1: إحصاءات جمع البيانات وتنقيحها. القيم الموجودة بين قوسين هي لـ shell ذات دقة عالية.
Discussion
البروتوكول الموصوف هنا يسمح بفهم انتقال dimer-dodecamer من TmPep1050 على المستوى الهيكلي. وقد شهدت منهجية سابقا لتحديد هيكل كل من oligomers TmPep105011. وكانت الخطوة الأكثر تحديا هي إيجاد ظروف تعزز تفكك الـddecamers إلى خافضات مستقرة. وكان على هذه الظروف أن تكون خفيفة بما يكفي للسماح بإعادة دمج الخافتات في الدلّاد عندما أضيفت العوامل المساعدة في أيونات المعادن. وكان فصل القلة أيضا خطوة حاسمة لأنها ظروف الدراسات الهيكلية والمزيد من التوصيف الكيميائي الحيوي (على سبيل المثال، دراسة reassociation dodecamer في جرعات مختلفة من Co2 +). تم استخدام الاستبدال الجزيئي ، وهو أسلوب مثبت لتحديد المرحلة ، لحل هياكل oligomers TmPep1050 ومتغيراتها. ويمكن تكييف البروتوكول المقترح لدراسة إنزيمات المعادن الأخرى التي تعتمد حالاتها من احتكار القلة على توافر العوامل المساعدة المعدنية الخاصة بها.
ولتوضيح البروتوكول، قُدمت حالة دراسة، هي TmPep1050H60A H307A التي ضعفت مواقع ربط المعادن الخاصة بها عن طريق تحوره-60 وه-307 إلى ألانين. وتربط هذه المخلفات بين Co2+ في موقعي M2 و M1 على التوالي. التدخل في ربط المعادن يمكن أن يكون قد اؤجّر الدولة القلة وأدى إلى انفصام كامل في مونومرات. وقد تم الإبلاغ عن أدلة على مثل هذه الظاهرة لPhTET2 وPfteT3, اثنين M42 أمينبيبتيداسيس من P. horikoshii وP. furiosus, على التوالي24,29. TmPep1050H60A H307A لم تتصرف كما هو متوقع مثل هذا المتغير شكلت dimers فقط. وأظهرت هيكلها نفس التعديلات كما dimer من النوع البري ولكن مع اثنين من الاستثناءات الصغيرة. في الواقع، يبدو أن السلاسل الجانبية لـ Asp-168 و Asp-62 مقفلة في اتجاه غير تقليدي يمنع تثبيت الموقع النشط. ويبدو أن توجههم فرض من قبل له-60 وه-307 كما لم يتم ملاحظة مثل هذه التعديلات في المتغيرات الطفرة نقطة واحدة.
Disclosures
ليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
نشكر مارتين رووفر على تصحيح هذه الورقة وتقديم تعليقات بناءة. كان الوصول إلى خط الشعاع Proxima 2 (SOLEIL synchrotron) ضمن مجموعات تخصيص الكتلة 20151139.
Materials
| Name | Company | Catalog Number | Comments |
| 1,10-phenanthroline | Sigma-Aldrich | 13, 137-7 | |
| Amicon Ultra 0.5 ml Centrifugal Filters Ultracel 30K | Merck Millipore | UFC503096 | |
| Amicon Ultra 15 Centrifugal Filters Ultracel 30K | Merck Millipore | UFC903024 | |
| Benzonase Nuclease | Merck Millipore | 70664-3 | |
| CCP4 | N/A | visit http://www.ccp4.ac.uk/ | |
| cOmplete EDTA-free | Roche | 5056489001 | |
| Coot | N/A | visit https://www2.mrc-lmb.cam.ac.uk/personal/pemsley/coot/ | |
| Crystal Screen I | Hampton Research | HR2-110 | |
| Crystal Screen II | Hampton Research | HR2-112 | |
| DreamTaq Green PCR Master Mix | ThermoFisher Scientific | K1082 | |
| EasyXtal 15-well tool | NeXtal | 132007 | |
| Escherichia coli PPY strain | N/A | see reference 31 | |
| Escherichia coli XL1 blue strain | Agilent | 200249 | |
| Gel Filtration Calibration Kit HMW | GE Healthcare Life Sciences | 28-4038-42 | |
| Gel Filtration Calibration Kit LMW | GE Healthcare Life Sciences | 28-4038-41 | |
| Gel Filtration Standard | Biorad | 1511901 | |
| GeneJET Plasmid Miniprep Kit | ThermoFisher Scientific | K0503 | |
| Index | Hampton Research | HR2-144 | |
| Litholoops | Molecular Dimensions | ||
| L-leucine-p-nitroanilide | Bachem AG | 40010720025 | |
| Natrix 1 | Hampton Research | HR2-116 | |
| Natrix 2 | Hampton Research | HR2-117 | |
| Neggia plugin | Dectris | N/A | visit https://www.dectris.com/ |
| NeXtal Tubes JCSG Core Suite I | NeXtal | 130724 | |
| NeXtal Tubes JCSG Core Suite II | NeXtal | 130725 | |
| NeXtal Tubes JCSG Core Suite III | NeXtal | 130726 | |
| NeXtal Tubes JCSG Core Suite IV | NeXtal | 130727 | |
| pBAD-TOPO | ThermoFisher Scientific | K430001 | |
| Phenix | N/A | visit https://www.phenix-online.org/ | |
| Phusion High-Fidelity DNA polymerase | ThermoFisher Scientific | F-530L | |
| Salt RX 1 | Hampton Research | HR2-107 | |
| Salt RX 2 | Hampton Research | HR2-109 | |
| SnakeSkin Dialysis Tubing, 3.5K MWCO | ThermoFisher Scientific | 88242 | |
| Source 15Phe | GE Healthcare Life Sciences | 17014702 | |
| Source 15Q | GE Healthcare Life Sciences | 17094705 | |
| Superdex 200 prep grade | GE Healthcare Life Sciences | 17104301 | |
| Thermotoga maritima MSB8 strain | American Type Culture Collection | ATCC 43589 | |
| TmCD00089984 | DNASU Plasmid Repository | N/A | |
| XDS | N/A | visit http://xds.mpimf-heidelberg.mpg.de/ | |
| xdsme | N/A | visit https://github.com/legrandp/xdsme |
References
- Levy, E. D., Teichmann, S. A. Structural, Evolutionary, and Assembly Principles of Protein Oligomerization. Progress in Molecular Biology and Translational Science. 117, 25-51 (2013).
- Selwood, T., Jaffe, E. K. Dynamic dissociating homo-oligomers and the control of protein function. Archives of Biochemistry and Biophysics. 519 (2), 131-143 (2012).
- Jaffe, E. K. The Remarkable Character of Porphobilinogen Synthase. Accounts of Chemical Research. 49 (11), 2509-2517 (2016).
- Ramström, H., et al. Properties and Regulation of the Bifunctional Enzyme HPr Kinase/Phosphatase in Bacillus subtilis. Journal of Biological Chemistry. 278 (2), 1174-1185 (2003).
- Rudyak, S. G., Brenowitz, M., Shrader, T. E. Mg2+-Linked Oligomerization Modulates the Catalytic Activiy of the Lon (La) Protease from Mycobacterium smegmatis. Biochemistry. 40 (31), 9317-9323 (2001).
- Yamamoto, S., Storey, K. B. Dissociation-Association of lactate dehydrogenase Isozymes: Influences on the formation of tetramers vs. dimers of M4-LDH and H4-LDH. International Journal of Biochemistry. 20 (11), 1261-1265 (1988).
- Sirover, M. A. Structural analysis of glyceraldehyde-3-phosphate dehydrogenase functional diversity. The International Journal of Biochemistry & Cell Biology. 57, 20-26 (2014).
- Gupta, V., Bamezai, R. N. K. Human pyruvate kinase M2: A multifunctional protein: Multifunctional Human PKM2. Protein Science. 19 (11), 2031-2044 (2010).
- Wiegand, G., Remington, S. J. Citrate synthase: Structure, Control, and Mechanism. Annual Review of Biophysics and Biophysical Chemistry. 15, 97-117 (1986).
- Libonati, M., Gotte, G. Oligomerization of bovine ribonuclease A: structural and functional features of its multimers. Biochemical Journal. 380 (2), 311-327 (2004).
- Dutoit, R., et al. How metal cofactors drive dimer-dodecamer transition of the M42 aminopeptidase TmPep1050 of Thermotoga maritima. Journal of Biological Chemistry. 294 (47), 17777-17789 (2019).
- Rawlings, N. D., et al. The MEROPS database of proteolytic enzymes, their substrates and inhibitors in 2017 and a comparison with peptidases in the PANTHER database. Nucleic Acids Research. 46 (1), 624-632 (2018).
- Neuwald, A. F., Liu, J. S., Lipman, D. J., Lawrence, C. E. Extracting protein alignment models from the sequence database. Nucleic Acids Research. 25 (9), 1665-1677 (1997).
- Dutoit, R., Brandt, N., Legrain, C., Bauvois, C. Functional Characterization of Two M42 Aminopeptidases Erroneously Annotated as Cellulases. PLoS ONE. 7 (11), 50639(2012).
- Franzetti, B., et al. Tetrahedral aminopeptidase: a novel large protease complex from archaea. The EMBO Journal. 21 (9), 2132-2138 (2002).
- Borissenko, L., Groll, M. Crystal Structure of TET Protease Reveals Complementary Protein Degradation Pathways in Prokaryotes. Journal of Molecular Biology. 346 (5), 1207-1219 (2005).
- Appolaire, A., et al. TET peptidases: A family of tetrahedral complexes conserved in prokaryotes. Biochimie. 122, 188-196 (2016).
- Russo, S., Baumann, U. Crystal Structure of a Dodecameric Tetrahedral-shaped Aminopeptidase. Journal of Biological Chemistry. 279 (49), 51275-51281 (2004).
- Schoehn, G., et al. An Archaeal Peptidase Assembles into Two Different Quaternary Structures: A tetrahedron and a giant octahedron. Journal of Biological Chemistry. 281 (47), 36327-36337 (2006).
- Durá, M. A., et al. The structural and biochemical characterizations of a novel TET peptidase complex from Pyrococcus horikoshii reveal an integrated peptide degradation system in hyperthermophilic Archaea: Characterization of P. horikoshii TET3 peptidase. Molecular Microbiology. 72 (1), 26-40 (2009).
- Basbous, H., Appolaire, A., Girard, E., Franzetti, B. Characterization of a Glycyl-Specific TET Aminopeptidase Complex from Pyrococcus horikoshii. Journal of Bacteriology. 200 (17), 00059(2018).
- Appolaire, A., et al. Small-angle neutron scattering reveals the assembly mode and oligomeric architecture of TET, a large, dodecameric aminopeptidase. Acta Crystallographica Section D Biological Crystallography. 70 (11), 2983-2993 (2014).
- Appolaire, A., et al. The TET2 and TET3 aminopeptidases from P yrococcus horikoshii form a hetero-subunit peptidasome with enhanced peptide destruction properties: TET aminopeptidase multi-subunit complex. Molecular Microbiology. 94 (4), 803-814 (2014).
- Colombo, M., Girard, E., Franzetti, B. Tuned by metals: the TET peptidase activity is controlled by 3 metal binding sites. Scientific Reports. 6 (1), 20876(2016).
- Petrova, T. E., et al. Structure of the dodecamer of the aminopeptidase APDkam598 from the archaeon Desulfurococcus kamchatkensis. Acta Crystallographica Section F Structural Biology Communications. 71 (3), 277-285 (2015).
- Kim, D., et al. Structural basis for the substrate specificity of PepA from Streptococcus pneumoniae, a dodecameric tetrahedral protease. Biochemical and Biophysical Research Communications. 391 (1), 431-436 (2010).
- Chevrier, B., et al. Crystal structure of Aeromonas proteolytica aminopeptidase: a prototypical member of the co-catalytic zinc enzyme family. Structure. 2, 283-291 (1994).
- Rosenbaum, E., Ferruit, M., Durá, M. A., Franzetti, B. Studies on the parameters controlling the stability of the TET peptidase superstructure from Pyrococcus horikoshii revealed a crucial role of pH and catalytic metals in the oligomerization process. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics. 1814 (10), 1289-1294 (2011).
- Macek, P., et al. Unraveling self-assembly pathways of the 468-kDa proteolytic machine TET2. Science Advances. 3 (4), 1601601(2017).
- Edelheit, O., Hanukoglu, A., Hanukoglu, I. Simple and efficient site-directed mutagenesis using two single-primer reactions in parallel to generate mutants for protein structure-function studies. BMC Biotechnology. 9 (1), 61(2009).
- Zhang, Y., Werling, U., Edelmann, W. SLiCE: a novel bacterial cell extract-based DNA cloning method. Nucleic Acids Research. 40 (8), 55(2012).
- Schleif, R. AraC protein, regulation of the l-arabinose operon in Escherichia coli, and the light switch mechanism of AraC action. FEMS Microbiology Reviews. 34 (5), 779-796 (2010).
- McPherson, A., Gavira, J. A. Introduction to protein crystallization. Acta Crystallographica Section F Structural Biology Communications. 70 (1), 2-20 (2014).
- Bergfors, T. Seeds to crystals. Journal of Structural Biology. 142 (1), 66-76 (2003).
- Dauter, Z. Collection of X-Ray Diffraction Data from Macromolecular Crystals. Protein Crystallography. 1607, 165-184 (2017).
- Powell, H. R. X-ray data processing. Bioscience Reports. 37 (5), 0227(2017).
- Battye, T. G. G., Kontogiannis, L., Johnson, O., Powell, H. R., Leslie, A. G. W. iMOSFLM a new graphical interface for diffraction-image processing with MOSFLM. Acta Crystallographica Section D Biological Crystallography. 67 (4), 271-281 (2011).
- Otwinowski, Z., Minor, W. Processing of X-ray diffraction data collected in oscillation mode. Methods in Enzymology. 276, 307-326 (1997).
- Clabbers, M. T. B., Gruene, T., Parkhurst, J. M., Abrahams, J. P., Waterman, D. G. Electron diffraction data processing with DIALS. Acta Crystallographica Section D Structural Biology. 74 (6), 506-518 (2018).
- Kabsch, W. XDS. Acta Crystallographica Section D Biological Crystallography. 66 (2), 125-132 (2010).
- Legrand, P. legrandp/xdsme: March 2019 version working with the latest XDS version. , Jan 26, 2018. Zenodo (2019).
- Evans, P. Scaling and assessment of data quality. Acta Crystallographica Section D Biological Crystallography. 62 (1), 72-82 (2006).
- Wlodawer, A., Minor, W., Dauter, Z., Jaskolski, M. Protein crystallography for non-crystallographers, or how to get the best (but not more) from published macromolecular structures: Protein crystallography for non-crystallographers. FEBS Journal. 275 (1), 1-21 (2008).
- Karplus, P. A., Diederichs, K. Assessing and maximizing data quality in macromolecular crystallography. Current Opinion in Structural Biology. 34, 60-68 (2015).
- Taylor, G. L. Introduction to phasing. Acta Crystallographica Section D Biological Crystallography. 66 (4), 325-338 (2010).
- Rossmann, M. G., Blow, D. M. The detection of sub-units within the crystallographic asymmetric unit. Acta Crystallographica. 15, 24-31 (1962).
- Rossmann, M. G. The molecular replacement method. Acta Crystallographica Section A Foundations of Crystallography. 46 (2), 73-82 (1990).
- McCoy, A. J., et al. Phaser crystallographic software. Journal of Applied Crystallography. 40 (4), 658-674 (2007).
- Adams, P. D., et al. PHENIX: a comprehensive Python-based system for macromolecular structure solution. Acta Crystallographica Section D Biological Crystallography. 66 (2), 213-221 (2010).
- Emsley, P., Lohkamp, B., Scott, W. G., Cowtan, K. Features and development of Coot. Acta Crystallographica Section D Biological Crystallography. 66 (4), 486-501 (2010).
- Chen, V. B., et al. MolProbity: all-atom structure validation for macromolecular crystallography. Acta Crystallographica Section D Biological Crystallography. 66 (1), 12-21 (2010).
- Zwart, P. H., Grosse-Kunstleve, R. W., Lebedev, A. A., Murshudov, G. N., Adams, P. D. Surprises and pitfalls arising from (pseudo)symmetry. Acta Crystallographica Section D Biological Crystallography. 64 (1), 99-107 (2008).
- Yeates, T. O. Detecting and overcoming crystal twinning. Methods in Enzymology. 276, 344-358 (1997).
- Terwilliger, T. C. Using prime-and-switch phasing to reduce model bias in molecular replacement. Acta Crystallographica Section D Biological Crystallography. 60 (12), 2144-2149 (2004).
- Terwilliger, T. C., et al. Iterative model building, structure refinement and density modification with the PHENIX AutoBuild wizard. Acta Crystallographica Section D Biological Crystallography. 64 (1), 61-69 (2008).
- Krissinel, E., Henrick, K. Inference of Macromolecular Assemblies from Crystalline State. Journal of Molecular Biology. 372 (3), 774-797 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved