Method Article
Tek Hücreli Doğuştan Gelen Floresan İmzalarının Konfokal Mikroskopi ile Yeniden Yapılandırılması
Bu Makalede
Özet
Burada, üç boyutlu bir alanda dağıtılan her canlı hücreden doğuştan gelen hücresel floresan imzalarının (yani hücresel otofluoresans) optik olarak çıkarılması ve kataloglanması için bir protokol sunulmaktadır. Bu yöntem, bakteri, mantar, maya, bitki ve hayvanlardan gelen hücreler de dahil olmak üzere çeşitli biyolojik sistemlerin doğuştan gelen floresan imzasını tek hücreli çözünürlükte incelemek için uygundur.
Özet
Burada açıklanan konfokal yansıma mikroskopi destekli tek hücreli doğuştan gelen floresan analizi (CRIF), üç boyutlu (3D) bir alanda dağılmış bir popülasyondaki her bir canlı hücreden doğuştan gelen hücresel floresan imzasını yeniden oluşturmak için minimal invaziv bir yöntemdir. Bir hücrenin doğuştan gelen floresan imzası, hücre içindeki çeşitli biyomoleküllerin yaydığı floresan sinyallerinin bir koleksiyonudur. Önceki çalışmalar, doğuştan gelen floresan imzaların fizyolojik durumdaki çeşitli hücresel özellikleri ve farklılıkları yansıttığını ve hücre karakterizasyonu ve tanımlanması için zengin bir bilgi kaynağı olduğunu ortaya konmuştur. Doğuştan gelen floresan imzalar geleneksel olarak nüfus düzeyinde analiz edilmiş, klonal bir kültür gerektirmiştir, ancak tek hücre düzeyinde değildir. CRIF özellikle 3D çözünürlük ve/veya bireysel hücrelerden floresan sinyallerinin seçici olarak çıkarılmasını gerektiren çalışmalar için uygundur. Floresan imzası bir hücrenin doğuştan gelen bir özelliği olduğundan, CRIF, sağlam ve tek hücrelerin türünün ve/veya fizyolojik durumunun etiketsiz tahmini için de uygundur. Bu yöntem, heterojen popülasyondaki her bir hücrenin fenotipinin hücre etiketlemesi olmadan bir mikroskop altında otofluoresans imzası ile doğrudan değerlendirilebileceği aerodinamik hücre analizi için güçlü bir araç olabilir.
Giriş
Bir hücre içinde çeşitli biyomoleküller1 otofluoresans sinyalleri yayar ve bir hücrenin doğuştan gelen floresan imzası bu sinyallerin montajından oluşur. Bu imza floresan çeşitli hücresel özellikleri ve fizyolojik durum farklılıklarını yansıtır. Doğuştan gelen floresan analizi minimal invazivdir ve hafif metabolik modifikasyondan hücre yıkımına kadar bir dizi iz bırakan geleneksel, daha invaziv mikrobiyolojik probları tamamlayabilir. DNA veya hücre içeriği ekstraksiyonu2,3, floresan in situ hibridizasyon4 ve floresan muhabir genlerinin genoma girmesi gibi geleneksel teknikler hücre tipinin veya fizyolojik durumun belirlenmesinde etkili olsa da, genellikle hücrelerin manipülasyonunu veya invaziv etiketlemeyi gerektirir.
Toplu mikrobiyal kültür süspansiyonları5,6, aktif çamurlar7, memeli dokuları8,9 ve memeli hücreleri1,10 dahil olmak üzere çeşitli canlı ve bozulmamış mikrobiyal kolonilerin doğuştan gelen floresan çalışmaları, doğuştan gelen floresan analizinin hücre tiplerinin ve fizyolojik durumun etiketsiz analizini kolaylaştırdığını göstermiştir. Doğuştan gelen floresan imzalar geleneksel olarak tek hücre düzeyinde değil, nüfus düzeyinde analiz edilmiştir ve bu nedenle klonal bir kültür gerektirmektedir. Buna karşılık, burada açıklanan confokal reflection mikroskopi destekli tek hücreli innate fluoresans analizi (CRIF) tekniği11, her bir canlı mikrobiyal hücrenin doğuştan gelen hücresel floresan imzasını yeniden yapılandırır ve kataloglar. Ayrıca CRIF, üç boyutlu (3B) bir alanda dağıtılan bir popülasyondaki tek bir mikrobiyal hücrenin doğuştan gelen floresan imzasını sistematik olarak harmanlayabilir.
Protokol
1. Numunenin hazırlanması
- Cam bir kaydırağın üzerine kuyulu 1 mm kalınlığında silikon conta yerleştirin.
- Silikon contanın kuyusuna 1 mm kalınlığında %0,8 (w/v) agarose levha yerleştirin.
- Rastgele bir mikrobiyal hücre kültürünün hücre yoğunluğunu 600 nm (OD660) = 1.0 optik yoğunluğa seyreltin.
- Agarose levhasına 5 μL hücre süspansiyonu yerleştirin.
- Cam bir kapakla hafifçe örtün.
2. Mikroskop kurulumu
NOT: CRIF tekniği konfokal yansıma mikroskopisi (CRM) ve çok kanallı konfokal mikspektoskopiyi birleştirir. CRM, hücresel morfoloji ve hücresel doğuştan gelen floresan bağımsız mekansal lokalizasyon için bilgi kaynağı olarak hizmet vermektedir. Çok kanallı konfokal mikspektif, hücresel doğuştan gelen floresan spektral bilgilerini sağlar. Aşağıdaki protokolde CRM veya konfokal floresan mikspektroskopi ile elde edilen herhangi bir görüntüye sırasıyla CRM görüntüsü veya çok kanallı konfokal mikspektroskopi görüntüsü denir.
- Descanned spektral kanallara sahip bir konfokal mikroskobu fotomultiplier tüpe (PMT) veya GaAsP dedektörüne bağlayın.
NOT: Bu kurulumlar çeşitli üreticilerden edinilebilir. - Mikroskobu yüksek sayısal diyafram açıklığı (NA) hedefiyle yeterli büyütme ile donatın.
NOT: Bakteri hücrelerini analiz etmek için NA > 1.4 ile 63x hedefi önerilir. - Hücre morfolojisini görselleştirmek için olay ışığının hücresel dağılımını sağlayan CRM'ye uyum sağlamak için mikroskobu yarı yansıma aynası (örneğin NT 80/20) ile donatın.
- Çok kanallı konfokal mikrospektroskopi için mikroskobu dikroik aynalarla donatın. Örneğin, sırasıyla 405, 458, 488, 514 veya 633 nm heyecan vericileri için MBS InVis405, MBS458, MBS488/514, MBS488/543/633 ışın ayırıcılarını kullanın.
- Lazer güç ölçer kullanarak her bir heyecan dalga boyu için aydınlatma yoğunluğunu ayarlayın. Uyarılma dalga boyları aracılığıyla mikroskop altındaki çıkışı sabit tutun (örneğin, 63x hedefiyle 50 μW kullanın).
3. Görüntü alımı
- Mikroskop yazılımını kullanarak iğne deliği boyutunu 1 AU olarak ayarlayın.
- Her heyecan dalga boyu için piksel bekleme süresini (yani tarama hızını) ayarlayın.
NOT: Aşırı uzun piksel bekleme süresi hücrelere zarar verebilir. Hücrelere fotodamajı en aza indirmek için aşırı uzun piksel bekleme süresinden kaçının. Bakteriyel numuneler için, bir piksel bekleme süresi <55.6 μs/μm2 (mikroskop altındaki ışınım çıkışı ~17 μW/cm2 olduğunda) genellikle büyüme inhibisyonunu önlemek için uygundur. Bu parametre organizmalara ve deneysel kurulumlara bağlı olarak değişebilir. - Tarama çözünürlüğünü ayarlayın. Bakteri gibi küçük hücreler için 1.024 x 1.024 tarama alanı kullanın.
- Z tarama aralığını, ilgi alanı kapsanması için ayarlayın.
NOT: Agarose levha üzerine dağıtılan bakteriyel ve maya hücre örnekleri için genellikle ~15 μm'lik bir Z tarama aralığı yeterlidir. - Descanned dedektörünü görünür dalga boyu aralığını (örneğin, 416−691 nm) yakalayacak şekilde ayarlayın. 8−10 nm'lik bir spektral pencere kullanın.
- Floresan görüntülerin Z yığınlarını oluşturmak için en uzundan en kısa heyecan dalga boylarına kadar bir dizi sırayla çok kanallı konfokal mikspestoskopi görüntüleri elde edin.
- CRM görüntülerini alın.
- Alınan görüntüleri 16 bit tiff dosyaları olarak bir dizine kaydedin. XXX'in heyecan dalga boyu olduğu, YY'nin dedektör kanal numarası, ZZ'nin Z dilim numarası ve "c" ve "z" dedektör numarası ve Z-dilim numarası için sırasıyla önekler olduğu XXXcYYzZZ.tif adlandırma kuralını kullanarak dosyaları adlandırın.
- Örneğin, çok kanallı konfokal mikrospektroskopi görüntüsü, dedektör dizisinin 1. dedektör kanalı olan 405 nm'lik bir eksitasyon dalga boyu ile alınırsa ve Z.tif yığınının 5. CRM görüntüleri için XXX yerine "CRM" dizesini kullanın (örneğin, "CRMc01z05.tif").
NOT: 2D veya 3D segmentasyonun görüntü verileri için en uygun olup olmadığına karar verin. Küçük hücrelerin 2D düzlemle sınırlandırıldığı durumlarda (örneğin, cam yüzeye yapışmış bakteri popülasyonu) bir 2D segmentasyon yöntemi kullanın. Hücre popülasyonunun üç boyutlu bir alana dağıtıldığı durumlarda (örneğin, biyofilmler ve doku örnekleri) veya hücre boyutlarının optik dilimin kalınlığından (örneğin, maya hücreleri, memeli hücreleri) daha büyük olduğu durumlarda 3D segmentasyon yöntemini kullanın. 2D segmentasyon için bölüm 4'e bakın; 3D segmentasyon için bölüm 5'e bakın.
- Örneğin, çok kanallı konfokal mikrospektroskopi görüntüsü, dedektör dizisinin 1. dedektör kanalı olan 405 nm'lik bir eksitasyon dalga boyu ile alınırsa ve Z.tif yığınının 5. CRM görüntüleri için XXX yerine "CRM" dizesini kullanın (örneğin, "CRMc01z05.tif").
4. 2D görüntü analizi
- Bir iş istasyonunu görüntü analiz yazılımıyla donatın (örneğin, MATLAB).
- Hücre segmentasyonunu ve tek hücreli doğuştan gelen floresan imzalarının yeniden yapılandırılmasıni gerçekleştirin.
- Görüntü analiz yazılımını açın.
- Sağlanan "Script2D.m" komut dosyalarından birini çift tıklatın ve açın.
- Düzenleyici sekmesine gidin ve Çalıştır'ı tıklatın. Bir klasör seçim penceresi görünmelidir.
- 3.8. adımda oluşturulan dizini seçin ve devam etmek için Aç'ı tıklatın. Segmentasyon parametresinin girişini soran bir iletişim kutusu otomatik olarak görüntülenir.
NOT: Test amacıyla sağlanan veri kümesini seçin ("Sample_2D"). Örnek veri kümesi sıkıştırılmış bir dosya olarak sağlanır ve önceden ayıklanmalıdır. - Segmentasyon parametrelerini girin: Görüntü Binarizasyonu için Görüntü Binarizasyon Eşiği (0−1) = 0,45, Hücre Bölgesi için Üst Eşik (piksel cinsinden) = 200, Hücre Bölgesi için Alt Eşik (piksel cinsinden) = 10 ve Dedektör Sayısı = 32. Devam etmek için Tamam'ı tıklatın.
NOT: Bu parametreler görüntü kalitesine bağlı olarak ayarlama gerektirebilir. - CRM görüntüsü sunan yeni bir görüntü penceresi görünmelidir. Arka plan çıkarma için kullanılacak rasgele bir arka plan bölgesi (örneğin, hücrelerin bulunmadığı alan) seçin. Fare sürükleyerek CRM görüntüsü içinde bir dikdörtgen çizin. Seçimi onaylamak için seçili bölgede çift tıklatın.
- 4.2.4 adımında seçilen aynı dizinde İmza adlı yeni bir dizin bulun.
NOT: Sağlanan kod otomatik olarak bu dizini oluşturur. "İmza" dizini, bir popülasyondaki her mikrobiyal hücrenin doğuştan gelen floresan imzasını, ortak bir "İmza" önekinden sonra seri olarak numaralanan dosyaları .png olarak depolar.
5.3D görüntü analizi
- Bir iş istasyonunu görüntü analiz yazılımı (Malzeme Tablosu) ile donatın.
- Hücre segmentasyonunu ve tek hücreli doğuştan gelen floresan imzalarının yeniden yapılandırılmasıni gerçekleştirin.
- Görüntü analiz yazılımını açın.
- Sağlanan "Script3D.m" komut dosyasını çift tıklatın ve açın.
- Düzenleyici sekmesine gidin ve Çalıştır'ı tıklatın. Bir klasör seçim penceresi görünmelidir.
- 3.8. adımda oluşturulan dizini seçin ve devam etmek için Aç'ı tıklatın. Segmentasyon parametrelerinin girişini soran bir iletişim kutusu otomatik olarak görüntülenir.
NOT: Test amacıyla sağlanan veri kümesini seçin ("Sample_3D"). Örnek veri kümesi sıkıştırılmış bir dosya olarak sağlanır ve önceden ayıklanmalıdır. - Segmentasyon parametrelerini girin: Görüntü binarizasyonu için Görüntü Binarizasyon Eşiği (0–1) = 0,01, Hücre Birimi için Üst Eşik (piksel cinsinden) = 1.000, Hücre Bölgesi için Alt Eşik (piksel cinsinden) = 20, X Piksel Boyutu [μm/piksel] = 0,26, Y Piksel Boyutu [μm/piksel] = 0,26, Z piksel Boyutu [μm/piksel] = 0,42 ve Dedektör Sayısı = 32. Devam etmek için Tamam'ı tıklatın; heyecan dalga boylarının sayısını soran bir iletişim kutusu görüntülenir.
NOT: Bu parametreler görüntü kalitesine bağlı olarak ayarlama gerektirebilir. - Görüntü alma için kullanılan dalga boylarının sayısını girin (örneğin, 405, 488, 561, 630 kullanılıyorsa, diyalog kutusuna 4 girin). Tamam'ı tıklatın.
- Heyecan dalga boylarını diyalog kutularına en kısadan (yani kutu adı: Heyecanlandırma No. 1) ile en uzun dalga boyuna kadar bir sırayla girin. Devam etmek için Tamam'ı tıklatın; CRM görüntüsü sunan yeni bir görüntü penceresi açılmalıdır.
- Arka plan çıkarma için kullanılacak rasgele arka plan bölgesini (örneğin, hücrelerin bulunmadığı alan) seçin. Fare sürükleyerek CRM görüntüsü içinde bir dikdörtgen çizin. Seçimi onaylamak için seçili bölgede çift tıklatın.
- 5.2.4 adımında seçilen dizinde İmza adlı dizini bulun.
NOT: Sağlanan kod otomatik olarak bu dizini oluşturur. "İmza" dizini, bir popülasyondaki her bir mikrobiyal hücrenin doğuştan gelen floresan imzasını, ortak bir "İmza" önekinden sonra seri olarak numaralanan dosyaları .png olarak depolar.
6. İstatistiksel analiz
NOT: Hücre popülasyonlarının hiperspektrumlarının dağılımını görselleştirmek için boyutsal azaltma teknikleri (örneğin, ana bileşen analizi [PCA]) gerçekleştirin. Sağlanan komut dosyası (PCA.py) iki hücre popülasyonu (yani iki sınıf) için PCA yürütür.
- Bir iş istasyonunu programlama dili ve beraberindeki kütüphaneler ve modüllerle donatın (Malzeme Tablosu).
- C sürücüsünde (veya eşdeğerinde) boş bir dizin oluşturun ve dizini "Parent_directory" (örneğin, C:/ Parent_ dizini).
- İki hücre popülasyonunun her birinin floresan imzalarını (örneğin, adım 4.2.7'de oluşturulan .png dosyaları) iki ayrı dizinde depolayın.
NOT: İki dizin de "Parent_directory" içinde bulunmalıdır.
C:/Parent_directory/ putidaKT2440/
putidaKT2440/
 İmza01.png
İmza01.png
 İmza02.png
İmza02.png
 :
: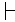 putidaKT2442/
putidaKT2442/
 İmza01.png
İmza01.png
 İmza02.png
İmza02.png
 :
: - PCA.py "Parent_directory" içine indirin.
- İş istasyonunun komut satırı arabirimini açın.
- Komut satırı arabirimine "python C:/Parent_directory/PCA.py" yazın.
- 'Hedef dizini seç' mesajı görüntülendikten sonra "Parent_directory" seçeneğini belirleyin.
- "C:/Parent_directory"nde, ortaya çıkan bir PCA çizimi içeren "PCA.png" bulun.
Sonuçlar
Şekil 1A, geleneksel spektrum grafiği (üstte) ve ısı haritası (ortada) olarak sunulan bakteri hücresinin tipik tek hücreli floresan imzasını göstermektedir. Şekil 1B, toprak bakterisi popülasyonunun orijinal CRM görüntüsünün üzerine yerleştirilmiş doğru bir 2B hücre segmentasyonunun sonucunu göstermektedir (Pseudomonas putida KT2440)12. Popülasyon için ortaya çıkan floresan imzaları Şekil 1D'de bir ısı haritası olarak sunulmaktadır. Başarılı hücre segmentasyonundan sonra intrapopülasyon değişkenliğinin nispeten küçük olduğunu unutmayın. Şekil 1B'de gösterildiği gibi aynı P. putida popülasyonuna bindirilen Şekil 1C'de yanlış hücre segmentasyonu örneği gösterilmiştir. Yanlış hücre segmentasyonunun popülasyonun doğuştan gelen floresan imzaları üzerindeki etkisi, önemli sayıda aykırı değerden kolayca anlaşılabilir (Şekil 1E, kırmızı üçgenler). Yanlış hücre segmentasyonu, PCA'dan sonra doğru hücre segmentasyonundan sonra elde edilen sıkı kümeye kıyasla daha gevşek bir küme ile sonuçlandı (Şekil 1F).
Tipik olarak, tür içi değişkenliğe rağmen, farklı hücre türlerinin doğuştan gelen floresan imzaları farklı kümeler oluşturur. Şekil 2C, taksonomik olarak yakın bir suş çifti (P. putida suşu KT2440 ve suşu KT244213) için PCA analizlerinin sonucunu sunar. Her ayrı popülasyonda gözlenen küçük değişkenliğe rağmen (Şekil 2A,B), her popülasyon PCA analiz grafiğinde ayrı bir küme oluşturmuştur (Şekil 2C).
Şekil 3A, tomurcuklanan maya Saccharomyces cerevisiae YM427114 popülasyonunun orijinal CRM görüntüsünün üzerine yerleştirilmiş doğru 3D hücre segmentasyonunun sonucunu göstermektedir. Şekil 3B, nüfus için doğuştan gelen floresan imzalarını göstermektedir.

Şekil 1: Segmentasyonun doğruluğu ve belirgin tür içi değişkenlik. (A) Bir bakteri hücresinin tipik tek hücreli doğuştan gelen floresan imzası (P. putida KT2440), spektrum grafiği (üstte) ve ısı haritası (ortada) olarak sunulmuştur. Emisyon dalga boyu gökkuşağı renk haritası (altta) olarak belirtilir. Spektrum grafiğinin Y ekseni ve ısı haritasının rengi, göreli floresan yoğunluklarını gösterir. Alttaki sayılar heyecan dalga boyunu gösteriyor. Görüntü analizi algoritması tarafından doğru (B) ve yanlış (C) hücre bölgesi tanımanın görsel gösterimi. Açık mavi gölgelendirme, P. putida KT 2440 toprak bakterisi popülasyonu için tespit edilen hücre bölgelerini gösterir. C panelinde kırmızı numaralandırma bulunan bloblar, algoritmanın hücre dışı bölgeleri (yani arka plan gürültüsünü) uygun olmayan binarizasyon eşiği ayarları nedeniyle hücre bölgeleri olarak sınıflandırdığı yanlış algılama örnekleridir. Ölçek çubukları = 1 μm boyunca. D ve E panelleri, sırasıyla doğru ve yanlış hücre segmentasyonu ile oluşturulan aynı popülasyon için doğuştan gelen floresan imzalarını tasvir eder. Her sütun, sarıdan maviye renk haritasının göreli floresan yoğunluğunu gösterdiği 1 x 192 matris olarak sunulan yeniden yapılandırılmış tek hücreli bir hiperspektrum gösterir. (F) PCA kullanılarak görselleştirilen doğru (açık mavi) ve yanlış (kırmızı) segmentasyonlarda doğuştan gelen floresan imzaların varyansı. Her eksen etiketi bileşen numarasını ve PCA analizine toplam yüzde katkısını gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Şekil 2: Doğuştan gelen floresan imzalarının iç ve türler arası değişkenliği. Doğuştan gelen floresan imzaları P. putida KT2440 (A) ve P. putida KT2442 (B) popülasyonu için ısı haritaları olarak sunulmuştur. (C) P. putida KT2440 (kırmızı, n = 288 ) ve P. putida KT2442'ye (mavi, n = 373) karşılık gelen PCA kullanılarak görselleştirilen iki doğuştan floresan imza çiftinin projeksiyonu. X ve Y eksenleri sırasıyla PC1 ve PC2'yi temsil eder. İçe gelen sayı her kümenin merkezini gösterir (1: P. putida KT2440, 2: P. putida KT2442). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
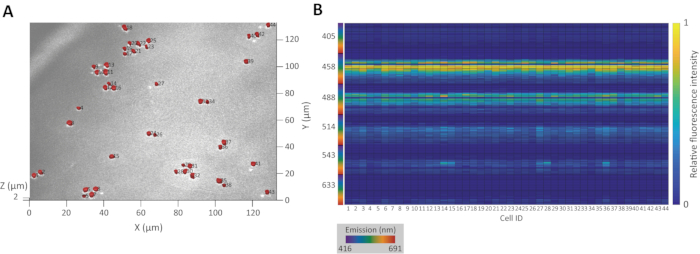
Şekil 3: 3D segmentasyon ve doğuştan floresan imza ekstraksiyonu örneği. (A) Tomurcuklanan maya S. cerevisiae YM4271 hücre popülasyonları olarak tanınan bölgelerin 3D projeksiyonu. Giriş numaraları kimlik numaralarıdır. (B) 3D bölgelerden çıkarılan doğuştan gelen floresan imzalarının ısı haritası. X ekseni numarası kimlik numarasına karşılık gelir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu yöntemde tekrarlanabilir sonuçlar elde etmek için yakından takip edilmesi gereken iki kritik nokta vardır: 1) mikroskop altındaki lazer güç çıkışını uyarım dalga boyları ve deneyleri ile tutarlı tutmak ve 2) doğru hücre segmentasyonu gerçekleştirmek.
İlk nokta, farklı deneyler arasında doğuştan gelen floresan imzasını karşılaştırırken özellikle önemlidir. Maksimum güç çıkışı lazer hatları arasında büyüklük sırasına kadar farklılık gösterebilir, çünkü aynı "çıkış yüzdesi" ayarlarını heyecan dalga boylarına uygulamaktan kaçının (örneğin, tüm 405, 488, 514 ve 530 nm lazer hatları için %5 güç çıkışı kullanarak). Ek olarak, amaç ve iç optikler genellikle aynı zamanda hesaba katılması gereken düzensiz optik emilim özelliklerine sahiptir. Bu nedenlerden dolayı, aslında bir lazer güç ölçer (Malzeme Tablosu) kullanılarak amaç altındaki çıktının ölçülmesi önerilir. Lazer çizgilerinden elde edilen çıktı birkaç yıl içinde önemli ölçüde bozunabileceğinden, bu ölçümün her birkaç deneyde veya periyodik olarak yapılması da önerilir.
İkinci nokta, doğru hücre segmentasyonu, özellikle tür içi veya türler arası değişkenliğin endişe kaynağı olduğu durumlarda önemli hale gelir. Yanlış hücre segmentasyonu (Şekil 1D), aykırı veri noktaları (Şekil 1E, kırmızı üçgenlerle gösterilir) ve daha belirgin tür içi değişkenlik ile sonuçlanır. Segmentasyon parametreleri, daha fazla analize veya makine öğrenimi modeline geçmeden önce, segmentasyon sonuçlarını orijinal CRM görüntüsüne bindirerek hücre segmentasyon doğruluğunu kontrol ederek dikkatlice belirlenmelidir. Düşük kaliteli bir görüntüyle çalışıyorsanız, doğru segmentasyon elde etmek için ek görüntü işleme gerekebilir. 'Gauss filtresi' veya 'ortanca filtre' kullanmak grenli yapıtları kaldırabilir ve ikili filtre işleme sayaçları herhangi bir çizgili arka plan.
Düşük kaliteli optikler (örneğin, konfokal olmayan bir sınıf hedefi) veya yetersiz dedektör hassasiyeti ile, soluk doğuştan gelen floresan imzalarının tespiti ile uğraşmak zor olabilir. Burada ve daha önce 11'de açıklanan kurulumu kullanarak, doğuştan gelen floresan, doğuştan gelen bir floresan imzasını yeniden oluşturmak için çok zayıf olan herhangi bir hücre örneğiyle karşılaşmadığımızı unutmayın. Daha güçlü emisyon sinyalleri elde etmek için daha yüksek emisyon çıkışı ve daha uzun piksel bekleme süresi kullanılabilse de, bu hücre örneklerine zarar verebilir. Silik doğuştan gelen floresanların bir sorun olduğu durumlar için potansiyel bir çözüm, örneğin et suyu yerine tampon veya sentetik ortamdaki hücreleri askıya alarak arka plan sinyal yoğunluğunu azaltmaktır. Cam dip yemekleri ve mikroakışkan cihazlar gibi hücre kapları türleri bu teknik için uyumlu ve uygundur, ancak burada ve önceki bir çalışmada hücreleri yerinde tutmak için bir agarose levha kullanılmıştır15.
Konfokal mikroskop yöntemi, yapışık hücre popülasyonları, biyofilmler ve doku örnekleri için mekansal çözünürlük ve yerinde analiz sunar. Bu metodolojinin olası bir takası, örneğin bir akış sitometresine kıyasla maksimum aktarım hızıdır. Tek bir tarama kümesiyle birkaç yüz ila bin doğuştan gelen floresan imzası toplayan eksiksiz bir konfokal tarama seti birkaç dakika kadar sürebilir. Akış sitometresi optik tasarımı nedeniyle daha az hassastır, ancak potansiyel olarak birkaç büyüklük sırasına göre daha büyük bir verim elde edebilir.
Doğuştan gelen bir floresan imzada belirli bir zirveden sorumlu olan bir bileşiği titizlikle tanımlamak, karmaşık doğası nedeniyle genellikle zordur. Bununla birlikte, vitaminler (örneğin, flavin adenin dinükleotid [FAD]), koenzimler (örneğin, nikotinamid adenin dinükleotid [NADH]) ve lipofussin pigmentleri gibi biyolojik olarak ilgili bir dizi molekülün hücrelerde önemli floroforlar olabileceği ileri sürmüştür1,16. Örneğin, FAD en fazla 350-450 nm arasında bir ekscitasyona ve yaklaşık 525 nm16'da bir emisyon zirvesine sahiptir. Serbest NADH, proteine bağlı NADH'ın emisyon spektrumu 16,17,18 farklı olmasına rağmen, sırasıyla 340 nm ve 460 nm'de bir ekscitasyon maksimum ve emisyon zirvesine sahiptir. Stresli veya yaşlı hücrelerle ilişkili olduğu bilinen lipopigmentler geniş bir eksitasyon aralığına (350–500 nm) ve emisyon aralığına (450-600 nm)16,18 sahiptir.
CRM kullanımı, hücre hatlarını tanımlamak için bağımsız bir bilgi kaynağı sunar ve bu nedenle CRIF'in bir başka önemli avantajını sağlar: 3D alanda dağıtılan tek tek hücrelerden floresan sinyallerinin seçici olarak çıkarılması. Bu, bütün bir mikrobiyal koloninin floresan özelliklerinin geleneksel analizinden veya orta bileşenlerden, salgılanan metabolitlerden ve hücre dışı matrislerden gelen hücre dışı sinyallerle kontamine olmuş çok sayıda hücreden gelen sinyallerin ortalama bir karışımı olan toplu kültür süspansiyonundan ileriye doğru bir adımı temsil eder. Tek hücreli doğuştan gelen floresan imzaların analizi, sağlam hücrelerin fizyolojik durumunun tahmine dayalı olarak karakterize edilmesine izin vererek, bir hücrenin dağılımının ve fizyolojik durumunun zamansal gelişimini çözmek için potansiyel bir çözüm sağlar.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bu çalışma kısmen Japonya Eğitim, Kültür, Spor ve Teknoloji Bakanlığı'ndan (18K04843) Y. Yawata'ya, JST ERATO'dan (JPMJER1502) N. Nomura'ya bilimsel araştırmalar için bir hibe ile desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Agarose | Wako Chemicals | 312-01193 | |
| Beam splitters | Carl Zeiss, Nikon | MBSInVis405, MBS458, MBS488, MBS458/514, MBS488/543, or MBS 488/543/633 beam splitters (Carl Zeiss) | |
| Confocal microscope | Carl Zeiss, Nikon | Model LSM 880 (Carl Zeiss), Model A1R (Nikon) | |
| Cover slips | Matsunami Glass | C024601 | |
| Glass slides | Matsunami Glass | S011120 | |
| Half-reflection mirror | Carl Zeiss, Nikon | NT80/20 | |
| Laser power meter | Thorlabs | PM400 (power meter console) and S175C (sensor) | |
| LB Broth | Nacalai tesque | 20066-95 | For bacteria culture |
| Image analysis software | The MathWorks | MATLAB version 2019a or later, Image Processing Toolbox is needed | |
| Microscope objective | Carl Zeiss, Nikon | 440762-9904 | e.g. 63x plan Apochomat NA = 1.4 (Carl Zeiss) |
| Microscope software | Carl Zeiss, Nikon | ZEN (Carl Zeiss),NIS-elements (Nikon) | |
| PBS(-) | Wako Chemicals | 166-23555 | |
| Programming language | Python and libraries, modules (numpy, scikit-learn, scikit-image, os, glob, matplotlib, tkinter) are rquired to run the supplied PCA script. | ||
| Silicone gasket | ThermoFisher Scientific | P24744 | |
| Workstation | A high-performance workstation with discrete GPUs is recommended. | ||
| Yeast extract-peptone-dextrose (YPD) agar medium | Sigma-Aldrich | Y1500-250G | For yeast culture |
| YPD medium | Sigma-Aldrich | Y1375-250G |
Referanslar
- Monici, M. Cell and tissue autofluorescence research and diagnostic applications. Biotechnology Annual Review. 11, 227-256 (2005).
- Tang, J. Microbial metabolomics. Current Genomics. 12, 391-403 (2011).
- Woo, P. C., Lau, S. K., Teng, J. L., Tse, H., Yuen, K. Y. Then and now: use of 16S rDNA gene sequencing for bacterial identification and discovery of novel bacteria in clinical microbiology laboratories. Clinical Microbiology and Infection. 14, 908-934 (2008).
- Amman, R., Fuchs, B. M. Single-cell identification in microbial communities by improved fluorescence in situ hybridization techniques. Nature Reviews Microbiology. 6, 339-348 (2008).
- Giana, H. E., Silveira, L., Zângaro, R. A., Pacheco, M. T. T. Rapid identification of bacterial species by fluorescence spectroscopy and classification through principal components analysis. Journal of Fluorescence. 13 (6), 489-493 (2003).
- Leblanc, L., Dufour, E. Monitoring the identity of bacteria using their intrinsic fluorescence. FEMS Microbiology Letters. 211 (2), 147-153 (2002).
- Hou, X., Liu, S., Feng, Y. The autofluorescence characteristics of bacterial intracellular and extracellular substances during the operation of anammox reactor. Scientific Reports. 7, 39289(2017).
- Ramanujam, N., et al. In vivo diagnosis of cervical intraepithelial neoplasia using 337-nm-excited laser-induced fluorescence. Proceeding National Academy of Sciences of the United States of America. 91 (21), 10193-10197 (1994).
- Zhang, J. C., et al. Innate cellular fluorescence reflects alterations in cellular proliferation. Lasers in Surgery and Medicine. 20 (3), 319-331 (1997).
- Gosnell, M. E., et al. Quantitative non-invasive cell characterisation and discrimination based on multispectral autofluorescence features. Scientific Reports. 6, 23453(2016).
- Yawata, Y., et al. Intra- and interspecies variability of single-cell innate fluorescence signature of microbial cell. Applied and Environmental Microbiology. 85, 00608-00619 (2019).
- Nelson, K. E., et al. Complete genome sequence and comparative analysis of the metabolically versatile Pseudomonas putida KT2440. Environmental Microbiology. 4 (12), 799-808 (2002).
- Bagdasarian, M., et al. Specific-purpose plasmid cloning vectors. II. Broad host range, high copy number, RSF1010-derived vectors, and a host-vector system for gene cloning in Pseudomonas. Gene. 16 (1-3), 237-247 (1981).
- Luo, Y., Vijaychander, S., Stile, J., Zhu, L. Cloning and analysis of DNA-binding proteins by yeast one-hybrid and one-two-hybrid systems. Biotechniques. 20 (4), 564-568 (1996).
- Yawata, Y., et al. Monitoring biofilm development in a microfluidic device using modified confocal reflection microscopy. Journal of Bioscience and Bioengineering. 110 (3), 377-380 (2010).
- Lakowicz, J. R. Principles of Fluorescence Spectroscopy. Third edition. , Springer. Germany. (2006).
- Blacker, T. S., Duchen, M. R. Investigating mitochondrial redox state using NADH and NADPH autofluorescence. Free Radical Biology & Medicine. 100, 53-65 (2016).
- Croce, A. C., Bottiroli, G. Autofluorescence spectroscopy and imaging: A tool for biomedical research and diagnosis. European Journal of Histochemistry. 58 (4), 2461(2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır