Method Article
공초점 현미경 검사법에 의한 단세포 인천성형광서명의 재구성
요약
여기서, 3차원 공간에 분포된 모든 개별 라이브 셀로부터 광적으로 추출 및 분류하는 프로토콜(즉, 세포 자동 형광)을 제시한다. 이 방법은 박테리아, 곰팡이, 효모, 식물 및 동물의 세포를 포함하여 단일 세포 해상도에서 다양한 생물학적 시스템의 타고난 형광 서명을 연구하는 데 적합합니다.
초록
여기서 설명된 공초점 반사 현미경 보조 단세포 인천성광 분석(CRIF),3차원(3D) 공간에 분포된 인구에서 각 개별 라이브 셀로부터 선천적인 세포 형광 시그니처를 재구성하는 최소 침습적 방법이다. 세포의 타고난 형광 시그니처는 세포 내의 다양한 생체 분자에 의해 방출되는 형광 신호의 모음입니다. 이전 연구는 타고난 형광 서명이 다양한 세포 특성과 생리적 상태의 차이를 반영하고 세포 특성화 및 식별을위한 풍부한 정보 소스임을 확립했습니다. 선천적 형광 서명은 전통적으로 인구 수준에서 분석되어 복제 배양을 필요로하지만 단일 세포 수준에서는 그렇지 않습니다. CRIF는 개별 세포에서 형광 신호의 3D 해상도 및/또는 선택적 추출을 요구하는 연구 결과에 특히 적합합니다. 형광 서명은 세포의 타고난 특성이기 때문에 CRIF는 그대로 및 단일 세포의 유형 및 / 또는 생리 적 상태의 태그없는 예측에도 적합합니다. 이 방법은 이종 집단에서 각 단일 세포의 표현형이 세포 태그없이 현미경의 밑에 그것의 자동 형광 서명에 의해 직접 평가될 수 있는 능률적인 세포 분석을 위한 강력한 공구일 지도 모릅니다.
서문
셀1 내의 다양한 생체 분자는 자가 형광 신호를 방출하고, 세포의 타고난 형광 서명은 이러한 신호의 조립으로 구성된다. 이 시그니처 형광은 다양한 세포 특성과 생리적 상태의 차이를 반영합니다. 선천적 형광의 분석은 최소 침습적이며 온화한 신진 대사 수정에서 완전한 세포 파괴에 이르기까지 다양한 흔적을 남기는 전통적인 침습적 미생물 프로브를 보완 할 수 있습니다. DNA 또는 세포 함량 추출2,3, 시투 혼성화4의 형광등, 그리고 게놈에 형광 기자 유전자의 도입과 같은 전통적인 기술은 세포 유형 또는 생리적 상태를 결정하는 데 효과적이지만, 일반적으로 세포의 조작또는 침습적 태깅이 필요합니다.
벌크 미생물 배양 현탁액5,6, 활성 슬러지7, 포유류 조직8,9 및 포유류 세포를 포함한 다양한 살아있는 및 그대로 미생물 식민지의 타고난 형광에 대한 연구는 선천성 형광 분석이 세포 유형 및 생리 상태의 태그 없는 분석을 용이하게 하는 것으로 나타났습니다. 선천적 형광 서명은 전통적으로 단일 세포 수준이 아닌 인구 수준에서 분석되어 클론 배양을 필요로합니다. 대조적으로, confocal refction microscopy-보조 단세포 innate fluorescence 분석 (CRIF) 기술11 여기에 설명된 각 개별 살아있는 미생물 세포의 타고난 세포 형광 서명을 재구성하고 카탈로그합니다. 더욱이, CRIF는 3차원(3D) 공간에 분포되는 집단 내에서 단일 미생물 세포의 선천적 형광 서명을 체계적으로 대조할 수 있다.
프로토콜
1. 샘플 준비
- 유리 슬라이드에 우물이 있는 1mm 두께의 실리콘 개스킷을 놓습니다.
- 실리콘 개스킷의 우물에 1mm 두께0.8%(w/v) 아가로즈 슬래브를 놓습니다.
- 임의미생물세포배양주의 세포밀도를 600nm(OD660) = 1.0에서 광학 밀도로 희석한다.
- 아가로즈 슬래브에 세포 현탁액의 5 μL 알리쿼트를 놓습니다.
- 유리 커버슬립으로 부드럽게 덮습니다.
2. 현미경의 설정
참고: CRIF 기술은 공초점 반사 현미경 검사법(CRM)과 멀티채널 공초점 현미경 분석법을 결합합니다. CRM은 세포 선천성 형광과는 무관한 세포 형태학 및 공간 국소화를 위한 정보의 근원 역할을 합니다. 멀티채널 공초점 현미경 검사는 세포 선천성 형광의 스펙트럼 정보를 제공합니다. 다음 프로토콜에서, CRM 또는 공초점 형광 현미경 분석기로 취득된 모든 심상은 CRM 영상 또는 다중 채널 공초점 현미경 분광법 심상으로, 각각 지칭된다.
- 소멸된 스펙트럼 채널과 공초점 현미경을 광증 튜브(PMT) 또는 GaAsP 검출기에 연결합니다.
참고: 이러한 설정은 여러 제조업체에서 사용할 수 있습니다. - 현미경에 높은 숫자 조리개 (NA) 목표를 적절한 배율로 장착하십시오.
참고: NA > 1.4를 가진 63x 목표는 세균성 세포를 분석하기 위해 권장됩니다. - 현미경에 반 반사 거울(예: NT 80/20)을 장착하여 사고 광의 세포 분산에 의존하여 세포 형태를 시각화하는 CRM을 수용하십시오.
- 멀티채널 공초점 현미경 검사법의 경우 현미경에 이색 거울을 장착하십시오. 예를 들어, MBS InVis405, MBS458, MBS458/514, MBS488/543, 또는 MBS 488/543/633 빔 스플리터 405, 458, 488, 514, 543, 또는 633 nm, excitationly를 사용합니다.
- 레이저 파워 미터를 사용하여 각 여기 파장에 대한 조명 강도를 조정합니다. 여기 파장을 통해 현미경 의 밑에 출력을 일정하게 유지하십시오 (예를 들어, 63x 목표와 함께 50 μW를 사용하십시오).
3. 이미지 수집
- 현미경 소프트웨어를 사용하여 핀홀 크기를 1AU로 설정합니다.
- 각 여기 파장에 대해 픽셀 거주 시간(예: 스캔 속도)을 설정합니다.
참고: 픽셀 이너무 긴 픽셀 거주 시간은 세포를 손상시킬 수 있습니다. 셀의 광피해를 최소화하기 위해 픽셀이 지나치게 긴 시간을 피하십시오. 세균성 시료의 경우, 픽셀 거주 시간 <55.6 μs/μm2 (현미경의 절개 출력이 ~17 μW/cm2인 경우)는 일반적으로 성장 억제를 피하기에 적합하다. 이 매개 변수는 유기체 및 실험 설정에 따라 달라질 수 있습니다. - 스캔 해상도를 설정합니다. 박테리아와 같은 작은 세포의 경우 1,024 x 1,024의 스캐닝 영역을 사용하십시오.
- 관심 영역이 다루어지되도록 Z 스캐닝 범위를 설정합니다.
참고: 아가로즈 슬래브에 분포된 세균 및 효모 세포 샘플의 경우, -15 μm의 Z 스캐닝 범위는 일반적으로 충분합니다. - 가시 파장 범위(예: 416-691 nm)를 캡처하기 위해 탈세 검출기를 설정합니다. 8-10 nm의 스펙트럼 창을 사용합니다.
- 다중 채널 공초점 현미경 이미지를 가장 긴 에서 최단 흥분 파장에서 순서로 획득하여 형광 이미지의 Z 스택을 만듭니다.
- CRM 이미지를 획득합니다.
- 획득한 이미지를 16비트 티프 파일로 디렉토리에 저장합니다. XXX가 흥분 파장인 명명 규칙 XXXcYzZZ.tif를 사용하여 파일의 이름을 지정하고, YY는 검출기 채널 번호이고, ZZ는 Z 슬라이스 번호이며, "c"와 "z"는 각각 검출기 번호와 Z 슬라이스 번호의 접두사입니다.
- 예를 들어, 다중 채널 공초점 마이크로스펙트로스크 이미지가 405nm, 검출기 어레이의 제1 검출기 채널의 내분 파장으로 촬영되고, Z-스택의 5번째 슬라이스인 경우, "405c01z05.tif"라고 지칭한다. CRM 이미지의 경우 XXX 대신 문자열 "CRM"을 사용합니다(예: "CRMc01z05.tif").
참고: 2D 또는 3D 세분화가 이미지 데이터에 가장 적합한지 여부를 결정합니다. 작은 세포가 2D 평면에 제약을 받는 상황에서 2D 세분화 방법을 사용합니다(예: 유리 표면에 어항을 인고하는 세균 모집단). 세포 집단이 3차원 공간(예를 들어, 생물막 및 조직 샘플)에 분포되는 상황에서 3D 세분화 방법을 사용하거나 세포 크기가 광학 슬라이스의 두께(예를 들어, 효모 세포, 포유류 세포)의 두께보다 크다. 2D 세분화의 경우 섹션 4를 참조합니다. 3D 세분화의 경우 섹션 5를 참조하십시오.
- 예를 들어, 다중 채널 공초점 마이크로스펙트로스크 이미지가 405nm, 검출기 어레이의 제1 검출기 채널의 내분 파장으로 촬영되고, Z-스택의 5번째 슬라이스인 경우, "405c01z05.tif"라고 지칭한다. CRM 이미지의 경우 XXX 대신 문자열 "CRM"을 사용합니다(예: "CRMc01z05.tif").
4. 2D 이미지 분석
- 워크스테이션에 이미지 분석 소프트웨어(예: MATLAB)를 장착합니다.
- 단세포 선천적 형광 서명의 세포 세분화 및 재구성을 수행합니다.
- 이미지 분석 소프트웨어를 엽니다.
- 제공된 스크립트 "Script2D.m"를 두 번 클릭하고 엽니다.
- 편집기 탭으로 이동한 다음 실행을 클릭합니다. 폴더 선택 창이 나타납니다.
- 3.8단계에서 만든 디렉토리를 선택한 다음 열기 를 클릭하여 진행합니다. 분할 매개 변수의 입력을 묻는 대화 상자가 자동으로 나타납니다.
참고: 테스트 목적으로 제공된 데이터 집합("Sample_2D")을 선택합니다. 샘플 데이터 집합은 압축 된 파일로 제공되며 사전에 추출해야합니다. - 분할 매개 변수 입력: 이미지 비나화에 대한 이미지 Binarization (0-1) = 0.45, 셀 영역(픽셀) = 200, 셀 영역(픽셀) = 10, 검출 기 수 = 32에 대한 낮은 임계값. 확인 을 클릭하여 진행합니다.
참고: 이러한 매개 변수는 이미지 품질에 따라 조정이 필요할 수 있습니다. - CRM 이미지를 표시하는 새 이미지 창이 나타나야 합니다. 백그라운드 영역(예: 셀이 없는 영역)을 선택하여 백그라운드 빼기에 사용합니다. 마우스 드래그하여 CRM 이미지 내에서 사각형을 그립니다. 선택한 영역 내에서 두 번 클릭하여 선택을 확인합니다.
- 4.2.4 단계에서 선택한 동일한 디렉터리에서 서명 이라는 새 디렉터리를 찾습니다.
참고: 제공된 코드는 자동으로 이 디렉터리를 만듭니다. "서명" 디렉터리는 일반적인 접두사 "서명"후에 일련 번호가 매겨진 .png 파일로 각 미생물 셀의 타고난 형광 서명을 저장합니다.
5.3D 이미지 분석
- 워크스테이션에 이미지 분석 소프트웨어(재료 표)를 장착합니다.
- 단세포 선천적 형광 서명의 세포 세분화 및 재구성을 수행합니다.
- 이미지 분석 소프트웨어를 엽니다.
- 제공된 스크립트 "Script3D.m"를 두 번 클릭하고 엽니다.
- 편집기 탭으로 이동한 다음 실행을 클릭합니다. 폴더 선택 창이 나타납니다.
- 3.8단계에서 만든 디렉토리를 선택한 다음 열기 를 클릭하여 진행합니다. 분할 매개 변수의 입력을 묻는 대화 상자가 자동으로 나타납니다.
참고: 테스트 목적으로 제공된 데이터 집합("Sample_3D")을 선택합니다. 샘플 데이터 집합은 압축 된 파일로 제공되며 사전에 추출해야합니다. - 분할 매개 변수 입력: 이미지 비나화에 대한 이미지 비나화 임계값 (0-1) = 0.01, 셀 볼륨(픽셀) = 1,000, 셀 영역(픽셀) = 20, X 픽셀 크기 [μm/픽셀] = 0.26, Y 픽셀 크기 [μm/픽셀] = 0.26, Z 픽셀 크기 [μm/픽셀] = 0.42= 0.42, 및 검출기 의 수 = 32. 확인 을 클릭하여 진행합니다. 여기 파장의 수에 대한 입력을 묻는 대화 상자가 나타납니다.
참고: 이러한 매개 변수는 이미지 품질에 따라 조정이 필요할 수 있습니다. - 이미지 수집에 사용되는 파장의 수를 입력합니다(예: 405, 488, 561, 630이 사용되는 경우 대화 상자에 4 를 입력). 확인을 클릭합니다.
- 가장 짧은(즉, 상자 이름: 여기 1번)에서 대화 상자에 가장 긴 파장에 이르는 순서로 여기 파장을 입력합니다. 확인 을 클릭하여 진행합니다. CRM 이미지를 제공하는 새 이미지 창이 팝업되어야 합니다.
- 백그라운드 빼기에는 임의백 영역(즉, 셀이 없는 영역)을 선택합니다. 마우스 드래그하여 CRM 이미지 내에서 사각형을 그립니다. 선택한 영역 내에서 두 번 클릭하여 선택을 확인합니다.
- 5.2.4 단계에서 선택한 디렉터리에서 서명 이라는 디렉토리를 찾습니다.
참고: 제공된 코드는 자동으로 이 디렉터리를 만듭니다. "서명" 디렉터리는 일반적인 접두사 "서명"을 한 후 일련 번호가 매겨진 .png 파일로 각 단일 미생물 셀의 타고난 형광 서명을 저장합니다.
6. 통계 분석
참고: 치수 감소 기술(예: 주 성분 분석[PCA])을 수행하여 세포 집단의 하이퍼스펙트럼 분포를 시각화합니다. 제공된 스크립트(PCA.py)는 두 개의 셀 모집단(즉, 두 클래스)에 대해 PCA를 실행합니다.
- 워크스테이션에 프로그래밍 언어와 함께 제공되는 라이브러리 및 모듈(재료 표)을 장착합니다.
- C 드라이브(또는 이와 동등한)에 빈 디렉터리를 만들고 디렉토리 "Parent_directory"(예: C:/)의 이름을 지정합니다. Parent_ 디렉토리).
- 두 셀 모집단의 형광 서명(예: 4.2.7단계에서 생성된 .png 파일)을 두 개의 개별 디렉터리로 저장합니다.
참고: 두 디렉터리 모두 "Parent_directory"에 있어야 합니다.
C:/Parent_directory/ 푸티다KT2440/
푸티다KT2440/
 시그니처01.png
시그니처01.png
 시그니처02.png
시그니처02.png
 :
: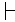 푸티다KT2442/
푸티다KT2442/
 시그니처01.png
시그니처01.png
 시그니처02.png
시그니처02.png
 :
: - "Parent_directory"에 PCA.py 다운로드합니다.
- 워크스테이션의 명령줄 인터페이스를 엽니다.
- 명령줄 인터페이스에 "파이썬 C:/Parent_directory/PCA.py"를 입력합니다.
- '대상 디렉토리 선택'이라는 메시지가 표시된 후 'Parent_directory'을 선택합니다.
- "C:/Parent_directory"에서 결과 PCA 플롯이 포함된 "PCA.png"를 찾습니다.
결과
도 1A는 전통적인 스펙트럼 플롯(top)과 히트맵(middle)으로 제시된 세균 세포의 전형적인 단세포 형광 서명을 나타낸다. 도 1B는 토양 박테리아집단의 원래 CRM 이미지 위에 중첩된 정확한 2D 세포 세분화의 결과를 나타낸다(슈도모나스 푸티다 KT2440)12. 인구에 대한 그 결과 타고난 형광 서명은 도 1D의 히트맵으로 제시됩니다. 성공적인 세포 세분화 에 따라 인구 내 변동성은 상대적으로 미미했다. 부정확한 세포 세분화의 예는 도 1B에 도시된 것과 동일한 P. putida에 겹쳐지는 도 1C에 도시된다. 인구의 타고난 형광 서명에 부정확한 세포 세분화의 영향은 상당한 수의 이상치(그림 1E, 빨간색 삼각형)에서 쉽게 명백합니다. 부정확한 세포 세분화는 정확한 세포 세분화에 따라 얻어진 단단한 클러스터에 비해 PCA 후 느슨한 클러스터를 초래하였다(도 1F).
전형적으로 종 내 가변성에도 불구하고, 다른 세포 모형의 선천적인 형광 서명은 별개의 클러스터를 형성합니다. 도 2C는 분류적으로 가까운 균주 쌍에 대한 PCA 분석의 결과를 제시한다 (P. putida 변형 KT2440 및 변형 KT244213). 각 개별 집단(그림 2A, B) 내에서 관찰된 사소한 가변성에도 불구하고 각 모집단은 PCA 분석 플롯(그림 2C)에 고유한 클러스터를 형성했습니다.
도 3A는 신진 효모 Saccharomyces cerevisiae YM427114의 집단의 원래 CRM 이미지 위에 중첩 정확한 3D 세포 세분화의 결과를 보여줍니다. 도 3B는 인구에 대한 결과 타고난 형광 서명을 나타낸다.

도 1: 세분화 및 명백한 종 내 가변성의 정확도. (A) 세균 세포의 전형적인 단세포 인천성 형광 서명 (P. putida KT2440), 스펙트럼 플롯 (상단) 및 열지도 (중간)로 제시. 방출 파장이 무지개 색 맵(아래쪽)으로 표시됩니다. 스펙트럼 플롯의 Y 축과 열 맵의 색상은 모두 상대형광 강도를 나타냅니다. 하단의 숫자는 여기 파장을 나타냅니다. 이미지 분석 알고리즘에 의한 정확한(B) 및 부정확한(C) 세포 영역 인식의 시각적 표현. 라이트 블루 차도는 토양 박테리아 P. 푸티다 KT 2440의 인구에 대해 검출된 세포 영역을 나타낸다. 패널 C 에 적색 번호가 있는 Blob은 알고리즘이 부적절한 바이너화 임계값 설정으로 인해 비셀 영역(즉, 배경 잡음)으로 분류된 잘못된 탐지의 예입니다. 스케일 바 = 전체 1 μm. 패널 D 및 E 는 각각 정확하고 부정확한 세포 세분화로 생성된 동일한 집단에 대한 타고난 형광 서명을 묘사합니다. 각 열은 1 x 192 매트릭스로 표시되는 재구성된 단일 셀 하이퍼스펙트럼을 나타내며, 여기서 노란색-파란색 색상 맵은 상대형 형광 강도를 나타냅니다. (F) PCA를 사용하여 시각화된 정확한(라이트 블루) 및 부정확한(빨간색) 세분화의 선천적 형광 서명의 차이. 각 축 레이블은 구성 요소 수와 PCA 분석에 대한 누적 백분율 기여를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
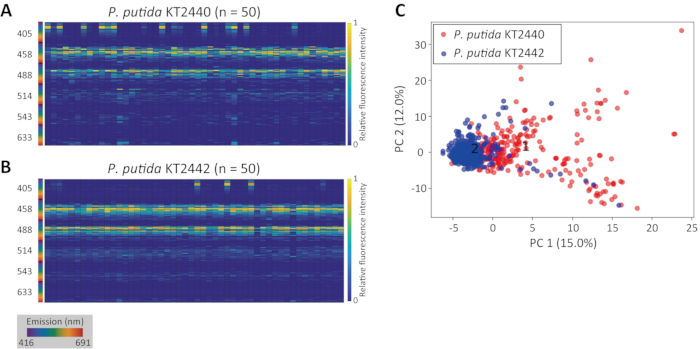
그림 2: 선천성 형광 서명의 종내 및 종간 가변성. P. putida KT2440 (A) 및 P. putida KT2442 (B)의 인구에 대한 열지도로 제시 된 타고난 형광 서명. (C) P. putida KT2440 (빨간색, n = 288) 및 P. putida KT2442 (파란색, n = 373)에 대응하는 PCA를 사용하여 시각화 된 두 개의 타고난 형광 시그니처 쌍의 투영. X-및 Y축은 각각 PC1 및 PC2를 나타냅니다. 인세트 번호는 각 클러스터의 중심을 나타냅니다 (1: P. putida KT2440, 2: P. putida KT2442). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
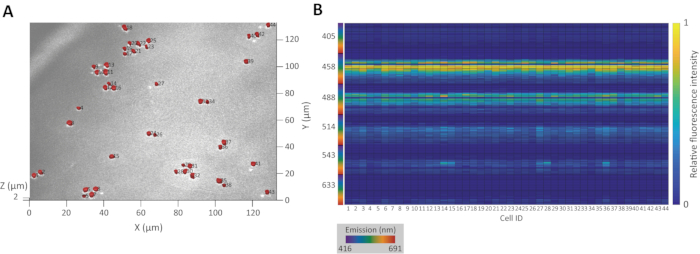
그림 3: 3D 세분화 및 타고난 형광 서명 추출의 예. (A) 신진 효모S. 세레비시아 에 YM4271의 세포 집단으로 인식된 영역의 3D 투영. 시작 번호는 식별 번호입니다. (B) 3D 영역에서 추출한 선천성 형광 서명의 열지도. X축 번호는 식별 번호에 해당합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
재현 가능한 결과를 얻기 위해 밀접하게 따라야 하는 두 가지 중요한 점이 있습니다: 1) 심내 목표하에서 레이저 전력 출력을 관찰하고, 2) 정확한 세포 세분화를 수행한다.
첫 번째 점은 다른 실험 중 타고난 형광 서명을 비교할 때 특히 중요합니다. 최대 전력 출력이 레이저 라인 간의 크기 순서까지 다를 수 있기 때문에 단순히 동일한 "백분율 출력" 설정을 여기 파장(예: 405, 488, 514 및 530 nm 레이저 라인 모두에 대해 5%의 전력 출력을 사용하는)에 적용하지 마십시오. 또한, 목표와 내부 광학은 일반적으로 고르지 않은 광학 흡수 특성을 가지며, 이는 또한 고려해야 한다. 이러한 이유로 레이저 파워 미터(재료 표)를 사용하여 목표하에서 출력을 측정하는 것이 좋습니다. 레이저 라인의 출력이 몇 년 동안 크게 붕괴 될 수 있기 때문에 이 측정을 몇 가지 실험마다 또는 주기적으로 하는 것이 좋습니다.
두 번째 점, 정확한 세포 세분화는 종 내 또는 종 간 가변성이 우려되는 상황에서 특히 중요합니다. 부정확한 세포 세분화(그림 1D)는 이상값 데이터 포인트(그림 1E, 빨간색 삼각형으로 표시)와 더 큰 명백한 종 내 가변성을 초래합니다. 세분화 매개 변수는 추가 분석 또는 교육 기계 학습 모델로 진행하기 전에 세분화 결과를 원래 CRM 이미지에 오버레이하여 셀 세분화 정확도를 검사하여 신중하게 결정해야 합니다. 품질이 좋지 않은 이미지로 작업하는 경우 정확한 세분화를 달성하기 위해 추가 이미지 처리가 필요할 수 있습니다. '가우시안 필터' 또는 '중앙값 필터'를 사용하면 거친 아티팩트를 제거할 수 있으며, 양자 간 필터 처리는 스트라이프 배경을 카운터로 처리합니다.
품질이 좋지 않은 광학(예: 비공초점 등급 목표) 또는 검출기 감도 가 부족하여 희미한 선천성 형광 서명의 검출을 처리하는 것은 어려울 수 있습니다. 여기에 설명된 설정을 사용하여 111이전에는 선천적 형광이 너무 희미하여 선천적 형광 서명을 재구성하는 세포 샘플의 어떤 유형도 발생하지 않았습니다. 여기에 대한 높은 방출 출력과 더 긴 픽셀 거주 시간을 사용하여 더 강한 방출 신호를 얻을 수 있지만, 이것은 세포 샘플에 손상을 일으킬 수 있습니다. 희미한 선천적 형광이 문제가되는 경우의 잠재적 인 해결책은 예를 들어 국물 대신 버퍼 또는 합성 미디어에서 세포를 일시 중단하여 배경 신호 강도를 줄이는 것입니다. 아가로스 슬래브가 본전 및 이전 연구에서 세포를 유지하였음에도 불구하고 유리 바닥 접시 및 미세 유체 장치와 같은 세포 용기의 유형은 이 기술에 적합하고 적합합니다15.
공초점 현미경 방법은 부착 세포 인구, 생물막 및 조직 샘플을 위한 공간 해상도 및 시상 분석을 제공합니다. 예를 들어, 이 방법론의 잠재적 인 절충은 유동 사이토미터에 비해 최대 처리량입니다. 단일 스캔 세트로 수백~100개의 선천형 형광 서명을 수집하는 전체 공초점 스캔 세트는 최대 몇 분정도 걸릴 수 있습니다. 유량 사이토미터는 광학 설계로 인해 민감하지 않지만 잠재적으로 몇 배의 크기로 인해 처리량을 달성할 수 있습니다.
선천적 형광 서명에서 특정 피크를 담당하는 화합물을 엄격하게 식별하는 것은 일반적으로 복잡한 특성으로 인해 도전적입니다. 그러나, 비타민(예를 들어, 플라빈 아데닌 디뉴클레오티드[FAD]), 코엔자임(예를 들어, 니코티나미드 아데닌 디뉴클레오티드[NADH]) 및 리포푸스신 안료와 같은 다수의 생물학적 관련 분자가 세포에서 주요 형광이 될 수 있다고 제안되었습니다. 예를 들어, FAD는 350-450 nm 사이의 최대 흥분과 약 525 nm16에서 방출 피크를 가지고 있습니다. 무료 NADH는 단백질 바운드 NADH의 방출 스펙트럼은 16,17,18과 다르지만 각각 340 nm 및 460 nm에서 흥분 최대 및 방출 피크를 가지고 있습니다. 스트레스 또는 숙성 세포와 연관되는 것으로 알려진 리포색소침착은 광범위한 흥분 범위(350-500 nm) 및 방출 범위(450-600 nm)16,18을 갖는다.
CRM의 사용은 세포 윤곽을 식별하는 정보의 독립적 인 소스를 제공하고 따라서 CRIF의 또 다른 중요한 이점을 제공합니다 : 3D 공간에 분포 된 개별 세포에서 형광 신호의 선택적 추출. 이는 중간 성분, 분비된 대사산물 및 세포외 매트릭스로부터 비세포 신호로 오염된 방대한 수의 세포로부터의 신호의 평균 혼합물인 전체 미생물 식민지 또는 벌크 배양 현탁액의 형광 특성의 전통적인 분석에서 한 걸음 앞으로 나아간 것을 나타낸다. 단세포 인천성형광 서명의 분석은 그대로 세포의 생리적 상태의 예측 특성화를 허용하고, 세포의 분포 및 생리 상태의 현세적 발달을 해결하기위한 잠재적 인 솔루션을 제공합니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 연구는 일본 교육문화체육관광부(18K04843)에서 YST ERATO(JPMJER1502)에서 N. 노무라까지 과학연구보조금으로 부분적으로 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| Agarose | Wako Chemicals | 312-01193 | |
| Beam splitters | Carl Zeiss, Nikon | MBSInVis405, MBS458, MBS488, MBS458/514, MBS488/543, or MBS 488/543/633 beam splitters (Carl Zeiss) | |
| Confocal microscope | Carl Zeiss, Nikon | Model LSM 880 (Carl Zeiss), Model A1R (Nikon) | |
| Cover slips | Matsunami Glass | C024601 | |
| Glass slides | Matsunami Glass | S011120 | |
| Half-reflection mirror | Carl Zeiss, Nikon | NT80/20 | |
| Laser power meter | Thorlabs | PM400 (power meter console) and S175C (sensor) | |
| LB Broth | Nacalai tesque | 20066-95 | For bacteria culture |
| Image analysis software | The MathWorks | MATLAB version 2019a or later, Image Processing Toolbox is needed | |
| Microscope objective | Carl Zeiss, Nikon | 440762-9904 | e.g. 63x plan Apochomat NA = 1.4 (Carl Zeiss) |
| Microscope software | Carl Zeiss, Nikon | ZEN (Carl Zeiss),NIS-elements (Nikon) | |
| PBS(-) | Wako Chemicals | 166-23555 | |
| Programming language | Python and libraries, modules (numpy, scikit-learn, scikit-image, os, glob, matplotlib, tkinter) are rquired to run the supplied PCA script. | ||
| Silicone gasket | ThermoFisher Scientific | P24744 | |
| Workstation | A high-performance workstation with discrete GPUs is recommended. | ||
| Yeast extract-peptone-dextrose (YPD) agar medium | Sigma-Aldrich | Y1500-250G | For yeast culture |
| YPD medium | Sigma-Aldrich | Y1375-250G |
참고문헌
- Monici, M. Cell and tissue autofluorescence research and diagnostic applications. Biotechnology Annual Review. 11, 227-256 (2005).
- Tang, J. Microbial metabolomics. Current Genomics. 12, 391-403 (2011).
- Woo, P. C., Lau, S. K., Teng, J. L., Tse, H., Yuen, K. Y. Then and now: use of 16S rDNA gene sequencing for bacterial identification and discovery of novel bacteria in clinical microbiology laboratories. Clinical Microbiology and Infection. 14, 908-934 (2008).
- Amman, R., Fuchs, B. M. Single-cell identification in microbial communities by improved fluorescence in situ hybridization techniques. Nature Reviews Microbiology. 6, 339-348 (2008).
- Giana, H. E., Silveira, L., Zângaro, R. A., Pacheco, M. T. T. Rapid identification of bacterial species by fluorescence spectroscopy and classification through principal components analysis. Journal of Fluorescence. 13 (6), 489-493 (2003).
- Leblanc, L., Dufour, E. Monitoring the identity of bacteria using their intrinsic fluorescence. FEMS Microbiology Letters. 211 (2), 147-153 (2002).
- Hou, X., Liu, S., Feng, Y. The autofluorescence characteristics of bacterial intracellular and extracellular substances during the operation of anammox reactor. Scientific Reports. 7, 39289 (2017).
- Ramanujam, N., et al. In vivo diagnosis of cervical intraepithelial neoplasia using 337-nm-excited laser-induced fluorescence. Proceeding National Academy of Sciences of the United States of America. 91 (21), 10193-10197 (1994).
- Zhang, J. C., et al. Innate cellular fluorescence reflects alterations in cellular proliferation. Lasers in Surgery and Medicine. 20 (3), 319-331 (1997).
- Gosnell, M. E., et al. Quantitative non-invasive cell characterisation and discrimination based on multispectral autofluorescence features. Scientific Reports. 6, 23453 (2016).
- Yawata, Y., et al. Intra- and interspecies variability of single-cell innate fluorescence signature of microbial cell. Applied and Environmental Microbiology. 85, 00608-00619 (2019).
- Nelson, K. E., et al. Complete genome sequence and comparative analysis of the metabolically versatile Pseudomonas putida KT2440. Environmental Microbiology. 4 (12), 799-808 (2002).
- Bagdasarian, M., et al. Specific-purpose plasmid cloning vectors. II. Broad host range, high copy number, RSF1010-derived vectors, and a host-vector system for gene cloning in Pseudomonas. Gene. 16 (1-3), 237-247 (1981).
- Luo, Y., Vijaychander, S., Stile, J., Zhu, L. Cloning and analysis of DNA-binding proteins by yeast one-hybrid and one-two-hybrid systems. Biotechniques. 20 (4), 564-568 (1996).
- Yawata, Y., et al. Monitoring biofilm development in a microfluidic device using modified confocal reflection microscopy. Journal of Bioscience and Bioengineering. 110 (3), 377-380 (2010).
- Lakowicz, J. R. . Principles of Fluorescence Spectroscopy. Third edition. , (2006).
- Blacker, T. S., Duchen, M. R. Investigating mitochondrial redox state using NADH and NADPH autofluorescence. Free Radical Biology & Medicine. 100, 53-65 (2016).
- Croce, A. C., Bottiroli, G. Autofluorescence spectroscopy and imaging: A tool for biomedical research and diagnosis. European Journal of Histochemistry. 58 (4), 2461 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유