Method Article
Rekonstruktion von einzelligen angeborenen Fluoreszenzsignaturen durch konfokale Mikroskopie
In diesem Artikel
Zusammenfassung
Hier wird ein Protokoll zur optischen Extraktion und Katalogisierung angeborener zellulärer Fluoreszenzsignaturen (d.h. zelluläre Autofluoreszenz) aus jeder einzelnen lebenden Zelle vorgestellt, die in einem dreidimensionalen Raum verteilt ist. Diese Methode eignet sich, um die angeborene Fluoreszenzsignatur verschiedener biologischer Systeme mit einzelliger Auflösung zu untersuchen, einschließlich Zellen von Bakterien, Pilzen, Hefen, Pflanzen und Tieren.
Zusammenfassung
Beschrieben wird hier die konfokale Reflexionsmikroskopie-assistierte Einzelzell-Angeborenenfluoreszenzanalyse (CRIF), eine minimal-invasive Methode zur Rekonstruktion der angeborenen zellulären Fluoreszenzsignatur jeder einzelnen lebenden Zelle in einer Population, die in einem dreidimensionalen (3D) Raum verteilt ist. Die angeborene Fluoreszenzsignatur einer Zelle ist eine Sammlung von Fluoreszenzsignalen, die von verschiedenen Biomolekülen innerhalb der Zelle emittiert werden. Frühere Studien haben gezeigt, dass angeborene Fluoreszenzsignaturen verschiedene zelluläre Eigenschaften und Unterschiede im physiologischen Status widerspiegeln und eine reichhaltige Informationsquelle für die Zellcharakterisierung und -identifizierung darstellen. Angeborene Fluoreszenzsignaturen wurden traditionell auf Populationsebene analysiert, was eine klonale Kultur erforderte, aber nicht auf Einzelzellebene. CRIF eignet sich besonders für Studien, die eine 3D-Auflösung und/oder selektive Extraktion von Fluoreszenzsignalen einzelner Zellen erfordern. Da die Fluoreszenzsignatur eine angeborene Eigenschaft einer Zelle ist, eignet sich CRIF auch zur tagfreien Vorhersage des Typs und/oder physiologischen Status intakter und einzelner Zellen. Diese Methode kann ein leistungsfähiges Werkzeug für die optimierte Zellanalyse sein, bei der der Phänotyp jeder einzelnen Zelle in einer heterogenen Population direkt durch ihre Autofluoreszenzsignatur unter einem Mikroskop ohne Zellmarkierung beurteilt werden kann.
Einleitung
Verschiedene Biomoleküle innerhalb einer Zelle1 emittieren Autofluoreszenzsignale, und die angeborene Fluoreszenzsignatur einer Zelle besteht aus der Anordnung dieser Signale. Diese charakteristische Fluoreszenz spiegelt verschiedene zelluläre Eigenschaften und auch Unterschiede im physiologischen Status wider. Die Analyse der angeborenen Fluoreszenz ist minimal-invasiv und kann traditionelle, invasivere mikrobiologische Sonden ergänzen, die eine Reihe von Spuren von leichter metabolischer Modifikation bis hin zur vollständigen Zellzerstörung hinterlassen. Während traditionelle Techniken wie die Extraktion von DNA- oder Zellinhalten2,3, die fluoreszierende In-situ-Hybridisierung4 und die Einführung fluoreszierender Reportergene in das Genom bei der Bestimmung des Zelltyps oder des physiologischen Status wirksam sind, erfordern sie in der Regel entweder eine Manipulation der Zellen oder eine invasive Markierung.
Studien zur angeborenen Fluoreszenz verschiedener lebender und intakter mikrobieller Kolonien, einschließlich mikrobieller Kultursuspensionen5,6, aktiver Schlämme7, Säugetiergewebe8,9 und Säugetierzellen1,10, haben gezeigt, dass die angeborene Fluoreszenzanalyse eine tagfreie Analyse von Zelltypen und physiologischem Status erleichtert. Angeborene Fluoreszenzsignaturen wurden traditionell auf Populationsebene und nicht auf Einzelzellebene analysiert und erfordern daher eine klonale Kultur. Im Gegensatz dazu rekonstruiert und katalogisiert die hier beschriebene confokale Reflection microscopy-assisted single cell innate fluorescence analysis (CRIF)-Technik11 die angeborene zelluläre Fluoreszenzsignatur jeder einzelnen lebenden mikrobiellen Zelle. Darüber hinaus kann CRIF systematisch die angeborene Fluoreszenzsignatur einer einzelnen mikrobiellen Zelle innerhalb einer Population sammeln, die in einem dreidimensionalen (3D) Raum verteilt ist.
Protokoll
1. Vorbereitung der Probe
- Legen Sie eine 1 mm dicke Silikondichtung mit Vertiefungen auf einen Glasobjektträger.
- Legen Sie eine 1 mm dicke 0,8% (w/v) Agaroseplatte in die Vertiefung der Silikondichtung.
- Verdünnen Sie die Zelldichte einer beliebigen mikrobiellen Zellkultur auf eine optische Dichte bei 600 nm (OD660) = 1,0.
- Geben Sie eine 5 μL Aliquot Zellsuspension auf die Agaroseplatte.
- Vorsichtig mit einem Glasdeckglas abdecken.
2. Aufbau eines Mikroskops
HINWEIS: Die CRIF-Technik kombiniert konfokale Reflexionsmikroskopie (CRM) und konfokale Mehrkanal-Mikrospektroskopie. CRM dient als Informationsquelle für die zelluläre Morphologie und räumliche Lokalisierung, die unabhängig von der zellulären angeborenen Fluoreszenz ist. Die konfokale Mehrkanal-Mikrospektroskopie liefert die spektrale Information der zellulären angeborenen Fluoreszenz. Im folgenden Protokoll wird jedes Bild, das mit CRM oder konfokaler Fluoreszenz-Mikrospektroskopie aufgenommen wurde, als CRM-Bild bzw. Mehrkanal-Konfokal-Mikrospektroskopie-Bild bezeichnet.
- Schließen Sie ein konfokales Mikroskop mit abgestorbenen Spektralkanälen an eine Photomultiplierröhre (PMT) oder einen GaAsP-Detektor an.
HINWEIS: Diese Setups sind von mehreren Herstellern erhältlich. - Statten Sie das Mikroskop mit einem Objektiv mit hoher numerischer Apertur (NA) mit ausreichender Vergrößerung aus.
HINWEIS: Für die Analyse von Bakterienzellen wird ein 63-faches Objektiv mit NA > 1,4 empfohlen. - Statten Sie das Mikroskop mit einem Halbreflexionsspiegel (z. B. NT 80/20) aus, um CRM aufzunehmen, das auf der zellulären Streuung des einfallenden Lichts beruht, um die Zellmorphologie zu visualisieren.
- Für die konfokale Mehrkanal-Mikrospektroskopie ist das Mikroskop mit dichroitischen Spiegeln auszustatten. Verwenden Sie beispielsweise MBS InVis405, MBS458, MBS488, MBS458/514, MBS488/543 oder MBS 488/543/633 für 405, 458, 488, 514, 543 bzw. 633 nm Anregung.
- Stellen Sie die Beleuchtungsstärke für jede Anregungswellenlänge mit einem Laserleistungsmesser ein. Halten Sie die Leistung unter dem Mikroskop durch Anregungswellenlängen konstant (z. B. verwenden Sie 50 μW mit dem 63-fachen Objektiv).
3. Bildaufnahme
- Stellen Sie die Lochgröße mit der Mikroskopsoftware auf 1 AE ein.
- Stellen Sie die Pixelverweilzeit (d. h. die Scangeschwindigkeit) für jede Anregungswellenlänge ein.
HINWEIS: Eine zu lange Pixelverweildauer kann Zellen schädigen. Vermeiden Sie übermäßig lange Pixelverweilzeiten, um Fotoschäden an den Zellen zu minimieren. Für Bakterienproben ist normalerweise eine Pixelverweilzeit <55,6 μs/μm2 (wenn die Bestrahlungsstärke unter dem Mikroskop ~17 μW/cm2 beträgt) geeignet, um eine Wachstumshemmung zu vermeiden. Dieser Parameter kann je nach Organismus und Versuchsaufbau variieren. - Legen Sie die Scanauflösung fest. Verwenden Sie für kleine Zellen wie Bakterien eine Scanfläche von 1.024 x 1.024.
- Stellen Sie den Z-Scanbereich so ein, dass der gewünschte Bereich abgedeckt ist.
HINWEIS: Für Bakterien- und Hefezellproben, die auf einer Agaroseplatte verteilt sind, ist in der Regel ein Z-Scanning-Bereich von ~15 μm ausreichend. - Stellen Sie den entstaubten Detektor so ein, dass er den sichtbaren Wellenlängenbereich erfasst (z. B. 416−691 nm). Verwenden Sie ein Spektralfenster von 8−10 nm.
- Erfassen Sie mehrkanalige konfokale Mikrospektroskopiebilder in einer Sequenz von der längsten bis zur kürzesten Anregungswellenlänge, um Z-Stacks von Fluoreszenzbildern zu erzeugen.
- Erfassen Sie CRM-Bilder.
- Speichern Sie die aufgenommenen Bilder als 16-Bit-TIFF-Dateien in einem Verzeichnis. Benennen Sie die Dateien mit der Namenskonvention XXXcYYzZZ.tif, wobei XXX die Anregungswellenlänge, YY die Detektorkanalnummer, ZZ die Z-Slice-Nummer und "c" und "z" Präfixe für die Detektornummer bzw. die Z-Slice-Nummer sind.
- Wenn beispielsweise ein konfokales Mehrkanal-Mikrospektroskopiebild mit einer Anregungswellenlänge von 405 nm, dem 1. Detektorkanal des Detektorarrays, aufgenommen wird und der 5. Schnitt des Z-Stacks ist, nennen Sie ihn "405c01z05.tif". Verwenden Sie für CRM-Bilder die Zeichenfolge "CRM" anstelle von XXX (z. B. "CRMc01z05.tif").
HINWEIS: Entscheiden Sie, ob die 2D- oder 3D-Segmentierung für die Bilddaten am besten geeignet ist. Verwenden Sie eine 2D-Segmentierungsmethode in Situationen, in denen kleine Zellen auf eine 2D-Ebene beschränkt sind (z. B. Bakterienpopulation, die an einer Glasoberfläche haftet). Verwenden Sie die 3D-Segmentierungsmethode in Situationen, in denen die Zellpopulation in einem dreidimensionalen Raum verteilt ist (z. B. Biofilme und Gewebeproben) oder die Zellgrößen größer sind als die Dicke der optischen Scheibe (z. B. Hefezellen, Säugetierzellen). Informationen zur 2D-Segmentierung finden Sie in Abschnitt 4. Informationen zur 3D-Segmentierung finden Sie in Abschnitt 5.
- Wenn beispielsweise ein konfokales Mehrkanal-Mikrospektroskopiebild mit einer Anregungswellenlänge von 405 nm, dem 1. Detektorkanal des Detektorarrays, aufgenommen wird und der 5. Schnitt des Z-Stacks ist, nennen Sie ihn "405c01z05.tif". Verwenden Sie für CRM-Bilder die Zeichenfolge "CRM" anstelle von XXX (z. B. "CRMc01z05.tif").
4. 2D-Bildanalyse
- Statten Sie einen Arbeitsplatz mit Bildanalysesoftware (z. B. MATLAB) aus.
- Führen Sie eine Zellsegmentierung und Rekonstruktion von einzelligen angeborenen Fluoreszenzsignaturen durch.
- Öffnen Sie die Bildanalyse-Software.
- Doppelklicken sie und öffnen Sie eines der bereitgestellten Skripte "Script2D.m".
- Wechseln Sie zur Registerkarte Editor , und klicken Sie dann auf Ausführen. Ein Ordnerauswahlfenster sollte angezeigt werden.
- Wählen Sie das in Schritt 3.8 erstellte Verzeichnis aus und klicken Sie dann auf Öffnen , um fortzufahren. Ein Dialogfeld, in dem Sie zur Eingabe des Segmentierungsparameters aufgefordert werden, wird automatisch angezeigt.
HINWEIS: Wählen Sie zu Testzwecken den bereitgestellten Datensatz aus ("Sample_2D"). Das Beispiel-Dataset wird als komprimierte Datei bereitgestellt und sollte im Voraus extrahiert werden. - Geben Sie die Segmentierungsparameter ein: Schwellenwert der Bildbinarisierung (0−1) für die Bildbinarisierung = 0,45, Oberer Schwellenwert für einen Zellbereich (in Pixeln) = 200, Unterer Schwellenwert für einen Zellbereich (in Pixeln) = 10 und Anzahl der Detektoren = 32. Klicken Sie auf OK , um fortzufahren.
HINWEIS: Diese Parameter müssen je nach Bildqualität möglicherweise angepasst werden. - Ein neues Bildfenster mit einem CRM-Bild sollte angezeigt werden. Wählen Sie einen beliebigen Hintergrundbereich (d. h. einen Bereich, in dem Zellen fehlen) aus, der für die Hintergrundsubtraktion verwendet werden soll. Zeichnen Sie ein Rechteck innerhalb des CRM-Bildes durch Ziehen mit der Maus. Doppelklicken Sie innerhalb des ausgewählten Bereichs, um die Auswahl zu bestätigen.
- Suchen Sie ein neues Verzeichnis mit dem Namen Signatur in demselben Verzeichnis, das in Schritt 4.2.4 ausgewählt wurde.
HINWEIS: Der bereitgestellte Code erstellt dieses Verzeichnis automatisch. Das Verzeichnis "Signatur" speichert die angeborene Fluoreszenzsignatur jeder mikrobiellen Zelle innerhalb einer Population als .png Dateien, die nach einem gemeinsamen Präfix "Signatur" fortlaufend nummeriert sind.
5.3D Bildanalyse
- Statten Sie einen Arbeitsplatz mit der Bildanalysesoftware (Table of Materials) aus.
- Führen Sie eine Zellsegmentierung und Rekonstruktion von einzelligen angeborenen Fluoreszenzsignaturen durch.
- Öffnen Sie die Bildanalyse-Software.
- Doppelklicken Sie auf das bereitgestellte Skript "Script3D.m" und öffnen Sie es.
- Wechseln Sie zur Registerkarte Editor , und klicken Sie dann auf Ausführen. Ein Ordnerauswahlfenster sollte angezeigt werden.
- Wählen Sie das in Schritt 3.8 erstellte Verzeichnis aus und klicken Sie dann auf Öffnen , um fortzufahren. Ein Dialogfeld, das zur Eingabe der Segmentierungsparameter auffordert, wird automatisch angezeigt.
HINWEIS: Wählen Sie zu Testzwecken den bereitgestellten Datensatz aus ("Sample_3D"). Das Beispiel-Dataset wird als komprimierte Datei bereitgestellt und sollte im Voraus extrahiert werden. - Geben Sie die Segmentierungsparameter ein: Schwellenwert für die Bildbinarisation (0–1) für die Bildbinarisierung = 0,01, Oberer Schwellenwert für ein Zellenvolumen (in Pixeln) = 1.000, Unterer Schwellenwert für einen Zellbereich (in Pixeln) = 20, X-Pixelgröße [μm/Pixel] = 0,26, Y-Pixelgröße [μm/Pixel] = 0,26, Z-Pixelgröße [μm/Pixel] = 0,42 und Anzahl der Detektoren = 32. Klicken Sie auf OK , um fortzufahren. Ein Dialogfeld, in dem Sie aufgefordert werden, die Anzahl der Anregungswellenlängen einzugeben, wird angezeigt.
HINWEIS: Diese Parameter müssen je nach Bildqualität möglicherweise angepasst werden. - Geben Sie die Anzahl der Wellenlängen ein, die für die Bildaufnahme verwendet werden (wenn z. B. 405, 488, 561, 630 verwendet werden, geben Sie 4 in das Dialogfeld ein). Klicken Sie auf OK.
- Geben Sie die Anregungswellenlängen in einer Reihenfolge von der kürzesten (d. h. Feldname: Anregung Nr. 1) bis zur längsten Wellenlänge in die Dialogfelder ein. Klicken Sie auf OK , um fortzufahren. Ein neues Image-Fenster, das ein CRM-Image anzeigt, sollte angezeigt werden.
- Wählen Sie den beliebigen Hintergrundbereich (d. h. den Bereich, in dem Zellen fehlen) aus, der für die Hintergrundsubtraktion verwendet werden soll. Zeichnen Sie ein Rechteck innerhalb des CRM-Bildes durch Ziehen mit der Maus. Doppelklicken Sie innerhalb des ausgewählten Bereichs, um die Auswahl zu bestätigen.
- Suchen Sie das Verzeichnis Signatur in dem in Schritt 5.2.4 ausgewählten Verzeichnis.
HINWEIS: Der bereitgestellte Code erstellt dieses Verzeichnis automatisch. Das Verzeichnis "Signatur" speichert die angeborene Fluoreszenzsignatur jeder einzelnen mikrobiellen Zelle innerhalb einer Population als .png Dateien, die nach einem gemeinsamen Präfix "Signatur" fortlaufend nummeriert sind.
6. Statistische Auswertung
HINWEIS: Führen Sie dimensionale Reduktionstechniken (z. B. Hauptkomponentenanalyse [PCA]) durch, um die Verteilung der Hyperspektren der Zellpopulationen zu visualisieren. Das bereitgestellte Skript (PCA.py) führt PCA für zwei Zellpopulationen (d. h. zwei Klassen) aus.
- Statten Sie einen Arbeitsplatz mit der Programmiersprache und den dazugehörigen Bibliotheken und Modulen aus (Tabelle der Materialien).
- Erstellen Sie ein leeres Verzeichnis im Laufwerk C (oder einem gleichwertigen Laufwerk) und nennen Sie das Verzeichnis "Parent_directory" (d. h. C:/ Parent_ Verzeichnis).
- Speichern Sie die Fluoreszenzsignaturen (z. B. die in Schritt 4.2.7 generierten .png Dateien) jeder der beiden Zellpopulationen in zwei separaten Verzeichnissen.
HINWEIS: Die beiden Verzeichnisse sollten sich beide im "Parent_directory" befinden.
C:/Parent_directory/ putidaKT2440/
putidaKT2440/
 Signatur01.png
Signatur01.png
 Signatur02.png
Signatur02.png
 :
: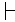 putidaKT2442/
putidaKT2442/
 Signatur01.png
Signatur01.png
 Signatur02.png
Signatur02.png
 :
: - Laden Sie PCA.py in die "Parent_directory" herunter.
- Öffnen Sie die Befehlszeilenschnittstelle der Arbeitsstation.
- Geben Sie "python C:/Parent_directory/PCA.py" in die Befehlszeilenschnittstelle ein.
- Wählen Sie "Parent_directory", nachdem die Meldung "Zielverzeichnis auswählen" angezeigt wird.
- Suchen Sie im "C:/Parent_directory" nach "PCA.png", das einen resultierenden PCA-Plot enthält.
Ergebnisse
Abbildung 1A zeigt die typische einzellige Fluoreszenzsignatur einer Bakterienzelle, dargestellt als traditionelles Spektrumdiagramm (oben) und als Heatmap (Mitte). Abbildung 1B zeigt das Ergebnis einer genauen 2D-Zellsegmentierung, die dem ursprünglichen CRM-Bild einer Population von Bodenbakterien (Pseudomonas putida KT2440)12 überlagert wird. Die resultierenden angeborenen Fluoreszenzsignaturen für die Population sind in Abbildung 1D als Heatmap dargestellt. Beachten Sie, dass die Variabilität innerhalb der Population nach erfolgreicher Zellsegmentierung relativ gering war. Ein Beispiel für eine ungenaue Zellsegmentierung ist in Abbildung 1C dargestellt, die derselben Population von P. putida wie in Abbildung 1B überlagert wird. Der Einfluss einer ungenauen Zellsegmentierung auf die angeborenen Fluoreszenzsignaturen der Population ist an der beträchtlichen Anzahl von Ausreißern leicht ersichtlich (Abbildung 1E, rote Dreiecke). Ungenaue Zellsegmentierung führte zu einem lockereren Cluster nach PCA im Vergleich zu dem engen Cluster, der nach genauer Zellsegmentierung erhalten wurde (Abbildung 1F).
Typischerweise bilden angeborene Fluoreszenzsignaturen verschiedener Zelltypen trotz der Variabilität innerhalb der Spezies unterschiedliche Cluster. Abbildung 2C zeigt das Ergebnis von PCA-Analysen für ein taxonomisch nahes Stammpaar (P. putida Stamm KT2440 und Stamm KT244213). Trotz der geringen Variabilität, die innerhalb jeder einzelnen Population beobachtet wurde (Abbildung 2A,B), bildete jede Population einen eigenen Cluster auf dem PCA-Analysediagramm (Abbildung 2C).
Abbildung 3A zeigt das Ergebnis einer genauen 3D-Zellsegmentierung, die über dem ursprünglichen CRM-Bild einer Population von knospenden Hefe Saccharomyces cerevisiae YM427114 überlagert ist. Abbildung 3B zeigt die resultierenden angeborenen Fluoreszenzsignaturen für die Bevölkerung.

Abbildung 1: Genauigkeit der Segmentierung und scheinbare Variabilität innerhalb der Spezies. (A) Typische einzellige angeborene Fluoreszenzsignatur einer Bakterienzelle (P. putida KT2440), dargestellt als Spektrumdiagramm (oben) und Heatmap (Mitte). Die Emissionswellenlänge wird als Regenbogen-Farbkarte angezeigt (unten). Die Y-Achse des Spektrumdiagramms und die Farbe der Heatmap geben beide die relativen Fluoreszenzintensitäten an. Die Zahlen unten geben die Anregungswellenlänge an. Visuelle Darstellung der genauen (B) und ungenauen (C) Zellregionserkennung durch den Bildanalysealgorithmus. Hellblaue Schattierung zeigt Zellregionen an, die für eine Population des Bodenbakteriums P. putida KT 2440 nachgewiesen wurden. Blobs mit roter Nummerierung in Bedienfeld C sind Beispiele für eine Fehlerkennung, bei der der Algorithmus Nicht-Zellbereiche (d. h. Hintergrundrauschen) aufgrund unangemessener Binarisierungsschwellenwerteinstellungen als Zellbereiche klassifiziert hat. Maßstabsbalken = durchgehend 1 μm. Die Panels D und E zeigen die angeborenen Fluoreszenzsignaturen für dieselbe Population, die mit genauer bzw. ungenauer Zellsegmentierung erzeugt wurden. Jede Spalte zeigt ein rekonstruiertes einzelliges Hyperspektrum, das als 1 x 192-Matrix dargestellt wird, wobei die Gelb-Blau-Farbkarte die relative Fluoreszenzintensität anzeigt. (F) Die Varianz angeborener Fluoreszenzsignaturen in genauen (hellblau) und ungenauen (rot) Segmentierungen, visualisiert mit PCA. Jede Achsenbezeichnung bezeichnet die Komponentennummer und ihren kumulativen prozentualen Beitrag zur PCA-Analyse. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
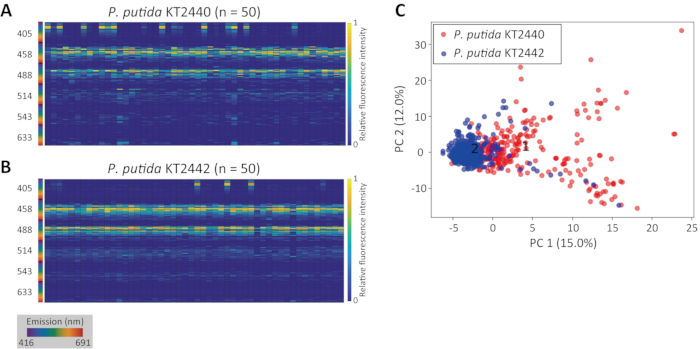
Abbildung 2: Intra- und Interspezies-Variabilität der angeborenen Fluoreszenzsignaturen. Angeborene Fluoreszenzsignaturen, die als Heatmaps für eine Population von P. putida KT2440 (A) und P. putida KT2442 (B) dargestellt werden. (C) Projektion der beiden angeborenen Fluoreszenzsignaturpaare, visualisiert mit PCA, entsprechend P. putida KT2440 (rot, n = 288) und P. putida KT2442 (blau, n = 373). X- und Y-Achsen stellen PC1 bzw. PC2 dar. Die Einschubzahl gibt das Zentrum jedes Clusters an (1: P. putida KT2440, 2: P. putida KT2442). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Abbildung 3: Beispiel für 3D-Segmentierung und angeborene Fluoreszenzsignaturextraktion. (A) 3D-Projektion von Regionen, die als Zellpopulationen der knospenden Hefe S. cerevisiae YM4271 erkannt wurden. Die Einschubnummern sind die Identifikationsnummern. (B) Heatmap der angeborenen Fluoreszenzsignaturen, extrahiert aus den 3D-Regionen. Die X-Achsen-Nummer entspricht der Identifikationsnummer. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Es gibt zwei kritische Punkte in dieser Methode, die genau verfolgt werden müssen, um reproduzierbare Ergebnisse zu erhalten: 1) Halten Sie die Laserleistung unter dem Mikroskopobjektiv durch Anregungswellenlängen und Experimente konsistent und 2) führen Sie eine genaue Zellsegmentierung durch.
Der erste Punkt ist besonders wichtig, wenn man die angeborene Fluoreszenzsignatur zwischen verschiedenen Experimenten vergleicht. Vermeiden Sie es, einfach die gleichen "prozentualen Ausgangseinstellungen" auf die Anregungswellenlängen anzuwenden (d. h. die Verwendung von 5% Ausgangsleistung für alle 405-, 488-, 514- und 530-nm-Laserlinien), da die maximale Leistungsabgabe zwischen den Laserlinien bis zu einer Größenordnung variieren kann. Darüber hinaus weisen das Objektiv und die interne Optik in der Regel ungleichmäßige optische Absorptionseigenschaften auf, die ebenfalls berücksichtigt werden müssen. Aus diesen Gründen wird empfohlen, die Leistung unter dem Objektiv tatsächlich mit einem Laserleistungsmesser (Table of Materials) zu messen. Es wird auch empfohlen, diese Messung alle paar Experimente oder periodisch durchzuführen, da die Leistung von Laserlinien über einige Jahre hinweg signifikant zerfallen kann.
Der zweite Punkt, die genaue Zellsegmentierung, wird besonders wichtig in Situationen, in denen die Variabilität innerhalb oder zwischen den Arten ein Problem darstellt. Eine ungenaue Zellsegmentierung (Abbildung 1D) führt zu Ausreißerdatenpunkten (Abbildung 1E, dargestellt durch rote Dreiecke) und einer größeren scheinbaren Variabilität innerhalb der Spezies. Die Segmentierungsparameter sollten sorgfältig bestimmt werden, wobei die Genauigkeit der Zellsegmentierung überprüft werden sollte, indem die Segmentierungsergebnisse mit dem ursprünglichen CRM-Bild überlagert werden, bevor weitere Analysen oder Schulungen von Machine Learning-Modellen durchgeführt werden. Wenn Sie mit einem Bild von schlechter Qualität arbeiten, kann eine zusätzliche Bildverarbeitung erforderlich sein, um eine genaue Segmentierung zu erreichen. Die Verwendung eines "Gauß-Filters" oder eines "Medianfilters" kann körnige Artefakte entfernen, und die bilaterale Filterverarbeitung wirkt sich auf jeden gestreiften Hintergrund aus.
Bei einer Optik von schlechter Qualität (z. B. einem nicht konfokalen Objektiv) oder einer unzureichenden Detektorempfindlichkeit kann der Nachweis von schwachen angeborenen Fluoreszenzsignaturen eine Herausforderung darstellen. Beachten Sie, dass wir mit dem hier und zuvor beschriebenen Setup11 auf keine Art von Zellprobe gestoßen sind, deren angeborene Fluoreszenz zu schwach war, um eine angeborene Fluoreszenzsignatur zu rekonstruieren. Obwohl eine höhere Emissionsleistung für die Anregung und eine längere Pixelverweilzeit verwendet werden können, um stärkere Emissionssignale zu erhalten, kann dies zu Schäden an den Zellproben führen. Eine mögliche Lösung für Fälle, in denen eine schwache angeborene Fluoreszenz ein Problem darstellt, besteht darin, die Intensität des Hintergrundsignals zu reduzieren, z. B. durch Suspendieren von Zellen in Puffer- oder synthetischen Medien anstelle von Brühe. Arten von Zellbehältern, wie Glasbodenschalen und mikrofluidische Geräte, sind für diese Technik kompatibel und geeignet, obwohl eine Agaroseplatte verwendet wurde, um die Zellen hier und in einer früheren Studie in Position zu halten15.
Die konfokale Mikroskopmethode bietet räumliche Auflösung und In-situ-Analyse für adhärente Zellpopulationen, Biofilme und Gewebeproben. Ein potenzieller Kompromiss dieser Methodik ist beispielsweise der maximale Durchsatz im Vergleich zu einem Durchflusszytometer. Ein kompletter Satz konfokaler Scans, der einige hundert bis tausend angeborene Fluoreszenzsignaturen mit einem einzigen Satz von Scans sammelt, kann bis zu einigen Minuten dauern. Ein Durchflusszytometer ist aufgrund seines optischen Designs weniger empfindlich, kann aber potenziell einen um mehrere Größenordnungen höheren Durchsatz erreichen.
Eine Verbindung, die für einen bestimmten Peak in einer angeborenen Fluoreszenzsignatur verantwortlich ist, rigoros zu identifizieren, ist aufgrund ihrer komplizierten Natur typischerweise eine Herausforderung. Es wurde jedoch vorgeschlagen, dass eine Reihe von biologisch relevanten Molekülen wie Vitamine (z. B. Flavinadenindinukleotid [FAD]), Coenzyme (z. B. Nicotinamidadenindinukleotid [NADH]) und Lipofuszinpigmente wichtige Fluorophore in Zellen sein könnten1,16. Zum Beispiel hat FAD ein Anregungsmaximum zwischen 350–450 nm und einen Emissionspeak bei etwa 525 nm16. Freies NADH hat ein Anregungsmaximum und einen Emissionspeak bei 340 nm bzw. 460 nm, obwohl die Emissionsspektren des proteingebundenen NADH unterschiedlich sind16,17,18. Lipopigmente, von denen bekannt ist, dass sie mit gestressten oder gealterten Zellen assoziiert werden, haben einen breiten Anregungsbereich (350–500 nm) und einen Emissionsbereich (450–600 nm)16,18.
Der Einsatz von CRM bietet eine unabhängige Informationsquelle zur Identifizierung von Zellkonturen und bietet damit einen weiteren wesentlichen Vorteil von CRIF: die selektive Extraktion von Fluoreszenzsignalen aus einzelnen Zellen, die in einem 3D-Raum verteilt sind. Dies stellt einen Schritt vorwärts gegenüber der traditionellen Analyse der Fluoreszenzeigenschaften einer ganzen mikrobiellen Kolonie oder einer Massenkultursuspension dar, bei der es sich um eine gemittelte Mischung von Signalen einer großen Anzahl von Zellen handelt, die mit Nicht-Zell-Signalen von mittleren Komponenten, sezernierten Metaboliten und extrazellulären Matrizen kontaminiert sind. Eine Analyse der angeborenen Fluoreszenzsignaturen einzelner Zellen ermöglicht die prädiktive Charakterisierung des physiologischen Status intakter Zellen und bietet eine mögliche Lösung zur Auflösung der zeitlichen Entwicklung der Zellverteilung und des physiologischen Zustands.
Offenlegungen
Die Autoren haben nichts preiszugeben.
Danksagungen
Diese Studie wurde zum Teil durch einen Zuschuss für die wissenschaftliche Forschung des japanischen Ministeriums für Bildung, Kultur, Sport und Technologie (18K04843) an Y. Yawata, den JST ERATO (JPMJER1502) an N. Nomura unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Agarose | Wako Chemicals | 312-01193 | |
| Beam splitters | Carl Zeiss, Nikon | MBSInVis405, MBS458, MBS488, MBS458/514, MBS488/543, or MBS 488/543/633 beam splitters (Carl Zeiss) | |
| Confocal microscope | Carl Zeiss, Nikon | Model LSM 880 (Carl Zeiss), Model A1R (Nikon) | |
| Cover slips | Matsunami Glass | C024601 | |
| Glass slides | Matsunami Glass | S011120 | |
| Half-reflection mirror | Carl Zeiss, Nikon | NT80/20 | |
| Laser power meter | Thorlabs | PM400 (power meter console) and S175C (sensor) | |
| LB Broth | Nacalai tesque | 20066-95 | For bacteria culture |
| Image analysis software | The MathWorks | MATLAB version 2019a or later, Image Processing Toolbox is needed | |
| Microscope objective | Carl Zeiss, Nikon | 440762-9904 | e.g. 63x plan Apochomat NA = 1.4 (Carl Zeiss) |
| Microscope software | Carl Zeiss, Nikon | ZEN (Carl Zeiss),NIS-elements (Nikon) | |
| PBS(-) | Wako Chemicals | 166-23555 | |
| Programming language | Python and libraries, modules (numpy, scikit-learn, scikit-image, os, glob, matplotlib, tkinter) are rquired to run the supplied PCA script. | ||
| Silicone gasket | ThermoFisher Scientific | P24744 | |
| Workstation | A high-performance workstation with discrete GPUs is recommended. | ||
| Yeast extract-peptone-dextrose (YPD) agar medium | Sigma-Aldrich | Y1500-250G | For yeast culture |
| YPD medium | Sigma-Aldrich | Y1375-250G |
Referenzen
- Monici, M. Cell and tissue autofluorescence research and diagnostic applications. Biotechnology Annual Review. 11, 227-256 (2005).
- Tang, J. Microbial metabolomics. Current Genomics. 12, 391-403 (2011).
- Woo, P. C., Lau, S. K., Teng, J. L., Tse, H., Yuen, K. Y. Then and now: use of 16S rDNA gene sequencing for bacterial identification and discovery of novel bacteria in clinical microbiology laboratories. Clinical Microbiology and Infection. 14, 908-934 (2008).
- Amman, R., Fuchs, B. M. Single-cell identification in microbial communities by improved fluorescence in situ hybridization techniques. Nature Reviews Microbiology. 6, 339-348 (2008).
- Giana, H. E., Silveira, L., Zângaro, R. A., Pacheco, M. T. T. Rapid identification of bacterial species by fluorescence spectroscopy and classification through principal components analysis. Journal of Fluorescence. 13 (6), 489-493 (2003).
- Leblanc, L., Dufour, E. Monitoring the identity of bacteria using their intrinsic fluorescence. FEMS Microbiology Letters. 211 (2), 147-153 (2002).
- Hou, X., Liu, S., Feng, Y. The autofluorescence characteristics of bacterial intracellular and extracellular substances during the operation of anammox reactor. Scientific Reports. 7, 39289 (2017).
- Ramanujam, N., et al. In vivo diagnosis of cervical intraepithelial neoplasia using 337-nm-excited laser-induced fluorescence. Proceeding National Academy of Sciences of the United States of America. 91 (21), 10193-10197 (1994).
- Zhang, J. C., et al. Innate cellular fluorescence reflects alterations in cellular proliferation. Lasers in Surgery and Medicine. 20 (3), 319-331 (1997).
- Gosnell, M. E., et al. Quantitative non-invasive cell characterisation and discrimination based on multispectral autofluorescence features. Scientific Reports. 6, 23453 (2016).
- Yawata, Y., et al. Intra- and interspecies variability of single-cell innate fluorescence signature of microbial cell. Applied and Environmental Microbiology. 85, 00608-00619 (2019).
- Nelson, K. E., et al. Complete genome sequence and comparative analysis of the metabolically versatile Pseudomonas putida KT2440. Environmental Microbiology. 4 (12), 799-808 (2002).
- Bagdasarian, M., et al. Specific-purpose plasmid cloning vectors. II. Broad host range, high copy number, RSF1010-derived vectors, and a host-vector system for gene cloning in Pseudomonas. Gene. 16 (1-3), 237-247 (1981).
- Luo, Y., Vijaychander, S., Stile, J., Zhu, L. Cloning and analysis of DNA-binding proteins by yeast one-hybrid and one-two-hybrid systems. Biotechniques. 20 (4), 564-568 (1996).
- Yawata, Y., et al. Monitoring biofilm development in a microfluidic device using modified confocal reflection microscopy. Journal of Bioscience and Bioengineering. 110 (3), 377-380 (2010).
- Lakowicz, J. R. . Principles of Fluorescence Spectroscopy. Third edition. , (2006).
- Blacker, T. S., Duchen, M. R. Investigating mitochondrial redox state using NADH and NADPH autofluorescence. Free Radical Biology & Medicine. 100, 53-65 (2016).
- Croce, A. C., Bottiroli, G. Autofluorescence spectroscopy and imaging: A tool for biomedical research and diagnosis. European Journal of Histochemistry. 58 (4), 2461 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten