Method Article
Reconstrucción de firmas de fluorescencia innata unicelular mediante microscopía confocal
En este artículo
Resumen
Aquí, se presenta un protocolo para extraer y catalogar ópticamente firmas de fluorescencia celular innata (es decir, autofluorescencia celular) de cada célula viva individual distribuida en un espacio tridimensional. Este método es adecuado para estudiar la firma de fluorescencia innata de diversos sistemas biológicos a una resolución de una sola célula, incluidas las células de bacterias, hongos, levaduras, plantas y animales.
Resumen
Aquí se describe el análisis de fluorescencia innata de una sola célula (CRIF) asistido por microscopía confocal, un método mínimamente invasivo para reconstruir la firma de fluorescencia celular innata de cada célula viva individual en una población distribuida en un espacio tridimensional (3D). La firma de fluorescencia innata de una célula es una colección de señales de fluorescencia emitidas por varias biomoléculas dentro de la célula. Estudios previos establecieron que las firmas de fluorescencia innata reflejan diversas propiedades celulares y diferencias en el estado fisiológico y son una rica fuente de información para la caracterización e identificación celular. Las firmas de fluorescencia innata se han analizado tradicionalmente a nivel poblacional, lo que requiere un cultivo clonal, pero no a nivel unicelular. CRIF es particularmente adecuado para estudios que requieren resolución 3D y / o extracción selectiva de señales de fluorescencia de células individuales. Debido a que la firma de fluorescencia es una propiedad innata de una célula, CRIF también es adecuado para la predicción sin etiquetas del tipo y / o estado fisiológico de células intactas y individuales. Este método puede ser una herramienta poderosa para el análisis celular simplificado, donde el fenotipo de cada célula individual en una población heterogénea puede evaluarse directamente por su firma de autofluorescencia bajo un microscopio sin etiquetado celular.
Introducción
Diversas biomoléculas dentro de una célula1 emiten señales de autofluorescencia, y la firma de fluorescencia innata de una célula consiste en el ensamblaje de estas señales. Esta fluorescencia característica refleja varias propiedades celulares y también diferencias en el estado fisiológico. El análisis de la fluorescencia innata es mínimamente invasivo y puede complementar las sondas microbiológicas tradicionales y más invasivas que dejan una gama de rastros desde una modificación metabólica leve hasta la destrucción celular completa. Si bien las técnicas tradicionales como la extracción de ADN o contenido celular2,3, la hibridación fluorescente in situ4 y la introducción de genes reporteros fluorescentes en el genoma son efectivas para determinar el tipo de célula o el estado fisiológico, comúnmente requieren la manipulación de las células o el etiquetado invasivo.
Los estudios de la fluorescencia innata de varias colonias microbianas vivas e intactas, incluyendo suspensiones de cultivo microbiano a granel5,6, lodos activos7, tejidos de mamíferos8,9 y células de mamíferos1,10, han demostrado que el análisis de fluorescencia innata facilita el análisis sin etiquetas de los tipos de células y el estado fisiológico. Las firmas de fluorescencia innata se han analizado tradicionalmente a nivel poblacional y no a nivel unicelular, por lo que requieren un cultivo clonal. Por el contrario, la técnica de análisis de fluorescencia innata unicelular asistida por microscopía confocal (CRIF)11 descrita aquí reconstruye y cataloga la firma de fluorescencia celular innata de cada célula microbiana viva individual. Además, CRIF puede recopilar sistemáticamente la firma de fluorescencia innata de una sola célula microbiana dentro de una población que se distribuye en un espacio tridimensional (3D).
Protocolo
1. Preparación de la muestra
- Coloque una junta de silicona de 1 mm de espesor con pocillos en un portaobjetos de vidrio.
- Coloque una losa de agarosa de 1 mm de espesor al 0,8% (p/v) en el pozo de la junta de silicona.
- Diluir la densidad celular de un cultivo celular microbiano arbitrario a una densidad óptica a 600 nm (OD660) = 1.0.
- Coloque una alícuota de 5 μL de suspensión celular en la losa de agarosa.
- Cubra suavemente con una funda de vidrio.
2. Configuración de un microscopio
NOTA: La técnica CRIF combina microscopía de reflexión confocal (CRM) y microspectroscopía confocal multicanal. CRM sirve como fuente de información para la morfología celular y la localización espacial, que es independiente de la fluorescencia innata celular. La microespectroscopía confocal multicanal proporciona la información espectral de la fluorescencia innata celular. En el siguiente protocolo, cualquier imagen adquirida con CRM o microespectroscopía de fluorescencia confocal se conoce como imagen CRM o imagen de microespectroscopía confocal multicanal, respectivamente.
- Conecte un microscopio confocal con canales espectrales escaneados a un tubo fotomultiplicador (PMT) o detector GaAsP.
NOTA: Estas configuraciones están disponibles en varios fabricantes. - Equipar el microscopio con un objetivo de alta apertura numérica (NA) con un aumento adecuado.
NOTA: Se recomienda un objetivo 63x con NA > 1.4 para analizar células bacterianas. - Equipe el microscopio con un espejo de media reflexión (por ejemplo, NT 80/20) para acomodar CRM, que se basa en la dispersión celular de la luz incidente para visualizar la morfología celular.
- Para la microespectroscopía confocal multicanal, equipe el microscopio con espejos dicroicos. Por ejemplo, utilice los divisores de haz MBS InVis405, MBS458, MBS488, MBS458/514, MBS488/543 o MBS 488/543/633 para la excitación de 405, 458, 488, 514, 543 o 633 nm, respectivamente.
- Ajuste la intensidad de iluminación para cada longitud de onda de excitación utilizando un medidor de potencia láser. Mantenga constante la salida bajo el microscopio a través de longitudes de onda de excitación (por ejemplo, use 50 μW con el objetivo 63x).
3. Adquisición de imágenes
- Establezca el tamaño del agujero de alfiler en 1 UA utilizando el software del microscopio.
- Establezca el tiempo de permanencia de píxeles (es decir, la velocidad de escaneo) para cada longitud de onda de excitación.
NOTA: Un tiempo de permanencia de píxeles excesivamente largo puede dañar las células. Evite el tiempo de permanencia de píxeles excesivamente largo para minimizar el fotodaño a las celdas. Para muestras bacterianas, un tiempo de permanencia de píxeles <55.6 μs / μm2 (cuando la salida de irradiancia bajo el microscopio es ~ 17 μW / cm2) generalmente es adecuado para evitar la inhibición del crecimiento. Este parámetro puede variar dependiendo de los organismos y configuraciones experimentales. - Establezca la resolución de escaneo. Para células pequeñas como bacterias, use un área de escaneo de 1,024 x 1,024.
- Establezca el rango de escaneo Z para que la región de interés esté cubierta.
NOTA: Para muestras de células bacterianas y de levadura distribuidas en una losa de agarosa, un rango de escaneo Z de ~ 15 μm suele ser suficiente. - Configure el detector escaneado para capturar el rango de longitud de onda visible (por ejemplo, 416−691 nm). Utilice una ventana espectral de 8−10 nm.
- Adquiera imágenes de microespectroscopía confocal multicanal en una secuencia de longitudes de onda de excitación más largas a más cortas para crear pilas Z de imágenes de fluorescencia.
- Adquirir imágenes de CRM.
- Guarde las imágenes adquiridas como archivos tiff de 16 bits en un directorio. Asigne a los archivos el nombre de la convención de nomenclatura XXXcYYzZZ.tif, donde XXX es la longitud de onda de excitación, YY es el número de canal del detector, ZZ es el número de corte Z y "c" y "z" son prefijos para el número del detector y el número de corte Z, respectivamente.
- Por ejemplo, si se toma una imagen de microespectroscopía confocal multicanal con una longitud de onda de excitación de 405 nm, 1er canal detector de la matriz del detector, y es la 5ª porción de la pila Z, asígnele el nombre "405c01z05.tif". Para las imágenes de CRM, use la cadena "CRM" en lugar de XXX (por ejemplo, "CRMc01z05.tif").
NOTA: Decida si la segmentación 2D o 3D es la más adecuada para los datos de la imagen. Utilice un método de segmentación 2D en situaciones en las que las células pequeñas están limitadas a un plano 2D (por ejemplo, la población bacteriana que se adhiere a una superficie de vidrio). Utilice el método de segmentación 3D en situaciones en las que la población celular se distribuye en un espacio tridimensional (por ejemplo, biopelículas y muestras de tejido) o los tamaños de las células son mayores que el grosor de la rebanada óptica (por ejemplo, células de levadura, células de mamíferos). Para la segmentación 2D, consulte la sección 4; para la segmentación 3D, consulte la sección 5.
- Por ejemplo, si se toma una imagen de microespectroscopía confocal multicanal con una longitud de onda de excitación de 405 nm, 1er canal detector de la matriz del detector, y es la 5ª porción de la pila Z, asígnele el nombre "405c01z05.tif". Para las imágenes de CRM, use la cadena "CRM" en lugar de XXX (por ejemplo, "CRMc01z05.tif").
4. Análisis de imágenes 2D
- Equipe una estación de trabajo con software de análisis de imágenes (por ejemplo, MATLAB).
- Realizar la segmentación celular y la reconstrucción de firmas de fluorescencia innata unicelular.
- Abra el software de análisis de imágenes.
- Haga doble clic y abra uno de los scripts proporcionados "Script2D.m".
- Ve a la pestaña Editor y, a continuación, haz clic en Ejecutar. Debería aparecer una ventana de selección de carpetas.
- Seleccione el directorio creado en el paso 3.8 y, a continuación, haga clic en Abrir para continuar. Aparecerá automáticamente un cuadro de diálogo que solicita la entrada del parámetro de segmentación.
NOTA: Para fines de prueba, seleccione el conjunto de datos proporcionado ("Sample_2D"). El conjunto de datos de ejemplo se proporciona como un archivo comprimido y debe extraerse de antemano. - Introduzca los parámetros de segmentación: Umbral de binarización de imágenes (0−1) para binarización de imágenes = 0,45, Umbral superior para una región celular (en píxeles) = 200, Umbral inferior para una región celular (en píxeles) = 10 y Número de detectores = 32. Haga clic en Aceptar para continuar.
NOTA: Estos parámetros pueden requerir ajustes dependiendo de la calidad de la imagen. - Debería aparecer una nueva ventana de imagen que presenta una imagen de CRM. Seleccione una región de fondo arbitraria (es decir, un área donde las celdas están ausentes) para usarla para la resta de fondo. Dibuje un rectángulo dentro de la imagen de CRM arrastrando el mouse. Haga doble clic dentro de la región seleccionada para confirmar la selección.
- Busque un nuevo directorio denominado Firma en el mismo directorio seleccionado en el paso 4.2.4.
Nota : el código proporcionado crea automáticamente este directorio. El directorio "Firma" almacena la firma de fluorescencia innata de cada célula microbiana dentro de una población como archivos .png que se numeran en serie después de un prefijo común "Firma".
5.3D análisis de imágenes
- Equipar una estación de trabajo con el software de análisis de imágenes (Tabla de Materiales).
- Realizar la segmentación celular y la reconstrucción de firmas de fluorescencia innata unicelular.
- Abra el software de análisis de imágenes.
- Haga doble clic y abra el script proporcionado "Script3D.m".
- Ve a la pestaña Editor y, a continuación, haz clic en Ejecutar. Debería aparecer una ventana de selección de carpetas.
- Seleccione el directorio creado en el paso 3.8 y, a continuación, haga clic en Abrir para continuar. Aparecerá automáticamente un cuadro de diálogo que solicita la entrada de los parámetros de segmentación.
NOTA: Para fines de prueba, seleccione el conjunto de datos proporcionado ("Sample_3D"). El conjunto de datos de ejemplo se proporciona como un archivo comprimido y debe extraerse de antemano. - Introduzca los parámetros de segmentación: Umbral de binarización de imágenes (0–1) para binarización de imágenes = 0,01, Umbral superior para un volumen de celda (en píxeles) = 1.000, Umbral inferior para una región de celda (en píxeles) = 20, Tamaño de píxel X [μm/píxel] = 0,26, Tamaño de píxel Y [μm/píxel] = 0,26, Tamaño de píxel Z [μm/píxel] = 0,42 y El número de detectores = 32. Haga clic en Aceptar para continuar; aparecerá un cuadro de diálogo que solicita la entrada para el número de longitudes de onda de excitación.
NOTA: Estos parámetros pueden requerir ajustes dependiendo de la calidad de la imagen. - Introduzca el número de longitudes de onda utilizadas para la adquisición de imágenes (por ejemplo, si se utilizan 405, 488, 561, 630, escriba 4 en el cuadro de diálogo). Haga clic en Aceptar.
- Introduzca las longitudes de onda de excitación en una secuencia desde la más corta (es decir, el nombre de la caja: Excitación Nº 1) hasta la longitud de onda más larga en los cuadros de diálogo. Haga clic en Aceptar para continuar; debería aparecer una nueva ventana de imagen que presenta una imagen de CRM.
- Seleccione la región de fondo arbitraria (es decir, el área donde las celdas están ausentes) que se utilizará para la resta de fondo. Dibuje un rectángulo dentro de la imagen de CRM arrastrando el mouse. Haga doble clic dentro de la región seleccionada para confirmar la selección.
- Busque el directorio denominado Firma en el directorio seleccionado en el paso 5.2.4.
Nota : el código proporcionado crea automáticamente este directorio. El directorio "Signature" almacena la firma de fluorescencia innata de cada célula microbiana individual dentro de una población como archivos .png que se numeran en serie después de un prefijo común "Signature".
6. Análisis estadístico
NOTA: Realizar técnicas de reducción dimensional (por ejemplo, análisis de componentes principales [PCA]) para visualizar la distribución de hiperespectros de las poblaciones celulares. El script proporcionado (PCA.py) ejecuta PCA para dos poblaciones celulares (es decir, dos clases).
- Equipar una estación de trabajo con el lenguaje de programación y las bibliotecas y módulos que la acompañan (Tabla de Materiales).
- Cree un directorio vacío en la unidad C (o equivalente) y asigne al directorio el nombre "Parent_directory" (es decir, C:/ Parent_ directorio).
- Almacene las firmas de fluorescencia (por ejemplo, los archivos de .png generados en el paso 4.2.7) de cada una de las dos poblaciones celulares en dos directorios separados.
NOTA: Los dos directorios deben estar ubicados en el "Parent_directory".
C:/Parent_directory/ putidaKT2440/
putidaKT2440/
 Firma01.png
Firma01.png
 Firma02.png
Firma02.png
 :
: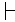 putidaKT2442/
putidaKT2442/
 Firma01.png
Firma01.png
 Firma02.png
Firma02.png
 :
: - Descargue PCA.py en el "Parent_directory".
- Abra la interfaz de línea de comandos de la estación de trabajo.
- Escriba "python C:/Parent_directory/PCA.py" en la interfaz de línea de comandos.
- Seleccione el "Parent_directory" después de que se muestre el mensaje "Seleccionar directorio de destino".
- En el "C:/Parent_directory", busque "PCA.png", que contiene una gráfica PCA resultante.
Resultados
La Figura 1A muestra la firma típica de fluorescencia de una sola célula de una célula bacteriana presentada como una gráfica de espectro tradicional (arriba) y como un mapa de calor (medio). La Figura 1B muestra el resultado de una segmentación celular 2D precisa superpuesta sobre la imagen CRM original de una población de bacterias del suelo (Pseudomonas putida KT2440)12. Las firmas de fluorescencia innata resultantes para la población se presentan como un mapa de calor en la Figura 1D. Tenga en cuenta que la variabilidad intrapoblación fue relativamente menor después de una segmentación celular exitosa. Un ejemplo de segmentación celular inexacta se muestra en la Figura 1C, que se superpone a la misma población de P. putida como se muestra en la Figura 1B. El impacto de la segmentación celular inexacta en las firmas de fluorescencia innatas de la población es fácilmente evidente a partir del considerable número de valores atípicos (Figura 1E, triángulos rojos). La segmentación celular inexacta dio como resultado un grupo más suelto después de PCA en comparación con el grupo apretado obtenido después de una segmentación celular precisa (Figura 1F).
Por lo general, a pesar de la variabilidad intraespecie, las firmas de fluorescencia innata de diferentes tipos de células forman grupos distintos. La Figura 2C presenta el resultado de los análisis de PCA para un par de cepas taxonómicamente cercanas (cepa KT2440 de P. putida y cepa KT244213). A pesar de la menor variabilidad observada dentro de cada población separada (Figura 2A, B), cada población formó un grupo distinto en la gráfica de análisis de PCA (Figura 2C).
La Figura 3A muestra el resultado de la segmentación precisa de células 3D superpuesta sobre la imagen CRM original de una población de levadura en ciernes Saccharomyces cerevisiae YM427114. La Figura 3B muestra las firmas de fluorescencia innata resultantes para la población.

Figura 1: Precisión de la segmentación y variabilidad aparente dentro de la especie. (A) Firma de fluorescencia innata unicelular típica de una célula bacteriana (P. putida KT2440), presentada como una gráfica de espectro (arriba) y un mapa de calor (medio). La longitud de onda de emisión se indica como un mapa de color arco iris (abajo). El eje Y de la gráfica del espectro y el color del mapa de calor indican las intensidades relativas de fluorescencia. Los números en la parte inferior indican la longitud de onda de excitación. Representación visual del reconocimiento preciso (B) e inexacto (C) de la región celular mediante el algoritmo de análisis de imágenes. El sombreado azul claro indica las regiones celulares detectadas para una población de la bacteria del suelo P. putida KT 2440. Los blobs con numeración roja en el panel C son ejemplos de detección falsa, donde el algoritmo clasificó regiones no celulares (es decir, ruido de fondo) como regiones celulares debido a configuraciones de umbral de binarización inapropiadas. Barras de escala = 1 μm en todo. Los paneles D y E representan las firmas de fluorescencia innatas para la misma población, generadas con una segmentación celular precisa e inexacta, respectivamente. Cada columna muestra un hiperespectro unicelular reconstruido presentado como una matriz de 1 x 192, donde el mapa de color amarillo a azul indica la intensidad relativa de la fluorescencia. (F) La varianza de las firmas de fluorescencia innatas en segmentaciones precisas (azul claro) e inexactas (rojo) visualizadas usando PCA. Cada etiqueta de eje denota el número de componente y su contribución porcentual acumulada al análisis de PCA. Haga clic aquí para ver una versión más grande de esta figura.
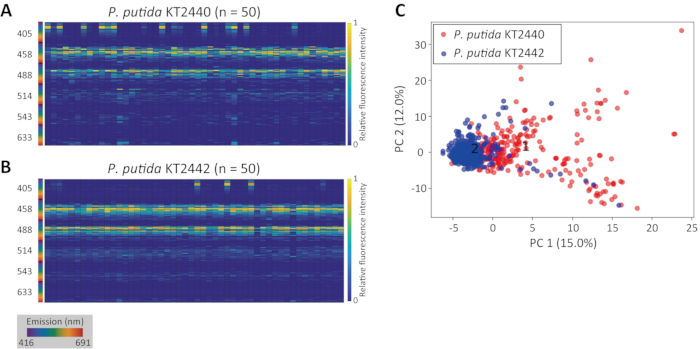
Figura 2: Variabilidad intra e interespecie de las firmas de fluorescencia innata. Firmas de fluorescencia innata presentadas como mapas de calor para una población de P. putida KT2440 (A) y P. putida KT2442 (B). (C) Proyección de los dos pares de firmas de fluorescencia innata visualizados mediante PCA, correspondientes a P. putida KT2440 (rojo, n = 288) y P. putida KT2442 (azul, n = 373). Los ejes X e Y representan PC1 y PC2, respectivamente. El número de recuadro indica el centro de cada racimo (1: P. putida KT2440, 2: P. putida KT2442). Haga clic aquí para ver una versión más grande de esta figura.
Figura 3: Ejemplo de segmentación 3D y extracción de firma de fluorescencia innata. (A) Proyección 3D de regiones reconocidas como poblaciones celulares de levadura en ciernes S. cerevisiae YM4271. Los números insertados son los números de identificación. (B) Mapa de calor de firmas de fluorescencia innatas extraídas de las regiones 3D. El número del eje X corresponde al número de identificación. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Hay dos puntos críticos en este método que deben seguirse de cerca para obtener resultados reproducibles: 1) mantener la salida de potencia del láser bajo el objetivo del microscopio consistente a través de longitudes de onda de excitación y experimentos, y 2) realizar una segmentación celular precisa.
El primer punto es particularmente importante cuando se compara la firma de fluorescencia innata entre diferentes experimentos. Evite simplemente aplicar la misma configuración de "porcentaje de salida" a las longitudes de onda de excitación (es decir, usar una salida de potencia del 5% para todas las líneas láser de 405, 488, 514 y 530 nm), ya que la salida de potencia máxima puede diferir hasta un orden de magnitud entre las líneas láser. Además, el objetivo y la óptica interna suelen tener características de absorción óptica desiguales, que también deben tenerse en cuenta. Por estas razones, se recomienda medir realmente la salida bajo el objetivo utilizando un medidor de potencia láser (Tabla de Materiales). También se recomienda tomar esta medición cada pocos experimentos, o periódicamente, porque la salida de las líneas láser puede decaer significativamente en unos pocos años.
El segundo punto, la segmentación celular precisa, se vuelve particularmente importante en situaciones donde la variabilidad intra o interespecie es una preocupación. La segmentación celular inexacta (Figura 1D) da como resultado puntos de datos atípicos (Figura 1E, indicada por triángulos rojos) y una mayor variabilidad aparente dentro de la especie. Los parámetros de segmentación deben determinarse cuidadosamente, verificando la precisión de la segmentación celular superponiendo los resultados de segmentación en la imagen original de CRM, antes de proceder a cualquier análisis adicional o entrenar modelos de aprendizaje automático. Si se trabaja con una imagen de baja calidad, se podría requerir un procesamiento de imagen adicional para lograr una segmentación precisa. El uso de un 'filtro gaussiano' o 'filtro mediano' puede eliminar artefactos granulados, y el procesamiento de filtros bilaterales contrarresta cualquier fondo rayado.
Con una óptica de mala calidad (por ejemplo, un objetivo de grado no confocal) o una sensibilidad insuficiente del detector, tratar con la detección de firmas de fluorescencia innata débiles puede ser un desafío. Nótese que utilizando la configuración descrita aquí y anteriormente11, no encontramos ningún tipo de muestra celular cuya fluorescencia innata fuera demasiado débil para reconstruir una firma de fluorescencia innata. Aunque se puede utilizar una mayor salida de emisión para la excitación y un mayor tiempo de permanencia de píxeles para obtener señales de emisión más fuertes, esto puede causar daños a las muestras celulares. Una solución potencial para los casos en que la fluorescencia innata débil es un problema es reducir la intensidad de la señal de fondo, por ejemplo, suspendiendo las células en tampón o medios sintéticos en lugar de caldo. Los tipos de envases celulares, como los platos con fondo de vidrio y los dispositivos microfluídicos, son compatibles y apropiados para esta técnica, aunque se utilizó una losa de agarosa para retener las células en posición aquí y en un estudio previo15.
El método de microscopio confocal ofrece resolución espacial y análisis in situ para poblaciones de células adherentes, biopelículas y muestras de tejido. Una compensación potencial de esta metodología es el rendimiento máximo en comparación con un citómetro de flujo, por ejemplo. Un conjunto completo de escaneos confocales que recolectan de unos pocos cientos a mil firmas de fluorescencia innatas con un solo conjunto de escaneos puede tomar hasta unos minutos. Un citómetro de flujo es menos sensible debido a su diseño óptico, pero potencialmente puede lograr un rendimiento varios órdenes de magnitud mayor.
Identificar rigurosamente un compuesto que es responsable de un pico específico en una firma fluorescente innata suele ser un desafío, debido a su naturaleza complicada. Sin embargo, se ha sugerido que una serie de moléculas biológicamente relevantes, como las vitaminas (por ejemplo, flavina adenina dinucleótido [FAD]), las coenzimas (por ejemplo, nicotinamida adenina dinucleótido [NADH]) y los pigmentos de lipofuscina podrían ser fluoróforos importantes en las células1,16. Por ejemplo, FAD tiene un máximo de excitación entre 350-450 nm y un pico de emisión de aproximadamente 525 nm16. El NADH libre tiene un máximo de excitación y un pico de emisión a 340 nm y 460 nm, respectivamente, aunque los espectros de emisión del NADH unido a proteínas difieren16,17,18. Los lipopigmentos que se sabe que se asocian con células estresadas o envejecidas tienen un amplio rango de excitación (350-500 nm) y un rango de emisión (450-600 nm)16,18.
El uso de CRM ofrece una fuente independiente de información para identificar los contornos celulares y, por lo tanto, proporciona otra ventaja significativa de CRIF: la extracción selectiva de señales de fluorescencia de células individuales distribuidas en un espacio 3D. Esto representa un paso adelante desde el análisis tradicional de las características de fluorescencia de toda una colonia microbiana o una suspensión de cultivo a granel, que es una mezcla promediada de señales de un gran número de células contaminadas con señales no celulares de componentes medios, metabolitos secretados y matrices extracelulares. Un análisis de firmas de fluorescencia innata de una sola célula permite la caracterización predictiva del estado fisiológico de las células intactas, proporcionando una solución potencial para resolver el desarrollo temporal de la distribución y el estado fisiológico de una célula.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este estudio fue apoyado en parte por una subvención para la investigación científica del Ministerio de Educación, Cultura, Deportes y Tecnología de Japón (18K04843) a Y. Yawata, el JST ERATO (JPMJER1502) a N. Nomura.
Materiales
| Name | Company | Catalog Number | Comments |
| Agarose | Wako Chemicals | 312-01193 | |
| Beam splitters | Carl Zeiss, Nikon | MBSInVis405, MBS458, MBS488, MBS458/514, MBS488/543, or MBS 488/543/633 beam splitters (Carl Zeiss) | |
| Confocal microscope | Carl Zeiss, Nikon | Model LSM 880 (Carl Zeiss), Model A1R (Nikon) | |
| Cover slips | Matsunami Glass | C024601 | |
| Glass slides | Matsunami Glass | S011120 | |
| Half-reflection mirror | Carl Zeiss, Nikon | NT80/20 | |
| Laser power meter | Thorlabs | PM400 (power meter console) and S175C (sensor) | |
| LB Broth | Nacalai tesque | 20066-95 | For bacteria culture |
| Image analysis software | The MathWorks | MATLAB version 2019a or later, Image Processing Toolbox is needed | |
| Microscope objective | Carl Zeiss, Nikon | 440762-9904 | e.g. 63x plan Apochomat NA = 1.4 (Carl Zeiss) |
| Microscope software | Carl Zeiss, Nikon | ZEN (Carl Zeiss),NIS-elements (Nikon) | |
| PBS(-) | Wako Chemicals | 166-23555 | |
| Programming language | Python and libraries, modules (numpy, scikit-learn, scikit-image, os, glob, matplotlib, tkinter) are rquired to run the supplied PCA script. | ||
| Silicone gasket | ThermoFisher Scientific | P24744 | |
| Workstation | A high-performance workstation with discrete GPUs is recommended. | ||
| Yeast extract-peptone-dextrose (YPD) agar medium | Sigma-Aldrich | Y1500-250G | For yeast culture |
| YPD medium | Sigma-Aldrich | Y1375-250G |
Referencias
- Monici, M. Cell and tissue autofluorescence research and diagnostic applications. Biotechnology Annual Review. 11, 227-256 (2005).
- Tang, J. Microbial metabolomics. Current Genomics. 12, 391-403 (2011).
- Woo, P. C., Lau, S. K., Teng, J. L., Tse, H., Yuen, K. Y. Then and now: use of 16S rDNA gene sequencing for bacterial identification and discovery of novel bacteria in clinical microbiology laboratories. Clinical Microbiology and Infection. 14, 908-934 (2008).
- Amman, R., Fuchs, B. M. Single-cell identification in microbial communities by improved fluorescence in situ hybridization techniques. Nature Reviews Microbiology. 6, 339-348 (2008).
- Giana, H. E., Silveira, L., Zângaro, R. A., Pacheco, M. T. T. Rapid identification of bacterial species by fluorescence spectroscopy and classification through principal components analysis. Journal of Fluorescence. 13 (6), 489-493 (2003).
- Leblanc, L., Dufour, E. Monitoring the identity of bacteria using their intrinsic fluorescence. FEMS Microbiology Letters. 211 (2), 147-153 (2002).
- Hou, X., Liu, S., Feng, Y. The autofluorescence characteristics of bacterial intracellular and extracellular substances during the operation of anammox reactor. Scientific Reports. 7, 39289 (2017).
- Ramanujam, N., et al. In vivo diagnosis of cervical intraepithelial neoplasia using 337-nm-excited laser-induced fluorescence. Proceeding National Academy of Sciences of the United States of America. 91 (21), 10193-10197 (1994).
- Zhang, J. C., et al. Innate cellular fluorescence reflects alterations in cellular proliferation. Lasers in Surgery and Medicine. 20 (3), 319-331 (1997).
- Gosnell, M. E., et al. Quantitative non-invasive cell characterisation and discrimination based on multispectral autofluorescence features. Scientific Reports. 6, 23453 (2016).
- Yawata, Y., et al. Intra- and interspecies variability of single-cell innate fluorescence signature of microbial cell. Applied and Environmental Microbiology. 85, 00608-00619 (2019).
- Nelson, K. E., et al. Complete genome sequence and comparative analysis of the metabolically versatile Pseudomonas putida KT2440. Environmental Microbiology. 4 (12), 799-808 (2002).
- Bagdasarian, M., et al. Specific-purpose plasmid cloning vectors. II. Broad host range, high copy number, RSF1010-derived vectors, and a host-vector system for gene cloning in Pseudomonas. Gene. 16 (1-3), 237-247 (1981).
- Luo, Y., Vijaychander, S., Stile, J., Zhu, L. Cloning and analysis of DNA-binding proteins by yeast one-hybrid and one-two-hybrid systems. Biotechniques. 20 (4), 564-568 (1996).
- Yawata, Y., et al. Monitoring biofilm development in a microfluidic device using modified confocal reflection microscopy. Journal of Bioscience and Bioengineering. 110 (3), 377-380 (2010).
- Lakowicz, J. R. . Principles of Fluorescence Spectroscopy. Third edition. , (2006).
- Blacker, T. S., Duchen, M. R. Investigating mitochondrial redox state using NADH and NADPH autofluorescence. Free Radical Biology & Medicine. 100, 53-65 (2016).
- Croce, A. C., Bottiroli, G. Autofluorescence spectroscopy and imaging: A tool for biomedical research and diagnosis. European Journal of Histochemistry. 58 (4), 2461 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados