Method Article
Diş Hamuru Parakrin Sinyalleri yanıt olarak Neurite Outgrowth Çalışma Co-Kültür Yöntemi
Bu Makalede
Özet
Biz izolasyon, dağılım ve diş hamuru kaplama (DP) trigeminal ile birincil hücrelerin kaplama (TG) nöronlar üstteki transwell filtreleri üzerinde kültürlü. DP hücrelerinin hücresel yanıtları immünofloresan veya RNA/protein analizi ile analiz edilebilir. Konfokal mikroskopi ile nöronal belirteçlerin immünfloresansi neurite outgrowth yanıtlarının analizine izin verir.
Özet
Diş innervasyonu dişlerin basınç, sıcaklık ve iltihabı algılamasını sağlar, bunların hepsi diş organının kullanımı ve bakımı için çok önemlidir. Duyusal innervasyon olmadan, günlük oral aktiviteler onarılamaz hasara neden olur. Önemine rağmen, diş geliştirme ve bakım innervasyon rolleri büyük ölçüde göz ardı edilmiştir. Çeşitli çalışmalar DP hücrelerinin dişe ve diş boyunca TG aksonları çekmek ve yönlendirmek için hücre dışı matriks proteinleri ve parakrin sinyalleri salgıladığını göstermiştir. Ancak, birkaç çalışma DP mezenchyme ve nöronal afferents arasındaki çapraz konuşma içine ayrıntılı bir fikir sağlamıştır. Bilgideki bu boşluğu gidermek için araştırmacılar bu etkileşimleri araştırmak için ortak kültürleri ve çeşitli tekniklerden yararlanmaya başladılar. Burada, gözenekleri aracılığıyla aksonal büyüme sağlamak için büyük çaplı gözenekleri ile bir üstteki transwell filtre üzerinde dağınık TG nöronlar ile co-culturing birincil DP hücreleri dahil birden fazla adım göstermektedir. Adenovirüs-Cre-GFP rekombinaz sistemi kullanılarak gen delesini kolaylaştırmak için loxP bölgelerinin oluşturduğu ilgi genine sahip primer DP hücreleri kullanılmıştır. Thy1-YFP fareden TG nöronlar kullanarak hassas afferent görüntüleme için izin, konfokal mikroskopi ile arka plan seviyelerinin çok üzerinde ifade ile. DP yanıtları protein veya RNA toplama ve analizi yoluyla veya alternatif olarak çıkarılabilir cam kapaklar üzerine kaplanmış DP hücrelerinin immünofloresan boyama yoluyla araştırılabilir. Medya proteomik analizler gibi teknikler kullanılarak analiz edilebilir, ancak bu medyada fetal sığır serumunun varlığından dolayı albümin tükenmesini gerektirir. Bu protokol, tg nöronlarının ve DP hücrelerinin morfolojik, genetik ve sitosiskeleter yanıtlarını incelemek için manipüle edilebilen basit bir yöntem sağlar.
Giriş
Diş innervasyonu dişlerin basınç, sıcaklık ve iltihabı algılamasını sağlar, bunların hepsi diş organının kullanımı ve bakımı için çok önemlidir. Diş çürükleri ve travma ile ilişkili diş ağrısı hissedilmemesi hastalığın ilerlemesine yol açar. Böylece, uygun innervasyon normal diş büyümesi, fonksiyon ve bakım için bir gerekliliktir.
Çoğu organ tamamen işlevsel ve doğum zamanı ile innerve iken, diş gelişimi yetişkin yaşam içine uzanır, diş innervasyonu ve mineralizasyon sonrası aşamalarında meydana gelen ile1,2. İlginçtir, diş hamuru (DP) mezenchyme başlangıçta gelişmekte olan diş organıiçine akson girişini önlemek için embriyogenez sırasında itici sinyalleri salgılar, hangi daha sonra diş patlaması yakın olarak çekici faktörlerin salgısına geçer3,4. Doğum sonrası evrelerde, trigeminal (TG) sinirinden gelen afferent aksonlar, dentin birikiminin başladığı zaman dişin içine ve her zamanına nüfuz eder (Pagella, P. ve ark.5'tegözden geçirilir). Vivo çalışmalarda çeşitli nöronal-mezenkimal etkileşimler farelerde diş innervasyonu kılavuzu göstermiştir (Luukko gözden, K. veark. 6),ama moleküler mekanizmaların birkaç ayrıntı mevcuttur.
Hücre ortak kültürleri, araştırmacıların nöronal ve mezenkimal popülasyonlar arasındaki etkileşimleri manipüle edebildiği kontrollü ortamlar sağlar. Ortak kültür deneyleri, diş innervasyonu ve gelişimine rehberlik eden sinyal yollarının daha derinlerine dalmamayı mümkün kılar. Ancak, ortak kültürdeki hücreleri incelemek için kullanılan geleneksel yöntemlerin bir çoğu teknik zorluklar sunmaktadır. Örneğin, neurite büyüme kristal mor boyama non-özel TG demet dağılımları dahil Schwann hücreleri leke olabilir, ve nispeten küçük tepkiler ile renk yoğunluğu zirveleri olabilir7. Mikroakışkan odaları cazip bir seçenek sunuyoruz, ancak transwellfiltreler 8,9 ve sadece DP salgıları nöronal tepkilerin araştırılmasına izin çok daha pahalıdır. Bu sorunları ele almak için, bir protokol geliştirdik: a) DP salgılarına yanıt olarak TG neurite outgrowth kesin boyama ve görüntüleme, b) DP hücreleri ve / veya TG nöronlar genetik modifikasyonbelirli sinyal yollarını araştırmak için, ve c) TG nöronlar tarafından salgılanan faktörlere DP hücre yanıtlarının araştırılması. Bu protokol, bir in vitro co-kültür testin kontrollü ortamında diş innervasyonunun çeşitli özelliklerini tam olarak araştırma olanağı sağlar.
Protokol
Farelerle yapılan tüm deneyler UAB Kurumsal Hayvan Bakım ve Kullanım Komitesi (IACUC) tarafından onaylanmıştır.
1. Plaka Hazırlama
NOT: Coverslips, tayın sonundaDP hücrelerini görüntülemek için kullanılabilir. Numune işleme sırasında kontaminasyonu önlemek için steril doku kültürü başlığının dışındaki tüm kuluçka ve durulama basamaklarında plaka kapağının açık olduğundan emin olun.
-
Coverslip hazırlama
- Otoklav dairesel kapakları.
- Ultra saf suyu kaputun altına süzün.
- Kapakları 24 kuyulu bir tabağa aktarın ve her birini 0,1 mg/mL poli-D-lizin 400 μL ile kaplayın.
- Coverlips emmek için izin verin, 5 dakika batırılmış, bir rocker üzerinde 12 rpm veya orbital shaker 40-50 rpm. Kontaminasyonu önlemek için kapağın üzerinde olduğundan emin olun.
- 12 rpm veya shaker bir rocker üzerinde yaklaşık 5 dakika boyunca filtre ultrasaf su ile kapakları durulayın 50 rpm. Tekrar.
- Kapak kapaklarının kaputun altında en az 2 saat kurumasını bekleyin ve plaka kapağı kapalı buharlaşmayı kolaylaştırın. Bu kapaklar 48 saat içinde kullanılmalıdır.
- İmmünofloresans için yapılan tayın sonunda coverslips ve proses üzerine tohum DP hücreleri (bölüm 3.3).
-
Kaplama filtreleri
- Laminanın 10 μg/mL'ye seyreltilmesi. Seyreltilmiş laminin kaputun altına süzün.
- Pipet 450-500 μL 10 μg/mL laminin 24 kuyunun her kuyuiçine.
- Transwell filtresini, 3 μm gözenekliliği, laminin çözeltisi ile temas etmesi için bir kuyuya yerleştirin ve 2 saat veya gece boyunca 37 °C'lik bir kuluçka makinesinde bırakın. Filtre gözenekleri, çözeltinin bir kısmının filtrenin hem üst hem de alt kısmını dağıtmasına ve kaplamasına izin vermelidir. Bu filtreler 48 saat içinde kullanılmalı veya 4 °C'de 1 haftaya kadar buzdolabında bekletilmelidir.
2. İsteğe Bağlı Genetik Manipülasyon ile Hücre Kaplaması
- Fareler: Mezenkimal-nöronal etkileşimleri incelemek için DP hücrelerinin genetik değişimi yapılabilir (ancak gerekli değildir). Önerilen genetik varyasyonlar için bölüm 2.3 ve 2.4'e bakın.
- DP diseksiyonu, dağılım ve kaplama (Şekil 1)
NOT: DP diseksiyonu için ultra ince, düz kenarlı forseps kullanın. Ultra ince kenarlar, kullanıcının mineralize yapı ile DP dokusu arasındaki forcep kenarını sıkıştırmasını sağlar.- Hasat P5-P8 fareler. Bu aşamada dişler mineralleşmeli ve kök açık olmalıdır.
- Neonatları hipotermi yoluyla, 4 °C'lik buzdolabında ki bir tabağa yerleştirerek, dokunmaya devam edene kadar anestezi edin. Belirlenen tesiste ki Yoğun Bakım Ünitesi prosedürlerine uygun olarak ve kafa kesme ile nötralar.
- Her fareden DP toplamak için 50 mL konik tüpte %0,25 tripsin-EDTA'dan oluşan 3-5 mL aliquot hazırlayın. Bu doğum sonrası farelerdiş hamuru sindirimini kolaylaştıracaktır. 10'dan fazla doğum sonrası fareden doku sindiriyorsanız 3 mL'den fazla kullanın.
- Ağzı tavana doğru ve boyun tabanı çalışma yüzeyinde düz olacak şekilde tek kullanımlık bir alt lık üzerine baş yerleştirin. Mandibulayı maksilladan ayırmak için testere hareketiyle jilet kullanın.
- İsteğe bağlı olarak azı azı nalerine daha kolay erişim sağlamak için dili makasla veya çömleçlerle çıkarın.
- Açılan başı steril bir gazlı bez yastığının üzerine bir tabağa yerleştirin ve numuneyi bir kesme mikroskobunun altına yerleştirin(Şekil 1D).
- İlk azı döşeylerini çevreleyen alveoler kemik dokusunu çıkarın. Submandibular dişler bu noktada tam olarak patlak vermez. Alveolar açılım içine forceps yerleştirin ve ağız bukcal (yanak) veya lingual (dil) tarafına doğru diş uzak doku kızdırmak. Maksiller dişler pozlama ve çıkarılması için diş etrafında yarık tam kaldırılmasını gerektirir.
- Submandibular ve maksiller ilk azı döşeylerini (M1s) 1x fosfat tamponlu salin (PBS) içeren ayrı bir hücre kültür yemeğine yavaşça aktarın.
- Tüm M1'ler toplanana kadar 2.2.4-2.2.8'i tekrarlayın. Hasat sırasında buz üzerinde M1s içeren çanak tutun.
- Her M1'in dışını çevreleyen Emaye Dış Organını (EOE) çıkarın. Bu alternatif olarak adım 2.2.11 sonra yapılabilir.
- Bir set ile M1'i döndürün, böylece tepeler inin ve açık kök açıkta kalır. Dişin alt kısmında oval bir açıklık ve ince bir dentin ve mine tabakası ile kapsüllenmiş opak DP dokusu olacaktır.
- Forceps ucu nu kullanarak, mineralize dokunun iç çevresi etrafında forceps bir kol çalıştırarak DP yavaşça gevşetin. DP dokusunu mineralize yapıdan çıkarın ve 1x PBS içeren üçüncü bir tabağa aktarın. EOE'yi zaten ayrılmamışsa çıkarın(Şekil 1E).
- 50 mL konik tüpte tüm DP dokusunu %0.25 tripsin-EDTA'ya aktarın. Girdap karışımı ve 10 dakika boyunca 37 ° C ılık su banyosu yer. Bu aynı forceps veya uzun, şişe forceps ile yapılabilir. Doku dağıtmak zor olacak ve her 3-4 dakika girdap gerektirecektir. Tripsin hücre zarlarına zarar verebileceğinden 10 dk trypsinizasyonu geçmeyin.
- Steril bir başlık altında, enzimin inaktive etmek için en az 1:1 medya son oranına ısınmış co-kültür medya(Tablo 1)ekleyin. Daha fazla doku dağılımı isteniyorsa daha büyük oranlar kabul edilebilir.
- Pipet, DP'yi medyada daha fazla dağıtmak için 10 mL'lik pipetle medyayı birden çok kez yukarı ve aşağı doğru çevirin. Büyük kabarcıklar önlemek için dikkatli olun. Tam dağılım neredeyse doku yapışkan doğası nedeniyle mümkün değildir. Ancak, hücreler bir kez kaplanmış doku dan dışa doğru göç edecek çünkü de gerekli değildir.
- Dağılmış DP'nin 1 mL'sini 24 kuyulu doku kültür plakasının her kuyuya aktarımı(Şekil 1F).
- Plakayı 37 °C'de bir kuvöze yerleştirin ve ortam değiştirmeden önce hücrelerin dağılmayan dokudan 48 saat boyunca takılmasına ve dışarı çıkmasına izin verin. 1 hafta içinde %85-90 biraraya gelmek için primer hücrelerin nispeten yüksek konsantrasyonlarda kapılması gerekir. Bu 1 hafta sonra elde edilemezse, plakayı atın.
- DP Hücrelerinin İsteğe Bağlı Genetik Manipülasyonu
- Hücre sinyal yollarını değiştirmek için, dp hücrelerini genetik nakavt farelerden veya loksp bölgeleri tarafından kuşatılan bir genin bulunduğu farelerden toplayarak. İkinci durumda, gen Adenovirus-Cre-GFP (Ad-Cre-GFP) rekombinaz kullanılarak aşağıda açıklandığı gibi, kanatlı geni kaldırmak için silinebilir. Viral enfeksiyonun hücresel yanıta neden olmamasını sağlamak için adenovirüs-eGFP (Ad-eGFP) kontrol virüsü olarak kullanın.
NOT: Ad-eGFP çok güçlü CMV organizatörü arttırıcı tarafından kontrol edilir. Ad-Cre-GFP, Cre ve GFP arasında çok güçlü olmayan bir iç düzenleyici bölge olan IRES tarafından düzenlenir. Bu ad-cre-GFP hücrelerinden daha Ad-eGFP hücrelerinde parlak floresan ile sonuçlanır. Hücresel floresan düzeylerine değil, floresan hücrelerin toplam sayısına göre eşdeğer enfeksiyon düzeylerini doğrulayın. - Her kuyuda virüs içeren 500 μL ve 10 g/mL polibren hazırlayın. Polibren10yakın hücrelerde viral enfeksiyon ile yardımcı olur. Bu protokol, etkili gen enfeksiyonu için Ad-eGFP için 100 ve hücre canlılığı üzerinde çok az veya hiç etkisi olmayan etkili gen enfeksiyonu için 200 Ad-Cre-GFP'nin çokluktaki enfeksiyon (MOI) sayısına dayanmaktadır. Tahmini hücre sayısı 4 x 104 hücre/kuyu 24 kuyulu bir plakadır:
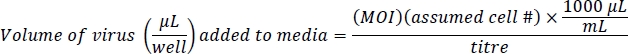
- Ortamı kısa girdap veya pipetleme ile karıştırın ve her kuyuya 500°L ekleyin.
- 24 saat sonra, ek polibren veya virüs içermeyen 500 μL ek bir ortak kültür ortamı ekleyin.
- Toplam 48 saat sonra, virüs içeren medya aspire ve taze co-kültür medya ile değiştirin. Bu noktada, TG nöronlar transwell filtreler üzerine eklenebilir.
- Hücre sinyal yollarını değiştirmek için, dp hücrelerini genetik nakavt farelerden veya loksp bölgeleri tarafından kuşatılan bir genin bulunduğu farelerden toplayarak. İkinci durumda, gen Adenovirus-Cre-GFP (Ad-Cre-GFP) rekombinaz kullanılarak aşağıda açıklandığı gibi, kanatlı geni kaldırmak için silinebilir. Viral enfeksiyonun hücresel yanıta neden olmamasını sağlamak için adenovirüs-eGFP (Ad-eGFP) kontrol virüsü olarak kullanın.
- Trigeminal nöron diseksiyonu, dağılım ve kaplama
NOT: Bu protokolde, DP hücreleri ile birlikte kültürde neurite büyümenin görüntülenmesi ergen (6 haftalık) B6.Cg-Tg kullanılarak optimize edilebildi.Thy1-YFP)16Jrs/J fareler. Thy1-YFP farelerinin merkezi ve periferik sinir sistemleri, ekspresyonu nöronlarda P6-P10 civarında başlayan ve doğum sonrası ve erişkin yaşamda sinir sistemi boyunca katlanarak artan sarı floresan protein (YFP) etiketine sahiptir.11,12. YFP ve GFP bu sinirlerin anti-GFP antikorları ile lekelenmiş olmasını sağlayan dizileri korunmuş, bir pan-nöronal leke ile sonuçlanan. Sonuçta, bu fareler kullanılan ve hücre kültüründe yetiştirilen nöronların daha iyi görselleştirme ve nicelizin sağlar.- Karbondioksit li ergen fareleri ötenazi ve ardından servikal çıkığı.
- Farelerin kafasını koparın ve kafatasından deri çıkarın. Erkek ve dişilerin eşdeğer sayıda içerdiğinden emin olun.
- Kafatasının tabanına mikro-diseksiyon makası bir çift ucu yerleştirin. Kafatasının sagittal sütür boyunca kesilmiş (Şekil 1A).
- Dört küçük yatay kesim yapın: iki kulakları tarafından koronal dikişler boyunca, ve kafatası tabanında lambdoid dikişler boyunca iki. Bu iki kemik flebi oluşturacaktır.
- İki kemik kapağını soymak için püzüler kullanın. Bu beyni ortaya çıkaracak.
- Beyni çıkar. 1x PBS ile bir doku kültürü çanak baş aktarın ve mikroskop altına koyun.
- Kemirgenlerde kolayca görülebilen TG gangliyonu bulun13, maksiller sürecin beyin ve kemik arasındaki dura maddede yer alır (Şekil 1B).
- Gözlere, maksilla ve mandibula seyahat üç dalları kesin ve düz kenar ince çiller kullanarak soğuk 1x PBS için ganglia aktarın. Hasat sırasında buz üzerinde TG gangliyonu içeren çanak tutun.
- Tüm TG demetleri hasat edildikten sonra, şişe forceps kullanarak 5 mg/mL steril filtreli kollajenaz tip II içeren 50 mL konik bir tüpe ganglia aktarın.
- TG demeti ile kollajenaz girdap ve 25-30 dakika boyunca 37 ° C su banyosu tüp yerleştirin. Bu süre zarfında konik tüpü su banyosundan, girdaptan alın ve her 5-10 dakikada bir banyoya dönün.
- Santrifüj kollajenaz-TG nöron çözeltisi için 2 dk 643 x g.
- Bir doku kültürü başlık altında, yavaşça bir mikropipette ile kollajenaz aspire.
- %1 steril filtreli tripsin tip II ve girdap 5 mL ekleyin. Konik tüpü 37 °C'lik bir su banyosuna 5 dakika yerleştirin.
- Centrifuge tripsin-TG karışımı için 5 dk 643 x g. Bir mikropipet ile tripsin üst kısmını çıkarın, böylece TG nöronlar kaldırılmaz. Tüpte hala sıvı olacak.
- Kalan trypsin 'i devre dışı bırakacak kadar ortam ekleyin (1:1 veya daha düşük bir trypsin oranında ortama).
- Hücre sayısını sayın ve çözeltiyi 200.000 hücre/mL (hücre içeren 50.000 hücrenin 250 μL'si) seyreltin.
- Bölüm 1.2'den kaplanmış transwell filtrelerini DP ile kuyulara yerleştirin.
- Hücre içeren çözeltiyi 200.000 hücre/mL olacak şekilde seyreltin. Pipet 250 μL transwell filtre üzerine, ve kültür hücreleri 37 °C gecede(Şekil 1F).
- Ertesi gün, 1 μM uridin ve 15 μM 5'-flor-2'deoksiuridine ile 1 mL Co-kültür medya ile medya değiştirin nötrinit büyümesini önleyebilir mezenkimal hücrelerin aşırı çoğalmasını durdurmak için. İsteğe bağlı: Daha fazla manipülasyon girişiminde çalışıyorsanız bu ortama büyüme faktörleri veya inhibitörleri ekleyin.
- Kültür ek istenen zaman noktaları için hücreleri. Bu protokol, medya sadece 2 gün mitotik inhibitörleri eklemek için değiştirildi ile kültür 5 toplam gün için optimize edilmiştir. Daha uzun süreler ek ortam değişiklikleri gerektirir.
3. Numune Toplama ve İşleme
- Trigeminal boyama
- Pipet 1 mL steril 1x PBS aliquots bir doku kültürü başlık altında 24-iyi plaka içine her transwell filtre işlenecek.
- Filtrenin üzerine çıkan sıvıyı 200-1.000 μL pipetle çıkararak hücre katmanlarını sağlam bırakmaya dikkat edin. Ekli hücreler bağlı kalmalı ve bu nazik pipetleme sırasında eklenmemiş hücreler gevşek gelecektir. Bir vakum filtresi hücre tabakasına zarar verebilir ve aspirasyon için tavsiye edilmez.
- Filtreyi, önceki adımda belirtildiği gibi ortamın üst tabakasını çıkardığından emin olarak 1x PBS plakasına aktarın.
- 10 dakika boyunca bir orbital shaker üzerinde 12 rpm veya 40-50 rpm bir rocker tüm transwell filtreleri ve kapakları ile plaka yerleştirin.
- Yukarıda açıklandığı gibi üst tabaka da dahil olmak üzere PBS aspire, 1xPBS 500 μL ekleyin ve ek bir 5-10 dakika durulama için rocker veya orbital shaker yer.
- 1x PBS'yi bir kez daha aspire edin ve %4 paraformaldehit (PFA) ile değiştirin. Tüm filtre yüzeyinin batırılmış olması için en az 500 μL kullanın. 1 saat oda sıcaklığında 40-50 rpm 12 rpm veya orbital shaker bir rocker üzerine plaka yerleştirin.
- PFA'yı çıkarın ve 500 μL 1x PBS ile bir rocker üzerinde 5-10 dakika boyunca plakaları iki kez durula.
- %10 büyükbaş hayvan serum albumini (BSA) + %5 keçi/eşek serumu, ikincil antikor konak hayvanına bağlı olarak %0.05 Tween-1xPBS (PBST) ile blok. Filtrenin sıvıya batırılabilmesi için 450-500 μL çözelti kullanın.
NOT: Bu aşamada, bu plakalar daha sonra işlemek için birkaç ay boyunca 4 °C'de saklanabilir. Buharlaşmanın meydana gelmemesini sağlamak için plakayı kapatmak için parafilm kullanın ve filtre yüzeylerinin su altında kalması için buharlaşmayı düzenli olarak kontrol edin. - Bloğu çıkarın ve ilave bir durulama olmadan % 1 BSA-PBST primer antikor 450-500 μL ekleyin. Gece boyunca 4 °C'de inkübün, hafifçe sallayarak.
- Oda sıcaklığında bir kaya üzerinde 500 μL 1xPBST ile primer antikor çözeltisini çıkarın ve durulayın
- PBST'yi çıkarın, floroforları ışık bozulmasından korumak için 4 °C'de bir kayanın üzerine bir gecede ikincil antikor ekleyin ve inküvit ekleyin. Tekrar durulayın, 3 kez, oda sıcaklığında bir rocker üzerinde 1x PBST ile. 1x PBS ile değiştirin.
NOT: Bu noktada, florofor bozulmasını önlemek için alüminyum folyoya sarılı halde plaka 4 °C'de birkaç ay saklanabilir. Buharlaşmanın meydana gelmemesini sağlamak için plakayı kapatmak için parafilm kullanın ve filtre yüzeylerinin su altında kalması için buharlaşmayı düzenli olarak kontrol edin. Bir ay içinde görüntü en iyisidir. - Optimal görüntüleme için, özellikle arka plan seviyelerinin çok üzerinde nöronal afferents leke bir anti-GFP antikor ile Thy1-YFP fare nöronlar kullanın. Thy1-YFP fareler mevcut değilse aksonal yapıları tam olarak lekelemek için Anti-Neurofilament 200 kullanın.
- İstenildiği gibi görüntü. Filtrelerin kaplanmış olması gerekmez ve bunun yerine ters mikroskopla görüntüleme için bir kapak kayması veya slayt üzerine yerleştirilebilir.
NOT: Filtrenin alanları afferent yapılar içermez. Tüm afferent yapıları yakalayan z-yığın derinliğiile birkaç görüntü alın. Büyük alanlar veya (tercihen) tüm filtre bölgeleri üzerinde nötrit outgrowth görselleştirmek için dikiş yazılımı kullanın.
- RNA, protein ve ortam toplama
- Transwell filtreleri işleme sırasında, RNAse/DNaAse içermeyen tüplerde ortam toplayın ve daha sonraki tahliller için dondurulun (ELISA, proteomik, vb.).
- Hemen sonra medya toplama, aliquot lysis tampon veya Radyo İmmüno Yağış Asa (RIPA) proteinler ve fosfataz inhibitörleri ile arabellek kuyulara. Bu protokol 24 kuyulu bir plakada 100 μL/kuyu için optimize edildi.
- Arabelleklerin hücreleri 5 dakika boyunca lyse izin verin, sonra yeni bir pipet ucu ile her filtre kazıyın ve RNAse / DNAE-free tüplerde hücre örnekleri toplamak. Gelecekteki tahliller için lysis dondurun (yarı-nicel ve / veya nicel PCR, Batı leke, vb).
- Diş hamuru hücrelerinin isteğe bağlı immünofloresans:
- Cover'ları Bölüm 1.1'den forsepslerle hafifçe kaldırın ve sallanan 1 saat için %4 PFA ile farklı kuyulara aktarın.
- PfA'yı aspire edin ve kapakları 1x PBS ile iki kez durula. Standart immünofloresan teknikleri ile ilgi belirteçleri için permeabilizasyon, engelleme ve immünofloresan ile bunu takip edin.
Sonuçlar
Bu sonuçlar, TG neurite monokültür kontrolüne göre altta yatan primer DP hücrelerinin varlığında TG neurite outgrowth'un arttığını göstermektedir(Şekil 2A,C). Neurite büyüme bazı tas-to-asa değişkenliği vardır. Böylece, bir TG nöron monokültür nörat büyüme bazal düzeylerini tespit etmek için bir kontrol olarak tüm tahliller dahil edilmelidir. Ad-Cre-GFP enfeksiyonu ve Ad-eGFP enfeksiyonu eşdeğer sayıda hücre olarak doğrulandıktan sonra bu protokolde Tgfbr2f/f faresinden birincil hücreler kullanılmıştır(Şekil 2D). Ad-eGFP bir kontrol viral vektör olarak görev yaptı. Ad-Cre-GFP, yarı kantitatif PCR(Şekil 2E)ile gösterildiği gibi yanlı gen Tgfbr2'yi sildi. Transforming büyüme faktörü beta reseptörü 2 (Tgfbr2) deletion olan kültürlerde, neurite outgrowth azaltıldı(Şekil 2A-C).
Thy1-YFP fare TG nöronlarını kullandık ve şekil 2'degösterildiği gibi, bu arka planın çok üzerinde aksonal yapıların çok spesifik ve parlak görüntülerini üreten bir anti-GFP antikorile boyandı. Bu kristal menekşe7gibi daha önce bildirilen yöntemler kullanarak non-nöronal hücrelerin non-spesifik boyama olmadan nöronal belirteçlerin özel boyama izin verdi. Filtrelerdeki büyük gözenekler otofloresan ve/veya ikincil antikorlar birikebilir ve aksonal görüntüleme hassasiyetini azaltabilir(Şekil 3). İmmünofloresans ile Thy1-YFP nöronlar büyük ölçüde görüntüleme geliştirir iken, daha fazla arka plan otomatik eşik yazılımı ile kaldırılabilir ve daha sonra sayısal. Ayrıca, ilk bulgularımıza (gösterilmez) ve thy1-YFP fareler mevcut değilse diğer8,9'a dayanarak Neurofilament 200 için immünororesans gerçekleştirmenizi öneririz.

Şekil 1: Eş kültür için hücre elde etmek için fare diseksiyonu şeması. (A) Fare kafatasını açmak ve son tasvirde siyah olarak gösterilen TG sinirlerini bulmak için kesilecek yerin diyagramı. Makas noktalı çizgiler boyunca kesmek için makas uçları eklemek için nerede gösterir. (B) Thy1-YFP+ TG sinirlerini beyaz daire içine alan birleşik bir darkfield ve GFP görüntüsü. (C) Diseksiyonlu TG gangliyonu, F'degösterildiği gibi dağılabilir ve kültürlenebilir. (D) P7 farenin çene kemiği, sol tarafta mandibula tutan pofiller ve dilin her iki tarafında patlamamış dişler içeren alveoler kemik sırtları. (E) DP doku (daire içinde) mineralize yapı (üst) çıkarılan ve emaye dış epitel (alt) bir doku kültürü tedavi plaka içinde dağıtmak ve plaka kaldırıldı, Fgösterildiği gibi . Görüntüler ölçeklendirilecek şekilde gösterilmez. DP hücreleri dağıtıldı ve TG nöronlar eklemeden önce biraraya büyüdü. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Ortak kültürden temsil sonuçları. (A-C) Thy1-YFP TG nöronlar transwell filtrelerinde primer Tgfbr2f/f DP hücrelerinin üzerine 3 m gözenek ile kültürlendi. YFP proteini için nöronal yapıların tüm filtre üzerinde son derece spesifik boyanmasını sağlamak için anti-GFP antikor kullanılarak immünofloresan boyama yapıldı. 10x'te 100 m z-stack konfokal mikroskopi görüntülerinin maksimum projeksiyonları toplanmış ve dikiş yazılımı ile dikilmiştir. TG nöronlar dp hücreleri ile birlikte kültür(A)zaman tek başına kültürlü daha önemli ölçüde daha fazla büyüme gösterdi(C). Nöronların Ad-Cre-GFP ile enfekte DP hücreleri ile birlikte Tgfbr2 (B)yıkmak için enfekte olduğunda Neurite outgrowth indüklenen değildi . Ölçek çubuğu = 1.000 μm. Ad-eGFP ve Ad-Cre-GFP ile enfekte hücrelerin eşdeğer sayıları (D)gösterilir. Ölçek çubuğu = 125 μm. Yarı kantitatif PCR Tgfbr2 KD doğruladı (E). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Afferent görüntülemede sunulan teknik güçlükler. (A) Hücre popülasyonlarının kristal mor boyama sonra transwell filtrelerin Brightfield görüntüleme. Büyük gözenekler yaygındır. Büyük ok mezenkimal morfolojisi sergileyen bir hücreye işaret ederken, küçük ok nöronal morfolojinin bir hücresini işaret ediyor. Kristal menekşe önyargısız her iki hücrelekeli. (B) Β3 tubulin in inİmfüorescent boyama bir Alexa-488 ikincil antikor ile birden fazla hücrede non-spesifik boyama gösterdi, afferent yapıların görüntüleme zor hale. Görüntüler temsilidir ve Şekil 2'degösterilen görüntülemeyi optimize etmek için birden fazla tahlil üzerinde tekrarlanır. Ölçek çubuğu = 50 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Bileşen | Birim | Konsantrasyon | |
| MEM α | 440 mL | ||
| Isı inaktive fetal sığır serum | 50 mL | 10% | |
| 100x L-glutamin | 5 mL | 1 x | |
| Penisilin-streptomisin 100 x | 5 mL | 1 x | |
| Bu son konsantrasyonlarda mitotik inhibitörleri ile 2. | |||
| Uridin | 1 μM | ||
| 5'-Flor-2'deoksitürin | 15 μM | ||
Tablo 1: Ortak kültür medyası.
Tartışmalar
Ağız boşluğugünlük faaliyetleri dişlerin uygun kullanım ve bakım izin vermek için dış uyaranları ve iç iltihabı algılamak gerektirir. Ancak, diş innervasyonunun gelişim süreçlerini yönlendiren sinyallerle ilgili sadece sınırlı bilgi mevcuttur. Bu protokol, iki popülasyon arasındaki çapraz iletişimi incelemek için birincil DP hücrelerini ve TG nöronlarını izole etmek ve birlikte kültüre getirmek için bir yöntem sağlar. Çeşitli değişkenler optimize edildi ve aşağıda açıklandığı gibi, araştırma nın diğer yollarını açık bıraktı.
Bu tazyikin her adımında kontroller önemlidir. Altta yatan DP hücreleri olmayan TG nöronlu bir transwell filtresi, TG büyümesi için bir temel sağlamak için her tsaydahil edilmelidir. Bir Ad-Cre-GFP rekombinase ile ilgi kuşatılmış bir gen silerken, sadece floresan belirteci ifade eden bir kontrol virüsü hücrelerin eşdeğer sayıda enfekte olduğunu doğrulamak için kullanılmalıdır. Biz ad-eGFP ve Ad-Cre-GFP için 100 ve 200 MOI minimal hücre ölümü ile enfeksiyon yüksek düzeyde gösterdi, sırasıyla, her laboratuvar bu adımı optimize etmelidir. Floresan proteinler farklı promotörlere bağlanabildiği ve bu nedenle diferansiyel ifade eşdeğer sayıda enfekte neden olabileceğinden, floresan hücreler sayılmalıdır. Floresan genel yoğunluğu doğru enfeksiyon durumunu yansıtmaz çünkü alakasız. Bu protokolde yarı kantitatif PCR ile gösterildiği gibi genin silinmesini göstermek önemlidir (Şekil 2). Bu protokol bu konuyu ele almasa da, önceki araştırmalar, diğer hücre hatlarıile kontrol tahlillerinin, neurite outgrowth'un dp hücreleri8ile birlikte kültür tarafından özel olarak indüklendiğini göstermek için ekleyebileceğini göstermiştir.
Bu protokol birincil hücreleri kullandığından, kontaminasyonun ortaya konulabileceği birden çok aşama vardır. Bunu önlemek için, tüm reaktifler steril filtreedilmelidir. Ayrıca, her değişken için deneylerin, bir filtrenin çıkarılmasına ve kontamine olmuş bir kuyunun sterilizasyonuna tam bir töz hatası olmadan izin vermek için yinelenen veya üç katı olarak çalıştırılması önerilir.
Dp hücre yapışmasını sağlamak için kapaklar poli-D-lizin ve/veya hücre dışı bir matriks proteini ile kaplanmalıdır. Hücreler başlangıçta eklemek olsa da, viral enfeksiyon kaplanmamış kapakları üzerinde hücre kaldırma ölüme neden olur ve co-kültür teşalimi genetik manipülasyon önler.
Bu iyi non-nöronal hücreler, TG gangliyondan Schwann hücreleri gibi, kültür de nöronal hücrelerin hayatta kalmasını etkileyebilir kurulmuştur14,15,16. Bu protokolde 1 μM uridin ve 15 μM 5-floro-2'deoksitürdine eklenerek nöronal sağkalım optimize edildi. Schwann hücre proliferasyonlarını inhibe etmek için bu antimitotik ajanların eklenmesi olmadan, neurite outgrowth oluşmaz. Bu senescent Schwann hücrelerinin ortak kültürdeki varlığının nöronal yanıtı değiştirip değiştirmediği bilinmemektedir. Minör nöronların izole birkaç ek adım gerektirir ve protokoller bu değişkeni kaldırmak isteyen araştırmacılar için kullanılabilir17. Her iki durumda da, nöron dağılımı biraz bir aksotomi taklit ve yaralanma / onarım temsil düşünülebilir18 gelişme daha fazla. Daha ileri çalışmalar in vitro bireysel nöronlar aksonal büyüme fasiküller gelen in vivo aksonal büyüme arasındaki farkları belirlemek için gerekli olacaktır, ve bu protokolde ele alınmaz.
Bu protokol baştan sona 1-3 hafta sürer. %85-90'ın biraraya gelmesi için 1 haftadan fazla süren DP hücrelerinin kullanılması mümkün olmakla birlikte, bu hücrelerin bu noktayı çok yavaş bir şekilde böldüğü için hücrelerin birkaç gün içinde biraraya gelmek için yeterince yüksek yoğunlukta tohumlanmış olması önerilir. Bu genellikle 24-iyi plaka satır başına yaklaşık 5-7 P5-8 fareler gerektirir. Bu protokol toplam 5 günlük ortak kültür için optimize edildi ve bu noktada fenol kırmızısı ortam renk değiştirmeye başladı. Daha uzun tahliller isteniyorsa ortam değiştirilmelidir.
Çeşitli co-kültür tahlilleri standart ECM kaplı doku kültürüplakaları3 ile DP salgılanan faktörlere yanıt olarak nötriit büyüme göstermek için yapılmıştır3 ,19,20,21 veya mikroakışkan odaları8,22,23. Bu protokol, bu yöntemlere göre çeşitli avantajlar sunar. Örneğin, TG ganglia ve DP doku ko-kültürü nöritler için özel bir mekansal ilişki gerektirir ve kısa menzilli parakrin sinyalleri yanıt. Organ kültürü ile, sadece DP dokusuna en yakın ganglia nöritler yanıt edebiliyoruz3, Bu protokolde kullanılan dağınık TG nöronlar altında DP hücrelerinden eşit mesafede kültürlü ise. İkinci olarak, organ kültürleri büyük örneklerde bulunan oksijen ve besin eksikliği nedeniyle doku nekrozu tanıtabilir24. Dağılmış hücrelerin ortak kültürü bu olasılığı ortadan kaldırır. Nöronlar da dahil olmak üzere bazı co-kültürler nöronal medya gerektirir3,22 hangi neurite büyüme teşvik baskın bir rol oynayabilir. Bu protokol nörona özgü büyüme faktörleri eklemez, böylece altta yatan DP hücrelerinden gelen parakrin sinyalleri ile neurite büyüme yanıtları arasındaki doğrudan ilişkinin değerlendirilmesini sağlar. Bu co-kültür medya da beta-glikofofosfat gibi mineralizasyonu teşvik etmek için bileşenleri yoksun olduğunu belirtmekte yarar vardır. Bu, araştırmacıların mineralizasyonu teşvik etmek için nöritlerin sinyalleri nasıl salgılayabildiğini belirlemelerine olanak tanır. Ancak, aynı zamanda genellikle in vivo mevcut olacağını mineralize odontoblastlar olmadan sadece daha az farklılaşmış DP hücreleri dahil ederek çalışma sınırlar.
Önceki araştırmadan gelen kolorimetrik yanıtlar7,8 Schwann hücre katkıları nı açıklamaz ve nöronal morfolojiyi göstermez, çünkü kristal morjen tüm hücreleri özel olarak lekeler. Filtrelerin immünororesan boyama afferent görüntüleme zor hale yüksek arka plan düzeyleri neden olabilir(Şekil 2). Mevcut protokol, Thy1-YFP TG nöronlar ve anti-GFP antikor kullanarak nöronal afferentlerin hassas boyanmasını sağlar ve tüm figür boyunca büyük büyüme görüntüleri oluşturacak kadar parlak bir sinyal sağlar(Şekil 3). Thy1-YFP fareler mevcut değilse, Anti-Nörofilament 200 gibi diğer nöronal belirteçleri kullanmak mümkündür.
Son olarak, loxP siteleri ile çevrili ilgi genleri ile farelerin birincil DP hücreleri kullanarak bir Ad-Cre-GFP sistemi ile bu genlerin basit ve verimli silinmesini sağlar. Gelecekteki çalışmalarda, Ad-Cre rekombinaz sistemi loxP siteleri tarafından kuşatılmış bir ilgi geni varsa TG nöronlar üzerinde kullanılabilir. Bu, nöronal popülasyondan gelen parakrin sinyallerin DP hücrelerini nasıl etkilediği ne kadar açık çalışmalara yardımcı olacaktır, özellikle dp hücreleri kapakların üzerine tohumlanırsa (Bölüm 1.1). Gelecekteki çalışmalar, farmakolojik inhibitörlerin eklenmesi ve/veya büyüme faktörleri gibi diğer manipülasyonları da kullanabilir. Ayrıca bu protokolü 8 μm gözenekli transwell filtreleri kullanarak göç çalışmalarını içerecek şekilde değiştirmek de mümkündür.
Sonuç olarak, nöronlar ve DP hücreleri kullanan bu transwell co-kültür analizi birden fazla hücresel parametrelerin araştırılmasıiçin izin verir. Bu mümkün teşvik ve diş innervasyonunu destekleyen mezenkimal nöronal etkileşimler hakkında bilgi nin vücut genişletmek için yapar.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bu çalışma a) Ulusal Sağlık Enstitüleri/NIAMS (rs'ye R01 AR062507 ve R01 AR053860, b) Alabama Üniversitesi Birmingham Diş Akademik Araştırma Eğitimi (DART) hibe (sayı T90DE022736 (PI MacDougall)) tarafından Desteklenmiştir. c) Bir UAB Küresel Merkezi Kraniyofasiyal, Ağız ve Diş Bozuklukları (GC-KODLU) Pilot ve Fizibilite hibe SBP ve d) Ulusal Diş ve Kraniyofasiyal Enstitüsü Araştırma / Ulusal Sağlık Enstitüleri K99 DE024406 SBP hibe.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 5-Fluoro-2'-deoxyuridine | Sigma-Aldrich | F0503 | Used as a mitotic Inhibitor at 15 μM concentration in co-culture media, Day 2 |
| 24 Well Cell Culture Plate | Corning | 3524 | Co-culture plate |
| Alexa-546 anti-chicken | Invitrogen | A-11040 | Secondary to stain neurite outgrowth labeled by anti-GFP antibody, 1:500 dilution |
| Anti-GFP Antibody | Aves Lab, Inc | GFP-1010 | Primary antibody to label Thy1-YFP neurons, 1:200 dilution |
| Anti-Neurofilament 200 antibody | Sigma-Aldrich | NO142 | Monoclonal primary antibody to label neurons, 1:1000 dilution, alternative if YFP mice are not available |
| B6;129- Tgfbr2tm1Karl/J | The Jackson Laboratory | 12603 | Tgfbr2f/f mouse model used for dental pulp cells in optimized protocol |
| B6.Cg-Tg(Thy1-YFP)16Jrs/J | The Jackson Laboratory | 3709 | Thy1-YFP mouse model genotype used for trigeminal neurons |
| Collagenase Type II | Millipore | 234155-100MG | Used to disperse trigeminal neurons |
| Fetal Bovine Serum | Gibco | 10437 | Additive to co-culture media |
| Fine forceps | Fine Science Tools | 11413-11 | Fine forceps for TG dissection |
| Laminin | Sigma-Aldrich | L2020 | Coats the transwell inserts at final concentration of 10 μg/ml, stock solution is assumed at 1.5 mg/ml |
| Lysis Buffer (Buffer RLT) | Qiagen | 79216 | Extracts RNA from dental pulp cells post co-culture |
| L-Glutamine | Gibco | 25030081 | Additive to co-culture media |
| Micro-dissecting scissors | Sigma-Aldrich | S3146-1EA | Dissection scissors to open skull |
| Microscope Cover Glass | Fisherbrand | 12-545-81 | Circlular coverslip for optional cell culturing and immunofluorescence processing |
| Minimal Essential Medium a | Gibco | 12571063 | Co-culture media base |
| Penicillin-Streptomycin | Gibco | 15070063 | Antibiotic additive to co-culture media |
| Phosphatase Inhibitor | Sigma-Aldrich | 04 906 837 001 | Additive to RIPA Buffer for extracting protein from dental pulp cells post co-culture |
| Polybrene | Millipore | TR-1003-G | Used to aid in dental pulp cell transfection |
| Poly-D-Lysine | Sigma-Aldrich | P7280 | Coverslip coating to aid dental pulp cellular adhesion |
| Protease Inhibitors | Millipore | 05 892 791 001 | Additive to RIPA Buffer for extracting protein from dental pulp cells post co-culture |
| RNAse/DNAse free eppendorf tubes | Denville | C-2172 | Presterilized 1.7 ml tubes for RNA, DNA or protein collection at the end of assay |
| ThinCert Cell Culture Insert | Greiner Bio-One | 662631 | Transwell inserts for trigeminal neurons in co-culture assays |
| Trypsin-EDTA (0.25%) | Gibco | 25200056 | Used fto disperse dental pulp cells |
| Trypsin Type II | Sigma-Aldrich | T-7409 | Used to disperse trigeminal neurons |
| Ultra Fine Forceps | Fine Science Tools | 11370-40 | Ultra fine forceps for dissection |
| Uridine | Sigma-Aldrich | U3750 | Used as a mitotic Inhibitor at 1 μM concentration in co-culture media, Day 2 |
| Vacuum Filtration System | Millipore | SCNY00060 | Steriflip disposable filter, 50 μm nylon net filter |
| Vial forceps | Fine Science Tools | 110006-15 | Long forceps for tissue transfer to conicals |
Referanslar
- Moe, K., Sijaona, A., Shrestha, A., Kettunen, P., Taniguchi, M., Luukko, K. Semaphorin 3A controls timing and patterning of the dental pulp innervation. Differentiation. 84 (5), 371-379 (2012).
- Kollar, E. J., Lumsden, A. G. Tooth morphogenesis: the role of the innervation during induction and pattern formation. Journal de biologie buccale. 7 (1), 49-60 (1979).
- Lillesaar, C., Fried, K. Neurites from trigeminal ganglion explants grown in vitro are repelled or attracted by tooth-related tissues depending on developmental stage. Neuroscience. 125 (1), 149-161 (2004).
- Fried, K., Lillesaar, C., Sime, W., Kaukua, N., Patarroyo, M. Target finding of pain nerve fibers: Neural growth mechanisms in the tooth pulp. Physiology & Behavior. 92 (1-2), 40-45 (2007).
- Pagella, P., Jiménez-Rojo, L., Mitsiadis, T. A. Roles of innervation in developing and regenerating orofacial tissues. Cellular and Molecular Life Sciences. 71 (12), 2241-2251 (2014).
- Luukko, K., Kettunen, P. Integration of tooth morphogenesis and innervation by local tissue interactions, signaling networks, and semaphorin 3A. Cell Adhesion & Migration. , 1-9 (2016).
- Smit, M., Leng, J., Klemke, R. L. Assay for neurite outgrowth quantification. BioTechniques. 35 (2), 254-256 (2003).
- de Almeida, J. F. A., Chen, P., Henry, M. A., Diogenes, A. Stem cells of the apical papilla regulate trigeminal neurite outgrowth and targeting through a BDNF-dependent mechanism. Tissue engineering. Part A. 20 (23-24), 3089-3100 (2014).
- Pagella, P., Miran, S., Mitsiadis, T. Analysis of Developing Tooth Germ Innervation Using Microfluidic Co-culture Devices. Journal of Visualized Experiments. (102), e53114(2015).
- Coelen, R. J., Jose, D. G., May, J. T. The effect of hexadimethrine bromide (polybrene) on the infection of the primate retroviruses SSV 1/SSAV 1 and BaEV. Archives of Virology. 75 (4), 307-311 (1983).
- Caroni, P. Overexpression of growth-associated proteins in the neurons of adult transgenic mice. Journal of neuroscience methods. 71 (1), 3-9 (1997).
- Alić, I., et al. Neural stem cells from mouse strain Thy1 YFP-16 are a valuable tool to monitor and evaluate neuronal differentiation and morphology. Neuroscience Letters. 634, 32-41 (2016).
- Howroyd, P. C. Dissection of the Trigeminal Ganglion of Nonrodent Species Used in Toxicology Studies. Toxicologic Pathology. , (2019).
- Schwieger, J., Esser, K. H., Lenarz, T., Scheper, V. Establishment of a long-term spiral ganglion neuron culture with reduced glial cell number: Effects of AraC on cell composition and neurons. Journal of Neuroscience Methods. 268, 106-116 (2016).
- Liu, R., Lin, G., Xu, H. An Efficient Method for Dorsal Root Ganglia Neurons Purification with a One-Time Anti-Mitotic Reagent Treatment. PLoS ONE. 8 (4), 60558(2013).
- Burry, R. W. Antimitotic drugs that enhance neuronal survival in olfactory bulb cell cultures. Brain Research. 261 (2), 261-275 (1983).
- Katzenell, S., Cabrera, J. R., North, B. J., Leib, D. A. Isolation, Purification, and Culture of Primary Murine Sensory Neurons. Methods in molecular biology. 1656, Clifton, N.J. 229-251 (2017).
- Dussor, G. O., Price, T. J., Flores, C. M. Activating transcription factor 3 mRNA is upregulated in primary cultures of trigeminal ganglion neurons. Molecular Brain Research. 118 (1-2), 156-159 (2003).
- Lillesaar, C., Arenas, E., Hildebrand, C., Fried, K. Responses of rat trigeminal neurones to dental pulp cells or fibroblasts overexpressing neurotrophic factors in vitro. Neuroscience. 119 (2), 443-451 (2003).
- Lillesaar, C., Eriksson, C., Fried, K. Rat tooth pulp cells elicit neurite growth from trigeminal neurones and express mRNAs for neurotrophic factors in vitro. Neuroscience Letters. 308 (3), (2001).
- Lillesaar, C., Eriksson, C., Johansson, C. S., Fried, K., Hildebrand, C. Tooth pulp tissue promotes neurite outgrowth from rat trigeminal ganglia in vitro. Journal of neurocytology. 28 (8), 663-670 (1999).
- Chmilewsky, F., Ayaz, W., Appiah, J., About, I., Chung, S. H. Nerve Growth Factor Secretion From Pulp Fibroblasts is Modulated by Complement C5a Receptor and Implied in Neurite Outgrowth. Scientific reports. 6, 31799(2016).
- Pagella, P., Neto, E., Jiménez-Rojo, L., Lamghari, M., Mitsiadis, T. A. Microfluidics co-culture systems for studying tooth innervation. Frontiers in Physiology. 5, 326(2014).
- Miura, T., Yokokawa, R. Tissue culture on a chip: Developmental biology applications of self-organized capillary networks in microfluidic devices. Development, Growth & Differentiation. 58 (6), 505-515 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır