Method Article
Eine Co-Kultur-Methode zur Untersuchung des Neuriten-Auswuchss als Reaktion auf Dental Pulp Paracrine Signale
In diesem Artikel
Zusammenfassung
Wir beschreiben die Isolierung, Dispersion und Beschichtung von Zellstoff (DP) Primärzellen mit trigeminalen (TG) Neuronen, die auf darüber liegenden Transwellfiltern kultiviert sind. Zelluläre Reaktionen von DP-Zellen können mit Immunfluoreszenz oder RNA/Protein-Analyse analysiert werden. Die Immunfluoreszenz neuronaler Marker mit konfokaler Mikroskopie ermöglicht die Analyse von Neuriten-Auswuchsreaktionen.
Zusammenfassung
Zahninnervation ermöglicht es Den Zähnen, Druck, Temperatur und Entzündungen zu spüren, die alle für die Verwendung und Wartung des Zahnorgans entscheidend sind. Ohne sensorische Innervation würden tägliche orale Aktivitäten irreparable Schäden verursachen. Trotz ihrer Bedeutung wurden die Rollen der Innervation in der Zahnentwicklung und -pflege weitgehend übersehen. Mehrere Studien haben gezeigt, dass DP-Zellen extrazelluläre Matrixproteine und Parakrinsignale absondern, um TG-Axone in und durch den Zahn zu ziehen und zu führen. Allerdings haben nur wenige Studien detaillierte Einblicke in den Crosstalk zwischen dem DP-Mesenchym und neuronalen Afferents geliefert. Um diese Wissenslücke zu schließen, haben Forscher begonnen, Kokulturen und eine Vielzahl von Techniken zu nutzen, um diese Wechselwirkungen zu untersuchen. Hier zeigen wir die verschiedenen Schritte bei der Ko-Kultivierung primärer DP-Zellen mit TG-Neuronen, die auf einem darüber liegenden Transwell-Filter mit poren großen Durchmessern verteilt sind, um das axonale Wachstum durch die Poren zu ermöglichen. Primäre DP-Zellen mit dem von loxP-Sites flankierten Gen von Interesse wurden genutzt, um die Genlöschung mit einem Adenovirus-Cre-GFP-Rekombinatossystem zu erleichtern. Die Verwendung von TG-Neuronen aus der Thy1-YFP-Maus ermöglichte eine präzise affekte Bildgebung mit einer Expression, die durch konfokale Mikroskopie deutlich über dem Hintergrundniveau liegt. Die DP-Antworten können durch Protein- oder RNA-Sammlung und -Analyse oder alternativ durch immunfluoreszierende Färbung von DP-Zellen untersucht werden, die auf abnehmbaren Glasabdeckungen plattiert sind. Medien können mit Techniken wie proteomischen Analysen analysiert werden, obwohl dies eine Erschöpfung des Albums aufgrund des Vorhandenseins von fetalem Rinderserum in den Medien erfordert. Dieses Protokoll bietet eine einfache Methode, die manipuliert werden kann, um die morphologischen, genetischen und zytoskelettalen Reaktionen von TG-Neuronen und DP-Zellen als Reaktion auf die kontrollierte Umgebung eines Co-Kultur-Assays zu untersuchen.
Einleitung
Zahninnervation ermöglicht es Den Zähnen, Druck, Temperatur und Entzündungen zu spüren, die alle für die Verwendung und Wartung des Zahnorgans entscheidend sind. Wenn Zahnschmerzen im Zusammenhang mit Zahnkaries und Trauma nicht wahrkommen, führt dies zum Fortschreiten der Erkrankung. Daher ist eine richtige Innervation eine Voraussetzung für normales Zahnwachstum, Funktion und Pflege.
Während die meisten Organe zum Zeitpunkt der Geburt voll funktionsfähig und innerviert sind, erstreckt sich die Zahnentwicklung bis ins Erwachsenenleben, wobei Zahninnervation und Mineralisierung in den postnatalen Stadien1,2konzertant auftreten. Interessanterweise sezerniert das Zahnpulp (DP) Mesenchym zunächst abstoßende Signale während der Embryogenese, um das Eindringen von Axon in das sich entwickelnde Zahnorgan zu verhindern, das sich später auf die Sekretion von Anziehungskraftfaktoren verlagert, wenn sich der Zahn dem Ausbruchnähert 3,4. Während der postnatalen Stadien dringen afferent Axone aus dem trigeminalen (TG) Nerv in und durch den Zahn um die Zeit, in der die Dentinablagerung beginnt (rezensiert in Pagella, P. et al.5). Mehrere In-vivo-Studien haben gezeigt, dass neuronal-mesenchymale Wechselwirkungen die Zahninnervation bei Mäusen leiten (in Luukko, K. et al.6), aber nur wenige Details der molekularen Mechanismen sind verfügbar.
Zellkokulturen bieten kontrollierte Umgebungen, in denen Forscher Wechselwirkungen zwischen neuronalen und mesenchymalen Populationen manipulieren können. Co-Kultur-Experimente ermöglichen es, tiefer in die Signalwege einzutauchen, die Zahninnervation und Entwicklung leiten. Einige der konventionellen Methoden zur Untersuchung von Zellen in der Kokultur stellen jedoch technische Herausforderungen dar. Zum Beispiel kann die kristallviolette Färbung von Neuritenauswüchsen Schwann-Zellen, die in TG-Bündeldispersionen enthalten sind, nicht spezifisch färben, und es kann Spitzen in der Farbintensität mit relativ kleinen Antwortengeben 7. Mikrofluidische Kammern bieten eine attraktive Option, sind aber deutlich teurer als Transwell-Filter8,9 und erlauben nur die Untersuchung neuronaler Reaktionen auf DP-Sekrete. Um diese Probleme anzugehen, haben wir ein Protokoll entwickelt, das a) präzise Färbung und Bildgebung des TG-Neuritenwachstums als Reaktion auf DP-Sekrete, b) genetische Modifikation von DP-Zellen und/oder TG-Neuronen zur Untersuchung spezifischer Signalwege und c) Die Untersuchung von DP-Zellreaktionen auf Faktoren ermöglicht, die von TG-Neuronen sezerniert werden. Dieses Protokoll bietet die Möglichkeit, mehrere Merkmale der Zahninnervation in der kontrollierten Umgebung eines In-vitro-Co-Kultur-Assays genau zu untersuchen.
Protokoll
Alle Experimente mit Mäusen wurden vom UAB Institutional Animal Care and Use Committee (IACUC) genehmigt.
1. Plattenvorbereitung
HINWEIS: Coverslips können verwendet werden, um DP-Zellen am Ende des Assays abzubilden. Stellen Sie sicher, dass der Plattendeckel während aller Inkubations- und Spülschritte außerhalb der sterilen Gewebekulturhaube eingeschaltet ist, um eine Kontamination während der Probenverarbeitung zu verhindern.
-
Coverslip-Vorbereitung
- Autoklav-Rundabdeckungen.
- Filtern Sie reines Reinstwasser unter die Haube.
- Die Deckellipsen auf eine 24-Well-Platte übertragen und jeweils mit 400 l 0,1 mg/ml Poly-D-Lysin abdecken.
- Lassen Sie die Coverlips einweichen, für 5 min eintauchen, auf einem Rocker bei 12 Rpm oder Orbital-Shaker bei 40-50 Rpm. Stellen Sie sicher, dass der Deckel eingeschaltet ist, um eine Kontamination zu verhindern.
- Spülen Sie die Deckelmitlipse mit gefiltertem Reinstwasser ca. 5 min auf einer Wippe bei 12 Rpm oder Shaker bei 50 Rpm. Wiederholen.
- Lassen Sie die Abdeckungen mindestens 2 h unter der Haube trocknen, wobei der Plattendeckel ausgeschaltet ist, um die Verdunstung zu erleichtern. Diese Abdeckungen sollten innerhalb von 48 h verwendet werden.
- Seed DP-Zellen auf Abdeckungen und Prozess am Ende des Testes für Immunfluoreszenz (Abschnitt 3.3).
-
Beschichtungsfilter
- Laminin auf 10 g/ml verdünnen. Filtern Sie das verdünnte Laminin unter die Haube.
- Pipette 450-500 l von 10 g/ml Laminin in jeden Brunnen einer 24-Well-Platte.
- Transwell-Filter, 3 m Porosität, so in einen Brunnen geben, dass er die Lamininlösung kontaktiert und in einem 37 °C-Inkubator für 2 h oder über Nacht belassen. Filterporen sollten es ermöglichen, dass ein Teil der Lösung diffundiert und sowohl die Ober- als auch die Unterseite des Filters beschichtet wird. Diese Filter sollten innerhalb von 48 h verwendet oder bei 4 °C bis zu 1 Woche gekühlt werden.
2. Zellplating mit optionaler genetischer Manipulation
- Mäuse: Genetische Veränderungen von DP-Zellen können durchgeführt werden (ist aber nicht erforderlich), um mesenchymal-neuronale Wechselwirkungen zu untersuchen. Siehe Abschnitte 2.3 und 2.4 für vorgeschlagene genetische Variationen.
- DP-Sektion, Dispersion und Beschichtung (Abbildung 1)
HINWEIS: Verwenden Sie für die DP-Sektion ultrafeine, gerade Randzangen. Die ultrafeinen Kanten ermöglichen es dem Benutzer, die Kraftkante zwischen der mineralisierten Struktur und dem DP-Gewebe zu verkeilen.- Ernte P5-P8 Mäuse. In diesem Stadium sollten die Zähne mineralisierend sein, und die Wurzel ist offen.
- Anästhetisieren Sie die Neonate über Unterkühlung, indem Sie sie in eine Schüssel im 4 °C-Kühlschrank legen, bis sie sich nicht mehr bewegen oder auf Berührung reagieren. Euthanisieren von Neonaten durch Enthauptung und in Übereinstimmung mit den IACUC-Verfahren in der vorgesehenen Einrichtung.
- Bereiten Sie ein 3-5 ml Aliquot von 0,25% Trypsin-EDTA in einem 50 ml konischen Rohr vor, um den DP von jeder Maus zu sammeln. Dies wird die Verdauung von Zellstoff von postnatalen Mäusen erleichtern. Verwenden Sie mehr als 3 ml, wenn Gewebe von mehr als 10 postnatalen Mäusen verdaut wird.
- Legen Sie den Kopf auf ein Einweg-Unterpad, so dass der Mund zur Decke hin und die Basis des Halses ist flach auf der Arbeitsfläche. Verwenden Sie eine Rasierklinge in einer Sägebewegung, um den Unterkiefer von der Maxilla zu trennen.
- Entfernen Sie optional die Zunge entweder mit einer Schere oder mit Zangen, um den Zugang zu den Molaren zu erleichtern.
- Legen Sie den geöffneten Kopf in eine Schale auf einem sterilen Gazepad und legen Sie die Probe unter ein Sezieren mikroskop (Abbildung 1D).
- Entfernen Sie das alveolare Knochengewebe, das die ersten Molaren umgibt. Submandibuläre Zähne sind an dieser Stelle noch nicht vollständig ausgebrochen. Setzen Sie Zangen in die Alveolaröffnung ein und necken Sie das Gewebe vom Zahn weg in Richtung der bukkalen (Wange) oder lingualen (Zunge) Seite des Mundes. Maxillary Zähne erfordern vollständige Entfernung der Spalte um den Zahn für die Exposition und Entfernung.
- Übertragen Sie die submandibulären und oberkieferförmigen ersten Molaren (M1s) vorsichtig in eine separate Zellkulturschale mit 1x phosphatgepufferter Saline (PBS).
- Wiederholen Sie 2.2.4-2.2.8, bis alle M1s gesammelt sind. Halten Sie das Gericht mit den M1s während der Ernte auf Eis.
- Entfernen Sie das Enamel-Außenorgan (EOE), das die Außenseite jedes M1 umgibt. Dies kann alternativ nach Schritt 2.2.11 erfolgen.
- Drehen Sie mit einer Reihe von Zangen die M1, damit die Spitzen nach unten sind und die offene Wurzel freigelegt wird. Es wird eine ovale Öffnung auf der Unterseite des Zahnes geben, und undurchsichtiges DP-Gewebe, das durch eine dünne Schicht aus Dentin und Zahnschmelz verkapselt ist.
- Lösen Sie mit der Spitze der Zange vorsichtig den DP, indem Sie einen Arm der Zange um den inneren Umfang des mineralisierten Gewebes laufen lassen. Entfernen Sie DP-Gewebe aus der mineralisierten Struktur und übertragen Sie es in eine dritte Schale, die 1x PBS enthält. Entfernen Sie den EOE, wenn er nicht bereits getrennt war (Abbildung 1E).
- Übertragen Sie das gesamte DP-Gewebe auf 0,25% Trypsin-EDTA in einem 50 ml konischen Rohr. Wirbeln Sie die Mischung und legen Sie in einem 37 °C warmen Wasserbad für 10 min. Dies kann mit den gleichen Zangen oder mit langen, durchstechernden Zangen erfolgen. Das Gewebe wird schwer zu dispergieren sein und erfordert Wirbel alle 3-4 min. Überschreiten Sie NICHT 10 min Trypsinisierung, da das Trypsin Zellmembranen beschädigen kann.
- Unter einer sterilen Kapuze, fügen Sie erwärmte Co-Kultur-Medien (Tabelle 1) zu einem Endverhältnis von mindestens 1:1 Medien, um Trypsin zu versuchen, um das Enzym zu inaktivieren. Größere Verhältnisse sind akzeptabel, wenn mehr Gewebedispersion gewünscht wird.
- Pipette die Medien auf und ab mehrmals mit einer 10 ml Pipette, um die DP in den Medien weiter zu zerstreuen. Achten Sie darauf, große Blasen zu vermeiden. Eine vollständige Dispersion ist aufgrund der klebrigen Natur des Gewebes nahezu unmöglich. Es ist jedoch auch nicht notwendig, da Zellen nach der Plattierte aus dem Gewebe nach außen wandern.
- Übertragen Sie 1 ml des dispergierten DP auf jeden Brunnen einer 24-Well-Gewebekulturplatte (Abbildung 1F).
- Legen Sie die Platte bei 37 °C in einen Inkubator und lassen Sie die Zellen 48 h lang andas undisperse Gewebe anhaften und auswandern, bevor sie die Medien wechseln. Primärzellen müssen in relativ hohen Konzentrationen plattiert werden, um innerhalb einer Woche 85-90% Zusammenfluss zu erreichen. Wenn dies nach 1 Woche nicht erreicht wird, entsorgen Sie die Platte.
- Optionale genetische Manipulation von DP-Zellen
- Um zellsignalier Wege zu verändern, ernten Sie DP-Zellen von genetischen Knockout-Mäusen oder von Mäusen, bei denen ein Gen von Interesse von loxP-Standorten flankiert wird. Im letzteren Fall kann das Gen mit Adenovirus-Cre-GFP (Ad-Cre-GFP) Rekombinante gelöscht werden, um das flankierte Gen zu entfernen, wie unten beschrieben. Verwenden Sie Adenovirus-eGFP (Ad-eGFP) als Kontrollvirus, um sicherzustellen, dass die Virusinfektion keine zelluläre Reaktion verursacht.
HINWEIS: Ad-eGFP wird vom CMV-Promoter-Enhancer gesteuert, der sehr stark ist. Ad-Cre-GFP wird durch ein IRES reguliert, eine interne Regulierungsregion zwischen Cre und GFP, die nicht sehr stark ist. Dies führt zu einer helleren Fluoreszenz in Ad-eGFP-Zellen als Ad-Cre-GFP-Zellen. Bestätigen Sie die äquivalenten Infektionsniveaus basierend auf der Gesamtzahl der Zellen, die fluoreszieren, nicht auf den Niveaus der zellulären Fluoreszenz. - Bereiten Sie 500 l Viren enthaltende Medien und 10 g/ml Polybren pro Brunnen vor. Polybren hilft bei einer Virusinfektion in Zellen nahe dem Zusammenfluss10. Dieses Protokoll basiert auf einer Vielzahl von Infektionen (MOI) von 100 für Ad-eGFP und 200 Ad-Cre-GFP für eine effiziente Geninfektion mit wenig oder gar keiner Wirkung auf die Zelllebensfähigkeit. Die geschätzte Zellzahl beträgt 4 x 104 Zellen/Gut einer 24-Well-Platte:
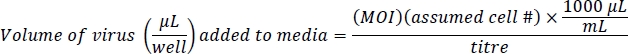
- Mischen Sie Medien mit kurzen Wirbeln oder Pipettieren und fügen Sie 500 l zu jedem Brunnen hinzu.
- Fügen Sie nach 24 h weitere 500 L Co-Kultur-Medien hinzu, die kein zusätzliches Polybren oder Virus enthalten.
- Nach insgesamt 48 h, aspirieren Virus-haltige Medien und ersetzen sie durch frische Co-Kultur-Medien. An diesem Punkt können TG-Neuronen auf Transwell-Filtern hinzugefügt werden.
- Um zellsignalier Wege zu verändern, ernten Sie DP-Zellen von genetischen Knockout-Mäusen oder von Mäusen, bei denen ein Gen von Interesse von loxP-Standorten flankiert wird. Im letzteren Fall kann das Gen mit Adenovirus-Cre-GFP (Ad-Cre-GFP) Rekombinante gelöscht werden, um das flankierte Gen zu entfernen, wie unten beschrieben. Verwenden Sie Adenovirus-eGFP (Ad-eGFP) als Kontrollvirus, um sicherzustellen, dass die Virusinfektion keine zelluläre Reaktion verursacht.
- Trigeminale Neuronensektion, Dispersion und Beschichtung
HINWEIS: In diesem Protokoll wurde die Bildgebung des Neuritenauswüchsins in der Kokultur mit DP-Zellen mit Jugendlichen (6 Wochen alt) B6.Cg-Tg( optimiert.Thy1-YFP)16Jrs/J Mäuse. Das zentrale und periphere Nervensystem von Thy1-YFP-Mäusen hat ein gelbes fluoreszierendes Protein (YFP)-Tag, dessen Expression bei Neuronen um P6-P10 beginnt und während des postnatalen und Erwachsenenlebens exponentiell im gesamten Nervensystem zunimmt.11,12. YFP und GFP haben Sequenzen konserviert, die es ermöglichen, diese Nerven mit Anti-GFP-Antikörpern zu beflecken, was zu einem panneuronalen Fleck führt. Letztlich ermöglichen diese Mäuse eine bessere Visualisierung und Quantifizierung der verwendeten und in der Zellkultur angebauten Neuronen.- Euthanisieren Sie jugendliche Mäuse mit Kohlendioxid, gefolgt von zervikalen Dislokationen.
- Enthaupten Sie die Mäuse und entfernen Sie die Haut aus dem Schädel. Achten Sie darauf, gleichwertige Anzahl von Männern und Frauen enthalten.
- Stecken Sie die Spitze einer Mikrosezierender Schere in die Schädelbasis. Schneiden Sie entlang der sagittalen Naht des Schädels (Abbildung 1A).
- Machen Sie vier kleine horizontale Schnitte: zwei entlang der koronalen Nähte an den Ohren und zwei entlang der Lambdoid-Nähte an der Basis des Schädels. Dadurch sollten zwei Knochenklappen entstehen.
- Verwenden Sie die Zange, um die beiden Knochenklappen zu schälen. Dies sollte das Gehirn offenbaren.
- Entfernen Sie das Gehirn. Übertragen Sie den Kopf auf eine Gewebekulturschale mit 1x PBS und unter das Mikroskop.
- Finden Sie die TG-Ganglien, die bei Nagetieren13gut sichtbar sind, die in der Dura-Materie zwischen Gehirn und Knochen des Kieferprozesses untergebracht sind (Abbildung 1B).
- Schneiden Sie die drei Zweige, die zu den Augen, Maxillae und Unterkiefer reisen und übertragen Sie die Ganglien auf kalte 1x PBS mit geraden feinen Zangen. Halten Sie das Gericht mit den TG-Ganglien während der Ernte auf Eis.
- Nachdem alle TG-Bündel geerntet sind, übertragen Sie Ganglien in ein 50 ml konisches Rohr mit 5 mg/ml sterilgefilterter Kollagennase Typ II mit Durchstechflasche.
- Die Kollagenase mit dem TG-Bündel vortexen und das Rohr 25-30 min in ein 37 °C Wasserbad geben. Während dieser Zeit, nehmen Sie die konische Röhre aus dem Wasserbad, Wirbel, und kehren Sie in das Bad alle 5-10 min.
- Zentrifugieren Sie die Kollagenase-TG-Neuronlösung für 2 min bei 643 x g.
- Unter einer Gewebekulturhaube die Kollagenase vorsichtig mit einer Mikropipette ansaugen.
- Fügen Sie 5 ml von 1% steril-gefiltertem Trypsin Typ II und Wirbel hinzu. Legen Sie das konische Rohr in ein 37 °C Wasserbad für 5 min.
- Zentrifugieren Sie die Trypsin-TG-Mischung für 5 min bei 643 x g. Entfernen Sie den oberen Teil von Trypsin mit einer Mikropipette, damit die TG-Neuronen nicht entfernt werden. Es wird immer noch Flüssigkeit in der Röhre sein.
- Fügen Sie genügend Medien hinzu, um das verbleibende Trypsin zu deaktivieren (bei einem Verhältnis von Trypsin zu Medium von 1:1 oder niedriger).
- Zählen Sie die Anzahl der Zellen und verdünnen Sie die Lösung auf 200.000 Zellen/ml (250 l zellhaltige 50.000 Zellen).
- Beschichtete Transwell-Filter aus Abschnitt 1.2 in Brunnen mit DP legen.
- Verdünnen Sie die zellhaltige Lösung so, dass es 200.000 Zellen/ml gibt. Pipette 250 l auf den Transwell-Filter auf, und Kultur der Zellen bei 37 °C über Nacht(Abbildung 1F).
- Ersetzen Sie am nächsten Tag die Medien durch 1 ml Co-Kultur-Medien durch 1 M Uridin und 15 M 5'-Fluor-2'Deoxyuridin, um die Überproliferation von mesenchymalen Zellen zu stoppen, die ein Neuritenwachstum verhindern können. Optional: Fügen Sie Wachstumsfaktoren oder Inhibitoren in diesem Medium hinzu, wenn Sie versuchen, weitere Manipulationen zu versuchen.
- Kultur der Zellen für zusätzliche gewünschte Zeitpunkte. Dieses Protokoll wurde für 5 Gesamttage der Kultur optimiert, wobei die Medien nur am 2. Tag geändert wurden, um mitotische Inhibitoren hinzuzufügen. Längere Zeiträume erfordern zusätzliche Medienänderungen.
3. Probensammlung und -verarbeitung
- Trigeminale Färbung
- Pipette 1 ml Aliquots steriler 1x PBS in eine 24-Well-Platte unter einer Gewebekulturhaube für jeden zu verarbeitenden Transwellfilter.
- Entfernen Sie die Flüssigkeit auf dem Filter mit einer 200-1.000 l Pipette entfernt werden, wobei darauf zu achten, dass Zellschichten intakt zu lassen. Angefügte Zellen sollten befestigt bleiben und nicht angeschlossene Zellen lösen sich während dieser sanften Pipettierung. Ein Vakuumfilter kann die Zellschicht beschädigen und wird für die Aspiration nicht empfohlen.
- Übertragen Sie den Filter auf die 1x PBS-Platte, wobei Sie sicher sein müssen, dass die obere Medienschicht, wie im vorherigen Schritt erwähnt, entfernt wird.
- Legen Sie die Platte mit allen Transwell-Filtern und Deckeln bei 12 Umdrehungen pro Minute oder 40-50 Umdrehungen pro Minute auf einen Orbital-Shaker für 10 min.
- Aspirieren Sie die PBS, einschließlich der oberen Schicht wie oben beschrieben, fügen Sie 500 l 1xPBS und legen Sie auf der Wippe oder Orbital-Shaker für eine zusätzliche 5-10 min Spülung.
- 1x PBS noch einmal ansaugen und durch 4% Paraformaldehyd (PFA) ersetzen. Verwenden Sie mindestens 500 L, damit die gesamte Filteroberfläche untergetaucht ist. Legen Sie die Platte auf eine Wippe bei 12 Rpm oder Orbital-Shaker bei 40-50 Rpm bei Raumtemperatur für 1 h.
- Entfernen Sie die PFA und spülen Sie die Platten zweimal für 5-10 min jeweils auf einer Wippe mit 500 l von 1x PBS.
- Block mit 10% Rinderserumalbumin (BSA) + 5% Ziegen-/Eselserum, je nach Sekundärantikörper Wirtstier, in 0,05% Tween-1xPBS (PBST). Verwenden Sie 450-500 l Lösung, so dass der Filter in die Flüssigkeit getaucht wird.
HINWEIS: In diesem Stadium können diese Platten bei 4 °C für mehrere Monate gelagert werden, um zu einem späteren Zeitpunkt zu verarbeiten. Verwenden Sie Parafilm, um die Platte zu versiegeln, um sicherzustellen, dass keine Verdunstung auftritt, und überprüfen Sie regelmäßig auf Verdunstung, so dass Filteroberflächen untergetaucht bleiben. - Entfernen Sie den Block und fügen Sie 450-500 L Primärantikörper in 1% BSA-PBST ohne zusätzliche Spülung hinzu. Bei 4 °C über Nacht inkubieren, sanft schaukeln.
- Primäre Antikörperlösung entfernen und mit 500 l 1xPBST auf einer Wippe 3 mal bei Raumtemperatur abspülen
- Entfernen Sie den PBST, fügen Sie Sekundärantikörper hinzu und brüten Sie über Nacht bei 4 °C in Aluminiumfolie eingewickelt auf eine Wippe, um Fluorophore vor Lichtdegradation zu schützen. Spülen Sie wieder, 3 mal, mit 1x PBST auf einer Wippe bei Raumtemperatur. Ersetzen Sie dies durch 1x PBS.
HINWEIS: An dieser Stelle kann die Platte für mehrere Monate bei 4 °C gelagert werden, wenn sie in Aluminiumfolie eingewickelt wird, um den Fluorophorabbau zu verhindern. Verwenden Sie Parafilm, um die Platte zu versiegeln, um sicherzustellen, dass keine Verdunstung auftritt, und überprüfen Sie regelmäßig auf Verdunstung, so dass Filteroberflächen untergetaucht bleiben. Es ist am besten, innerhalb eines Monats zu bilden. - Für eine optimale Bildgebung, verwenden Thy1-YFP Maus Neuronen mit einem Anti-GFP-Antikörper, um speziell die neuronalen Afferents weit über Hintergrundniveaus zu färben. Verwenden Sie Anti-Neurofilament 200, um axonale Strukturen präzise zu färben, wenn Thy1-YFP-Mäuse nicht verfügbar sind.
- Bild wie gewünscht. Filter müssen nicht plattiert werden und können stattdessen auf einem Deckel- oder Dia zur Bildgebung mit einem invertierten Mikroskop platziert werden.
HINWEIS: Bereiche des Filters enthalten keine affetierenden Strukturen. Nehmen Sie mehrere Bilder mit einer Z-Stack-Tiefe auf, die alle affekten Strukturen erfasst. Verwenden Sie Diensoftware, um das Neuritenwachstum über große Flächen oder (vorzugsweise) ganze Filterbereiche zu visualisieren.
- RNA-, Protein- und Mediensammlung
- Während die Transwell-Filter verarbeitet werden, sammeln Sie die Medien in RNAse/DNAse-freien Rohren und frieren sie für spätere Tests ein (ELISA, Proteomik usw.).
- Unmittelbar nach der Mediensammlung puffert aliquot Lysepuffer oder Radio Immuno Precipitation Assay (RIPA) mit Proteinase- und Phosphatase-Inhibitoren in die Brunnen. Dieses Protokoll wurde für 100 l/well in einer 24-Well-Platte optimiert.
- Puffer 5 min lang lysieren, jeden Filter mit einer neuen Pipettenspitze kratzen und die Zellproben in RNAse/DNAse-freien Rohren sammeln. Einfrieren der Lyse für zukünftige Assays (semiquantitative und/oder quantitative PCR, Western Blot usw.).
- Optionale Immunfluoreszenz von Zellstoffzellen:
- Heben Sie die Deckel aus Abschnitt 1.1 vorsichtig mit Zangen an und übertragen Sie sie mit 4% PFA für 1 h mit Schaukelin in verschiedene Brunnen.
- PFA aspirieren und die Abdeckungen zweimal mit 1x PBS ausspülen. Folgen Sie dies mit Permeabilisation, Blockierung und Immunfluoreszenz für Marker von Interesse mit Standard-Immunfluoreszenz-Techniken.
Ergebnisse
Diese Ergebnisse zeigen, dass das TG-Neuritenwachstum in Gegenwart von primären DP-Zellen im zugrunde liegenden Brunnen im Vergleich zur Kontrolle der TG-Neuritenmonokultur erhöht wurde (Abbildung 2A,C). Es gibt einige Assay-zu-Assay-Variabilität im Neuritenwachstum. Daher sollte eine TG-Neuronenmonokultur in alle Assays als Kontrolle aufgenommen werden, um die Basalwerte des Neuritenauswüchses zu erkennen. Primärzellen aus der Tgfbr2f/f-Maus wurden in diesem Protokoll verwendet, nachdem eine Infektion mit Ad-Cre-GFP und Ad-eGFP in einer entsprechenden Anzahl von Zellen bestätigt wurde (Abbildung 2D). Das Ad-eGFP diente als Kontroll-Virusvektor. Das Ad-Cre-GFP löschte das flankierte Gen Tgfbr2, wie die semiquantitative PCR (Abbildung 2E) zeigt. In den Kulturen mit transformierendem Wachstumsfaktor Beta-Rezeptor 2 (Tgfbr2) Deletion wurde das Neuritenwachstum verringert (Abbildung 2A-C).
Wir verwendeten die Thy1-YFP Maus TG Neuronen und färbten sie mit einem Anti-GFP-Antikörper, der sehr spezifische und helle Bilder von axonalen Strukturen weit über diesem Hintergrund erzeugte, wie in Abbildung 2gezeigt. Dies ermöglichte die spezifische Färbung von neuronalen Markern ohne unspezifische Färbung von nicht-neuronalen Zellen durch die Verwendung zuvor berichteter Methoden wie Kristallviolett7. Die großen Poren in den Filtern können sekundäre Antikörper autofluoreszieren und/oder ansammeln und die Genauigkeit der axonalen Bildgebung verringern (Abbildung 3). Während die Thy1-YFP-Neuronen mit Immunfluoreszenz die Bildgebung drastisch verbessern, kann mit auto-thresholding Software weiterer Hintergrund entfernt und dann quantifiziert werden. Wir empfehlen auch die Durchführung der Immunfluoreszenz für Neurofilament 200 auf der Grundlage unserer vorläufigen Erkenntnisse (nicht gezeigt) sowie andere8,9, wenn Thy1-YFP-Mäuse nicht verfügbar sind.

Abbildung 1: Ein Schaltplan der Maussektion, um Zellen für die Co-Kultur zu erhalten. (A) Ein Diagramm, wo man schneiden, um den Mausschädel zu öffnen und TG-Nerven zu lokalisieren, in schwarz in der letzten Darstellung gezeigt. Scheren zeigen an, wo die Scherenspitzen eingesetzt werden sollen, um sie entlang der gepunkteten Linien zu schneiden. (B) Ein kombiniertes Dunkelfeld- und GFP-Bild, das Thy1-YFP+ TG-Nerven in Weiß kreist. (C) Sezierte TG-Ganglien können dann dispergiert und kultiviert werden, wie in Fgezeigt. (D) Der Unterkiefer einer P7-Maus, mit Zangen, die den Unterkiefer auf der linken Seite halten, und alveolaren Knochenrücken, die auf jeder Seite der Zunge ausgebrochene Zähne enthalten. (E) DP-Gewebe (umkreist) aus der mineralisierten Struktur (oben) extrahiert, und der Zahnschmelz äußere epithel (unten), die entfernt wurde, um zu dispergieren und Platte in einem Gewebe Kultur behandelt Platte, wie in Fgezeigt. Bilder werden nicht skaliert. DP-Zellen wurden dispergiert und bis zum Zusammenfluss angebaut, bevor TG-Neuronen hinzugefügt wurden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Repräsentative Ergebnisse aus der Kokultur. (A-C) Thy1-YFP TG-Neuronen wurden in Transwell-Filtern mit 3 m Poren auf primären Tgfbr2f/f DP-Zellen kultiviert. Immunfluoreszierende Färbung wurde für das YFP-Protein mit einem Anti-GFP-Antikörper durchgeführt, um hochspezifische Färbungen neuronaler Strukturen über den gesamten Filter zu ermöglichen. Die maximalen Projektionen von 100-m-z-Stack-Konfokalmikroskopie-Bildern mit 10x wurden gesammelt und mit Nähsoftware genäht. TG-Neuronen zeigten deutlich mehr Wachstum, wenn sie mit DP-Zellen (A) kokultiviert wurden, als wenn sie allein kultiviert wurden (C). Neuritenwachstum wurde nicht induziert, wenn Neuronen mit DP-Zellen ko-kultiviert wurden, die mit Ad-Cre-GFP infiziert waren, um Tgfbr2 (B) niederzuschlagen. Skala bar = 1.000 m. Äquivalente Anzahl von Zellen, die mit Ad-eGFP und Ad-Cre-GFP infiziert sind, sind in (D) dargestellt. Skalenbalken = 125 m. Semi-quantitative PCR bestätigte die Tgfbr2 KD (E). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Technische Schwierigkeiten bei der bildgebenden Bildgebung. (A) Brightfield-Bildgebung von Transwell-Filtern nach kristallvioletter Färbung von Zellpopulationen. Große Poren sind weit verbreitet. Der große Pfeil zeigt auf eine Zelle, die mesenchymale Morphologie aufweist, während der kleine Pfeil auf eine Zelle der neuronalen Morphologie zeigt. Kristallviolett befleckt beide Zellen ohne Voreingenommenheit. (B) Die immunfluoreszierende Färbung von 3 Tubulin mit einem Alexa-488 Sekundärantikörper zeigte eine unspezifische Färbung mehrerer Zellen, was die Bildgebung von affemittenten Strukturen erschwerte. Die Bilder sind repräsentativ und wurden über mehrere Assays wiederholt, um die in Abbildung 2gezeigte Bildgebung zu optimieren. Skalenbalken = 50 m. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Komponente | Volumen | Konzentration | |
| MEM | 440 ml | ||
| Hitze inaktivierte fetale Rinderserume | 50 ml | 10% | |
| 100x L-Glutamin | 5 mL | 1x | |
| Penicillin-Streptomycin 100 x | 5 mL | 1x | |
| Medienwechsel am 2. Tag mit Mitotikinhibitoren bei diesen Endkonzentrationen | |||
| Uridin | 1 M | ||
| 5'-Fluor-2'deoxyuridin | 15 m | ||
Tabelle 1: Co-Kulturmedien.
Diskussion
Die täglichen Aktivitäten der Mundhöhle erfordern, dass die Zähne äußere Reize und innere Entzündungen spüren, um eine ordnungsgemäße Nutzung und Wartung zu ermöglichen. Es liegen jedoch nur begrenzte Informationen über die Signale vor, die die Entwicklungsprozesse der Zahninnervation vorantreiben. Dieses Protokoll bietet eine Methode zur Isolierung und Kokultur primärer DP-Zellen und TG-Neuronen, um die Kreuzkommunikation zwischen den beiden Populationen zu untersuchen. Mehrere Variablen wurden optimiert und lassen weitere Forschungswege offen, wie unten beschrieben.
Kontrollen sind bei jedem Schritt in diesem Test wichtig. Ein Transwell-Filter mit TG-Neuronen ohne zugrunde liegende DP-Zellen sollte in jeden Test einbezogen werden, um eine Basis für das TG-Wachstum zu bieten. Beim Löschen eines flankierten Gens von Interesse mit einer Ad-Cre-GFP-Rekombinante sollte ein Kontrollvirus verwendet werden, das nur den fluoreszierenden Marker ausdrückt, um zu bestätigen, dass eine entsprechende Anzahl von Zellen infiziert wurde. Während wir hohe Infektionsraten mit minimalem Zelltod bei 100 und 200 MOI für Ad-eGFP bzw. Ad-Cre-GFP demonstrierten, sollte jedes Labor diesen Schritt optimieren. Da fluoreszierende Proteine an verschiedene Promotoren angebunden werden können und daher eine differenzielle Expressionsäquivalente Anzahl infizierter Zellen verursachen, sollten Fluoreszenzzellen gezählt werden. Die Gesamtintensität der Fluoreszenz ist irrelevant, da sie den Infektionsstatus nicht genau widerspiegelt. Es ist wichtig, die Deletion des Gens nachzuweisen, wie mit semiquantitativer PCR in diesem Protokoll gezeigt wird (Abbildung 2). Obwohl dieses Protokoll dieses Thema nicht behandelte, zeigten frühere Forschungen, dass Kontrollassays mit anderen Zelllinien aufgenommen werden konnten, um zu zeigen, dass das Neuritenwachstum speziell durch Kokultur mit DP-Zellen8induziert wird.
Da dieses Protokoll primäre Zellen verwendet, gibt es mehrere Stufen, in denen eine Kontamination eingeführt werden kann. Um dies zu verhindern, sollten alle Reagenzien steril gefiltert werden. Darüber hinaus wird empfohlen, Experimente für jede Variable in doppelter oder dreifacher Ausführung durchzuführen, um die Entfernung eines Filters und die Sterilisation eines kontaminierten Brunnens ohne vollständigen Ausfall des Assays zu ermöglichen.
Coverlips müssen mit Poly-D-Lysin und/oder einem extrazellulären Matrixprotein beschichtet werden, um die DP-Zellhaftung zu gewährleisten. Während sich die Zellen zunächst anheften, verursacht eine Virusinfektion den Zelllifting-Tod auf unbeschichteten Coverlips und verhindert die genetische Manipulation des Co-Kultur-Assays.
Es ist gut erwiesen, dass nicht-neuronale Zellen, wie Schwann-Zellen aus der TG-Ganglien, das Überleben von neuronalen Zellen in Kultur14,15,16beeinflussen können. In diesem Protokoll wurde das neuronale Überleben durch Zugabe von 1 'M Uridin und 15 'M 5-Fluor-2'deoxyuridin optimiert. Ohne die Zugabe dieser antimitatischen Wirkstoffe zur Hemmung der Schwann-Zellproliferation wird es kein Neuritenwachstum geben. Es ist nicht bekannt, ob das Vorhandensein dieser seneszenten Schwann-Zellen in der Kokultur die neuronale Reaktion verändert. Die Isolierung muriner Neuronen erfordert mehrere zusätzliche Schritte, und Protokolle sind für Forscher verfügbar, die diese Variable entfernen möchten17. In beiden Fällen imitiert die Neuronendispersion etwas eine Axotomie und könnte als Verletzung/Reparatur18 mehr als Entwicklung angesehen werden. Weitere Studien wären erforderlich, um die Unterschiede zwischen in vivo axonalen Wachstum von Fascicles im Vergleich zu axonalen Wachstum von einzelnen Neuronen in vitro zu bestimmen, und diese werden in diesem Protokoll nicht behandelt.
Dieses Protokoll dauert 1-3 Wochen von Anfang bis Ende. Während es möglich ist, DP-Zellen zu nutzen, die mehr als 1 Woche benötigen, um 85-90% Zusammenfluss zu erreichen, wird empfohlen, dass Zellen mit einer hohen Dichte gesät werden, um den Zusammenfluss innerhalb weniger Tage zu erreichen, da diese Zellen sich sehr langsam über diesen Punkt dividieren. Dies erfordert in der Regel etwa 5-7 P5-8 Mäuse pro Reihe einer 24-Well-Platte. Dieses Protokoll wurde für insgesamt 5 Tage Co-Kultur optimiert, an dem die Medien mit Phenolrot begannen, die Farbe zu verschieben. Die Medien sollten verändert werden, wenn längere Assays gewünscht werden.
Mehrere Co-Kultur-Assays wurden durchgeführt, um das Neuritenwachstum als Reaktion auf Faktoren zu demonstrieren, die von den DP-Sekretfaktoren mit Standard-ECM-beschichteten Gewebekulturplatten3,19,20,21 oder mikrofluidischen Kammern8,22,23abgesondert werden. Dieses Protokoll bietet mehrere Vorteile gegenüber diesen Methoden. Zum Beispiel erfordert TG-Ganglien und DP-Gewebe-Co-Kultur eine spezifische räumliche Beziehung für die Neuriten zu spüren und auf kurzrädrige Parakrinsignale reagieren. Bei der Organkultur sind nur die Neuriten in den Ganglien, die dem DP-Gewebe am nächsten sind, in der Lage,3zu reagieren, während die in diesem Protokoll verwendeten dispergierten TG-Neuronen in gleichem Abstand zu den darunter liegenden DP-Zellen kultiviert werden. Zweitens können Organkulturen Gewebenekrose aufgrund des Mangels an Sauerstoff und Nährstoffen in großen Proben24einführen. Die Kokultur der dispergierten Zellen beseitigt diese Möglichkeit. Einige Ko-Kulturen einschließlich Neuronen erfordern neuronale Medien3,22, die eine dominante Rolle bei der Förderung von Neuritenwachstum spielen können. Dieses Protokoll fügt keine neuronspezifischen Wachstumsfaktoren hinzu, wodurch eine Bewertung der direkten Beziehung zwischen parakrinen Signalen aus den zugrunde liegenden DP-Zellen und neuriter-Auswuchsreaktionen ermöglicht wird. Es ist erwähnenswert, dass die Co-Kultur-Medien auch Komponenten fehlen, um mineralisierung zu fördern, wie Beta-Glycerophosphat. Auf diese Weise können die Ermittler feststellen, wie Neuriten Signale absondern können, um die Mineralisierung zu fördern. Es schränkt die Studie jedoch auch ein, indem es nur weniger differenzierte DP-Zellen ohne die mineralisierenden Odontoblasten einbezieht, die typischerweise in vivo vorhanden wären.
Kolorimetrische Reaktionen aus früheren Forschungen7,8 bezeichnen weder Schwann-Zellbeiträge noch zeigen neuronale Morphologie, da Kristallviolett alle Zellen nicht spezifisch färbt. Immunfluoreszierende Färbung von Filtern kann zu hohen Hintergrundwerten führen, die die bildende Bildgebung erschweren (Abbildung 2). Das vorliegende Protokoll ermöglicht die präzise Färbung neuronaler Afferents durch die Verwendung von Thy1-YFP TG Neuronen und einem Anti-GFP-Antikörper und liefert ein Signal, das hell genug ist, um große Wachstumsbilder in einer gesamten Abbildung zu erzeugen (Abbildung 3). Es ist möglich, andere neuronale Marker zu verwenden, wie Anti-Neurofilament 200, wenn Thy1-YFP Mäuse nicht verfügbar sind.
Schließlich ermöglicht die Verwendung primärer DP-Zellen von Mäusen mit Genen von Interesse, die von loxP-Standorten flankiert werden, eine einfache und effiziente Löschung dieser Gene mit einem Ad-Cre-GFP-System. In zukünftigen Studien könnte das Ad-Cre-Rekombinatoase-System auf den TG-Neuronen verwendet werden, wenn sie ein Gen von Interesse haben, das von loxP-Sites flankiert wird. Dies würde Studien darüber erleichtern, wie parakrine Signale aus der neuronalen Population DP-Zellen beeinflussen, insbesondere wenn die DP-Zellen auf den Abdeckungen gesät werden (Abschnitt 1.1). Zukünftige Studien können andere Manipulationen nutzen, wie die Zugabe von pharmakologischen Inhibitoren und/oder Wachstumsfaktoren. Es ist auch möglich, dieses Protokoll so zu ändern, dass Migrationsstudien mithilfe von Transwellfiltern mit 8 m Porosität verwendet werden.
Zusammenfassend lässt sich sagen, dass dieser Transwell-Co-Kultur-Assay unter Verwendung von Neuronen und DP-Zellen die Untersuchung mehrerer zellulärer Parameter ermöglicht. Dies macht es möglich, den Wissensstand über die mesenchymal-neuronalen Wechselwirkungen zu erweitern, die die Zahninnervation fördern und unterstützen.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Arbeit wurde unterstützt von a) den National Institutes of Health/NIAMS (Grant Numbers R01 AR062507 und R01 AR053860 to RS), b) der University of Alabama at Birmingham Dental Academic Research Training (DART) Grant (Nummer T90DE022736 (PI MacDougall)) an SBP vom National Institute of Dental and Craniofacial Research/National Institutes of Health, c) ein UAB Global Center for Craniofacial, Oral and Dental Disorders (GC-CODED) Pilot- und Machbarkeitsstipendium an SBP und d) das National Institute of Dental and Craniofacial Forschungs-/National Institutes of Health K99 DE024406 Zuschuss an SBP.
Materialien
| Name | Company | Catalog Number | Comments |
| 5-Fluoro-2'-deoxyuridine | Sigma-Aldrich | F0503 | Used as a mitotic Inhibitor at 15 μM concentration in co-culture media, Day 2 |
| 24 Well Cell Culture Plate | Corning | 3524 | Co-culture plate |
| Alexa-546 anti-chicken | Invitrogen | A-11040 | Secondary to stain neurite outgrowth labeled by anti-GFP antibody, 1:500 dilution |
| Anti-GFP Antibody | Aves Lab, Inc | GFP-1010 | Primary antibody to label Thy1-YFP neurons, 1:200 dilution |
| Anti-Neurofilament 200 antibody | Sigma-Aldrich | NO142 | Monoclonal primary antibody to label neurons, 1:1000 dilution, alternative if YFP mice are not available |
| B6;129- Tgfbr2tm1Karl/J | The Jackson Laboratory | 12603 | Tgfbr2f/f mouse model used for dental pulp cells in optimized protocol |
| B6.Cg-Tg(Thy1-YFP)16Jrs/J | The Jackson Laboratory | 3709 | Thy1-YFP mouse model genotype used for trigeminal neurons |
| Collagenase Type II | Millipore | 234155-100MG | Used to disperse trigeminal neurons |
| Fetal Bovine Serum | Gibco | 10437 | Additive to co-culture media |
| Fine forceps | Fine Science Tools | 11413-11 | Fine forceps for TG dissection |
| Laminin | Sigma-Aldrich | L2020 | Coats the transwell inserts at final concentration of 10 μg/ml, stock solution is assumed at 1.5 mg/ml |
| Lysis Buffer (Buffer RLT) | Qiagen | 79216 | Extracts RNA from dental pulp cells post co-culture |
| L-Glutamine | Gibco | 25030081 | Additive to co-culture media |
| Micro-dissecting scissors | Sigma-Aldrich | S3146-1EA | Dissection scissors to open skull |
| Microscope Cover Glass | Fisherbrand | 12-545-81 | Circlular coverslip for optional cell culturing and immunofluorescence processing |
| Minimal Essential Medium a | Gibco | 12571063 | Co-culture media base |
| Penicillin-Streptomycin | Gibco | 15070063 | Antibiotic additive to co-culture media |
| Phosphatase Inhibitor | Sigma-Aldrich | 04 906 837 001 | Additive to RIPA Buffer for extracting protein from dental pulp cells post co-culture |
| Polybrene | Millipore | TR-1003-G | Used to aid in dental pulp cell transfection |
| Poly-D-Lysine | Sigma-Aldrich | P7280 | Coverslip coating to aid dental pulp cellular adhesion |
| Protease Inhibitors | Millipore | 05 892 791 001 | Additive to RIPA Buffer for extracting protein from dental pulp cells post co-culture |
| RNAse/DNAse free eppendorf tubes | Denville | C-2172 | Presterilized 1.7 ml tubes for RNA, DNA or protein collection at the end of assay |
| ThinCert Cell Culture Insert | Greiner Bio-One | 662631 | Transwell inserts for trigeminal neurons in co-culture assays |
| Trypsin-EDTA (0.25%) | Gibco | 25200056 | Used fto disperse dental pulp cells |
| Trypsin Type II | Sigma-Aldrich | T-7409 | Used to disperse trigeminal neurons |
| Ultra Fine Forceps | Fine Science Tools | 11370-40 | Ultra fine forceps for dissection |
| Uridine | Sigma-Aldrich | U3750 | Used as a mitotic Inhibitor at 1 μM concentration in co-culture media, Day 2 |
| Vacuum Filtration System | Millipore | SCNY00060 | Steriflip disposable filter, 50 μm nylon net filter |
| Vial forceps | Fine Science Tools | 110006-15 | Long forceps for tissue transfer to conicals |
Referenzen
- Moe, K., Sijaona, A., Shrestha, A., Kettunen, P., Taniguchi, M., Luukko, K. Semaphorin 3A controls timing and patterning of the dental pulp innervation. Differentiation. 84 (5), 371-379 (2012).
- Kollar, E. J., Lumsden, A. G. Tooth morphogenesis: the role of the innervation during induction and pattern formation. Journal de biologie buccale. 7 (1), 49-60 (1979).
- Lillesaar, C., Fried, K. Neurites from trigeminal ganglion explants grown in vitro are repelled or attracted by tooth-related tissues depending on developmental stage. Neuroscience. 125 (1), 149-161 (2004).
- Fried, K., Lillesaar, C., Sime, W., Kaukua, N., Patarroyo, M. Target finding of pain nerve fibers: Neural growth mechanisms in the tooth pulp. Physiology & Behavior. 92 (1-2), 40-45 (2007).
- Pagella, P., Jiménez-Rojo, L., Mitsiadis, T. A. Roles of innervation in developing and regenerating orofacial tissues. Cellular and Molecular Life Sciences. 71 (12), 2241-2251 (2014).
- Luukko, K., Kettunen, P. Integration of tooth morphogenesis and innervation by local tissue interactions, signaling networks, and semaphorin 3A. Cell Adhesion & Migration. , 1-9 (2016).
- Smit, M., Leng, J., Klemke, R. L. Assay for neurite outgrowth quantification. BioTechniques. 35 (2), 254-256 (2003).
- de Almeida, J. F. A., Chen, P., Henry, M. A., Diogenes, A. Stem cells of the apical papilla regulate trigeminal neurite outgrowth and targeting through a BDNF-dependent mechanism. Tissue engineering. Part A. 20 (23-24), 3089-3100 (2014).
- Pagella, P., Miran, S., Mitsiadis, T. Analysis of Developing Tooth Germ Innervation Using Microfluidic Co-culture Devices. Journal of Visualized Experiments. (102), e53114(2015).
- Coelen, R. J., Jose, D. G., May, J. T. The effect of hexadimethrine bromide (polybrene) on the infection of the primate retroviruses SSV 1/SSAV 1 and BaEV. Archives of Virology. 75 (4), 307-311 (1983).
- Caroni, P. Overexpression of growth-associated proteins in the neurons of adult transgenic mice. Journal of neuroscience methods. 71 (1), 3-9 (1997).
- Alić, I., et al. Neural stem cells from mouse strain Thy1 YFP-16 are a valuable tool to monitor and evaluate neuronal differentiation and morphology. Neuroscience Letters. 634, 32-41 (2016).
- Howroyd, P. C. Dissection of the Trigeminal Ganglion of Nonrodent Species Used in Toxicology Studies. Toxicologic Pathology. , (2019).
- Schwieger, J., Esser, K. H., Lenarz, T., Scheper, V. Establishment of a long-term spiral ganglion neuron culture with reduced glial cell number: Effects of AraC on cell composition and neurons. Journal of Neuroscience Methods. 268, 106-116 (2016).
- Liu, R., Lin, G., Xu, H. An Efficient Method for Dorsal Root Ganglia Neurons Purification with a One-Time Anti-Mitotic Reagent Treatment. PLoS ONE. 8 (4), 60558(2013).
- Burry, R. W. Antimitotic drugs that enhance neuronal survival in olfactory bulb cell cultures. Brain Research. 261 (2), 261-275 (1983).
- Katzenell, S., Cabrera, J. R., North, B. J., Leib, D. A. Isolation, Purification, and Culture of Primary Murine Sensory Neurons. Methods in molecular biology. 1656, Clifton, N.J. 229-251 (2017).
- Dussor, G. O., Price, T. J., Flores, C. M. Activating transcription factor 3 mRNA is upregulated in primary cultures of trigeminal ganglion neurons. Molecular Brain Research. 118 (1-2), 156-159 (2003).
- Lillesaar, C., Arenas, E., Hildebrand, C., Fried, K. Responses of rat trigeminal neurones to dental pulp cells or fibroblasts overexpressing neurotrophic factors in vitro. Neuroscience. 119 (2), 443-451 (2003).
- Lillesaar, C., Eriksson, C., Fried, K. Rat tooth pulp cells elicit neurite growth from trigeminal neurones and express mRNAs for neurotrophic factors in vitro. Neuroscience Letters. 308 (3), (2001).
- Lillesaar, C., Eriksson, C., Johansson, C. S., Fried, K., Hildebrand, C. Tooth pulp tissue promotes neurite outgrowth from rat trigeminal ganglia in vitro. Journal of neurocytology. 28 (8), 663-670 (1999).
- Chmilewsky, F., Ayaz, W., Appiah, J., About, I., Chung, S. H. Nerve Growth Factor Secretion From Pulp Fibroblasts is Modulated by Complement C5a Receptor and Implied in Neurite Outgrowth. Scientific reports. 6, 31799(2016).
- Pagella, P., Neto, E., Jiménez-Rojo, L., Lamghari, M., Mitsiadis, T. A. Microfluidics co-culture systems for studying tooth innervation. Frontiers in Physiology. 5, 326(2014).
- Miura, T., Yokokawa, R. Tissue culture on a chip: Developmental biology applications of self-organized capillary networks in microfluidic devices. Development, Growth & Differentiation. 58 (6), 505-515 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten