Method Article
طريقة الثقافة المشتركة لدراسة النيرايت الناء في الاستجابة لإشارات اللب الأسنان باراكرين
In This Article
Summary
نحن نصف العزلة والتشتت والطلاء من الخلايا الأولية لب الأسنان (DP) مع الخلايا العصبية ثلاثية التوائم (TG) المستزرعة فوق مرشحات عبر ويل فوق. يمكن تحليل الاستجابات الخلوية لخلايا DP مع الفلور المناعي أو تحليل الحمض النووي الريبي / البروتين. الفلور المناعي من علامات الخلايا العصبية مع المجهر المعالبؤر يسمح تحليل استجابات نمو النيوتر.
Abstract
يسمح تعصيب الأسنان للأسنان باستشعار الضغط ودرجة الحرارة والالتهاب ، وكلها حاسمة لاستخدام وصيانة جهاز الأسنان. بدون تعصيب حسي ، فإن الأنشطة الشفوية اليومية ستسبب ضررًا لا يمكن إصلاحه. على الرغم من أهميتها ، تم تجاهل أدوار التعصيب في تطوير الأسنان وصيانتها إلى حد كبير. وقد أظهرت العديد من الدراسات أن خلايا DP تفرز بروتينات مصفوفة خارج الخلية وإشارات الباراكرين لجذب وتوجيه محاور TG في جميع أنحاء السن. ومع ذلك ، قدمت دراسات قليلة نظرة مفصلة في الحديث المتبادل بين mesenchyme DP والخلايا العصبية afferents. ولمعالجة هذه الفجوة في المعرفة، بدأ الباحثون في استخدام الثقافات المشتركة ومجموعة متنوعة من التقنيات للتحقيق في هذه التفاعلات. هنا، ونحن نشرح الخطوات المتعددة المشاركة في الزراعة المشتركة الخلايا DP الأولية مع الخلايا العصبية TG المنتشرة على مرشح عبر ويل فوقمع المسام قطرها كبيرة للسماح نمو محور عصبي من خلال المسام. تم استخدام خلايا DP الأولية مع جين الفائدة محاطة بمواقع loxP لتسهيل حذف الجينات باستخدام نظام الـ Adenovirus-Cre-GFP recombinase. باستخدام الخلايا العصبية TG من الماوس Thy1-YFP يسمح للتصوير afferent دقيقة، مع التعبير أعلى بكثير من مستويات الخلفية عن طريق المجهر confocal. يمكن التحقيق في استجابات DP من خلال جمع وتحليل البروتين أو الحمض النووي الريبي ، أو بدلاً من ذلك ، من خلال تلطيخ الفلورسنت المناعي لخلايا DP المطلية على قسائم الأغطية الزجاجية القابلة للإزالة. يمكن تحليل وسائل الإعلام باستخدام تقنيات مثل التحليلات البروتينية ، على الرغم من أن هذا سيتطلب استنفاد الزلال بسبب وجود مصل الأبقار الجنينفي في وسائل الإعلام. يوفر هذا البروتوكول طريقة بسيطة يمكن التلاعب بها لدراسة الاستجابات المورفولوجية والوراثية والهيكلية للخلايا العصبية TG وخلايا DP استجابة للبيئة الخاضعة للرقابة من تحليل الثقافة المشتركة.
Introduction
يسمح تعصيب الأسنان للأسنان باستشعار الضغط ودرجة الحرارة والالتهاب ، وكلها حاسمة لاستخدام وصيانة جهاز الأسنان. يؤدي الفشل في الشعور بألم الأسنان المرتبط بتسوس الأسنان والصدمات النفسية إلى تطور المرض. وبالتالي ، فإن التعصيب السليم هو شرط لنمو الأسنان العادية ، وظيفة والرعاية.
في حين أن معظم الأجهزة تعمل بكامل طاقتها وتُدمج بحلول وقت الولادة ، فإن تطور الأسنان يمتد إلى حياة البالغين ، مع تعصيب الأسنان والتمعدن الذي يحدث بالتنسيق خلال مراحل ما بعد الولادة1،2. ومن المثير للاهتمام أن اللب الأسنان (DP) mesenchyme تفرز في البداية إشارات طاردة أثناء تكوين الأجنة لمنع دخول محور عصبي إلى جهاز الأسنان النامية ، والتي تتحول في وقت لاحق إلى إفراز عوامل جذب مع اقتراب الأسنان من ثوران3،4. خلال مراحل ما بعد الولادة ، تخترق المحاور المحورية من العصب الثلاثي التوائم (TG) في الأسنان وفي جميع أنحاء هافيالوقت الذي يبدأ فيه ترسب دنتين (تمت مراجعته في باجيلا ، P. وآخرون5). وقد أظهرت العديد من الدراسات في الجسم الحي أن التفاعلات العصبية-mesenchymal دليل تعصيب الأسنان في الفئران (استعرضت في لوكو، K. وآخرون6)،ولكن تفاصيل قليلة من الآليات الجزيئية المتاحة.
توفر الثقافات المشتركة للخلايا بيئات خاضعة للرقابة حيث يمكن للمحققين التعامل مع التفاعلات بين الخلايا العصبية والسكان الميسينشيم. تجعل تجارب الثقافة المشتركة من الممكن التعمق في مسارات الإشارات التي توجه تعصيب الأسنان وتطورها. ومع ذلك، فإن العديد من الأساليب التقليدية المستخدمة لدراسة الخلايا في الثقافة المشتركة تطرح تحديات تقنية. على سبيل المثال، يمكن تلطيخ الكريستال البنفسجي من النيوريت outgrowth غير محددة وصمة عار شوان الخلايا المدرجة في تشتت حزمة TG، وربما يكون هناك قمم في كثافة اللون مع استجابات صغيرة نسبيا7. تقدم غرف Microfluidic خيارًا جذابًا ، ولكنها أكثر تكلفة بكثير من مرشحات ترانسويل8،9 وتسمح فقط بالتحقيق في استجابات الخلايا العصبية لإفرازات DP. لمعالجة هذه القضايا، وضعنا بروتوكوليسمح ل: أ) تلطيخ دقيق والتصوير من نمو TG neurite استجابة لإفرازات DP، ب) التعديل الوراثي للخلايا DP و / أو الخلايا العصبية TG للتحقيق في مسارات إشارة محددة، و ج) التحقيق في استجابات خلايا DP للعوامل التي تفرزها الخلايا العصبية TG. يوفر هذا البروتوكول القدرة على التحقيق بدقة في العديد من ميزات تعصيب الأسنان في البيئة الخاضعة للرقابة في فحص الثقافة المشتركة في المختبر.
Protocol
تمت الموافقة على جميع التجارب على الفئران من قبل لجنة رعاية الحيوانات المؤسسية واستخدامها في البنك العربي المتحد (IACUC).
1. إعداد لوحة
ملاحظة: يمكن استخدام قسائم التغطيات لتصوير خلايا DP في نهاية الفحص. تأكد من أن غطاء اللوحة موجود أثناء جميع خطوات الحضانة والإنضار خارج غطاء زراعة الأنسجة المعقمة لمنع التلوث أثناء معالجة العينات.
-
إعداد قسيمة الغلاف
- التغطيات الدائرية الأوتوكلاف.
- تصفية المياه فائقة النقاء تحت غطاء محرك السيارة.
- نقل القسائم إلى لوحة 24 جيدا وتغطي كل واحد مع 400 ميكرولتر من 0.1 ملغ / مل بولي D-ليسين.
- السماح للcoverslips نقع، مغمورة لمدة 5 دقيقة، على الروك في 12 دورة في الدقيقة أو شاكر المداري في 40-50 دورة في الدقيقة. تأكد من أن الغطاء على منع التلوث.
- شطف القسائم مع المياه فائقة النقاء المصفاة لمدة 5 دقيقة على الروك في 12 دورة في الدقيقة أو شاكر في 50 دورة في الدقيقة. كرر.
- السماح للcoverslips لتجف لمدة 2 ساعة على الأقل تحت غطاء محرك السيارة مع غطاء لوحة قبالة لتسهيل التبخر. وينبغي استخدام هذه القسائم في غضون 48 ساعة.
- خلايا DP البذور فوق التغطيات وعملية في نهاية اختبار للفلورية المناعية (القسم 3.3).
-
مرشحات الطلاء
- تمييع اللامينين إلى 10 ميكروغرام/مل. تصفية الصفيحة المخفف تحت غطاء محرك السيارة.
- ماصة 450-500 ميكرولتر من 10 ميكروغرام/ مل لامينين في كل بئر من لوحة 24 جيدا.
- ضع فلتر ترانسويل، 3 ميكرومتر مسامية، في بئر بحيث يتصل بمحلول اللامينين وتركه في حاضنة 37 درجة مئوية إما لساعتين أو بين عشية وضحاها. يجب أن تسمح مسام الفلتر ببعض المحلول لنشر وطبقة أعلى وأسفل الفلتر. يجب استخدام هذه الفلاتر في غضون 48 ساعة أو أن تكون مبردة عند 4 درجات مئوية لمدة تصل إلى أسبوع واحد.
2. طلاء الخلايا مع التلاعب الجيني الاختياري
- الفئران: يمكن إجراء التغيير الوراثي لخلايا DP (ولكن ليس مطلوبًا) لدراسة التفاعلات بين الخلايا العصبية والمتوسطة. انظر القسمين 2.3 و 2.4 للاطلاع على الاختلافات الجينية المقترحة.
- تشريح DP والتشتت والطلاء(الشكل 1)
ملاحظة: بالنسبة لتشريح DP، استخدم ملقط ًا فائق الدقة ومستقيم ًا. وحواف فائقة غرامة تسمح للمستخدم لإسفين حافة forcep بين الهيكل المععدن والأنسجة DP.- حصاد الفئران P5-P8. في هذه المرحلة ، يجب أن تكون الأسنان تمعدن ، والجذر مفتوح.
- تخدير الولدان عن طريق انخفاض حرارة الجسم عن طريق وضعهم في طبق في الثلاجة 4 درجة مئوية حتى لا يتحركوا بعد الآن أو يستجيبون للمس. القتل الرحيم الولدان عن طريق قطع الرأس ووفقا لإجراءات IACUC في المرفق المعين.
- إعداد 3-5 مل aliquot من 0.25٪ التربسين-EDTA في أنبوب مخروطي 50 مل لجمع DP من كل فأرة. وهذا سوف يسهل هضم لب الأسنان من الفئران بعد الولادة. استخدم أكثر من 3 مل إذا هضم الأنسجة من أكثر من 10 فئران ما بعد الولادة.
- ضع الرأس على لوحة تحت ية يمكن التخلص منها بحيث يكون الفم نحو السقف وقاعدة الرقبة مسطحة على سطح العمل. استخدام شفرة حلاقة في حركة منشار لفصل الفك السفلي من الفك العلوي.
- إزالة اللسان اختياريا إما مع مقص أو مع ملقط للسماح بالوصول إلى أسهل الأضراس.
- ضع الرأس المفتوح في طبق فوق وسادة شاش معقمة وضع العينة تحت مجهر تشريح(الشكل 1D).
- إزالة أنسجة العظام السنخية المحيطة الأضراس الأولى. لا تثور الأسنان تحت الفك السفلي بالكامل في هذه المرحلة. أدخل الملقط في فتح السنخية وندف الأنسجة بعيدا عن الأسنان نحو الصد (الخد) أو اللغوية (اللسان) الجانب من الفم. سوف الأسنان الفك العلوي تتطلب إزالة كاملة من مشقوق حول الأسنان للتعرض وإزالتها.
- نقل بلطف الأضراس الأولى تحت الفك السفلي والفك العلوي (M1s) إلى طبق ثقافة خلية منفصلة مع 1x الفوسفات العازلة المالحة (PBS).
- كرر 2.2.4-2.2.8 حتى يتم جمع جميع M1s. الحفاظ على الطبق الذي يحتوي على M1s على الجليد أثناء الحصاد.
- قم بإزالة الجهاز الخارجي للمينا (EOE) المحيط بالجزء الخارجي من كل M1. ويمكن أن يتم ذلك بدلا ً من ذلك بعد الخطوة 2.2.11.
- مع مجموعة من ملقط، تدوير M1 بحيث cusps أسفل ويتعرض الجذر المفتوح. سيكون هناك فتحة بيضاوية على الجزء السفلي من الأسنان، وأنسجة DP مبهمة مغلفة بطبقة رقيقة من العاج والمينا.
- باستخدام طرف ملقط، تخفيف بلطف DP عن طريق تشغيل ذراع واحد من ملقط حول محيط الداخلية للأنسجة المعدنية. إزالة الأنسجة DP من الهيكل المعدني ونقلها إلى طبق ثالث يحتوي على 1x PBS. إزالة EOE إذا لم يكن مفصولًا بالفعل(الشكل 1E).
- نقل جميع الأنسجة DP إلى 0.25٪ التربسين-EDTA في أنبوب مخروطي 50 مل. دوامة الخليط ومكان في حمام الماء الدافئ 37 درجة مئوية لمدة 10 دقيقة. ويمكن القيام بذلك مع نفس اللقط أو مع ملقط قارورة طويلة. الأنسجة سيكون من الصعب تفريق وسوف تتطلب دوامة كل 3-4 دقيقة. لا تتجاوز 10 دقيقة التربسين منذ التربسين يمكن أن تلحق الضرر أغشية الخلايا.
- تحت غطاء محرك السيارة المعقم، أضف وسائط الثقافة المشتركة الدافئة(الجدول 1)إلى نسبة نهائية لا تقل عن 1:1 وسائط للالتربسين لتعطيل الإنزيم. نسب أكبر مقبولة إذا كان المطلوب المزيد من تشتت الأنسجة.
- ماصة وسائل الإعلام صعودا وهبوطا عدة مرات مع ماصة 10 مل لمزيد من تفريق DP في وسائل الإعلام. يجب الحرص على تجنب فقاعات كبيرة. التشتت الكامل يكاد يكون مستحيلا بسبب الطبيعة اللزجة للأنسجة. ومع ذلك، فإنه ليس من الضروري أيضا منذ الخلايا سوف تهاجر إلى الخارج من الأنسجة مرة واحدة مطلي.
- نقل 1 مل من DP مشتتة إلى كل بئر من لوحة زراعة الأنسجة 24-well(الشكل 1F).
- ضع اللوحة في حاضنة عند درجة حرارة 37 درجة مئوية واسمح للخلايا بإرفاقها وترحيلها من الأنسجة غير المشتتة لمدة 48 ساعة قبل تغيير الوسائط. الخلايا الأولية تحتاج إلى أن تكون مطلية بتركيزات عالية نسبيا من أجل الوصول إلى 85-90٪ التقاء في غضون أسبوع واحد. إذا لم يتحقق ذلك بعد أسبوع واحد، تخلص من الطبق.
- التلاعب الوراثي الاختياري لخلايا موانئ دبي
- لتغيير مسارات إشارات الخلايا، حصاد خلايا DP من الفئران بالضربة القاضية الوراثية أو من الفئران التي يحيط بها جين من الفائدة من قبل مواقع loxP. في الحالة الأخيرة، يمكن حذف الجين باستخدام أدينو فيروس-Cre-GFP (Ad-Cre-GFP) المؤتلف لإزالة الجين المحيط، كما هو موضح أدناه. استخدم Adenovirus-eGFP (Ad-eGFP) كفيروس تحكم لضمان عدم تسبب العدوى الفيروسية في استجابة خلوية.
ملاحظة: يتم التحكم في Ad-eGFP بواسطة محسن مروج CMV، وهو قوي جداً. يتم تنظيم Ad-Cre-GFP من قبل IRES ، وهي منطقة تنظيمية داخلية بين Cre و GFP ، وهي ليست قوية جدًا. وهذا يؤدي إلى سطوع أكثر إشراقا في خلايا Ad-eGFP من خلايا Ad-Cre-GFP. تأكيد مستويات العدوى المكافئة على أساس العدد الإجمالي للخلايا الفلورية، وليس على مستويات الفلورسين الخلوي. - إعداد 500 ميكرولتر من الوسائط التي تحتوي على فيروس و 10 ميكروغرام/مل من البوليبرين لكل بئر. Polybrene يساعد مع العدوى الفيروسية في الخلايا بالقرب من التقاء10. ويستند هذا البروتوكول على تعدد العدوى (MOI) من 100 لAd-eGFP و 200 Ad-Cre-GFP لعدوى الجينات فعالة مع تأثير ضئيل أو معدوم على صلاحية الخلية. عدد الخلايا المقدر هو 4 × 104 خلايا / بئر من لوحة 24-well:
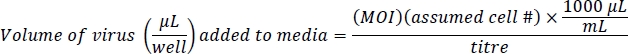
- مزيج وسائل الإعلام مع دوامة قصيرة أو pipetting وإضافة 500 ميكرولتر إلى كل بئر.
- بعد 24 ساعة، إضافة 500 ميكرولتر إضافية من الوسائط الثقافة المشتركة التي لا تحتوي على بوليبرين إضافية أو فيروس.
- بعد ما مجموعه 48 ساعة، يستنشق الوسائط التي تحتوي على الفيروسات واستبدالها بوسائط ثقافية مشاركة جديدة. عند هذه النقطة، يمكن إضافة الخلايا العصبية TG فوق مرشحات عبر ويل.
- لتغيير مسارات إشارات الخلايا، حصاد خلايا DP من الفئران بالضربة القاضية الوراثية أو من الفئران التي يحيط بها جين من الفائدة من قبل مواقع loxP. في الحالة الأخيرة، يمكن حذف الجين باستخدام أدينو فيروس-Cre-GFP (Ad-Cre-GFP) المؤتلف لإزالة الجين المحيط، كما هو موضح أدناه. استخدم Adenovirus-eGFP (Ad-eGFP) كفيروس تحكم لضمان عدم تسبب العدوى الفيروسية في استجابة خلوية.
- تشريح الخلايا العصبية الثلاثية التوائم والتشتت والطلاء
ملاحظة: في هذا البروتوكول، تم تحسين تصوير نمو النيوتر في الثقافة المشتركة مع خلايا DP باستخدام المراهقين (6 أسابيع) B6.Cg-Tg (Thy1-YFP) 16Jrs / J الفئران. الأنظمة العصبية المركزية والمحيطية للفئران Thy1-YFP لديها علامة بروتين الفلورسنت الأصفر (YFP) الذي يبدأ التعبير حول P6-P10 في الخلايا العصبية ويزيد أضعافا مضاعفة في جميع أنحاء الجهاز العصبي خلال فترة ما بعد الولادة وحياة الكبار11,12. وقد حافظت YFP وGFP تسلسل التي تسمح لهذه الأعصاب لتكون ملطخة مع الأجسام المضادة GFP، مما أدى إلى وصمة عار عموم الخلايا العصبية. في نهاية المطاف، تسمح هذه الفئران لتصور أفضل والقياس الكمي للخلايا العصبية المستخدمة ونمت في ثقافة الخلايا.- قتل فئران المراهقين مع ثاني أكسيد الكربون تليها خلع عنق الرحم.
- قطع رأس الفئران وإزالة الجلد من الجمجمة. تأكد من تضمين أعداد مكافئة من الذكور والإناث.
- أدخل طرف زوج من مقص تشريح الصغرى في قاعدة الجمجمة. قطع على طول خياطة القوس من الجمجمة(الشكل 1A).
- جعل أربعة تخفيضات أفقية صغيرة: اثنين على طول الغرز التاجية من الأذنين، واثنين على طول الغرز lambdoid في قاعدة الجمجمة. هذا يجب أن يخلق اثنين من اللوحات من العظام.
- استخدام ملقط لتقشير مرة أخرى اثنين من اللوحات من العظام. هذا يجب أن يكشف عن الدماغ.
- إزالة الدماغ. نقل الرأس إلى طبق زراعة الأنسجة مع 1x PBS ووضعها تحت المجهر.
- تحديد موقع العقدة TG، والتي يمكن رؤيتها بسهولة في القوارض13،تقع في المادة دورا بين الدماغ والعظام من عملية الفك العلوي(الشكل 1B).
- قطع الفروع الثلاثة التي تسافر إلى العينين، maxillae والفك السفلي ونقل العقد إلى 1x الباردة PBS باستخدام ملقط غرامة على التوالي الحافة. الحفاظ على الطبق الذي يحتوي على العقد TG على الجليد أثناء الحصاد.
- مرة واحدة يتم حصاد جميع حزم TG، نقل العقد إلى أنبوب مخروطي 50 مل تحتوي على 5 ملغ / مل الكولاجين المعقمة تصفية نوع الثاني باستخدام ملقط القارورة.
- دوامة الكولاجين مع حزمة TG ووضع الأنبوب في حمام مائي 37 درجة مئوية لمدة 25-30 دقيقة. خلال هذا الوقت، واتخاذ أنبوب مخروطي من حمام الماء، دوامة، والعودة إلى الحمام كل 5-10 دقيقة.
- الطرد المركزي حل الخلايا العصبية الكولاجين TG لمدة 2 دقيقة في 643 × ز.
- تحت غطاء محرك السيارة زراعة الأنسجة، يستنشق بلطف الكولاجين مع ميكروبيبيت.
- أضف 5 مل من 1٪ التربسين المعقم من النوع الثاني والدوامة. ضع الأنبوب المخروطي في حمام مائي 37 درجة مئوية لمدة 5 سنوات.
- الطرد المركزي مزيج التربسين-TG لمدة 5 دقيقة في 643 × ز. إزالة الجزء العلوي من التربسين مع ميكروبيبيت, بحيث لا تتم إزالة الخلايا العصبية TG. سيظل هناك سائل في الأنبوب
- إضافة ما يكفي من وسائل الإعلام لإلغاء تنشيط التربسين المتبقية (بنسبة 1:1 أو أقل من التربسين إلى وسائل الإعلام).
- عد عدد الخلايا وتمييع المحلول إلى 200،000 خلية / مل (250 ميكرولتر من الخلايا التي تحتوي على 50،000 خلية).
- ضع مرشحات الترانسويل المغلفة من القسم 1.2 إلى آبار مع DP.
- تمييع المحلول الذي يحتوي على الخلية بحيث يكون هناك 200,000 خلية/مل. ماسيت 250 ميكرولتر على مرشح transwell، وثقافة الخلايا في 37 درجة مئوية بين عشية وضحاها(الشكل 1F).
- في اليوم التالي، استبدال وسائل الإعلام مع 1 مل من وسائل الإعلام الثقافة المشتركة مع 1 μM uridine و 15 μM 5'-فلور-2'deoxyuridine لوقف الانتشار المفرط للخلايا المتوسطة التي قد تمنع نمو النيوتيور. اختياري: إضافة عوامل النمو أو مثبطات في هذه الوسائط إذا حاولت المزيد من التلاعب.
- ثقافة الخلايا للحصول على نقاط زمنية إضافية مطلوبة. تم تحسين هذا البروتوكول لمدة 5 أيام إجمالية من الثقافة مع تغيير الوسائط فقط في اليوم 2 لإضافة مثبطات mitotic. تتطلب الفترات الزمنية الأطول تغييرات إضافية في الوسائط.
3. جمع العينات ومعالجتها
- تلطيخ ثلاثي التوائم
- ماسيت 1 مل aliquots من 1x PBS المعقم في لوحة 24 جيدا تحت غطاء محرك السيارة زراعة الأنسجة لكل مرشح transwell ليتم معالجتها.
- إزالة السائل فوق مرشح تتم إزالتها مع ماصة 200-1000 ميكرولتر، مع الحرص على ترك طبقات الخلية سليمة. وينبغي أن تبقى الخلايا المرفقة المرفقة والخلايا غير المرفقة سوف تأتي فضفاضة خلال هذا pipetting لطيف. مرشح فراغ يمكن أن تلحق الضرر طبقة الخلية وليس من المستحسن للطموح.
- نقل مرشح إلى لوحة PBS 1x، مع التأكد من إزالة الطبقة العليا من وسائل الإعلام كما ذكر في الخطوة السابقة.
- ضع اللوحة مع جميع المرشحات والأغطية عبر ويل على الروك في 12 دورة في الدقيقة أو 40-50 دورة في الدقيقة على شاكر المداري لمدة 10 دقيقة.
- يستنشق برنامج تلفزيوني، بما في ذلك الطبقة العليا كما هو موضح أعلاه، إضافة 500 ميكرولتر من 1xPBS ووضع على الروك أو شاكر المداري لشطف إضافية 5-10 دقيقة.
- يستنشق 1x PBS مرة أخرى واستبدالها بنسبة 4٪ paraformaldehyde (PFA). استخدم ما لا يقل عن 500 ميكرولتر بحيث يتم غمر سطح الفلتر بالكامل. ضع اللوحة على الروك عند 12 دورة في الدقيقة أو شاكر مداري عند 40-50 دورة في الدقيقة في درجة حرارة الغرفة لمدة ساعة واحدة.
- إزالة PFA وشطف لوحات مرتين لمدة 5-10 دقيقة لكل منعلى الروك مع 500 ميكرولتر من 1x PBS.
- كتلة مع 10٪ الألبومين مصل البقر (BSA) + 5٪ مصل الماعز / حمار، اعتمادا على الحيوان المضيف الأجسام المضادة الثانوية، في 0.05٪ Tween-1xPBS (PBST). استخدام 450-500 ميكرولتر من المحلول بحيث يتم غمر الفلتر في السائل.
ملاحظة: في هذه المرحلة، يمكن تخزين هذه اللوحات عند 4 درجة مئوية لعدة أشهر لمعالجتها في وقت لاحق. استخدم البارفيلم لختم اللوحة لضمان عدم حدوث التبخر والتحقق بانتظام من التبخر بحيث تظل أسطح التصفية مغمورة بالمياه. - إزالة كتلة وإضافة 450-500 ميكرولتر من الأجسام المضادة الأولية في 1٪ BSA-PBST دون شطف إضافية. احتضان في 4 درجة مئوية بين عشية وضحاها، هزاز بلطف.
- إزالة محلول الأجسام المضادة الأولية وشطف مع 500 ميكرولتر من 1xPBST على الروك، 3 مرات، في درجة حرارة الغرفة
- إزالة PBST، إضافة الأجسام المضادة الثانوية واحتضان على الروك بين عشية وضحاها في 4 درجة مئوية ملفوفة في رقائق الألومنيوم لحماية الفلوروفوريات من تدهور الضوء. شطف مرة أخرى، 3 مرات، مع 1x PBST على الروك في درجة حرارة الغرفة. استبدال مع 1x PBS.
ملاحظة: عند هذه النقطة، يمكن تخزين لوحة لعدة أشهر في 4 درجة مئوية إذا ملفوفة في رقائق الألومنيوم لمنع تدهور الفلوروفور. استخدم البارفيلم لختم اللوحة لضمان عدم حدوث التبخر والتحقق بانتظام من التبخر بحيث تظل أسطح التصفية مغمورة بالمياه. فمن الأفضل أن صورة في غضون شهر واحد. - للتصوير الأمثل، والاستفادة من الخلايا العصبية الماوس Thy1-YFP مع الأجسام المضادة GFP لوصمة عار على وجه التحديد afferents الخلايا العصبية أعلى بكثير من مستويات الخلفية. استخدام المضادة Neurofilament 200 لوصمة عار بدقة الهياكل المحورية إذا كانت الفئران Thy1-YFP غير متوفرة.
- الصورة على النحو المطلوب. لا تحتاج الفلاتر إلى أن تكون مطلية ويمكن بدلاً من ذلك وضعها فوق قسيمة تغطية أو شريحة للتصوير باستخدام مجهر مقلوب.
ملاحظة: لن تحتوي مناطق عامل التصفية على بنيات afferent. التقط العديد من الصور بعمق z-stack الذي يلتقط جميع الهياكل الخالية من المباني. استخدام برنامج خياطة لتصور نمو النيوتر على مساحات واسعة، أو (يفضل) مناطق التصفية بأكملها.
- الحمض النووي الريبي والبروتين وجمع وسائل الإعلام
- في حين أن مرشحات transwell هي المعالجة ، وجمع وسائل الإعلام في RNAse / DNAse الأنابيب الخالية وتجميد للمقالات اللاحقة (ELISA ، البروتينات ، الخ).
- مباشرة بعد جمع وسائل الإعلام، aliquot العازلة الليكوت أو الراديو المناعي ة الترسيب العازلة (RIPA) العازلة مع البروتينات ومثبطات فوسفاتاز في الآبار. تم تحسين هذا البروتوكول ل100 ميكرولتر / جيد في لوحة 24-well.
- السماح للمخازن المؤقتة لخلايا lyse لمدة 5 دقيقة، ثم كشط كل مرشح مع تلميح ماصة جديدة، وجمع عينات الخلية في أنابيب RNAse/DNAse الخالية. تجميد تحليل للمقالات المستقبلية (شبه الكمية و / أو الكمية PCR، لطخة الغربية، الخ).
- الفلور المناعي الاختياري لخلايا لب الأسنان:
- رفع بلطف القسائم من القسم 1.1 مع ملقط ونقلها إلى آبار مختلفة مع 4٪ PFA ل1 ساعة مع هزاز.
- اسشق PFA وشطف التغطيات مرتين مع 1x PBS. اتبع هذا مع permeabilization، وحجب ومثبطات المناعة لعلامات الفائدة مع تقنيات الفلورة المناعية القياسية.
النتائج
هذه النتائج تبين أن TG neurite النمرة قد زاد في وجود خلايا DP الأولية في البئر الكامنة مقارنة مع السيطرة على TG النوريت أحادية الاستزراع(الشكل 2A, C). هناك بعض التقلبات من أجل التقافي في نمو النيوت. وهكذا، ينبغي إدراج الثقافة العصبية TG monoculture في جميع المقالات كتحكم للكشف عن المستويات القاعدية للنتروجين النيوريت. تم استخدام الخلايا الأولية من الماوس Tgfbr2و / و في هذا البروتوكول بعد أن تم تأكيد عدوى Ad-Cre-GFP وAd-eGFP بأعداد مكافئة من الخلايا(الشكل 2D). كان Ad-eGFP بمثابة ناقل فيروسي للمكافحة. قام Ad-Cre-GFP بحذف الجين المحيط، Tgfbr2، كما يتضح من PCR شبه الكمي(الشكل 2E). في الثقافات مع تحويل النمو مستقبلات مستقبلات بيتا 2 (Tgfbr2) حذف، انخفض نمو النيوتريت(الشكل 2A-C).
لقد استخدمنا الخلايا العصبية TG الماوس Thy1-YFP ولطختها بجسم مضاد مضاد لـ GFP أنتج صورًا محددة جدًا ومشرقة للهياكل المحورية فوق هذه الخلفية ، كما هو موضح في الشكل 2. هذا سمح تلطيخ محددة من علامات الخلايا العصبية دون تلطيخ غير محددة من الخلايا غير العصبية باستخدام أساليب ذكرت سابقا مثل الكريستال البنفسجي7. المسام الكبيرة في المرشحات يمكن autofluoresce و / أو تتراكم الأجسام المضادة الثانوية وتقليل دقة التصوير المحوري(الشكل 3). في حين أن الخلايا العصبية Thy1-YFP مع الفلورة المناعية يحسن بشكل كبير التصوير، يمكن إزالة المزيد من الخلفية مع برامج العتبات التلقائية ومن ثم قياسها كميا. نوصي أيضًا بأداء الفلور المناعي لـ Neurofilament 200 استنادًا إلى النتائج الأولية التي توصلنا إليها (غير مبين) بالإضافة إلى الآخرين8و9 إذا لم تكن فئران Thy1-YFP متوفرة.

الشكل 1: تخطيطي لتشريح الماوس للحصول على خلايا للثقافة المشتركة. (أ)رسم تخطيطي لأين يمكن قطع لفتح جمجمة الماوس وتحديد موقع الأعصاب TG، هو مبين باللون الأسود في التصوير الأخير. مقص تشير إلى مكان لإدراج نصائح مقص لقطع على طول خطوط منقط. (ب)صورة مظلمة وGFP مجتمعة تظهر ث1-YFP + TG الأعصاب حلقت باللون الأبيض. (C)تشريح TG العقديمكن بعد ذلك أن تكون مشتتة ومثقفة، كما هو مبين في F. (د)الفك السفلي للفأر P7، مع ملقط عقد الفك السفلي على اليسار والتلال العظمية السنخية التي تحتوي على أسنان لم تندلع على كل جانب من اللسان. (E)الأنسجة DP (دائرة) المستخرجة من الهيكل المعدني (أعلى)، والظهارة الخارجية المينا (أسفل) التي تمت إزالتها لتفريق ولوحة في لوحة الأنسجة المعالجة بزراعة، كما هو مبين في F. لا يتم عرض الصور على نطاق. تم تفريق خلايا DP ونمت إلى التقاء قبل إضافة الخلايا العصبية TG. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: نتائج تمثيلية من الثقافة المشتركة. (A-C) Thy1-YFP TG الخلايا العصبية كانت مثقفة في مرشحات عبر ويل مع 3 ميكرومتر المسام فوق خلايا Tgfbr2و و DP. تم إجراء تلطيخ الفلورسنت المناعي لبروتين YFP باستخدام جسم مضاد GFP لتوفير تلطيخ محدد للغاية من هياكل الخلايا العصبية على الفلتر بأكمله. تم جمع الإسقاطات القصوى لصور المجهر المُكسّم لـ 100 ميكرومتر في المكدس عند 10 x وخياطتها باستخدام برامج خياطة. أظهرت الخلايا العصبية TG بشكل ملحوظ أكثر نموًا عندما شاركت في الاستزراع مع خلايا DP(A)مما كانت عليها عندما تمت استزراعها بمفردها(C). لم يتم حث النيوريت النمو عندما كانت الخلايا العصبية المشتركة في الثقافة مع خلايا DP المصابة Ad-Cre-GFP لهدم Tgfbr2 (B). مقياس شريط = 1000 ميكرون. تظهر في(D)أعداد مكافئة من الخلايا المصابة بـ Ad-eGFP وAd-Cre-GFP . مقياس شريط = 125 ميكرون. وأكد PCR شبه الكمية Tgfbr2 KD(E). يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: الصعوبات التقنية المعروضة في التصوير الوافي. (أ)التصوير برايتفيلد من مرشحات transwell بعد تلطيخ الكريستال البنفسجي من مجموعات الخلايا. المسام الكبيرة هي السائدة. يشير السهم الكبير إلى خلية تعرض مورفولوجيا الميسينتشيم، في حين يشير السهم الصغير إلى خلية من مورفولوجيا الخلايا العصبية. الكريستال البنفسجي ملطخة كل من الخلايا دون تحيز. (ب)تلطيخ الفلورسنت المناعي من التوبولين مع الأجسام المضادة الثانوية اليكسا-488 أظهرت تلطيخ غير محددة من خلايا متعددة، مما يجعل التصوير من هياكل afferent صعبة. الصور هي تمثيلية وتكررت على عدة اختبارات لتحسين التصوير هو مبين في الشكل 2. مقياس شريط = 50 ميكرون. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
| مكون | حجم | تركيز | |
| MEM α | 440 مل | ||
| مصل الأبقار الجنيني المعطل بالحرارة | 50 مل | 10% | |
| 100x L-الجلوتامين | 5 مل | 1x | |
| البنسلين-ستريبتومسين 100 x | 5 مل | 1x | |
| تغيير وسائل الإعلام في اليوم 2 مع مثبطات mitotic في هذه التركيزات النهائية | |||
| أوريدين | 1 ميكرومتر | ||
| 5'-فلور-2'ديوكسيسوريدين | 15 ميكرومتر | ||
الجدول 1: وسائط الإعلام ذات الثقافة المشتركة.
Discussion
تتطلب الأنشطة اليومية لتجويف الفم أن تستشعر الأسنان المحفزات الخارجية والالتهاب اتّهات داخليًا من أجل السماح بالاستخدام السليم والصيانة. ومع ذلك ، لا تتوفر سوى معلومات محدودة بشأن الإشارات التي تحرك عمليات تطوير تعصيب الأسنان. يوفر هذا البروتوكول طريقة لعزل والمشاركة في زراعة خلايا DP الأولية والخلايا العصبية TG من أجل دراسة الاتصال المتبادل بين السكان. وتم تحسين العديد من المتغيرات وترك سبل البحث مفتوحة، على النحو المبين أدناه.
الضوابط مهمة في كل خطوة في هذا المنقّي. يجب تضمين مرشح ترانسويل مع الخلايا العصبية TG دون خلايا DP الأساسية في كل مقهيس لتوفير خط أساس لنمو TG. عند حذف جين مُحاط ذو أهمية مع إعادة دمج Ad-Cre-GFP، يجب استخدام فيروس تحكم يعبر فقط عن علامة الفلورسنت لتأكيد إصابة أعداد مكافئة من الخلايا. في حين أظهرنا مستويات عالية من العدوى مع الحد الأدنى من وفيات الخلايا في 100 و 200 وزارة الداخلية لAd-eGFP وAd-Cre-GFP، على التوالي، يجب على كل مختبر تحسين هذه الخطوة. لأن البروتينات الفلورية يمكن أن تعلق على المروجين مختلفة، وبالتالي تسبب التعبير التفاضلي أرقام مكافئة للخلايا المصابة، وينبغي أن تحسب الخلايا المفلورة. الكثافة الإجمالية للفلورية غير ذات صلة لأنها لا تعكس بدقة حالة العدوى. من المهم إثبات حذف الجين ، كما هو موضح مع PCR شبه الكمي في هذا البروتوكول(الشكل 2). في حين أن هذا البروتوكول لم يعالج هذا الموضوع ، أظهرت الأبحاث السابقة أنه يمكن تضمين مقالات التحكم مع خطوط الخلايا الأخرى لإثبات أن نمو النيوت رتريت هو على وجه التحديد من خلال الثقافة المشتركة مع خلايا DP8.
لأن هذا البروتوكول يستخدم الخلايا الأولية، وهناك مراحل متعددة التي يمكن إدخال التلوث. لمنع هذا، يجب أن تكون جميع الكواشف المعقمة تصفية. بالإضافة إلى ذلك، فمن المستحسن أن يتم تشغيل التجارب لكل متغير في مكررة أو ثلاثة توائم للسماح لإزالة مرشح وتعقيم بئر ملوثة دون فشل كامل للاختبار.
يجب أن تكون مغلفة Coverslips مع بولي D-ليسين و / أو بروتين مصفوفة خارج الخلية لضمان التصاق الخلية DP. في حين أن الخلايا لا نعلق في البداية، العدوى الفيروسية يسبب الوفاة رفع الخلايا على التغطيات غير المصقول ويمنع التلاعب الجيني للدراسة بالثقافة المشتركة.
ومن الثابت جيدا أن الخلايا غير العصبية، مثل خلايا شوان من العقد TG، يمكن أن تؤثر على بقاء الخلايا العصبية في الثقافة14،15،16. في هذا البروتوكول، تم تحسين بقاء الخلايا العصبية عن طريق إضافة 1 ميكرومتر يوريدين و 15 ميكرومتر 5-فلورو-2'ديوكسيسيريد. دون إضافة هذه العوامل antimitotic لمنع انتشار الخلايا Schwann، لن يحدث نمو النيوريت. ومن غير المعروف ما إذا كان وجود هذه الخلايا شوان senescent في الثقافة المشتركة تغيير الاستجابة العصبية. عزل الخلايا العصبية مورين يتطلب عدة خطوات إضافية، والبروتوكولات المتاحة للمحققين الذين يرغبون في إزالة هذا المتغير17. في كلتا الحالتين، تشتت الخلايا العصبية يحاكي إلى حد ما axotomymy ويمكن اعتبار أن تمثل إصابة / إصلاح18 أكثر من التنمية. وسوف تكون هناك حاجة إلى مزيد من الدراسات لتحديد الاختلافات بين النمو المحور يمني من اللفافات مقابل النمو المحوري من الخلايا العصبية الفردية في المختبر, وهذه لا تعالج في هذا البروتوكول.
يستغرق هذا البروتوكول 1-3 أسابيع من البداية إلى النهاية. في حين أنه من الممكن الاستفادة من خلايا DP التي تتطلب أكثر من أسبوع واحد للوصول إلى التقاء 85-90٪، فمن المستحسن أن تزرع الخلايا بكثافة عالية بما يكفي للوصول إلى التقاء في غضون أيام قليلة منذ أن تنقسم هذه الخلايا ببطء شديد بعد تلك النقطة. وهذا يتطلب عموما حوالي 5-7 P5-8 الفئران في صف واحد من لوحة 24 جيدا. تم تحسين هذا البروتوكول لما مجموعه 5 أيام من الثقافة المشتركة ، وعند هذه النقطة بدأت الوسائط ذات اللون الأحمر في نقل اللون. يجب تغيير الوسائط إذا كانت هناك رغبة في إجراء مقالات أكثر.
وقد أجريت عدة مقالات الثقافة المشتركة لإظهار نمو النيوتر استجابة لعوامل تفرزها DP تفرز العوامل مع لوحات ثقافة الأنسجة المغلفة ECM القياسية3،19،20،21 أوغرف microfluidic8،22،23. يوفر هذا البروتوكول العديد من المزايا على هذه الأساليب. على سبيل المثال، يتطلب الاستزراع المشترك لأنسجة TG وDP علاقة مكانية محددة للنويات للاستشعار والاستجابة لإشارات الباراكرين قصيرة المدى. مع ثقافة الجهاز، فقط النيوترات في العقد الأقرب إلى الأنسجة DP قادرة على الاستجابة3، في حين أن الخلايا العصبية TG المتناثرة المستخدمة في هذا البروتوكول يتم استزراعها على مسافة متساوية من خلايا DP تحتها. ثانيا، يمكن لثقافات الأعضاء إدخال نخر الأنسجة بسبب نقص الأكسجين والمواد المغذية المتاحة في عينات كبيرة24. الثقافة المشتركة للخلايا المشتتة يزيل هذا الاحتمال. بعض الثقافات المشتركة بما في ذلك الخلايا العصبية تتطلب وسائل الإعلام العصبية3,22 التي يمكن أن تلعب دورا مهيمنا في تعزيز نمو النيوت. هذا البروتوكول لا يضيف عوامل النمو العصبية محددة, مما يسمح لتقييم العلاقة المباشرة بين إشارات الباراكرين من خلايا DP الأساسية والاستجابات نمو النيوريت. ومن الجدير بالذكر أن وسائط الإعلام ذات الثقافة المشتركة تفتقر أيضا إلى مكونات لتعزيز التمعدن، مثل بيتا غليسيروفوسفات. وهذا يسمح للمحققين لتحديد كيف يمكن أن تفرز النيوتات إشارات لتشجيع التمعدن. ومع ذلك ، فإنه يحد أيضا من الدراسة فقط بما في ذلك خلايا DP أقل تميزادون دون التمعدن odontoblasts التي من شأنها أن تكون عادة موجودة في الجسم الحي.
الاستجابات Colorimetric من البحوث السابقة7،8 لا تحدد مساهمات الخلية Schwann ولا تظهر مورفولوجيا الخلايا العصبية منذ الكريستال البنفسجي غير على وجه التحديد البقع جميع الخلايا. يمكن أن يؤدي تلطيخ الفلورسنت المناعي للفلاتر إلى مستويات خلفية عالية تجعل التصوير المتألق صعبًا(الشكل 2). يسمح البروتوكول الحالي بتلطيخ دقيق للخلايا العصبية من خلال استخدام الخلايا العصبية TG Thy1-YFP والأجسام المضادة GFP ويوفر إشارة ساطعة بما يكفي لتوليد صور كبيرة للنمو في جميع أنحاء شخصية بأكملها(الشكل 3). فمن الممكن الاستفادة من علامات الخلايا العصبية الأخرى, مثل 200 المضادة للأعصاب, إذا لم تكن الفئران Thy1-YFP متوفرة.
وأخيرا، فإن استخدام خلايا DP الأولية من الفئران ذات الجينات ذات الاهتمام محاطة بمواقع loxP يسمح بحذف بسيط وفعال لهذه الجينات باستخدام نظام Ad-Cre-GFP. في الدراسات المستقبلية، يمكن استخدام نظام إعادة الدمج Ad-Cre على الخلايا العصبية TG إذا كان لديهم جين من الاهتمام تحيط به مواقع loxP. وهذا من شأنه أن يسهل الدراسات حول كيفية تأثير إشارات الباراكرين من السكان العصبية على خلايا DP ، خاصة إذا كانت خلايا DP مصنفة فوق القسائم (القسم 1.1). يمكن للدراسات المستقبلية استخدام التلاعبات الأخرى، مثل إضافة مثبطات دوائية و / أو عوامل النمو. ومن الممكن أيضا تعديل هذا البروتوكول ليشمل دراسات الهجرة باستخدام مرشحات ترانسويل المسامية 8 ميكرومتر.
في الختام، هذا transwell شارك في الثقافة فحص استخدام الخلايا العصبية وخلايا DP يسمح للتحقيق في المعلمات الخلوية متعددة. وهذا يجعل من الممكن لتوسيع الجسم من المعرفة حول التفاعلات الخلايا العصبية المتوسطة التي تعزز وتدعم تعصيب الأسنان.
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
تم دعم هذا العمل من قبل أ) المعاهد الوطنية للصحة / NIAMS (أرقام المنحR01 AR062507 و R01 AR053860 إلى RS) ، ب) جامعة ألاباما في برمنغهام التدريب الأكاديمي للبحوث الأكاديمية (DART) منحة (رقم T90DE0022736 (PI MacDougall)) إلى SBP من المعهد الوطني لبحوث الأسنان والعناية بالجمجمة / المعاهد الوطنية للصحة ، ج) مركز الجامعة العربية العربية العالمي لاضطرابات الوجه القحفي والفم والأسنان (GC-CODED) نموذج تجريبي ومنحة جدوى لSBP و d) المعهد الوطني لطب الأسنان والوجه القحفي البحوث / المعاهد الوطنية للصحة K99 DE024406 منحة إلى SBP.
Materials
| Name | Company | Catalog Number | Comments |
| 5-Fluoro-2'-deoxyuridine | Sigma-Aldrich | F0503 | Used as a mitotic Inhibitor at 15 μM concentration in co-culture media, Day 2 |
| 24 Well Cell Culture Plate | Corning | 3524 | Co-culture plate |
| Alexa-546 anti-chicken | Invitrogen | A-11040 | Secondary to stain neurite outgrowth labeled by anti-GFP antibody, 1:500 dilution |
| Anti-GFP Antibody | Aves Lab, Inc | GFP-1010 | Primary antibody to label Thy1-YFP neurons, 1:200 dilution |
| Anti-Neurofilament 200 antibody | Sigma-Aldrich | NO142 | Monoclonal primary antibody to label neurons, 1:1000 dilution, alternative if YFP mice are not available |
| B6;129- Tgfbr2tm1Karl/J | The Jackson Laboratory | 12603 | Tgfbr2f/f mouse model used for dental pulp cells in optimized protocol |
| B6.Cg-Tg(Thy1-YFP)16Jrs/J | The Jackson Laboratory | 3709 | Thy1-YFP mouse model genotype used for trigeminal neurons |
| Collagenase Type II | Millipore | 234155-100MG | Used to disperse trigeminal neurons |
| Fetal Bovine Serum | Gibco | 10437 | Additive to co-culture media |
| Fine forceps | Fine Science Tools | 11413-11 | Fine forceps for TG dissection |
| Laminin | Sigma-Aldrich | L2020 | Coats the transwell inserts at final concentration of 10 μg/ml, stock solution is assumed at 1.5 mg/ml |
| Lysis Buffer (Buffer RLT) | Qiagen | 79216 | Extracts RNA from dental pulp cells post co-culture |
| L-Glutamine | Gibco | 25030081 | Additive to co-culture media |
| Micro-dissecting scissors | Sigma-Aldrich | S3146-1EA | Dissection scissors to open skull |
| Microscope Cover Glass | Fisherbrand | 12-545-81 | Circlular coverslip for optional cell culturing and immunofluorescence processing |
| Minimal Essential Medium a | Gibco | 12571063 | Co-culture media base |
| Penicillin-Streptomycin | Gibco | 15070063 | Antibiotic additive to co-culture media |
| Phosphatase Inhibitor | Sigma-Aldrich | 04 906 837 001 | Additive to RIPA Buffer for extracting protein from dental pulp cells post co-culture |
| Polybrene | Millipore | TR-1003-G | Used to aid in dental pulp cell transfection |
| Poly-D-Lysine | Sigma-Aldrich | P7280 | Coverslip coating to aid dental pulp cellular adhesion |
| Protease Inhibitors | Millipore | 05 892 791 001 | Additive to RIPA Buffer for extracting protein from dental pulp cells post co-culture |
| RNAse/DNAse free eppendorf tubes | Denville | C-2172 | Presterilized 1.7 ml tubes for RNA, DNA or protein collection at the end of assay |
| ThinCert Cell Culture Insert | Greiner Bio-One | 662631 | Transwell inserts for trigeminal neurons in co-culture assays |
| Trypsin-EDTA (0.25%) | Gibco | 25200056 | Used fto disperse dental pulp cells |
| Trypsin Type II | Sigma-Aldrich | T-7409 | Used to disperse trigeminal neurons |
| Ultra Fine Forceps | Fine Science Tools | 11370-40 | Ultra fine forceps for dissection |
| Uridine | Sigma-Aldrich | U3750 | Used as a mitotic Inhibitor at 1 μM concentration in co-culture media, Day 2 |
| Vacuum Filtration System | Millipore | SCNY00060 | Steriflip disposable filter, 50 μm nylon net filter |
| Vial forceps | Fine Science Tools | 110006-15 | Long forceps for tissue transfer to conicals |
References
- Moe, K., Sijaona, A., Shrestha, A., Kettunen, P., Taniguchi, M., Luukko, K. Semaphorin 3A controls timing and patterning of the dental pulp innervation. Differentiation. 84 (5), 371-379 (2012).
- Kollar, E. J., Lumsden, A. G. Tooth morphogenesis: the role of the innervation during induction and pattern formation. Journal de biologie buccale. 7 (1), 49-60 (1979).
- Lillesaar, C., Fried, K. Neurites from trigeminal ganglion explants grown in vitro are repelled or attracted by tooth-related tissues depending on developmental stage. Neuroscience. 125 (1), 149-161 (2004).
- Fried, K., Lillesaar, C., Sime, W., Kaukua, N., Patarroyo, M. Target finding of pain nerve fibers: Neural growth mechanisms in the tooth pulp. Physiology & Behavior. 92 (1-2), 40-45 (2007).
- Pagella, P., Jiménez-Rojo, L., Mitsiadis, T. A. Roles of innervation in developing and regenerating orofacial tissues. Cellular and Molecular Life Sciences. 71 (12), 2241-2251 (2014).
- Luukko, K., Kettunen, P. Integration of tooth morphogenesis and innervation by local tissue interactions, signaling networks, and semaphorin 3A. Cell Adhesion & Migration. , 1-9 (2016).
- Smit, M., Leng, J., Klemke, R. L. Assay for neurite outgrowth quantification. BioTechniques. 35 (2), 254-256 (2003).
- de Almeida, J. F. A., Chen, P., Henry, M. A., Diogenes, A. Stem cells of the apical papilla regulate trigeminal neurite outgrowth and targeting through a BDNF-dependent mechanism. Tissue engineering. Part A. 20 (23-24), 3089-3100 (2014).
- Pagella, P., Miran, S., Mitsiadis, T. Analysis of Developing Tooth Germ Innervation Using Microfluidic Co-culture Devices. Journal of Visualized Experiments. (102), e53114(2015).
- Coelen, R. J., Jose, D. G., May, J. T. The effect of hexadimethrine bromide (polybrene) on the infection of the primate retroviruses SSV 1/SSAV 1 and BaEV. Archives of Virology. 75 (4), 307-311 (1983).
- Caroni, P. Overexpression of growth-associated proteins in the neurons of adult transgenic mice. Journal of neuroscience methods. 71 (1), 3-9 (1997).
- Alić, I., et al. Neural stem cells from mouse strain Thy1 YFP-16 are a valuable tool to monitor and evaluate neuronal differentiation and morphology. Neuroscience Letters. 634, 32-41 (2016).
- Howroyd, P. C. Dissection of the Trigeminal Ganglion of Nonrodent Species Used in Toxicology Studies. Toxicologic Pathology. , (2019).
- Schwieger, J., Esser, K. H., Lenarz, T., Scheper, V. Establishment of a long-term spiral ganglion neuron culture with reduced glial cell number: Effects of AraC on cell composition and neurons. Journal of Neuroscience Methods. 268, 106-116 (2016).
- Liu, R., Lin, G., Xu, H. An Efficient Method for Dorsal Root Ganglia Neurons Purification with a One-Time Anti-Mitotic Reagent Treatment. PLoS ONE. 8 (4), 60558(2013).
- Burry, R. W. Antimitotic drugs that enhance neuronal survival in olfactory bulb cell cultures. Brain Research. 261 (2), 261-275 (1983).
- Katzenell, S., Cabrera, J. R., North, B. J., Leib, D. A. Isolation, Purification, and Culture of Primary Murine Sensory Neurons. Methods in molecular biology. 1656, Clifton, N.J. 229-251 (2017).
- Dussor, G. O., Price, T. J., Flores, C. M. Activating transcription factor 3 mRNA is upregulated in primary cultures of trigeminal ganglion neurons. Molecular Brain Research. 118 (1-2), 156-159 (2003).
- Lillesaar, C., Arenas, E., Hildebrand, C., Fried, K. Responses of rat trigeminal neurones to dental pulp cells or fibroblasts overexpressing neurotrophic factors in vitro. Neuroscience. 119 (2), 443-451 (2003).
- Lillesaar, C., Eriksson, C., Fried, K. Rat tooth pulp cells elicit neurite growth from trigeminal neurones and express mRNAs for neurotrophic factors in vitro. Neuroscience Letters. 308 (3), (2001).
- Lillesaar, C., Eriksson, C., Johansson, C. S., Fried, K., Hildebrand, C. Tooth pulp tissue promotes neurite outgrowth from rat trigeminal ganglia in vitro. Journal of neurocytology. 28 (8), 663-670 (1999).
- Chmilewsky, F., Ayaz, W., Appiah, J., About, I., Chung, S. H. Nerve Growth Factor Secretion From Pulp Fibroblasts is Modulated by Complement C5a Receptor and Implied in Neurite Outgrowth. Scientific reports. 6, 31799(2016).
- Pagella, P., Neto, E., Jiménez-Rojo, L., Lamghari, M., Mitsiadis, T. A. Microfluidics co-culture systems for studying tooth innervation. Frontiers in Physiology. 5, 326(2014).
- Miura, T., Yokokawa, R. Tissue culture on a chip: Developmental biology applications of self-organized capillary networks in microfluidic devices. Development, Growth & Differentiation. 58 (6), 505-515 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved