Method Article
研究对牙髓寄生虫信号反应的神经质生长的共同培养方法
摘要
我们描述了牙髓(DP)原细胞的分离、分散和电镀,这些细胞在覆盖的透井过滤器上培养三叉(TG)神经元。DP细胞的细胞反应可以通过免疫荧光或RNA/蛋白质分析进行分析。神经元标记物与共聚焦显微镜的免疫荧光允许分析神经质外生长反应。
摘要
牙齿内侧使牙齿能够感知压力、温度和炎症,所有这些都对牙齿器官的使用和维护至关重要。没有感官内向,日常的口腔活动将造成无法弥补的损害。尽管它很重要,但内在牙齿在牙齿发育和维护中的作用在很大程度上被忽视了。几项研究表明,DP细胞分泌细胞外基质蛋白和副体信号,以吸引和引导TG斧头进入牙齿并在整个牙齿中。然而,很少有研究对DP间质和神经元亲和力之间的相声有详细的见解。为了解决知识的这一差距,研究人员已经开始利用共同文化和各种技术来研究这些相互作用。在这里,我们演示了在具有大直径孔隙的覆盖跨孔过滤器上分散的TG神经元共同培养初级DP细胞的多个步骤,以允许斧孔通过孔隙生长。利用腺病毒-Cre-GFP重组酶系统,利用具有致利益基因的初级DP细胞,利用loxP位点促进基因删除。使用 Thy1-YFP 鼠标中的 TG 神经元可以进行精确的对焦成像,通过共聚焦显微镜的表达远高于背景水平。DP反应可以通过蛋白质或RNA的收集和分析,或者通过免疫荧光染色的DP细胞镀在可移动玻璃盖玻片。介质可以使用技术,如蛋白组分析进行分析,虽然这将需要白蛋白耗尽,因为胎儿牛血清在介质中的存在。该协议提供了一个简单的方法,可以操纵研究TG神经元和DP细胞的形态、遗传和细胞骨骼反应,以响应共培养测定的受控环境。
引言
牙齿内侧使牙齿能够感知压力、温度和炎症,所有这些都对牙齿器官的使用和维护至关重要。未能感觉到与蛀牙和创伤相关的牙痛会导致疾病进展。因此,适当的内侧是正常牙齿生长、功能和护理的必要要求。
虽然大多数器官在出生时功能齐全,内在,牙齿发育延伸到成年,牙齿内侧和矿化在产后阶段1、2中协同发生。有趣的是,牙髓(DP)间质在胚胎形成过程中最初分泌排斥信号,以防止斧头进入发育中的牙齿器官,后来随着牙齿接近爆发3、4,它转移到吸引因子的分泌。在产后阶段,三角 (TG) 神经的一个发泡的斧头在牙本质沉积开始的时间渗透到牙齿中并贯穿整个牙齿(在 Pagella,P. 等人 5中进行了审查)。几项体内研究表明,神经元间质相互作用指导小鼠的牙齿内侧(在Luukko,K.等人6中回顾),但分子机制的细节很少。
细胞共培养物提供受控环境,调查人员可以在其中操纵神经元和间质体之间的相互作用。共培养实验使得深入探讨引导牙齿内向和发展的信号通路成为可能。然而,用于研究共培养细胞的几种常规方法带来了技术挑战。例如,神经酸盐生长的水晶紫罗兰染色可以非特有染色施万细胞包含在TG捆绑分散体中,并且可能存在颜色强度的峰值,反应相对较小7。微流体室提供了一个有吸引力的选择,但比跨井过滤器8,9昂贵得多,并且只允许研究神经元对DP分泌物的反应。为了解决这些问题,我们开发了一个协议,允许:a) 对TG神经质生长的精确染色和成像,以响应DP分泌物;b) 对DP细胞和/或TG神经元进行基因改造,以研究特定的信号通路,以及c)研究DP细胞对TG神经元分泌因子的反应。该协议提供了在体外共培养测定的受控环境中精确研究牙齿内侧的几个特征的能力。
研究方案
所有小鼠实验均获得UAB机构动物护理和使用委员会(IACUC)的批准。
1. 板材制备
注: 盖玻片可用于在测定结束时对 DP 细胞进行成像。在无菌组织培养罩外的所有孵育和冲皮步骤期间,确保板盖已打开,以防止样品处理过程中受到污染。
-
盖玻片准备
- 高压灭菌器圆形盖玻片。
- 过滤引擎盖下的超纯水。
- 将盖玻片转移到24孔板,并覆盖每个400μL 0.1mg/mL多D-莱辛。
- 让盖玻片在 12 rpm 时浸泡在摇臂上 5 分钟,或以 40-50 rpm 的速度将轨道摇床浸入。确保盖子已盖上以防止污染。
- 在 12 rpm 的摇臂上用过滤的超纯水冲洗盖玻片约 5 分钟,在 50 rpm 时摇动。重复。
- 让盖玻片在盖罩下干燥至少 2 小时,并盖上板盖,以方便蒸发。这些盖玻片应在 48 小时内使用。
- 免疫荧光测定结束时,在盖玻片和工艺上覆盖的DP细胞种子(第3.3节)。
-
涂层过滤器
- 稀利米宁至10微克/mL。过滤引擎盖下稀释的层压。
- 移液器 450-500 μL 的 10 μg/mL 层压宁进入 24 孔板的每个孔中。
- 将透孔滤光片(3 μm 孔隙度)放入井中,使其接触层宁溶液,并将其置于 37°C 培养箱中 2 小时或过夜。过滤孔应允许某些溶液扩散和涂覆过滤器的顶部和底部。这些过滤器应在 48 小时内使用,或在 4°C 下冷藏长达 1 周。
2. 可选遗传操作的细胞电镀
- 小鼠:可以进行DP细胞的基因改变(但不是必需的),以研究中位-神经元相互作用。有关建议的遗传变异,请参阅第 2.3 和 2.4 节。
- DP解剖、分散和电镀 (图 1)
注:对于 DP 解剖,请使用超精细、直边钳。超细边缘将允许用户在矿化结构和 DP 组织之间楔入力边缘。- 收获P5-P8小鼠。在这个阶段,牙齿应该是矿化的,根部是开放的。
- 通过体温过低麻醉新生儿,将它们放入4°C冰箱的盘子里,直到它们不再移动或对触摸做出反应。在指定设施通过斩首和按照IACUC程序对新生儿实施安乐死。
- 在 50 mL 锥形管中制备 3-5 mL 等分 0.25% 胰蛋白酶-EDTA,从每只小鼠收集 DP。这将有助于从产后小鼠的牙髓消化。如果从10只以上的产后小鼠中消化组织,请使用超过3 mL。
- 将头部放在一次性底垫上,使嘴朝向天花板,颈部底部平放在工作表面上。在锯动中使用剃刀刀片将下颌刀与刀刃分开。
- 可选择用剪刀或钳子取下舌头,以便更容易地接触到摩尔。
- 将打开的头部放在无菌纱布垫上的盘子中,并将标本放在解剖显微镜下(图1D)。
- 去除第一摩尔周围的阿尔韦拉尔骨组织。此时,下颌牙没有完全爆发。将钳子插入开路口,将组织从牙齿向口腔的布卡(气管)或语言(舌头)侧插入。最大牙齿需要完全去除牙齿周围的裂口,以便暴露和去除。
- 轻轻地将下颌和上颌第一摩尔(M1s)转移到单独的细胞培养皿,其中含有1倍磷酸盐缓冲盐水(PBS)。
- 重复 2.2.4-2.2.8,直到收集所有 M1。在收获期间,将含有 M1 的盘子放在冰上。
- 拆下每个 M1 外部周围的 Enamel 外器官 (EOE)。这也可以在步骤 2.2.11 之后完成。
- 使用一组钳子,旋转 M1,使尖尖向下,打开的根被暴露。牙齿底部将有一个椭圆形开口,不透明的DP组织被一层薄薄的牙本质和牙釉质包裹。
- 使用钳尖,通过围绕矿化组织的内周运行一个钳子,轻轻松开 DP。从矿化结构中取出DP组织,并将其转移到含有1x PBS的第三个培养皿。如果 EOE 尚未分离(图 1E)。
- 将所有DP组织转移到0.25%胰蛋白酶-EDTA在50 mL锥形管中。将混合物涡旋,放入37°C的温水浴中10分钟。这可以通过相同的钳子或长小瓶钳来完成。组织将难以分散,需要每3-4分钟涡旋一次。不要超过10分钟的胰蛋白酶化,因为胰蛋白酶可以损害细胞膜。
- 在无菌罩下,将加热共培养子培养(表1)添加到至少1:1的培养蛋白酶的最终比例中,以灭活酶。如果需要更多的组织分散,则可以接受更大的比率。
- 使用 10 mL 移液器多次上下移液介质,以进一步分散介质中的 DP。小心避免大气泡。由于组织的粘性性质,完全分散几乎是不可能的。然而,这也是没有必要的,因为细胞一旦镀层就会从组织向外迁移。
- 将分散的 DP 的 1 mL 转移到 24 孔组织培养板的每个孔(图 1F)。
- 将板置于37°C的培养箱中,让细胞在更换介质前从未分散的组织中附着并迁移48小时。原发性细胞需要在相对较高的浓度下进行镀层,以便在1周内达到85-90%的汇合。如果 1 周后无法实现,请丢弃板。
- DP细胞的可选遗传操作
- 为了改变细胞信号通路,从基因敲除小鼠或感兴趣的基因由loxP位点的小鼠身上收获DP细胞。在后一种情况下,可以使用腺病毒-Cre-GFP(Ad-Cre-GFP)重组酶来去除侧翼基因,如下所述。使用腺病毒-eGFP (Ad-eGFP) 作为控制病毒,以确保病毒感染不会引起细胞响应。
注: Ad-eGFP 由 CMV 提升剂增强器控制,该增强剂非常强大。Ad-Cre-GFP 由 IRES 监管,这是 Cre 和 GFP 之间的内部监管区域,它不是很强。这导致Ad-eGFP细胞比Ad-Cre-GFP细胞更亮荧光。根据荧光细胞的总数,而不是细胞荧光水平,确认等效的感染水平。 - 每井制备500μL的含有病毒的介质和10微克/mL的聚二苯乙烯。聚苯乙烯协助在汇合10附近的细胞中感染病毒。该协议基于Ad-eGFP的100感染(MOI)和200 Ad-Cre-GFP的多重感染(MOI),用于有效基因感染,对细胞活力的影响很小或根本没有影响。估计的细胞数是 24 孔板的 4 x 104细胞/孔:
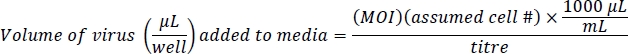
- 将介质与短暂的涡流或移液混合,并向每个井添加 500 μL。
- 24小时后,添加不含额外聚宝醇或病毒的附加培养剂500μL。
- 在总共48小时后,吸出含病毒的介质,并更换新的共培养介质。此时,TG 神经元可以添加到透井滤波器的顶部。
- 为了改变细胞信号通路,从基因敲除小鼠或感兴趣的基因由loxP位点的小鼠身上收获DP细胞。在后一种情况下,可以使用腺病毒-Cre-GFP(Ad-Cre-GFP)重组酶来去除侧翼基因,如下所述。使用腺病毒-eGFP (Ad-eGFP) 作为控制病毒,以确保病毒感染不会引起细胞响应。
- 三角神经元解剖、分散和电镀
注:在本协议中,利用青少年(6周大)B6.Cg-Tg((6周大)对与DP细胞共培养的幼子外生生长的成像进行了优化(Thy1-YFP16Jrs/J 小鼠。Thy1-YFP小鼠的中枢和周围神经系统有一个黄色荧光蛋白(YFP)标签,其表达开始于神经元中的P6-P10周围,并在产后和成人期在整个神经系统呈指数级增长11,12.YFP和GFP保存了序列,使这些神经被抗GFP抗体染色,导致泛神经染色。最终,这些小鼠允许更好的可视化和量化在细胞培养中使用的和生长的神经元。- 用二氧化碳对青少年小鼠实施安乐死,然后进行宫颈脱位。
- 把老鼠斩首,从头骨上取下皮肤。一定要包括同等数量的男性和女性。
- 将一对微解剖剪刀的尖端插入头骨底部。沿着头骨的下垂缝合线切割 (图 1A)。
- 做四个小的水平切口:两个沿冠状缝合由耳朵,两个沿羊皮缝合在头骨底部。这应该创建两个骨瓣。
- 使用钳子剥回骨头的两个皮瓣。这应该揭示大脑。
- 取出大脑。将头部转移到带有 1x PBS 的组织培养皿中,并置于显微镜下。
- 找到TG坏疽,这是很容易在啮齿动物13,位于大脑和骨之间的上颌过程的杜拉物质(图1B)。
- 切割三根行至眼睛、最大和下颌的树枝,并使用直边细钳将木条转移到冷1x PBS。在收获期间,将含有TG结条的盘子放在冰上。
- 一旦所有TG束被收获,转移神经结到50 mL锥形管含有5mg/mL无菌过滤胶原酶II类型使用小瓶钳。
- 用TG束涡旋胶原酶,将管子放入37°C水浴中25-30分钟。在此期间,将圆锥管从水浴、漩涡中拿出来,每 5-10 分钟返回浴缸。
- 在643 x g下将胶原酶-TG神经元溶液离心2分钟。
- 在组织培养罩下,用微移液器轻轻吸吸胶原酶。
- 加入5 mL的1%无菌过滤胰蛋白酶II型和涡旋。将锥形管放入 37°C 水浴中 5 分钟。
- 在643 x g下将胰蛋白酶-TG混合物离心5分钟。用微移液器去除胰蛋白酶的顶部,以便不去除TG神经元。管子里还有液体。
- 添加足够的介质以停用剩余的胰蛋白酶(以 1:1 或更低的胰蛋白酶与介质的比率)。
- 计算细胞数量,并将溶液稀释至200,000个细胞/mL(含有50,000个细胞的250μL)。
- 将涂层跨井过滤器从第 1.2 节放入带 DP 的井中。
- 稀释含细胞的溶液,使其有200,000个细胞/mL。将250μL移液器移至透井过滤器上,并在37°C过夜培养细胞(图1F)。
- 第二天,用1μM尿氨酸和15μM 5'-氟-2'脱氧尿素替换1mL共培养基培养基,以阻止可能防止神经质外生长的中生细胞的过度增殖。可选:如果尝试进一步操作,在此介质中添加生长因子或抑制剂。
- 为其他所需时间点培养单元格。该协议针对 5 天的总培养日进行了优化,仅在第 2 天更改了介质以添加线粒抑制剂。较长的时间段将需要其他介质更改。
3. 样品收集和处理
- 三角染色
- 将无菌 1x PBS 的移液器 1 mL 等分液放入组织培养罩下的 24 孔板中,以便处理每个跨井过滤器。
- 用 200-1,000 μL 移液器取出过滤器顶部的液体,小心保持细胞层完好无损。附加的细胞应保持连接,未连接的细胞将在此温和移液过程中松动。真空过滤器可能会损坏细胞层,不建议用于吸入。
- 将滤光片转移到 1x PBS 板,确保删除上一步中提到的介质顶层。
- 将带有所有跨井滤清器和盖子的板以 12 rpm 或 40-50 rpm 的速度放在轨道摇床上 10 分钟。
- 吸气(包括上述顶层)加入 500 μL 的 1xPBS,并放置在摇臂或轨道摇摇器上,额外冲洗 5-10 分钟。
- 再次吸气 1x PBS,用 4% 的甲醛 (PFA) 替换。使用至少 500 μL,使整个过滤器表面被淹没。将板置于 12 rpm 的摇臂上,或在室温下以 40-50 rpm 的速度将板放在轨道摇臂上 1 小时。
- 在 500 μL 为 1x PBS 的摇臂上,取出 PFA 并冲洗板两次,每次冲洗 5-10 分钟。
- 块与10%牛血清白蛋白(BSA) = 5%山羊/驴血清,取决于二级抗体宿主动物,在0.05%补间-1xPBS(PBST)。使用 450-500 μL 溶液,使过滤器浸入液体中。
注:在此阶段,这些板可在4°C下储存数月,稍后处理。使用副薄膜密封板,以确保不会发生蒸发,并定期检查是否蒸发,使过滤表面保持淹没状态。 - 取出块,在1%BSA-PBST中加入450-500μL的原抗体,无需额外的冲洗。在4°C孵育过夜,轻轻摇动。
- 去除原抗体溶液,在室温下用500μL的1xPBST在摇杆上冲洗3次
- 去除PBST,加入二级抗体,并在4°C包裹在铝箔的摇臂上孵育过夜,以保护荧光团免受光降解。再次冲洗,3次,在室温下用1x PBST在摇臂上。替换为 1x PBS。
注:此时,如果用铝箔包裹,以防止荧光降解,板可以在4°C下储存数月。使用副薄膜密封板,以确保不会发生蒸发,并定期检查是否蒸发,使过滤表面保持淹没状态。最好在一个月内进行图像拍摄。 - 为了获得最佳成像效果,利用Thy1-YFP小鼠神经元具有抗GFP抗体,专门染色远高于背景水平的神经元。如果没有 Thy1-YFP 小鼠,请使用抗神经丝 200 精确染色斧头结构。
- 根据需要显示图像。过滤器不需要镀层,而是可以放置在盖玻片或幻灯片上,以便用倒置显微镜进行成像。
注: 滤波器区域将不包含一个可处理的结构。使用 z 堆栈深度拍摄多个图像,以捕获所有可处理结构。使用拼接软件在大面积或(最好)整个过滤区域上可视化神经质生长。
- RNA、蛋白质和介质收集
- 当透井滤波器进行处理时,在无RNA/DNA管中收集介质,并冷冻以进行以后的检测(ELISA、蛋白质组学等)。
- 在介质收集后,无分量裂化缓冲液或无线电免疫沉淀测定(RIPA)缓冲液与蛋白酶和磷酸酶抑制剂进入井中。该协议针对 24 孔板中的 100 μL/孔进行了优化。
- 允许缓冲液将细胞分液5分钟,然后用新的移液器尖端刮擦每个过滤器,并在无RNA/DNA管中收集细胞样本。冻结未来测定的莱沙(半定量和/或定量PCR、西带子等)。
- 牙髓细胞的可选免疫荧光:
- 用钳子轻轻提起第 1.1 节的盖玻片,并将其转移到不同的井中,用 4% PFA 摇动 1 小时。
- 吸气 PFA,用 1x PBS 冲洗盖玻片两次。通过标准免疫荧光技术对感兴趣的标记物进行渗透、阻断和免疫荧光。
结果
这些结果表明,与TG神经酸盐单一培养的控制相比,TG神经酸盐出生长在基础井中原DP细胞的存在下增加(图2A,C)。在神经质外生长中有一些测定到测定的变异性。因此,TG神经元单一培养应包含在所有测定中,作为检测神经质外生长基底水平的控制。在Ad-Cre-GFP和Ad-eGFP感染后,Tgfbr2f/f小鼠的初级细胞被用于此协议(图2D)。Ad-eGFP 作为控制病毒载体。Ad-Cre-GFP删除了侧翼基因Tgfbr2,半定量PCR(图2E)证明了这一点。在转化生长因子β受体2(Tgfbr2)缺失的培养物中,神经素生长减少(图2A-C)。
我们使用Thy1-YFP小鼠TG神经元,并染色他们与抗GFP抗体,产生非常具体和明亮的图像的斧状结构远高于这个背景,如图2所示。这允许神经元标记的特定染色,没有非神经细胞的非特异性染色,利用先前报告的方法,如水晶紫罗兰7。滤芯中的大孔可以自荧光和/或积累二级抗体,降低斧头成像的精度(图3)。虽然具有免疫荧光的Thy1-YFP神经元极大地改善了成像,但可以使用自动阈值软件去除进一步的背景,然后进行量化。我们还建议根据我们的初步发现(未显示)以及其他8,9,如果Thy1-YFP小鼠不可用,对Neurofilament 200进行免疫荧光。

图1:小鼠解剖的示意图,以获得用于共培养的细胞。(A) 在上次描述中以黑色显示的图表,用于切割何处打开鼠标头骨并定位 TG 神经。剪刀指示沿虚线插入剪刀尖的位置。(B) 一个结合的暗场和GFP图像,显示Thy1-YFP®TG神经在白色中盘旋。(C) 分离的 TG 帮派然后可以分散和培养,如F所示。(D) P7鼠标的下颌,钳子在左侧拿着下颌骨,而在舌头两侧都有未爆牙的海角骨脊。(E) 从矿化结构(顶部)中提取的DP组织(圆形),以及被移除以分散和板在组织培养处理板中的釉质外皮(底部),如F所示。图像不会显示缩放。DP细胞在添加TG神经元之前被分散并生长到汇合。请点击此处查看此图的较大版本。

图2:共同文化的代表制。(A-C)Thy1-YFP TG神经元在跨井滤波器中培养,在主Tgfbr2f/f DP细胞上具有3μm孔隙。使用抗GFP抗体对YFP蛋白进行免疫荧光染色,在整个过滤器上提供神经元结构的高度特异性染色。收集10倍z-stack共聚焦显微镜图像的最大投影10倍,并拼接拼接软件。TG神经元在与DP细胞(A)共同培养时比单独培养(C)时表现出更多的生长。当神经元与感染Ad-Cre-GFP的DP细胞共同培养以击倒Tgfbr2 (B)时,神经质细胞的产生不会引起。刻度条 = 1,000 μm。感染 Ad-eGFP 和 Ad-Cre-GFP 的细胞数量相等,如 (D) 所示。刻度条 = 125 μm。半定量PCR证实了Tgfbr2 KD (E).请点击此处查看此图的较大版本。

图3:在一次成像中呈现的技术困难。(A) 在细胞群的水晶紫染色后,对透水过滤器进行光明场成像。大毛孔很普遍。大箭头指出一个显示等态形态的细胞,而小箭头指向神经元形态的细胞。水晶紫罗兰无偏见地污染了两个细胞。(B) 用Alexa-488二次抗体对β3图布林的免疫荧光染色显示多细胞非特异性染色,使得对发泡结构的成像变得困难。图像具有代表性,在多个检测中重复,以优化如图 2所示的成像。刻度条 = 50 μm。请点击此处查看此图的较大版本。
| 组件 | 体积 | 浓度 | |
| MEM | | 440 mL | ||
| 加热灭活胎儿牛血清 | 50 mL | 10% | |
| 100x L-谷氨酰胺 | 5 mL | 1x | |
| 青霉素-链霉素 100 x | 5 mL | 1x | |
| 在第2天用线粒抑制剂改变介质,这些最终浓度 | |||
| 乌里丁 | 1 μM | ||
| 5'-氟-2'脱氧尿氨酸 | 15 μM | ||
表1:共同文化媒体。
讨论
口腔的日常活动要求牙齿感知外部刺激和内部炎症,以便正确使用和维护。然而,关于驱动牙齿内侧发育过程的信号,只有有限的信息可用。该协议提供了一种分离和共同培养原DP细胞和TG神经元的方法,以研究两个群体之间的交叉通信。如下所述,对几个变量进行了优化,并留下了进一步的研究渠道。
控制在本次测定的每一步都很重要。每个测定中都应包含具有无基础DP细胞的TG神经元的转井滤波器,为TG生长提供基线。当删除带有 Ad-Cre-GFP 重组酶的侧翼基因时,应使用仅表示荧光标记的控制病毒来确认已感染等效数量的细胞。尽管我们分别在 Ad-eGFP 和 Ad-Cre-GFP 的 100 和 200 MOI 中证明了高感染率,但每个实验室都应优化此步骤。由于荧光蛋白可以附着在不同的启动子上,因此会导致被感染的表达等价物的差分,因此应计算荧光细胞。荧光的整体强度是无关紧要的,因为它不能准确地反映感染状态。证明基因的删除很重要,如本协议中半定量PCR所示(图2)。虽然此协议没有涉及这个主题,但先前的研究表明,可以包括与其他细胞系的对照测定,以证明神经细胞外生长是由与DP细胞8共培养的。
由于此协议使用原细胞,因此可以引入污染的多个阶段。为了防止这种情况,所有试剂都应无菌过滤。此外,建议对每个变量进行重复或三次试验,以便在完全失败的情况下去除过滤器和灭菌受污染的油井。
盖玻片必须涂有多D-裂解素和/或细胞外基质蛋白,以确保DP细胞粘附。虽然细胞最初附着,但病毒感染会导致细胞在未覆盖的盖玻片上起死,并防止共同培养测定的基因操作。
众所周知,非神经元细胞,如来自TG神经质的Schwan细胞,可以影响培养14、15、16中神经元细胞的生存。在此协议中,通过添加1μM尿氨酸和15μM 5-氟-2'脱氧尿氨酸来优化神经元存活率。如果不添加这些抗米剂来抑制Schwann细胞增殖,神经质外生长就不会发生。不知道这些衰老的施万细胞在共培养中的存在是否会改变神经元的反应。隔离鼠神经元需要几个额外的步骤,并且协议可供想要删除这个变量17的研究者使用。在这两种情况下,神经元分散在某种程度上模仿一个轴切除术,可以被认为是代表伤害/修复18比发展。需要进一步的研究来确定从分片体到体外单个神经元的异体生长与体外神经元的异形生长之间的差异,这些在协议中没有得到解决。
该协议从开始到结束需要 1-3 周的时间。虽然可以使用需要超过1周的DP细胞达到85-90%的汇合,但建议以足够高的密度播种细胞,使其在几天内达到汇合,因为这些细胞分裂得非常缓慢超过该点。这通常需要大约5-7 P5-8小鼠每行24孔板。该协议针对总共 5 天的共培养进行了优化,此时带苯酚红色的介质开始改变颜色。如果需要较长的检测,应更换介质。
已进行若干共培养测定,以证明神经素生长,以响应DP分泌因子分泌的因素与标准ECM涂层组织培养板3,19,20,21或微流体室8,22,23。与这些方法的优点时,此协议具有几个优点。例如,TG神经和DP组织共培养需要一个特定的空间关系,以便神经酸盐感知和响应短程对羟基苯甲酸酯信号。在器官培养中,只有最接近DP组织的神经酸盐能够响应3,而该协议中使用的分散的TG神经元与下面的DP细胞的距离相等。其次,器官培养可以引入组织坏死,由于缺乏氧气和营养物质,在大样本24。分散细胞的共同培养消除了这种可能性。一些共体培养物,包括神经元,需要神经元介子3,22,它可以在促进神经质外生长中起主导作用。该协议不添加神经元特定的生长因子,从而允许评估来自底层DP细胞的副体信号与神经质生长反应之间的直接关系。值得注意的是,共培养介质也缺乏促进矿化的成分,如β-糖酸醇。这使得研究人员能够确定神经酸盐如何分泌信号以鼓励矿化。然而,它也限制了研究,只包括分化程度较低的DP细胞,而没有通常存在于体内的矿化性odontoblast。
先前研究7,8的色度反应没有划定施万细胞的贡献,也没有显示神经元形态,因为水晶紫罗兰非特有污渍所有细胞。过滤器的免疫荧光染色会导致高背景水平,使成像困难(图2)。本协议允许利用Thy1-YFP TG神经元和抗GFP抗体精确染色神经元,并提供足够明亮的信号,以在整个图中生成大的增长图像(图3)。如果Thy1-YFP小鼠不可用,可以使用其他神经元标记,如抗神经纤维200。
最后,使用具有对基基因的小鼠的初级DP细胞,利用Ad-Cre-GFP系统,可以简单有效地删除这些基因。在未来的研究中,Ad-Cre重组酶系统可用于TG神经元,如果他们有一个感兴趣的基因,两侧由loxP位点。这将有助于研究来自神经元种群的副细胞信号如何影响DP细胞,特别是如果DP细胞被播种在盖玻片上(第1.1节)。未来的研究可以利用其他操作,如添加药理抑制剂和/或生长因子。也可以修改此协议,通过使用 8 μm 孔隙透孔滤波器来包括迁移算例。
总之,这种利用神经元和DP细胞的跨井共培养测定允许研究多个细胞参数。这使得可以扩大有关促进和支持牙齿内侧作用的中位神经相互作用的知识体。
披露声明
作者没有什么可透露的。
致谢
这项工作得到了国家卫生研究院/NIAMS(授予编号R01 AR062507和R01 AR053860至RS)的支持,b) 阿拉巴马大学伯明翰牙科学术研究培训(DART)赠款(编号T90DE022736(PI MacDougall)从国家牙科和颅面研究所/国家卫生研究院向SBP提供, c) UAB全球颅面、口腔和牙科疾病中心(GC-CODE)试点和可行性赠款给SBP和d)国家牙科和颅面研究所研究/国家卫生研究院K99 DE024406赠款给SBP。
材料
| Name | Company | Catalog Number | Comments |
| 5-Fluoro-2'-deoxyuridine | Sigma-Aldrich | F0503 | Used as a mitotic Inhibitor at 15 μM concentration in co-culture media, Day 2 |
| 24 Well Cell Culture Plate | Corning | 3524 | Co-culture plate |
| Alexa-546 anti-chicken | Invitrogen | A-11040 | Secondary to stain neurite outgrowth labeled by anti-GFP antibody, 1:500 dilution |
| Anti-GFP Antibody | Aves Lab, Inc | GFP-1010 | Primary antibody to label Thy1-YFP neurons, 1:200 dilution |
| Anti-Neurofilament 200 antibody | Sigma-Aldrich | NO142 | Monoclonal primary antibody to label neurons, 1:1000 dilution, alternative if YFP mice are not available |
| B6;129- Tgfbr2tm1Karl/J | The Jackson Laboratory | 12603 | Tgfbr2f/f mouse model used for dental pulp cells in optimized protocol |
| B6.Cg-Tg(Thy1-YFP)16Jrs/J | The Jackson Laboratory | 3709 | Thy1-YFP mouse model genotype used for trigeminal neurons |
| Collagenase Type II | Millipore | 234155-100MG | Used to disperse trigeminal neurons |
| Fetal Bovine Serum | Gibco | 10437 | Additive to co-culture media |
| Fine forceps | Fine Science Tools | 11413-11 | Fine forceps for TG dissection |
| Laminin | Sigma-Aldrich | L2020 | Coats the transwell inserts at final concentration of 10 μg/ml, stock solution is assumed at 1.5 mg/ml |
| Lysis Buffer (Buffer RLT) | Qiagen | 79216 | Extracts RNA from dental pulp cells post co-culture |
| L-Glutamine | Gibco | 25030081 | Additive to co-culture media |
| Micro-dissecting scissors | Sigma-Aldrich | S3146-1EA | Dissection scissors to open skull |
| Microscope Cover Glass | Fisherbrand | 12-545-81 | Circlular coverslip for optional cell culturing and immunofluorescence processing |
| Minimal Essential Medium a | Gibco | 12571063 | Co-culture media base |
| Penicillin-Streptomycin | Gibco | 15070063 | Antibiotic additive to co-culture media |
| Phosphatase Inhibitor | Sigma-Aldrich | 04 906 837 001 | Additive to RIPA Buffer for extracting protein from dental pulp cells post co-culture |
| Polybrene | Millipore | TR-1003-G | Used to aid in dental pulp cell transfection |
| Poly-D-Lysine | Sigma-Aldrich | P7280 | Coverslip coating to aid dental pulp cellular adhesion |
| Protease Inhibitors | Millipore | 05 892 791 001 | Additive to RIPA Buffer for extracting protein from dental pulp cells post co-culture |
| RNAse/DNAse free eppendorf tubes | Denville | C-2172 | Presterilized 1.7 ml tubes for RNA, DNA or protein collection at the end of assay |
| ThinCert Cell Culture Insert | Greiner Bio-One | 662631 | Transwell inserts for trigeminal neurons in co-culture assays |
| Trypsin-EDTA (0.25%) | Gibco | 25200056 | Used fto disperse dental pulp cells |
| Trypsin Type II | Sigma-Aldrich | T-7409 | Used to disperse trigeminal neurons |
| Ultra Fine Forceps | Fine Science Tools | 11370-40 | Ultra fine forceps for dissection |
| Uridine | Sigma-Aldrich | U3750 | Used as a mitotic Inhibitor at 1 μM concentration in co-culture media, Day 2 |
| Vacuum Filtration System | Millipore | SCNY00060 | Steriflip disposable filter, 50 μm nylon net filter |
| Vial forceps | Fine Science Tools | 110006-15 | Long forceps for tissue transfer to conicals |
参考文献
- Moe, K., Sijaona, A., Shrestha, A., Kettunen, P., Taniguchi, M., Luukko, K. Semaphorin 3A controls timing and patterning of the dental pulp innervation. Differentiation. 84 (5), 371-379 (2012).
- Kollar, E. J., Lumsden, A. G. Tooth morphogenesis: the role of the innervation during induction and pattern formation. Journal de biologie buccale. 7 (1), 49-60 (1979).
- Lillesaar, C., Fried, K. Neurites from trigeminal ganglion explants grown in vitro are repelled or attracted by tooth-related tissues depending on developmental stage. Neuroscience. 125 (1), 149-161 (2004).
- Fried, K., Lillesaar, C., Sime, W., Kaukua, N., Patarroyo, M. Target finding of pain nerve fibers: Neural growth mechanisms in the tooth pulp. Physiology & Behavior. 92 (1-2), 40-45 (2007).
- Pagella, P., Jiménez-Rojo, L., Mitsiadis, T. A. Roles of innervation in developing and regenerating orofacial tissues. Cellular and Molecular Life Sciences. 71 (12), 2241-2251 (2014).
- Luukko, K., Kettunen, P. Integration of tooth morphogenesis and innervation by local tissue interactions, signaling networks, and semaphorin 3A. Cell Adhesion & Migration. , 1-9 (2016).
- Smit, M., Leng, J., Klemke, R. L. Assay for neurite outgrowth quantification. BioTechniques. 35 (2), 254-256 (2003).
- de Almeida, J. F. A., Chen, P., Henry, M. A., Diogenes, A. Stem cells of the apical papilla regulate trigeminal neurite outgrowth and targeting through a BDNF-dependent mechanism. Tissue engineering. Part A. 20 (23-24), 3089-3100 (2014).
- Pagella, P., Miran, S., Mitsiadis, T. Analysis of Developing Tooth Germ Innervation Using Microfluidic Co-culture Devices. Journal of Visualized Experiments. (102), e53114(2015).
- Coelen, R. J., Jose, D. G., May, J. T. The effect of hexadimethrine bromide (polybrene) on the infection of the primate retroviruses SSV 1/SSAV 1 and BaEV. Archives of Virology. 75 (4), 307-311 (1983).
- Caroni, P. Overexpression of growth-associated proteins in the neurons of adult transgenic mice. Journal of neuroscience methods. 71 (1), 3-9 (1997).
- Alić, I., et al. Neural stem cells from mouse strain Thy1 YFP-16 are a valuable tool to monitor and evaluate neuronal differentiation and morphology. Neuroscience Letters. 634, 32-41 (2016).
- Howroyd, P. C. Dissection of the Trigeminal Ganglion of Nonrodent Species Used in Toxicology Studies. Toxicologic Pathology. , (2019).
- Schwieger, J., Esser, K. H., Lenarz, T., Scheper, V. Establishment of a long-term spiral ganglion neuron culture with reduced glial cell number: Effects of AraC on cell composition and neurons. Journal of Neuroscience Methods. 268, 106-116 (2016).
- Liu, R., Lin, G., Xu, H. An Efficient Method for Dorsal Root Ganglia Neurons Purification with a One-Time Anti-Mitotic Reagent Treatment. PLoS ONE. 8 (4), 60558(2013).
- Burry, R. W. Antimitotic drugs that enhance neuronal survival in olfactory bulb cell cultures. Brain Research. 261 (2), 261-275 (1983).
- Katzenell, S., Cabrera, J. R., North, B. J., Leib, D. A. Isolation, Purification, and Culture of Primary Murine Sensory Neurons. Methods in molecular biology. 1656, Clifton, N.J. 229-251 (2017).
- Dussor, G. O., Price, T. J., Flores, C. M. Activating transcription factor 3 mRNA is upregulated in primary cultures of trigeminal ganglion neurons. Molecular Brain Research. 118 (1-2), 156-159 (2003).
- Lillesaar, C., Arenas, E., Hildebrand, C., Fried, K. Responses of rat trigeminal neurones to dental pulp cells or fibroblasts overexpressing neurotrophic factors in vitro. Neuroscience. 119 (2), 443-451 (2003).
- Lillesaar, C., Eriksson, C., Fried, K. Rat tooth pulp cells elicit neurite growth from trigeminal neurones and express mRNAs for neurotrophic factors in vitro. Neuroscience Letters. 308 (3), (2001).
- Lillesaar, C., Eriksson, C., Johansson, C. S., Fried, K., Hildebrand, C. Tooth pulp tissue promotes neurite outgrowth from rat trigeminal ganglia in vitro. Journal of neurocytology. 28 (8), 663-670 (1999).
- Chmilewsky, F., Ayaz, W., Appiah, J., About, I., Chung, S. H. Nerve Growth Factor Secretion From Pulp Fibroblasts is Modulated by Complement C5a Receptor and Implied in Neurite Outgrowth. Scientific reports. 6, 31799(2016).
- Pagella, P., Neto, E., Jiménez-Rojo, L., Lamghari, M., Mitsiadis, T. A. Microfluidics co-culture systems for studying tooth innervation. Frontiers in Physiology. 5, 326(2014).
- Miura, T., Yokokawa, R. Tissue culture on a chip: Developmental biology applications of self-organized capillary networks in microfluidic devices. Development, Growth & Differentiation. 58 (6), 505-515 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。