Method Article
שיטת שיתוף התרבות כדי ללמוד Neurite Outgrowth בתגובה שיניים זולה הקרנף סימנים
In This Article
Summary
אנו מתארים את הבידוד, פיזור וציפוי של התאים הראשוניים של שיניים (DP) בתאי הראשי עם מסננים (TG) נוירונים תרבותי על גבי מסנני transwell יטב. התגובות הסלולר של תאים DP ניתן לנתח עם immunofluorescence או בניתוח RNA/חלבון. אימונואופלונציה של סמנים עצביים עם מיקרוסקופ קונפוקלית מאפשר ניתוח של תגובות neurite מוצלח.
Abstract
אינבציה שן מאפשר לשיניים לחוש לחץ, טמפרטורה ודלקת, כולם חיוניים לשימוש ותחזוקה של איבר השן. ללא שימור חושי, פעילות שבעל פה יומית. תגרום נזק בלתי הפיך למרות חשיבותו, תפקידי האינבציה בהתפתחות השן ותחזוקתו התעלמו במידה רבה. מספר מחקרים הוכיחו כי תאים DP להפריש חלבונים מטריקס מטריצות ואותות הפרדרין כדי למשוך ולהנחות TG אקסונים לתוך ולאורך השן. עם זאת, מחקרים מעטים סיפקו תובנה מפורטת לתוך הטבלת הצלבות בין מספר העקורים לבין האפיפראנטים העצביים. כדי לטפל בפער זה בידע, החוקרים החלו לנצל שיתוף תרבויות ומגוון של טכניקות כדי לחקור את האינטראקציות האלה. כאן, אנו להדגים את השלבים מרובים מעורבים בתאי DP הראשי של העקורים עם הנוירונים TG התפזרו על מסנן מעבר היטב עם נקבוביות בקוטר גדול כדי לאפשר צמיחה סיבי דרך הנקבוביות. בתאי DP העיקרי עם הגן של הריבית מוקף האתרים loxP היו מנוצלים כדי להקל על מחיקת גנים באמצעות אדנווירוס-recombinase GFP מערכת. שימוש בנוירונים TG מהעכבר Thy1-yfp מותר לדימות מדויק של כלי לימפה, עם ביטוי היטב מעל רמות הרקע על ידי המיקרוסקופיה. תגובות DP ניתן לחקור באמצעות חלבון או או RNA איסוף וניתוח, או לחילופין, באמצעות כתמים immunofluorescent של תאים DP מצופה על כיסוי זכוכית נשלפת. מדיה ניתן לנתח באמצעות טכניקות כגון ניתוח פרוטאומית, למרות זה ידרוש המחסור אלבומין בשל נוכחותם של סרום העוברי העובר במדיה. פרוטוקול זה מספק שיטה פשוטה שיכולה להיות מניפולציות כדי ללמוד את התגובות מורפולוגית, גנטית, השלד ואת התשובות של הנוירונים TG ותאי DP בתגובה לסביבה מבוקרת של שיתוף תרבות שיטת.
Introduction
אינבציה שן מאפשר לשיניים לחוש לחץ, טמפרטורה ודלקת, כולם חיוניים לשימוש ותחזוקה של איבר השן. אי תחושה של כאב שיניים הקשורים עששת וטראומה מוביל התקדמות המחלה. לכן, אינבציה נכונה היא דרישה לצמיחה שן רגילה, תפקוד וטיפול.
בעוד רוב האיברים הם פונקציונליים לחלוטין innervated על ידי זמן הלידה, התפתחות שיניים מרחיב לחיי מבוגרים, עם אינבציה שן ומינרליזציה המתרחשים בקונצרט במהלך השלבים לידה1,2. באופן מעניין, עיסת שיניים (DP) מזנכימה בתחילה מפריש אותות דוחה במהלך embryogenesis כדי למנוע כניסה אקסון לתוך האיבר המתפתח השיניים, אשר מאוחר יותר משתנה הפרשה של גורמים מושכים כמו השן התקרבות התפרצות3,4. במהלך השלבים לאחר הלידה, כלי לימפה אקסונים מתוך העצבים המשולש (TG) לחדור לתוך ולאורך השן סביב הזמן דנטט התצהיר מתחיל (נבדקו pagella, P. et al.5). מספר מחקרים vivo הוכיחו כי התקשורת העצבית-mesenchymal מדריך שיניים מורה בעכברים (נבדקו ב Luukko, K. et al.6), אבל כמה פרטים של מנגנונים מולקולריים זמינים.
שיתוף התרבויות הסלולארי מספק סביבות מבוקרות שבהן החוקרים יכולים להשפיע על האינטראקציות בין אוכלוסיות נירואליות לבין אוכלוסיית מסנצ'יאל. שיתוף האמנות ניסויים לאפשר להתעמק עמוק יותר לתוך משעולים איתות המנחה השן ופיתוח. עם זאת, כמה מהשיטות הקונבנציונליות המשמשות לחקר התאים בתרבות המשותף מציגים אתגרים טכניים. למשל, כתמים קריסטל סגול של neurite מוצלח יכול לא במיוחד הכתמים שתאי schwann כלולים בדיסיות הצרור TG, וייתכנו פסגות בחוזק צבע עם תגובות קטנות יחסית7. חדרי מיקרופלואידיג מציעים אופציה אטרקטיבית, אבל הם הרבה יותר יקרים מאשר מסנני העברה של8,9 ורק לאפשר את החקירה של תגובות נוירואליות הפרשות העקורים. כדי לטפל בנושאים אלה, פיתחנו פרוטוקול המאפשר: a) כתמים מדויקים והדמיה של TG neurite מוצלח בתגובה הפרשות DP, b) שינוי גנטי של תאים dp ו/או הנוירונים TG לחקור מסלולים מסוימים איתות, ו c) חקירה של תגובות תא DP הגורמים מופרש על ידי TG נוירונים. פרוטוקול זה מספק את היכולת לחקור במדויק מספר תכונות של אינבציה שן בסביבה מבוקרת של שיתוף תרבות חוץ-גופית.
Protocol
כל הניסויים עם עכברים אושרו על ידי טיפול בעלי חיים מוסדיים UAB והשתמש הוועדה (IACUC).
1. הכנת צלחות
הערה: ניתן להשתמש בכיסויים לתאי DP של תמונה בסוף הטיפול. להיות בטוח מכסה הצלחת הוא על במהלך כל הדגירה ושטיפה צעדים מחוץ המכסה התרבות סטרילי רקמה כדי למנוע זיהום במהלך עיבוד לדוגמה.
-
הכנה לכיסויים
- . כיסוי מעגלי אוטוקלב
- . לסנן מים מתחת למכסה המנוע
- להעביר את הכיסויים לצלחת 24-באר ולכסות כל אחד עם 400 μL של 0.1 mg/mL פולי-D-ליזין.
- אפשר שמיכות להשרות, שקוע עבור 5 דקות, על נדנדה ב 12 סל ד או שייקר מסלולית ב 40-50 סל ד. ודא שהמכסה מופעל כדי למנוע זיהום.
- לשטוף את שמיכות עם מים מסוננים באולטרטהור עבור כ 5 דקות על הנדנדה ב 12 סל ד או שייקר ב 50 סל ד. חזור על.
- אפשר את הכיסויים להתייבש לפחות 2 h מתחת למכסה המנוע עם מכסה הצלחת כדי להקל על התאיידות. שמיכות אלה יש להשתמש בתוך 48 h.
- זרעי העקורים תאים על גבי שמיכות ותהליך בסוף השיטת הimmunofluorescence (סעיף 3.3).
-
מסנני ציפויים
- דלל את הלמינציה ל -10 μg/mL. מסננים את הלמינציה המדוללת מתחת למכסה המנוע.
- פיפטה 450-500 μL של 10 μg/mL למינציה לכל באר של צלחת 24.
- מסנן מיקום, 3 יקרומטר, בבאר כך שהוא מקשר את התמיסה למינציה ולהשאיר אותו בחממה 37 ° c עבור 2 h או בן לילה. מסנן נקבוביות צריך לאפשר חלק מהפתרון לפזר ומעילים הן החלק העליון והתחתון של המסנן. מסננים אלה יש להשתמש בתוך 48 h או להיות בקירור ב 4 ° צ' עבור עד 1 שבוע.
2. ציפוי תאים עם מניפולציה גנטית אופציונלית
- עכברים: שינוי גנטי של תאים DP ניתן לבצע (אך אינו נדרש) כדי ללמוד את האינטראקציות הנוירואליות. ראה סעיפים 2.3 ו 2.4 עבור וריאציות גנטיות מוצעים.
- ניתוח, פיזור וציפוי של DP (איור 1)
הערה: עבור ניתוח DP, השתמש אולטרה דק, מלקחיים ישר בקצה. הקצוות דקים במיוחד יאפשר למשתמש לטריז את הקצה הכוח בין המבנה מינרליזציה ואת רקמת DP.- הקציר P5-P8 עכברים. בשלב זה, השיניים צריכות להיות מינראליזציה, והשורש פתוח.
- הneonates באמצעות היפותרמיה באמצעות הצבת אותם במנה במקרר של 4 ° c עד שהם לא יזוזו יותר או יגיבו למגע. המתת חסד neonates על-ידי עריפת ראש ובהתאם להליכי IACUC במתקן המיועד.
- להכין 3-5 mL סדרת מחלקים של 0.25% טריפסין-edta ב שפופרת של 50 מ"ל-ml כדי לאסוף את DP מכל עכבר. זה יקל על העיכול של עיסת שיניים מעכברים שלאחר הלידה. השתמש יותר מ-3 mL אם עיכול רקמות מ 10 עכברים לפני הלידה.
- הניחו את הראש על משטח תחתון חד-פעמי כך שהפה הוא לכיוון התקרה ובסיס הצוואר שטוח על פני העבודה. להפריד את הלסת התחתונה. מהמקליה
- באופן אופציונלי להסיר את הלשון עם מספריים או עם מלקחיים כדי לאפשר גישה קלה יותר טוחנות.
- מניחים את הראש פתוח בקערה על גבי משטח גזה סטרילי ומניחים את הדגימה תחת מיקרוסקופ מבתר (איור 1ד).
- הסר את רקמת העצם מכתשיים סביב טוחנות הראשון. שיני הלסת התחתונה. לא מפרצו לגמרי בשלב זה הכנס מלקחיים לתוך מכתשיים פותחים ומתגרים את הרקמה הרחק מהשן לכיוון הלחי (לשון) או לצד הלשון (לשוני) של הפה. שיניים מקסלסת ידרוש הסרה מלאה של החריץ סביב השן לחשיפה והסרה.
- העבר בעדינות את טוחנות הלסת התחתונה והלסת הראשית הראשונה (M1s) לצלחת תרבות נפרדת עם תמיסת מלח באגירה של 1 x פוספט (PBS).
- חזור על ה2.2.4-2.2.8 עד לאיסוף כל הM1s. לשמור את המנה המכילה את M1s על קרח במהלך הקציר.
- הסר את האיבר החיצוני אמייל (EOE) המקיף את החלק החיצוני של כל M1. זה ניתן לחילופין לעשות לאחר שלב 2.2.11.
- עם קבוצה של מלקחיים, לסובב את M1 כך cusps הם למטה את השורש הפתוח חשוף. יהיה פתח סגלגל בתחתית השן, ורקמת DP אטום שעברו שכבה דקה של דנטין ואמייל.
- באמצעות קצה של מלקחיים, בעדינות לשחרר את DP על ידי הפעלת זרוע אחת של מלקחיים סביב ההיקף הפנימי של הרקמה מינרליזציה. הסר את רקמת DP מתוך המבנה מינרליזציה ולהעביר אותו למנה שלישית המכילה 1x PBS. הסר את ה-EOE אם הוא לא הופרד כבר (איור 1E).
- העבר את כל רקמת DP ל 0.25% טריפסין-EDTA בשפופרת מ50 mL. מערבולת התערובת והמקום באמבט מים ב37 מעלות צלזיוס למשך 10 דקות. זה יכול להיעשות עם מלקחיים אותו או עם ארוך, מלקחיים בקבוקון. הרקמה יהיה קשה להתפזר וידרוש vortexing כל 3-4 דקות. מאחר והטריפסין עלולים. לגרום נזק לקרום התא
- תחת מכסה סטרילי, הוסף מדיה משותפת של תרבות שיתוף (טבלה 1) ליחס הסופי של לפחות 1:1 מדיה לטריפסין כדי להשבית את האנזים. יחס גדול יותר מקובלים אם הצורך פיזור רקמות יותר.
- פיפטה את התקשורת למעלה ולמטה מספר פעמים עם צנרת 10 מ ל כדי לפזר עוד יותר את DP בתקשורת. להיזהר להימנע בועות גדולות. הפיזור השלם הוא כמעט בלתי אפשרי בשל האופי הדביק של הרקמה. עם זאת, זה גם לא הכרחי מאז התאים יועברו החוצה מן הרקמה מצופה פעם.
- העבר 1 מ ל של DP התפזרו לכל באר של הלוח 24-היטב של תרבות הרקמה (איור 1F).
- מניחים את הצלחת בחממה ב 37 ° צ' ומאפשרים לתאים לצרף ולנדוד מתוך הרקמה הבלתי מפוזרת עבור 48 h לפני שינוי המדיה. התאים העיקריים צריך להיות מצופה בריכוזים גבוהים יחסית על מנת להגיע 85-90% המפגש בתוך שבוע 1. אם זה לא מושגת לאחר 1 שבוע, למחוק את הצלחת.
- מניפולציה גנטית אופציונלית של תאי DP
- כדי לשנות את מסלולים איתות התא, הקציר תאים של DP מעכברים הסתרה גנטית או מעכברים שבו גן של עניין מוקף באתרי loxP. במקרה האחרון, ניתן למחוק את הגן באמצעות אדנווירוס-יצורים-GFP (Ad-היצורים-GFP) recombinase להסיר את הגן מוקף, כפי שמתואר להלן. השתמש ב-אדנוvirus-eGFP (Ad-eGFP) כווירוס בקרה כדי לוודא שהזיהום הנגיפי אינו גורם לתגובה תאית.
הערה: Ad-eGFP נשלט על ידי משפר המקדם של CMV, שהוא חזק מאוד. Ad-מיני-GFP מוסדר על ידי IRES, אזור הרגולציה הפנימית בין היצור ו GFP, אשר אינו חזק מאוד. התוצאה היא פלואורסצנטית בהיר יותר בתאי Ad-eGFP מאשר בתאים לספירה-GFP. אשר רמות זיהום שוות-ערך בהתאם למספר הכולל של תאים fluorescing, לא ברמות של פלואורסצנטית סלולרי. - הכינו 500 μL של מדיה המכילה וירוס 10 μg/mL של polybrene לכל טוב. Polybrene מסייע עם זיהום נגיפי בתאים ליד המפגש10. פרוטוקול זה מבוסס על ריבוי של זיהום (המשרד העצמי) של 100 עבור Ad-eGFP ו 200 Ad-מיין-GFP עבור זיהום גנטי יעיל עם מעט או ללא השפעה על הכדאיות התא. מספר התאים המשוער הוא 4 x 104 תאים/בתוספת צלחת של 24 שעות ביממה:
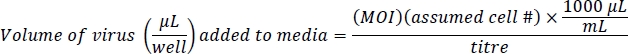
- מערבבים מדיה עם הורטקנג קצר או ליטוף ולהוסיף 500 μL לכל טוב.
- לאחר 24 שעות, הוסף תוספת 500 μL של מדיית שיתוף תרבות שאינה מכילה polybrene או וירוס נוספים.
- לאחר סך של 48 h, מתיף מדיה המכילה וירוס ולהחליף עם מדיה שיתוף תרבותי טרי. בשלב זה, הנוירונים TG ניתן להוסיף על גבי מסננים transwell יטב.
- כדי לשנות את מסלולים איתות התא, הקציר תאים של DP מעכברים הסתרה גנטית או מעכברים שבו גן של עניין מוקף באתרי loxP. במקרה האחרון, ניתן למחוק את הגן באמצעות אדנווירוס-יצורים-GFP (Ad-היצורים-GFP) recombinase להסיר את הגן מוקף, כפי שמתואר להלן. השתמש ב-אדנוvirus-eGFP (Ad-eGFP) כווירוס בקרה כדי לוודא שהזיהום הנגיפי אינו גורם לתגובה תאית.
- ניתוח מהדק, פיזור וציפוי
הערה: בפרוטוקול זה, הדמיה של neurite מוצלח ב שיתוף תרבות עם תאי העקורים היה אופטימיזציה באמצעות מתבגר (בן 6 שבועות) B6.Cg-Tg (Thy1-YFP) 16Jrs/J עכברים. מערכות העצבים המרכזית וההיקפית של עכברים Thy1-YFP יש חלבון פלורסנט צהוב (YFP) תג אשר הביטוי מתחיל סביב P6-P10 בנוירונים ומגדיל באופן מעריכי לאורך מערכת העצבים במהלך לאחר הלידה וחיי מבוגרים11,12. YFP ו-GFP יש רצפים שמרו המאפשרים עצבים אלה להיות מוכתם עם נוגדנים anti-GFP, וכתוצאה מכך כתם עצבי פאן. בסופו של דבר, עכברים אלה מאפשרים הדמיה טובה יותר וכימות של הנוירונים המשמשים וגדל בתרבות התא.- המתת חסד מתבגר עכברים עם דו תחמוצת הפחמן ואחריו פריקה צוואר הרחם.
- לערוף את ראשו של העכברים ולהסיר את העור מהגולגולת. הקפידו לכלול מספר שווה ערך של זכרים ונקבות.
- הכניסו את הקצה של זוג מספריים מיקרו לתוך בסיס הגולגולת. חותכים לאורך התפר המשונן של הגולגולת (איור 1א).
- הפוך ארבעה חתכים אופקיים קטנים: שניים לאורך התפרים המסיסים על ידי האוזניים, ושניים לאורך התפרים לבלית בבסיס הגולגולת. זה אמור ליצור. שני כנפיים של עצם
- השתמש בלקחיים כדי לקלף. את שני המדפים של העצם . זה אמור לחשוף את המוח
- . תסיר את המוח להעביר את הראש לצלחת תרבות רקמות עם 1x PBS ולשים מתחת למיקרוסקופ.
- אתר את ה-TG ganglia, אשר ניתן לראות בקלות במכרסמים13, שוכנו בחומר הדורא בין המוח לעצם של תהליך הלסתהראשונה (איור 1B).
- חותכים את שלושת הענפים כי לנסוע אל העיניים, maxillae הלסת התחתונה ולהעביר את גרעינים קר 1x PBS באמצעות מלקחיים קנס בקצה ישר. שמור את המנה המכילה את ה-TG גרעינים על הקרח במהלך הקציר.
- לאחר כל הצרורות TG הם נקצרו, להעביר גרעינים לצינור 50 mL המכיל 5 מ"ג/mL סטרילי-מסוננים קולגן סוג II באמצעות מלקחיים במבחנה.
- מערבולת הקולגן עם צרור TG ומניחים את הצינור באמבט מים 37 ° c עבור 25-30 דקות. במהלך תקופה זו, לקחת את צינור החרוט מתוך אמבט מים, מערבולת, ולחזור לאמבטיה כל 5-10 דקות.
- צנטריפוגה את פתרון תא העצב-TG. במשך 2 דקות ב 643 x ג'י
- מתחת למכסה המנוע של הרקמה, משוך בעדינות את הקולאז בעזרת מיקרופיפטה.
- הוסף 5 מ ל של 1% טריפסין מסוננים מסוג II ו מערבולת. מניחים את צינורית החרוט באמבט המים של 37 ° c במשך 5 דקות.
- צנטריפוגה את המיקס של טריפסין-TG במשך 5 דקות ב 643 x g. הסר את החלק העליון של טריפסין עם מיקרופיפטה, כך שהנוירונים TG לא יוסרו. . עדיין יהיה נוזל בצינור
- הוסף מספיק מדיה כדי להשבית את הטריפסין הנותרים (ב-1:1 או ביחס נמוך יותר של טריפסין למדיה).
- לספור את מספר התאים ולדלל את הפתרון 200,000 תאים/mL (250 μL של תא המכיל 50,000 תאים).
- המקום פילטרים מצופה transwell יטב מסעיף 1.2 לתוך בארות עם DP.
- דלל את הפתרון המכיל את התא כך שיש 200,000 תאים/mL. פיפטה 250 μL אל מסנן הטרנסג, והתרבות התאים ב-37 ° צ' לילה (איור 1F).
- למחרת, להחליף את המדיה עם 1 מ ל של מדיה שיתוף תרבות עם 1 μM uridine ו 15 μM 5 '-fluor-2' deאוקסיאורידיין כדי לעצור את התפשטות יתר של תאי mesenchymal שעשויים למנוע neurite outgrowth. אופציונלי: הוסף גורמי גדילה או מעכבי במדיה זו אם אתה מנסה לבצע תפעול נוסף.
- תרבות התאים עבור נקודות זמן רצויות נוספות. פרוטוקול זה היה מיטבי עבור 5 ימים סך של תרבות עם המדיה השתנה רק ביום 2 כדי להוסיף mitotic מעכבי. פרקי זמן ארוכים יותר ידרשו שינויי מדיה נוספים.
3. איסוף ועיבוד דוגמאות
- צביעת משולש
- פיפטה 1 mL המרקמת ה-PBS של ה-1x לצלחת 24 שעות תחת המכסה של תרבות הרקמה עבור כל מסנן transwell כדי להיות מעובד.
- הסר את הנוזל על גבי המסנן יוסרו עם הצינורות 200-1000 μL, להיות זהירים לעזוב את שכבות התאים ללא פגע. תאים מצורפים צריכים להישאר מחוברים ותאים שאינם מצורפים יהיה רופף במהלך זה ליטוף עדין. מסנן ואקום יכול להזיק לשכבת התא ולא מומלץ לשאיפה.
- העבר את המסנן ללוח ה-PBS של 1x, הקפד להסיר את השכבה העליונה של המדיה כפי שהוזכר בשלב הקודם.
- מניחים את הצלחת עם כל מסנני transwell מכסים על הנדנדה ב 12 סל ד או 40-50 סל ד על שייקר מסלולית עבור 10 דקות.
- לרוב הערוץ, כולל את השכבה העליונה כפי שמתואר לעיל, להוסיף 500 μL של 1xPBS ומקום על הנדנדה או שייקר מסלולית עבור 5-10 דקות נוספות לשטוף.
- משף את ה-PBS 1 x פעם נוספת ולהחליף עם 4% פאראפורמלדהיד (בשיא). השתמש לפחות 500 μL כדי שמשטח הסינון כולו יהיה שקוע. מניחים את הצלחת על נדנדה ב 12 סל ד או שייקר מסלולית ב 40-50 סל ד בטמפרטורת החדר עבור 1 h.
- להסיר את התחתית ולשטוף את הצלחות פעמיים עבור 5-10 דקות כל אחד על הנדנדה עם 500 μL של 1x PBS.
- בלוק עם 10% בסרום שור (BSA) + 5% סרום עז/חמור, בהתאם לבעל החיים הפונדקאי נוגדן משני, ב 0.05% יצירת רצף-1xPBS (PBST). השתמש ב-450-500 μL של הפתרון כך שהמסנן יהיה שקוע בנוזל.
הערה: בשלב זה ניתן לאחסן צלחות אלה ב-4 ° c למשך מספר חודשים לתהליך במועד מאוחר יותר. השתמש parafilm כדי לאטום את הצלחת כדי להבטיח אידוי לא מתרחשת ולבדוק באופן סדיר עבור התאיידות, כך משטחים מסנן להישאר שקוע. - הסר את הבלוק ולהוסיף 450-500 μL של הנוגדן העיקרי ב 1% BSA-PBST ללא שטיפה נוספת. מודטה ב -4 ° c לילה, נדנדה בעדינות.
- להסיר פתרון נוגדן ראשוני ולשטוף עם 500 μL של 1xPBST על נדנדה, 3 פעמים, בטמפרטורת החדר
- הסר את PBST, להוסיף נוגדן משני ו-דגירה על הנדנדה לילה ב 4 ° c עטוף רדיד אלומיניום כדי להגן fluorophores מן השפלה קלה. לשטוף שוב, 3 פעמים, עם 1x PBST על הנדנדה בטמפרטורת החדר. החלף ב-1x PBS.
הערה: בשלב זה, הצלחת ניתן לאחסן במשך מספר חודשים ב 4 ° צ' אם עטוף רדיד אלומיניום כדי למנוע השפלה fluorophore. השתמש parafilm כדי לאטום את הצלחת כדי להבטיח אידוי לא מתרחשת ולבדוק באופן סדיר עבור התאיידות, כך משטחים מסנן להישאר שקוע. מומלץ לצלם בתוך חודש אחד. - לדימות אופטימלי, להשתמש Thy1-YFP הנוירונים בעכבר עם נוגדן anti-GFP במיוחד כתם עצבי afferents היטב מעל רמות הרקע. השתמש ב200 האנטי-נוירופילמנט כדי להכתים במדויק מבנים סיבי אם עכברים Thy1-yfp אינם זמינים.
- תמונה כרצונך. מסננים לא צריך להיות מצופה במקום זאת ניתן להציב על גבי שמיכות או שקופית עבור הדמיה עם מיקרוסקופ הפוך.
הערה: אזורי המסנן לא יכילו מבני כלי לימפה. צלם מספר תמונות עם עומק מחסנית z הלוכד את כל מבני כלי לימפה. השתמש בתוכנת תפירה כדי להמחיש את neurite מוצלח על פני אזורים גדולים, או (רצוי) כל אזורי הסינון.
- האוסף של RNA, חלבונים ומדיה
- בעוד מסנני transwell הם עיבוד, לאסוף את המדיה ב rnase/dnase-צינורות חינם להקפיא עבור בחני מאוחר יותר (אליסה, פרוטאומניקס, וכו ').
- מיד לאחר איסוף המדיה, מאגר הליזה סדרת מחלקים או שיטת המשקעים (ריפה) מאגר עם פרוטטינואז ו פוספספטאז מעכבי לתוך הבארות. פרוטוקול זה היה אופטימיזציה עבור 100 μL/ובכן בצלחת 24-טוב.
- אפשר מאגרים כדי lyse תאים עבור 5 דקות, ולאחר מכן לגרד כל מסנן עם עצה חדשה בצנרת, ולאסוף דגימות תאים בצינורות RNAse/DNAse-חינם. הקפאת הליזה לקבלת מאמר עתידי (למחצה כמותי ו/או ה-PCR הכמותי, אבן החשופה המערבית, וכו ').
- אימונוצילונציה אופציונליים של תאים שיניים עיסת:
- בעדינות להרים שמיכות מסעיף 1.1 עם מלקחיים ולהעביר אותם בארות שונות עם 4% כדור החלקה לכיוון 1 h עם נדנדה.
- ולשטוף את הכיסויים פעמיים. עם הערוץ הראשון בצע את הפעולה עם החדירות, חסימת ומחיסולי הגנה עבור סמנים של עניין עם שיטות immunofluorescence סטנדרטיים.
תוצאות
תוצאות אלה מראות כי הגדילה TG neurite מוצלח הוגדלה בנוכחות תאים DP העיקרי בבסיס היטב לעומת השליטה של TG neurite מונוקולטורה (איור 2א, ג). יש כמה שינויים בneurite הצמיחה. לפיכך, יש לכלול את מרחב העצב הTG של החברה באופן קבוע כפקד כדי לזהות את רמות הבסיס של neurite outgrowth. התאים הראשוניים מהעכבר Tgfbr2f/f שימשו בפרוטוקול זה לאחר זיהום של לספירה-gfp ו-Ad-egfp אושרה במספרים שווי ערך של תאים (איור 2ד). ה-Ad-eGFP שימש כווקטור שליטה ויראלי. המודעה-הספירה-GFP למחוק את הגן מוקף, Tgfbr2, כפי שהפגינו על ידי חצי כמותית PCR (איור 2E). בתרבויות עם שינוי גורם הצמיחה ביתא קולטן 2 (Tgfbr2) מחיקה, neurite מוצלח הצטמצמה (איור 2A-C).
אנו מנוצל Thy1-yfp הנוירונים העכבר TG ומוכתם אותם עם נוגדן anti-gfp שייצרה תמונות ספציפיות מאוד בהיר של מבנים סיבי היטב מעל הרקע הזה, כפי שמוצג באיור 2. הדבר איפשר את הצביעת המסוים של סמנים עצביים ללא כתמים לא ספציפיים של תאים עצביים על ידי שימוש בשיטות שדווחו קודם לכן כגון גביש סגול7. הנקבוביות הגדולות במסננים יכולים להיות מדויקים ו/או לצבור נוגדנים משניים ולהקטין את הדיוק של הדמיה סיבי (איור 3). בעוד הנוירונים Thy1-YFP עם immunofluorescence באופן דרסטי משפר את ההדמיה, הרקע הנוסף ניתן להסיר עם התוכנה auto-סף ולאחר מכן כימות. אנו ממליצים גם על ביצוע immunofluorescence עבור 200 נוירופילמנט מבוסס על ממצאים ראשוניים שלנו (לא מוצג) כמו גם אחרים8,9 אם Thy1-yfp עכברים אינם זמינים.

איור 1: סכמטית של הקרע בעכבר כדי להשיג תאים לשיתוף התרבות. (א) דיאגרמה של היכן לחתוך כדי לפתוח את הגולגולת העכבר ולאתר עצבי TG, המוצגת בשחור בתיאור האחרון. מספריים מציינים היכן להוסיף את עצות המספריים לחיתוך לאורך הקווים המנוקדים. (ב) משולב שדה אפל ו gfp תמונה המציגה THY1-yfp + העצבים TG בעיגול לבן. (ג) בגזור TG גרעינים יכול להיות מפוזר ותרבותי, כפי שמוצג ב- F. (ד) הלסת התחתונה של עכבר P7, עם מלקחיים המחזיקים את הלסת התחתונה ברכסים משמאל ומכתשיים המכילים שיניים בלתי מועצמות בכל צד של הלשון. (ה) העקורים רקמת (הקיפו) שחולצו מן המבנה מינרליזציה (למעלה), ואת הזיגוג האמייל החיצוני (למטה) כי הוסר להתפזר ולוחית בצלחת תרבות רקמה המטופלת, כפי שמוצג ב- F. תמונות אינן מוצגות בקנה מידה. תאים DP התפזרו וגדלו למפגש לפני הוספת נוירונים TG. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2: הנציגה נובעת מהתרבות השותפת. (א-ג) Thy1-yfp הנוירונים TG היו תרבותי ב transwell מסנני עם 3 יקרומטר נקבוביות על גבי תאים הראשי Tgfbr2f/f DP. כתמים אימונוoforonal בוצע עבור חלבון YFP באמצעות נוגדן אנטי GFP כדי לספק כתמים ספציפיים מאוד של מבנים עצביים על המסנן כולו. התחזיות המקסימליים של 100 יקרומטר z-מחסנית מיקרוסקופיה תמונות מיקרוסקופ ב 10x נאספו ותפרו עם תוכנה תפירה. הנוירונים TG הפגינומשמעותית יותר הצמיחה כאשר שיתוף תרבותי עם תאי DP (א) מאשר כאשר מתורבת לבד (ג). Neurite מוצלח לא המושרה כאשר הנוירונים היו שיתוף תרבותי עם תאי DP נגוע לספירה-ביצורים-gfp כדי להפיל Tgfbr2 (ב). סרגל קנה מידה = 1,000 μm. מספר שווה ערך של תאים נגועים ב-Ad-eGFP ו-Ad-מיין-GFP מוצגים ב (ד). סרגל קנה מידה = 125 μm. ה-PCR החצי כמותי אישר את Tgfbr2 KD (E). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 3: קשיים טכניים שהוצגו בהדמיה כלי לימפה. (א) ברייטפילד הדמיה של מסננים transwell לאחר כתמים קריסטל סגול של אוכלוסיות תאים. נקבוביות גדולות נפוצות. החץ הגדול מצביע על תא המוצגים על מורפולוגיה של המקימים, בעוד שהחץ הקטן מצביע על תא של מורפולוגיה עצבית. קריסטל סגול מוכתם בשני התאים ללא הטיה. (ב) immunofluorescent כתמים של β3 טובולין עם הנוגדן אלקסה-488 משני הראה כתמים לא ספציפיים של תאים מרובים, הפיכת הדמיה של מבנים כלי לימפה קשה. התמונות מייצגות וחזרו על מספר מוסר כדי למטב את ההדמיה המוצגת באיור 2. סרגל קנה מידה = 50 μm. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
| רכיב | אמצעי אחסון | ריכוז | |
| הגברת התנועה | 440 מ ל | ||
| חום עוברי העובר מופעל | 50 מ ל | 10 | |
| 100x L-גלוטמין | 5 מ ל | 1x | |
| פניצילין-סטרפטומיצין 100 x | 5 מ ל | 1x | |
| שינוי מדיה ביום 2 עם מעכבי mitotic בריכוזים הסופיים האלה | |||
| אורידיין | 1 μM | ||
| 5 '-fluor-2deאוקסידודין | 15 μM | ||
שולחן 1: מדיה שותפה לתרבות.
Discussion
הפעילויות היומיומיות של חלל הפה דורשים כי תחושת השיניים גירויים חיצוניים דלקת פנימית על מנת לאפשר שימוש נאות ותחזוקה. עם זאת, רק מידע מוגבל זמין לגבי האותות הנוהגים בתהליכים ההתפתחותיים של השימור השן. פרוטוקול זה מספק שיטה לבידוד ושיתוף של התאים העיקריים של DP ו-TG הנוירונים כדי ללמוד את התקשורת בין שתי האוכלוסיות. מספר משתנים היו ממוטבים והשאירו שדרות פתוחות נוספות של מחקר, כמתואר להלן.
הפקדים חשובים בכל שלב בסדר זה. מסנן transwell עם נוירונים TG בלי תאים DP הבסיסית צריך להיכלל בכל הספקות כדי לספק קו בסיס עבור הצמיחה TG. בעת מחיקת גנים מקיפים של עניין עם recombinase-לספירה-GFP, וירוס שליטה המבטא רק את סמן פלורסנט יש להשתמש כדי לאשר את המספרים המקבילה של תאים נדבקו. בעוד הדגמנו רמות גבוהות של זיהום עם מוות תאים מינימלי ב 100 ו 200 מוי עבור Ad-eGFP ו-Ad-מיין-GFP, בהתאמה, כל מעבדה צריך למטב את השלב הזה. מכיוון חלבונים פלורסנט יכול להיות מצורף היזמים שונים ולכן לגרום לביטויים המקבילה ביטוי מספרים של הנגועים, התאים רואה צריך להיות נספרות. העוצמה הכוללת של הקרינה הפלואורסצנטית אינה רלוונטית משום שהיא אינה משקפת במדויק את מצב הזיהום. חשוב להדגים את מחיקת הגן, כפי שמוצג ב-PCR חצי כמותי בפרוטוקול זה (איור 2). בעוד פרוטוקול זה לא מטפל בנושא זה, המחקר הקודם הראה כי בחני שליטה עם שורות תאים אחרים ניתן לכלול כדי להדגים את neurite מוצלח נגרמת במיוחד על ידי תרבות שיתוף עם תאים DP8.
בגלל פרוטוקול זה מנצל תאים ראשוניים, ישנם מספר שלבים שבהם זיהום ניתן להציג. כדי למנוע את זה, כל הריאגנטים צריך להיות מסוננים סטרילי. בנוסף, מומלץ שניסויים עבור כל משתנה יופעלו בשכפול או בטרילקאט כדי לאפשר הסרה של מסנן ועיקור של באר מזוהמת ללא כישלון מוחלט של הצורך.
כיסוי חייב להיות מצופה עם פולי-D-ליזין ו/או חלבון מטריצה החילוץ כדי להבטיח הדבקה תא DP. בעוד התאים לעשות בתחילה לצרף, זיהום נגיפי גורם להרים מוות שמיכות מצופה ומונע את המניפולציה הגנטית של שיתוף התרבות שכונתיות.
הוא מבוסס היטב כי תאים שאינם עצביים, כגון תאים schwann מ TG ganglia, יכול להשפיע על הישרדות של תאים נוירוונאליות בתרבות14,15,16. בפרוטוקול זה, הישרדות עצבית היתה ממוטבת על-ידי הוספת 1 μM uridine ו 15 μM 5-fluoro-2deאוקסיאורידיין. ללא תוספת של סוכני antimitotic אלה כדי לעכב את התפשטות התא schwann, neurite מוצלח לא תתרחש. זה לא ידוע אם הנוכחות של התאים האלה הסנסאנואן בתרבות שיתוף לשנות את התגובה העצבית. בידוד נוירונים מורלין דורש מספר שלבים נוספים, ופרוטוקולים זמינים עבור חוקרים שרוצים להסיר את המשתנה הזה17. בשני המקרים, הפיזור הנוירונים מחקה מעט את הפיום ויכול להיחשב לייצג פציעה/תיקון18 יותר מאשר פיתוח. מחקרים נוספים יידרשו לקבוע את ההבדלים בין הצמיחה vivo סיבי מ fascicles לעומת צמיחה סיבי של נוירונים בודדים בתוך מבחנה, ואלה אינם ממוען פרוטוקול זה.
פרוטוקול זה לוקח 1-3 שבועות מתחילתו ועד סופו. אמנם ניתן להשתמש בתאי DP הדורשים יותר משבוע 1 כדי להגיע 85-90% זרימה, מומלץ כי התאים להיות הזרע בצפיפות גבוהה מספיק כדי להגיע למפגש תוך כמה ימים מאז תאים אלה להפריד לאט מאוד מעבר נקודה זו. זה בדרך כלל דורש סביב 5-7 P5-8 עכברים לכל שורה של צלחת 24. פרוטוקול זה היה אופטימיזציה עבור סך של 5 ימים של תרבות שיתוף, בשלב זה את המדיה עם פנול אדום החל להזיז צבע. יש לשנות את המדיה אם ברצונך לקבל עוד.
שיתוף תרבות מספר בחני כבר בוצעו כדי להפגין neurite מוצלח בתגובה לגורמים המופרשים על ידי גורמים העקורים המופרשים עם לוחיות העור הרגילות ecm מצופה רקמות3,19,20,21 או מיקרופלואידיג בתאי8,22,23. פרוטוקול זה מציע מספר יתרונות על-פני שיטות אלה. למשל, TG גרעינים ו-DP רקמת שיתוף התרבות דורש מערכת יחסים מרחבית ספציפית עבור neurites לחוש ולהגיב אותות הקרנף קצר טווח. עם תרבות האיברים, רק neurites ב גרעינים הקרוב ביותר רקמת DP מסוגלים להגיב3, בעוד הנוירונים TG מפוזרים בשימוש בפרוטוקול זה הם מתורבתים במרחק שווה מתאי DP מתחת. שנית, תרבויות איברים יכולים להחדיר נמק רקמות עקב חוסר חמצן וחומרים מזינים זמין בדגימות גדולות24. התרבות המשותף של תאים מפוזרים מסירה אפשרות זו. כמה תרבויות שכונתיות כולל נוירונים דורשים מדיה עצבית3,22 אשר יכול לשחק תפקיד דומיננטי בקידום neurite outgrowth. פרוטוקול זה אינו מוסיף גורמי הצמיחה ספציפיים לעצב, ובכך מאפשר הערכה של הקשר הישיר בין אותות הפרדרין מן התאים DP הבסיסית ואת תגובות neurite מוצלח. ראוי לציין כי מדיה שיתוף התרבות חסר גם רכיבים לקידום מינרליזציה, כגון beta-glycerophosphate. זה מאפשר לחוקרים לקבוע כיצד neurites עשוי להפריש אותות כדי לעודד מינרליזציה. עם זאת, הוא גם מגביל את המחקר על-ידי כולל רק תאים DP פחות הבדיל ללא מינרלתותהקטנים שהיו בדרך כלל להיות נוכח vivo.
מטרי תגובות מחקר הקודם7,8 אין להתוות תרומות שבתאיהתאים ולא להפגיןמורפולוגיה עצבית מאחר וסגול קריסטל לא במיוחד כתמים כל התאים. Immunofluorescent כתמים של מסננים יכול לגרום לרמות ברקע גבוה שגורמות הדמיה כלי לימפה קשה (איור 2). הפרוטוקול הנוכחי מאפשר את הצביעת המדויק של afferents עצבי על ידי ניצול Thy1-YFP TG נוירונים ונוגדן אנטי GFP ומספק אות בהיר מספיק כדי ליצור תמונות גדולות של צמיחה ברחבי דמות שלמה (איור 3). ניתן להשתמש בסמנים עצביים אחרים, כגון אנטי-נוירופילמנט 200, אם עכברים Thy1-YFP אינם זמינים.
בסופו של דבר, שימוש בתאי DP העיקרי מעכברים עם גנים של עניין מוקף על ידי אתרי loxP מאפשר מחיקה פשוטה ויעילה של גנים אלה עם מערכת המודעה-GFP. במחקרים עתידיים, מערכת recombinase בעלי הספירה יכולה לשמש על הנוירונים TG אם יש להם גן של עניין מוקף באתרי loxP. זה יהיה להקל על מחקרים על איך הפרדרין אותות מן האוכלוסייה העצבית להשפיע על תאי DP, במיוחד אם התאים DP הם הנזרע על גבי coverslips (סעיף 1.1). מחקרים עתידיים יכולים לנצל מניפולציות אחרות, כגון תוספת של מעכבי תרופתי ו/או גורמי גדילה. ניתן גם לשנות פרוטוקול זה כדי לכלול מחקרים הגירה על ידי שימוש ב-8 יקרומטר מסננים שונים.
לסיכום, זה שיתוף תרבות transwell יטב שימוש בנוירונים ותאי DP מאפשר חקירה של פרמטרים סלולריים מרובים. זה מאפשר להרחיב את הגוף של הידע על האינטראקציות הנוירוכאליות-עצביים אשר לקדם ולתמוך אינבציה שן.
Disclosures
. למחברים אין מה לגלות
Acknowledgements
עבודה זו היתה נתמכת על ידי) המוסדות הלאומיים לבריאות/NIAMS (להעניק מספרים R01 AR062507 ו R01 AR053860 ל RS), ב) אוניברסיטת אלבמה הדרכה המחקר האקדמי של ברמינגהאם (DART) מענק (מספר T90DE022736 (PI MacDougall) כדי SBP מן המכון הלאומי לרפואת שיניים, מכוני בריאות הלאומי, ג) מרכז עולמי UAB עבור הגולגולת, אוראלי הפרעות שיניים (GC-מקודד) פיילוט והיתכנות מענק SBP ו-d) המכון הלאומי לרפואת שיניים וקרניו Ofacial מחקר/מכוני לאומי של בריאות K99 DE024406 מענק SBP.
Materials
| Name | Company | Catalog Number | Comments |
| 5-Fluoro-2'-deoxyuridine | Sigma-Aldrich | F0503 | Used as a mitotic Inhibitor at 15 μM concentration in co-culture media, Day 2 |
| 24 Well Cell Culture Plate | Corning | 3524 | Co-culture plate |
| Alexa-546 anti-chicken | Invitrogen | A-11040 | Secondary to stain neurite outgrowth labeled by anti-GFP antibody, 1:500 dilution |
| Anti-GFP Antibody | Aves Lab, Inc | GFP-1010 | Primary antibody to label Thy1-YFP neurons, 1:200 dilution |
| Anti-Neurofilament 200 antibody | Sigma-Aldrich | NO142 | Monoclonal primary antibody to label neurons, 1:1000 dilution, alternative if YFP mice are not available |
| B6;129- Tgfbr2tm1Karl/J | The Jackson Laboratory | 12603 | Tgfbr2f/f mouse model used for dental pulp cells in optimized protocol |
| B6.Cg-Tg(Thy1-YFP)16Jrs/J | The Jackson Laboratory | 3709 | Thy1-YFP mouse model genotype used for trigeminal neurons |
| Collagenase Type II | Millipore | 234155-100MG | Used to disperse trigeminal neurons |
| Fetal Bovine Serum | Gibco | 10437 | Additive to co-culture media |
| Fine forceps | Fine Science Tools | 11413-11 | Fine forceps for TG dissection |
| Laminin | Sigma-Aldrich | L2020 | Coats the transwell inserts at final concentration of 10 μg/ml, stock solution is assumed at 1.5 mg/ml |
| Lysis Buffer (Buffer RLT) | Qiagen | 79216 | Extracts RNA from dental pulp cells post co-culture |
| L-Glutamine | Gibco | 25030081 | Additive to co-culture media |
| Micro-dissecting scissors | Sigma-Aldrich | S3146-1EA | Dissection scissors to open skull |
| Microscope Cover Glass | Fisherbrand | 12-545-81 | Circlular coverslip for optional cell culturing and immunofluorescence processing |
| Minimal Essential Medium a | Gibco | 12571063 | Co-culture media base |
| Penicillin-Streptomycin | Gibco | 15070063 | Antibiotic additive to co-culture media |
| Phosphatase Inhibitor | Sigma-Aldrich | 04 906 837 001 | Additive to RIPA Buffer for extracting protein from dental pulp cells post co-culture |
| Polybrene | Millipore | TR-1003-G | Used to aid in dental pulp cell transfection |
| Poly-D-Lysine | Sigma-Aldrich | P7280 | Coverslip coating to aid dental pulp cellular adhesion |
| Protease Inhibitors | Millipore | 05 892 791 001 | Additive to RIPA Buffer for extracting protein from dental pulp cells post co-culture |
| RNAse/DNAse free eppendorf tubes | Denville | C-2172 | Presterilized 1.7 ml tubes for RNA, DNA or protein collection at the end of assay |
| ThinCert Cell Culture Insert | Greiner Bio-One | 662631 | Transwell inserts for trigeminal neurons in co-culture assays |
| Trypsin-EDTA (0.25%) | Gibco | 25200056 | Used fto disperse dental pulp cells |
| Trypsin Type II | Sigma-Aldrich | T-7409 | Used to disperse trigeminal neurons |
| Ultra Fine Forceps | Fine Science Tools | 11370-40 | Ultra fine forceps for dissection |
| Uridine | Sigma-Aldrich | U3750 | Used as a mitotic Inhibitor at 1 μM concentration in co-culture media, Day 2 |
| Vacuum Filtration System | Millipore | SCNY00060 | Steriflip disposable filter, 50 μm nylon net filter |
| Vial forceps | Fine Science Tools | 110006-15 | Long forceps for tissue transfer to conicals |
References
- Moe, K., Sijaona, A., Shrestha, A., Kettunen, P., Taniguchi, M., Luukko, K. Semaphorin 3A controls timing and patterning of the dental pulp innervation. Differentiation. 84 (5), 371-379 (2012).
- Kollar, E. J., Lumsden, A. G. Tooth morphogenesis: the role of the innervation during induction and pattern formation. Journal de biologie buccale. 7 (1), 49-60 (1979).
- Lillesaar, C., Fried, K. Neurites from trigeminal ganglion explants grown in vitro are repelled or attracted by tooth-related tissues depending on developmental stage. Neuroscience. 125 (1), 149-161 (2004).
- Fried, K., Lillesaar, C., Sime, W., Kaukua, N., Patarroyo, M. Target finding of pain nerve fibers: Neural growth mechanisms in the tooth pulp. Physiology & Behavior. 92 (1-2), 40-45 (2007).
- Pagella, P., Jiménez-Rojo, L., Mitsiadis, T. A. Roles of innervation in developing and regenerating orofacial tissues. Cellular and Molecular Life Sciences. 71 (12), 2241-2251 (2014).
- Luukko, K., Kettunen, P. Integration of tooth morphogenesis and innervation by local tissue interactions, signaling networks, and semaphorin 3A. Cell Adhesion & Migration. , 1-9 (2016).
- Smit, M., Leng, J., Klemke, R. L. Assay for neurite outgrowth quantification. BioTechniques. 35 (2), 254-256 (2003).
- de Almeida, J. F. A., Chen, P., Henry, M. A., Diogenes, A. Stem cells of the apical papilla regulate trigeminal neurite outgrowth and targeting through a BDNF-dependent mechanism. Tissue engineering. Part A. 20 (23-24), 3089-3100 (2014).
- Pagella, P., Miran, S., Mitsiadis, T. Analysis of Developing Tooth Germ Innervation Using Microfluidic Co-culture Devices. Journal of Visualized Experiments. (102), e53114(2015).
- Coelen, R. J., Jose, D. G., May, J. T. The effect of hexadimethrine bromide (polybrene) on the infection of the primate retroviruses SSV 1/SSAV 1 and BaEV. Archives of Virology. 75 (4), 307-311 (1983).
- Caroni, P. Overexpression of growth-associated proteins in the neurons of adult transgenic mice. Journal of neuroscience methods. 71 (1), 3-9 (1997).
- Alić, I., et al. Neural stem cells from mouse strain Thy1 YFP-16 are a valuable tool to monitor and evaluate neuronal differentiation and morphology. Neuroscience Letters. 634, 32-41 (2016).
- Howroyd, P. C. Dissection of the Trigeminal Ganglion of Nonrodent Species Used in Toxicology Studies. Toxicologic Pathology. , (2019).
- Schwieger, J., Esser, K. H., Lenarz, T., Scheper, V. Establishment of a long-term spiral ganglion neuron culture with reduced glial cell number: Effects of AraC on cell composition and neurons. Journal of Neuroscience Methods. 268, 106-116 (2016).
- Liu, R., Lin, G., Xu, H. An Efficient Method for Dorsal Root Ganglia Neurons Purification with a One-Time Anti-Mitotic Reagent Treatment. PLoS ONE. 8 (4), 60558(2013).
- Burry, R. W. Antimitotic drugs that enhance neuronal survival in olfactory bulb cell cultures. Brain Research. 261 (2), 261-275 (1983).
- Katzenell, S., Cabrera, J. R., North, B. J., Leib, D. A. Isolation, Purification, and Culture of Primary Murine Sensory Neurons. Methods in molecular biology. 1656, Clifton, N.J. 229-251 (2017).
- Dussor, G. O., Price, T. J., Flores, C. M. Activating transcription factor 3 mRNA is upregulated in primary cultures of trigeminal ganglion neurons. Molecular Brain Research. 118 (1-2), 156-159 (2003).
- Lillesaar, C., Arenas, E., Hildebrand, C., Fried, K. Responses of rat trigeminal neurones to dental pulp cells or fibroblasts overexpressing neurotrophic factors in vitro. Neuroscience. 119 (2), 443-451 (2003).
- Lillesaar, C., Eriksson, C., Fried, K. Rat tooth pulp cells elicit neurite growth from trigeminal neurones and express mRNAs for neurotrophic factors in vitro. Neuroscience Letters. 308 (3), (2001).
- Lillesaar, C., Eriksson, C., Johansson, C. S., Fried, K., Hildebrand, C. Tooth pulp tissue promotes neurite outgrowth from rat trigeminal ganglia in vitro. Journal of neurocytology. 28 (8), 663-670 (1999).
- Chmilewsky, F., Ayaz, W., Appiah, J., About, I., Chung, S. H. Nerve Growth Factor Secretion From Pulp Fibroblasts is Modulated by Complement C5a Receptor and Implied in Neurite Outgrowth. Scientific reports. 6, 31799(2016).
- Pagella, P., Neto, E., Jiménez-Rojo, L., Lamghari, M., Mitsiadis, T. A. Microfluidics co-culture systems for studying tooth innervation. Frontiers in Physiology. 5, 326(2014).
- Miura, T., Yokokawa, R. Tissue culture on a chip: Developmental biology applications of self-organized capillary networks in microfluidic devices. Development, Growth & Differentiation. 58 (6), 505-515 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved