Method Article
Un metodo di co-cultura per studiare l'escrescenza neurite in risposta ai segnali paracrini dentali
In questo articolo
Riepilogo
Descriviamo l'isolamento, la dispersione e la placcatura delle cellule primarie della polpa dentale (DP) con neuroni trigeminali (TG) coltivati in cima ai filtri transwell sovrastanti. Le risposte cellulari delle cellule DP possono essere analizzate con l'immunofluorescenza o l'analisi RNA/proteina. L'immunofluorescenza dei marcatori neuronali con microscopia confocale consente l'analisi delle risposte di escrescenza neurite.
Abstract
L'innervazione dentale consente ai denti di rilevare pressione, temperatura e infiammazione, che sono tutti cruciali per l'uso e il mantenimento dell'organo dentale. Senza l'innervazione sensoriale, le attività orali quotidiane causerebbero danni irreparabili. Nonostante la sua importanza, i ruoli di innervazione nello sviluppo e nella manutenzione dei denti sono stati in gran parte trascurati. Diversi studi hanno dimostrato che le cellule DP secernono proteine della matrice extracellulare e segnali paracrini per attirare e guidare gli assoni TG dentro e in tutto il dente. Tuttavia, pochi studi hanno fornito informazioni dettagliate sul crosstalk tra il DP mesenchyme e afferenti neuronali. Per colmare questa lacuna nella conoscenza, i ricercatori hanno iniziato a utilizzare le co-culture e una varietà di tecniche per studiare queste interazioni. Qui, dimostriamo i molteplici passaggi coinvolti nella co-cultura delle cellule DP primarie con neuroni TG dispersi su un filtro transwell sovrastante con pori di grande diametro per consentire la crescita assonale attraverso i pori. Le cellule DP primarie con il gene di interesse affiancato da siti loxP sono state utilizzate per facilitare la delezione genica utilizzando un sistema ricombinase Adenovirus-Cre-GFP. L'utilizzo di neuroni TG del topo Thy1-YFP ha permesso una precisa imaging afferente, con espressione ben al di sopra dei livelli di fondo mediante microscopia confocale. Le risposte del DP possono essere studiate attraverso la raccolta e l'analisi di proteine o RNA, o in alternativa, attraverso la colorazione immunofluorescente delle cellule DP placcate su coperture in vetro rimovibile. I media possono essere analizzati utilizzando tecniche come le analisi proteomiche, anche se ciò richiederà l'esaurimento dell'album a causa della presenza di siero bovino fetale nei media. Questo protocollo fornisce un metodo semplice che può essere manipolato per studiare le risposte morfologiche, genetiche e citoscheletriche dei neuroni TG e delle cellule DP in risposta all'ambiente controllato di un saggio di co-cultura.
Introduzione
L'innervazione dentale consente ai denti di rilevare pressione, temperatura e infiammazione, che sono tutti cruciali per l'uso e il mantenimento dell'organo dentale. Il mancato rilevamento del dolore dentale associato alla carie dentale e al trauma porta alla progressione della malattia. Pertanto, una corretta innervazione è un requisito per la normale crescita, funzione e cura dei denti.
Mentre la maggior parte degli organi sono completamente funzionali e innervati dal momento della nascita, lo sviluppo dei denti si estende nella vita adulta, con l'innervazione dei denti e la mineralizzazione che si verificano in concerto durante le fasi postnatali1,2. È interessante notare che la polpa dentale (DP) mesenchyme inizialmente secerne segnali repellenti durante l'embriogenesi per impedire l'ingresso dell'assone nell'organo dentale in via di sviluppo, che successivamente si sposta alla secrezione di fattori attrattivi come il dente si avvicina all'eruzione3,4. Durante le fasi postnatali, gli assoni afferenti del nervo trigeminale (TG) penetrano dentro e in tutto il dente intorno al momento in cui inizia la deposizione della dentina (rivisto a Pagella, P. et al.5). Diversi studi in vivo hanno dimostrato che le interazioni neuronale-mesenchymal guidano l'innervazione dentale nei topi (rivisti a Luukko, K. et al.6),ma sono disponibili pochi dettagli dei meccanismi molecolari.
Le co-culture cellulari forniscono ambienti controllati in cui gli investigatori possono manipolare le interazioni tra popolazioni neuronali e mesenchimale. Gli esperimenti di co-cultura consentono di approfondire i percorsi di segnalazione che guidano l'innervazione e lo sviluppo dei denti. Tuttavia, molti dei metodi convenzionali utilizzati per studiare le cellule in co-cultura presentano sfide tecniche. Per esempio, la colorazione viola cristallina della crescita di neurite può non macchiare specificamente le cellule di Schwann incluse nelle dispersioni dei pacchetti TG, e ci possono essere picchi di intensità del colore con risposte relativamente piccole7. Le camere microfluidiche offrono un'opzione interessante, ma sono considerevolmente più costose dei filtri transwell8,9 e consentono solo lo studio delle risposte neuronali alle secrezioni DP. Per affrontare questi problemi, abbiamo sviluppato un protocollo che consente: a) precisa colorazione e imaging della crescita di TG neurite in risposta alle secrezioni DP, b) modificazione genetica delle cellule DP e/o neuroni TG per studiare percorsi di segnalazione specifici, e c) indagine delle risposte delle cellule DP a fattori secreti dai neuroni TG. Questo protocollo offre la possibilità di studiare con precisione diverse caratteristiche dell'innervazione dei denti nell'ambiente controllato di un saggio di co-cultura in vitro.
Protocollo
Tutti gli esperimenti con i topi sono stati approvati dall'UAB Institutional Animal Care and Use Committee (IACUC).
1. Preparazione piastra
NOTA: i coverlips possono essere utilizzati per l'immagine di celle DP alla fine del saggio. Assicurarsi che il coperchio della piastra sia acceso durante tutte le fasi di incubazione e risciacquo al di fuori del cofano di coltura dei tessuti sterili per evitare la contaminazione durante la lavorazione del campione.
-
Preparazione coverslip
- Autoclave correle.
- Filtrare l'acqua ultrapura sotto il cofano.
- Trasferire i copricopertine su una piastra di 24 pozze e coprire ciascuno con 400 litri di 0,1 mg/mL poli-D-lisina.
- Lasciare in ammollo i copricapi, immersi per 5 min, su un rocker a 12 giri/m o shaker orbitale a 40-50 giri/mm. Assicurarsi che il coperchio sia acceso per evitare la contaminazione.
- Sciacquare le coverlips con acqua ultrapura filtrata per circa 5 min su un rocker a 12 giri/m o shaker a 50 giri/. Ripetere.
- Lasciare asciugare i coperchi per almeno 2 h sotto il cofano con il coperchio della piastra spento per facilitare l'evaporazione. Questi copricopertine devono essere utilizzati entro 48 h.
- Le cellule di pesiamo DP in cima coprono i loronubi e il processo alla fine del saggio per l'immunofluorescenza (sezione 3.3).
-
Filtri di rivestimento
- Lamino diluito a 10 g/mL. Filtrare la laminina diluita sotto il cofano.
- Pipette 450-500 -L di 10 g/mL di laminina in ogni pozzo di una piastra di 24 pozze.
- Mettere il filtro transwell, 3 om porosity, in un pozzo in modo che contatti la soluzione di laminina e lasciarlo in un'incubatrice a 37 gradi centigradi per 2 h o per una notte. I pori del filtro dovrebbero consentire ad alcune delle soluzioni di diffondersi e rivestire sia la parte superiore che quella inferiore del filtro. Questi filtri devono essere utilizzati entro 48 h o essere refrigerati a 4 gradi centigradi per un massimo di 1 settimana.
2. Placcatura cellulare con manipolazione genetica opzionale
- Topi: L'alterazione genetica delle cellule DP può essere eseguita (ma non è necessaria) per studiare le interazioni mesenchimal-neuronale. Vedere le sezioni 2.3 e 2.4 per le variazioni genetiche suggerite.
- Dissezione, dispersione e placcatura DP (Figura 1)
NOTA: Per la dissezione DP, utilizzare pinze ultra-fine e dritte. I bordi ultra-fini permetteranno all'utente di cuneo il bordo della pinna tra la struttura mineralizzata e il tessuto DP.- Raccogliere topi P5-P8. In questa fase, i denti dovrebbero essere mineralizzanti e la radice è aperta.
- Anestesizzare i neonati tramite ipotermia mettendoli in un piatto nel frigorifero a 4 gradi centigradi fino a quando non si muovono più o rispondono al tatto. Eutanasia i neonati per decapitazione e in conformità con le procedure IACUC presso l'impianto designato.
- Preparare un 3-5 mL di 0.25% trypsin-EDTA in un tubo conico 50 mL per raccogliere il DP da ogni topo. Ciò faciliterà la digestione della polpa dentale dai topi postnatali. Utilizzare più di 3 mL se digerire il tessuto da più di 10 topi postnatali.
- Posizionare la testa su un sottopad usa e getta in modo che la bocca sia verso il soffitto e la base del collo sia piatta sulla superficie di lavoro. Utilizzare una lama di rasoio in un movimento di segatura per separare la mandibole dalla mascella.
- Facoltativamente, rimuovere la lingua con le forbici o con pinze per consentire un accesso più facile ai molari.
- Posizionare la testa aperta in un piatto in cima a un tampone di garza sterile e posizionare il campione sotto un microscopio sezionante (Figura 1D).
- Rimuovere il tessuto osseo alveolare che circonda i primi molari. I denti submandibolali non sono completamente eruttati a questo punto. Inserire le pinze nell'apertura alveolar e prendere in giro il tessuto lontano dal dente verso il lato buccale (guancia) o linguale (lingua) della bocca. I denti mascellari richiedono la completa rimozione della fessura intorno al dente per l'esposizione e la rimozione.
- Trasferire delicatamente i primi molari submandibolari e mascellari (M1) in un piatto di coltura cellulare separato con 1x salina con buffer di fosfato (PBS).
- Ripetere 2.2.4-2.2.8 fino a quando non vengono raccolti tutti i M1. Conservare il piatto contenente gli M1 sul ghiaccio durante la raccolta.
- Rimuovere l'organo esterno smaltato (EOE) che circonda l'esterno di ogni M1. Questo può essere fatto in alternativa dopo il passaggio 2.2.11.This can alternatively be done after step 2.2.11.
- Con un set di pinze, ruotare l'M1 in modo che le cuspidi siano abbassate e la radice aperta sia esposta. Ci sarà un'apertura ovale sul fondo del dente, e tessuto DP opaco incapsulato da un sottile strato di dentina e smalto.
- Utilizzando la punta delle pinze, allentare delicatamente il DP eseguendo un braccio delle pinze intorno alla circonferenza interna del tessuto mineralizzato. Togliere il tessuto DP dalla struttura mineralizzata e trasferirlo in un terzo piatto contenente 1x PBS. Rimuovere l'EOE se non era già separato (Figura 1E).
- Trasferire tutto il tessuto DP allo 0,25% trypsin-EDTA in un tubo conico da 50 mL. Vorticare la miscela e mettere in un bagno d'acqua tiepida 37 gradi per 10 min. Questo può essere fatto con le stesse pinze o con lunghe pinze fiala. Il tessuto sarà difficile da disperdere e richiederà vortice ogni 3-4 min. NON superare 10 min trypsinizzazione dal momento che la trypsin può danneggiare le membrane cellulari.
- Sotto un cofano sterile, aggiungere i mezzi di comunicazione di cocoltura riscaldati (Tabella 1) ad un rapporto finale di almeno 1:1 media per provare per inattivare l'enzima. I rapporti più grandi sono accettabili se si desidera una maggiore dispersione dei tessuti.
- Pipette il supporto su e giù più volte con una pipetta da 10 mL per disperdere ulteriormente il DP nei media. Fare attenzione a evitare grandi bolle. La completa dispersione è quasi impossibile a causa della natura appiccicosa del tessuto. Tuttavia, non è necessario poiché le cellule migreranno verso l'esterno dal tessuto una volta placcate.
- Trasferire 1 mL del DP disperso in ogni pozzo di una piastra di coltura dei tessuti a 24 pozze(Figura 1F).
- Posizionare la piastra in un'incubatrice a 37 gradi centigradi e consentire alle cellule di attaccarsi e migrare dal tessuto non disperso per 48 h prima di cambiare supporto. Le cellule primarie devono essere placcate a concentrazioni relativamente elevate per raggiungere l'85-90% di confluenza entro 1 settimana. Se questo non viene raggiunto dopo 1 settimana, scartare la piastra.
- Manipolazione genetica opzionale delle cellule DP
- Per alterare le vie di segnalazione cellulare, raccogliere le cellule DP da topi ad urlo genetico o da topi in cui un gene di interesse è affiancato da siti loxP. In quest'ultimo caso, il gene può essere eliminato utilizzando la ricombinani Adenovirus-Cre-GFP (Ad-Cre-GFP) per rimuovere il gene affiancato, come descritto di seguito. Utilizzare Adenovirus-eGFP (Ad-eGFP) come virus di controllo per garantire che l'infezione virale non causi una risposta cellulare.
NOTA: Ad-eGFP è controllato dal promotore CMV, che è molto forte. Ad-Cre-GFP è regolata da un IRES, una regione interna di regolamentazione tra Cre e GFP, che non è molto forte. Ciò si traduce in una fluorescenza più luminosa nelle cellule Ad-eGFP rispetto alle cellule Ad-Cre-GFP. Confermare i livelli di infezione equivalenti in base al numero totale di cellule fluorescing, non sui livelli di fluorescenza cellulare. - Preparare 500 litri di supporti contenenti virus e 10 g/mL di polibrene per pozzo. La polibrena assiste con l'infezione virale nelle cellule vicine alla confluenza10. Questo protocollo si basa su una molteplicità di infezioni (MOI) di 100 per Ad-eGFP e 200 Ad-Cre-GFP per un'infezione genica efficiente con un effetto minimo o nullo sulla vitalità cellulare. Il numero di celle stimato è 4 x 104 celle / pozzetto di una piastra di 24 pozze:
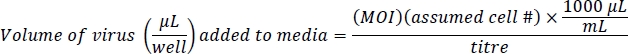
- Mescolare i supporti con un breve vortice o pipettaggio e aggiungere 500 L ad ogni pozzo.
- Dopo 24 h, aggiungere altri 500 l di supporti di co-coltura che non contengono polibrene o virus aggiuntivi.
- Dopo un totale di 48 h, aspirare i media contenenti virus e sostituirli con nuovi media di co-cultura. A questo punto, i neuroni TG possono essere aggiunti in cima filtri transwell.
- Per alterare le vie di segnalazione cellulare, raccogliere le cellule DP da topi ad urlo genetico o da topi in cui un gene di interesse è affiancato da siti loxP. In quest'ultimo caso, il gene può essere eliminato utilizzando la ricombinani Adenovirus-Cre-GFP (Ad-Cre-GFP) per rimuovere il gene affiancato, come descritto di seguito. Utilizzare Adenovirus-eGFP (Ad-eGFP) come virus di controllo per garantire che l'infezione virale non causi una risposta cellulare.
- Dissezione, dispersione e placcatura dei neuroni trigemini
NOTA: In questo protocollo, l'imaging della escrescenza di neurite nella co-coltura con cellule DP è stato ottimizzato utilizzando l'adolescente (6-settimana-vecchio) B6.Cg-Tg(Thy1-YFP)16Topi da parte del I sistemi nervosi centrali e periferici dei topi Thy1-YFP hanno un tag di proteina fluorescente gialla (YFP) la cui espressione inizia intorno al P6-P10 nei neuroni e aumenta esponenzialmente in tutto il sistema nervoso durante la vita postnatale e adulta11,12. YFP e GFP hanno conservato sequenze che permettono a questi nervi di essere macchiati con anticorpi anti-GFP, con conseguente macchia pan-neuronale. In definitiva, questi topi consentono una migliore visualizzazione e quantificazione dei neuroni utilizzati e cresciuti nella coltura cellulare.- Topi adolescenti eutanasi con anidride carbonica seguiti da lussazione cervicale.
- Decapitare i topi e rimuovere la pelle dal cranio. Assicurati di includere un numero equivalente di maschi e femmine.
- Inserire la punta di un paio di forbici micro-dissecting nella base del cranio. Tagliare lungo la sutura sagittale del cranio (Figura 1A).
- Fai quattro piccoli tagli orizzontali: due lungo le suture coronali dalle orecchie e due lungo le suture lambdoid alla base del cranio. Questo dovrebbe creare due lembi di osso.
- Utilizzare le pinze per sbucciare i due lembi di osso. Questo dovrebbe rivelare il cervello.
- Togliete il cervello. Trasferire la testa in un piatto di coltura tissutale con 1x PBS e mettere al microscopio.
- Individuare i gangli TG, facilmente visibili nei roditori13, alloggiati nella materia dura tra il cervello e l'osso del processo mascellare (Figura 1B).
- Tagliare i tre rami che viaggiano agli occhi, mascella e mandibola e trasferire i gangli a freddo 1x PBS utilizzando pinze sottili dritte. Conservare il piatto contenente i gangli TG sul ghiaccio durante la raccolta.
- Una volta raccolti tutti i fasci TG, trasferire i gangli in un tubo conico da 50 mL contenente 5 mg/mL di tipo di collagenae filtrato sterile II utilizzando pinze a fiala.
- Vorticare la collagenasi con il fascio TG e posizionare il tubo in un bagno d'acqua 37 c per 25-30 min. Durante questo periodo, prendere il tubo conico fuori dal bagno d'acqua, vortice, e tornare al bagno ogni 5-10 min.
- Centrifugare la soluzione neuronacollagee-TG per 2 min a 643 x g.
- Sotto un cofano di coltura tissutale, aspirare delicatamente la collagenasi con una micropipetta.
- Aggiungere 5 mL dell'1% di trypsin e vortice filtrati sterilemente. Collocare il tubo conico in un bagno d'acqua di 37 gradi per 5 min.
- Centrifugare il mix trypsin-TG per 5 min a 643 x g. Rimuovere la parte superiore della trypsin con una micropipetta, in modo che i neuroni TG non vengano rimossi. Ci sarà ancora liquido nel tubo.
- Aggiungere un numero sufficiente di supporti per disattivare la trypsin rimanente (a un rapporto 1:1 o inferiore tra la trypsin e il supporto).
- Contare il numero di cellule e diluire la soluzione a 200.000 celle/mL (250 - L di 50.000 celle contenenti celle).
- Posizionare i filtri transwell rivestiti dalla sezione 1.2 in pozzi con DP.
- Diluire la soluzione contenente celle in modo che ci siano 200.000 celle/mL. Pipetta 250 - L sul filtro transwell, e la coltura delle cellule a 37 gradi centigradi durante la notte (Figura 1F).
- Il giorno successivo, sostituire i media con 1 mL di supporti di co-coltura con 1 uridina M e 15 -M 5'-fluor-2'deoxyuridina per fermare la proliferazione eccessiva di cellule mesenchymal che possono impedire la crescita neurite. Facoltativo: aggiungere fattori di crescita o inibitori in questo supporto se si tenta di ulteriori manipolazioni.
- Coltura le celle per ulteriori punti temporali desiderati. Questo protocollo è stato ottimizzato per 5 giorni totali di cultura con i media cambiati solo il giorno 2 per aggiungere inibitori mitotici. Periodi di tempo più lunghi richiederanno ulteriori modifiche ai supporti.
3. Raccolta ed elaborazione dei campioni
- Colorazione trigeminale
- Pipetta 1 mL aliquote di sterile 1x PBS in una piastra di 24 pozze sotto un cappuccio di coltura dei tessuti per ogni filtro transwell da elaborare.
- Rimuovere il liquido in cima al filtro rimosso con una pipetta da 200-1.000 l,fare attenzione a lasciare intatti gli strati cellulari. Le cellule attaccate devono rimanere attaccate e le cellule non attaccate si allentano durante questa delicata pipettatura. Un filtro a vuoto può danneggiare lo strato cellulare e non è raccomandato per l'aspirazione.
- Trasferire il filtro alla piastra 1x PBS, assicurandosi di rimuovere lo strato superiore dei supporti come indicato nel passaggio precedente.
- Posizionare la piastra con tutti i filtri transwell e coperchi su un rocker a 12 giri/m o 40-50 rpm su uno shaker orbitale per 10 min.
- Aspirati il PBS, incluso lo strato superiore come descritto sopra, aggiungere 500 luna di 1xPBS e posizionare sul rocker o shaker orbitale per un ulteriore 5-10 min risciacquo.
- Aspirati il 1x PBS ancora una volta e sostituire con 4% paraformaldeide (PFA). Utilizzare almeno 500 l in modo che l'intera superficie del filtro sia sommersa. Posizionare la piastra su un rocker a 12 giri/m lma o agitatore orbitale a 40-50 giri a temperatura ambiente per 1 h.
- Rimuovere il PFA e sciacquare le piastre due volte per 5-10 min ciascuno su un rocker con 500 L di 1x PBS.
- Blocco con 10% di semastro bovino albumina (BSA) - 5% siero di capra / asino, a seconda dell'animale ospite anticorpale secondario, in 0.05% Tween-1xPBS (PBST). Utilizzare 450-500 l di soluzione in modo che il filtro sia immerso nel liquido.
NOTA: In questa fase, queste piastre possono essere conservate a 4 gradi centigradi per diversi mesi per essere lavorate in un secondo momento. Utilizzare il parafilm per sigillare la piastra per garantire che l'evaporazione non si verifichi e controllare regolarmente l'evaporazione in modo che le superfici del filtro rimangano sommerse. - Rimuovere il blocco e aggiungere 450-500 l di anticorpo primario in 1% BSA-PBST senza un ulteriore risciacquo. Incubare a 4 gradi centigradi, a dondolo dolcemente.
- Rimuovere la soluzione anticorpale primaria e risciacquare con 500 L di 1xPBST su un rocker, 3 volte, a temperatura ambiente
- Rimuovere il PBST, aggiungere anticorpo secondario e incubare su un rocker durante la notte a 4 gradi centigradi avvolto in un foglio di alluminio per proteggere i fluorofori dalla degradazione leggera. Risciacquare di nuovo, 3 volte, con 1x PBST su un rocker a temperatura ambiente. Sostituire con 1x PBS.
NOTA: A questo punto, la piastra può essere conservata per diversi mesi a 4 gradi centigradi se avvolta in un foglio di alluminio per prevenire la degradazione del fluoroforo. Utilizzare il parafilm per sigillare la piastra per garantire che l'evaporazione non si verifichi e controllare regolarmente l'evaporazione in modo che le superfici del filtro rimangano sommerse. E 'meglio immaginare entro un mese. - Per una imaging ottimale, utilizzare i neuroni del topo Thy1-YFP con un anticorpo anti-GFP per macchiare specificamente gli afferenti neuronali ben al di sopra dei livelli di fondo. Utilizzare Anti-Neurofilament 200 per macchiare con precisione le strutture assonali se i topi Thy1-YFP non sono disponibili.
- Immagine come desiderato. I filtri non devono essere placcati e possono invece essere posizionati in cima a un coperchio o a un vetrino per l'imaging con un microscopio invertito.
NOTA: le aree del filtro non conterranno strutture afferenti. Scatta diverse immagini con una profondità z-stack che cattura tutte le strutture afferenti. Utilizzare il software di cucitura per visualizzare la escrescenza neurite su grandi aree, o (preferibilmente) intere regioni di filtro.
- Raccolta di RNA, proteine e supporti
- Mentre i filtri di trasbelno sono in fase di elaborazione, raccogliere i supporti in tubi senza RNAse/DNAse e congelare per i saggi successivi (ELISA, proteomica, ecc.).
- Subito dopo la raccolta dei media, buffer di lisi è o Radio Immuno Precipitazionation Assay (RIPA) tampone con inibitori di proteine e fosforasi nei pozzi. Questo protocollo è stato ottimizzato per 100 l/well in una piastra di 24 pozze.
- Consentire ai buffer di lesi le cellule per 5 minuti, quindi raschiare ogni filtro con una nuova punta di pipetta e raccogliere i campioni di cellule in tubi senza RNAse/DNAse. Congelare la lisi per i saggi futuri (PCR semi-quantitativo e/o quantitativo, macchia occidentale, ecc.).
- Immunofluorescenza facoltativa delle cellule della polpa dentale:
- Sollevare delicatamentei da sezione 1.1 con pinze e trasferirli in diversi pozzi con 4% PFA per 1 h con dondolo.
- Aspirare PFA e risciacquare le coverlips due volte con 1x PBS. Seguire questo con permeabilizzazione, blocco e immunofluorescenza per marcatori di interesse con tecniche di immunofluorescenza standard.
Risultati
Questi risultati mostrano che l'escrescenza di TG neurite è stata aumentata in presenza di cellule primarie DP nel pozzo sottostante rispetto al controllo della monocoltura neurite TG (Figura 2A,C). C'è una certa variabilità saggio-saggio-saggio nella escrescenza neurite. Pertanto, una monocoltura neuronale TG dovrebbe essere inclusa in tutti i saggi come un controllo per rilevare i livelli basali di escrescenza neurite. Le cellule primarie del mouse Tgfbr2f/f sono state utilizzate in questo protocollo dopo che l'infezione di Ad-Cre-GFP e Ad-eGFP è stata confermata in un numero equivalente di cellule (Figura 2D). L'Ad-eGFP servito come un vettore virale di controllo. L'Ad-Cre-GFP ha cancellato il gene fiancheggiato, Tgfbr2, come dimostrato dalla PCR semi-quantitativa (Figura 2E). Nelle culture con trasformazione trasformazione del fattore di crescita beta recettore 2 (Tgfbr2) eliminazione, escrescenza neurite è stata diminuita (Figura 2A-C).
Abbiamo utilizzato i neuroni Thy1-YFP mouse TG e li macchiato con un anticorpo anti-GFP che ha prodotto immagini molto specifiche e luminose di strutture assonali ben al di sopra di questo sfondo, come mostrato Figura 2. Questo ha permesso la colorazione specifica dei marcatori neuronali senza colorazione non specifica delle cellule non neuronali utilizzando metodi precedentemente segnalati come il cristallo viola7. I grandi pori nei filtri possono autofluorizzare e/o accumulare anticorpi secondari e diminuire la precisione dell'imaging assonale (Figura 3). Mentre i neuroni Thy1-YFP con immunofluorescenza migliorano drasticamente l'imaging, ulteriore sfondo può essere rimosso con il software di auto-sogliatura e quindi quantificato. Si consiglia inoltre di eseguire l'immunofluorescenza per Neurofilament 200 sulla base dei nostri risultati preliminari (non mostrati) così come altri8,9 se i topi Thy1-YFP non sono disponibili.

Figura 1: Uno schema della dissezione del mouse per ottenere le cellule per la co-coltura. (A) Un diagramma di dove tagliare per aprire il cranio del topo e individuare i nervi TG, mostrato in nero nell'ultima rappresentazione. Le forbici indicano dove inserire le punte delle forbici per tagliare lungo le linee tratteggiate. (B) Un'immagine combinata di campo scuro e GFP che mostra i nervi Thy1-YFP TG cerchiati in bianco. (C) I gangli TG distratti possono quindi essere dispersi e coltivati, come mostrato in F. (D) La mandibola di un topo P7, con pinze che tengono la mandibola a sinistra e creste ossee alveolar contenenti denti non erogati su ciascun lato della lingua. (E) Tessuto DP (cerchiato) estratto dalla struttura mineralizzata (in alto) e dall'epitelio esterno smaltato (in basso) che è stato rimosso per disperdere e piastrare in una piastra trattata con coltura di tessuto, come mostrato in F. Le immagini non vengono visualizzate in scala. Le cellule DP sono state disperse e cresciute fino a confluenza prima di aggiungere neuroni TG. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Risultati rappresentativi della co-cultura. (A-C) I neuroni Thy1-YFP TG sono stati coltivati in filtri transwell con 3 pori m in cima alle cellule primarie Tgfbr2f/f DP. La colorazione immunofluorescente è stata eseguita per la proteina YFP utilizzando un anticorpo anti-GFP per fornire una colorazione altamente specifica delle strutture neuronali sull'intero filtro. Sono state raccolte e cucite con un software di cucitura le proiezioni massime di 100 m z-stack di microscopia confocale a 10x. I neuroni TG hanno dimostrato una crescita significativamente maggiore quando co-coltivati con cellule DP (A) rispetto a quando coltivati da soli (C). L'escrescenza di Neurite non è stata indotta quando i neuroni sono stati co-coltivati con cellule DP infettate da Ad-Cre-GFP per abbattere Tgfbr2 (B). Barra della scala: 1.000 m. Un numero equivalente di cellule infettate da Ad-eGFP e Ad-Cre-GFP è indicato in (D). Barra della scala: 125 m. La PCR semiquantitativa ha confermato il Tgfbr2 KD (E). Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Difficoltà tecniche presentate nell'imaging afferente. (A) Imaging brightfield di filtri transwell dopo la colorazione viola cristallina delle popolazioni di cellule. I pori grandi sono prevalenti. La grande freccia indica una cella che mostra morfologia mesenchimale, mentre la piccola freccia indica una cellula di morfologia neuronale. Cristallo viola macchiato entrambe le cellule senza pregiudizi. (B) La colorazione immunofluorescente della tubulina di 3 z 3 con un anticorpo secondario Alexa-488 ha mostrato una colorazione non specifica di più cellule, rendendo difficile l'imaging di strutture afferenti. Le immagini sono rappresentative e sono state ripetute su più saggi per ottimizzare l'imaging mostrato nella Figura 2. Barra della scala: 50 m. Fare clic qui per visualizzare una versione più grande di questa figura.
| Componente | Volume | Concentrazione | |
| MEM | 440 mL | ||
| Siero bovino fetale inattivato dal calore | 50 mL | 10% | |
| 100x L-glutamina | 5 mL | 1x (in modo non il | |
| Penicillina-streptomycin 100 x | 5 mL | 1x (in modo non il | |
| Cambiare i media il giorno 2 con inibitori mitotici a queste concentrazioni finali | |||
| Uridina | 1 M | ||
| 5'-Fluor-2'deossiuridina | 15 M | ||
Tabella 1: Media di cocultura.
Discussione
Le attività quotidiane della cavità orale richiedono che i denti percepiscano stimoli esterni e infiammazione interna al fine di consentire un corretto utilizzo e manutenzione. Tuttavia, sono disponibili solo informazioni limitate per quanto riguarda i segnali che guidano i processi di sviluppo dell'innervazione dei denti. Questo protocollo fornisce un metodo per isolare e co-cultura cellule primarie DP e neuroni TG al fine di studiare la comunicazione incrociata tra le due popolazioni. Diverse variabili sono state ottimizzate e lasciano aperte ulteriori vie di ricerca, come descritto di seguito.
I controlli sono importanti in ogni fase di questo saggio. Un filtro transwell con neuroni TG senza cellule DP sottostanti dovrebbe essere incluso in ogni saggio per fornire una linea di base per la crescita TG. Quando si elimina un gene flanked di interesse con una ricombinasi Ad-Cre-GFP, un virus di controllo che esprime solo il marcatore fluorescente deve essere utilizzato per confermare che un numero equivalente di cellule è stato infettato. Mentre abbiamo dimostrato alti livelli di infezione con minima morte cellulare a 100 e 200 MOI per Ad-eGFP e Ad-Cre-GFP, rispettivamente, ogni laboratorio dovrebbe ottimizzare questo passaggio. Poiché le proteine fluorescenti possono essere attaccate a diversi promotori e quindi causare l'espressione differenziale di numeri equivalenti di infetti, le cellule fluorescenti dovrebbero essere contate. L'intensità complessiva della fluorescenza è irrilevante perché non riflette accuratamente lo stato dell'infezione. È importante dimostrare la delezione del gene, come mostrato con la PCR semi-quantitativa in questo protocollo (Figura 2). Anche se questo protocollo non ha affrontato questo argomento, ricerche precedenti hanno dimostrato che i saggi di controllo con altre linee di cellule potrebbero essere inclusi per dimostrare che la crescita di neurite è specificamente indotta dalla co-cultura con le cellule DP8.
Poiché questo protocollo utilizza cellule primarie, ci sono più fasi in cui la contaminazione può essere introdotta. Per evitare questo, tutti i reagenti devono essere sterili filtrati. Inoltre, si raccomanda di eseguire esperimenti per ogni variabile in duplicato o triplice copiato per consentire la rimozione di un filtro e la sterilizzazione di un pozzo contaminato senza un completo fallimento del saggio.
I ritellini devono essere rivestiti con poli-D-lysina e/o una proteina a matrice extracellulare per garantire l'adesione delle cellule DP. Mentre le cellule si attaccano inizialmente, l'infezione virale provoca la morte del sollevamento cellulare su copritrici non rivestite e previene la manipolazione genetica del saggio di co-cultura.
È ben noto che le cellule non neuronali, come le cellule di Schwann dai gangli TG, possono influenzare la sopravvivenza delle cellule neuronali nella coltura14,15,16. In questo protocollo, la sopravvivenza neuronale è stata ottimizzata aggiungendo 1 uridina M e 15 -M 5-fluoro-2'deoxyuridina. Senza l'aggiunta di questi agenti antimitotici per inibire la proliferazione cellulare di Schwann, non si verificherà l'escrescenza di neurite. Non è noto se la presenza di queste cellule senescenti di Schwann nella co-coltura alteri la risposta neuronale. Isolamento neuroni murini richiede diversi passaggi aggiuntivi, e protocolli sono disponibili per gli investigatori che vogliono rimuovere questa variabile17. In entrambi i casi, la dispersione del neurone imita un'assiotomia e potrebbe essere considerata come una ferita/riparazione18 in più rispetto allo sviluppo. Ulteriori studi sarebbero necessari per determinare le differenze tra la crescita assonale in vivo dai fascicoli rispetto alla crescita assonale da singoli neuroni in vitro, e questi non sono affrontati in questo protocollo.
Questo protocollo richiede 1-3 settimane dall'inizio alla fine. Mentre è possibile utilizzare cellule DP che richiedono più di 1 settimana per raggiungere 85-90% confluenza, si raccomanda che le cellule siano semiate ad una densità abbastanza alta per raggiungere la confluenza entro pochi giorni poiché queste cellule si dividono molto lentamente oltre quel punto. Questo richiede generalmente circa 5-7 P5-8 topi per fila di una piastra di 24 pozzetti. Questo protocollo è stato ottimizzato per un totale di 5 giorni di co-cultura, a quel punto i media con fenolo rosso hanno cominciato a cambiare colore. I media dovrebbero essere cambiati se si desidera un lungo sordità.
Diversi saggi di co-cultura sono stati eseguiti per dimostrare l'escrescenza neurite in risposta a fattori secreti dal DP secreted factors con piastre standard di coltura dei tessuti rivestiti ECM3,19,20,21 o camere microfluidiche8,22,23. Questo protocollo offre diversi vantaggi rispetto a questi metodi. Ad esempio, la cocultura dei gangli e dei tessuti TG richiede una relazione spaziale specifica affinché i neuriti percepiscano e rispondano ai segnali paracrini a corto raggio. Con la coltura degli organi, solo i neuriti nei gangli più vicini al tessuto DP sono in grado di rispondere3, mentre i neuroni TG dispersi utilizzati in questo protocollo sono coltivati ad una distanza uguale dalle cellule DP sottostanti. In secondo luogo, le colture di organi possono introdurre necrosi tissutale a causa della mancanza di ossigeno e sostanze nutritive disponibili in grandi campioni24. La co-coltura delle cellule disperse elimina questa possibilità. Alcune co-culture tra cui neuroni richiedono media neuronali3,22 che possono svolgere un ruolo dominante nel promuovere la crescita neurite. Questo protocollo non aggiunge fattori di crescita specifici del neurone, consentendo così una valutazione della relazione diretta tra i segnali paracrini dalle cellule DP sottostanti e le risposte di escrescenza neurite. Vale la pena notare che i mezzi di comunicazione di co-cultura mancano anche di componenti per promuovere la mineralizzazione, come il beta-glicerofosfato. Questo permette agli investigatori di determinare come i neuriti potrebbero secernere segnali per incoraggiare la mineralizzazione. Tuttavia, limita anche lo studio includendo solo cellule DP meno differenziate senza gli odontoblasti mineralizzanti che sarebbero tipicamente presenti in vivo.
Le risposte colorimetriche della ricerca precedente7,8 non delineano i contributi delle cellule di Schwann né dimostrano la morfologia neuronale poiché il viola cristallino non macchia specificamente tutte le cellule. La colorazione immunofluorescente dei filtri può comportare livelli di fondo elevati che rendono difficile l'imaging afferente (Figura 2). Il presente protocollo consente la colorazione precisa degli afferenti neuronali utilizzando i neuroni Thy1-YFP TG e un anticorpo anti-GFP e fornisce un segnale abbastanza luminoso da generare grandi immagini di crescita in un'intera figura (Figura 3). È possibile utilizzare altri marcatori neuronali, come Anti-Neurofilament 200, se i topi Thy1-YFP non sono disponibili.
Infine, l'utilizzo di cellule DP primarie di topi con geni di interesse affiancati da siti loxP consente una semplice ed efficiente delezione di questi geni con un sistema Ad-Cre-GFP. In studi futuri, il sistema ricombinante Ad-Cre potrebbe essere utilizzato sui neuroni TG se hanno un gene di interesse affiancato da siti loxP. Ciò faciliterebbe gli studi su come i segnali paracrini provenienti dalla popolazione neuronale influenzano le cellule DP, in particolare se le cellule DP sono semi in cima ai copricapi (Sezione 1.1). Studi futuri possono utilizzare altre manipolazioni, come l'aggiunta di inibitori farmacologici e/o fattori di crescita. È anche possibile modificare questo protocollo per includere studi di migrazione utilizzando 8 filtri di traslazione porosità.
In conclusione, questo saggio transwell co-cultura utilizzando neuroni e cellule DP consente l'indagine di più parametri cellulari. Questo rende possibile ampliare il corpo di conoscenza sulle interazioni mesenchymal-neuronali che promuovono e supportano l'innervazione dei denti.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto da a) il National Institutes of Health/NIAMS (numeri di sovvenzione R01 AR062507 e R01 AR053860 a RS), b) l'Università dell'Alabama presso Birmingham Dental Academic Research Training (DART) grant (numero T90DE022736 (PI MacDougall)) a SBP dal National Institute of Dental and Craniofacial/National Research Institutes of Health, c) un Centro globale UAB per i disturbi craniofacciali, orali e odontoiatrici (GC-CODED) Pilota e facilità di fattibilità a SBP e d) l'Istituto Nazionale di Odontoiatria e Craniofacial Ricerca/ Istituti nazionali di salute K99 DE024406 sovvenzione a SBP.
Materiali
| Name | Company | Catalog Number | Comments |
| 5-Fluoro-2'-deoxyuridine | Sigma-Aldrich | F0503 | Used as a mitotic Inhibitor at 15 μM concentration in co-culture media, Day 2 |
| 24 Well Cell Culture Plate | Corning | 3524 | Co-culture plate |
| Alexa-546 anti-chicken | Invitrogen | A-11040 | Secondary to stain neurite outgrowth labeled by anti-GFP antibody, 1:500 dilution |
| Anti-GFP Antibody | Aves Lab, Inc | GFP-1010 | Primary antibody to label Thy1-YFP neurons, 1:200 dilution |
| Anti-Neurofilament 200 antibody | Sigma-Aldrich | NO142 | Monoclonal primary antibody to label neurons, 1:1000 dilution, alternative if YFP mice are not available |
| B6;129- Tgfbr2tm1Karl/J | The Jackson Laboratory | 12603 | Tgfbr2f/f mouse model used for dental pulp cells in optimized protocol |
| B6.Cg-Tg(Thy1-YFP)16Jrs/J | The Jackson Laboratory | 3709 | Thy1-YFP mouse model genotype used for trigeminal neurons |
| Collagenase Type II | Millipore | 234155-100MG | Used to disperse trigeminal neurons |
| Fetal Bovine Serum | Gibco | 10437 | Additive to co-culture media |
| Fine forceps | Fine Science Tools | 11413-11 | Fine forceps for TG dissection |
| Laminin | Sigma-Aldrich | L2020 | Coats the transwell inserts at final concentration of 10 μg/ml, stock solution is assumed at 1.5 mg/ml |
| Lysis Buffer (Buffer RLT) | Qiagen | 79216 | Extracts RNA from dental pulp cells post co-culture |
| L-Glutamine | Gibco | 25030081 | Additive to co-culture media |
| Micro-dissecting scissors | Sigma-Aldrich | S3146-1EA | Dissection scissors to open skull |
| Microscope Cover Glass | Fisherbrand | 12-545-81 | Circlular coverslip for optional cell culturing and immunofluorescence processing |
| Minimal Essential Medium a | Gibco | 12571063 | Co-culture media base |
| Penicillin-Streptomycin | Gibco | 15070063 | Antibiotic additive to co-culture media |
| Phosphatase Inhibitor | Sigma-Aldrich | 04 906 837 001 | Additive to RIPA Buffer for extracting protein from dental pulp cells post co-culture |
| Polybrene | Millipore | TR-1003-G | Used to aid in dental pulp cell transfection |
| Poly-D-Lysine | Sigma-Aldrich | P7280 | Coverslip coating to aid dental pulp cellular adhesion |
| Protease Inhibitors | Millipore | 05 892 791 001 | Additive to RIPA Buffer for extracting protein from dental pulp cells post co-culture |
| RNAse/DNAse free eppendorf tubes | Denville | C-2172 | Presterilized 1.7 ml tubes for RNA, DNA or protein collection at the end of assay |
| ThinCert Cell Culture Insert | Greiner Bio-One | 662631 | Transwell inserts for trigeminal neurons in co-culture assays |
| Trypsin-EDTA (0.25%) | Gibco | 25200056 | Used fto disperse dental pulp cells |
| Trypsin Type II | Sigma-Aldrich | T-7409 | Used to disperse trigeminal neurons |
| Ultra Fine Forceps | Fine Science Tools | 11370-40 | Ultra fine forceps for dissection |
| Uridine | Sigma-Aldrich | U3750 | Used as a mitotic Inhibitor at 1 μM concentration in co-culture media, Day 2 |
| Vacuum Filtration System | Millipore | SCNY00060 | Steriflip disposable filter, 50 μm nylon net filter |
| Vial forceps | Fine Science Tools | 110006-15 | Long forceps for tissue transfer to conicals |
Riferimenti
- Moe, K., Sijaona, A., Shrestha, A., Kettunen, P., Taniguchi, M., Luukko, K. Semaphorin 3A controls timing and patterning of the dental pulp innervation. Differentiation. 84 (5), 371-379 (2012).
- Kollar, E. J., Lumsden, A. G. Tooth morphogenesis: the role of the innervation during induction and pattern formation. Journal de biologie buccale. 7 (1), 49-60 (1979).
- Lillesaar, C., Fried, K. Neurites from trigeminal ganglion explants grown in vitro are repelled or attracted by tooth-related tissues depending on developmental stage. Neuroscience. 125 (1), 149-161 (2004).
- Fried, K., Lillesaar, C., Sime, W., Kaukua, N., Patarroyo, M. Target finding of pain nerve fibers: Neural growth mechanisms in the tooth pulp. Physiology & Behavior. 92 (1-2), 40-45 (2007).
- Pagella, P., Jiménez-Rojo, L., Mitsiadis, T. A. Roles of innervation in developing and regenerating orofacial tissues. Cellular and Molecular Life Sciences. 71 (12), 2241-2251 (2014).
- Luukko, K., Kettunen, P. Integration of tooth morphogenesis and innervation by local tissue interactions, signaling networks, and semaphorin 3A. Cell Adhesion & Migration. , 1-9 (2016).
- Smit, M., Leng, J., Klemke, R. L. Assay for neurite outgrowth quantification. BioTechniques. 35 (2), 254-256 (2003).
- de Almeida, J. F. A., Chen, P., Henry, M. A., Diogenes, A. Stem cells of the apical papilla regulate trigeminal neurite outgrowth and targeting through a BDNF-dependent mechanism. Tissue engineering. Part A. 20 (23-24), 3089-3100 (2014).
- Pagella, P., Miran, S., Mitsiadis, T. Analysis of Developing Tooth Germ Innervation Using Microfluidic Co-culture Devices. Journal of Visualized Experiments. (102), e53114(2015).
- Coelen, R. J., Jose, D. G., May, J. T. The effect of hexadimethrine bromide (polybrene) on the infection of the primate retroviruses SSV 1/SSAV 1 and BaEV. Archives of Virology. 75 (4), 307-311 (1983).
- Caroni, P. Overexpression of growth-associated proteins in the neurons of adult transgenic mice. Journal of neuroscience methods. 71 (1), 3-9 (1997).
- Alić, I., et al. Neural stem cells from mouse strain Thy1 YFP-16 are a valuable tool to monitor and evaluate neuronal differentiation and morphology. Neuroscience Letters. 634, 32-41 (2016).
- Howroyd, P. C. Dissection of the Trigeminal Ganglion of Nonrodent Species Used in Toxicology Studies. Toxicologic Pathology. , (2019).
- Schwieger, J., Esser, K. H., Lenarz, T., Scheper, V. Establishment of a long-term spiral ganglion neuron culture with reduced glial cell number: Effects of AraC on cell composition and neurons. Journal of Neuroscience Methods. 268, 106-116 (2016).
- Liu, R., Lin, G., Xu, H. An Efficient Method for Dorsal Root Ganglia Neurons Purification with a One-Time Anti-Mitotic Reagent Treatment. PLoS ONE. 8 (4), 60558(2013).
- Burry, R. W. Antimitotic drugs that enhance neuronal survival in olfactory bulb cell cultures. Brain Research. 261 (2), 261-275 (1983).
- Katzenell, S., Cabrera, J. R., North, B. J., Leib, D. A. Isolation, Purification, and Culture of Primary Murine Sensory Neurons. Methods in molecular biology. 1656, Clifton, N.J. 229-251 (2017).
- Dussor, G. O., Price, T. J., Flores, C. M. Activating transcription factor 3 mRNA is upregulated in primary cultures of trigeminal ganglion neurons. Molecular Brain Research. 118 (1-2), 156-159 (2003).
- Lillesaar, C., Arenas, E., Hildebrand, C., Fried, K. Responses of rat trigeminal neurones to dental pulp cells or fibroblasts overexpressing neurotrophic factors in vitro. Neuroscience. 119 (2), 443-451 (2003).
- Lillesaar, C., Eriksson, C., Fried, K. Rat tooth pulp cells elicit neurite growth from trigeminal neurones and express mRNAs for neurotrophic factors in vitro. Neuroscience Letters. 308 (3), (2001).
- Lillesaar, C., Eriksson, C., Johansson, C. S., Fried, K., Hildebrand, C. Tooth pulp tissue promotes neurite outgrowth from rat trigeminal ganglia in vitro. Journal of neurocytology. 28 (8), 663-670 (1999).
- Chmilewsky, F., Ayaz, W., Appiah, J., About, I., Chung, S. H. Nerve Growth Factor Secretion From Pulp Fibroblasts is Modulated by Complement C5a Receptor and Implied in Neurite Outgrowth. Scientific reports. 6, 31799(2016).
- Pagella, P., Neto, E., Jiménez-Rojo, L., Lamghari, M., Mitsiadis, T. A. Microfluidics co-culture systems for studying tooth innervation. Frontiers in Physiology. 5, 326(2014).
- Miura, T., Yokokawa, R. Tissue culture on a chip: Developmental biology applications of self-organized capillary networks in microfluidic devices. Development, Growth & Differentiation. 58 (6), 505-515 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon