Method Article
치과 펄프 파라크린 신호에 대한 응답으로 노이라이트 의 성장을 연구하는 공동 문화 방법
요약
우리는 치과 펄프 (DP) 1 차 세포의 격리, 분산 및 도금이 지나치게 트랜스웰 필터 위에 배양된 삼차 (TG) 뉴런을 설명합니다. DP 세포의 세포 반응은 면역 형광 또는 RNA /단백질 분석으로 분석 될 수있다. 공초점 현미경검사법을 가진 신경 마커의 면역형광은 신경질성 파생 반응의 분석을 허용합니다.
초록
치아 의 식구는 치아가 압력, 온도 및 염증을 감지 할 수 있게하며, 이 모든 것이 치아 기관의 사용 및 유지 보수에 중요합니다. 감각 적인 내면없이, 매일 구강 활동은 돌이킬 수없는 손상을 일으킬 것입니다. 그 중요성에도 불구하고 치아 발달 및 유지 보수에서 의한 내면화의 역할은 크게 간과되었습니다. 여러 연구는 DP 세포가 치아 안팎으로 TG 축을 유치하고 안내하기 위해 세포외 매트릭스 단백질과 파라크린 신호를 분비한다는 것을 입증했습니다. 그러나, 몇몇 연구 결과는 DP mesenchyme와 신경 구심질 사이 크로스토크에 상세한 통찰력을 제공했습니다. 지식의 이 격차를 해결하기 위하여는, 연구원은 이 상호 작용을 조사하기 위하여 공동 문화 및 다양한 기술을 이용하기 시작했습니다. 여기에서, 우리는 기공을 통해 축산 성장을 허용하기 위하여 큰 직경 기공을 가진 오버리 트랜스웰 필터에 분산된 TG 뉴런을 가진 1 차적인 DP 세포를 공동 배양에서 관련시킨 다중 단계를 보여줍니다. loxP 부위에 의해 측면에 있는 관심 있는 유전자를 가진 1차 DP 세포는 아데노바이러스-Cre-GFP 재조합아제 시스템을 사용하여 유전자 결실을 용이하게 하기 위해 활용되었다. Thy1-YFP 마우스에서 TG 뉴런을 사용하여 공초점 현미경 검사법에 의한 배경 수준 보다 훨씬 높은 표정으로 정밀한 구심성 이미징을 허용했습니다. DP 반응은 단백질 또는 RNA 수집 및 분석을 통해 조사될 수 있고, 또는 탈착식 유리 커버슬립에 도금된 DP 세포의 면역형광 염색을 통해 조사될 수 있다. 미디어는 프로테오믹 분석과 같은 기술을 사용하여 분석할 수 있지만, 미디어에 태아 소 혈청의 존재로 인해 알부민 고갈이 필요합니다. 이 프로토콜은 공동 배양 분석의 조절된 환경에 반응하여 TG 뉴런 및 DP 세포의 형태학적, 유전적, 및 세포골격 반응을 연구하기 위해 조작될 수 있는 간단한 방법을 제공한다.
서문
치아 의 식구는 치아가 압력, 온도 및 염증을 감지 할 수 있게하며, 이 모든 것이 치아 기관의 사용 및 유지 보수에 중요합니다. 치과 충치및 외상과 관련되었던 치아 고통을 감지하지 못하면 질병 진행으로 이끌어 냅니다. 따라서 적절한 내면화는 정상적인 치아 성장, 기능 및 관리를위한 요구 사항입니다.
대부분의 장기는 출생 시부터 완벽하게 기능하고 자극되지만, 치아 발달은 출생 후1,2단계에서 치아 내피와 미네랄화가 동시에 발생하는 성인 생활로 확장됩니다. 흥미롭게도, 치과 펄프 (DP) mesenchyme는 처음에 개발 치아 기관으로 축삭 진입을 방지하기 위해 배아 발생 동안 발충제 신호를 분비, 이는 나중에 치아가분화에가까워짐에 따라 유치인자의 분비로 이동3,4. 출생 후 단계 동안, 삼차 (TG) 신경에서 구심성 축축은 상아질 침착이 시작되는 시간 의 주위에 치아에 침투합니다 (Pagella에서 검토, P.외. 5). 몇몇 생체 내 연구는 뉴런 -mesenchymal 상호 작용이 마우스에서 치아 내심을 안내한다는 것을 입증했다 (Luukko에서 검토, K. 외6),그러나 분자 메커니즘의 몇 가지 세부 사항을 사용할 수 있습니다.
세포 공동 배양은 조사자가 신경과 중간 엽 인구 사이 상호 작용을 조작할 수 있는 통제된 환경을 제공합니다. 공동 배양 실험을 통해 치아 내심 및 발달을 유도하는 신호 경로에 대해 더 깊이 파고들 수 있습니다. 그러나, 공동 배양에서 세포를 연구하기 위하여 이용된 몇몇 전통적인 방법은 기술적인 도전을 제출합니다. 예를 들어, 뉴라이트 의 크리스탈 바이올렛 염색은 TG 번들 분산에 포함된 비특이적 슈완 세포를 비특이적으로 염색할 수 있으며, 상대적으로 작은 반응으로 색 강도가 피크일 수 있다7. 미세 유체 챔버는 매력적인 옵션을 제공하지만 트랜스웰 필터8,9보다 상당히 비싸고 DP 분비에 대한 신경 반응의 조사만 허용합니다. 이러한 문제를 해결하기 위해, 우리는 허용하는 프로토콜을 개발했습니다: a) DP 분비에 대한 응답으로 TG 뉴라이트 의 정확한 염색 및 이미징, b) DP 세포 및/또는 TG 뉴런의 유전자 변형은 특정 신호 전달 경로를 조사하고, c) TG 뉴런에 의해 분비되는 요인에 대한 DP 세포 반응의 조사. 이 프로토콜은 시험관 내 공동 배양 분석법의 조절된 환경에서 치아 내피의 여러 특징을 정밀하게 조사하는 기능을 제공한다.
프로토콜
마우스를 사용한 모든 실험은 UAB 기관 동물 관리 및 사용 위원회(IACUC)에 의해 승인되었습니다.
1. 플레이트 준비
참고: 커버슬립은 분석의 끝에 있는 DP 세포를 이미지화하는 데 사용될 수 있습니다. 시료 처리 중 오염을 방지하기 위해 멸균 조직 배양 후드 외부의 모든 인큐베이션 및 헹구 단계 동안 플레이트 뚜껑이 켜져 있는지 확인하십시오.
-
커버슬립 준비
- 오토클레이브 원형 커버슬립.
- 후드 아래에 초순수를 걸으세요.
- 커버슬립을 24웰 플레이트에 옮기고 0.1 mg/mL 폴리-D-리신 400 μL로 덮습니다.
- 커버슬립을 5분 간 담그고, 12rpm의 로커또는 40-50rpm의 궤도 셰이커에 담가두십시오. 오염을 방지하기 위해 뚜껑이 켜져 있는지 확인하십시오.
- 12rpm에서 로커에 약 5분 간 여과된 초순수로 커버슬립을 헹구거나 50rpm에서 셰이커로 헹구어 줍니다. 반복.
- 커버슬립이 증발을 용이하게 하기 위해 플레이트 뚜껑을 닫고 후드 아래에서 최소 2시간 동안 건조되도록 하십시오. 이러한 커버립은 48 시간 이내에 사용해야합니다.
- 종자 DP 세포는 면역 형광에 대한 분석의 끝에서 전표및 공정을 커버한다 (섹션 3.3).
-
코팅 필터
- 라미닌을 10 μg/mL로 희석합니다. 후드 아래에 희석 된 라미닌을 필터링합니다.
- 파이펫 450-500 μL 의 10 μg/mL 라미닌은 24 웰 플레이트의 각 우물에.
- 트랜스웰 필터, 3 μm 다공성을 잘 에 놓고 라미닌 용액에 접촉하고 2 시간 또는 하룻밤 동안 37 °C 인큐베이터에 둡니다. 필터 기공은 용액의 일부가 필터의 상단과 하단을 모두 확산하고 코팅할 수 있도록 해야 합니다. 이 필터는 48 시간 이내에 사용하거나 최대 1 주 동안 4 °C에서 냉장 보관해야합니다.
2. 선택적 유전자 조작을 가진 세포 도금
- 마우스: DP 세포의 유전 변경은 중간 엽 신경 상호 작용을 연구하기 위하여 수행될 수 있습니다 (그러나 필수는 아닙니다). 제안된 유전 적 변이에 대한 섹션 2.3 및 2.4를 참조하십시오.
- DP 해부, 분산 및 도금(그림 1)
참고: DP 해부를 위해 초미세 직선 포셉을 사용하십시오. 초미세 에지는 사용자가 광물구조와 DP 조직 사이의 포스프 엣지를 쐐기할 수 있게 한다.- 수확 P5-P8 마우스. 이 단계에서 치아는 미네랄화되어야하며 뿌리는 열려 있습니다.
- 더 이상 움직이거나 만지지 않을 때까지 4 °C 냉장고에 접시에 넣어 저체온증을 통해 신생아를 마취. 신생아를 참수하고 지정된 시설의 IACUC 절차에 따라 안락사시.
- 각 마우스로부터 DP를 수집하기 위해 50 mL 원추형 튜브에 0.25% 트립신-EDTA의 3-5 mL aliquot를 준비한다. 이것은 산후 마우스에서 치과 펄프의 소화를 촉진할 것입니다. 10개 이상의 산후 마우스에서 조직을 소화하는 경우 3 mL 이상을 사용하십시오.
- 일회용 언더패드에 머리를 놓아 입이 천장을 향하고 목의 밑면이 작업 표면에 평평해지되도록 합니다. 면도날을 톱질 동작에 사용하여 악악에서 하악골을 분리합니다.
- 선택적으로 가위로 또는 집게로 혀를 제거하여 어금니에 쉽게 접근 할 수 있습니다.
- 열린 머리를 멸균 거즈 패드 꼭대기에 놓고 시편을 해부 현미경 아래에 놓습니다(그림 1D).
- 첫 번째 대구치를 둘러싼 폐포 뼈 조직을 제거합니다. 이 시점에서 치아가 완전히 분출되지 는 않습니다. 폐포 개구부에 집게를 삽입하고 구강의 볼 (뺨) 또는 언어 (혀) 쪽으로 치아에서 멀리 조직을 애타게. 상악 치아는 노출 및 제거를 위해 치아 주위의 갈라진 부분을 완전히 제거해야합니다.
- 1x 인산완충식염수(PBS)로 하악골 과 상악제 첫 어금니(M1s)를 별도의 세포 배양 접시에 부드럽게 옮김을 옮김을 옮김을 옮니다.
- 모든 M1이 수집될 때까지 2.2.4-2.2.8을 반복합니다. 수확 하는 동안 얼음에 M1s를 포함 하는 접시를 유지 합니다.
- 각 M1의 외부를 둘러싼 에나멜 외장기(EOE)를 제거한다. 이 작업은 2.2.11 단계 이후에 수행할 수 있습니다.
- 집게 세트를 사용하여 M1을 회전하여 커프가 다운되고 열린 루트가 노출되도록 합니다. 치아 바닥에 타원형 개구부가 있으며, 불투명 한 DP 조직은 상아질과 에나멜의 얇은 층으로 캡슐화됩니다.
- 집게의 끝을 사용하여 미네랄화된 조직의 내부 둘레에 집게의 한쪽 팔을 실행하여 DP를 부드럽게 풀어보십시오. 광물화된 구조에서 DP 조직을 제거하고 1x PBS를 함유한 세 번째 접시로 옮김. EOE가 아직 분리되지 않은 경우 제거합니다(그림1E).
- 모든 DP 조직을 50 mL 원추형 튜브에서 0.25% 트립신-EDTA로 옮김. 혼합물을 소용돌이시키고 37°C의 따뜻한 수조에 10분 동안 놓습니다. 이것은 동일한 집게 또는 긴 바이알 집게로 수행 할 수 있습니다. 조직은 분산하기 어렵고 3-4 분마다 소용돌이가 필요합니다. 트립신세포막을 손상시킬 수 있기 때문에 10분 트립시니화를 초과하지 마십시오.
- 멸균 후드 하에서, 효소를 비활성화시키기 위해 트립신을 1:1 이상의 최종 비율로 데운 공동 배양배지(표 1)를첨가한다. 더 많은 조직 분산이 필요한 경우 더 큰 비율은 허용됩니다.
- 10mL 파이펫으로 미디어를 위아래로 여러 번 파이펫하여 용지에 DP를 더욱 분산시다. 큰 거품을 피하기 위해 주의하십시오. 완전한 분산은 조직의 끈적 끈적한 특성으로 인해 거의 불가능합니다. 그러나, 세포가 일단 도금된 조직에서 바깥쪽으로 이동하기 때문에 또한 필요하지 않습니다.
- 분산된 DP의 1 mL을 24웰 조직 배양판의 각각의 웰로 이송한다(도1F).
- 플레이트를 37°C의 인큐베이터에 놓고 세포가 분산되지 않은 조직에서 48시간 동안 부착하여 배출한 후 매체를 변경합니다. 1 차 적인 세포는 1 주 안에 85-90% 합류에 도달하기 위하여 상대적으로 높은 농도에서 도금될 필요가 있습니다. 1주일 후에도 이 것을 달성하지 못하면 접시를 버리십시오.
- DP 세포의 선택적 유전자 조작
- 세포 신호 경로를 변경하려면, 유전 녹아웃 마우스에서 또는 관심있는 유전자가 loxP 사이트에 의해 측면에있는 마우스에서 DP 세포를 수확. 후자의 경우에, 유전자는 아래에 설명된 바와 같이, 측면 유전자를 제거하기 위해 아데노바이러스-Cre-GFP(Ad-Cre-GFP) 재조합을 사용하여 삭제될 수 있다. 바이러스 감염이 세포 반응을 일으키지 않도록 대조군 바이러스로서 아데노바이러스-eGFP(Ad-eGFP)를 사용한다.
참고: Ad-eGFP는 CMV 프로모터 인핸서에 의해 제어되며, 이는 매우 강합니다. Ad-Cre-GFP는 매우 강하지 않은 Cre와 GFP 사이의 내부 규제 지역인 IRES에 의해 규제됩니다. 이것은 Ad-Cre-GFP 세포 보다는 Ad-eGFP 세포에 있는 밝은 형광 초래합니다. 세포 형광의 수준에 아니라 형광 세포의 총 수에 따라 동등한 감염 수준을 확인합니다. - 바이러스를 함유한 500 μL의 매질과 10 μg/mL의 폴리브렌을 잘 준비한다. 폴리 브레인은 합류10근처 세포에서 바이러스 감염을 지원합니다. 이 프로토콜은 세포 생존에 거의 또는 전혀 영향을 미치지 않는 효율적인 유전자 감염을 위해 Ad-eGFP와 200 Ad-Cre-GFP에 대해 100의 감염(MOI)의 복합성을 기반으로 합니다. 추정 된 세포 수는 4 x 104 세포 / 24 웰 플레이트의 우물입니다.
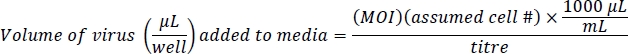
- 짧은 소용돌이 또는 파이펫팅으로 용지를 혼합하고 각 우물에 500 μL을 추가합니다.
- 24시간 후, 추가적인 폴리브렌 또는 바이러스를 포함하지 않는 500 μL의 공동 배양 배지를 추가한다.
- 총 48시간 후, 흡인 바이러스 함유 배지를 흡인하고 신선한 공동 배양 매체로 대체한다. 이 시점에서, TG 뉴런은 트랜스웰 필터 위에 추가될 수 있다.
- 세포 신호 경로를 변경하려면, 유전 녹아웃 마우스에서 또는 관심있는 유전자가 loxP 사이트에 의해 측면에있는 마우스에서 DP 세포를 수확. 후자의 경우에, 유전자는 아래에 설명된 바와 같이, 측면 유전자를 제거하기 위해 아데노바이러스-Cre-GFP(Ad-Cre-GFP) 재조합을 사용하여 삭제될 수 있다. 바이러스 감염이 세포 반응을 일으키지 않도록 대조군 바이러스로서 아데노바이러스-eGFP(Ad-eGFP)를 사용한다.
- 삼차 신경 해부, 분산 및 도금
참고: 이 프로토콜에서는, DP 세포와 공동 배양에 있는 neurite outgrowth의 화상 진찰은 사춘기 (6 주 령) B6.Cg-Tg를 사용하여 최적화되었습니다Thy1-YFP)16Jrs/J 마우스. Thy1-YFP 마우스의 중추 및 말초 신경계에는 노랑 형광 단백질(YFP) 태그가 있는데, 그의 발현은 뉴런에서 P6-P10 주변에서 시작되어 산후 및 성인 생활 중 신경계 전반에 걸쳐 기하급수적으로 증가합니다.11,12. YFP와 GFP는 이러한 신경이 항 GFP 항체로 염색될 수 있도록 하는 서열을 보존하여 범뉴런 얼룩을 초래합니다. 궁극적으로, 이 마우스는 세포 배양에서 사용되고 성장한 뉴런의 더 나은 시각화 및 정량화를 허용한다.- 자궁 경부 탈구 다음 이산화탄소와 사춘기 마우스를 안락사.
- 마우스를 참수하고 두개골에서 피부를 제거합니다. 남성과 여성의 동등한 숫자를 포함해야합니다.
- 한 쌍의 미세 해부 가위 끝을 두개골 바닥에 삽입합니다. 두개골의 시상 봉합사를 따라 잘라(그림 1A).
- 네 개의 작은 수평 컷을 확인: 귀에 의해 관상 봉합사를 따라 두, 두개골의 바닥에 양두 봉합사를 따라 두. 이렇게 하면 두 개의 골격 플랩이 생성됩니다.
- 포셉을 사용하여 뼈의 두 플랩을 다시 벗깁니다. 이것은 두뇌를 드러내야 합니다.
- 뇌를 제거합니다. 머리를 1x PBS로 조직 배양 접시로 옮기고 현미경으로 넣습니다.
- 설치류(13)에서쉽게 볼 수있는 TG 중추를 찾아, 상악 과정의 뇌와 뼈 사이의 경막 질에 보관(그림 1B).
- 눈으로 이동하는 세 가지, 상악및 하악을 잘라 내고 직선 가장자리 미세 집게를 사용하여 중추를 차가운 1x PBS로 옮김을 옮니다. 수확 하는 동안 얼음에 TG 중추를 포함 하는 접시를 유지 합니다.
- 모든 TG 번들이 수확되면, 바이알 집게를 사용하여 5 mg/mL 멸균 여과 콜라게나제 타입 II를 포함하는 50 mL 원추형 튜브로 중추를 옮긴다.
- TG 번들로 콜라게나아제와 소용돌이를 25-30 분 동안 37°C 수조에 튜브를 놓습니다. 이 시간 동안, 수조, 소용돌이에서 원유 튜브를 꺼내, 매 5-10 분마다 목욕으로 돌아갑니다.
- 콜라게나아제-TG 뉴런 용액을 643 x g에서2분 동안 원심분리기.
- 조직 배양 후드 에서, 부드럽게 마이크로 파이펫으로 콜라게나아제를 흡인.
- 1% 멸균 된 트립신 타입 II와 와류의 5 mL을 추가하십시오. 원원관을 37°C 수조에 5분 동안 놓습니다.
- 트립신-TG 믹스를 643 x g에서5분 동안 원심분리기. TG 뉴런이 제거되지 않도록 마이크로 파이펫으로 트립신의 상단 부분을 제거하십시오. 튜브에 액체가 여전히 있을 것입니다.
- 나머지 트립신을 비활성화하기에 충분한 미디어를 추가합니다(미디어에 대한 트립신의 비율이 1:1 또는 더 낮습니다).
- 세포 수를 계산하고 용액을 200,000 셀 / mL (250 μL의 세포 함유 50,000 셀)로 희석합니다.
- 섹션 1.2의 코팅된 트랜스웰 필터를 DP가 있는 우물에 넣습니다.
- 200,000 세포 / mL이 되도록 세포 함유 용액을 희석하십시오. 파이펫 250 μL을 트랜스웰 필터 상에 상하고, 밤새 37°C에서 세포를 배양하였다(도1F).
- 다음날, 배지를 1 μM uridine 및 15 μM 5'-플루오르-2'deoxyuridine으로 공동 배양 배지의 1 mL로 교체하여 중증 성 세포의 과다 증식을 막아 중증 자생을 방지할 수 있습니다. 선택 사항: 추가 조작을 시도하는 경우 이 미디어에 성장 인자 또는 억제제가 추가됩니다.
- 원하는 추가 시간 지점을 위해 세포를 배양합니다. 이 프로토콜은 2일째에만 미디어가 변경된 총 5일간의 배양에 최적화되어 유사분열 억제제를 추가했습니다. 기간이 길수록 추가 미디어 변경이 필요합니다.
3. 샘플 수집 및 처리
- 삼차 염색
- 피펫 1 mL aliquots 멸균 1x PBS를 각 트랜스웰 필터에 대한 조직 배양 후드 하에서 24웰 플레이트 내로 처리한다.
- 200-1,000 μL 파이펫으로 제거할 필터 위에 있는 액체를 제거하고 셀 층을 그대로 두십시오. 부착 된 세포는 부착 된 상태로 유지되어야하며 부착되지 않은 셀은이 부드러운 파이펫팅 중에 느슨해집니다. 진공 필터는 세포 층을 손상시킬 수 있으며 흡인에는 권장되지 않습니다.
- 필터를 1x PBS 플레이트로 옮기고, 이전 단계에서 언급한 바와 같이 미디어의 상부 층을 제거해야 한다.
- 모든 트랜스웰 필터와 뚜껑이 있는 플레이트를 12rpm 또는 40-50rpm의 로커에 10분 동안 궤도 셰이커에 놓습니다.
- 위에서 설명한 바와 같이 상부 층을 포함한 PBS를 흡인하고, 1xPBS의 500 μL을 추가하고 로커 또는 궤도 셰이커에 놓고 5-10 분 간 헹구어 줍니다.
- 1x PBS를 한 번 더 흡인하고 4% 파라포름알데히드(PFA)로 대체합니다. 전체 필터 표면이 침수되도록 적어도 500 μL을 사용합니다. 플레이트를 로커에 12rpm 또는 궤도 셰이커를 실온에서 40-50rpm으로 1시간 동안 놓습니다.
- PFA를 제거하고 1x PBS의 500 μL로 로커에서 각각 5-10 분 동안 플레이트를 두 번 헹구고.
- 10% 소 혈청 알부민 (BSA) + 5 % 염소 / 당나귀 혈청을 차단, 이차 항체 숙주 동물에 따라, 0.05 % 트위엔 -1xPBS (PBST). 450-500 μL의 용액을 사용하여 필터가 액체에 잠기게 하십시오.
참고 :이 단계에서, 이러한 플레이트는 나중에 처리하기 위해 몇 달 동안 4 °C에서 저장할 수 있습니다. 파라필름을 사용하여 플레이트를 밀봉하여 증발이 발생하지 않도록 하고 정기적으로 증발을 확인하여 필터 표면이 침수된 상태로 유지되도록 하십시오. - 블록을 제거하고 추가 헹구지 않고 1 % BSA-PBST에서 1 % 1 % 1 차 항체의 450-500 μL을 추가하십시오. 밤새 4 °C에서 배양하고 부드럽게 흔들어 주세요.
- 1차 항체 용액을 제거하고 로커에서 500 μL의 1xPBST로 실온에서 3회 헹구어 보시고
- PBST를 제거하고, 이차 항체를 추가하고 알루미늄 호일에 싸여 4 °C에서 밤새 로커에 배양하여 광 분해로부터 형광을 보호하십시오. 실온에서 로커에 1x PBST로 다시 3회 헹구십시오. 1x PBS로 교체합니다.
참고 : 이 시점에서, 플레이트는 불소 열화를 방지하기 위해 알루미늄 호일에 싸여있는 경우 4 °C에서 몇 개월 동안 보관 될 수있다. 파라필름을 사용하여 플레이트를 밀봉하여 증발이 발생하지 않도록 하고 정기적으로 증발을 확인하여 필터 표면이 침수된 상태로 유지되도록 하십시오. 그것은 한 달 이내에 이미지하는 것이 가장 좋습니다. - 최적의 이미징을 위해, 안티 GFP 항체를 가진 Thy1-YFP 마우스 뉴런을 활용하여 배경 수준보다 신경 구심을 구체적으로 염색합니다. Thy1-YFP 마우스를 사용할 수 없는 경우 축삭 구조를 정확하게 염색하기 위해 항 신경 필라멘트 200을 사용하십시오.
- 원하는 대로 이미지. 필터는 도금할 필요가 없으며 대신 거꾸로 된 현미경으로 이미징을 위해 커버슬립 이나 슬라이드 위에 놓을 수 있습니다.
참고: 필터 영역에는 구심성 구조가 포함되지 않습니다. 모든 구심성 구조를 캡처하는 z-stack 깊이로 여러 이미지를 촬영합니다. 스티치 소프트웨어를 사용하여 넓은 영역 또는 전체 필터 영역에 대한 신경구 의 자성장을 시각화하십시오.
- RNA, 단백질 및 미디어 수집
- 트랜스웰 필터가 처리되는 동안 RNAE/DNAse 없는 튜브에서 미디어를 수집하고 이후 의학적 조사(ELISA, 프로테오믹스 등)를 위해 동결합니다.
- 미디어 수집 직후, 알리쿼트 리시스 버퍼 또는 라디오 면역 침전 분석(RIPA) 완충액과 단백질효소 및 인산아제 억제제가 웰내로. 이 프로토콜은 24웰 플레이트에서 100 μL/well에 최적화되었습니다.
- 버퍼가 세포를 5분 동안 용해시키도록 허용한 다음 새 파이펫 팁으로 각 필터를 긁어내고 RNAe/DNAse 가없는 튜브에서 세포 샘플을 수집합니다. 향후 분석(반정량 및/또는 정량적 PCR, 웨스턴 블롯 등)에 대한 용해를 동결합니다.
- 치과 펄프 세포의 선택적 면역 형광 :
- 포셉으로 섹션 1.1의 커버슬립을 부드럽게 들어 올리고 흔들림으로 1 시간 동안 4 % PFA로 다른 우물로 옮김하십시오.
- PFA를 흡인하고 1x PBS로 커버슬립을 두 번 헹구세요. 표준 면역 형광 기술로 관심있는 마커에 대한 투과, 차단 및 면역 형광으로 이것을 따르십시오.
결과
이러한 결과는 TG 뉴라이트 단문화의 대조군과 비교하여 기본에서 1차 DP 세포의 존재에서 TG 뉴라이트 의 자성장이 증가하였다는 것을보여준다(도 2A,C). 신경외 분석 결과에서 몇 가지 분석-대-분석 가변성이 있다. 따라서, TG 뉴런 단일배양은 뉴라이트 의 기저 수준을 검출하는 대조군으로서 모든 검역사에 포함되어야 한다. Tgfbr2f/f 마우스로부터의 1차 세포는 Ad-Cre-GFP 및 Ad-eGFP의 감염 후 이 프로토콜에서 사용되었고, 동등한 수의세포(도 2D)에서확인되었다. Ad-eGFP는 대조군 바이러스 벡터로서 작용하였다. Ad-Cre-GFP는 반정적 PCR(도2E)에의해 입증된 바와 같이 측면 유전자인 Tgfbr2를 삭제하였다. 배양에서 베타 수용체 2(Tgfbr2) 결실을 변형시키고, 신경외자 자성장이 감소하였다(도2A-C).
우리는 Thy1-YFP 마우스 TG 뉴런을 활용하고 그림 2와같이 이 배경 위에 축삭 구조의 매우 구체적이고 밝은 이미지를 생성하는 항 GFP 항체로 염색했습니다. 이는 크리스탈 바이올렛7과같은 이전에 보고된 방법을 활용하여 비특이적 인 뉴런 세포의 비 특이적 염색없이 뉴런 마커의 특정 염색을 허용했다. 필터의 큰 기공은 이차 항체를 오토플루오르거나 축적할 수 있으며 축색 이미징의 정밀도를 떨어뜨릴 수있습니다(그림 3). 면역 형광을 가진 Thy1-YFP 뉴런이 이미징을 크게 향상시키는 동안, 추가 배경은 자동 임계값 소프트웨어로 제거한 다음 정량화할 수 있습니다. 우리는 또한 신경 필라멘트에 대 한 면역 형 광를 수행 하는 것이 좋습니다 200 우리의 예비 결과에 따라 (도시되지 않음) 뿐만 아니라 다른 사람8,9 Thy1-YFP 마우스를 사용할 수 없는 경우.

도 1: 공동 배양세포를 얻기 위해 마우스 해부의 개략적. (A)마지막 묘사에서 검은 색으로 표시된 마우스 두개골을 열고 TG 신경을 찾기 위해 잘라낼 위치의 다이어그램입니다. 가위는 점선을 따라 잘라낼 가위 끝을 삽입할 위치를 나타냅니다. (B)Thy1-YFP+ TG 신경을 흰색으로 동그라미를 보여주는 다크필드 및 GFP 이미지가 결합된 이미지. (C)해부TG 중추는 F에도시된 바와 같이 분산및 배양될 수 있다. (D)P7 마우스의 하악골, 포셉이 왼쪽에 하악골을 들고 있고 혀 의 양쪽에 분출되지 않은 치아가 들어있는 폐포 뼈 능선. (e)광물화된 구조(top)로부터 추출된 DP 조직(circled)과 에나멜 외피(아래)를 제거하여 조직 배양판에 분산 및 플레이트를 제거하였고, F에도시된 바와 같이. 이미지의 배율이 표시되지 않습니다. DP 세포는 TG 뉴런을 첨가하기 전에 합류하도록 분산및 성장하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 공동 문화권에서 나온 대표적인 결과. (A-C) Thy1-YFP TG 뉴런은 1차 Tgfbr2f/f DP 세포 위에 3 μm 기공을 가진 트랜스웰 필터에서 배양되었다. 면역형광 염색은 전체 필터에 걸쳐 신경 구조의 고도로 특이적인 염색을 제공하기 위해 항 GFP 항체를 사용하여 YFP 단백질에 대해 수행되었다. 10x에서 100 μm z 스택 공초점 현미경 현미경 의 최대 투영을 수집하고 스티치 소프트웨어로 바느질했다. TG 뉴런은 단독으로 배양할 때보다 DP세포(A)와공동 배양할 때 훨씬 더 많은 자생을 입증하였다(C). 뉴런이 Ad-Cre-GFP에 감염된 DP 세포와 공동 배양되었을 때 뉴런이 Tgfbr2(B)를 무너뜨리도록 유도되지 않았다. 배율 막대 = 1,000 μm. Ad-eGFP 및 Ad-Cre-GFP에 감염된 세포의 동등한 수는(D)에도시되어 있다. 배율 막대 = 125 μm. 반정량PCR은 Tgfbr2 KD(E)를확인하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 구심성 이미징에서 제시된 기술적 어려움. (A)세포 집단의 크리스탈 바이올렛 염색 후 트랜스웰 필터의 브라이트필드 이미징. 큰 모공이 널리 퍼져 있습니다. 큰 화살표는 중간 엽 형태를 나타내는 세포를 가리키는 반면 작은 화살표는 신경 형태세포를 가리킵니다. 크리스탈 바이올렛은 편견없이 두 세포를 염색. (B)Alexa-488 이차 항체를 가진 β3 tubulin의 면역 형광 염색은 다중 세포의 비특이적 염색을 보여주었고, 구심성 구조의 이미징을 어렵게 하였다. 이미지는 대표적인 것으로, 도 2에도시된 이미징을 최적화하기 위해 여러 개의 시정을 통해 반복되었다. 배율 막대 = 50 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 구성 요소 | 볼륨 | 농도 | |
| MEM α | 440 mL | ||
| 열 불활성화 태아 소 세루메 | 50 mL | 10% | |
| L-글루타민 100x | 5 mL | 1x | |
| 페니실린 연쇄상 구균 100 x | 5 mL | 1x | |
| 이러한 최종 농도에서 유사분열 억제제로 2일째에 미디어를 변경 | |||
| 우리딘 (미국) | 1 μM | ||
| 5'-플루오르-2'데옥시우리딘 | 15 μM | ||
표 1: 공동 문화 미디어.
토론
구강의 일상 적인 활동은 치아가 적절한 사용과 유지 보수를 허용하기 위해 외부 자극과 내부 염증을 감지해야합니다. 그러나 치아 내막의 발달 과정을 이끄는 신호와 관련하여 제한된 정보만 사용할 수 있습니다. 이 프로토콜은 두 집단 간의 교차 통신을 연구하기 위해 1차 DP 세포 및 TG 뉴런을 분리하고 공동 배양하는 방법을 제공한다. 몇 가지 변수가 최적화되었고 아래에 설명된 대로 연구의 추가 길을 열어 두십시오.
컨트롤은 이 분석의 모든 단계에서 중요합니다. 기본 DP 세포가 없는 TG 뉴런을 가진 트랜스웰 필터는 TG 성장을 위한 기준선을 제공하기 위하여 모든 분석제에 포함되어야 합니다. Ad-Cre-GFP 재조합으로 관심 있는 측면 유전자를 삭제할 때 형광 마커만을 발현하는 대조군 바이러스가 동등한 수의 세포가 감염되었음을 확인하는 데 사용되어야 합니다. 우리는 Ad-eGFP와 Ad-Cre-GFP를 위한 100 그리고 200 MOI에 최소한의 세포 죽음으로 감염의 상부를 각각 설명하는 동안, 각 실험실은 이 단계를 낙하해야 합니다. 형광 단백질은 다른 프로모터에 부착될 수 있고 그러므로 감염된의 차등 발현 동등한 수를 일으키는 원인이 되기 때문에, 형광 세포는 계산되어야 합니다. 형광의 전반적인 강도는 감염 상태를 정확하게 반영하지 않기 때문에 무관합니다. 이 프로토콜에서 반정량적 PCR과 같이 유전자의 결실을 입증하는 것이중요하다(도 2). 이 프로토콜이 이 주제를 다루지 는 않았지만, 이전 연구는 다른 세포 라인을 가진 대조군 분석이 DP세포8과의공동 배양에 의해 구체적으로 유도된다는 것을 입증하기 위해 포함될 수 있음을 입증하였다.
이 프로토콜은 1 차적인 세포를 이용하기 때문에, 오염이 소개될 수 있는 다중 단계가 있습니다. 이를 방지하기 위해 모든 시약을 멸균하여 여과해야 합니다. 또한, 모든 변수에 대한 실험을 중복 또는 삼중항으로 실행하여 필터를 제거하고 오염된 오염된 우물을 완전히 고장없이 제거할 것을 권장합니다.
커버슬립은 DP 세포 부착을 보장하기 위해 폴리-D-리신 및/또는 세포외 매트릭스 단백질로 코팅되어야 합니다. 세포가 처음에 붙이는 동안, 바이러스성 감염은 코팅되지 않은 커버립에 세포를 들어 올리는 죽음을 일으키는 원인이 되고 공동 문화 분석의 유전 조작을 방지합니다.
TG 중추로부터의 슈완 세포와 같은 비신경세포가배양14,15,16에서뉴런 세포의 생존에 영향을 미칠 수 있다는 것은 잘 확립되어 있다. 이 프로토콜에서, 뉴런 생존은 1 μM uridine 및 15 μM 5-플루오로-2'데옥시우리딘을 첨가하여 최적화되었다. 이러한 항미토제의 첨가없이 슈완 세포 증식을 억제, 신경세포 자성장이 발생하지 않을 것이다. 이러한 노화 슈완 세포의 존재가 공동 배양에서 뉴런 반응을 변화시키는지 여부는 알려지지 않았다. 뮤린 뉴런을 분리하려면 몇 가지 추가 단계가 필요하며 이 변수17을제거하려는 조사자가 프로토콜을 사용할 수 있습니다. 두 경우 모두, 뉴런 분산은 다소 축축을 모방하고 개발보다 부상 / 수리18 을 나타내는 것으로 간주 될 수있다. 추가 연구는 생체 외에서 개별 뉴런에서 축 색 성장 대 fascicles에서 생체 내 축 축 축 성장 사이의 차이 결정 하는 데 필요한 것, 그리고 이들은이 프로토콜에서 해결 되지 않습니다.
이 프로토콜은 처음부터 끝까지 1-3 주가 걸립니다. 85-90% 합류에 도달하기 위하여 1 주일 이상 을 요구하는 DP 세포를 이용하는 것이 가능하 동안, 이 세포가 그 점을 지나서 아주 천천히 분할하기 때문에 세포가 며칠 안에 합류에 도달하기 위하여 충분히 높은 밀도에서 파종되는 것이 좋습니다. 이것은 일반적으로 24 웰 플레이트의 행 당 약 5-7 P5-8 마우스를 요구합니다. 이 프로토콜은 총 5일간의 공동 배양에 최적화되었으며, 이 때 페놀 레드를 가진 미디어가 색을 이동하기 시작했다. 더 긴 assays가 필요한 경우에 매체는 변경되어야 합니다.
몇몇 공동 배양 어설주는 표준 ECM 코팅된 조직 배양판3,19,20,21 또는 미세유체 챔버8,22,23을가진 DP 분비 인자에 의해 분비된 인자에 반응하여 neurite 의 성장을 입증하기 위해 수행되었다. 이 프로토콜은 이러한 메서드에 비해 몇 가지 이점을 제공합니다. 예를 들어, TG 신경절 및 DP 조직 공동 배양은 뉴라이트가 단거리 파라크린 신호를 감지하고 반응하기 위한 특정 공간 적 관계를 필요로 합니다. 장기 배양으로, DP 조직에 가장 가까운 중추에 있는 신경대만3반응할수 있는 반면, 이 프로토콜에 사용된 분산된 TG 뉴런은 아래 DP 세포로부터 동등한 거리에서 배양된다. 둘째, 장기 배양물은 큰시료(24)에서이용 가능한 산소 및 영양소의 부족으로 인한 조직 괴사를 도입할 수 있다. 분산된 세포의 공동 배양은 이러한 가능성을 제거합니다. 뉴런을 포함한 일부 공동 배양은 뉴런 배지3,22를 필요로 하며 이는 신경성 의 자성장을 촉진하는 데 지배적인 역할을 할 수 있다. 이 프로토콜은 뉴런 특이적 성장 인자를 추가하지 않으므로, 근본적인 DP 세포와 뉴라이트 의 자성장 반응으로부터의 파라크린 신호 사이의 직접적인 관계를 평가할 수 있다. 공동 배양 매체는 또한 베타 글리세로 인산염과 같은 미네랄화를 촉진하는 성분이 부족하다는 점에 주목할 필요가 있습니다. 이를 통해 연구자들은 신경염이 어떻게 신호를 분비하여 광물화를 촉진할 수 있는지 를 결정할 수 있습니다. 그러나, 또한 생체 내에서 전형적으로 존재할 광물화 오돈토블라스트없이 덜 분화된 DP 세포를 포함시킴으로써 연구를 제한한다.
이전 연구7,8에서 착색 반응은 슈완 세포 기여를 묘사하거나 크리스탈 바이올렛이 모든 세포를 구체적으로 얼룩지게하기 때문에 신경 형태를 입증하지 않는다. 필터의 면역 형광 염색은 구심성 이미징을 어렵게 만드는 높은 배경 수준을 초래할 수 있습니다(그림 2). 본 프로토콜은 Thy1-YFP TG 뉴런 및 항-GFP 항체를 활용하여 뉴런 구심질의 정확한 염색을 허용하고 전체 그림전반에 걸쳐 성장의 큰 이미지를 생성할 수 있을 만큼 충분히 밝은 신호를제공한다(그림 3). Thy1-YFP 마우스를 사용할 수 없는 경우 항 신경 필라멘트 200과 같은 다른 뉴런 마커를 활용할 수 있습니다.
마지막으로, loxP 사이트에 의해 측면에 관심있는 유전자를 가진 마우스에서 1 차적인 DP 세포를 사용하여 Ad-Cre-GFP 시스템을 가진 이 유전자의 간단하고 능률적인 삭제를 허용합니다. 향후 연구에서, Ad-Cre 재조합 시스템 tG 뉴런에 사용할 수 있는 경우 그들은 loxP 사이트에 의해 측면 관심의 유전자. 이것은 신경 인구에서 paracrine 신호가 DP 세포에 영향을 미치는 방법에 대한 연구를 용이하게 할 것입니다, DP 세포가 커버 립스 위에 시드되는 경우에 특히 (섹션 1.1). 미래 연구는 다른 조작을 활용할 수 있습니다., 약리학 억제제 및 성장 인자의 추가 등. 또한 8 μm 다공성 트랜스웰 필터를 사용하여 마이그레이션 연구를 포함하도록 이 프로토콜을 수정할 수도 있습니다.
결론적으로, 뉴런 및 DP 세포를 이용한 이 트랜스웰 공동 배양 분석법은 다중 세포 파라미터의 조사를 허용한다. 이것은 가능 하 게 촉진 하 고 치아 내심을 지원 하는 중간 엽-신경 상호 작용에 대 한 지식의 시체를 확대.
공개
저자는 공개 할 것이 없다.
감사의 말
이 작품은 a) 국립 보건 원 (보조금 번호 R01 AR062507 및 R01 AR053860 에 RS), b) 버밍엄 치과 학술 연구 교육 (DART) 보조금 (번호 T90DE022736 (PI 맥두걸)) 국립 치과 연구소에서 SBP에 알라바마 대학 c) UAB 글로벌 두개안면, 구강 및 치과 장애 센터(GC-CODED) SBP 및 d에 대한 파일럿 및 타당성 보조금) 국립 치과 및 두개안면 연구소 연구/국립 보건원 K99 DE024406 SBP 에 대한 보조금.
자료
| Name | Company | Catalog Number | Comments |
| 5-Fluoro-2'-deoxyuridine | Sigma-Aldrich | F0503 | Used as a mitotic Inhibitor at 15 μM concentration in co-culture media, Day 2 |
| 24 Well Cell Culture Plate | Corning | 3524 | Co-culture plate |
| Alexa-546 anti-chicken | Invitrogen | A-11040 | Secondary to stain neurite outgrowth labeled by anti-GFP antibody, 1:500 dilution |
| Anti-GFP Antibody | Aves Lab, Inc | GFP-1010 | Primary antibody to label Thy1-YFP neurons, 1:200 dilution |
| Anti-Neurofilament 200 antibody | Sigma-Aldrich | NO142 | Monoclonal primary antibody to label neurons, 1:1000 dilution, alternative if YFP mice are not available |
| B6;129- Tgfbr2tm1Karl/J | The Jackson Laboratory | 12603 | Tgfbr2f/f mouse model used for dental pulp cells in optimized protocol |
| B6.Cg-Tg(Thy1-YFP)16Jrs/J | The Jackson Laboratory | 3709 | Thy1-YFP mouse model genotype used for trigeminal neurons |
| Collagenase Type II | Millipore | 234155-100MG | Used to disperse trigeminal neurons |
| Fetal Bovine Serum | Gibco | 10437 | Additive to co-culture media |
| Fine forceps | Fine Science Tools | 11413-11 | Fine forceps for TG dissection |
| Laminin | Sigma-Aldrich | L2020 | Coats the transwell inserts at final concentration of 10 μg/ml, stock solution is assumed at 1.5 mg/ml |
| Lysis Buffer (Buffer RLT) | Qiagen | 79216 | Extracts RNA from dental pulp cells post co-culture |
| L-Glutamine | Gibco | 25030081 | Additive to co-culture media |
| Micro-dissecting scissors | Sigma-Aldrich | S3146-1EA | Dissection scissors to open skull |
| Microscope Cover Glass | Fisherbrand | 12-545-81 | Circlular coverslip for optional cell culturing and immunofluorescence processing |
| Minimal Essential Medium a | Gibco | 12571063 | Co-culture media base |
| Penicillin-Streptomycin | Gibco | 15070063 | Antibiotic additive to co-culture media |
| Phosphatase Inhibitor | Sigma-Aldrich | 04 906 837 001 | Additive to RIPA Buffer for extracting protein from dental pulp cells post co-culture |
| Polybrene | Millipore | TR-1003-G | Used to aid in dental pulp cell transfection |
| Poly-D-Lysine | Sigma-Aldrich | P7280 | Coverslip coating to aid dental pulp cellular adhesion |
| Protease Inhibitors | Millipore | 05 892 791 001 | Additive to RIPA Buffer for extracting protein from dental pulp cells post co-culture |
| RNAse/DNAse free eppendorf tubes | Denville | C-2172 | Presterilized 1.7 ml tubes for RNA, DNA or protein collection at the end of assay |
| ThinCert Cell Culture Insert | Greiner Bio-One | 662631 | Transwell inserts for trigeminal neurons in co-culture assays |
| Trypsin-EDTA (0.25%) | Gibco | 25200056 | Used fto disperse dental pulp cells |
| Trypsin Type II | Sigma-Aldrich | T-7409 | Used to disperse trigeminal neurons |
| Ultra Fine Forceps | Fine Science Tools | 11370-40 | Ultra fine forceps for dissection |
| Uridine | Sigma-Aldrich | U3750 | Used as a mitotic Inhibitor at 1 μM concentration in co-culture media, Day 2 |
| Vacuum Filtration System | Millipore | SCNY00060 | Steriflip disposable filter, 50 μm nylon net filter |
| Vial forceps | Fine Science Tools | 110006-15 | Long forceps for tissue transfer to conicals |
참고문헌
- Moe, K., Sijaona, A., Shrestha, A., Kettunen, P., Taniguchi, M., Luukko, K. Semaphorin 3A controls timing and patterning of the dental pulp innervation. Differentiation. 84 (5), 371-379 (2012).
- Kollar, E. J., Lumsden, A. G. Tooth morphogenesis: the role of the innervation during induction and pattern formation. Journal de biologie buccale. 7 (1), 49-60 (1979).
- Lillesaar, C., Fried, K. Neurites from trigeminal ganglion explants grown in vitro are repelled or attracted by tooth-related tissues depending on developmental stage. Neuroscience. 125 (1), 149-161 (2004).
- Fried, K., Lillesaar, C., Sime, W., Kaukua, N., Patarroyo, M. Target finding of pain nerve fibers: Neural growth mechanisms in the tooth pulp. Physiology & Behavior. 92 (1-2), 40-45 (2007).
- Pagella, P., Jiménez-Rojo, L., Mitsiadis, T. A. Roles of innervation in developing and regenerating orofacial tissues. Cellular and Molecular Life Sciences. 71 (12), 2241-2251 (2014).
- Luukko, K., Kettunen, P. Integration of tooth morphogenesis and innervation by local tissue interactions, signaling networks, and semaphorin 3A. Cell Adhesion & Migration. , 1-9 (2016).
- Smit, M., Leng, J., Klemke, R. L. Assay for neurite outgrowth quantification. BioTechniques. 35 (2), 254-256 (2003).
- de Almeida, J. F. A., Chen, P., Henry, M. A., Diogenes, A. Stem cells of the apical papilla regulate trigeminal neurite outgrowth and targeting through a BDNF-dependent mechanism. Tissue engineering. Part A. 20 (23-24), 3089-3100 (2014).
- Pagella, P., Miran, S., Mitsiadis, T. Analysis of Developing Tooth Germ Innervation Using Microfluidic Co-culture Devices. Journal of Visualized Experiments. (102), e53114(2015).
- Coelen, R. J., Jose, D. G., May, J. T. The effect of hexadimethrine bromide (polybrene) on the infection of the primate retroviruses SSV 1/SSAV 1 and BaEV. Archives of Virology. 75 (4), 307-311 (1983).
- Caroni, P. Overexpression of growth-associated proteins in the neurons of adult transgenic mice. Journal of neuroscience methods. 71 (1), 3-9 (1997).
- Alić, I., et al. Neural stem cells from mouse strain Thy1 YFP-16 are a valuable tool to monitor and evaluate neuronal differentiation and morphology. Neuroscience Letters. 634, 32-41 (2016).
- Howroyd, P. C. Dissection of the Trigeminal Ganglion of Nonrodent Species Used in Toxicology Studies. Toxicologic Pathology. , (2019).
- Schwieger, J., Esser, K. H., Lenarz, T., Scheper, V. Establishment of a long-term spiral ganglion neuron culture with reduced glial cell number: Effects of AraC on cell composition and neurons. Journal of Neuroscience Methods. 268, 106-116 (2016).
- Liu, R., Lin, G., Xu, H. An Efficient Method for Dorsal Root Ganglia Neurons Purification with a One-Time Anti-Mitotic Reagent Treatment. PLoS ONE. 8 (4), 60558(2013).
- Burry, R. W. Antimitotic drugs that enhance neuronal survival in olfactory bulb cell cultures. Brain Research. 261 (2), 261-275 (1983).
- Katzenell, S., Cabrera, J. R., North, B. J., Leib, D. A. Isolation, Purification, and Culture of Primary Murine Sensory Neurons. Methods in molecular biology. 1656, Clifton, N.J. 229-251 (2017).
- Dussor, G. O., Price, T. J., Flores, C. M. Activating transcription factor 3 mRNA is upregulated in primary cultures of trigeminal ganglion neurons. Molecular Brain Research. 118 (1-2), 156-159 (2003).
- Lillesaar, C., Arenas, E., Hildebrand, C., Fried, K. Responses of rat trigeminal neurones to dental pulp cells or fibroblasts overexpressing neurotrophic factors in vitro. Neuroscience. 119 (2), 443-451 (2003).
- Lillesaar, C., Eriksson, C., Fried, K. Rat tooth pulp cells elicit neurite growth from trigeminal neurones and express mRNAs for neurotrophic factors in vitro. Neuroscience Letters. 308 (3), (2001).
- Lillesaar, C., Eriksson, C., Johansson, C. S., Fried, K., Hildebrand, C. Tooth pulp tissue promotes neurite outgrowth from rat trigeminal ganglia in vitro. Journal of neurocytology. 28 (8), 663-670 (1999).
- Chmilewsky, F., Ayaz, W., Appiah, J., About, I., Chung, S. H. Nerve Growth Factor Secretion From Pulp Fibroblasts is Modulated by Complement C5a Receptor and Implied in Neurite Outgrowth. Scientific reports. 6, 31799(2016).
- Pagella, P., Neto, E., Jiménez-Rojo, L., Lamghari, M., Mitsiadis, T. A. Microfluidics co-culture systems for studying tooth innervation. Frontiers in Physiology. 5, 326(2014).
- Miura, T., Yokokawa, R. Tissue culture on a chip: Developmental biology applications of self-organized capillary networks in microfluidic devices. Development, Growth & Differentiation. 58 (6), 505-515 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유