Method Article
Fare Beyninde Mikroglial Yoğunluk, Morfoloji ve Periferik Miyeloid Hücre Infiltrasyonu Analizi için IBA1 ve TMEM119 Kullanılarak İmmünofloresanS Boyama
Bu Makalede
Erratum Notice
Özet
Bu protokol, mikroglial yoğunluk, dağılım ve morfolojinin yanı sıra fare beyin dokusunda periferik miyeloid hücre infiltrasyonunun analizine ek olarak, IBA1 ve TMEM119'un immünororesan costaining'i için adım adım iş akışını tanımlar.
Özet
Bu mikroglia çift görselleştirme ve fare beyin dokusunda makrofajlar infiltrasyon için bir protokoldür. TMEM119 (mikrogliayı seçici olarak etiketler), IBA1 ile birlikte (morfolojilerinin olağanüstü bir görselleştirmesini sağlar), yoğunluk, dağılım ve morfolojideki değişikliklerin araştırılmasına olanak tanır. Bu parametrelerin ölçülmesi, beynin yerleşik makrofajları olan mikroglianın oynadığı rollere ilişkin içgörüler sağlamada önemlidir. Normal fizyolojik koşullar altında, mikroglia düzenli olarak mozaik benzeri bir desen dağıtılır ve ramified süreçleri ile küçük bir soma mevcut. Bununla birlikte, çevresel faktörlere (travma, enfeksiyon, hastalık veya yaralanma) yanıt olarak, mikroglial yoğunluk, dağılım ve morfoloji hakarete bağlı olarak çeşitli şekillerde değiştirilmiştir. Ayrıca, açıklanan çift boyama yöntemi, IBA1 ekspresyonuna göre ve TMEM119 ile birlikte lokalizasyon olmadan beyindeki makrofajların görüntülenmesine olanak sağlar. Bu yaklaşım böylece mikroglia ve sızma makrofajlar arasında ayrımcılık sağlar, hangi sağlık ve hastalık çeşitli bağlamlarda beyin homeostaz onların farklı katılımı içine fonksiyonel anlayışlar sağlamak için gereklidir. Bu protokol, seçici belirteçlerin tanımlanması ile ilgili nöroimmünolojideki en son bulguları birleştirir. Aynı zamanda hem deneyimli nöroimmünolojistler hem de nöroimmünolojiyi projelere entegre etmek isteyen araştırmacılar için yararlı bir araç olarak hizmet vermektedir.
Giriş
Akut veya kronik olsun, nöroinflamasyon sıkı mikroglia etkilenir, beynin yerleşik makrofajlar. Mikroglianın immünoboyama yoluyla görselleştirilmesi, son derece erişilebilir bir teknik olan ışık mikroskobu kullanımı ile nöroinflamasyon çalışmaları için değerlidir. Homeostatik koşullarda, mikroglia genellikle örtüşmeyen, mozaik benzeri bir desen olarak dağıtılır. Onlar ramified süreçleri uzatmak küçük somassergilemek 1, bazen birbirlerine temas2. Mikroglial ramified süreçler dinamik beyin parankim anket, nöronlar ile etkileşim, diğer glial hücreler, ve normal fizyolojik koşullar sırasında kan damarları3. Mikroglia onları immünolojik görevleri gerçekleştirmek ve beyin ortamında değişikliklere yanıt sağlayan reseptörlerin bir cephanelik ile donatılmıştır, hücre ölümü, ya da doku hasarı. Buna ek olarak, özellikle sinaptik oluşum, bakım ve eleme4,5önemli fizyolojik fonksiyonlar uygulamak.
Mikroglia üzerinde kullanılan mevcut belirteçler arasında iyonize kalsiyum bağlayıcı adaptör molekül 1 (IBA1) en yaygın olarak kullanılanlardan biridir. IBA1, elektronmikroskobuile doğrulanan ince distal prosesler de dahil olmak üzere mikroglial morfolojinin olağanüstü görselleştirmesini sağlayan kalsiyum bağlayıcı bir proteindir 6. Bu araç mikroglial dönüşüm karakterize aracı olmuştur, eski olarak adlandırılan "aktivasyon", hayvan hastalığı modelleri geniş bir dizi7,8,9. Nöroinflamasyon varlığında, mikroglial yanıt içerir: hücresel yoğunluk artışı olarak tanımlanan mikrogliozis, bazen kümeleme neden dağılım değişiklikleri, hücre gövdesinin genişlemesi, yanı sıra kalınlaşma ve daha ameboid şekiller ile ilişkili süreçlerin kısalması10,11,12,13.
İmmünoboyama belirli belirteçlere karşı yönlendirilen antikorların bulunabilirliği ile sınırlıdır. Daha da önemlisi, IBA1 mikroglia ile değil, aynı zamanda beyin14infiltrasyon periferik makrofajlar ile ifade edilir. Beyin içinde IBA1-pozitif hücrelerin gözlem bu araştırma alanında mikroglia bir belirteç haline gelmiştir iken, periferik makrofaj infiltrasyonu çeşitli koşullar altında bildirilmiştir, hatta marjinal sağlıklı beyin15,16 ,17,18. Sonuç olarak, Tek başına IBA1 kullanımı mikroglia seçici görselleştirme izin vermez. Buna ek olarak, makrofajlar, beyne sızdıktan sonra yerleşik mikroglianın moleküler ve morfolojik özelliklerini benimseyerek farklılaşmayı engellerler 19. Bu, hem mikroglianın işlevini araştırırken hem de makrofajlara sızarken bir zorluk teşkil eder.
Mikroglia ve periferik makrofajlar farklı kökenlere sahip olmakla birlikte (örneğin, embriyonik sarık kesesi ve kemik iliği, sırasıyla20,21), iki hücre popülasyonunun beyinde farklı roller19. Bu nedenle, bu iki popülasyon arasında yoğunluklarını, dağılımlarını, morfolojilerini ve işlevlerini modüle edebilen invaziv manipülasyonlar (kemik iliği kimeraları veya parabiyoz) olmadan ayrım yapan yöntemler kullanmak çok önemlidir. TMEM119 sağlık ve hastalık koşulları arasında mikroglia özgü bir belirteç olarak ortaya çıkmıştır22. IBA1 ile birleştirildiğinde, bu belirteç tmem119-negatif ve IBA1-pozitif makrofajlar, infiltrasyon bu hücrelerin ayırt etmek için yararlı olur. Bu gelişimsel olarak düzenlenmiş olsa da, TMEM119 doğum sonrası gün 3 (P3) ve 6 (P6) gibi erken olarak ifade edilir, sürekli P10 ve P1422arasında yetişkin seviyelerine ulaşana kadar artan . IBA1 embriyonik gün 10.5 (E10.5)23gibi erken ifade edilir. Önerilen çift etiketleme protokolü bu iki popülasyonun doğum sonrası yaşam boyunca incelenmesinde yararlıdır.
Bu protokol mikroglia ve periferik makrofajlar arasında ayrımcılık sağlayan bir adım-adım immünboyama prosedürü sağlar. Ayrıca mikroglial yoğunluk, dağılım ve morfolojinin kantitatif analizinin yanı sıra periferik makrofaj infiltrasyonunun analizini de açıklar. Mikroglia ve periferik makrofajların araştırılması kendi başına yararlı olmakla birlikte, bu protokol nöroinflamatuar fuayelerin lokalizasyonuna daha da olanak sağlar; böylece, tamamlayıcı (henüz, daha fazla zaman ve kaynak tüketen) tekniklerin kullanımı ile, araştırmak için belirli bölgeleri belirlemek için bir platform olarak hizmet vermektedir.
Protokol
Tüm deneysel prosedürler, Kanada Hayvan Bakımı Konseyi ve Université Laval Hayvan Bakım Komitesi'ne uygun olarak Kurumsal Hayvan Etiği komitelerinin yönergelerine uygun olarak gerçekleştirilmiştir.
1. İmmünoboyama
- Bir beyin atlası yardımıyla ilgi bölgesi (ROI) (yani, hipokampus) içeren üç fare beyin bölümleri seçin. Bölümleri plastik çok kuyulu bir tabağa yerleştirin ve üzerini 350 μL fosfat tamponlu salin (PBS) ile kaplayın (Tablo 1).
NOT: Optimal sonuçlar için beyin %4 paraformaldehit ile perfüzyon yapılmalı ve vibratom ile 50 μm kalınlığa indirilmelidir. 24 adet çok kuyulu plaka için her kuyu altı bölüme kadar çıkabilir. Her kuyu için önerilen çözelti hacmi 350 μL (en fazla üç bölüm için) ve altı bölümiçeren kuyular için 500 μL'dir. Daha fazla sayıda bölüm için 12 adet çok kuyulu plaka kullanılması önerilir. Her kuyu için seçilen çözelti hacminin dokuyu tamamen kapladığından ve bölümlerin yüzdürünmesine izin verdiğinden emin olun. Önerilen birimler protokolün geri kalanında kullanılan her çözüm için geçerlidir. - Numuneleri 350 μL PBS ile kaplayarak yıkayın ve çok amaçlı plakayı oda sıcaklığında (RT) çok amaçlı bir çalkalayıcının üzerine yerleştirerek dinlenmelerine izin verin. 5 dakika sonra PBS çıkarın ve taze PBS ile 5x değiştirin.
NOT: Çözümleri kaldırmak için transfer pipeti önerilir. Herhangi bir çözelti dökerken, doku bütünlüğünü korumak için kuyu duvarına pipet ucu yerleştirmek için emin olun. Ayrıca her yeni çözüm için yeni bir pipet kullandığınızdan emin olun. - PBS'yi çıkarın ve pH = 6.0 ile 10 mM sodyum sitrat tamponunun 350 μL'sini ekleyin (Tablo 1).
- Çok kuyulu plakayı parafin filmle kapatın ve önceden ısıtılmış bir su banyosunda 70 °C'de 40 dakika boyunca yüzdürün.
- Çok kuyulu plaka yaklaşık 15 dakika soğumasını bekleyin.
- Sodyum sitrat tamponu çıkarın ve adım 1.2'de yapıldığı gibi PBS'deki bölümleri yıkayın.
- PBS'yi çıkarın ve 350 μL taze üretilen %0,1 NaBH4 (Tablo 1)ekleyin ve RT'de 30 dakika kuluçkaya yatırın.
- %0,1 NaBH4 çözeltisini çıkarın ve Adım 1.2'de yapıldığı gibi PBS'deki bölümleri yıkayın.
- PBS'yi kaldırın ve çok amaçlı bir çalkalayıcının üzerine RT'de 1 saat için engelleme tamponu(Tablo 1)ekleyin.
NOT: Bir sonraki adımda aynı çözüm kullanılacağından, iki kat daha fazla blokaj arabelleği hazırladığından emin olun. - Engelleme tamponu kaldırın ve birincil antikorların karışımını içeren tamponu bloke ederek değiştirin (1:150 fare IBA1 + 1:300 TMEM119). Plakayı parafin filmle kapatın ve gece boyunca 4 °C'de kuluçkaya yatırın.
- Ertesi gün, yaklaşık 15 dakika RT sıcak örnekleri.
- Triton (PBST)(Tablo 1)ile PBS'de 5 dakika boyunca 5 x kesitleri yıkayın.
- PBST'yi çıkarın ve ikincil antikorların karışımını içeren engelleme tamponu ekleyin (IBA1 için 1:300 eşek anti-fare Alexa 488; TMEM119 için 1:300 keçi anti-tavşanı Alexa 568) RT'de 1,5 saat boyunca.
- Engelleme arabelleği kaldırın ve pbst ile bu kez hariç, adım 1.2'de yapılan bölümleri 5x yıkayın.
- PBST çıkarın ve RT 5 dakika için 4',6-diamidino-2-fenilindole (DAPI) [1:20000] ekleyin.
- DAPI'yi çıkarın ve her biri 5 dk fosfat tamponu (PB) ile 3x boyunca bölümleri yıkayın.
- Bölümleri mikroskop kaydırağine monte edin. Işıktan korunurken kurusunlar.
- Kurutulduğunda, kabarcık oluşumunu önleyerek, floresan orta montaj ve bir coverslip ile kapak bazı damla ekleyin.
NOT: Slaytları ışıktan korunurken, histolojik bir slayt kutusunun içinde 4 °C'de saklayın. Örnekler birkaç ay boyunca saklanabilir.
2. Yoğunluk ve dağılım analizi için görüntüleme
- Geniş alan epifloresan mikroskobu yardımıyla, düşük büyütme ve DAPI kanalı yatırım getirisi (yani, hipokampus CA1 bölgesi) bulmak için kullanın.
- DAPI, 488 ve 568 kanal ve filtreyle 0,5'lik sayısal diyafram açıklığını (NA) kullanarak 0,3 m/piksel çözünürlükte görüntüler elde edin. Yatırım Getirisi'ni kapsayan mozaik bir resim yakalayın. Alternatif olarak, daha büyük bir görüntüiçine dikişli olacak bireysel fotoğraf çekmek.
NOT: Mozaik görüntü, küçük görüntülerin oluşturduğu süper bir görüntüdür. Mozaik görüntüler genellikle yüksek büyütme alanının sınırlı alanının üstesinden gelmek için kullanılır. Bazı yazılımlar mozaik işlevi içerir; yine de, görüntüler de el ile birlikte diğer fotoğraf düzenleme yazılımı ile birlikte tek tek görüntüleri dikiş tarafından dikişli olabilir. Ölçek bilgilerini dosyaya eklemeyi unutmayın. Bu tür bir analiz için, yatırım getirisi/hayvan başına en az 300 mikroglial hücrenin görüntülenmiş olması tavsiye edilir (örneğin hipokampus için yaklaşık 10−15 resme karşılık gelen), deneysel durum başına en az beş hayvan. Şekil 1A−C, colabelled microglia'nın görüntülerini gösterir. - Görüntüyü TIFF dosyası olarak kaydedin.
3. Morfoloji analizi için görüntüleme
- Konfokal veya yapılandırılmış aydınlatma mikroskobu kullanarak, yatırım getirisini düşük büyütme de bulmak için DAPI kanalını kullanın.
- 40x hedefi (yani NA 1.4 yağ) kullanarak, Yatırım Getirisi içinde bir IBA1+/TMEM119+ hücre bulun. Canlı görüntüleme sırasında, Z ekseninde hareket edin. Rasgele seçilen mikroglianın sinyali kaybolur kaybolmaz, bu Z seviyesini Z-yığınının başlangıcı olarak ayarlayın. Mikroglia sinyali kaybolana kadar Z ekseni boyunca ters yönde ilerleyin ve bu noktayı Z-yığınının sonu olarak ayarlayın.
NOT: Şekil 2A−C, IBA1+/TMEM119+ mikroglia görüntülerini gösterir. - 0,33 μm Z aralığı ve piksel boyutu 0,15 m/piksel kullanarak üç kanalda da (DAPI, 488, 568) bir Z destesi oluşturun. Ölçek bilgilerini dosyaya ekleyin.
NOT: Önerilen Z aralığı hedefin çözme gücüne bağlıdır (örneğin, NA 1.4 yağı gibi 40x'lik bir hedef için 0,33 μm'dir). Morfoloji analizi için, deneysel durum başına en az beş hayvan ile hayvan başına en az 20 hücre olması tavsiye edilir. - Dosyayı TIFF dosyası olarak kaydedin.
4. Yoğunluk ve dağılım analizi
- En yakın komşu mesafesi (NND) eklentisi yüklü FIJI/ImageJ'i açın. 20x görüntüyü açın.
NOT: Kurulum yönergelerini bulmak için "ImageJ ile En Yakın Komşu Mesafeleri Hesaplaması" anahtar sözcüğüne sahip bir arama motoru kullanın. Eklenti Yazar Yuxiong Mao olduğunu. - Görüntüyü nislin üzerine basılmış bir ölçeğe göre ölçeği el ile ayarlamak için, düz çizgi aracını(Şekil 3E)seçin, imleci ölçeğin kenarına yerleştirin ve shift tuşuna basarken görüntüdeki ölçeğe mümkün olduğunca yakın bir çizgi çizin(Şekil 3I), Analyze | Ölçek ayarlayın,sonra doğru bilgileri girin (Şekil 3J).
NOT: Ölçek bazen dosyanın meta verilerinde bulunabilir ve otomatik olarak ayarlanabilir. - Resim Seçin | Renk | Tüm kanalların bileşik görüntüsünü oluşturmak için bileşik oluşturun.
NOT: Görüntü edinimi sırasında FIJI/ImageJ otomatik olarak RGB formatında bir bileşik oluşturur. - Menü çubuğunda Analiz et | Ölçümleri ayarlayın. Kontrol Alanı, Centroid, ve Çevre. Sekmede Yeniden Yönlendir' i tıklatın ve açılan dosyayı seçin ( Şekil3K).
- Görüntüye Git | Renk | Kanal aracını açmak için kanal aracı.
NOT: Bu menü belirli bir rengin devre dışı olmasını sağlar. DAPI kanalı yatırım getirisini tanımlamak ve hücreleri onaylamak için yararlı olabilir. Saymayı kolaylaştırmak için devre dışı bırakılabilir. - Serbest seçim aracıyla Yatırım Getirisi'nin kaba bir çevresini çizin (Şekil 3D).
- Araç çubuğundaki oval alete çift tıklayarak seçim fırçası aracını etkinleştirin ve seçim fırça kutusunu etkinleştir'in işaretli olduğundan emin olun(Şekil 3G). Bu araç, YG'yi daha hassas bir şekilde ifade etmek için kullanılacaktır. 200−400 arasında uygun bir fırça boyutu seçin.
- Seçim fırçasını kullanarak, çevreyi Yatırım Getirisi'ne en iyi uyacak şekilde ayarlayın. YG yöneticisine eklemek için klavyedeki T tuşuna basın (Şekil 3L).
- Analiz'i Seçin | Ölçün veya M tuşuna basın ve sonuç penceresi açılır. Sonuçları bir veri sayfasında kopyalayıp yapıştırın, ardından alanla ilgili bilgileri (örneğin, Yatırım Getirisi alanı; Şekil 3R).
- YG'nin alanını kopyaladıktan sonra, üzerine tıklayarak ve Backspace tuşuna basarak sonuçları penceresinden bilgileri silin.
- YG yöneticisi penceresine(Şekil 3L)gidin , YG izini sağ tıklatın, resmin adını eşleşecek şekilde adı değiştirin ve sonra kaydedin.
- Araç çubuğundaki fırça aletine çift tıklayın. Siyah rengi ve 10 fırça boyutunu seçin. Bindirme nin Paint seçeneğinin işaretsiz olduğundan emin olun (Şekil 3H).
- TMEM119 kanalında, her TMEM119+ mikroglia için soma'nın ortasına dikkatlice siyah bir nokta yerleştirin. TMEM119 için pozitif olmayan hücrelerin merkezine beyaz bir nokta yerleştirin (sızan makrofajları işaretlemek için). YG'de bulunan tüm hücreler için aynı yordamı yineleyin.
NOT: Tüm noktaların (siyah beyaz) aynı kanalda bulunması önemlidir. Kanalın kimliği görüntü penceresi etiketlerinin rengine bakarak doğrulanabilir (kırmızı, mavi veya yeşil). - Resim Seçin | Renk | Split kanal. Her kanal için bir pencere görüntülenir. Ardından, nokta ek açıklamaları olan kanalı tanımlayın ve diğer iki pencereyi kapatın.
- Yeni bölünmüş kanal görüntüsünü yeniden yönlendirin. Analize Git | Ölçümleri ayarlayın. Sekmede Yeniden Yönlendir' i tıklatın ve bölünmüş kanal görüntüsünü seçin ( Şekil3K).
- Resim Seçin | Türü | 8-bit. Görüntüye Git | Eşik 'i ayarlayın ve seçin (Şekil 3O). Eşiği ayarlamak için, her iki çubukta da sola (eşik değeri = 0) kadar ikinci çubuğun düğmesini kaydırın.
NOT: Bu, görüntüde yalnızca beyaz görünen siyah nokta bırakır. - YG yöneticisi penceresinde YG'yi seçin. Analiz'i Seçin | Parçacığı analiz edin (Şekil 3N). On Size (inchʻ2): 1−20 yazın. Piksel birimini işaretsiz tutun, Ekranı kontrol edin, özetleyin ve yöneticiye ekleyinve Tamamtuşuna basın. Özet penceresi açılır ve puan sayısını verir(Şekil 3P). Bilgileri kopyalayın ve veri sayfasına yapıştırın.
- Eklentileri Seçin | NND. NND penceresi açılır (Şekil 3Q). Tüm bilgileri veri sayfasına kopyalayın/yapıştırın. Her sayı, her mikroglianın en yakın komşu mikrogliaya olan uzaklığı temsil eder.
- Eşik penceresine geri dön ve ilk çubuğu sağa doğru kaydırın (her iki çubukta da eşik değeri = 255), tüm beyaz noktalarını görünür, beyaz görünür bırakır(Şekil 3M).
- Analiz'i Seçin | Parçacığı analiz edin. Puan sayısını sağlayan özet penceresi açılır (Şekil 3P). Bilgileri kopyalayın ve veri sayfasına yapıştırın.
- YG yöneticisine gidin tüm noktaları seçin, sağ tıklayın ve resmin adı ile kaydedin. Bu, bir zip dosyasındaki tüm noktaların kaydedilmesine olanak sağlar(Şekil 3L). Dosya Yı Seçin | Olarak kaydedin ve dosyayı çözümlenen görüntünün tanımlanmasına izin veren bir adla kaydedin.
- IBA1+/TMEM119+ çift pozitif hücre sayısını Yatırım Getirisi alanına bölerek mikroglia (her görüntü için) yoğunluğunu elde edin.
NOT: Her resim için değerler her hayvan için ortalama olabilir. Veriler daha sonra tüm hayvanların ortalama (SEM) ortalama ± standart hatası olarak sunulabilir. - Tüm TMEM119+ hücrelerinin NND değerlerinin resim başına ortalamasını alarak NND'yi belirleyin.
NOT: Veriler daha sonra tüm hayvanların ortalama ± SEM olarak sunulabilir. - Formülü kullanarak boşluk indeksini hesaplayın: NND2 x yoğunluğu.
NOT: Veriler daha sonra tüm hayvanların ortalama ± SEM olarak sunulabilir. Bu ölçüm için birimler rasgele birimler olacaktır. - 12 μm'nin altında NND'si olan hücreleri tanımlayarak mikroglial kümeleri ölçün.
NOT: Burada, birbirine arborizasyonlarla dokunan iki doğrudan yan yana mikroglial hücre arasındaki yaklaşık mesafe olduğu için 12 m seçilir. Bu koşulu karşılayan üçten fazla mikroglia varsa, görüntüye dönün ve bu hücrelerin bir veya birden çok kümenin parçası olup olmadığını doğrulayın. - Küme sayısını doğruladıktan sonra, veri sayfasındaki küme sayısını yazın.
NOT: Küme sayısı her hayvan için hücre/mm2 yoğunluğunu elde etmek için Yatırım Getirisi alanına bölünebilir. Veriler daha sonra tüm hayvanların ortalama ± SEM olarak sunulabilir. - Periferik miyeloid hücre infiltrasyon yüzdesini belirlemek için, her hayvan için toplam miyeloid hücre sayısının (TMEM119+/IBA1+ + TMEM119-/IBA1+) üzerinde IBA1+/TMEM119 hücrelerinin % değerini hesaplayın.
NOT: Veriler daha sonra tüm hayvanların ortalama ± SEM olarak sunulabilir.
5. Morfoloji analizi
- FIJI/ImageJ'yi açın.
- Image J veya FIJI kullanarak 40x görüntüyü açın. Bir açılır pencere seçin görüntülerin bir yığın içinde açılması gerektiğini soran görünür. Tamam'ıtıklatın. Ardından Resim | Yığınlar | Z projeksiyon penceresini açmak için Z projesi. İlk dilimden son dilime kadar tüm dilimleri ekleyin. Maksimum Yoğunluğun Projeksiyon Türüaltında seçildiğinden emin olun ve Tamam'ı tıklatın
- Z projesiyle birlikte yeni pencereye tıklayın. Resim Seçin | Renkler | Bölünmüş kanallar. IBA1 kanalının görüntüleriüzerindeki izleri iletin.
NOT: Diğer kanallar (TMEM119 ve DAPI) mikroglial morfoloji analizi sırasında gerektiğinde açık tutulabilir ve danışılabilir. - Menü çubuğunda Analiz et | Ölçümleri ayarlayın. Alanı, Centroid'ive ÇevreyiKontrol Edin. Sekmede Yeniden Yönlendir, açılan dosyayı seçin ( Şekil3K).
- 4.2 adımlarında açıklandığı gibi ölçeği ayarlayın.
- IBA1 kanalındaki soma boyutunu ölçmek için, serbest seçim aracıyla soma'nın kaba bir çevresini çizin (Şekil 3D).
- Araç çubuğundaki oval alete çift tıklayarak seçim fırçası aracını etkinleştirin ve ardından seçim fırça kutusunu etkinleştir 'i işaretleyin (Şekil 3G). 10−20(Şekil 3B)arasında bir seçim fırçası boyutu seçin.
- Seçim fırçasını kullanarak, soma'ya en iyi uyacak şekilde izlemeyi ayarlayın. Yakınlaştırma bu adımsırasında hassasiyet sağlayacaktır (Şekil 2I).
- Soma izini Yatırım Getirisi yöneticisine eklemek için T tuşuna basın (Şekil 3L).
- Analiz'i Seçin | Ölçün veya M tuşuna basın. Bir sonuç penceresi açılır. Sonuçları bir veri sayfasında kopyalayıp yapıştırın (Şekil 3R).
- Soma alanıyla ilgili bilgileri kaydetmek için YG yöneticisi penceresine gidin, YG'ye sağ tıklayın, resmin adını eşleşecek şekilde adı değiştirin, izlemenin soma için olduğunu belirtin, ardından dosyayı kaydedin.
- IBA1 kanalındaki ağaçlandırma alanını ölçmek için, çokgen şeklini başlatacak olan çokgen seçim aracı ile mikroglial proses ekstremitesini tıklatın (Şekil 3C).
- Mikroglial süreçlerin uçlarını takip ederek, mikroglial ağaçlandırmaların kapsadığı alanı en iyi şekilde temsil eden bir poligon oluşturmak için her proses ekstremitenin uçlarına tıklayarak mikroglianın etrafından dolaşın(Şekil 2D−H).
NOT: Poligonun tüm mikroglial proses ekstremitelerini birbirine bağladığından emin olun. Çokgeni oluşturan çizgiler asla kesişmemelidir. Bir mikroglial işlem ipucu etrafında tıklayarak, sürecin herhangi bir bölümünü kesme önlemek için dikkatli olun. Bazen bir işlem etrafında gitmek için ekstra puan eklemek yararlıdır. Çokgeni oluşturan nokta sayısı distal proses sayısıyla doğrudan bağlantılı değildir ve bu nedenle çalışma için geçerli değildir. - Çokgeni kapatmak için çokgenin başlangıç noktasını tıklatın.
- İzlemeyi Yatırım Getirisi yöneticisine eklemek için T tuşuna basın (Şekil 3L). Analiz'i Seçin | Ölçün veya M tuşuna basın. Bir sonuç penceresi açılır. Sonuçları bir veri sayfasında kopyalayıp yapıştırın (Şekil 3R).
- Ağaçlandırma alanıyla ilgili bilgileri kaydetmek için YG yöneticisi penceresine gidin, YG'ye sağ tıklayın, resmin adını eşleşecek şekilde adı değiştirin, ağaçlandırma için belirtin ve ardından dosyayı kaydedin.
- Her hayvan için tüm soma alanları nın ortalamasını alarak soma alanını belirleyin.
NOT: Veriler tüm hayvanların ortalama ± SEM olarak sunulabilir. - Her hayvan için tüm ağaçlandırma alanları ortalama tarafından arborization alanı belirleyin.
NOT: Veriler tüm hayvanların ortalama ± SEM olarak sunulabilir. - Her mikroglial hücre ve hayvan başına ortalama için formül soma alanı / arborization alanı kullanarak morfoloji indeksi hesaplayın.
NOT: Veriler tüm hayvanların ortalama ± SEM olarak sunulabilir.
Sonuçlar
Şekil 1, floresan mikroskopi ile 20x'te görüntülenmiş dorsal hipokampusun koronal bölümünde IBA1 ve TMEM119 kullanılarak mikroglianın ortak etiketlemesi gösterilmektedir. Başarılı bir boyama mikroglial hücre cisimlerini ve ince süreçlerini ortaya çıkarır (Şekil 1A−C). Bu boyama mikroglial yoğunluk ve dağılım belirlenmesi ve mikroglial kümelerin belirlenmesi sağlar (Şekil 1I) ve infiltrasyon makrofajlar (Şekil 1F).
Şekil 2, Mikroglial ağaçlandırma izleme prosedürünün(Şekil 2D−H)adım adım örnekolarak IBA1+/TMEM119+ mikroglia(Şekil 2A−C)yanı sıra hücre gövdesi izleme örneğini göstermektedir (Şekil 2I ), her ikisi de konfokal mikroskopi ile 40x olarak görüntülenir.

Şekil 1: IBA1 ve TMEM119 yoğunluk, dağılım, kümelenme ve periferik miyeloid hücre infiltrasyon analizi için fare beyin dokusunun çift boyama. (A−C) C57BL/6 yetişkin farenin hipokampusunda tipik mikroglial dağılım. (D−F) Mikroglia IBA1+/TMEM119+ olarak tanımlandı ve erkek farenin amigdalasında IBA1+/TMEM119 (beyaz ok) olarak tanımlanan makrofajsız olarak tanımlandı. (G−I) Bir farenin hipokampus iki microglia (beyaz kare) kümesi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
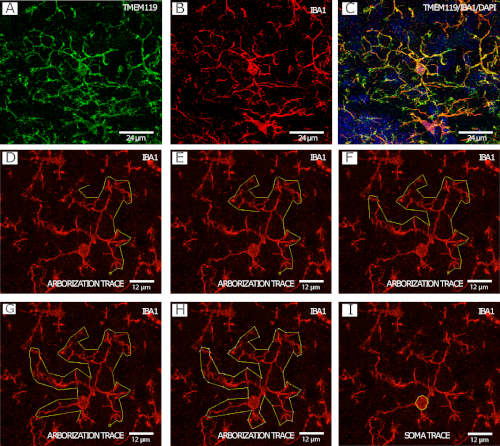
Şekil 2: Mikroglial morfoloji analizi için IBA1 ve TMEM119 boyama. (A−C) Mikroglia. (D−I) FIJI/ImageJ'deki çokgen aracını kullanarak IBA1 kanalı ile ağaçlandırma takibinin adım adım örneği. (J) Fiji/ImageJ'deki serbest seçim aracını kullanarak IBA1 kanalı ile mikroglia soma izleme örneği. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: FIJI/ImageJ arabirimi ve mikroglial yoğunluk, dağılım, kümeleme, morfoloji ve periferik miyeloid hücre infiltrasyonu analizi için araçlar. (A−R) Yoğunluk, küme ve morfoloji analizleri için kullanılan tüm araçların, menülerin ve pencerelerin derlenmesine neden olur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Çözümleri | Hazırlık |
| Arabelleği engelleme | %0.5 jelatin + %5 doğal keçi serumu + %5 doğal eşek serumu + %0.01 Triton X-100 TBS [0.05 M] |
| Sitrat arabelleği | 1.92 g sitrik asit [10 mM], 500 μL Tween 20 [0.05% (v/v)], 700 mL ultrasaf su, naoh ile pH = 6.0 ayarlayın [10 N], ultrasaf su ile 1 L doldurun |
| NaBH4 | [0.01% w/w] Ultra saf su 10 mL NaBH4 0.01 g disolve, çözelti iyi karışık olmalıdır. Bu çözüm kabarcık oluşturur; karıştırdıktan sonra kapağı açarak serbest bırakma basıncı |
| Pb | [100 mM] Na2HPO4 23.48 g ve NaH2PO44 4.8 g disolve · H2O in 1 L ultrasaf su, sonra 2 L kadar doldurun, pH = 7,4 ayarlamak |
| Pbs | [50 mM] Na 5.87 g2 HPO4,1.2 g NaH2PO4· H2O, 500 mL ultra saf suda 9 g NaCl, 1 L'ye kadar ultra saf su ile doldurun, pH = 7,4 |
| PBST | PBS + %0.01 Triton X-100 |
| Tbs | Seyreltik Tris HCl [0.5 M] ultrasaf su ile 1:10 [0.05 M], Tris HCl 1 L almak [0.05 M] ve NaCl 8.75 g ekleyin |
| Tris HCl | [0,5 M] 950 mL ultrasaf su, 78.8 g Tris tampon hidroklorür ekleyin (C4H11NO3Cl) pH = 8 ayarlayın ve 1 L doldurun |
Tablo 1: İmmünoboyamada kullanılan çözeltiler.
Tartışmalar
Bu protokol iki kritik bölüme ayrılabilir: boyama ve analiz kalitesi. Boyama optimal değilse, mikroglial hücreleri yeterince temsil etmek için başarısız olacak, böylece yoğunluk, dağılım ve morfoloji ölçümleri etkileyen. Buna ek olarak, infiltrasyon periferik miyeloid hücrelerin oranı hafife alınabilir. Bu boyama protokolünün en iyi leştirilmiş bir sürümüdür, ancak en uygun olmayan görüntülere neden olabilecek çeşitli etkenler vardır. Hayvanın perfüzyonu bu protokole dahil edilmese de, beyin fiksasyonu iyi yürütülmezse, lekelenmenin kalitesi tehlikeye girer. Ayrıca, yeterli perfüzyon çalışma ile müdahale edebilir kan damarlarıiçinde makrofajlar olmamasını sağlamak için gereklidir.
Immünboyama ile ilgili olarak, en kritik ayrıntılar tamponlar kalitesi dahil, adım engelleme, antikorların doğru depolama, ve beyin örnek işleme. Tamponların uygun hazırlanması ve depolanması boyama kalitesi üzerinde doğrudan bir etkiye sahiptir. Belirtilmediği sürece, bazı arabellekler uzun süre saklanabilir, ancak kontaminasyon belirtileri gösteren herhangi bir arabellek kullanımı kaçınılmalıdır. Arabellekler günler veya haftalar öncesinden hazırlanırsa, kullanmadan önce her çözümün pH'ı doğrulanmalıdır.
Ayrıca, immünoboyama ile ilgili olarak, arka plan boyama varlığı en sık karşılaşılan sorunlardan biri olmaya devam etmektedir. Arka plan boyama zor mikroglia analiz etmek için yapar, özellikle morfolojisi, ve bu nedenle sonuçları önyargı olacaktır. Arka planı önlemek için engelleme adımının doğru şekilde yapılması önemlidir. Antikorların depolanması nın etkinliği üzerinde doğrudan etkileri de vardır. Şirket tarafından sağlanan depolama yönergelerine kesinlikle uymanın yanı sıra sık sık çözülme-donma döngülerinden kaçınması tavsiye edilir. Son olarak, tüm süreç boyunca, beyin bölümlerinin fiziksel bütünlüğüne dikkat etmek önemlidir. Özellikle deneyci bu yordamda deneyimli değilse, her işleme sırasında (arabellek değişiklikleri, yıkama ve montaj) dikkatli kullanmak önemlidir. Çözelti veya tampon değiştirirken numunelerin sıvı çözeltisi olmadan terk edilmemesi tavsiye edilir, sonraki adım için çözümler önceden kuyuya dökmeye hazır olmalıdır. Numunelerin kurutulmasını önleyebilecek buharlaşmayı önlemek için çok kuyulu plaka, gece adımda parafin filmle doğru bir şekilde mühürlenmelidir.
Mikroglial yoğunluk, dağılım ve morfolojinin nicel analizinin nitel raporlara göre çeşitli avantajları vardır. Önyargıyı önlemek için, analizi yapan araştırmacı deneysel duruma kör edilmelidir. Bu nedenle, farklı kişilerin çözümleme gerçekleştirmek ve dosyaların adını değiştirmek için (bir anahtar sayfada orijinal ve yeni adlar tutarken) önerilmektedir. Yeni isimler deneysel durum hiçbir ipucu olmalıdır. Tüm analiz bu kör dosyaları üzerinde yapılabilir ve orijinal görüntü kimliği sadece veri derleme sonra ve istatistiksel analiz öncesinde ortaya. Kör etme zaten deneyimli araştırmacılar tarafından uygulanmış olmasına rağmen, ilk kez bu tür bir analiz yapanlar için değerli bir tavsiye olmaya devam etmektedir.
Beyin bölgesi için kontrol beyin kesitseçimi ve analiz sırasında YG izleme sırasında yapılır. Hayvanlar arasında Bregma düzeylerinin aynı aralığından bölümleri kullandığınızdan emin olun. Yoğunluk, dağılım ve morfoloji analizleri için aynı Yatırım Getirisi kullanılmalıdır. Yoğunluk ve dağılım analizleri için, FIJI/Image J'de Yatırım Getirisi çizerken kesin olmak özellikle önemlidir. Beyin atlası kullanımı hem kesit seçimi hem de Yatırım Getirisi takibi için şiddetle tavsiye edilir. DAPI kullanımı da nöroanatomik yerlerin belirlenmesini kolaylaştırır. Varyans önlemek için, sadece kısmen Yatırım Getirisi bulunan mikroglia reddetmek için tavsiye edilir, onların mikro çevre arasında farklılık gösterebileceği gibi. Yoğunluk analizi için mikroglia işaretlerken, DAPI kanalı bir seçim ölçütü olarak kullanılabilir. Sadece DAPI lekeli çekirdekleri içeren mikroglia sayarak, tüm kabul mikroglia seçim sırasında kişisel önyargı azaltarak, aynı düzlemde bulunmaktadır.
NND, boşluk indeksi ve küme analizi ölçümleri tek tek hücreleri işaretleyen noktaların konumlarını temel aldığından ve mesafeler FIJI/ImageJ tarafından hesaplandığından, bu noktaları yerleştirirken tutarlı olmak önemlidir. Kesinlikle görsel olarak belirlenir hücre gövdesinin merkezine, nokta yerleştirmek için emin olun. Ayrıca, nokta boyutu analiz boyunca tutarlı kalmalıdır. Bu mikroglial popülasyonun mekansal dağılımının daha iyi bir temsil katkıda bulunacaktır. Küme analizi için, önceki analizlerimize göre 12 μm mesafe eşiği olarak seçilmiştir. Bununla birlikte, NND'si 12 μm'nin altında olan dört veya daha fazla farklı hücre varsa, tüm bu hücreler tek bir kümenin bir parçasını alabilir veya iki hücrekümesini temsil edebilir. Bu, görüntülere geri dönmeyi ve gerçek küme sayısını onaylamayı gerekli kınandı.
Yatırım getirisinin beyin atlası kullanılarak nöroanatomik özelliklerle belirlendiği yoğunluk ve dağılımdan farklı olarak, morfoloji analizi için mikroglial hücrelerin seçimi hücreyi analiz etme yeteneğine dayanır. Analiz edilebilen tüm hücreler, seçim önyargısını önlemek için başka bir Z yığınına taşınmadan önce z-yığınında çözümlemek üzere seçilmelidir. Hücreleri dışlamanedenleri arasında immünoleme veya doku kesme, işleme (örn. yırtılma) veya montaj (örn. kabarcık oluşumu) ile ilgili sorunlar yer almaktadır. İdeal olarak, bu tür sorunları olan beyin bölümleri sistematik görüntüleme ve analiz dışında tutulmalıdır. TMEM119 ve IBA1'in boyanmasını %100 örtüşmediğini de unutmamak önemlidir(Şekil 2A−C). TMEM119 süreç sürekliliğinin (iba1 gibi) görselleştirilmesine izin vermeyişolduğundan, bu bir hücrenin nerede bittiğini ve diğerinin nerede başladığını değerlendirmeyi zorlaştırır. Böylece morfoloji analizi IBA1 kanalı kullanılarak yapılır. Ayrıca, tüm izlemeler ve noktalar kaydedilmeli ve gelecekteki revizyon için görselleştirilerek şeffaflığın artırılması ve sonuçların tekrarlanabilirliği gösterilmelidir.
Bu protokol mikroglia ve sızma makrofajlar ile ilgili değerli bilgiler sağlar. Uygulamalarına örnek olarak, farklı beyin bölgelerindeki mikroglia değişiklikleri yoluyla nöroinflamasyon belirtilerinin saptanması, bir bileşiğin anti-inflamatuar etkilerini incelemek ve mikroglianın uygun işlevini engelleyen faktörlerin incelenmesi sayılabilir. Bu protokol, beyindeki makrofajların algılanmasına ve bu hücrelerin mikrogliadan farklılaşmasına olanak sağladığı düşünülürse, ek uygulamalar şunlardır: makrofajların işe alınmasının belirli bir hakaret veya diğer tekniklerin kullanımı (yani, genetik araçlar) ve doğrulama ve hakaret sırasında beyinde periferik makrofajlar yokluğunun sonuçlarını çalışma. Floresan mikroskopinin beyin parankim içine infiltrasyonu onaylamak için yeterli olmadığını unutmayın. IBA1+/TMEM119- hücreler ventrikülveya perivasküler boşluk yakınında gözlendiğinde, parankim içinde lokalizasyonlarını doğrulamak için elektron mikroskobu gibi daha yüksek uzamsal çözünürlük teknikleri ne zaman gereklidir. Yoğunluk, dağılım ve morfolojideki değişiklikler mikroglial ve makrofaj rollerinin iyi göstergeleri olmakla birlikte, fonksiyonel araştırmalarla birleştirildiğinde bu yaklaşım en güçlü yaklaşımdır.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Nathalie Vernoux'a rehberlik ve deneylerdeki yardımları için minnettarız. Dr. Emmanuel Planel ve Serge Rivest'e floresan ve konfokal mikroskoplarını kullanmaları için de teşekkür ederiz. Bu çalışma kısmen Meksika Bilim ve Teknoloji Konseyi (CONACYT; F.G.I), Fondation Famille-Choquette ve Centre thématique de recherche en neurosciences (TON; to K.P.), Fonds de Recherche du Québec - Santé (M.B.) ve Shastri Indo-Kanada Enstitüsü (K.B.'ye) yanı sıra Kanada Doğa Bilimleri ve Mühendislik Araştırma Konseyi'nden (NSERC) M.E.T. M.E.T.'ye bir Discovery bursu, Sağlık ve Terapide Nöroimmün Plastisite Kanada Araştırma Başkanı 'na (Tier II) sahiptir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 488 donkey anti-mouse | Invitrogen/Thermofisher | A21202 | |
| Alexa Fluor 568 goat anti-rabbit | Invitrogen/Thermofisher | A11011 | |
| Biolite 24 Well multidish | Thermo Fisher | 930186 | |
| Bovine serum albumin | EMD Millipore Corporation | 2930 | |
| Citric acid | Sigma-Aldrich | C0759-500G | |
| DAPI Nuceleic acid stain | Invitrogen/Thermofisher | MP 01306 | |
| Fine Brush | Art store | ||
| Fluoromount-G | Southern Biotech | 0100-01 | |
| Gelatin from coldwater fish skin | Sigma-Aldrich | G7765 | |
| Microscope coverglass | Fisher Scientific | 1254418 | |
| Microslides positively charged | VWR | 48311-703 | |
| Monoclonal mouse Anti-IBA1 | Millipore | MABN92 | |
| Na2H2PO4·H2O | BioShop Canada Inc. | SPM306, SPM400 | |
| Na2HPO4 | BioShop Canada Inc. | SPD307, SPD600 | |
| NaBH4 | Sigma-Aldrich | 480886 | |
| NaCl | Fisher Scientific | S642500 | |
| Normal donkey serum (NDS) | Jackson ImmunoResearch laboratories Inc. | 017-000-121 | |
| Normal goat serum (NGS) | Jackson ImmunoResearch laboratories Inc. | 005-000-121 | |
| Parafilm-M | Parafilm | PM-999 | |
| Rabbit monoclonal Anti-TMEM119 | Abcam | ab209064 | |
| Reciprocal Shaking bath model 25 | Precision Scientific | - | |
| Transfer pipette | |||
| Tris buffer hydrochloride | BioShop Canada Inc. | TRS002/TRS004 | |
| Triton-X-100 | Sigma-Aldrich | T8787 | |
| Tween 20 | Sigma-Aldrich | P7949-100ML |
Referanslar
- Lawson, L. J., Perry, V. H., Dri, P., Gordon, S. Heterogeneity in the distribution and morphology of microglia in the normal adult mouse brain. Neuroscience. 39 (1), 151-170 (1990).
- Milior, G., et al. Fractalkine receptor deficiency impairs microglial and neuronal responsiveness to chronic stress. Brain, Behavior, and Immunity. 55, 114-125 (2016).
- Nimmerjahn, A., Kirchhoff, F., Helmchen, F. Resting Microglial Cells Are Highly Dynamic Surveillants of Brain Parenchyma in Vivo. Science. 308 (5726), 1314-1318 (2005).
- Hickman, S., Izzy, S., Sen, P., Morsett, L., Khoury, J. E. Microglia in neurodegeneration. Nature Neuroscience. 21 (10), 1359(2018).
- Tay, T. L., Savage, J. C., Hui, C. W., Bisht, K., Tremblay, M. È Microglia across the lifespan: from origin to function in brain development, plasticity and cognition. The Journal of Physiology. 595 (6), 1929-1945 (2017).
- Tremblay, M. È, Lowery, R. L., Majewska, A. K. Microglial Interactions with Synapses Are Modulated by Visual Experience. PLoS Biology. 8 (11), (2010).
- Jakovljevic, M., et al. Induction of NTPDase1/CD39 by Reactive Microglia and Macrophages Is Associated With the Functional State During EAE. Frontiers in Neuroscience. 13, (2019).
- Taylor, A. M. W., et al. Microglia Disrupt Mesolimbic Reward Circuitry in Chronic Pain. The Journal of Neuroscience. 35 (22), 8442-8450 (2015).
- Poliani, P. L., et al. TREM2 sustains microglial expansion during aging and response to demyelination. The Journal of Clinical Investigation. 125 (5), 2161-2170 (2015).
- Lu, S. M., et al. HIV-1 Tat-Induced Microgliosis and Synaptic Damage via Interactions between Peripheral and Central Myeloid Cells. PLoS ONE. 6 (9), e23915(2011).
- Rodríguez, J. J., et al. Increased densities of resting and activated microglia in the dentate gyrus follow senile plaque formation in the CA1 subfield of the hippocampus in the triple transgenic model of Alzheimer's disease. Neuroscience Letters. 552, 129-134 (2013).
- Rasmussen, S., et al. Persistent activation of microglia is associated with neuronal dysfunction of callosal projecting pathways and multiple sclerosis-like lesions in relapsing-remitting experimental autoimmune encephalomyelitis. Brain. 130 (11), 2816-2829 (2007).
- Walker, F. R., et al. Dynamic structural remodelling of microglia in health and disease: a review of the models, the signals and the mechanisms. Brain, Behavior, and Immunity. 37, 1-14 (2014).
- Ohsawa, K., Imai, Y., Kanazawa, H., Sasaki, Y., Kohsaka, S. Involvement of Iba1 in membrane ruffling and phagocytosis of macrophages/microglia. Journal of Cell Science. 113 (17), 3073-3084 (2000).
- Yamasaki, R., et al. Differential roles of microglia and monocytes in the inflamed central nervous system. Journal of Experimental Medicine. 211 (8), 1533-1549 (2014).
- Wohleb, E. S., et al. Peripheral innate immune challenge exaggerated microglia activation, increased the number of inflammatory CNS macrophages, and prolonged social withdrawal in socially defeated mice. Psychoneuroendocrinology. 37 (9), 1491-1505 (2012).
- Shemer, A., et al. Engrafted parenchymal brain macrophages differ from microglia in transcriptome, chromatin landscape and response to challenge. Nature Communications. 9, (2018).
- Geissmann, F., et al. Development of monocytes, macrophages and dendritic cells. Science (New York, N.Y). 327 (5966), 656-661 (2010).
- Minogue, A. M. Role of infiltrating monocytes/macrophages in acute and chronic neuroinflammation: Effects on cognition, learning and affective behaviour. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 79, 15-18 (2017).
- Ginhoux, F., et al. Fate Mapping Analysis Reveals That Adult Microglia Derive from Primitive Macrophages. Science (New York, N.Y). 330 (6005), 841-845 (2010).
- Kierdorf, K., et al. Microglia emerge from erythromyeloid precursors via Pu.1- and Irf8-dependent pathways. Nature Neuroscience. 16 (3), 273-280 (2013).
- Bennett, M. L., et al. New tools for studying microglia in the mouse and human CNS. Proceedings of the National Academy of Sciences of the United States of America. 113 (12), E1738-E1746 (2016).
- Mizutani, M., et al. The fractalkine receptor but not CCR2 is present on microglia from embryonic development throughout adulthood. Journal of Immunology. 188 (1), 29-36 (2012).
Erratum
Formal Correction: Erratum: Immunofluorescence Staining Using IBA1 and TMEM119 for Microglial Density, Morphology and Peripheral Myeloid Cell Infiltration Analysis in Mouse Brain
Posted by JoVE Editors on 10/12/2019. Citeable Link.
An erratum was issued for: Immunofluorescence Staining Using IBA1 and TMEM119 for Microglial Density, Morphology and Peripheral Myeloid Cell Infiltration Analysis in Mouse Brain. An author name was updated.
The name was corrected from:
Maude Bordelau
to:
Maude Bordeleau
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır