Method Article
使用IBA1和TMEM119进行小鼠脑微胶质密度、形态学和周围骨髓细胞渗透分析的免疫荧光染色
Erratum Notice
摘要
该协议描述了IBA1和TMEM119免疫荧光结化的分步工作流程,除了分析微胶质密度、分布和形态,以及小鼠脑组织中外周髓细胞渗透。
摘要
这是一种用于微胶质和渗透小鼠脑组织巨噬细胞的双重可视化的协议。TMEM119(选择性地标记微胶质),当与IBA1(提供其形态的异常可视化)相结合时,可以调查密度、分布和形态的变化。量化这些参数对于深入了解微胶体(大脑的常驻巨噬细胞)所扮演的角色非常重要。在正常生理条件下,微胶质定期以马赛克状模式分布,并呈现具有模压过程的小索马。然而,作为对环境因素(即创伤、感染、疾病或伤害)的反应,微胶质密度、分布和形态会以各种方式改变,具体取决于侮辱。此外,所述双染色方法允许根据其IBA1的表达,在不与TMEM119共定位的情况下,对大脑中渗透巨噬细胞进行可视化。因此,这种方法允许区分微胶质和渗透巨噬细胞,这是提供功能见解,使他们在健康和疾病的不同背景下对大脑平衡的独特参与。该协议集成了神经免疫学中与选择性标记物鉴定相关的最新发现。它还作为一个有用的工具,为有经验的神经免疫学家和研究人员寻求将神经免疫学纳入项目。
引言
无论是急性还是慢性,神经炎症都受到微胶质(大脑常住巨噬细胞)的严重影响。通过免疫染色可视化微胶质对于使用光显微镜(一种高度可访问的技术)研究神经炎症有价值。在静时条件下,微胶质通常以非重叠的马赛克状模式分布。他们表现出小索马,延长冲撞过程1,有时相互接触2。在正常生理条件下,微胶质电肿过程动态地测量脑气囊瘤,与神经元、其他胶质细胞和血管相互作用3。Microglia 配备了一个受体库,允许他们执行免疫学任务,并应对大脑环境的变化、细胞死亡或组织损伤。此外,它们还发挥关键的生理功能,特别是在突触形成、维持和消除4、5。
在用于研究微胶质的现有标记中,离子钙结合适配器分子1(IBA1)是使用最广泛的指标之一。IBA1是一种钙结合蛋白,提供微胶质形态的卓越可视化,包括精细的远端过程,电子显微镜6证实了这一点。该工具在描述微胶质转化(以前称为"活化")方面起到了重要作用,在动物疾病模型7、8、9中。在神经炎症的存在,微胶质反应包括:微胶质症,定义为细胞密度增加,分布变化,有时导致聚类,细胞体扩大,以及增厚和缩短与更多ameboid形状相关的过程10,11,12,13。
免疫染色受针对特定标记物的抗体的可用性的限制。重要的是,IBA1是由微胶质表达的,但也由渗入大脑14的外围巨噬细胞表达。虽然观察脑内的IBA1阳性细胞已成为这一研究领域微胶质的标志,但周围巨噬细胞渗透在各种条件下被报道,甚至在健康大脑中略有渗透。 ,17,18.因此,单单使用IBA1并不能选择性地可视化微胶质。此外,巨噬细胞在渗入大脑后,采用居民微胶质的分子和形态特征,从而阻碍分化。这是一个挑战,当调查微胶质和渗透巨噬细胞的功能。
虽然微胶质和周围巨噬细胞有不同的起源(例如,从胚胎蛋黄囊和骨髓,分别20,21),有越来越多的发现表明,两个细胞群发挥不同的角色在大脑19。因此,使用无侵入性操作(即骨髓嵌合体或寄生虫)来区分这两个种群的方法至关重要,这些方法可以调节它们的密度、分布、形态和功能。TMEM119已成为一个微胶质特异性标记跨越健康和疾病条件22。当与IBA1结合使用时,该标记对于区分这些细胞与渗透巨噬细胞(TMEM119阴性和IBA1阳性)非常有用。虽然它是发育调节,TMEM119早在产后第3天(P3)和6(P6),稳步增加,直到达到P10和P1422之间的成人水平。IBA1最早表示在胚胎日10.5 (E10.5)23。因此,拟议的双标签方案有助于研究这两个种群的产后生活。
该协议提供了一个分步免疫染色程序,允许在微胶质和周围巨噬细胞之间进行区分。并解释了如何对微胶质密度、分布和形态进行定量分析,以及对周围巨噬菌体渗透的分析。虽然微胶质和周围巨噬细胞的调查本身是有用的,但该协议进一步允许神经炎门厅的本地化;因此,它还作为一个平台,利用补充(然而,更耗费时间和资源)技术,确定要调查的特定区域。
研究方案
所有实验程序均符合机构动物伦理委员会的指导方针,符合加拿大动物护理理事会和拉瓦尔大学动物护理委员会。
1. 免疫染色
- 在大脑地图集的帮助下,选择三个包含感兴趣区域(ROI)(即海马)的小鼠大脑部分。将各部分放入塑料多孔板中,用 350 μL 的磷酸盐缓冲盐 (PBS) 覆盖它们(表 1)。
注:为了获得最佳效果,大脑应注入4%的甲醛,并使用振动膜切割至厚度为50μm。对于 24 个多孔板,每个孔最多可以容纳 6 个截面。每口井推荐的溶液体积为350μL(最多三个部分)和500μL,用于包含六个部分的井。对于较多的截面,建议使用 12 多孔板。确保每口井的选定溶液体积完全覆盖组织并允许各部分浮动。建议的卷适用于协议的其余部分中使用的每个解决方案。 - 用 350 μL 的 PBS 覆盖样品,并在室温 (RT) 下将多孔板放在多用途摇床顶部,让样品休息。5 分钟后取出 PBS,并将其更换为 5 倍。<
注:要移除溶液,建议使用移液器。倒入任何溶液时,请确保将移液器的尖端放在井壁上,以保护组织的完整性。还要确保为每个新解决方案使用新的移液器。 - 取出PBS,加入350 μL的10 mM柠酸钠缓冲液,pH值= 6.0 (表1)。
- 用石蜡薄膜密封多孔板,让它在70°C下漂浮在先前预热的水浴上40分钟。
- 让多孔板冷却约 15 分钟。
- 如步骤 1.2 所述,取出柠酸钠缓冲液并清洗 PBS 中的部分。
- 去除PBS,加入350 μL新鲜制作的0.1%NaBH4(表1),在RT孵育30分钟。
- 如步骤 1.2 中所做的那样,取出 0.1% NaBH4溶液并清洗 PBS 中的部分。
- 在多用途摇床顶部的 RT 处移除 PBS 并添加阻塞缓冲器 (表 1) 1 小时。
注: 请确保准备双倍的阻塞缓冲区量,因为下一步将使用相同的解决方案。 - 取出阻塞缓冲液,并通过阻断含有原抗体混合物的缓冲液(1:150 鼠标 IBA1 = 1:300 TMEM119)进行更换。用石蜡薄膜密封板,让它在4°C下孵育过夜。
- 第二天,在RT加热样品约15分钟。
- 在 PBS 中用 triton (PBST) (表 1) 将部分每部洗涤 5 分钟。
- 去除PBST,并添加含有二次抗体混合物的阻断缓冲液(1:300驴抗小鼠Alexa 488用于IBA1;1:300山羊抗兔子Alexa 568用于TMEM119),在RT1.5小时。
- 如步骤 1.2 中所做的那样,删除阻塞缓冲区并清洗第 5 部分,但这次使用 PBST 除外。
- 取出 PBST,在 RT 上加入 4°,6-二酰胺-2-苯林多尔 (DAPI) [1:20000] 5 分钟。
- 取出 DAPI,在磷酸盐缓冲液 (PB) 中分别清洗 3x 部分 5 分钟。
- 将部分安装在显微镜幻灯片上。让他们干燥,同时防止光线。
- 干燥时,加入一些安装荧光介质滴,并盖上盖板,避免气泡形成。
注:将幻灯片存放在 4°C 的星体幻灯片盒内,防止光线照射。样品可以保存几个月。
2. 用于密度和分布分析的成像
- 借助广域荧光显微镜,使用低放大倍率和 DAPI 通道定位 ROI(即海马的 CA1 区域)。
- 使用 0.5 的数字光圈 (NA) 以 20 倍的速度采集图像,使用 DAPI、488 和 568 通道和滤镜,分辨率为 0.3 μm/像素。捕获覆盖 ROI 的马赛克图片。或者,拍摄将缝合成较大图像的单个照片。
注: 马赛克图像是由较小的图像构成的超级图像。马赛克图像通常用于克服高放大倍率的视场的有限区域。有些软件包括马赛克功能;然而,图像也可以手动缝合与其他照片编辑软件,通过缝合单个图像合二为一。请记住将缩放信息添加到文件中。对于这种类型的分析,建议每个 ROI/动物至少成像 300 个微胶质细胞(例如,对应于海马区大约 10-15 张图片),每个实验条件至少包含 5 个动物。图 1A+C显示了共标记微胶合的图形。 - 将图像另存为 TIFF 文件。
3. 形态分析成像
- 使用共聚焦或结构化照明显微镜,使用 DAPI 通道在低放大倍率下定位 ROI。
- 使用 40 倍物镜(即 NA 1.4 油),在 ROI 内定位 IBA1+/TMEM119+ 单元。进行实时成像时,在 Z 轴中移动。一旦随机选择的微胶质信号消失,将此 Z 级设置为 Z 堆栈的开头。沿相反方向沿 Z 轴移动,直到微胶质的信号消失,并将该点设置为 Z 堆栈的末端。
注:图2A+C显示了IBA1+/TMEM119+微胶质的图像。 - 使用 0.33 μm Z 间隔和 0.15 μm/像素的像素大小在所有三个通道(DAPI、488、568)中创建 Z 堆栈。将缩放信息添加到文件中。
注: 建议的 Z 间隔取决于目标的解析能力(例如,对于 40 倍目标(如 NA 1.4 油,为 0.33 μm)。对于形态分析,建议每只动物至少拥有20个细胞,每个实验条件至少5个动物。 - 将文件另存为 TIFF 文件。
4. 密度和分布分析
- 打开 FIJI/ImageJ,并安装了最近的邻居距离 (NND) 插件。打开 20x 图像。
注: 使用关键字为"最近邻距离计算与 ImageJ"的搜索引擎查找安装说明。插件作者是毛玉雄。 - 要根据图像上印有的比例手动设置比例,请选择直线工具 (图 3E),将光标放在刻度的边缘,并在按下移位键时,尽可能靠近图像上的比例绘制一条线(图 3I\/c1[),选择分析|设置比例,然后输入正确的信息 (图 3J)。
注: 缩放有时可以包含在文件的元数据中并自动设置。 - 选择图像|颜色|创建复合以创建所有通道的复合图像。
注:在图像采集期间,FIJI/ImageJ 将自动创建 RGB 格式的合成。 - 在菜单栏上,选择"分析|设置测量值 。检查区域、中心和周界。在"重定向到"选项卡上,单击并选择打开的文件 (图 3K)。
- 转到图像|颜色|通道工具用于打开通道工具。
注:此菜单将允许禁用特定颜色。DAPI 通道可用于识别 ROI 和确认单元。它可以停用,使计数更容易。 - 使用手绘选择工具(图 3D) 绘制 ROI 的粗略周长。
- 通过双击工具栏上的椭圆工具启用选择画笔工具,并确保选中"启用选择画笔"框(图 3G)。此工具将用于更精确地划定投资回报率。选择 200×400 之间的适当画笔大小。
- 使用选择画笔调整周长以最适合 ROI。按键盘上的T可添加到 ROI 管理器 (图 3L)。
- 选择分析|测量或按M键,将弹出一个结果窗口。复制结果并将其粘贴到数据表上,然后保存有关区域的信息(即 ROI 区域;图 3R.
- 复制 ROI 区域后,通过单击结果窗口并按后退空间键从结果窗口中擦除信息。
- 转到 ROI 管理器窗口 (图 3L),右键单击 ROI 跟踪,更改名称以匹配图像的名称,然后保存。
- 双击工具栏上的画笔工具。选择黑色和画笔大小为 10。确保未选中"覆盖绘制"选项 (图 3H)。
- 在 TMEM119 通道中,小心地在每个 TMEM119+ 微胶质的 soma 中心放置一个黑点。在对TMEM119不积极的细胞中心放置一个白点(以标记渗透巨噬细胞)。对 ROI 中包含的所有单元格重复相同的过程。
注: 所有点(黑色和白色)都位于同一通道中,这一点很重要。可以通过查看图像窗口标签的颜色来验证通道的标识(红色、蓝色或绿色)。 - 选择图像|颜色|拆分通道.将显示每个通道的窗口。然后,标识具有点注释的通道并关闭其他两个窗口。
- 重定向新的拆分通道图像。转到分析|设置测量值 。在"重定向到"选项卡上,单击并选择拆分通道图像 (图 3K)。
- 选择图像|类型|8 位.转到图像|调整并选择阈值(图 3O)要调整阈值,请滑动第二个柱的按钮,一直向左滑动(阈值 = 0),在两个柱中。
注: 这将只留下图像上的黑点,显示为白色。 - 在 ROI 管理器窗口中选择 ROI。选择分析|分析粒子(图 3N)在大小(英寸=2)上:写1~20。保持像素单元未选中,选中显示、汇总并添加到管理器,然后按"确定"。摘要窗口将弹出并给出点数 (图 3P)。复制信息并将其粘贴到数据表。
- 选择插件|NND.NND 窗口将弹出 (图 3Q)。将所有信息复制/粘贴到数据表。每个数字表示每个微胶glia与最近的相邻微胶质的距离。
- 返回阈值窗口,并向右滑动第一个柱线(两个柱中的阈值 = 255),这将使所有白点可见,显示为白色(图 3M)。
- 选择分析|分析粒子。提供点数的摘要窗口将弹出 (图 3P)。复制信息并将其粘贴到数据表。
- 转到 ROI 管理器,选择所有点,右键单击,然后保存图像的名称。这将允许在 zip 文件中保存所有点 (图 3L)。选择文件|另存为,并将文件保存为允许标识已分析图像的名称。
- 通过将 IBA1+/TMEM119+ 双正细胞数除以 ROI 面积,获得微胶质的密度(对于每个图像)。
注: 每张图片的值可以平均每个动物。然后,数据可以呈现为所有动物的均值 (SEM) 的均值 = 标准误差。 - 通过获取所有 TMEM119+ 单元的 NND 值的平均值来确定 NND。
注:数据可以呈现为所有动物的平均 = SEM。 - 使用公式:NND2 x 密度计算间距指数。
注:数据可以呈现为所有动物的平均 = SEM。此测量的单位将是任意单位。 - 通过识别 NND 低于 12 μm 的细胞来量化微胶质簇。
注: 此处选择 12 μm,因为它是两个直接并列的微胶质细胞之间的近似距离,这些细胞通过树形相互接触。如果有三个以上满足此条件的微胶质,请返回到映像并验证这些单元是一个或多个群集的一部分。 - 确认群集数后,在数据表中写入群集数。
注:簇的数量可以除以ROI区域,以获得每个动物的细胞/毫米2的密度。然后,数据可以呈现为所有动物的平均 = SEM。 - 要确定周围骨髓细胞渗透的百分比,请计算每个动物的IBA1+/TMEM119-细胞在骨髓细胞总数(TMEM119+/IBA1+=TMEM119/IBA1+)的百分比。
注:数据可以呈现为所有动物的平均 = SEM。
5. 形态分析
- 打开 FIJI/ImageJ。
- 使用图像 J 或 FIJI 打开 40x 图像。选择"将出现一个弹出窗口,询问是否应在堆栈中打开图像。单击"确定"。接下来,选择"图像 |堆栈 |Z 项目以打开 Z 投影窗口。包括所有切片,从第一个切片到最后一个切片。确保在投影类型下选择了最大强度,然后单击"确定"
- 单击 Z 项目的新窗口。选择图像|颜色|拆分通道.在 IBA1 通道的图像上执行跟踪。
注:在微胶质形态分析期间,其他通道(TMEM119和DAPI)可以保持打开状态,并根据需要进行咨询。 - 在菜单栏上,选择"分析|设置测量值 。检查区域、中心和周界。在"重定向到"选项卡上,选择打开的文件 (图 3K)。
- 设置步骤 4.2 中描述的比例。
- 要测量 IBA1 通道中的索马大小,使用手绘选择工具(图 3D) 绘制索马的粗糙周长。
- 通过双击工具栏上的椭圆工具,然后选中启用选择画笔框(图 3G ),启用选择画笔工具。选择 10×20 之间的选择画笔大小 (图 3B)。
- 使用选择画笔调整曲线以最适合索马。放大将在此步骤中实现精度 (图 2I)。
- 按T键将 soma 跟踪添加到 ROI 管理器 (图 3L)。
- 选择分析|测量或按M键。将弹出一个结果窗口。复制结果并将其粘贴到数据表上 (图 3R)。
- 要保存有关 soma 区域的信息,请转到 ROI 管理器窗口,右键单击 ROI,更改名称以匹配图像的名称,指定跟踪是用于 soma 的,然后保存文件。
- 要测量 IBA1 通道中的轴化区域,使用多边形选择工具单击微胶质过程极值,该工具将启动多边形形状(图 3C)。
- 按照微胶质过程的提示,通过单击每个过程极肢的尖端来绕微胶体,形成最能代表微胶质化覆盖的区域的多边形(图2D+H)。
注:确保多边形连接所有微胶过程四肢。形成多边形的线不应相交。当点击微胶质工艺尖端时,小心避免切断过程的任何部分。有时添加额外的点来绕过进程很有用。形成多边形的点数与远端过程的数量没有直接联系,因此与研究无关。 - 要关闭面,请单击多边形的起点。
- 按T键将跟踪添加到 ROI 管理器 (图 3L)。选择分析|测量或按M键。将弹出一个结果窗口。复制结果并将其粘贴到数据表上 (图 3R)。
- 要保存有关植树区域的信息,请转到 ROI 管理器窗口,右键单击 ROI,更改名称以匹配图像的名称,指定进行植树,然后保存文件。
- 通过平均每个动物的所有索马区域来确定索马区域。
注:数据可以呈现为所有动物的平均 = SEM。 - 通过平均每个动物的所有植树区来确定植树面积。
注:数据可以呈现为所有动物的平均 = SEM。 - 使用每个微胶质细胞的公式索马面积/树干面积和每个动物的平均值计算形态指数。
注:数据可以呈现为所有动物的平均 = SEM。
结果
图1显示了使用IBA1和TMEM119在背海马的日冕部分使用的微胶合体共标记,通过荧光显微镜以20倍成像。成功的染色揭示了微胶质细胞体及其精细过程(图1A+C)。这种染色允许确定微胶质密度和分布,并识别微胶质簇(图1I)和渗透巨噬细胞(图1F)。
图 2显示了 IBA1_/TMEM119+ 微胶质(图 2A+C),这是微胶质化跟踪过程(图 2D_H)的逐步示例,以及细胞体跟踪示例(图 2I),两者均通过共聚焦显微镜在 40 倍下成像。

图1:IBA1和TMEM119对小鼠脑组织的双重染色,用于密度、分布、聚类和周围骨髓细胞渗透分析。(A+C)C57BL/6成年小鼠海马中的典型微胶质分布。(D+F)在雄鼠杏仁核中识别为IBA1+/TMEM119+和渗透宏噬细胞的微胶质识别为IBA1+/TMEM119(白色箭头)。(G+I)在小鼠海马区两个微胶(白色正方形)的簇。请点击此处查看此图的较大版本。
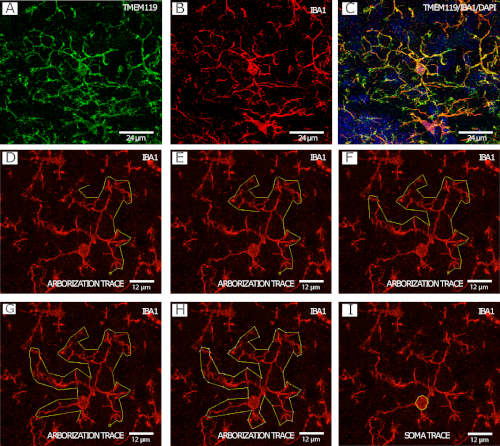
图2:IBA1和TMEM119染色,用于微胶质形态分析。(A+C)微胶亚。(D+I)使用 FIJI/ImageJ 中的多边形工具使用 IBA1 通道进行植树的分步示例。(J) 使用 FIJI/ImageJ 中的手绘工具使用 IBA1 通道进行微胶质索马跟踪的示例。请点击此处查看此图的较大版本。

图3:FIJI/ImageJ接口和用于微胶质密度、分布、聚类、形态和周围骨髓细胞渗透分析的工具。(A+R)用于密度、聚类和形态分析的所有工具、菜单和窗口的编译。请点击此处查看此图的较大版本。
| 解决 方案 | 制备 |
| 阻塞缓冲区 | 0.5% 明胶 = 5% 天然山羊血清 + 5% 天然驴血清 = 0.01% Triton X-100 在 TBS [0.05 M] |
| 坐酸盐缓冲器 | 1.92 克柠檬酸 [10 mM],500 μL 的 Tween 20 [0.05% (v/v)], 700 mL 的超纯水, 调整 pH = 6.0 与 NaOH [10 N], 填充高达 1 L 与超纯水 |
| 纳伯4 | [0.01% w/w]在10mL的超纯水中溶解0.01克的NaBH4,溶液应混合良好。此解决方案创建气泡;混合后打开盖释放压力 |
| 铅 | [100 mM]Disolve 23.48 g Na2HPO4和 4.8 g NaH2PO4|H2O 在 1 L 中的超纯水,然后加注至 2 L,调整 pH = 7.4 |
| Pbs | [50 mM]Disolve 5.87 g Na2HPO4, 1.2 g NaH2PO4|H2O,9 g NaCl 在 500 mL 的超纯水中,用超纯水填充高达 1 L,调整 pH = 7.4 |
| PBST | PBS = 0.01% 特里顿 X-100 |
| Tbs | 稀释 Tris HCl [0.5 M] 与超纯水 1:10 [0.05 M],采取 1 L 的 Tris HCl [0.05 M] 和添加 8.75 g 的 NaCl |
| 特里斯 HCl | [0.5 M] 950 mL 超纯水,加入 78.8 g 的盐酸三重缓冲液 (C4H11NO3Cl) 调整 pH = 8 并灌装至 1 L |
表1:用于免疫染色的解决方案。
讨论
该协议可以分为两个关键部分:染色和分析的质量。如果染色不是最佳的,它将无法充分表示微胶质细胞,从而影响密度、分布和形态测量。此外,渗透周围骨髓细胞的比例可能被低估。这是染色协议的优化版本,但有几个因素可能会导致图像不理想。即使动物的灌注不包括在本协议中,但如果大脑固定没有很好地执行,染色的质量将受到损害。此外,需要足够的灌注,以确保血管内没有可能干扰研究的巨噬细胞。
关于免疫染色,最关键的细节包括缓冲液的质量,阻塞步骤,抗体的适当储存和大脑样本处理。缓冲液的正确制备及其储存对染色质量有直接影响。除非指定,否则某些缓冲液可以长期存放,但应避免使用任何显示污染迹象的缓冲器。如果缓冲液提前数天或数周制备,则应在使用前验证每个溶液的pH。
此外,关于免疫染色,背景染色的存在仍然是最常见的问题之一。背景染色使得分析微胶质,特别是其形态变得困难,因此会偏袒结果。为了防止后台操作,正确执行阻止步骤非常重要。抗体的储存条件也直接影响其疗效。建议严格遵守公司提供的存储指南,避免频繁的解冻冻结周期。最后,在整个过程中,注意大脑部分的物理完整性是至关重要的。每次操作(缓冲液更改、处理和安装)时,请务必谨慎使用,尤其是在实验者没有遇到此过程时。建议在更换溶液或缓冲液时避免使样品不产生任何液体溶液,后续步骤的解决方案应事先准备好倒入油井中。在一夜的台阶上,应用石蜡薄膜正确密封多孔板,以避免可能导致样品干燥的蒸发。
微胶质密度、分布和形态的定量分析比定性报告具有几个优点。为了防止偏差,执行分析的研究者应该对实验条件视而不见。因此,建议让不同的人执行分析并更改文件的名称(同时将原始名称和新名称保留在密钥表中)。新名称不应有实验条件的提示。可以对这些盲文件进行整个分析,原始图像标识只有在数据汇编和统计分析之前才能显示。虽然有经验的研究人员已经练习了致盲,但对于首次进行此类分析的人来说,它仍然是有价值的建议。
在大脑部分选择和在分析期间跟踪 ROI 期间,对大脑区域的控制进行。确保使用不同动物的相同范围的布雷格玛水平部分。密度、分布和形态分析应使用相同的 ROI。对于密度和分布分析,在 FIJI/Image J 中绘制 ROI 时,精度尤为重要。强烈建议在部分选择和 ROI 跟踪中使用大脑图集。DAPI的使用还有助于识别神经解剖学地标。为了避免差异,建议拒绝仅部分位于 ROI 中的微胶质,因为它们在微环境中可能有所不同。在标记微胶质进行密度分析时,DAPI 通道可用作选择标准。通过仅计算包含 DAPI 染色核的微胶质,所有被视为微胶质的均位于同一平面上,从而减少了选择过程中的个人偏差。
由于 NND、间距指数和聚类分析的测量基于标记单个单元的点的位置,并且由于距离由 FIJI/ImageJ 计算,因此在放置这些点时必须保持一致。确保严格地将点放在细胞体的中心,这是视觉确定的。此外,在整个分析过程中,点的大小应保持一致。这将有助于更好地表现微胶质种群的空间分布。对于聚类分析,根据我们以前的分析,选择12μm作为距离阈值。然而,如果有四个或更多不同的细胞的NND低于12μm,所有这些细胞可以采取一个集群的一部分或代表两个细胞的两个簇。因此,必须返回到映像并确认群集的实际数量。
与密度和分布不同,在密度和分布中,ROI由使用大脑图集的神经解剖学特征决定,而选择微胶质细胞进行形态分析是基于分析细胞的能力。在移动到另一个 Z 堆栈之前,应选择所有可分析的单元格在 Z 堆栈中进行分析,以防止选择偏差。排除细胞的原因包括免疫染色或组织切割、处理(例如撕裂)或安装(例如气泡形成)的问题。理想情况下,有此类问题的大脑部分应系统地排除在成像和分析之外。还必须注意,TMEM119 和 IBA1 的染色不会显示 100% 重叠(图2A+C)。由于 TMEM119 不允许对过程连续性(以及 IBA1)进行可视化,因此很难评估一个单元的结束位置以及另一个单元的启动位置。因此,形态分析是使用IBA1通道完成的。此外,所有轨迹和点都应保存和可视化,以便将来进行修订,从而提高结果的透明度和可重现性。
该协议提供有关微胶质和渗透巨噬细胞的宝贵信息。其应用示例包括通过不同大脑区域微胶质的变化来检测神经炎症的迹象,研究化合物的抗炎作用,以及研究干扰微胶质正常功能的因素。考虑到该协议允许检测大脑中的巨噬细胞渗透和微胶质分化这些细胞,其他应用包括:确定巨噬细胞的招募是否发生在特定的侮辱中,或者与使用其他技术(即遗传工具),确认和研究在侮辱期间大脑中没有周围巨噬细胞的后果。请记住,荧光显微镜本身不足以确认脑膜内渗透。当IBA1+/TMEM119-细胞在心室或血管外空间附近观察到时,需要更高的空间分辨率技术,如电子显微镜,以确认其在腹腔内的定位。虽然密度、分布和形态的变化是微胶质和巨噬菌体作用的良好指标,但这种方法与功能调查相结合时最为强大。
披露声明
作者没有什么可透露的。
致谢
我们感谢娜塔莉·韦尔努对实验的指导和协助。我们还要感谢伊曼纽尔·普朗内尔博士和谢尔盖·里夫斯特博士分别使用荧光显微镜和共聚焦显微镜。这项工作的部分经费来自墨西哥科学技术委员会(CONACYT;F.G.I)、法米尔-乔奎特基金会和神经科学研究中心(CTRN;K.P.)、魁北克基金会-圣地基金会(至医学硕士)的奖学金。Shastri Indo-Canada 研究所(至 K.B.),以及加拿大自然科学和工程研究委员会(NSERC)向 M.E.T.M.E.T.提供的发现补助金,担任加拿大健康与治疗神经免疫可塑性研究主席(第二级)。
材料
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 488 donkey anti-mouse | Invitrogen/Thermofisher | A21202 | |
| Alexa Fluor 568 goat anti-rabbit | Invitrogen/Thermofisher | A11011 | |
| Biolite 24 Well multidish | Thermo Fisher | 930186 | |
| Bovine serum albumin | EMD Millipore Corporation | 2930 | |
| Citric acid | Sigma-Aldrich | C0759-500G | |
| DAPI Nuceleic acid stain | Invitrogen/Thermofisher | MP 01306 | |
| Fine Brush | Art store | ||
| Fluoromount-G | Southern Biotech | 0100-01 | |
| Gelatin from coldwater fish skin | Sigma-Aldrich | G7765 | |
| Microscope coverglass | Fisher Scientific | 1254418 | |
| Microslides positively charged | VWR | 48311-703 | |
| Monoclonal mouse Anti-IBA1 | Millipore | MABN92 | |
| Na2H2PO4·H2O | BioShop Canada Inc. | SPM306, SPM400 | |
| Na2HPO4 | BioShop Canada Inc. | SPD307, SPD600 | |
| NaBH4 | Sigma-Aldrich | 480886 | |
| NaCl | Fisher Scientific | S642500 | |
| Normal donkey serum (NDS) | Jackson ImmunoResearch laboratories Inc. | 017-000-121 | |
| Normal goat serum (NGS) | Jackson ImmunoResearch laboratories Inc. | 005-000-121 | |
| Parafilm-M | Parafilm | PM-999 | |
| Rabbit monoclonal Anti-TMEM119 | Abcam | ab209064 | |
| Reciprocal Shaking bath model 25 | Precision Scientific | - | |
| Transfer pipette | |||
| Tris buffer hydrochloride | BioShop Canada Inc. | TRS002/TRS004 | |
| Triton-X-100 | Sigma-Aldrich | T8787 | |
| Tween 20 | Sigma-Aldrich | P7949-100ML |
参考文献
- Lawson, L. J., Perry, V. H., Dri, P., Gordon, S. Heterogeneity in the distribution and morphology of microglia in the normal adult mouse brain. Neuroscience. 39 (1), 151-170 (1990).
- Milior, G., et al. Fractalkine receptor deficiency impairs microglial and neuronal responsiveness to chronic stress. Brain, Behavior, and Immunity. 55, 114-125 (2016).
- Nimmerjahn, A., Kirchhoff, F., Helmchen, F. Resting Microglial Cells Are Highly Dynamic Surveillants of Brain Parenchyma in Vivo. Science. 308 (5726), 1314-1318 (2005).
- Hickman, S., Izzy, S., Sen, P., Morsett, L., Khoury, J. E. Microglia in neurodegeneration. Nature Neuroscience. 21 (10), 1359 (2018).
- Tay, T. L., Savage, J. C., Hui, C. W., Bisht, K., Tremblay, M. &. #. 2. 0. 0. ;. Microglia across the lifespan: from origin to function in brain development, plasticity and cognition. The Journal of Physiology. 595 (6), 1929-1945 (2017).
- Tremblay, M. &. #. 2. 0. 0. ;., Lowery, R. L., Majewska, A. K. Microglial Interactions with Synapses Are Modulated by Visual Experience. PLoS Biology. 8 (11), (2010).
- Jakovljevic, M., et al. Induction of NTPDase1/CD39 by Reactive Microglia and Macrophages Is Associated With the Functional State During EAE. Frontiers in Neuroscience. 13, (2019).
- Taylor, A. M. W., et al. Microglia Disrupt Mesolimbic Reward Circuitry in Chronic Pain. The Journal of Neuroscience. 35 (22), 8442-8450 (2015).
- Poliani, P. L., et al. TREM2 sustains microglial expansion during aging and response to demyelination. The Journal of Clinical Investigation. 125 (5), 2161-2170 (2015).
- Lu, S. M., et al. HIV-1 Tat-Induced Microgliosis and Synaptic Damage via Interactions between Peripheral and Central Myeloid Cells. PLoS ONE. 6 (9), e23915 (2011).
- Rodríguez, J. J., et al. Increased densities of resting and activated microglia in the dentate gyrus follow senile plaque formation in the CA1 subfield of the hippocampus in the triple transgenic model of Alzheimer's disease. Neuroscience Letters. 552, 129-134 (2013).
- Rasmussen, S., et al. Persistent activation of microglia is associated with neuronal dysfunction of callosal projecting pathways and multiple sclerosis-like lesions in relapsing-remitting experimental autoimmune encephalomyelitis. Brain. 130 (11), 2816-2829 (2007).
- Walker, F. R., et al. Dynamic structural remodelling of microglia in health and disease: a review of the models, the signals and the mechanisms. Brain, Behavior, and Immunity. 37, 1-14 (2014).
- Ohsawa, K., Imai, Y., Kanazawa, H., Sasaki, Y., Kohsaka, S. Involvement of Iba1 in membrane ruffling and phagocytosis of macrophages/microglia. Journal of Cell Science. 113 (17), 3073-3084 (2000).
- Yamasaki, R., et al. Differential roles of microglia and monocytes in the inflamed central nervous system. Journal of Experimental Medicine. 211 (8), 1533-1549 (2014).
- Wohleb, E. S., et al. Peripheral innate immune challenge exaggerated microglia activation, increased the number of inflammatory CNS macrophages, and prolonged social withdrawal in socially defeated mice. Psychoneuroendocrinology. 37 (9), 1491-1505 (2012).
- Shemer, A., et al. Engrafted parenchymal brain macrophages differ from microglia in transcriptome, chromatin landscape and response to challenge. Nature Communications. 9, (2018).
- Geissmann, F., et al. Development of monocytes, macrophages and dendritic cells. Science (New York, N.Y). 327 (5966), 656-661 (2010).
- Minogue, A. M. Role of infiltrating monocytes/macrophages in acute and chronic neuroinflammation: Effects on cognition, learning and affective behaviour. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 79, 15-18 (2017).
- Ginhoux, F., et al. Fate Mapping Analysis Reveals That Adult Microglia Derive from Primitive Macrophages. Science (New York, N.Y). 330 (6005), 841-845 (2010).
- Kierdorf, K., et al. Microglia emerge from erythromyeloid precursors via Pu.1- and Irf8-dependent pathways. Nature Neuroscience. 16 (3), 273-280 (2013).
- Bennett, M. L., et al. New tools for studying microglia in the mouse and human CNS. Proceedings of the National Academy of Sciences of the United States of America. 113 (12), E1738-E1746 (2016).
- Mizutani, M., et al. The fractalkine receptor but not CCR2 is present on microglia from embryonic development throughout adulthood. Journal of Immunology. 188 (1), 29-36 (2012).
Erratum
Formal Correction: Erratum: Immunofluorescence Staining Using IBA1 and TMEM119 for Microglial Density, Morphology and Peripheral Myeloid Cell Infiltration Analysis in Mouse Brain
Posted by JoVE Editors on 10/12/2019. Citeable Link.
An erratum was issued for: Immunofluorescence Staining Using IBA1 and TMEM119 for Microglial Density, Morphology and Peripheral Myeloid Cell Infiltration Analysis in Mouse Brain. An author name was updated.
The name was corrected from:
Maude Bordelau
to:
Maude Bordeleau
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。