Method Article
Tinción de inmunofluorescencia utilizando IBA1 y TMEM119 para la densidad microglial, morfología y análisis de infiltración de células mieloides periféricas en el cerebro del ratón
En este artículo
Erratum Notice
Resumen
Este protocolo describe un flujo de trabajo paso a paso para la costaría inmunofluorescente de IBA1 y TMEM119, además del análisis de la densidad microglial, la distribución y la morfología, así como la infiltración de células mieloides periféricas en el tejido cerebral del ratón.
Resumen
Este es un protocolo para la visualización dual de microglia e infiltración de macrófagos en el tejido cerebral del ratón. TMEM119 (que etiqueta la microglia selectivamente), cuando se combina con IBA1 (que proporciona una visualización excepcional de su morfología), permite investigar los cambios en la densidad, distribución y morfología. La cuantificación de estos parámetros es importante para proporcionar información sobre los roles ejercidos por la microglia, los macrófagos residentes del cerebro. En condiciones fisiológicas normales, la microglia se distribuye regularmente en un patrón similar a un mosaico y presenta un pequeño soma con procesos ramificados. Sin embargo, como respuesta a factores ambientales (es decir, trauma, infección, enfermedad o lesión), la densidad microglial, la distribución y la morfología se alteran de diversas maneras, dependiendo del insulto. Además, el método de doble tinción descrito permite la visualización de macrófagos infiltrados en el cerebro en función de su expresión de IBA1 y sin colocalización con TMEM119. Por lo tanto, este enfoque permite la discriminación entre la microglia y la infiltración de macrófagos, que se requiere para proporcionar información funcional sobre su participación distinta en la homeostasis cerebral en diversos contextos de salud y enfermedad. Este protocolo integra los últimos hallazgos en neuroinmunología que se refieren a la identificación de marcadores selectivos. También sirve como una herramienta útil tanto para los neuroinmólogos experimentados como para los investigadores que buscan integrar la neuroinmunología en los proyectos.
Introducción
Ya sea aguda o crónica, la neuroinflamación está fuertemente influenciada por la microglia, los macrófagos residentes del cerebro. Visualizar la microglia a través de la inmunomancha es valioso para el estudio de la neuroinflamación con el uso de microscopía de luz, una técnica altamente accesible. En condiciones homeostáticas, la microglia se distribuye típicamente en un patrón no superpuesto, similar a un mosaico. Exhiben pequeños somas que se extienden procesos ramificados1, que a veces se ponen en contacto entre sí2. Los procesos ramificados microgliales examinan dinámicamente el parénquima cerebral, interactuando con las neuronas, otras células gliales y los vasos sanguíneos durante las condiciones fisiológicas normales3. Microglia están equipadas con un arsenal de receptores que les permiten realizar tareas inmunológicas y responder a los cambios en el entorno cerebral, a la muerte celular o al daño tisular. Además, ejercen funciones fisiológicas clave, especialmente en la formación sináptica, mantenimiento, y eliminación4,5.
Entre los marcadores disponibles utilizados para estudiar la microglia, la molécula de adaptador de calcio ionizado 1 (IBA1) es una de las más utilizadas. IBA1 es una proteína de unión al calcio que proporciona una visualización excepcional de la morfología microglial, incluidos los procesos distales finos, como lo confirma la microscopía electrónica6. Esta herramienta ha sido fundamental para caracterizar la transformación microglial, anteriormente llamada "activación", en una amplia gama de modelos de enfermedades animales7,8,9. En presencia de neuroinflamación, la respuesta microglial incluye: microgliosis que se define como un aumento de la densidad celular, cambios en la distribución que a veces resultan en clustering, agrandamiento del cuerpo celular, así como engrosamiento y acortamiento de procesos asociados con formas más ameboideas10,11,12,13.
La inmunomancha está limitada por la disponibilidad de anticuerpos dirigidos contra marcadores específicos. Es importante destacar que IBA1 se expresa mediante microglia, pero también por macrófagos periféricos que se infiltran en el cerebro14. Mientras que la observación de células IBAN1 positivas dentro del cerebro se ha convertido en un marcador de microglia en este campo de investigación, la infiltración de macrófagos periféricos se ha reportado bajo diversas condiciones, incluso marginalmente en el cerebro sano15,16 ,17,18. En consecuencia, el uso de IBA1 por sí solo no permite la visualización selectiva de microglia. Además, los macrófagos adoptan características moleculares y morfológicas de la microglia residente una vez que se han infiltrado en el cerebro, lo que dificulta la diferenciación19. Esto representa un desafío a la hora de investigar la función de la microglia y de la infiltración de macrófagos.
Si bien los macrófagos periféricos y microglia tienen orígenes distintos (por ejemplo, del saco de yema embrionaria y la médula ósea, respectivamente20,21), hay un número cada vez mayor de hallazgos que indican que las poblaciones de dos células ejercen diferentes roles en el cerebro19. Por lo tanto, es crucial utilizar métodos que discriminen entre estas dos poblaciones sin manipulaciones invasivas (es decir, quimeras de médula ósea o parabiosis) que puedan modular su densidad, distribución, morfología y función. TMEM119 ha surgido como un marcador específico de microglia en todas las condiciones de salud y enfermedad22. Cuando se combina con IBA1, este marcador se vuelve útil para diferenciar estas células de los macrófagos infiltrados, que son TMEM119-negativo e IBA1-positivo. Si bien está regulada por el desarrollo, TMEM119 se expresa ya en los días postnatales 3 (P3) y 6 (P6), aumentando constantemente hasta alcanzar los niveles adultos entre P10 y P1422. Iba1 se expresa desde el día embrionario 10.5 (E10.5)23. Por lo tanto, el protocolo de doble etiquetado propuesto es útil para estudiar estas dos poblaciones a lo largo de la vida posnatal.
Este protocolo proporciona un procedimiento de inmunostainización paso a paso que permite la discriminación entre la microglia y los macrófagos periféricos. También explica cómo realizar un análisis cuantitativo de la densidad microglial, la distribución y la morfología, así como el análisis de la infiltración de macrófagos periféricos. Si bien la investigación de microglia y macrófagos periféricos es útil por sí sola, este protocolo permite además la localización de vestíbulos neuroinflamatorios; por lo tanto, también sirve como plataforma para identificar regiones específicas para investigar, con el uso de técnicas complementarias (aún, más lentas y que consumen recursos).
Protocolo
Todos los procedimientos experimentales se llevaron a cabo de acuerdo con las directrices de los comités institucionales de ética animal, de conformidad con el Consejo Canadiense de Cuidado de Animales y el Comité de Cuidado de Animales de la Universidad Laval.
1. Inmunomanchación
- Seleccione tres secciones del cerebro del ratón que contengan la región de interés (ROI) (es decir, el hipocampo) con la ayuda de un atlas cerebral. Coloque las secciones en una placa de plástico multipocillos y cúbralas con 350 ml de solución salina con fosfato (PBS)(Tabla 1).
NOTA: Para obtener resultados óptimos, los cerebros deben ser perfundidos con un 4% de paraformaldehído y cortados a un espesor de 50 m con un vibratome. Para una placa de 24 pocillos múltiples, cada pozo puede contener hasta seis secciones. El volumen recomendado de solución para cada pocil es de 350 ml (para un máximo de tres secciones) y de 500 l para los pozos que contienen seis secciones. Para un mayor número de secciones, se recomienda utilizar una placa de 12 pocillos múltiples. Asegúrese de que el volumen seleccionado de solución para cada pocal cubra completamente el tejido y permita que las secciones floten. Los volúmenes recomendados se aplican para cada solución utilizada en el resto del protocolo. - Lave las muestras cubriéndolas con 350 ml de PBS y déjelas reposar colocando la placa multipozo encima de un agitador multiusos a temperatura ambiente (RT). Retire el PBS después de 5 min y reemplácelo 5 veces con PBS fresco.
NOTA: Para eliminar las soluciones, se recomienda una pipeta de transferencia. Cuando vierta en cualquier solución, asegúrese de colocar la punta de la pipeta contra la pared del pozo para proteger la integridad del tejido. Asegúrese también de utilizar una nueva pipeta para cada nueva solución. - Retire el PBS y agregue 350 ml de tampón de citrato sódico de 10 mM con pH a 6,0(Tabla 1).
- Selle la placa multipocilla con película de parafina y déjela flotar en un baño de agua previamente precalentado durante 40 minutos a 70 oC.
- Deje que la placa de varios pocillos se enfríe durante aproximadamente 15 minutos.
- Retire el tampón de citrato de sodio y lave las secciones de PBS como se hace en el paso 1.2.
- Retire el PBS y agregue 350 l de NaBH4 recién hecho(Tabla 1)y deje incubar durante 30 minutos en RT.
- Retire la solución de 0.1% NaBH4 y lave las secciones en PBS como se hace en el paso 1.2.
- Retire el PBS y agregue el buffer de bloqueo(Tabla 1) durante 1 h en RT encima de un agitador multipropósito.
NOTA: Asegúrese de preparar volúmenes duplicados de búfer de bloqueo, ya que se utilizará la misma solución en el siguiente paso. - Retire el búfer de bloqueo y sustitúyalo por un búfer de bloqueo que contenga la mezcla de anticuerpos primarios (1:150 mouse IBA1 + 1:300 TMEM119). Sellar la placa con película de parafina y dejar que se incuba durante la noche a 4oC.
- Al día siguiente, muestras cálidas en RT durante aproximadamente 15 minutos.
- Lave las secciones 5x durante 5 min cada una en PBS con tritón (PBST)(Tabla 1).
- Retire PBST y agregue el búfer de bloqueo que contenga la mezcla de anticuerpos secundarios (1:300 burro antiratón Alexa 488 para IBA1; 1:300 cabra anti-conejo 568 para TMEM119) durante 1.5 h en RT. A partir de este punto, proteja las muestras de la luz.
- Retire el tampón de bloqueo y lave las secciones 5x como se hace en el paso 1.2, excepto esta vez con PBST.
- Retire el PBST y agregue 4o,6-diamidino-2-fenilindolo (DAPI) [1:20000] durante 5 min en RT.
- Retire DAPI y lave las secciones 3x durante 5 min cada una en tampón de fosfato (PB).
- Monte las secciones en una diapositiva del microscopio. Déjalos secar mientras están protegidos de la luz.
- Cuando se seque, añadir algunas gotas de medio de fluorescencia de montaje y cubrir con un cubreobjetos, evitando la formación de burbujas.
NOTA: Almacene las diapositivas mientras están protegidas de la luz, dentro de una caja de diapositivas histológica, a 4oC. Las muestras se pueden conservar durante varios meses.
2. Imágenes para el análisis de densidad y distribución
- Con la ayuda de un microscopio de epifluorescencia de campo ancho, utilice un aumento bajo y el canal DAPI para localizar el ROI (es decir, la región CA1 del hipocampo).
- Adquiera imágenes a 20x, utilizando una apertura numérica (NA) de 0,5, con los canales y filtros DAPI, 488 y 568, con una resolución de 0,3 m/píxel. Capture una imagen de mosaico que cubra el ROI. Alternativamente, tome fotografías individuales que se coserán en una imagen más grande.
NOTA: Una imagen de mosaico es una super imagen constituida por imágenes más pequeñas. Las imágenes de mosaico se utilizan generalmente para superar el área limitada del campo de visión de aumentos altos. Algunos programas incluyen una función de mosaico; sin embargo, las imágenes también se pueden coser manualmente junto con otro software de edición de fotos mediante la costura de las imágenes individuales en una sola. Recuerde agregar la información de escala al archivo. Para este tipo de análisis, se recomienda tener al menos 300 células microgliales fotografiadas por ROI/animal (correspondientes a aproximadamente 10-15 imágenes para el hipocampo, por ejemplo), con un mínimo de cinco animales por condición experimental. La Figura 1A-C muestra las imágenes de la microglia colabelled. - Guarde la imagen como un archivo TIFF.
3. Imágenes para el análisis morfológico
- Con un microscopio de iluminación confocal o estructurado, utilice el canal DAPI para localizar el ROI con bajo aumento.
- Usando un objetivo 40x (es decir, aceite NA 1.4), localice una célula IBA1+/TMEM119+ dentro del ROI. Mientras las imágenes en vivo, muévanse en el eje Z. Tan pronto como desaparezca la señal de la microglia seleccionada al azar, establezca este nivel Z como el comienzo de la pila Z. Muévete a lo largo del eje Z en la dirección opuesta hasta que la señal de la microglia desaparezca y establece ese punto como el final de la pila Z.
NOTA: La Figura 2A-C muestra imágenes de la microglia IBA1+/TMEM119+. - Cree una pila Z en los tres canales (DAPI, 488, 568) utilizando un intervalo Z de 0,33 m y un tamaño de píxel de 0,15 m/píxel. Agregue la información de escala al archivo.
NOTA: El intervalo Z recomendado depende de la potencia de resolución del objetivo (por ejemplo, para un objetivo de 40x como el aceite NA 1.4, es de 0,33 m). Para el análisis morfológico, se recomienda tener al menos 20 células por animal con un mínimo de cinco animales por condición experimental. - Guarde el archivo como un archivo TIFF.
4. Análisis de densidad y distribución
- Abra FIJI/ImageJ con el plugin de distancia de vecino más cercano (NND) instalado. Abra la imagen 20x.
NOTA: Utilice un motor de búsqueda con la palabra clave "Cálculo de distancias de vecino más cercano con ImageJ" para encontrar las instrucciones de instalación. El plugin Author es Yuxiong Mao. - Para establecer la escala manualmente en función de una escala impresa en la imagen, seleccione la herramienta de línea recta(Figura 3E),coloque el cursor en el borde de la escala y, mientras presiona la tecla Mayús, dibuje una línea lo más cerca posible de la escala en la imagen(Figura 3IAnalizar) Establezca la escalay, a continuación, introduzca la información correcta(figura 3J).
NOTA: La escala a veces se puede incluir en los metadatos del archivo y establecerse automáticamente. - Seleccione Imagen ( Image) Color ( Color ) Cree compuesto para crear una imagen compuesta de todos los canales.
NOTA: Durante la adquisición de imágenes, FIJI/ImageJ creará automáticamente un compuesto en formato RGB. - En la barra de menús, seleccione Analizar . Establezca las medidas. Compruebe el área, Centroidey perímetro. En la pestaña Redireccionar a, haga clic y seleccione el archivo abierto(Figura 3K).
- Ir a la imagen de la imagen de la imagen de la imagen de Color ( Color ) Herramienta de canal para abrir la herramienta de canal.
NOTA: Este menú permitirá desactivar un color específico. El canal DAPI puede ser útil para identificar el ROI y confirmar las celdas. Se puede desactivar para facilitar el conteo. - Dibuje un perímetro áspero del ROI con la herramienta de selección a mano alzada(Figura 3D).
- Habilite la herramienta de pincel de selección haciendo doble clic en la herramienta ovalada en la barra de herramientas y asegúrese de que la casilla Habilitar pincel de selección esté activada(Figura 3G). Esta herramienta se utilizará para delinear el ROI con mayor precisión. Seleccione un tamaño de pincel adecuado entre 200 y 400.
- Con el pincel de selección, ajuste el perímetro para que se ajuste mejor al ROI. Presione T en el teclado para agregarlo al administrador de ROI(Figura 3L).
- Seleccione Analizar (Analizar) Mida o presione la tecla M, y aparecerá una ventana de resultados. Copie y pegue los resultados en una hoja de datos y, a continuación, guarde la información relativa al área (es decir, el área del ROI; Figura 3R).
- Después de copiar el área del ROI, borre la información de la ventana de resultados haciendo clic en ella y presionando la tecla Retroceso.
- Vaya a la ventana del administrador de ROI(Figura 3L), haga clic con el botón derecho en el seguimiento del ROI, cambie el nombre para que coincida con el nombre de la imagen y, a continuación, guarde.
- Haga doble clic en la herramienta de pincel en la barra de herramientas. Seleccione el color negro y un tamaño de pincel de 10. Asegúrese de que la opción Pintar de superposición está desactivada(Figura 3H).
- En el canal TMEM119, coloque cuidadosamente un punto negro en el centro del soma para cada microglia TMEM119+. Coloque un punto blanco en el centro de las celdas que no son positivos para TMEM119 (para marcar los macrófagos infiltrados). Repita el mismo procedimiento para todas las celdas contenidas en el ROI.
NOTA: Es importante que todos los puntos (blanco y negro) se encuentren en el mismo canal. La identidad del canal se puede verificar (rojo, azul o verde) mirando el color de las etiquetas de la ventana de imagen. - Seleccione Imagen ( Image) Color ( Color ) Dividir canal. Aparecerá una ventana para cada canal. A continuación, identifique el canal que tiene las anotaciones de puntos y cierre las otras dos ventanas.
- Redirija la nueva imagen de canal dividido. Ir a Analizar ? Establezca las medidas. En la pestaña Redireccionar a, haga clic y seleccione la imagen de canal dividido(figura 3K).
- Seleccione Imagen ( Image) Tipo de la clase de texto (Type 8 bits. Ir a la imagen de la imagen de la imagen de la imagen de Ajuste y seleccione Umbral (Figura 3O). Para ajustar el umbral, deslice el botón de la segunda barra, hasta la izquierda (valor de umbral 0) en ambas barras.
NOTA: Esto dejará sólo los puntos negros en la imagen, que aparecen en blanco. - Seleccione el ROI en la ventana administrador de ROI. Seleccione Analizar (Analizar) Analizar partícula (Figura 3N). En tamaño (pulgadas 2): escribir 1 a 20. Mantenga la unidad de píxeles desactivada, marque Mostrar, resumir y agregar al administradory pulse Ok. La ventana de resumen aparecerá y dará el número de puntos(Figura 3P). Copie y pegue la información en la hoja de datos.
- Seleccione Plugins (Plugins) NND. Aparecerá la ventana NND (Figura 3Q). Copie/pegue toda la información en la hoja de datos. Cada número representa la distancia que cada microglia tiene a la microglia vecina más cercana.
- Vuelva a la ventana de umbral y deslice la primera barra hasta la derecha (valor de umbral 255 en ambas barras), lo que dejará todos los puntos blancos visibles, apareciendo en blanco(Figura 3M).
- Seleccione Analizar (Analizar) Analizar partícula. Aparecerá la ventana de resumen que proporciona el número de puntos (Figura 3P). Copie y pegue la información en la hoja de datos.
- Vaya al administrador de ROI para seleccionar todos los puntos, haga clic con el botón derecho y guárdelos con el nombre de la imagen. Esto permitirá guardar todos los puntos en un archivo zip(Figura 3L). Seleccione Archivo (File) ) Guarde como, y guarde el archivo con un nombre que permita identificar la imagen analizada.
- Obtenga la densidad de microglia (para cada imagen) dividiendo el número de celdas dobles positivas IBA1+/TMEM119+ por el área del ROI.
NOTA: Los valores de cada imagen se pueden promediar para cada animal. A continuación, los datos pueden presentarse como media de error estándar de la media (SEM) de todos los animales. - Determine el NND obteniendo un promedio por imagen de los valores NND de todas las células TMEM119+.
NOTA: Los datos pueden ser presentados como medias - SEM de todos los animales. - Calcule el índice de espaciado utilizando la fórmula: NND2 x densidad.
NOTA: Los datos pueden ser presentados como medias - SEM de todos los animales. Las unidades para esta medición serán unidades arbitrarias. - Cuantifique los racimos microgliales identificando las células que tienen un NND de menos de 12 m.
NOTA: Aquí se seleccionan 12 m, ya que es la distancia aproximada entre dos células microgliales que yuxtaponen directamente tocándose entre sí con arborizaciones. Si hay más de tres microglia que cumplen esta condición, vuelva a la imagen y compruebe si estas celdas forman parte de uno o varios clústeres. - Después de confirmar el número de clústeres, escriba el número de clústeres en la hoja de datos.
NOTA: El número de racimos se puede dividir por el área de ROI para obtener la densidad de células/mm2 para cada animal. Los datos pueden ser presentados como medias - SEM de todos los animales. - Para determinar el porcentaje de infiltración de células mieloides periféricas, calcule el porcentaje de células IBA1+/TMEM119 sobre el número total de células mieloides (TMEM119+IBA/IBA1+ + TMEM119-/IBA1+) para cada animal.
NOTA: Los datos pueden ser presentados como medias - SEM de todos los animales.
5. Análisis morfológico
- Abra FIJI/ImageJ.
- Abra la imagen 40x con Image J o FIJI. Seleccione Una ventana emergente aparecerá preguntando si las imágenes deben abrirse en una pila. Haga clic en Aceptar. A continuación, seleccione Imagen ( Image) Pilas ? Proyecto Z para abrir la ventana de proyección Z. Incluya todos los sectores, desde el primer hasta el último sector. Asegúrese de que la intensidad máxima está seleccionada en Tipo de proyeccióny haga clic en Aceptar
- Haga clic en la nueva ventana con el proyecto Z. Seleccione Imagen ( Image) Colores ? Dividir canales. Lleve a cabo las trazas en las imágenes del canal IBA1.
NOTA: Los otros canales (TMEM119 y DAPI) se pueden mantener abiertos y consultados según sea necesario durante el análisis de morfología microglial. - En la barra de menús, seleccione Analizar . Establezca las medidas. Compruebe el área, Centroidey Perímetro. En la pestaña Redireccionar a, seleccione el archivo abierto(Figura 3K).
- Establezca la escala como se describe en los pasos 4.2.
- Para medir el tamaño del soma en el canal IBA1, dibuje un perímetro áspero del soma con la herramienta de selección a mano alzada(Figura 3D).
- Habilite la herramienta de pincel de selección haciendo doble clic en la herramienta ovalada en la barra de herramientas, seguido de la casilla Habilitar el pincel de selección (Figura 3G). Seleccione un tamaño de pincel de selección entre 10 y 20(Figura 3B).
- Con el pincel de selección, ajuste el trazado para que se ajuste mejor al soma. Acercar se habilitará la precisión durante este paso(Figura 2I).
- Pulse la tecla T para añadir la traza de soma al gestor de ROI(Figura 3L).
- Seleccione Analizar (Analizar) Mida o pulse la tecla M. Aparecerá una ventana de resultados. Copie y pegue los resultados en una hoja de datos(Figura 3R).
- Para guardar la información relativa al área de soma, vaya a la ventana del administrador de ROI, haga clic con el botón derecho en el ROI, cambie el nombre para que coincida con el nombre de la imagen, especifique que el seguimiento es para soma y, a continuación, guarde el archivo.
- Para medir el área de arborización en el canal IBA1, haga clic en una extremidad de proceso microglial con la herramienta de selección de polígonos, que iniciará la forma del polígono(Figura 3C).
- Siguiendo las puntas de los procesos microgliales, vaya alrededor de la microglia haciendo clic en las puntas de cada extremidad del proceso para formar un polígono que mejor represente el área cubierta por las arborizaciones microglia(Figura 2D-H).
NOTA: Asegúrese de que el polígono conecta todas las extremidades del proceso microglial. Las líneas que forman el polígono nunca deben intersecar. Al hacer clic alrededor de una punta de proceso microglial, tenga cuidado de evitar cortar cualquier parte del proceso. A veces es útil agregar puntos adicionales para ir alrededor de un proceso. El número de puntos que forman el polígono no está directamente vinculado al número de procesos distales y, por lo tanto, no es relevante para el estudio. - Para cerrar el polígono, haga clic en el punto inicial del polígono.
- Presione la tecla T para agregar el seguimiento al administrador de ROI(Figura 3L). Seleccione Analizar (Analizar) Mida o pulse la tecla M. Aparecerá una ventana de resultados. Copie y pegue los resultados en una hoja de datos(Figura 3R).
- Para guardar la información relativa al área de arborización, vaya a la ventana administrador de ROI, haga clic con el botón derecho en el ROI, cambie el nombre para que coincida con el nombre de la imagen, especifique para la arborización y, a continuación, guarde el archivo.
- Determinar el área de soma promediando todas las áreas de soma para cada animal.
NOTA: Los datos se pueden presentar como medias de SEM de todos los animales. - Determinar el área de arborización promediando todas las áreas de arborización para cada animal.
NOTA: Los datos se pueden presentar como medias de SEM de todos los animales. - Calcule el índice de morfología utilizando el área de soma de fórmula/área de arborización para cada célula microglial y el promedio por animal.
NOTA: Los datos se pueden presentar como medias de SEM de todos los animales.
Resultados
La Figura 1 muestra el coetiquetado de microglia utilizando IBA1 y TMEM119 en una sección coronal del hipocampo dorsal que se muestra a 20 veces mediante microscopía de fluorescencia. Una tinción exitosa revela cuerpos celulares microgliales y sus procesos finos(Figura 1A-C). Esta tinción permite determinar la densidad microglial y la distribución e identificación de los cúmulos microgliales(Figura 1I)e infiltrarse en macrófagos(Figura 1F).
La Figura 2 muestra la microglia IBA1+/TMEM119+(Figura 2A-C) en un ejemplo escalonado del procedimiento de seguimiento de la arborización microglial(Figura 2D-H),así como un ejemplo de rastreo del cuerpo celular(Figura 2I ), ambos con imágenes a 40x por microscopía confocal.

Figura 1: Separación doble de tejido cerebral del ratón IBA1 y TMEM119 para análisis de densidad, distribución, agrupación y infiltración de células mieloides periféricas. (A-C) Distribución microglial típica en el hipocampo de un ratón adulto C57BL/6. (D-F) Microglia identificada como IBA1+/TMEM119+ y macrófagoino infiltrado identificado como IBA1+/TMEM119 (flecha blanca) en la amígdala de un ratón macho. (G-I) Cúmulo de dos microglia (cuadrado blanco) en el hipocampo de un ratón. Haga clic aquí para ver una versión más grande de esta figura.
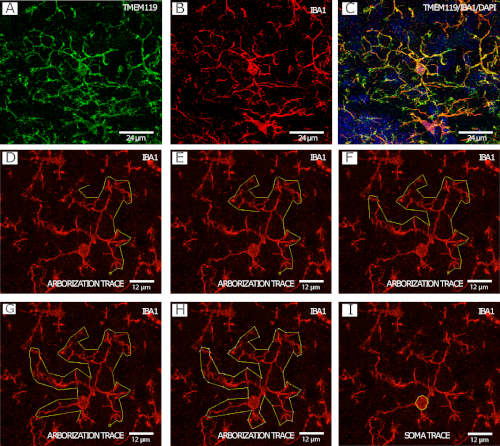
Figura 2: Tinción IBA1 y TMEM119 para análisis de morfología microglial. (A-C) Microglia. (D-I) Ejemplo paso a paso de seguimiento de arborización con el canal IBA1 utilizando la herramienta poligonal en FIJI/ImageJ. (J) Ejemplo de trazado de microglia soma con el canal IBA1 utilizando la herramienta de selección a mano alzada en FIJI/ImageJ. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Interfaz FIJI/ImageJ y herramientas para la densidad microglial, distribución, agrupación en clústeres, morfología y análisis de infiltración de células mieloides periféricas. (A-R) Recopilación de todas las herramientas, menús y ventanas utilizados para los análisis de densidad, clúster y morfología. Haga clic aquí para ver una versión más grande de esta figura.
| Soluciones | Preparación |
| Bloqueo del búfer | 0.5% gelatina + 5% suero natural de cabra + 5% suero de burro natural + 0.01% Triton X-100 en TBS [0.05 M] |
| Tampón de citrato | 1,92 g de ácido cítrico [10 mM], 500 l de Tween 20 [0,05% (v/v)], 700 ml de agua ultrapura, ajuste el pH a 6,0 con NaOH [10 N], llene hasta 1 L con agua ultrapura |
| NaBH4 | [0.01% p/p] Disolve 0,01 g de NaBH4 en 10 ml de agua ultrapura, la solución debe estar bien mezclada. Esta solución crea burbujas; presión de liberación abriendo la tapa después de mezclar |
| Pb | [100 mM] Disolve 23,48 g de Na2HPO4 y 4,8 g de NaH2PO4? H2O en 1 L de agua ultrapura, luego llenar hasta 2 L, ajustar el pH a 7,4 |
| Pbs | [50 mM] Disolve 5,87 g de Na2HPO4, 1,2 g de NaH2PO4? H2O, 9 g de NaCl en 500 ml de agua ultrapura, llenar hasta 1 L con agua ultrapura, ajustar el pH a 7,4 |
| PBST | PBS + 0.01% Triton X-100 |
| Tbs | Diluir Tris HCl [0,5 M] con agua ultrapura 1:10 [0,05 M], tomar 1 L de Tris HCl [0,05 M] y añadir 8,75 g de NaCl |
| Tris HCl | [0,5 M] 950 mL de agua ultrapura, añadir 78,8 g de clorhidrato tampón Tris (C4H11NO3Cl) ajustar el pH a 8 y llenar hasta 1 L |
Tabla 1: Soluciones utilizadas para la inmunomancha.
Discusión
Este protocolo se puede dividir en dos partes críticas: calidad de la tinción y análisis. Si la tinción no es óptima, no representará adecuadamente las células microgliales, afectando así las mediciones de densidad, distribución y morfología. Además, se puede subestimar la proporción de células mieloides periféricas de infiltración. Esta es una versión optimizada del protocolo de tinción, pero hay varios factores que pueden resultar en imágenes subóptimas. A pesar de que la perfusión del animal no está incluida en este protocolo, si la fijación cerebral no está bien ejecutada, la calidad de la tinción se verá comprometida. Además, se requiere suficiente perfusión para asegurar la ausencia de macrófagos dentro de los vasos sanguíneos que pueden interferir con el estudio.
Con respecto a la inmunomancha, los detalles más críticos incluyen la calidad de los tampones, el paso de bloqueo, el almacenamiento adecuado de anticuerpos y el manejo de muestras cerebrales. La preparación adecuada de los tampones y su almacenamiento tiene una influencia directa en la calidad de la tinción. A menos que se especifique, algunos búferes se pueden almacenar durante largos períodos, pero se debe evitar el uso de cualquier búfer que muestre signos de contaminación. Si los tampones se preparan con días o semanas de antelación, se debe verificar el pH de cada solución antes de su uso.
Además, en lo que respecta a la inmunomancha, la presencia de tinción de fondo sigue siendo uno de los problemas más comunes. La tinción de fondo dificulta el análisis de la microglia, especialmente su morfología, y por lo tanto sesgará los resultados. Para evitar el fondo, es importante que el paso de bloqueo se realice correctamente. Las condiciones de almacenamiento de los anticuerpos también tienen efectos directos sobre su eficacia. Se recomienda seguir estrictamente las pautas de almacenamiento proporcionadas por la empresa, así como evitar ciclos frecuentes de congelación de descongelación. Finalmente, durante todo el proceso, es fundamental prestar atención a la integridad física de las secciones cerebrales. Es importante tener cuidado durante cada manipulación (cambios de búfer, lavados y montaje), especialmente si el experimentador no tiene experiencia con este procedimiento. Se aconseja evitar dejar las muestras sin ninguna solución líquida al cambiar soluciones o tampones, las soluciones para el paso posterior deben estar listas para verter en el pozo de antemano. La placa multi-pozo debe estar correctamente sellada con película de parafina durante el paso de la noche para evitar la evaporación que puede llevar a las muestras a secar.
El análisis cuantitativo de la densidad microglial, la distribución y la morfología tiene varias ventajas sobre los informes cualitativos. Para evitar el sesgo, el investigador que realiza el análisis debe estar cegado a la condición experimental. Por lo tanto, se sugiere que diferentes personas realicen el análisis y cambien el nombre de los archivos (manteniendo los nombres originales y nuevos en una hoja de claves). Los nuevos nombres no deben tener indicios de la condición experimental. El análisis completo se puede hacer en estos archivos ciegos, y la identidad de la imagen original se revela sólo después de la compilación de datos y antes del análisis estadístico. Aunque la ceguera ya es practicada por investigadores experimentados, sigue siendo un valioso consejo para aquellos que realizan este tipo de análisis por primera vez.
El control de la región cerebral se realiza durante la selección de la sección cerebral y el rastreo del ROI durante el análisis. Asegúrese de utilizar secciones de la misma gama de niveles de Bregma en todos los animales. El mismo ROI debe utilizarse para los análisis de densidad, distribución y morfología. Para los análisis de densidad y distribución, es particularmente importante ser preciso al dibujar el ROI en FIJI/Image J. Se recomienda encarecidamente el uso de un atlas cerebral tanto para la selección de secciones como para el seguimiento del ROI. El uso de DAPI también facilita la identificación de puntos de referencia neuroanatómicos. Para evitar la varianza, se recomienda rechazar la microglia que sólo se encuentra parcialmente en el ROI, ya que pueden diferir entre su microambiente. Al marcar la microglia para el análisis de densidad, el canal DAPI se puede utilizar como criterio de selección. Contando sólo la microglia que contiene núcleos teñidos con DAPI, todas las microglia consideradas están en el mismo plano, reduciendo el sesgo personal durante la selección.
Dado que las mediciones para el NND, el índice de espaciado y el análisis de clústerse se basan en las ubicaciones de puntos que marcan celdas individuales, y dado que las distancias son calculadas por FIJI/ImageJ, es importante ser coherente al colocar estos puntos. Asegúrese de colocar estrictamente los puntos en el centro del cuerpo celular, que se determina visualmente. Además, el tamaño de los puntos debe ser coherente durante todo el análisis. Esto contribuirá a una mejor representación de la distribución espacial de la población microglial. Para el análisis de clústeres, se seleccionaron 12 m como un umbral de distancia basado en nuestros análisis anteriores. Sin embargo, si hay cuatro o más celdas diferentes con un NND por debajo de 12 m, todas estas celdas podrían tomar parte de un solo clúster o representar dos clústeres de dos celdas. Esto hizo necesario volver a las imágenes y confirmar el número real de clústeres.
A diferencia de la densidad y la distribución, en las que el ROI está determinado por características neuroanatómicas utilizando un atlas cerebral, la selección de células microgliales para el análisis morfológico se basa en la capacidad de analizar la célula. Todas las celdas que se pueden analizar deben seleccionarse para su análisis en una pila Z antes de pasar a otra pila Z para evitar el sesgo de selección. Las razones para excluir las células incluyen problemas con la inmunomancha o el corte de tejidos, procesamiento (por ejemplo, desgarro) o montaje (por ejemplo, formación de burbujas). Idealmente, las secciones cerebrales con tales problemas deben excluirse sistemáticamente de las imágenes y el análisis. También es importante tener en cuenta que la tinción para TMEM119 e IBA1 no muestra una superposición del 100%(Figura 2A-C). Debido a que TMEM119 no permite la visualización de la continuidad del proceso (así como IBA1), esto hace que sea difícil evaluar dónde termina una celda y dónde comienza otra. Por lo tanto, el análisis morfológico se realiza utilizando el canal IBA1. Además, todos los rastros y puntos deben guardarse y visualizarse para futuras revisiones, lo que permite aumentar la transparencia y reproducibilidad de los resultados.
Este protocolo proporciona información valiosa sobre la microglia y la infiltración de macrófagos. Ejemplos de sus aplicaciones incluyen la detección de signos de neuroinflamación a través de cambios en la microglia en diferentes regiones cerebrales, el estudio de los efectos antiinflamatorios de un compuesto, y el estudio de factores que interfieren con la función adecuada de la microglia. Teniendo en cuenta que este protocolo permite la detección de macrófagos infiltrantes en el cerebro y la diferenciación de estas células de la microglia, las aplicaciones adicionales incluyen: determinación si el reclutamiento de macrófagos se produce en un insulto particular o con el uso de otras técnicas (es decir, herramientas genéticas), y confirmar y estudiar las consecuencias de la ausencia de macrófagos periféricos en el cerebro durante el insulto. Tenga en cuenta que la microscopía de fluorescencia por sí sola no es suficiente para confirmar la infiltración dentro del parénquima cerebral. Cuando se observan células IBA1+/TMEM119- cerca de los ventrículos o del espacio perivascular, se requieren técnicas de mayor resolución espacial, como la microscopía electrónica, para confirmar su localización dentro del parénquima. Si bien los cambios en la densidad, la distribución y la morfología son buenos indicadores de los roles microgliales y de los macrófagos, este enfoque es más potente cuando se combina con investigaciones funcionales.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a Nathalie Vernoux por su orientación y ayuda con los experimentos. También queremos dar las gracias a los Doctores Emmanuel Planel y Serge Rivest por el uso de su fluorescencia y microscopios confocales, respectivamente. Este trabajo fue financiado en parte con becas del Consejo Mexicano de Ciencia y Tecnología (CONACYT; a F.G.I), Fundación Famille-tette y Centre thématique de recherche en neurosciences (CTRN; to K.P.), Fonds de Recherche du Québec - Santé (a M.B.), y Choqueté Shastri Indo-Canadian Institute (a K.B.), así como una beca Discovery del Natural Sciences and Engineering Research Council of Canada (NSERC) a M.E.T. M.E.T. tiene una Cátedra de Investigación de Canadá (Nivel II) de Plasticidad Neuroinmune en Salud y Terapia.
Materiales
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 488 donkey anti-mouse | Invitrogen/Thermofisher | A21202 | |
| Alexa Fluor 568 goat anti-rabbit | Invitrogen/Thermofisher | A11011 | |
| Biolite 24 Well multidish | Thermo Fisher | 930186 | |
| Bovine serum albumin | EMD Millipore Corporation | 2930 | |
| Citric acid | Sigma-Aldrich | C0759-500G | |
| DAPI Nuceleic acid stain | Invitrogen/Thermofisher | MP 01306 | |
| Fine Brush | Art store | ||
| Fluoromount-G | Southern Biotech | 0100-01 | |
| Gelatin from coldwater fish skin | Sigma-Aldrich | G7765 | |
| Microscope coverglass | Fisher Scientific | 1254418 | |
| Microslides positively charged | VWR | 48311-703 | |
| Monoclonal mouse Anti-IBA1 | Millipore | MABN92 | |
| Na2H2PO4·H2O | BioShop Canada Inc. | SPM306, SPM400 | |
| Na2HPO4 | BioShop Canada Inc. | SPD307, SPD600 | |
| NaBH4 | Sigma-Aldrich | 480886 | |
| NaCl | Fisher Scientific | S642500 | |
| Normal donkey serum (NDS) | Jackson ImmunoResearch laboratories Inc. | 017-000-121 | |
| Normal goat serum (NGS) | Jackson ImmunoResearch laboratories Inc. | 005-000-121 | |
| Parafilm-M | Parafilm | PM-999 | |
| Rabbit monoclonal Anti-TMEM119 | Abcam | ab209064 | |
| Reciprocal Shaking bath model 25 | Precision Scientific | - | |
| Transfer pipette | |||
| Tris buffer hydrochloride | BioShop Canada Inc. | TRS002/TRS004 | |
| Triton-X-100 | Sigma-Aldrich | T8787 | |
| Tween 20 | Sigma-Aldrich | P7949-100ML |
Referencias
- Lawson, L. J., Perry, V. H., Dri, P., Gordon, S. Heterogeneity in the distribution and morphology of microglia in the normal adult mouse brain. Neuroscience. 39 (1), 151-170 (1990).
- Milior, G., et al. Fractalkine receptor deficiency impairs microglial and neuronal responsiveness to chronic stress. Brain, Behavior, and Immunity. 55, 114-125 (2016).
- Nimmerjahn, A., Kirchhoff, F., Helmchen, F. Resting Microglial Cells Are Highly Dynamic Surveillants of Brain Parenchyma in Vivo. Science. 308 (5726), 1314-1318 (2005).
- Hickman, S., Izzy, S., Sen, P., Morsett, L., Khoury, J. E. Microglia in neurodegeneration. Nature Neuroscience. 21 (10), 1359(2018).
- Tay, T. L., Savage, J. C., Hui, C. W., Bisht, K., Tremblay, M. È Microglia across the lifespan: from origin to function in brain development, plasticity and cognition. The Journal of Physiology. 595 (6), 1929-1945 (2017).
- Tremblay, M. È, Lowery, R. L., Majewska, A. K. Microglial Interactions with Synapses Are Modulated by Visual Experience. PLoS Biology. 8 (11), (2010).
- Jakovljevic, M., et al. Induction of NTPDase1/CD39 by Reactive Microglia and Macrophages Is Associated With the Functional State During EAE. Frontiers in Neuroscience. 13, (2019).
- Taylor, A. M. W., et al. Microglia Disrupt Mesolimbic Reward Circuitry in Chronic Pain. The Journal of Neuroscience. 35 (22), 8442-8450 (2015).
- Poliani, P. L., et al. TREM2 sustains microglial expansion during aging and response to demyelination. The Journal of Clinical Investigation. 125 (5), 2161-2170 (2015).
- Lu, S. M., et al. HIV-1 Tat-Induced Microgliosis and Synaptic Damage via Interactions between Peripheral and Central Myeloid Cells. PLoS ONE. 6 (9), e23915(2011).
- Rodríguez, J. J., et al. Increased densities of resting and activated microglia in the dentate gyrus follow senile plaque formation in the CA1 subfield of the hippocampus in the triple transgenic model of Alzheimer's disease. Neuroscience Letters. 552, 129-134 (2013).
- Rasmussen, S., et al. Persistent activation of microglia is associated with neuronal dysfunction of callosal projecting pathways and multiple sclerosis-like lesions in relapsing-remitting experimental autoimmune encephalomyelitis. Brain. 130 (11), 2816-2829 (2007).
- Walker, F. R., et al. Dynamic structural remodelling of microglia in health and disease: a review of the models, the signals and the mechanisms. Brain, Behavior, and Immunity. 37, 1-14 (2014).
- Ohsawa, K., Imai, Y., Kanazawa, H., Sasaki, Y., Kohsaka, S. Involvement of Iba1 in membrane ruffling and phagocytosis of macrophages/microglia. Journal of Cell Science. 113 (17), 3073-3084 (2000).
- Yamasaki, R., et al. Differential roles of microglia and monocytes in the inflamed central nervous system. Journal of Experimental Medicine. 211 (8), 1533-1549 (2014).
- Wohleb, E. S., et al. Peripheral innate immune challenge exaggerated microglia activation, increased the number of inflammatory CNS macrophages, and prolonged social withdrawal in socially defeated mice. Psychoneuroendocrinology. 37 (9), 1491-1505 (2012).
- Shemer, A., et al. Engrafted parenchymal brain macrophages differ from microglia in transcriptome, chromatin landscape and response to challenge. Nature Communications. 9, (2018).
- Geissmann, F., et al. Development of monocytes, macrophages and dendritic cells. Science (New York, N.Y). 327 (5966), 656-661 (2010).
- Minogue, A. M. Role of infiltrating monocytes/macrophages in acute and chronic neuroinflammation: Effects on cognition, learning and affective behaviour. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 79, 15-18 (2017).
- Ginhoux, F., et al. Fate Mapping Analysis Reveals That Adult Microglia Derive from Primitive Macrophages. Science (New York, N.Y). 330 (6005), 841-845 (2010).
- Kierdorf, K., et al. Microglia emerge from erythromyeloid precursors via Pu.1- and Irf8-dependent pathways. Nature Neuroscience. 16 (3), 273-280 (2013).
- Bennett, M. L., et al. New tools for studying microglia in the mouse and human CNS. Proceedings of the National Academy of Sciences of the United States of America. 113 (12), E1738-E1746 (2016).
- Mizutani, M., et al. The fractalkine receptor but not CCR2 is present on microglia from embryonic development throughout adulthood. Journal of Immunology. 188 (1), 29-36 (2012).
Erratum
Formal Correction: Erratum: Immunofluorescence Staining Using IBA1 and TMEM119 for Microglial Density, Morphology and Peripheral Myeloid Cell Infiltration Analysis in Mouse Brain
Posted by JoVE Editors on 10/12/2019. Citeable Link.
An erratum was issued for: Immunofluorescence Staining Using IBA1 and TMEM119 for Microglial Density, Morphology and Peripheral Myeloid Cell Infiltration Analysis in Mouse Brain. An author name was updated.
The name was corrected from:
Maude Bordelau
to:
Maude Bordeleau
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados