Method Article
マウス脳における微小グリア密度、形態および末梢骨髄細胞浸潤解析のためのIBA1およびTMEM119を用いた免疫蛍光染色
Erratum Notice
要約
このプロトコルは、IBA1およびTMEM119の免疫蛍光コシャリンのための段階的なワークフローを記述し、ミクログリア密度、分布、および形態の分析に加えて、ならびにマウス脳組織における末梢骨髄細胞浸潤の分析を説明する。
要約
これは、ミクログリアの二重可視化とマウス脳組織におけるマクロファージへの浸潤のためのプロトコルである。TMEM119(ミクログリアに選択的にラベルを付ける)をIBA1(形態の例外的な可視化を提供する)と組み合わせることで、密度、分布、形態の変化を調査することができます。これらのパラメータを定量化することは、脳の常駐マクロファージであるミクログリアによって引き起こされる役割に関する洞察を提供する上で重要である。正常な生理学的条件下では、ミクログリアはモザイク状のパターンで定期的に分布し、ラミズプロセスを有する小さなソーマを提示する。それにもかかわらず、環境要因(すなわち、外傷、感染、疾患、または傷害)に対する応答として、微小グリア密度、分布、および形態は、侮辱に応じて様々な方法で変化する。さらに、記載された二重染色法は、IBA1の発現に基づいて脳内のマクロファージに浸潤し、TMEM119との共振を伴わずに可視化することを可能にする。このようにこのアプローチは、ミクログリアと浸潤マクロファージとの間の差別を可能にし、健康と疾患の様々な文脈にわたって脳恒常性に対する彼らの明確な関与に対する機能的な洞察を提供するために必要とされる。このプロトコルは、選択的マーカーの同定に関連する神経免疫学の最新の知見を統合する。また、経験豊富な神経免疫学者とプロジェクトに神経免疫学を統合しようとする研究者の両方のための有用なツールとして機能します。
概要
急性か慢性かにかかわらず、神経炎症はミクログリア、脳の常駐マクロファージによって密接に影響される。免疫染色を通じてミクログリアを可視化することは、光顕微鏡を用いた神経炎症の研究に役立つもので、非常にアクセスしやすい技術である。ホメオスタティック条件では、ミクログリアは通常、重なり合わないモザイク状のパターンで分布します。彼らは時々互いに接触する、ラミズされたプロセス1を拡張する小さなソマを示しています。微小グリアの突起プロセスは、正常な生理学的状態の間にニューロン、他のグリア細胞、および血管と相互作用する脳性毛腫を動的に調査する3。ミクログリアは、免疫学的タスクを実行し、脳のミリュー、細胞死、または組織損傷の変化に応答することを可能にする受容体の武器を備えています。加えて、それらは主要な生理学的機能を発揮し、特にシナプス形成、維持、および排除4、5で行う。
ミクログリアの研究に用いられる利用可能なマーカーの中でも、イオン化カルシウム結合アダプター分子1(IBA1)が最も広く用いられているものの1つである。IBA1は、電子顕微鏡6によって確認された微細遠位プロセスを含む微小グリア形態の例外的な可視化を提供するカルシウム結合タンパク質である。このツールは、以前は「活性化」と呼ばれていた微小グリア変換を、動物疾患モデル7、8、9の広大な配列で特徴付けるのに役立ちました。神経炎症の存在下で、微小グリア応答は、細胞密度の増加として定義される微小グリア症、時にはクラスタリング、細胞体の拡大、ならびに肥厚をもたらす分布の変化を含む。より多くのアメボイド形状10、11、12、13に関連するプロセスの短縮。
免疫染色は、特定のマーカーに対する抗体の入手可能性によって制限される。重要なことに、IBA1はミクログリアによって発現されるが、また脳14に浸潤する末梢マクロファージによって発現される。脳内のIBA1陽性細胞の観察は、この研究分野においてミクログリアのマーカーとなっているが、末梢マクロファージ浸潤は様々な条件下で報告されており、健康な脳15、16においてもわずかに 、17、18.したがって、IBA1単独の使用は、ミクログリアの選択的可視化を可能にしません。さらに、マクロファージは、いったん脳に侵入したミクログリアの分子的および形態学的特徴を採用し、したがって分化を妨げる19。これは、ミクログリアと浸潤マクロファージの両方の機能を調査する際の課題を表しています。
ミクログリアおよび末梢マクロファージは異なる起源を有するが(例えば、胚黄嚢および骨髄から、それぞれ20、21)、2つの細胞集団が発揮することを示す所見の数が増加している。脳内の異なる役割19.したがって、侵襲的な操作(すなわち、骨髄キメラまたはパラバイオシス)を伴わずに、密度、分布、形態、および機能を調節することができるこれらの2つの集団を区別する方法を使用することが重要です。TMEM119は、健康および疾患状態22にわたるミクログリア特異的マーカーとして出現した。IBA1と組み合わせると、このマーカーは、TMEM119陰性およびIBA1陽性である浸潤マクロファージからこれらの細胞を区別するのに有用となる。発達的に規制されている間、TMEM119は出生後3(P3)および6(P6)と早くも発現し、P10とP1422の間で成人レベルに達するまで着実に増加する。IBA1は胚の日10.5(E10.5)23と早くも表される。提案された二重標識プロトコルは、したがって、出生後の生活を通じてこれらの2つの集団を研究するのに有用である。
このプロトコルは、ミクログリアと末梢マクロファージ間の判別を可能にする段階的な免疫染色手順を提供する。また、ミクログリア密度、分布、形態の定量的分析や、末梢マクロファージ浸潤の解析を行う方法についても説明します。ミクログリアおよび末梢マクロファージの調査はそれ自体で有用であるが、このプロトコルはさらに神経炎症性ホワイエの局在化を可能にする。したがって、補完的な (まだ、より時間とリソースを消費する) 技術を使用して、調査する特定の領域を識別するプラットフォームとしても機能します。
プロトコル
すべての実験手順は、カナダ動物ケア評議会およびラバル大学動物ケア委員会に従って、制度動物倫理委員会のガイドラインに従って行われました。
1. 免疫染色
- 脳アトラスの助けを借りて、対象領域(ROI)(海馬)を含む3つのマウス脳セクションを選択します。セクションをプラスチック製のマルチウェルプレートに入れ、350 μLのリン酸緩衝生理食塩水(PBS)で覆います(表1)。
注:最適な結果を得るには、脳を4%パラホルムアルデヒドで浸透させ、ビブラートで50μmの厚さに切断する必要があります。24のマルチウェルプレートの場合、各ウェルは最大6つのセクションを保持することができます。各ウェルの推奨量は350μL(最大3つのセクションの場合)と6つのセクションを含む井戸の場合は500°Lです。セクションの数が多い場合は、12 個のマルチウェル プレートを使用することをお勧めします。各井戸の溶液の選択された容積が完全に組織を覆い、セクションが浮遊することを確認してください。推奨ボリュームは、プロトコルの残りの部分で使用されるすべてのソリューションに適用されます。 - サンプルを350°LのPBSで覆って洗浄し、多目的シェーカーの上に多目的シェーカー(RT)を置いて休ませます。5分後にPBSを取り外し、5xを新鮮なPBSに交換します。
メモ:ソリューションを削除するには、転送ピペットをお勧めします。任意の溶液に注ぐときは、組織の完全性を保護するために、井戸の壁にピペットの先端を置くことを確認してください。また、新しいソリューションごとに新しいピペットを使用してください。 - PBSを取り外し、pH = 6.0 (表1)でクエン酸ナトリウムバッファーを350μL加えます。
- パラフィンフィルムでマルチウェルプレートを密封し、70°Cで40分間、予熱した水浴に浮かばせます。
- マルチウェルプレートを約15分間冷却します。
- クエン酸ナトリウム緩衝液を取り出し、ステップ1.2の手順と同様にPBSで切片を洗浄します。
- PBSを取り出し、作りたての350°Lの0.1%NaBH4(表1)を加え、RTで30分間インキュベートします。
- 0.1%NaBH4の溶液を取り除き、ステップ1.2で行ったようにPBSで切片を洗浄します。
- PBSを取り外し、多目的シェーカーの上にRTで1時間ブロッキングバッファ(表1)を追加します。
注: 次の手順で同じソリューションを使用するので、ブロッキング バッファの 2 倍のボリュームを準備してください。 - ブロッキングバッファーを取り外し、一次抗体の混合物を含むブロッキングバッファー(1:150マウスIBA1+ 1:300 TMEM119)によって交換します。プレートをパラフィンフィルムで密封し、4°Cで一晩インキュベートします。
- 翌日、RTで約15分間温かいサンプルを採取する。
- トリトン(PBST)を用いたPBSでセクション5xをそれぞれ5分間洗浄する(表1)。
- PBSTを取り外し、二次抗体の混合物を含むブロッキングバッファを追加し(IBA1の場合は1:300ロバ抗マウスAlexa 488、TMEM119の場合は1:300ヤギ抗ウサギAlexa 568)をRTで1.5時間使用します。
- ブロッキングバッファを取り外し、PBSTを使用した場合を除き、ステップ1.2で行ったようにセクション5xを洗浄します。
- PBSTを取り外し、4′,6-ディアミディノ-2-フェニリンドール(DAPI)[1:20000]をRTで5分間追加します。
- DAPIを取り外し、リン酸緩衝液(PB)でそれぞれ5分間セクション3xを洗浄します。
- 顕微鏡スライドにセクションを取り付けます。光から保護しながら乾燥させます。
- 乾燥したら、取り付け蛍光培地を少し加え、カバースリップで覆い、気泡形成を避けます。
メモ:光から保護された状態で、組織学的なスライドボックス内のスライドを4°Cで保管してください。サンプルは数ヶ月間保存することができる。
2. 密度および分布分析のためのイメージング
- 広視野エピ蛍光顕微鏡の助けを借りて、低倍率とDAPIチャネルを使用してROI(すなわち、海馬のCA1領域)を見つけます。
- DAPI、488、および 568 チャンネルとフィルタを 0.3 μm/ピクセルの解像度で、0.5 の数値開口 (NA) を使用して、20 倍の画像を取得します。ROI を覆うモザイク画像をキャプチャします。または、より大きな画像にステッチされる個々の写真を撮ります。
注: モザイク 画像は、小さな画像で構成されるスーパー イメージです。モザイク画像は、通常、高倍率の視野の限られた領域を克服するために使用されます。一部のソフトウェアにはモザイク機能が含まれています。それにもかかわらず、画像は、個々の画像を1つにステッチすることで、他の写真編集ソフトウェアと一緒に手動でステッチすることもできます。縮尺情報をファイルに追加することを忘れないでください。このタイプの分析では、ROI/動物あたり少なくとも300個のマイクログリア細胞(例えば海馬の約10-15枚に対応)を、実験条件ごとに少なくとも5匹の動物に画像化することをお勧めします。図1A−Cは、コラベル付きミクログリアの画像を示す。 - イメージを TIFF ファイルとして保存します。
3. 形態解析のためのイメージング
- 共焦点または構造化照明顕微鏡を使用して、DAPIチャネルを使用してROIを低倍率で見つけます。
- 40倍の目標(NA 1.4オイル)を使用して、ROI内のIBA1+/TMEM119+セルを見つけます。ライブイメージング中に、Z軸で移動します。ランダムに選択されたミクログリアの信号が消えるとすぐに、このZレベルをZスタックの先頭として設定します。ミクログリアの信号が消えるまでZ軸に沿って反対方向に移動し、その点をZスタックの終点として設定します。
メモ:図2A-CはIBA1+/TMEM119+ミクログリアの画像を示しています。 - 0.33 μm Z 間隔と 0.15 μm/ピクセルのピクセル サイズを使用して、3 つのチャネルすべて (DAPI、488、568) で Z スタックを作成します。スケール情報をファイルに追加します。
注:推奨されるZ間隔は、目的の解決力に依存します(例えば、NA 1.4オイルなどの40倍の目的の場合、0.33μmです)。形態学的分析では、実験条件ごとに少なくとも5匹の動物を持つ動物1匹につき少なくとも20個の細胞を持つことをお勧めします。 - ファイルを TIFF ファイルとして保存します。
4. 密度と分布の分析
- 最も近い近距離(NND)プラグインがインストールされたFIJI/ImageJを開きます。20x イメージを開きます。
注: 検索エンジンを使用して、「ImageJ で最も近傍距離の計算」というキーワードを付け、インストール手順を見つけてください。プラグイン著者はユシオンマオです。 - 画像に刻印されたスケールに基づいてスケールを手動で設定するには、直線ツール(図3E)を選択し、スケールの端にカーソルを置き、Shiftキーを押しながら、画像上のスケールにできるだけ近い線を描きます(図3I)、分析|スケールを設定し、正しい情報を入力します (図 3J)。
注: スケールは、ファイルのメタデータに含まれ、自動的に設定される場合があります。 - 画像を選択 |カラー |コンポジットを作成して、すべてのチャンネルの合成イメージを作成します。
注: イメージの取得中に、FIJI/ImageJ は RGB 形式のコンポジットを自動的に作成します。 - メニュー バーで、[分析|測定値の設定:エリア、重心、および周長を確認します。[リダイレクト先]タブで をクリックし、開いているファイルを選択します (図 3K)。
- 画像に移動 |カラー |チャンネルツールを開きます。
注 : このメニューでは、特定の色を無効にできます。DAPI チャネルは、ROI を識別し、セルを確認するのに役立ちます。カウントを容易にするために非アクティブ化できます。 - フリーハンド選択ツールを使用して ROI の大まかな周長を描画します (図 3D)。
- ツール バーの楕円形ツールをダブルクリックして選択ブラシ ツールを有効にし、[選択ブラシを有効にする]チェック ボックスがオンになっていることを確認します (図 3G)。このツールは、ROI をより正確に説明するために使用されます。200~400 の適切なブラシ サイズを選択します。
- 選択ブラシを使用して、ROI に最適な境界を調整します。キーボードのTキーを押して ROI マネージャに追加します (図 3L)。
- 分析|Mキーを測定または押すと、結果ウィンドウがポップアップ表示されます。結果をコピーしてデータシートに貼り付け、エリアに関する情報(ROIの領域など)を保存します。図 3R)。
- ROIの領域をコピーした後、結果ウィンドウをクリックしてBackspaceキーを押して、結果ウィンドウから情報を消去します。
- ROIマネージャウィンドウ(図3L)に移動し、ROIトレースを右クリックし、イメージの名前と一致するように名前を変更して保存します。
- ツール バーのブラシ ツールをダブルクリックします。黒の色とブラシサイズ 10 を選択します。[オーバーレイのペイント]オプションがオフになっていることを確認します (図 3H)。
- TMEM119チャンネルでは、各TMEM119+ミクログリアのソーマを中央に慎重に黒いドットを配置します。TMEM119に対して陽性でない細胞の中央に白い点を置きます(浸潤マクロファージをマークします)。ROI に含まれるすべてのセルに対して同じ手順を繰り返します。
注: すべてのドット(白黒)が同じチャネルに配置されていることが重要です。チャンネルの ID は、画像ウィンドウのラベルの色を見ることで確認できます (赤、青、または緑)。 - 画像を選択 |カラー |分割チャネル:各チャンネルのウィンドウが表示されます。次に、ドット注釈が付いているチャネルを特定し、他の 2 つのウィンドウを閉じます。
- 新しい分割チャネル イメージをリダイレクトします。分析に移動 |測定値の設定:[リダイレクト先]タブで、分割チャネル イメージをクリックして選択します (図 3K)。
- 画像を選択 |タイプ|8 ビット.画像に移動 |しきい値を調整して選択します (図 3O)。しきい値を調整するには、2 番目のバーのボタンをスライドし、両方のバーの左 (しきい値 = 0) までスライドさせます。
注: 画像には黒い点のみが残り、白く表示されます。 - ROIマネージャウィンドウでROIを選択します。分析|パーティクルの分析(図 3N) 。サイズ (インチ2): 1-20 と入力します。ピクセル単位をオフのままにし、[表示]、[要約してマネージャに追加]の [マネージャに追加] をオンにして、[OK]をクリックします。サマリー ウィンドウがポップアップ表示され、ポイント数が表示されます (図 3P)。情報をコピーしてデータシートに貼り付けます。
- プラグインの選択 |NND.NND ウィンドウがポップアップ表示されます (図 3Q)。すべての情報をコピーしてデータシートに貼り付けます。各数値は、各ミクログリアが最も近いミクログリアまでの距離を表します。
- しきい値ウィンドウに戻り、最初のバーを右端までスライドさせます (両方のバーでしきい値 = 255)。
- 分析|パーティクルを分析します。ポイント数を示すサマリー ウィンドウがポップアップ表示されます (図 3P)。情報をコピーしてデータシートに貼り付けます。
- ROIマネージャにすべてのポイントを選択して右クリックし、イメージの名前で保存します。これにより、zip ファイル内のすべてのポイントを保存できます (図 3L)。ファイルの選択 |として保存し、分析された画像の識別を可能にする名前でファイルを保存します。
- IBA1+/TMEM119+二重陽性細胞の数をROIの面積で割ってミクログリア(画像毎)の密度を求めます。
注:各画像の値は、動物ごとに平均化することができます。その後、データは、すべての動物の平均(SEM)の平均±標準誤差として提示することができる。 - すべてのTMEM119+細胞のNND値の画像あたりの平均を得ることによって、NNDを決定します。
注:データは、すべての動物の平均±SEMとして提示することができます。 - NND2 x 密度という式を使用して間隔インデックスを計算します。
注:データは、すべての動物の平均±SEMとして提示することができます。この測定の単位は任意の単位になります。 - 12μm未満のNNDを有する細胞を同定することにより、微小グリアクラスターを定量化する。
注:ここでは、2つの直接ジャクスタポスミクログリア細胞間のおおよその距離が、アーバタイゼーションで互いに接触するので、12μmが選択されます。この条件を満たすミクログリアが 3 つ以上ある場合は、画像に戻り、これらのセルが 1 つまたは複数のクラスターの一部であるかどうかを確認します。 - クラスタの数を確認したら、データシートにクラスタの数を書き込みます。
注: クラスターの数を ROI 領域で除算して、各動物の細胞/mm2の密度を得ることができます。その後、データをすべての動物の平均±SEMとして提示することができる。 - 末梢骨髄細胞浸潤のパーセンテージを決定するには、各動物の骨髄細胞の総数(TMEM119+/IBA1++TMEM119-/IBA1+)に対するIBA1+/TMEM119-細胞の割合を計算します。
注:データは、すべての動物の平均±SEMとして提示することができます。
5. 形態解析
- フィジー/イメージJを開きます。
- イメージ J または FIJI を使用して 40x イメージを開きます。[選択] 画像をスタックで開くかどうかを確認するポップアップ ウィンドウが表示されます。[OK] をクリックします。次に、[画像 |スタック |Z プロジェクトを使用して、Z 投影ウィンドウを開きます。最初のスライスから最後のスライスまで、すべてのスライスを含めます。[投影タイプ]で[最大強度]が選択されていることを確認し、[OK]をクリックします。
- Z プロジェクトで新しいウィンドウをクリックします。画像を選択 |色|チャネルの分割:IBA1チャネルの画像にトレースを行います。
注:他のチャネル(TMEM119およびDAPI)は、マイクログリア形態解析中に必要に応じて開いたままにしておくことができます。 - メニュー バーで、[分析|測定値の設定:[エリア]、[図心]、および [周長]を確認します。[リダイレクト先]タブで、開いているファイルを選択します (図 3K)。
- 手順 4.2 の説明に従ってスケールを設定します。
- IBA1 チャネルのソーマ サイズを測定するには、フリーハンド選択ツールを使用してソーマの大まかな周囲を描画します (図 3D)。
- 選択ブラシ ツールを有効にするには、ツール バーの楕円形ツールをダブルクリックし、[選択ブラシ ボックスを有効にする]チェック ボックス (図 3G)をオンにします。選択ブラシのサイズを 10~20 の間で選択します(図 3B)。
- 選択ブラシを使用して、ソーマに最も合うようにトレースを調整します。拡大すると、この手順の精度が有効になります (図 2I)。
- Tキーを押して、ソマ トレースを ROI マネージャに追加します (図 3L)。
- 分析|Mキーを測定するか、押します。結果ウィンドウがポップアップ表示されます。結果をコピーしてデータシートに貼り付けます (図 3R)。
- ソーマ領域に関する情報を保存するには、ROIマネージャウィンドウに移動し、ROIを右クリックし、イメージの名前と一致するように名前を変更し、トレースがソーマ用であることを指定してから、ファイルを保存します。
- IBA1 チャネルの樹木化領域を測定するには、ポリゴン選択ツールを使用してマイクログリアプロセスの四分値をクリックすると、ポリゴン形状が開始されます(図 3C)。
- ミクログリアプロセスのヒントに従って、各工程の端点の先端をクリックしてミクログリアを回り、ミクログリアの耕作でカバーされる領域を最もよく表すポリゴンを形成します(図2D−H)。
注: ポリゴンがすべてのマイクログリアプロセスの四肢を接続していることを確認します。ポリゴンを形成するラインは、決して交差してはいけません。ミクログリアプロセスの先端をクリックする場合は、プロセスの任意の部分を切断しないように注意してください。プロセスを回避するために追加のポイントを追加すると便利な場合があります。ポリゴンを形成するポイントの数は遠位プロセスの数に直接リンクされないため、スタディには関係ありません。 - ポリゴンを閉じるには、ポリゴンの始点をクリックします。
- Tキーを押して、ROI マネージャにトレースを追加します (図 3L)。分析|Mキーを測定するか、押します。結果ウィンドウがポップアップ表示されます。結果をコピーしてデータシートに貼り付けます (図 3R)。
- 監視領域に関する情報を保存するには、ROI マネージャ ウィンドウに移動し、ROI を右クリックして、イメージの名前に一致するように名前を変更し、監視を指定してから、ファイルを保存します。
- 各動物のすべてのソーマ領域を平均化してソーマ領域を決定します。
注:データは、すべての動物の平均±SEMとして提示することができます。 - 各動物のすべての耕用領域を平均化することにより、樹木化領域を決定します。
注:データは、すべての動物の平均±SEMとして提示することができます。 - 各ミクログリア細胞の式ソーマ面積/樹木化面積と動物1匹あたりの平均を使用して、形態指数を計算します。
注:データは、すべての動物の平均±SEMとして提示することができます。
結果
図1は、蛍光顕微鏡により20x画像化された後方海馬の冠状部におけるIBA1およびTMEM119を用いたミクログリアの共標識を示す。染色が成功すると、微小グリア細胞体とその微細なプロセスが明らかになります(図1A-C)。この染色により、ミクログリア密度の測定とミクログリアクラスターの分布と同定(図1I)とマクロファージへの浸潤が可能である(図1F)。
図 2は、ミクログリアのアボリゼーション トレース手順 (図 2D-H)のステップワイズ例における IBA1+/TMEM119+ ミクログリア ( 図2A-C) と、セル本体トレースの例 (図 2 I)を示しています。)、共焦点顕微鏡により40倍に画像化した。

図1:密度、分布、クラスタリング、および末梢骨髄細胞浸潤分析のためのマウス脳組織のIBA1およびTMEM119二重染色。(A-C)C57BL/6成人マウスの海馬における典型的な微小グリア分布。(D-F)ミクログリアは、IBA1+/TMEM119+および男性マウスの扁桃体中のIBA1+/TMEM119(白矢印)として同定された浸潤マクロファージと同定した。(G-I)マウスの海馬における2ミクログリア(白い正方形)のクラスター。この図の大きなバージョンを表示するには、ここをクリックしてください。
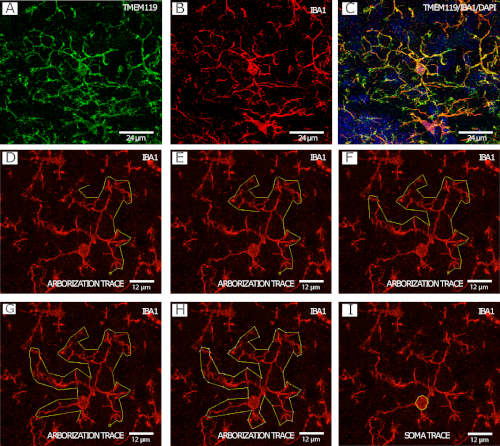
図2:微小グリア形態解析のためのIBA1およびTMEM119染色。(A-C)ミクログリア。(D-I)FIJI/ImageJ のポリゴン ツールを使用した IBA1 チャネルによるアボレイゼーション トレースのステップバイステップの例。(J) FIJI/ImageJのフリーハンド選択ツールを用いたIBA1チャネルを用いたミクログリアソマトレースの例。この図の大きなバージョンを表示するには、ここをクリックしてください。

図3:微小グリア密度、分布、クラスタリング、形態、および末梢骨髄細胞浸潤解析のためのFIJI/ImageJインタフェースおよびツール(A-R)密度、クラスター、および形態解析に使用されるすべてのツール、メニュー、およびウィンドウのコンパイル。この図の大きなバージョンを表示するには、ここをクリックしてください。
| ソリューション | 準備 |
| ブロッキング バッファ | 0.5% ゼラチン + 5% 天然ヤギ血清 + 5% 天然ロバ血清 + 0.01% トリトン X-100 in TBS [0.05 M] |
| クエン酸バッファー | 1.92 g のクエン酸 [10 mM]、 500 μL の Tween 20 [0.05% (v/v)]、700 mL の超純水、pH = 6.0 を NaOH [10 N]で調整し、超純水で 1 L まで満タンにします。 |
| ナBH4 | [0.01% w/w]超純水の10mL中のNaBH4の0.01gを溶解し、溶液を十分に混合すべきである。このソリューションは、バブルを作成します。混合後にキャップを開けて圧力を解放する |
| Pb | [100 mM]Na 2 HPO 4 および 4.8 g のNaH2PO4 ·超純水の1L中のH2O、次いで2Lまで充填し、pH =7.4を調整 |
| Pbs | [50 mM]Na2HPO4の解き分け 5.87 g, NaH2PO4の 1.2 g ·超純水500mLでNaClのH2O、9gのNaCl、超純水で最大1Lを充填し、pH=7.4を調整 |
| PBST | PBS + 0.01% トリトン X-100 |
| Tbs | 希薄トリス HCl [0.5 M] 超純水 1:10 [0.05 M]、トリス HCl の 1 L を取り、NaCl の 8.75 g を追加します。 |
| トリス・HCl | [0.5 M] 超純水の950 mL、78.8 gのトリス緩衝塩酸塩(C4H11NO3Cl)を加え、pH =8を調整し、最大1Lを充填する |
表1:免疫染色に用いる溶液。
ディスカッション
このプロトコルは、染色と分析の品質という2つの重要な部分に分けることができます。染色が最適でない場合、マイクログリア細胞を適切に表現できず、密度、分布、および形態測定に影響を与えます。また、浸潤末末性骨髄細胞の割合は過小評価され得る。これは染色プロトコルの最適化されたバージョンですが、最適でない画像につながる可能性のあるいくつかの要因があります。動物の灌流がこのプロトコルに含まれていないとしても、脳の固定が十分に実行されない場合、染色の品質が損なわれます。さらに、研究を妨げる可能性のある血管内のマクロファージの欠如を確保するために十分な灌流が必要である。
免疫染色に関しては、最も重要な詳細は、バッファーの品質、ブロッキングステップ、抗体の適切な貯蔵、および脳サンプル処理を含む。バッファーとその貯蔵の適切な調製は、染色の品質に直接影響を与えます。指定しない限り、一部のバッファーは長期間保存できますが、汚染の兆候を示すバッファーの使用は避ける必要があります。バッファーが数日前または数週間前に準備されている場合は、使用前のすべてのソリューションの pH を検証する必要があります。
さらに、免疫染色に関しては、バックグラウンド染色の存在は、最も一般的な問題の1つである。背景染色はミクログリア、特にその形態を分析することが困難になり、結果に偏ります。バックグラウンドを防ぐには、ブロッキングステップが正しく行われていることが重要です。抗体の貯蔵条件はまた、その有効性に直接的な影響を及ぼす。会社が提供する保管ガイドラインに厳密に従い、頻繁な解凍サイクルを避けることをお勧めします。最後に、全体のプロセスの間に、脳のセクションの物理的完全性に注意を払することが重要です。特に実験者がこの手順を経験していない場合は、各操作 (バッファーの変更、ワッシュ、および取り付け) の間に注意を払う必要があります。溶液またはバッファーを変更する際に液体溶液なしでサンプルを残さないようにすることをお勧めします, その後のステップのためのソリューションは、事前に井戸に注ぐ準備ができている必要があります.マルチウェルプレートは、サンプルを乾燥させる可能性のある蒸発を避けるために、一晩のステップ中にパラフィンフィルムで正しく密封する必要があります。
微小グリア密度、分布、および形態の定量的分析には、定性的なレポートよりもいくつかの利点があります。バイアスを防ぐために、分析を行う研究者は実験条件に目を見えない必要があります。したがって、異なるユーザーに分析を実行させ、ファイルの名前を変更することをお提案します (キー シートに元の名前と新しい名前を保持したまま)。新しい名前は、実験条件のヒントを持つべきではありません。分析全体は、これらのブラインドファイルに対して行うことができ、元の画像 ID は、データのコンパイル後、統計分析の前にのみ明らかにされます。盲目はすでに経験豊富な研究者によって実践されていますが、この種の分析を初めて行う人にとっては貴重なアドバイスです。
脳領域の制御は、脳セクションの選択と分析中のROIのトレース中に行われます。動物全体でブレグマレベルの同じ範囲からのセクションを使用することを確認してください。密度解析、分布解析、および形態解析には、同じ ROI を使用する必要があります。密度解析と分布解析では、FIJI/Image J で ROI を描画する際に正確であることが特に重要です。脳アトラスの使用は、セクション選択とROIトレースの両方に強くお勧めします。DAPI の使用はまた神経解剖学的ランドマークの同定を促進する。分散を避けるために、ROIに部分的にしか配置されていないミクログリアは、マイクロ環境によって異なる可能性があるため、拒否することをお勧めします。密度解析のためにミクログリアをマーキングする場合、DAPIチャネルを選択基準として使用できます。DAPI染色核を含むミクログリアのみをカウントすることにより、考慮されるミクログリアはすべて同じ平面にあり、選択時の個人的なバイアスを低減します。
NND、間隔指数、およびクラスター分析の測定値は、個々のセルを示すドットの位置に基づいているため、距離は FIJI/ImageJ によって計算されるため、これらのドットを配置する際には一貫性を保つ必要があります。視覚的に決定されるセル本体の中央にドットを厳密に配置してください。さらに、ドットのサイズは、解析全体を通じて一貫した状態を維持する必要があります。これは、微小グリア集団の空間分布のより良い表現に貢献します。クラスター分析では、以前の解析に基づいて距離しきい値として 12 μm が選択されました。それにもかかわらず、12μm未満のNNDを持つ4つ以上の異なるセルがある場合、これらの細胞はすべて単一のクラスターの一部を取るか、2つの細胞の2つのクラスタを表す可能性があります。これにより、イメージに戻り、実際のクラスター数を確認する必要が見られました。
脳アトラスを用いた神経解剖学的特徴によってROIが決定される密度と分布とは異なり、形態解析のためのマイクログリア細胞の選択は、細胞を分析する能力に基づいている。選択バイアスを防ぐために、別の Z スタックに移動する前に、解析可能なすべてのセルを Z スタック内の解析用に選択する必要があります。細胞を除外する理由は、免疫染色または組織切断、処理(例えば、裂傷)、または取り付け(例えば、気泡形成)に関する問題を含む。理想的には、このような問題を持つ脳のセクションは、イメージングと分析から体系的に除外する必要があります。また、TMEM119とIBA1の染色では100%の重なりが見られないことにも注意することが重要です(図2A-C)。TMEM119 ではプロセスの連続性 (および IBA1) の視覚化ができないため、あるセルがどこで終わり、別のセルがどこから始まるかを評価することが困難になります。したがって、形態解析はIBA1チャネルを用いて行われる。さらに、すべてのトレースとドットを保存して、将来の改訂のために視覚化し、結果の透明性と再現性を高める必要があります。
このプロトコルは、ミクログリアおよび浸潤マクロファージに関する貴重な情報を提供する。そのアプリケーションの例は、異なる脳領域におけるミクログリアの変化を介して神経炎症の徴候を検出する、化合物の抗炎症効果を研究し、ミクログリアの適切な機能を妨害する因子を研究する。このプロトコルは、脳内のマクロファージの浸潤検出とミクログリアからのこれらの細胞の分化を可能にすることを考慮すると、追加のアプリケーションが含まれます:マクロファージの募集が特定の侮辱または他の技術(すなわち、遺伝的ツール)の使用、および侮辱中の脳内の末梢マクロファージの不在の結果を確認し、研究する。蛍光顕微鏡は、脳性腫瘍の内部浸潤を確認するのに十分ではないことに留意してください。IBA1+/TMEM119-細胞が心室または血管周辺空間の近くで観察される場合、電子顕微鏡などのより高い空間分解能技術が、陰腔内での局在を確認する必要があります。密度、分布、および形態の変化は、ミクログリアおよびマクロファージの役割の良い指標ですが、このアプローチは、機能的な調査と組み合わせると最も強力です。
開示事項
著者たちは何も開示する必要はない。
謝辞
ナタリー・ヴェルヌーの指導と実験への支援に感謝しています。また、エマニュエル・プラネル博士とセルジュ・リヴェスト博士の蛍光顕微鏡と共焦点顕微鏡の使用に感謝申し上げたい。この作品の一部は、メキシコ科学技術評議会(CONACYT;to F.G.I)、フォンダシオン・ファミーユ・チョケット、センター・テマティック・ド・レッシェルシュ・エン・ニューロサイエンス(CTRN;to K.P.)、フォン・ド・レッシェルシュ・デュ・ケベック-サンテ(M.B.)の奨学金によって資金提供されました。シャストリ・インド・カナダ研究所(K.B.へ)のほか、カナダ自然科学・工学研究評議会(NSERC)からM.E.T.M.E.T.へのディスカバリー・グラントは、カナダの健康と治療における神経可塑性の研究委員長(Tier II)を保有しています。
資料
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 488 donkey anti-mouse | Invitrogen/Thermofisher | A21202 | |
| Alexa Fluor 568 goat anti-rabbit | Invitrogen/Thermofisher | A11011 | |
| Biolite 24 Well multidish | Thermo Fisher | 930186 | |
| Bovine serum albumin | EMD Millipore Corporation | 2930 | |
| Citric acid | Sigma-Aldrich | C0759-500G | |
| DAPI Nuceleic acid stain | Invitrogen/Thermofisher | MP 01306 | |
| Fine Brush | Art store | ||
| Fluoromount-G | Southern Biotech | 0100-01 | |
| Gelatin from coldwater fish skin | Sigma-Aldrich | G7765 | |
| Microscope coverglass | Fisher Scientific | 1254418 | |
| Microslides positively charged | VWR | 48311-703 | |
| Monoclonal mouse Anti-IBA1 | Millipore | MABN92 | |
| Na2H2PO4·H2O | BioShop Canada Inc. | SPM306, SPM400 | |
| Na2HPO4 | BioShop Canada Inc. | SPD307, SPD600 | |
| NaBH4 | Sigma-Aldrich | 480886 | |
| NaCl | Fisher Scientific | S642500 | |
| Normal donkey serum (NDS) | Jackson ImmunoResearch laboratories Inc. | 017-000-121 | |
| Normal goat serum (NGS) | Jackson ImmunoResearch laboratories Inc. | 005-000-121 | |
| Parafilm-M | Parafilm | PM-999 | |
| Rabbit monoclonal Anti-TMEM119 | Abcam | ab209064 | |
| Reciprocal Shaking bath model 25 | Precision Scientific | - | |
| Transfer pipette | |||
| Tris buffer hydrochloride | BioShop Canada Inc. | TRS002/TRS004 | |
| Triton-X-100 | Sigma-Aldrich | T8787 | |
| Tween 20 | Sigma-Aldrich | P7949-100ML |
参考文献
- Lawson, L. J., Perry, V. H., Dri, P., Gordon, S. Heterogeneity in the distribution and morphology of microglia in the normal adult mouse brain. Neuroscience. 39 (1), 151-170 (1990).
- Milior, G., et al. Fractalkine receptor deficiency impairs microglial and neuronal responsiveness to chronic stress. Brain, Behavior, and Immunity. 55, 114-125 (2016).
- Nimmerjahn, A., Kirchhoff, F., Helmchen, F. Resting Microglial Cells Are Highly Dynamic Surveillants of Brain Parenchyma in Vivo. Science. 308 (5726), 1314-1318 (2005).
- Hickman, S., Izzy, S., Sen, P., Morsett, L., Khoury, J. E. Microglia in neurodegeneration. Nature Neuroscience. 21 (10), 1359(2018).
- Tay, T. L., Savage, J. C., Hui, C. W., Bisht, K., Tremblay, M. È Microglia across the lifespan: from origin to function in brain development, plasticity and cognition. The Journal of Physiology. 595 (6), 1929-1945 (2017).
- Tremblay, M. È, Lowery, R. L., Majewska, A. K. Microglial Interactions with Synapses Are Modulated by Visual Experience. PLoS Biology. 8 (11), (2010).
- Jakovljevic, M., et al. Induction of NTPDase1/CD39 by Reactive Microglia and Macrophages Is Associated With the Functional State During EAE. Frontiers in Neuroscience. 13, (2019).
- Taylor, A. M. W., et al. Microglia Disrupt Mesolimbic Reward Circuitry in Chronic Pain. The Journal of Neuroscience. 35 (22), 8442-8450 (2015).
- Poliani, P. L., et al. TREM2 sustains microglial expansion during aging and response to demyelination. The Journal of Clinical Investigation. 125 (5), 2161-2170 (2015).
- Lu, S. M., et al. HIV-1 Tat-Induced Microgliosis and Synaptic Damage via Interactions between Peripheral and Central Myeloid Cells. PLoS ONE. 6 (9), e23915(2011).
- Rodríguez, J. J., et al. Increased densities of resting and activated microglia in the dentate gyrus follow senile plaque formation in the CA1 subfield of the hippocampus in the triple transgenic model of Alzheimer's disease. Neuroscience Letters. 552, 129-134 (2013).
- Rasmussen, S., et al. Persistent activation of microglia is associated with neuronal dysfunction of callosal projecting pathways and multiple sclerosis-like lesions in relapsing-remitting experimental autoimmune encephalomyelitis. Brain. 130 (11), 2816-2829 (2007).
- Walker, F. R., et al. Dynamic structural remodelling of microglia in health and disease: a review of the models, the signals and the mechanisms. Brain, Behavior, and Immunity. 37, 1-14 (2014).
- Ohsawa, K., Imai, Y., Kanazawa, H., Sasaki, Y., Kohsaka, S. Involvement of Iba1 in membrane ruffling and phagocytosis of macrophages/microglia. Journal of Cell Science. 113 (17), 3073-3084 (2000).
- Yamasaki, R., et al. Differential roles of microglia and monocytes in the inflamed central nervous system. Journal of Experimental Medicine. 211 (8), 1533-1549 (2014).
- Wohleb, E. S., et al. Peripheral innate immune challenge exaggerated microglia activation, increased the number of inflammatory CNS macrophages, and prolonged social withdrawal in socially defeated mice. Psychoneuroendocrinology. 37 (9), 1491-1505 (2012).
- Shemer, A., et al. Engrafted parenchymal brain macrophages differ from microglia in transcriptome, chromatin landscape and response to challenge. Nature Communications. 9, (2018).
- Geissmann, F., et al. Development of monocytes, macrophages and dendritic cells. Science (New York, N.Y). 327 (5966), 656-661 (2010).
- Minogue, A. M. Role of infiltrating monocytes/macrophages in acute and chronic neuroinflammation: Effects on cognition, learning and affective behaviour. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 79, 15-18 (2017).
- Ginhoux, F., et al. Fate Mapping Analysis Reveals That Adult Microglia Derive from Primitive Macrophages. Science (New York, N.Y). 330 (6005), 841-845 (2010).
- Kierdorf, K., et al. Microglia emerge from erythromyeloid precursors via Pu.1- and Irf8-dependent pathways. Nature Neuroscience. 16 (3), 273-280 (2013).
- Bennett, M. L., et al. New tools for studying microglia in the mouse and human CNS. Proceedings of the National Academy of Sciences of the United States of America. 113 (12), E1738-E1746 (2016).
- Mizutani, M., et al. The fractalkine receptor but not CCR2 is present on microglia from embryonic development throughout adulthood. Journal of Immunology. 188 (1), 29-36 (2012).
Erratum
Formal Correction: Erratum: Immunofluorescence Staining Using IBA1 and TMEM119 for Microglial Density, Morphology and Peripheral Myeloid Cell Infiltration Analysis in Mouse Brain
Posted by JoVE Editors on 10/12/2019. Citeable Link.
An erratum was issued for: Immunofluorescence Staining Using IBA1 and TMEM119 for Microglial Density, Morphology and Peripheral Myeloid Cell Infiltration Analysis in Mouse Brain. An author name was updated.
The name was corrected from:
Maude Bordelau
to:
Maude Bordeleau
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved