Method Article
Immunofluorescenza Colorazione utilizzando IBA1 e TMEM119 per densità microgliale, morfologia e infiltrazione delle cellule mieloidi periferiche nel cervello del mouse
In questo articolo
Erratum Notice
Riepilogo
Questo protocollo descrive un flusso di lavoro passo-passo per la costaintura immunofluorescente di IBA1 e TMEM119, oltre all'analisi della densità microgliale, della distribuzione e della morfologia, nonché dell'infiltrazione delle cellule mieloidi periferiche nel tessuto cerebrale del topo.
Abstract
Questo è un protocollo per la doppia visualizzazione della microglia e l'infiltrazione di macrofagi nel tessuto cerebrale del topo. TMEM119 (che etichetta la microglia in modo selettivo), se combinato con IBA1 (che fornisce un'eccezionale visualizzazione della loro morfologia), consente di sforare i cambiamenti nella densità, nella distribuzione e nella morfologia. Quantificare questi parametri è importante per fornire informazioni sui ruoli esercitati dalla microglia, i macrofagi residenti del cervello. In condizioni fisiologiche normali, le microglie sono regolarmente distribuite in un modello a mosaico e presentano un piccolo soma con processi ramificati. Tuttavia, come risposta a fattori ambientali (ad esempio, traumi, infezioni, malattie o lesioni), la densità microgliale, la distribuzione e la morfologia vengono alterate in vari modi, a seconda dell'insulto. Inoltre, il metodo di doppia colorazione descritto consente la visualizzazione di macrofagi infiltrati nel cervello in base alla loro espressione di IBA1 e senza colocalizzazione con TMEM119. Questo approccio consente quindi la discriminazione tra microglia e infiltrazione di macrofagi, che è necessaria per fornire informazioni funzionali sul loro distinto coinvolgimento nell'omeostasi cerebrale in vari contesti di salute e malattia. Questo protocollo integra le ultime scoperte in neuroimmunologia relative all'identificazione di marcatori selettivi. Serve anche come strumento utile sia per i neuroimmunologi esperti che per i ricercatori che cercano di integrare la neuroimmunologia nei progetti.
Introduzione
Che sia acuta o cronica, la neuroinfiammazione è strettamente influenzata dalla microglia, i macrofagi residenti del cervello. La visualizzazione della microglia attraverso l'immunostaining è preziosa per lo studio della neuroinfiammazione con l'uso della microscopia leggera, una tecnica altamente accessibile. In condizioni omeostatiche, la microglia è tipicamente distribuita in un modello non sovrapponi, simile a un mosaico. Essi esibiscono piccoli somas che estendono processi ramificati1, che a volte si contattanol'unl'altro 2 . I processi microgliali ramificati esaminano dinamicamente il parenchyma cerebrale, interagendo con neuroni, altre cellule gliali e vasi sanguigni durante le normali condizioni fisiologiche3. Le microglia sono dotate di un arsenale di recettori che consentono loro di eseguire compiti immunologici e rispondere ai cambiamenti nell'ambiente cerebrale, alla morte cellulare o ai danni ai tessuti. Inoltre, esercitano funzioni fisiologiche chiave, in particolare nella formazione sinaptica, manutenzione, ed eliminazione4,5.
Tra i marcatori disponibili utilizzati per studiare la microglia, l'adattatore legante di calcio ionizzato molecola 1 (IBA1) è uno dei più utilizzati. IBA1 è una proteina legante di calcio che fornisce una visualizzazione eccezionale della morfologia microgliale, compresi i processi distale fini, come confermato dalla microscopia elettronica6. Questo strumento è stato determinante nella caratterizzazione della trasformazione microgliale, precedentemente chiamata "attivazione", in una vasta gamma di modelli di malattie animali7,8,9. In presenza di neuroinfiammazione, la risposta microgliale comprende: microgliosi che è definita come un aumento della densità cellulare, cambiamenti nella distribuzione che a volte si traducono in clustering, allargamento del corpo cellulare, così come ispessimento e ispessimento e accorciamento dei processi associati a più forme ameboide10,11,12,13.
L'immunostaining è limitato dalla disponibilità di anticorpi diretti contro marcatori specifici. È importante sottolineare che IBA1 è espresso dalla microglia ma anche dai macrofagi periferici che si infiltrano nel cervello14. Mentre l'osservazione delle cellule iBA1 positive all'interno del cervello è diventata un marcatore di microglia in questo campo di ricerca, l'infiltrazione di macrofagi periferici è stata segnalata in varie condizioni, anche marginalmente nel cervello sano15,16 ,17,18. Di conseguenza, l'uso di IBA1 da solo non consente la visualizzazione selettiva della microglia. Inoltre, i macrofagi adottano caratteristiche molecolari e morfologiche della microglia residente una volta che si sono infiltrati nel cervello, ostacolando così la differenziazione19. Questo rappresenta una sfida quando si studia la funzione della microglia e dell'infiltrazione dei macrofagi.
Mentre le microglia e i macrofagi periferici hanno origini distinte (ad esempio, dal sacco del tuorlo embrionale e dal midollo osseo, rispettivamente20,21), vi è un numero crescente di rilievi che indicano che le due popolazioni di cellule esercitano diversi ruoli nel cervello19. È quindi fondamentale utilizzare metodi che discriminano tra queste due popolazioni senza manipolazioni invasive (cioè chimere di midollo osseo o parabiosi) che possono modularne la densità, la distribuzione, la morfologia e la funzione. Il TMEM119 è emerso come un marcatore specifico della microglia in tutte le condizioni di salute e malattia22. In combinazione con IBA1, questo marcatore diventa utile per differenziare queste cellule dall'infiltrazione di macrofagi, che sono TMEM119-negativi e IBA1-positivi. Mentre è regolamentato dal punto di vista dello sviluppo, TMEM119 è espresso già nei giorni postnatali 3 (P3) e 6 (P6), in costante aumento fino a raggiungere i livelli degli adulti tra P10 e P1422. IBA1 è espresso già come giorno embrionale 10.5 (E10.5)23. Il protocollo di doppia etichettatura proposto è quindi utile per studiare queste due popolazioni per tutta la vita postnatale.
Questo protocollo fornisce una procedura di immunostaining passo-passo che consente la discriminazione tra microglia e macrofagi periferici. Spiega anche come condurre un'analisi quantitativa della densità microgliale, della distribuzione e della morfologia, nonché un'analisi dell'infiltrazione dei macrofaghi periferici. Mentre lo studio di microglia e macrofagi periferici è utile da solo, questo protocollo consente ulteriormente la localizzazione di foyer neuroinfiammatori; quindi, serve anche come piattaforma per identificare aree specifiche da studiare, con l'uso di tecniche complementari (ancora, più dispendiose in termini di tempo e risorse).
Protocollo
Tutte le procedure sperimentali sono state eseguite in accordo con le linee guida dei comitati istituzionali etici degli animali, in conformità con il Canadian Council on Animal Care e l'Animal Care Committee dell'Università Laval.
1. Immunostaining
- Selezionare tre sezioni del cervello del mouse contenenti la regione di interesse (ROI) (cioè l'ippocampo) con l'aiuto di un atlante cerebrale. Collocare le sezioni in una piastra multi-pozza di plastica e coprirle con 350 - L di salina tampone di fosfato (PBS) (Tabella 1).
NOTA: Per ottenere risultati ottimali, i cervelli devono essere perfusi con il 4% di paraformaldeide e tagliati ad uno spessore di 50 m con un vibratome. Per una piastra multi-bene 24, ogni pozzo può contenere fino a sei sezioni. Il volume di soluzione consigliato per ogni pozzetto è di 350 gradi (per un massimo di tre sezioni) e di 500 l per pozzi contenenti sei sezioni. Per un numero maggiore di sezioni, si consiglia di utilizzare una piastra multi-bene 12. Assicurarsi che il volume selezionato della soluzione per ogni pozzo copra completamente il tessuto e permetta alle sezioni di galleggiare. I volumi consigliati si applicano a ogni soluzione utilizzata nel resto del protocollo. - Lavare i campioni coprendoli con 350 gradi di PBS e lasciarli riposare posizionando la piastra multi-po m sopra uno shaker multiuso a temperatura ambiente (RT). Rimuovere il PBS dopo 5 min e sostituirlo 5x con PBS fresco.
NOTA: Per rimuovere le soluzioni, si consiglia una pipetta di trasferimento. Quando si versa in qualsiasi soluzione, assicurarsi di posizionare la punta della pipetta contro la parete del pozzo per proteggere l'integrità dei tessuti. Assicurarsi inoltre di utilizzare una nuova pipetta per ogni nuova soluzione. - Rimuovere PBS e aggiungere 350 L di 10 mM di tampone di citrato di sodio con pH - 6,0 (tabella 1).
- Sigillare la piastra multi-bene con pellicola di paraffina e lasciarla galleggiare su un bagno d'acqua precedentemente preriscaldato per 40 min a 70 gradi centigradi.
- Lasciare raffreddare la piastra multi-bene per circa 15 min.
- Rimuovere il tampone di citrato di sodio e lavare le sezioni in PBS come fatto nel passaggio 1.2.
- Togliere PBS e aggiungere 350 l di NaBH4 (Tabella 1) appena fatto e lasciare incubare per 30 min a RT.
- Rimuovere la soluzione dello 0,1% NaBH4 e lavare le sezioni in PBS come completato nel passaggio 1.2.
- Rimuovere PBS e aggiungere il buffer di blocco (Tabella 1) per 1 h a RT sopra uno shaker multiuso.
NOTA: assicurarsi di preparare volumi doppi di buffer di blocco, poiché la stessa soluzione verrà utilizzata nel passaggio successivo. - Rimuovere il buffer di blocco e sostituirlo bloccando il buffer contenente la miscela di anticorpi primari (1:150 mouse IBA1 - 1:300 TMEM119). Sigillare la piastra con pellicola di paraffina e lasciarla incubare durante la notte a 4 gradi centigradi.
- Il giorno successivo, campioni caldi a RT per circa 15 min.
- Lavare le sezioni 5x per 5 min ciascuna in PBS con triton (PBST) (Tabella 1).
- Rimuovere PBST e aggiungere buffer di blocco contenente la miscela di anticorpi secondari (1:300 askey anti-topo Alexa 488 per IBA1; 1:300 capra anti-coniglio Alexa 568 per TMEM119) per 1,5 h a RT. A partire da questo punto in poi, proteggere i campioni dalla luce.
- Rimuovere il buffer di blocco e lavare le sezioni 5x come fatto nel passaggio 1.2, tranne questa volta con PBST.
- Rimuovere il PBST e aggiungere 4,6-diamidino-2-fenillindole (DAPI) [1:20000] per 5 min a RT.
- Rimuovere DAPI e lavare le sezioni 3x per 5 min ciascuna in tampone fosfato (PB).
- Montare le sezioni su un vetrino al microscopio. Lasciarli asciugare mentre sono protetti dalla luce.
- Una volta essiccato, aggiungere alcune gocce di supporto di fluorescenza di montaggio e coprire con una coverslip, evitando la formazione di bolle.
NOTA: Conservare i vetrini mentre sono protetti dalla luce, all'interno di una scatola di diapositive istologica, a 4 gradi centigradi. I campioni possono essere conservati per diversi mesi.
2. Imaging per analisi della densità e della distribuzione
- Con l'aiuto di un microscopio a epifluorescenza a campo ampio, utilizzare un basso ingrandimento e il canale DAPI per localizzare il ROI (cioè la regione CA1 dell'ippocampo).
- Acquisire le immagini a 20x, utilizzando un'apertura numerica (NA) di 0,5, con i canali e i filtri DAPI, 488 e 568, con una risoluzione di 0,3 m/pixel. Cattura un'immagine a mosaico che copre il ROI. In alternativa, scattare singole foto che verranno cucite in un'immagine più grande.
NOTA: Un'immagine a mosaico è un'immagine super costituita da immagini più piccole. Le immagini mosaiche sono solitamente utilizzate per superare l'area limitata del campo visivo degli alti ingrandimenti. Alcuni software includono una funzione a mosaico; tuttavia, le immagini possono anche essere cucite manualmente insieme ad altri software di fotoritocco cucino le singole immagini in una sola. Ricordarsi di aggiungere le informazioni di scala al file. Per questo tipo di analisi, si raccomanda di avere almeno 300 cellule microgliali fotografate per ROI/animale (corrispondenti a circa 10-15 immagini per l'ippocampo, ad esempio), con un minimo di cinque animali per condizione sperimentale. Figura 1A-C mostra le immagini di microglia colabelled. - Salvare l'immagine come file TIFF.
3. Imaging per l'analisi morfologia
- Utilizzando un microscopio di illuminazione confocale o strutturato, utilizzare il canale DAPI per individuare il ROI a basso ingrandimento.
- Utilizzando un obiettivo 40x (ad esempio, l'olio NA 1.4), individuare una cella IBA1/TMEM119 all'interno del ROI. Durante l'imaging dal vivo, spostare l'asse z. Non appena scompare il segnale della microglia selezionata casualmente, impostare questo livello di z come l'inizio dello stack z. Spostarsi lungo l'asse z nella direzione opposta fino a quando il segnale della microglia scompare e impostare tale punto come la fine della pila a z.
N.B.: La figura 2A-C mostra le immagini della microglia IBA1/TMEM119. - Create uno stack a z in tutti e tre i canali (DAPI, 488, 568) utilizzando una dimensione di 0,33 m e una dimensione in pixel di 0,15 m/pixel. Aggiungere le informazioni di scala al file.
NOTA: L'intervallo di z consigliato dipende dalla potenza di risoluzione dell'obiettivo (ad esempio, per un obiettivo 40x come l'olio NA 1.4, è 0,33 m). Per l'analisi morfologia, si raccomanda di avere almeno 20 cellule per animale con un minimo di cinque animali per condizione sperimentale. - Salvare il file come file TIFF.
4. Analisi della densità e della distribuzione
- Aprire FIJI/ImageJ con il plug-in NND (Nearest Distance) più vicino installato. Aprire l'immagine 20x.
NOTA: utilizzare un motore di ricerca con la parola chiave "Nearest Neighbor Distances Calculation with ImageJ" per trovare le istruzioni di installazione. Il plugin Autore è Yuxiong Mao. - Per impostare la scala manualmente in base a una scala stampata sull'immagine, selezionare lo strumento linea retta(Figura 3E), posizionare il cursore sul bordo della scala e, tenendo premuto il tasto Maiusc, disegnare una linea il più vicino possibile alla scala sull'immagine(Figura 3I/c1 >), selezionare Analizza Impostare la scala, quindi immettere le informazioni corrette (Figura 3J).
NOTA: la scala a volte può essere contenuta nei metadati del file e impostata automaticamente. - Selezionare l'immagine . Proprietà Color (Colore) Crea composito per creare un'immagine composita di tutti i canali.
NOTA: durante l'acquisizione dell'immagine, FIJI/ImageJ crea automaticamente un composito nel formato RGB. - Nella barra dei menu, selezionare Analizza Impostare le misure. Controllare Area, Centroidee Perimetro. Nella scheda Reindirizza a, fare clic e selezionare il file aperto ( Figura3K).
- Vai all'immagine . Proprietà Color (Colore) Strumento Canale per aprire lo strumento canale.
NOTA: questo menu consente di disattivare un colore specifico. Il canale DAPI può essere utile per identificare il ROI e confermare le celle. Può essere disattivato per facilitare il conteggio. - Disegnare un perimetro approssimativo del ROI con lo strumento di selezione a mano libera (Figura 3D).
- Attivate lo strumento pennello di selezione facendo doppio clic sullo strumento ovale sulla barra degli strumenti e verificate che la casella Abilita pennello di selezione sia selezionata ( Figura3G). Questo strumento verrà utilizzato per delineare il ROI in modo più preciso. Selezionare una dimensione del pennello appropriata tra 200 e 400.
- Utilizzando il pennello di selezione, regolare il perimetro per adattarlo al ROI. Premere T sulla tastiera per aggiungere al gestore del ROI (Figura 3L).
- Selezionare Analizza . Misurare o premere il tasto M e verrà visualizzata una finestra dei risultati. Copiare e incollare i risultati in un foglio dati, quindi salvare le informazioni relative all'area (ad esempio, l'area del ROI; Figura 3R).
- Dopo aver copiato l'area del ROI, cancellare le informazioni dalla finestra dei risultati facendo clic su di essa e premendo il tasto BACKSPACE.
- Passare alla finestra gestione ROI(Figura 3L), fare clic con il pulsante destro del mouse sulla traccia del ROI, modificare il nome in modo che corrisponda al nome dell'immagine, quindi salvare.
- Fate doppio clic sullo strumento pennello sulla barra degli strumenti. Selezionare il colore nero e una dimensione del pennello di 10. Assicurarsi che l'opzione Paint of overlay sia deselezionata ( Figura3H).
- Nel canale TMEM119, posizionare con cura un punto nero al centro il soma per ogni microglia TMEM119. Posizionare un punto bianco al centro delle celle che non sono positive per TMEM119 (per contrassegnare l'infiltrazione di macrofagi). Ripetere la stessa procedura per tutte le celle contenute nel ROI.
NOTA: è importante che tutti i punti (bianco e nero) si trovino nello stesso canale. L'identità del canale può essere verificata (rosso, blu o verde) osservando il colore delle etichette della finestra dell'immagine. - Selezionare l'immagine . Proprietà Color (Colore) Canale diviso. Apparirà una finestra per ogni canale. Quindi, identificare il canale con le annotazioni del punto e chiudere le altre due finestre.
- Reindirizza la nuova immagine del canale diviso. Vai a Analizzare Impostare le misure. Nella scheda Reindirizza a, fare clic e selezionare l'immagine del canale diviso ( Figura3K).
- Selezionare l'immagine . Proprietà Type (Tipo) 8 bit. Vai all'immagine . Regolare e selezionare Soglia (Figura 3O). Per regolare la soglia, far scorrere il pulsante della seconda barra, fino a sinistra (valore soglia - 0) in entrambe le barre.
NOTA: Questo lascerà solo i punti neri sull'immagine, che appaiono bianchi. - Selezionare il ROI nella finestra Gestione ROI. Selezionare Analizza . Analizza particella (Figura 3N). On Size (inch n. 2): scrivere 1/20. Mantenere l'unità pixel deselezionata, selezionare Schermo, riepilogare e aggiungere al gestoree premere OK. Verrà visualizzata la finestra di riepilogo che fornirà il numero di punti (Figura 3P). Copiare e incollare le informazioni nel foglio dati.
- Selezionare Plugins NND. Verrà visualizzata la finestra NND (Figura 3Q). Copiare/incollare tutte le informazioni nel foglio dati. Ogni numero rappresenta la distanza di ogni microglia alla microglia vicina più vicina.
- Tornare alla finestra di soglia e far scorrere la prima barra fino a destra (valore di soglia 255 in entrambe le barre), che lascerà visibili tutti i punti bianchi, apparendo bianco (Figura 3M).
- Selezionare Analizza . Analizzare la particella. Verrà visualizzata la finestra di riepilogo che fornisce il numero di punti (Figura 3P). Copiare e incollare le informazioni nel foglio dati.
- Vai a Gestione ROI seleziona tutti i punti, fai clic con il pulsante destro del mouse e salva con il nome dell'immagine. Ciò consentirà il salvataggio di tutti i punti in un file zip (Figura 3L). Selezionare il file Salvare connome e salvare il file con un nome che consenta l'identificazione dell'immagine analizzata.
- Ottenere la densità di microglia (per ogni immagine) dividendo il numero di cellule doppio-positive IBA1/TMEM119 per l'area del ROI.
NOTA: i valori per ogni immagine possono essere calcolati nella media per ogni animale. I dati possono quindi essere presentati come media : errore standard della media (SEM) di tutti gli animali. - Determinare il valore NND ottenendo una media per immagine dei valori NND di tutte le celle TMEM119.
NOTA: I dati possono quindi essere presentati come media : SEM di tutti gli animali. - Calcolare l'indice di spaziatura utilizzando la formula: NND2 x densità.
NOTA: I dati possono quindi essere presentati come media : SEM di tutti gli animali. Le unità per questa misurazione saranno unità arbitrarie. - Quantificai i cluster microgliali identificando le cellule che hanno un NND inferiore a 12 m.
NOTA: Qui è selezionata la 12 m, in quanto è la distanza approssimativa tra due cellule microgliali giustaptali che si toccano direttamente per arborizzazione. Se ci sono più di tre microglia che soddisfano questa condizione, tornare all'immagine e verificare se queste cellule fanno parte di uno o più cluster. - Dopo aver confermato il numero di cluster, scrivere il numero di cluster nel foglio dati.
NOTA: Il numero di cluster può essere diviso per l'area roi per ottenere la densità di cellule / mm2 per ogni animale. I dati possono quindi essere presentati come medi di tutti gli animali. - Per determinare la percentuale di infiltrazione delle cellule mieloidi periferiche, calcolare la percentuale di cellule IBA1/TMEM119- sul numero totale di cellule mieloidi (TMEM119/ IBA1 ) per ogni animale.
NOTA: I dati possono quindi essere presentati come media : SEM di tutti gli animali.
5. Analisi della morfologia
- Aprire FIJI/ImageJ.
- Aprire l'immagine 40x utilizzando l'immagine J o FIJI. Selezionare Apparirà una finestra popup che chiede se le immagini devono essere aperte in una pila. Fare clic su OK. Quindi, selezionare Immagine Proprietà Stacks . : per aprire la finestra di proiezione z. Includere tutte le sezioni, dalla prima all'ultima sezione. Assicurarsi che l'intensità massima sia selezionata in Tipo di proiezionee fare clic su OK
- Fare clic sulla nuova finestra con il progetto . Selezionare l'immagine . Proprietà Colors . Dividere i canali. Condurre le tracce sulle immagini del canale IBA1.
NOTA: Gli altri canali (TMEM119 e DAPI) possono essere tenuti aperti e consultati in base alle esigenze durante l'analisi della morfologia microgliale. - Nella barra dei menu, selezionare Analizza Impostare le misure. Controllare l'Area, Centroide Perimetro. Nella scheda Reindirizza a, selezionare il file aperto ( Figura3K).
- Impostare la scala come descritto nei passaggi 4.2.Set the scale as described in steps 4.2.
- Per misurare la dimensione del soma nel canale IBA1, disegnare un perimetro approssimativo del soma con lo strumento di selezione a mano libera (Figura 3D).
- Attivare lo strumento pennello di selezione facendo doppio clic sullo strumento ovale sulla barra degli strumenti, seguito selezionando Abilita la casella del pennello di selezione ( Figura3G). Selezionare una dimensione del pennello di selezione compresa tra 10 e 20 (Figura 3B).
- Utilizzando il pennello di selezione, regolare la traccia per adattarla al soma. Lo zoom avanti consentirà la precisione durante questo passaggio (Figura 2I).
- Premere il tasto T per aggiungere la traccia soma al gestore del ROI (Figura 3L).
- Selezionare Analizza . Misurare o premere il tasto M. Apparirà una finestra dei risultati. Copiare e incollare i risultati in un foglio dati (Figura 3R).
- Per salvare le informazioni relative all'area soma, vai alla finestra di gestione del ROI, fai clic con il pulsante destro del mouse sul ROI, modifica il nome in modo che corrisponda al nome dell'immagine, specifica che la traccia è per soma, quindi salva il file.
- Per misurare l'area di arborizzazione nel canale IBA1, fare clic su un'estremità del processo microgliale con lo strumento di selezione del poligono, che inizierà la forma del poligono (Figura 3C).
- Seguendo le punte dei processi microgliali, fare il giro della microglia cliccando sulle punte di ogni estremità di processo per formare un poligono che meglio rappresenta l'area coperta dalle arborizzazione microgliali (Figura 2D- H).
NOTA: Assicurarsi che il poligono colleghi tutte le estremità del processo microgliale. Le linee che formano il poligono non dovrebbero mai intersecarsi. Quando si fa clic intorno a una punta di processo microgliale, fare attenzione a evitare di tagliare qualsiasi parte del processo. A volte è utile aggiungere punti extra per aggirare un processo. Il numero di punti che formano il poligono non è direttamente collegato al numero di processi distale e quindi non è rilevante per lo studio. - Per chiudere il poligono, fare clic sul punto iniziale del poligono.
- Premere il tasto T per aggiungere la traccia al gestore del ROI (Figura 3L). Selezionare Analizza . Misurare o premere il tasto M. Apparirà una finestra dei risultati. Copiare e incollare i risultati in un foglio dati (Figura 3R).
- Per salvare le informazioni relative all'area di arborizzazione, vai alla finestra di gestione del ROI, fai clic con il pulsante destro del mouse sul ROI, modifica il nome in modo che corrisponda al nome dell'immagine, specifichi per il ribasso, quindi salva il file.
- Determinare l'area del soma calcolando la media di tutte le aree di soma per ogni animale.
NOTA: I dati possono essere presentati come media : SEM di tutti gli animali. - Determinare l'area di arborizzazione calcolando la media di tutte le aree di arborizzazione per ogni animale.
NOTA: I dati possono essere presentati come media : SEM di tutti gli animali. - Calcolare l'indice di morfologia utilizzando l'area della formula soma / arborizzazione per ogni cellula microgliale e media per animale.
NOTA: I dati possono essere presentati come media : SEM di tutti gli animali.
Risultati
La figura 1 mostra la co-etichettatura della microglia utilizzando IBA1 e TMEM119 in una sezione coronale dell'ippocampo dorsale immagine a 20x dalla microscopia a fluorescenza. Una colorazione di successo rivela i corpi cellulari microgliali e i loro processi fini (Figura 1A-C). Questa colorazione consente la determinazione della densità microgliale e la distribuzione e l'identificazione dei cluster microgliali (Figura 1I) e l'infiltrazione di macrofagi (Figura 1F).
Nella figura 2 è illustrato un esempio graduale dellaprocedura di tracciamento della arborizzazione microgliale(Figura 2D-H),nonché un esempio di tracciamento del corpo cellulare (Figura 2A-C)e un esempio di tracciamento del corpo cellulare(Figura 2I) ), entrambi immagini a 40x da microscopia confocale.

Figura 1: iBA1 e TMEM119 doppia colorazione del tessuto cerebrale del topo per l'analisi di densità, distribuzione, clustering e infiltrazione delle cellule mieloidi periferiche. (A -C) Distribuzione tipica del microglialnelle nell'ippocampo di un topo adulto C57BL/6. (D-F) Microglia identificata come IBA1/TMEM119 e macrofalo infiltrante identificata come IBA1/TMEM119 (freccia bianca) nell'amigdala di un topo maschio. (G-I) Ammasso di due microglia (quadrato bianco) nell'ippocampo di un topo. Fare clic qui per visualizzare una versione più grande di questa figura.
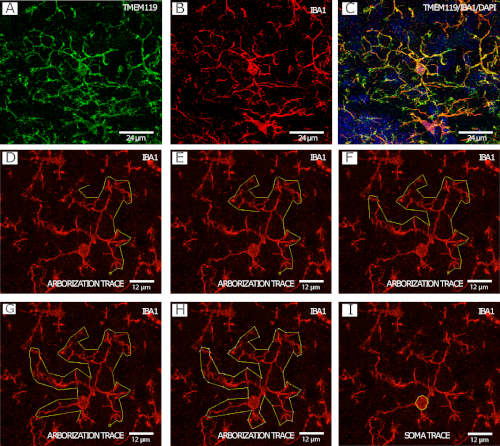
Figura 2: colorazione IBA1 e TMEM119 per l'analisi della morfologia microgliale. (A -C) Microglia. (D-I) Esempio passo-passo di tracciamento della arborizzazione con il canale IBA1 utilizzando lo strumento poligono in FIJI/ImmagineJ. (J) Esempio di tracciamento del soma di microglia con il canale IBA1 utilizzando lo strumento di selezione a mano libera in FIJI/ImageJ. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Interfaccia FIJI/ImmagineJ e strumenti per l'analisi di infiltrazione delle cellule mieloidi/immagini PIJI/ImageJ per densità microgliale, distribuzione, clustering, morfologia e analisi dell'infiltrazione delle cellule mieloidi periferiche. (A-R) Compilazione di tutti gli strumenti, i menu e le finestre utilizzati per le analisi di densità, cluster e morfologia. Fare clic qui per visualizzare una versione più grande di questa figura.
| Soluzioni | preparazione |
| Buffer di blocco | 0,5% gelatina - 5% di siero di capra naturale - 5% di siero d'asino naturale - 0,01% Triton X-100 in TBS [0,05 M] |
| Buffer di citrati | 1,92 g di acido citrico [10 mM], 500 -L di Tween 20 [0,05% (v/v)], 700 mL di acqua ultrapura, regolare il pH 6,0 con NaOH [10 N], riempire fino a 1 L con acqua ultrapura |
| NaBH4 | [0,01% w/w] Dirisolvere 0,01 g di NaBH4 in 10 mL di acqua ultrapura, la soluzione dovrebbe essere ben miscelata. Questa soluzione crea bolla; pressione di rilascio aprendo il tappo dopo la miscelazione |
| Pb | [100 mM] Disolve 23,48 g di Na2HPO4 e 4,8 g di NaH2PO4 H2O in 1 L di acqua ultrapura, quindi riempire fino a 2 L, regolare il pH |
| Pbs | [50 mM] Disolve 5,87 g di Na2HPO4, 1,2 g di NaH2PO4 H2O, 9 g di NaCl in 500 mL di acqua ultrapura, riempire fino a 1 L con acqua ultrapura, regolare pH - 7.4 |
| Pbst | PBS - 0,01% Triton X-100 |
| Tbs | Diluie Tris HCl [0,5 M] con acqua ultrapura 1:10 [0,05 M], prendere 1 L di Tris HCl [0,05 M] e aggiungere 8,75 g di NaCl |
| Tris HCl | [0,5 M] 950 mL di acqua ultrapura, aggiungere 78,8 g di idrocloruro tampone Tris (C4H11NO3Cl) regolare il pH 8 e riempire fino a 1 L |
Tabella 1: Soluzioni utilizzate per l'immunostaining.
Discussione
Questo protocollo può essere diviso in due parti critiche: la qualità della colorazione e l'analisi. Se la colorazione non è ottimale, non riuscirà a rappresentare adeguatamente le cellule microgliali, influenzando così la densità, la distribuzione e le misurazioni della morfologia. Inoltre, la percentuale di cellule mieloidi periferiche di infiltrazione può essere sottovalutata. Questa è una versione ottimizzata del protocollo di colorazione, ma ci sono diversi fattori che possono provocare immagini non ottimali. Anche se la perfusione dell'animale non è inclusa in questo protocollo, se la fissazione del cervello non è ben eseguita, la qualità della colorazione sarà compromessa. Inoltre, è necessaria una perfusione sufficiente per garantire l'assenza di macrofagi all'interno dei vasi sanguigni che possono interferire con lo studio.
Per quanto riguarda l'immunostaining, i dettagli più critici includono la qualità dei tamponi, la fase di blocco, la corretta conservazione degli anticorpi e la manipolazione dei campioni cerebrali. La corretta preparazione dei cuscinetti e il loro stoccaggio ha un'influenza diretta sulla qualità della colorazione. Se non specificato, alcuni buffer possono essere conservati per lunghi periodi, ma l'uso di qualsiasi buffer che mostra segni di contaminazione dovrebbe essere evitato. Se i buffer sono preparati con giorni o settimane di anticipo, il pH di ogni soluzione prima dell'uso deve essere verificato.
Inoltre, per quanto riguarda l'immunostaining, la presenza di colorazione di fondo rimane uno dei problemi più comuni. La colorazione di fondo rende difficile analizzare la microglia, in particolare la loro morfologia, e quindi sinterà sui risultati. Per evitare lo sfondo, è importante che la fase di blocco venga eseguita correttamente. Le condizioni di conservazione degli anticorpi hanno anche effetti diretti sulla loro efficacia. Si consiglia di seguire rigorosamente le linee guida di stoccaggio fornite dall'azienda, nonché di evitare frequenti cicli di congelamento dello scongelamento. Infine, durante l'intero processo, è fondamentale prestare attenzione all'integrità fisica delle sezioni del cervello. È importante prestare attenzione durante ogni manipolazione (modifiche del buffer, lavamenti e montaggio), soprattutto se lo sperimentatore non è sperimentato con questa procedura. Si consiglia di evitare di lasciare i campioni senza alcuna soluzione liquida quando si cambiano soluzioni o tamponi, le soluzioni per il passo successivo dovrebbero essere pronte a versare nel pozzo in anticipo. La piastra multi-bene deve essere correttamente sigillata con pellicola di paraffina durante la fase notturna per evitare l'evaporazione che può portare i campioni ad asciugare.
L'analisi quantitativa della densità microgliale, della distribuzione e della morfologia ha diversi vantaggi rispetto ai report qualitativi. Per prevenire pregiudizi, il ricercatore che esegue l'analisi deve essere accecato alla condizione sperimentale. Così, si consiglia di avere diverse persone eseguire l'analisi e modificare il nome dei file (pur mantenendo i nomi originali e nuovi in un foglio chiave). I nuovi nomi non devono avere alcun accenno alla condizione sperimentale. L'intera analisi può essere fatta su questi file accecati, e l'identità dell'immagine originale viene rivelata solo dopo la compilazione dei dati e prima dell'analisi statistica. Anche se l'accecamento è già praticato da ricercatori esperti, rimane un consiglio prezioso per coloro che eseguono questo tipo di analisi per la prima volta.
Il controllo per la regione del cervello viene fatto durante la selezione della sezione cerebrale e la tracciatura del ROI durante l'analisi. Assicurati di utilizzare sezioni della stessa gamma di livelli di Bregma tra gli animali. Lo stesso ROI deve essere utilizzato per le analisi di densità, distribuzione e morfologia. Per le analisi di densità e distribuzione, è particolarmente importante essere precisi quando si disegna il ROI in FIJI/Immagine J. L'uso di un atlante cerebrale è fortemente raccomandato sia per la selezione della sezione che per il tracciamento del ROI. L'uso di DAPI facilita anche l'identificazione di punti di riferimento neuroanatomici. Per evitare la varianza, si raccomanda di rifiutare le microglia che si trovano solo parzialmente nel ROI, in quanto possono differire tra il loro microambiente. Quando si marca microglia per l'analisi della densità, il canale DAPI può essere utilizzato come criterio di selezione. Contando solo le microglia che contengono nuclei macchiati DAPI, tutte le microglia considerate sono sullo stesso piano, riducendo il pregiudizio personale durante la selezione.
Poiché le misurazioni per l'indice NND, l'indice di spaziatura e l'analisi del cluster si basano sulle posizioni dei punti che contrassegnano le singole celle e poiché le distanze vengono calcolate da FIJI/ImageJ, è importante essere coerenti quando si posizionano questi punti. Assicurarsi di posizionare rigorosamente i punti al centro del corpo cellulare, che è determinato visivamente. Inoltre, la dimensione dei punti deve rimanere coerente per tutta l'analisi. Ciò contribuirà a una migliore rappresentazione della distribuzione spaziale della popolazione microgliale. Per l'analisi dei cluster, è stata selezionata una soglia di distanza basata sulle nostre analisi precedenti. Tuttavia, se ci sono quattro o più celle diverse con un NND inferiore a 12 m, tutte queste cellule potrebbero prendere parte di un singolo cluster o rappresentare due gruppi di due celle. Ciò ha reso necessario tornare alle immagini e confermare il numero effettivo di cluster.
A differenza della densità e della distribuzione, in cui il ROI è determinato da caratteristiche neuroanatomiche utilizzando un atlante cerebrale, la selezione delle cellule microgliali per l'analisi della morfologia si basa sulla capacità di analizzare la cellula. Tutte le celle che possono essere analizzate devono essere selezionate per l'analisi in una pila z prima di passare a un'altra pila z per evitare distorsioni di selezione. Le ragioni per escludere le cellule includono problemi con l'immunostaining o il taglio dei tessuti, l'elaborazione (ad esempio, lacrima) o il montaggio (ad esempio, la formazione di bolle). Idealmente, le sezioni cerebrali con tali problemi dovrebbero essere sistematicamente escluse dall'imaging e dall'analisi. È anche importante notare che la colorazione per TMEM119 e IBA1 non mostra sovrapposizione al 100% (Figura 2A -C). Poiché TMEM119 non consente la visualizzazione della continuità del processo (così come IBA1), questo rende difficile valutare dove finisce una cella e dove inizia un'altra. Così, l'analisi morfologia viene effettuata utilizzando il canale IBA1. Inoltre, tutte le tracce e i punti devono essere salvati e visualizzati per la revisione futura, consentendo di aumentare la trasparenza e la riproducibilità dei risultati.
Questo protocollo fornisce informazioni preziose per quanto riguarda la microglia e l'infiltrazione di macrofagi. Esempi delle sue applicazioni includono la rilevazione di segni di neuroinfiammazione attraverso cambiamenti nella microglia in diverse regioni del cervello, lo studio degli effetti antinfiammatori di un composto e lo studio dei fattori che interferiscono con la corretta funzione della microglia. Considerando che questo protocollo consente di rilevare l'infiltrazione di macrofagi nel cervello e la differenziazione di queste cellule dalla microglia, ulteriori applicazioni includono: determinare se il reclutamento di macrofagi avviene in un particolare insulto o con l'uso di altre tecniche (cioè strumenti genetici) e la conferma e lo studio delle conseguenze dell'assenza di macrofagi periferici nel cervello durante l'insulto. Tenete a mente che la microscopia a fluorescenza da sola non è sufficiente per confermare l'infiltrazione all'interno del parenchyma cerebrale. Quando le cellule di IBA1/TMEM119- sono osservate vicino ai ventricoli o allo spazio perivascolare, sono necessarie tecniche di risoluzione spaziale più elevata come la microscopia elettronica per confermare la loro localizzazione all'interno del parenchyma. Mentre i cambiamenti nella densità, nella distribuzione e nella morfologia sono buoni indicatori dei ruoli microgliali e macrofaschi, questo approccio è più potente se combinato con indagini funzionali.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Siamo grati a Nathalie Vernoux per la sua guida e assistenza con gli esperimenti. Vorremmo anche ringraziare i dottori Emmanuel Planel e Serge Rivest per l'uso della loro fluorescenza e microscopi confocali, rispettivamente. Questo lavoro è stato in parte finanziato da borse di studio del Consiglio messicano della scienza e della tecnologia (CONACYT; a F.G.I), Fondation Famille-Choquette e Centre thématique de recherche en neurosciences (CTRN; a K.P.), Fonds de Recherche du Québec - Santé (a M.B.), e Shastri Indo-Canadian Institute (a K.B.), così come una sovvenzione Discovery dal Natural Sciences and Engineering Research Council of Canada (NSERC) al M.E.T.M.E.T. ha una cattedra di ricerca canadese (livello II) di plasticità neuroimmune in salute e terapia.
Materiali
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 488 donkey anti-mouse | Invitrogen/Thermofisher | A21202 | |
| Alexa Fluor 568 goat anti-rabbit | Invitrogen/Thermofisher | A11011 | |
| Biolite 24 Well multidish | Thermo Fisher | 930186 | |
| Bovine serum albumin | EMD Millipore Corporation | 2930 | |
| Citric acid | Sigma-Aldrich | C0759-500G | |
| DAPI Nuceleic acid stain | Invitrogen/Thermofisher | MP 01306 | |
| Fine Brush | Art store | ||
| Fluoromount-G | Southern Biotech | 0100-01 | |
| Gelatin from coldwater fish skin | Sigma-Aldrich | G7765 | |
| Microscope coverglass | Fisher Scientific | 1254418 | |
| Microslides positively charged | VWR | 48311-703 | |
| Monoclonal mouse Anti-IBA1 | Millipore | MABN92 | |
| Na2H2PO4·H2O | BioShop Canada Inc. | SPM306, SPM400 | |
| Na2HPO4 | BioShop Canada Inc. | SPD307, SPD600 | |
| NaBH4 | Sigma-Aldrich | 480886 | |
| NaCl | Fisher Scientific | S642500 | |
| Normal donkey serum (NDS) | Jackson ImmunoResearch laboratories Inc. | 017-000-121 | |
| Normal goat serum (NGS) | Jackson ImmunoResearch laboratories Inc. | 005-000-121 | |
| Parafilm-M | Parafilm | PM-999 | |
| Rabbit monoclonal Anti-TMEM119 | Abcam | ab209064 | |
| Reciprocal Shaking bath model 25 | Precision Scientific | - | |
| Transfer pipette | |||
| Tris buffer hydrochloride | BioShop Canada Inc. | TRS002/TRS004 | |
| Triton-X-100 | Sigma-Aldrich | T8787 | |
| Tween 20 | Sigma-Aldrich | P7949-100ML |
Riferimenti
- Lawson, L. J., Perry, V. H., Dri, P., Gordon, S. Heterogeneity in the distribution and morphology of microglia in the normal adult mouse brain. Neuroscience. 39 (1), 151-170 (1990).
- Milior, G., et al. Fractalkine receptor deficiency impairs microglial and neuronal responsiveness to chronic stress. Brain, Behavior, and Immunity. 55, 114-125 (2016).
- Nimmerjahn, A., Kirchhoff, F., Helmchen, F. Resting Microglial Cells Are Highly Dynamic Surveillants of Brain Parenchyma in Vivo. Science. 308 (5726), 1314-1318 (2005).
- Hickman, S., Izzy, S., Sen, P., Morsett, L., Khoury, J. E. Microglia in neurodegeneration. Nature Neuroscience. 21 (10), 1359 (2018).
- Tay, T. L., Savage, J. C., Hui, C. W., Bisht, K., Tremblay, M. &. #. 2. 0. 0. ;. Microglia across the lifespan: from origin to function in brain development, plasticity and cognition. The Journal of Physiology. 595 (6), 1929-1945 (2017).
- Tremblay, M. &. #. 2. 0. 0. ;., Lowery, R. L., Majewska, A. K. Microglial Interactions with Synapses Are Modulated by Visual Experience. PLoS Biology. 8 (11), (2010).
- Jakovljevic, M., et al. Induction of NTPDase1/CD39 by Reactive Microglia and Macrophages Is Associated With the Functional State During EAE. Frontiers in Neuroscience. 13, (2019).
- Taylor, A. M. W., et al. Microglia Disrupt Mesolimbic Reward Circuitry in Chronic Pain. The Journal of Neuroscience. 35 (22), 8442-8450 (2015).
- Poliani, P. L., et al. TREM2 sustains microglial expansion during aging and response to demyelination. The Journal of Clinical Investigation. 125 (5), 2161-2170 (2015).
- Lu, S. M., et al. HIV-1 Tat-Induced Microgliosis and Synaptic Damage via Interactions between Peripheral and Central Myeloid Cells. PLoS ONE. 6 (9), e23915 (2011).
- Rodríguez, J. J., et al. Increased densities of resting and activated microglia in the dentate gyrus follow senile plaque formation in the CA1 subfield of the hippocampus in the triple transgenic model of Alzheimer's disease. Neuroscience Letters. 552, 129-134 (2013).
- Rasmussen, S., et al. Persistent activation of microglia is associated with neuronal dysfunction of callosal projecting pathways and multiple sclerosis-like lesions in relapsing-remitting experimental autoimmune encephalomyelitis. Brain. 130 (11), 2816-2829 (2007).
- Walker, F. R., et al. Dynamic structural remodelling of microglia in health and disease: a review of the models, the signals and the mechanisms. Brain, Behavior, and Immunity. 37, 1-14 (2014).
- Ohsawa, K., Imai, Y., Kanazawa, H., Sasaki, Y., Kohsaka, S. Involvement of Iba1 in membrane ruffling and phagocytosis of macrophages/microglia. Journal of Cell Science. 113 (17), 3073-3084 (2000).
- Yamasaki, R., et al. Differential roles of microglia and monocytes in the inflamed central nervous system. Journal of Experimental Medicine. 211 (8), 1533-1549 (2014).
- Wohleb, E. S., et al. Peripheral innate immune challenge exaggerated microglia activation, increased the number of inflammatory CNS macrophages, and prolonged social withdrawal in socially defeated mice. Psychoneuroendocrinology. 37 (9), 1491-1505 (2012).
- Shemer, A., et al. Engrafted parenchymal brain macrophages differ from microglia in transcriptome, chromatin landscape and response to challenge. Nature Communications. 9, (2018).
- Geissmann, F., et al. Development of monocytes, macrophages and dendritic cells. Science (New York, N.Y). 327 (5966), 656-661 (2010).
- Minogue, A. M. Role of infiltrating monocytes/macrophages in acute and chronic neuroinflammation: Effects on cognition, learning and affective behaviour. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 79, 15-18 (2017).
- Ginhoux, F., et al. Fate Mapping Analysis Reveals That Adult Microglia Derive from Primitive Macrophages. Science (New York, N.Y). 330 (6005), 841-845 (2010).
- Kierdorf, K., et al. Microglia emerge from erythromyeloid precursors via Pu.1- and Irf8-dependent pathways. Nature Neuroscience. 16 (3), 273-280 (2013).
- Bennett, M. L., et al. New tools for studying microglia in the mouse and human CNS. Proceedings of the National Academy of Sciences of the United States of America. 113 (12), E1738-E1746 (2016).
- Mizutani, M., et al. The fractalkine receptor but not CCR2 is present on microglia from embryonic development throughout adulthood. Journal of Immunology. 188 (1), 29-36 (2012).
Erratum
Formal Correction: Erratum: Immunofluorescence Staining Using IBA1 and TMEM119 for Microglial Density, Morphology and Peripheral Myeloid Cell Infiltration Analysis in Mouse Brain
Posted by JoVE Editors on 10/12/2019. Citeable Link.
An erratum was issued for: Immunofluorescence Staining Using IBA1 and TMEM119 for Microglial Density, Morphology and Peripheral Myeloid Cell Infiltration Analysis in Mouse Brain. An author name was updated.
The name was corrected from:
Maude Bordelau
to:
Maude Bordeleau
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon