Method Article
Cellule d'immunofluorescence utilisant IBA1 et TMEM119 pour la densité microgliale, la morphologie et l'analyse périphérique d'infiltration de cellules myéloïdes dans le cerveau de souris
Dans cet article
Erratum Notice
Résumé
Ce protocole décrit un workflow étape par étape pour la costaining immunofluorescente d'IBA1 et de TMEM119, en plus de l'analyse de la densité, de la distribution et de la morphologie microgliales, aussi bien que l'infiltration périphérique de cellules myéloïdes dans le tissu de cerveau de souris.
Résumé
Il s'agit d'un protocole pour la double visualisation des microglies et l'infiltration de macrophages dans le tissu cérébral de la souris. TMEM119 (qui étiquette les microglies de manière sélective), lorsqu'il est combiné avec IBA1 (qui fournit une visualisation exceptionnelle de leur morphologie), permet d'enquêter sur les changements dans la densité, la distribution et la morphologie. La quantification de ces paramètres est importante pour fournir des informations sur les rôles exercés par les microglies, les macrophages résidents du cerveau. Dans des conditions physiologiques normales, les microglies sont régulièrement distribuées en mosaïque et présentent un petit soma avec des processus ramifiés. Néanmoins, en réponse à des facteurs environnementaux (c.-à-d. traumatisme, infection, maladie ou blessure), la densité microgliale, la distribution et la morphologie sont modifiées de diverses manières, selon l'insulte. En outre, la méthode de double coloration décrite permet la visualisation des macrophages infiltrants dans le cerveau basé sur leur expression de IBA1 et sans colocalisation avec TMEM119. Cette approche permet ainsi la discrimination entre les microglies et les macrophages infiltrants, ce qui est nécessaire pour fournir des informations fonctionnelles sur leur implication distincte dans l'homéostasie du cerveau à travers divers contextes de la santé et la maladie. Ce protocole intègre les derniers résultats en neuroimmunologie qui se rapportent à l'identification des marqueurs sélectifs. Il sert également d'outil utile pour les neuroimmunologistes expérimentés et les chercheurs qui cherchent à intégrer la neuroimmunologie dans les projets.
Introduction
Qu'elle soit grave ou chronique, la neuroinflammation est fortement influencée par les microglies, les macrophages résidents du cerveau. La visualisation des microglies par immunostaining est précieuse pour l'étude de la neuroinflammation avec l'utilisation de la microscopie légère, une technique très accessible. Dans des conditions homéostatiques, les microglies sont généralement distribuées dans un modèle non superposé, ressemblant à une mosaïque. Ils présentent de petits somas qui prolongent les processus ramifiés1, qui parfois se contactentles uns lesautres 2 . Les processus ramifiés microglial s'enduisent dynamiquement sur le parenchyme cérébral, interagissant avec les neurones, les autres cellules gliales et les vaisseaux sanguins dans des conditions physiologiques normales3. Les microglies sont équipées d'un arsenal de récepteurs qui leur permettent d'effectuer des tâches immunologiques et de répondre aux changements dans le milieu cérébral, à la mort cellulaire ou aux lésions tissulaires. En outre, ils exercent des fonctions physiologiques clés, notamment dans la formation synaptique, l'entretien et l'élimination4,5.
Parmi les marqueurs disponibles utilisés pour étudier les microglies, la molécule ionisée d'adaptateur de liaison de calcium 1 (IBA1) est l'un des plus largement utilisés. IBA1 est une protéine de liaison de calcium qui fournit la visualisation exceptionnelle de la morphologie microgliale, y compris les processus distal fins, comme confirmé par la microscopie électronique6. Cet outil a joué un rôle déterminant dans la caractérisation de la transformation microgliale, anciennement appelée « activation », dans un vaste éventail de modèles de maladies animales7,8,9. En présence de neuroinflammation, la réponse microgliale comprend : la microgliose qui est définie comme une augmentation de la densité cellulaire, les changements de distribution qui se traduisent parfois par le regroupement, l'élargissement du corps cellulaire, ainsi que l'épaississement et raccourcissement des processus associés à des formes plus améboïdes10,11,12,13.
L'immunostaining est limité par la disponibilité d'anticorps dirigés contre des marqueurs spécifiques. Surtout, IBA1 est exprimé par des microglies mais aussi par des macrophages périphériques qui s'infiltrent dans le cerveau14. Tandis que l'observation des cellules IBA1-positives à l'intérieur du cerveau est devenue un marqueur des microglies dans ce domaine de recherche, l'infiltration périphérique de macrophage a été rapportée dans diverses conditions, même marginalement dans le cerveau sain15,16 ,17,18. Par conséquent, l'utilisation d'IBA1 seule ne permet pas la visualisation sélective des microglies. En outre, les macrophages adoptent des caractéristiques moléculaires et morphologiques des microglies résidentes une fois qu'ils ont infiltré le cerveau, empêchant ainsi la différenciation19. Cela représente un défi lors de l'étude de la fonction des microglies et de l'infiltration de macrophages.
Bien que les microglies et les macrophages périphériques aient des origines distinctes (p. ex., du sac de jaune embryonnaire et de la moelle osseuse, respectivement20,21), il y a un nombre croissant de résultats indiquant que les deux populations cellulaires exercent différents rôles dans le cerveau19. Il est donc crucial d'utiliser des méthodes qui font la distinction entre ces deux populations sans manipulations invasives (c.-à-d. chimères de moelle osseuse ou parabiose) qui peuvent moduler leur densité, leur distribution, leur morphologie et leur fonction. TMEM119 a émergé comme un marqueur microglies-spécifiques à travers la santé et les conditions de la maladie22. Lorsqu'il est combiné avec IBA1, ce marqueur devient utile pour différencier ces cellules de l'infiltration macrophages, qui sont TMEM119-négatif et IBA1-positif. Bien qu'il soit réglementé par le développement, TMEM119 est exprimé dès les jours postnatals 3 (P3) et 6 (P6), augmentant régulièrement jusqu'à atteindre les niveaux adultes entre P10 et P1422. IBA1 est exprimé dès le jour embryonnaire 10.5 (E10.5)23. Le protocole de double étiquetage proposé est donc utile pour étudier ces deux populations tout au long de la vie postnatale.
Ce protocole fournit une procédure d'immunostaining étape par étape qui permet la discrimination entre les microglies et les macrophages périphériques. Il explique également comment effectuer une analyse quantitative de la densité, de la distribution et de la morphologie des microglies, ainsi que l'analyse de l'infiltration périphérique de macrophage. Tandis que l'étude des microglies et des macrophages périphériques est utile en soi, ce protocole permet en outre la localisation des foyers neuroinflammatoires ; ainsi, il sert également de plate-forme pour identifier des régions spécifiques à étudier, avec l'utilisation de techniques complémentaires (encore plus longues et consommatrices de ressources).
Protocole
Toutes les procédures expérimentales ont été effectuées en accord avec les lignes directrices des comités institutionnels d'éthique animale, conformément au Conseil canadien sur les soins aux animaux et au Comité des soins aux animaux de l'Université Laval.
1. Immunostaining
- Sélectionnez trois sections du cerveau de souris contenant la région d'intérêt (ROI) (c.-à-d. l'hippocampe) à l'aide d'un atlas cérébral. Placer les sections dans une plaque en plastique multi-puits et les recouvrir de 350 l de salin tamponné par le phosphate (PBS) (tableau 1).
REMARQUE : Pour des résultats optimaux, les cerveaux doivent être perfusés avec 4 % de paraformaldéhyde et coupés à une épaisseur de 50 m avec un vibratome. Pour une plaque de 24 puits multiples, chaque puits peut contenir jusqu'à six sections. Le volume de solution recommandé pour chaque puits est de 350 L (pour un maximum de trois sections) et de 500 l pour les puits contenant six sections. Pour un plus grand nombre de sections, il est recommandé d'utiliser une plaque de 12 puits multiples. Assurez-vous que le volume de solution sélectionné pour chaque puits couvre complètement le tissu et permet aux sections de flotter. Les volumes recommandés s'appliquent à toutes les solutions utilisées dans le reste du protocole. - Laver les échantillons en les recouvrant de 350 oL de PBS et les laisser reposer en plaçant la plaque multi-puits sur le dessus d'un shaker polyvalent à température ambiante (RT). Retirez le PBS après 5 min et remplacez-le 5x par du PBS frais.
REMARQUE : Pour supprimer les solutions, une pipette de transfert est recommandée. Lorsque vous versez dans n'importe quelle solution, assurez-vous de placer la pointe de la pipette contre le mur du puits pour protéger l'intégrité des tissus. Assurez-vous également d'utiliser une nouvelle pipette pour chaque nouvelle solution. - Enlever le PBS et ajouter 350 l de 10 ml de tampon de citrate de sodium avec un pH de 6,0 (tableau 1).
- Scellez la plaque multi-puits avec du film de paraffine et laissez-la flotter sur un bain d'eau préalablement préchauffé pendant 40 min à 70 oC.
- Laisser refroidir la plaque multi-puits pendant environ 15 min.
- Retirez le tampon de citrate de sodium et lavez les sections dans le PBS comme cela a été fait à l'étape 1.2.
- Retirez le PBS et ajoutez 350 l de NaBH4 fraîchement préparé 0,1 %(tableau 1) et laissez incuber pendant 30 min à RT.
- Retirez la solution de 0,1 % NaBH4 et lavez les sections dans PBS comme cela a été fait à l'étape 1.2.
- Retirez le PBS et ajoutez un tampon de blocage (tableau 1) pendant 1 h à RT sur un shaker polyvalent.
REMARQUE : Assurez-vous de préparer des volumes doublés de tampon de blocage, car la même solution sera utilisée à l'étape suivante. - Retirez le tampon de blocage et remplacez-le en bloquant le tampon contenant le mélange d'anticorps primaires (1:150 souris IBA1 à 1:300 TMEM119). Sceller l'assiette avec du film de paraffine et laisser incuber toute la nuit à 4 oC.
- Le lendemain, des échantillons chauds à RT pendant environ 15 min.
- Laver les sections 5x pendant 5 min chacune en PBS avec triton (PBST) (tableau 1).
- Retirez la PBST et ajoutez un tampon de blocage contenant le mélange d'anticorps secondaires (1 300 ânes anti-souris Alexa 488 pour IBA1; 1 300 chèvre anti-lapin Alexa 568 pour TMEM119) pendant 1,5 h à RT. À partir de ce point, protégez les échantillons de la lumière.
- Retirez le tampon de blocage et lavez les sections 5x comme fait à l'étape 1.2, sauf cette fois avec PBST.
- Retirez la PBST et ajoutez 4,6-diamidino-2-phenylindole (DAPI) [1:20000] pendant 5 min à RT.
- Retirez Le DAPI et lavez les sections 3x pendant 5 min chacune dans un tampon de phosphate (PB).
- Montez les sections sur une lame de microscope. Laissez-les sécher tout en se protéger de la lumière.
- Une fois séché, ajouter quelques gouttes de fluorescence moyenne de montage et couvrir d'un bordereau, en évitant la formation de bulles.
REMARQUE : Conservez les diapositives tout en vous abritant de la lumière, à l'intérieur d'une boîte à glissière histologique, à 4 oC. Les échantillons peuvent être conservés pendant plusieurs mois.
2. Imagerie pour l'analyse de densité et de distribution
- À l'aide d'un microscope à épifluorescence à champ large, utilisez un grossissement faible et le canal DAPI pour localiser le retour sur investissement (c.-à-d. la région CA1 de l'hippocampe).
- Acquérir des images à 20x, à l'aide d'une ouverture numérique (NA) de 0,5, avec le DAPI, 488, et 568 canaux et filtres, à une résolution de 0,3 m/pixel. Capturez une image en mosaïque couvrant le retour sur investissement. Sinon, prenez des photos individuelles qui seront cousues dans une image plus grande.
REMARQUE : Une image en mosaïque est une image super constituée par des images plus petites. Les images de mosaïque sont généralement utilisées pour surmonter la zone limitée du champ de vision des grossissements élevés. Certains logiciels comprennent une fonction de mosaïque; néanmoins, les images peuvent également être cousues manuellement avec d'autres logiciels de retouche photo en cousant les images individuelles en une seule. N'oubliez pas d'ajouter les informations d'échelle au fichier. Pour ce type d'analyse, il est recommandé d'avoir au moins 300 cellules microgliales imagepar roi/animal (correspondant à environ 10 à 15 images pour l'hippocampe, par exemple), avec un minimum de cinq animaux par condition expérimentale. Figure 1A-C montre les images de microglies co-étiquetées. - Enregistrer l'image comme un fichier TIFF.
3. Imagerie pour l'analyse de la morphologie
- À l'aide d'un microscope d'éclairage confocal ou structuré, utilisez le canal DAPI pour localiser le retour sur investissement à faible grossissement.
- À l'aide d'un objectif 40x (c.-à-d. de l'huile NA 1.4), localisez une cellule IBA1MD/TMEM119À l'intérieur du roi-roi. Pendant l'imagerie en direct, déplacez-vous dans l'axe Z. Dès que le signal de la microglie choisie au hasard disparaît, définir ce niveau Z comme le début de la z-pile. Déplacez-vous le long de l'axe Z dans la direction opposée jusqu'à ce que le signal de la microglies disparaisse et fixe ce point comme la fin de la pile Z.
REMARQUE : La figure 2del'A-C montre des images de microglies IBA1MD/TMEM119MD. - Créez une pile Z dans les trois canaux (DAPI, 488, 568) à l'aide d'un intervalle Z de 0,33 m et d'une taille de pixel de 0,15 m/pixel. Ajoutez les informations d'échelle au fichier.
REMARQUE : L'intervalle Z recommandé dépend de la puissance de résolution de l'objectif (p. ex., pour un objectif 40x tel que l'huile NA 1.4, il est de 0,33 m). Pour l'analyse de la morphologie, il est recommandé d'avoir au moins 20 cellules par animal avec un minimum de cinq animaux par condition expérimentale. - Enregistrer le fichier comme un fichier TIFF.
4. Analyse de la densité et de la distribution
- Ouvrez FIJI/ImageJ avec le plugin voisin le plus proche (NND) installé. Ouvrez l'image 20x.
REMARQUE : Utilisez un moteur de recherche avec le mot clé « Calcul des distances de voisinage le plus proche avec ImageJ » pour trouver les instructions d'installation. L'auteur plugin est Yuxiong Mao. - Pour définir l'échelle manuellement à partir d'une échelle imprimée sur l'image, sélectionnez l'outil de ligne droite (Figure 3E), placez le curseur sur le bord de l'échelle, et, en appuyant sur la touche de décalage, tracez une ligne aussi près que possible de l'échelle sur l'image (Figure 3IMD/c1 -), sélectionnez Analyser Définir l'échelle, puis entrez les informations correctes (Figure 3J).
REMARQUE : L'échelle peut parfois être contenue dans les métadonnées du fichier et être fixée automatiquement. - Sélectionner l'image La couleur Faire composite pour créer une image composite de tous les canaux.
REMARQUE : Lors de l'acquisition d'images, FIJI/ImageJ créera automatiquement un composite dans le format RGB. - Sur la barre de menu, sélectionnez Analyser Définir des mesures. Check Area, Centroid, et Perimeter. Sur l'onglet Rediriger vers, cliquez et sélectionnez le fichier ouvert (Figure 3K).
- Aller à l'image (fr) La couleur Outil de canal pour ouvrir l'outil de canal.
REMARQUE : Ce menu permettra d'désactivé une couleur spécifique. Le canal DAPI peut être utile pour identifier le retour sur investissement et confirmer les cellules. Il peut être désactivé pour faciliter le comptage. - Dessinez un périmètre approximatif du retour sur investissement avec l'outil de sélection à main levée (Figure 3D).
- Activez l'outil de pinceau de sélection en cliquant en deux clics sur l'outil ovale sur la barre d'outils et assurez-vous que la boîte de pinceau de sélection Enable est cochée (Figure 3G). Cet outil sera utilisé pour délimiter le retour sur investissement plus précisément. Sélectionnez une taille de pinceau appropriée entre 200 et 400.
- À l'aide de la brosse de sélection, ajustez le périmètre pour mieux s'adapter au retour sur investissement. Appuyez sur T sur le clavier pour ajouter au gestionnaire de retour sur investissement (Figure 3L).
- Sélectionnez Analyze (en anglais) Mesurez ou appuyez sur la touche M, et une fenêtre de résultats apparaîtra. Copier et coller les résultats sur une feuille de données, puis enregistrer l'information concernant la zone (c.-à-d. la zone du retour sur investissement; Figure 3R).
- Après avoir copié la zone du retour sur investissement, effacer les informations de la fenêtre de résultats en cliquant dessus et en appuyant sur la touche Backspace.
- Aller à la fenêtre de gestionnaire de retour sur investissement (Figure 3L), cliquez à droite sur la trace de retour sur investissement, changer le nom pour correspondre au nom de l'image, puis enregistrer.
- Double-cliquez sur l'outil de brosse à la barre d'outils. Sélectionnez la couleur noire et une taille de pinceau de 10. Assurez-vous que l'option Peinture de la pariation n'est pas cochée (Figure 3H).
- Dans le canal TMEM119, placez soigneusement un point noir sur le centre du soma pour chaque microglie TMEM119. Placez un point blanc sur le centre des cellules qui ne sont pas positifs pour TMEM119 (pour marquer les macrophages infiltrants). Répétez la même procédure pour toutes les cellules contenues dans le retour sur investissement.
REMARQUE : Il est important que tous les points (noir et blanc) soient situés dans le même canal. L'identité du canal peut être vérifiée (rouge, bleu ou vert) en regardant la couleur des étiquettes de fenêtre d'image. - Sélectionner l'image La couleur Chaîne fractionnée. Une fenêtre pour chaque canal s'affiche. Ensuite, identifiez le canal qui a les annotations point et fermez les deux autres fenêtres.
- Rediriger la nouvelle image de canal split. Aller à L'analyse de l'année Définir des mesures. Sur l'onglet Rediriger vers, cliquez et sélectionnez l'image du canal split (Figure 3K).
- Sélectionner l'image Type de type 8 bits. Aller à l'image (fr) Ajuster et sélectionner Threshold (Figure 3O). Pour ajuster le seuil, faites glisser le bouton de la deuxième barre, jusqu'à la gauche (valeur seuil 0) dans les deux barres.
REMARQUE: Cela ne laissera que les points noirs sur l'image, apparaissant blanc. - Sélectionnez le retour sur investissement dans la fenêtre de gestionnaire de retour sur investissement. Sélectionnez Analyze (en anglais) Analyser les particules (Figure 3N). Sur la taille (pouce 2): écrivez 1-20. Gardez l'unité de pixel non cochée, vérifiez afficher, résumer et ajouter au gestionnaire,et appuyez sur Ok. La fenêtre récapitulatif apparaîtra et donnera le nombre de points (Figure 3P). Copiez et collez l'information à la feuille de données.
- Sélectionnez Plugins NND. La fenêtre NND apparaîtra (Figure 3Q). Copiez/collez toutes les informations à la feuille de données. Chaque nombre représente la distance que chaque microglies a à la microglies voisine la plus proche.
- Retournez à la fenêtre de seuil et faites glisser la première barre jusqu'à la droite (valeur seuil de 255 dans les deux barres), ce qui laissera tous les points blancs visibles, apparaissant blanc (Figure 3M).
- Sélectionnez Analyze (en anglais) Analyser la particule. La fenêtre récapitulatif qui fournit le nombre de points apparaîtra (Figure 3P). Copiez et collez l'information à la feuille de données.
- Rendez-vous sur le gestionnaire de retour sur investissement sélectionnez tous les points, cliquez à droite, et enregistrez avec le nom de l'image. Cela permettra d'enregistrer tous les points dans un fichier zip (Figure 3L). Sélectionner le fichier Enregistrer comme, et enregistrer le fichier avec un nom qui permet l'identification de l'image analysée.
- Obtenir la densité des microglies (pour chaque image) en divisant le nombre de cellules double-positives IBA1MD/TMEM119MD par la zone du retour sur investissement.
REMARQUE : Les valeurs de chaque image peuvent être moyennes pour chaque animal. Les données peuvent alors être présentées comme une erreur moyenne de la moyenne (SEM) de tous les animaux. - Déterminez le NND en obtenant une moyenne par image des valeurs NND de toutes les cellules TMEM119.
REMARQUE : Les données peuvent alors être présentées comme étant la moyenne de tous les animaux. - Calculez l'indice d'espacement à l'aide de la formule : Densité NND2 x.
REMARQUE : Les données peuvent alors être présentées comme étant la moyenne de tous les animaux. Les unités pour cette mesure seront des unités arbitraires. - Quantifier les amas microgglial en identifiant les cellules qui ont un NND inférieur à 12 m.
REMARQUE : Ici, 12 m sont sélectionnés, car il s'agit de la distance approximative entre deux cellules microgliales juxtaposant directement se touchant les unes les autres avec des arborisations. S'il y a plus de trois microglies qui répondent à cette condition, retournez à l'image et vérifiez si ces cellules font partie d'un ou plusieurs clusters. - Après avoir confirmé le nombre de clusters, écrivez le nombre de clusters dans la feuille de données.
REMARQUE : Le nombre de grappes peut être divisé par la zone de retour sur investissement pour obtenir la densité des cellules/mm2 pour chaque animal. Les données peuvent alors être présentées comme moyennes - SEM de tous les animaux. - Pour déterminer le pourcentage d'infiltration de cellules myéloïdes périphériques, calculez le pourcentage de cellules IBA1/TMEM119 par rapport au nombre total de cellules myéloïdes (TMEM119MD/IBA1MD - TMEM119-/IBA1) pour chaque animal.
REMARQUE : Les données peuvent alors être présentées comme étant la moyenne de tous les animaux.
5. Analyse de la morphologie
- Ouvrez FIJI/ImageJ.
- Ouvrez l'image 40x à l'aide de L'image J ou de LA FIJI. Sélectionnez Une fenêtre popup s'affiche demandant si les images doivent être ouvertes dans une pile. Cliquez OK. Ensuite, sélectionnez Image Piles ( Z projet pour ouvrir la fenêtre Z-Projection. Inclure toutes les tranches, de la première à la dernière tranche. Assurez-vous que l'intensité maximale est sélectionnée sous le typede projection , et cliquez sur OK
- Cliquez sur la nouvelle fenêtre avec le projet Z. Sélectionner l'image Couleurs et couleurs Chaînes fractionnements. Effectuer les traces sur les images du canal IBA1.
REMARQUE : Les autres canaux (TMEM119 et DAPI) peuvent être maintenus ouverts et consultés au besoin lors de l'analyse de la morphologie microgliale. - Sur la barre de menu, sélectionnez Analyser Définir des mesures. Vérifiez la zone, Centroid, et Perimeter. Sur l'onglet Redirect à, sélectionnez le fichier ouvert (Figure 3K).
- Définir l'échelle telle que décrite dans les étapes 4.2.
- Pour mesurer la taille du soma dans le canal IBA1, tracez un périmètre approximatif du soma avec l'outil de sélection à main levée (Figure 3D).
- Activez l'outil de pinceau de sélection en cliquant en deux clics sur l'outil ovale sur la barre d'outils, puis en cochant Activer la boîte de pinceau de sélection ( Figure3G). Sélectionnez une taille de pinceau de sélection entre 10 et 20 (figure 3B).
- À l'aide de la brosse de sélection, ajuster la trace pour mieux s'adapter au soma. Le zoom avant permettra la précision pendant cette étape (Figure 2I).
- Appuyez sur la touche T pour ajouter la trace de soma au gestionnaire du retour sur investissement (Figure 3L).
- Sélectionnez Analyze (en anglais) Mesurez ou appuyez sur la touche M. Une fenêtre de résultats apparaîtra. Copier et coller les résultats sur une feuille de données (Figure 3R).
- Pour enregistrer les informations concernant la zone soma, allez à la fenêtre de gestionnaire de retour sur investissement, cliquez à droite sur le roi-retour, changez le nom pour correspondre au nom de l'image, spécifiez que la trace est pour soma, puis enregistrez le fichier.
- Pour mesurer la zone d'arboriculture dans le canal IBA1, cliquez sur l'extrémité d'un processus microglial avec l'outil de sélection du polygone, qui commencera la forme du polygone (figure 3C).
- En suivant les extrémités des processus microglial, faites le tour des microglies en cliquant sur les extrémités de chaque processus pour former un polygone qui représente le mieux la zone couverte par les arborescences microgliales (Figure 2Dh).
REMARQUE : Assurez-vous que le polygone relie toutes les extrémités du processus microglial. Les lignes formant le polygone ne doivent jamais se croiser. Lorsque vous cliquez autour d'une pointe de processus microglial, veillez à éviter de couper n'importe quelle partie du processus. Il est parfois utile d'ajouter des points supplémentaires pour contourner un processus. Le nombre de points formant le polygone n'est pas directement lié au nombre de processus distal et n'est donc pas pertinent pour l'étude. - Pour fermer le polygone, cliquez sur le point de départ du polygone.
- Appuyez sur la touche T pour ajouter la trace au gestionnaire du retour sur investissement (Figure 3L). Sélectionnez Analyze (en anglais) Mesurez ou appuyez sur la touche M. Une fenêtre de résultats apparaîtra. Copier et coller les résultats sur une feuille de données (Figure 3R).
- Pour enregistrer les informations concernant la zone d'arboriculture, rendez-vous sur la fenêtre du gestionnaire de retour sur investissement, cliquez à droite sur le retour sur investissement, changez le nom pour correspondre au nom de l'image, spécifiez pour l'arboriculture, puis enregistrez le fichier.
- Déterminer la zone de soma en faisant la moyenne de toutes les zones de soma pour chaque animal.
REMARQUE : Les données peuvent être présentées comme étant la moyenne de tous les animaux. - Déterminer la zone d'arboriculture en faisant la moyenne de toutes les zones d'arboriculture pour chaque animal.
REMARQUE : Les données peuvent être présentées comme étant la moyenne de tous les animaux. - Calculer l'indice de morphologie en utilisant la zone soma/zone d'arborescence de la formule pour chaque cellule microgliale et la moyenne par animal.
REMARQUE : Les données peuvent être présentées comme étant la moyenne de tous les animaux.
Résultats
La figure 1 montre la co-étiquetage des microglies à l'aide d'IBA1 et de TMEM119 dans une section coronale de l'hippocampe dorsal image à 20x par microscopie de fluorescence. Une coloration réussie révèle les corps de cellules microgliales et leurs processus fins (Figure 1A-C). Cette coloration permet de déterminer la densité et la distribution microgliales et l'identification des amas microglial (Figure 1I) et des macrophages infiltrants (Figure 1F).
La figure 2 montre les microglies IBA1MD/TMEM11M (Figure 2A-C) dans un exemple stepwise de la procédure de traçage de l'arborabilité microgliale (Figure 2D-H), ainsi qu'un exemple de traçage du corps cellulaire (Figure 2I ), tous deux photographiés à 40x par microscopie confocale.

Figure 1 : IBA1 et TMEM119 double coloration du tissu cérébral de souris pour la densité, la distribution, le regroupement, et l'analyse périphérique d'infiltration de cellules myéloïdes. (A-C) Distribution microgliale typique dans l'hippocampe d'une souris adulte C57BL/6. (D-F) Microglies identifiées comme IBA1MD/TMEM119MD et macrophage infiltrant identifié comme IBA1MD/TMEM119 (flèche blanche) dans l'amygdale d'une souris mâle. (G-I) Groupe de deux microglies (carré blanc) dans l'hippocampe d'une souris. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
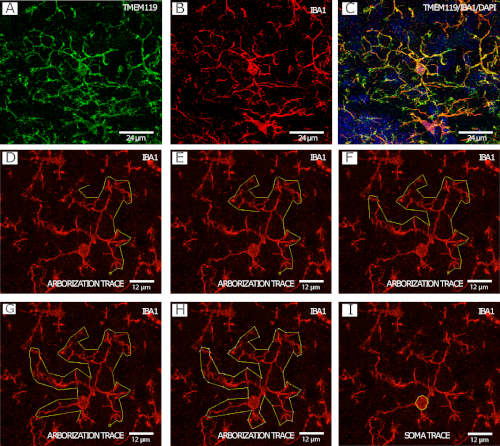
Figure 2 : coloration IBA1 et TMEM119 pour l'analyse de la morphologie microgliale. (A-C) Des microglies. (D-I) Exemple étape par étape de traçage d'arborescence avec le canal IBA1 à l'aide de l'outil polygone dans FIJI/ImageJ. (J) Exemple de microglies soma traçage avec le canal IBA1 à l'aide de l'outil de sélection à main levée dans FIJI/ImageJ. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 3 : Interface FIJI/ImageJ et outils pour la densité microgliale, la distribution, le clustering, la morphologie et l'analyse périphérique de l'infiltration des cellules myéloïdes. (A-R) Compilation de tous les outils, menus et fenêtres utilisés pour les analyses de densité, de cluster et de morphologie. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
| Solutions | préparation |
| Blocage du tampon | 0,5 % de gélatine, 5 % de sérum de chèvre naturel, 5 % de sérum d'âne naturel, 0,01 % Triton X-100 en SCT [0,05 M] |
| Tampon de citrate | 1,92 g d'acide citrique [10 mM], 500 l de Tween 20 [0,05% (v/v)], 700 mL d'eau ultrapure, ajuster le pH 6,0 avec NaOH [10 N], remplir jusqu'à 1 L d'eau ultrapure |
| NaBH4 Annonces | [0,01 % w/w] Disolve 0.01 g de NaBH4 dans 10 ml d'eau ultrapure, la solution doit être bien mélangée. Cette solution crée des bulles; relâchez la pression en ouvrant le bouchon après le mélange |
| Pb | [100 mM] Disolve 23.48 g de Na2HPO4 et 4.8 g de NaH2PO4 H2O en 1 L d'eau ultrapure, puis remplir jusqu'à 2 L, ajuster le pH 7,4 |
| Pbs | [50 mM] Disolve 5.87 g de Na2HPO4, 1.2 g de NaH2PO4 H2O, 9 g de NaCl dans 500 ml d'eau ultrapure, remplir jusqu'à 1 L d'eau ultrapure, ajuster le pH à 7,4 |
| PBST (en) | PBS - 0,01% Triton X-100 |
| Tbs | Diluer Tris HCl [0,5 M] avec de l'eau ultrapure 1:10 [0,05 M], prendre 1 L de Tris HCl [0,05 M] et ajouter 8,75 g de NaCl |
| Tris HCl (en) | [0.5 M] 950 ml d'eau ultrapure, ajouter 78,8 g d'hydrochlorure tampon Tris (C4H11NO3Cl) ajuster le pH 8 et remplir jusqu'à 1 L |
Tableau 1 : Solutions utilisées pour l'immunostaining.
Discussion
Ce protocole peut être divisé en deux parties critiques : la qualité de la coloration et l'analyse. Si la coloration n'est pas optimale, elle ne représentera pas adéquatement les cellules microgliales, affectant ainsi la densité, la distribution et les mesures de morphologie. En outre, la proportion de cellules myéloïdes périphériques d'infiltration peut être sous-estimée. Il s'agit d'une version optimisée du protocole de coloration, mais il existe plusieurs facteurs qui peuvent entraîner des images sous-optimales. Même si la perfusion de l'animal n'est pas incluse dans ce protocole, si la fixation du cerveau n'est pas bien exécutée, la qualité de la coloration sera compromise. En outre, une perfusion suffisante est nécessaire pour assurer l'absence de macrophages à l'intérieur des vaisseaux sanguins qui peuvent interférer avec l'étude.
En ce qui concerne l'immunostaining, les détails les plus critiques incluent la qualité des tampons, l'étape de blocage, le stockage approprié des anticorps, et la manipulation d'échantillon de cerveau. La bonne préparation des tampons et leur stockage a une influence directe sur la qualité de la coloration. Sauf indication, certains tampons peuvent être stockés pendant de longues périodes, mais l'utilisation de tout tampon qui montre des signes de contamination doit être évitée. Si les tampons sont préparés des jours ou des semaines à l'avance, le pH de chaque solution avant utilisation doit être vérifié.
En outre, en ce qui concerne l'immunostaining, la présence de coloration de fond reste l'un des problèmes les plus communs. La coloration de fond le rend difficile d'analyser les microglies, en particulier leur morphologie, et donc de biaiser les résultats. Pour éviter l'arrière-plan, il est important que l'étape de blocage soit effectuée correctement. Les conditions de stockage des anticorps ont également des effets directs sur leur efficacité. Il est conseillé de suivre strictement les directives d'entreposage fournies par l'entreprise et d'éviter les cycles fréquents de décongélation et de congélation. Enfin, tout au long du processus, il est essentiel de prêter attention à l'intégrité physique des sections du cerveau. Il est important de faire preuve de prudence lors de chaque manipulation (changements de tampon, lavages et montage), surtout si l'expérimentateur n'est pas expérimenté avec cette procédure. Il est conseillé d'éviter de laisser les échantillons sans solution liquide lors du changement de solutions ou tampons, les solutions pour l'étape suivante doivent être prêts à verser dans le puits à l'avance. La plaque multi-puits doit être correctement scellée avec du film de paraffine pendant l'étape de nuit pour éviter l'évaporation qui peut conduire les échantillons à sécher.
L'analyse quantitative de la densité, de la distribution et de la morphologie microgliales présente plusieurs avantages par rapport aux rapports qualitatifs. Pour éviter les biais, le chercheur effectuant l'analyse doit être aveuglé par la condition expérimentale. Ainsi, il est suggéré d'avoir différentes personnes effectuer l'analyse et changer le nom des fichiers (tout en gardant les noms originaux et nouveaux dans une feuille de clé). Les nouveaux noms ne devraient pas avoir d'indices de la condition expérimentale. L'analyse complète peut être effectuée sur ces fichiers aveuglés, et l'identité d'image d'origine n'est révélée qu'après la compilation des données et avant l'analyse statistique. Bien que l'aveuglement soit déjà pratiqué par des chercheurs expérimentés, il reste des conseils précieux pour ceux qui effectuent ce type d'analyse pour la première fois.
Le contrôle de la région du cerveau se fait pendant la sélection de la section du cerveau et le traçage du retour sur investissement pendant l'analyse. Assurez-vous d'utiliser des sections de la même gamme de niveaux de Bregma à travers les animaux. Le même retour sur investissement devrait être utilisé pour les analyses de densité, de distribution et de morphologie. Pour les analyses de densité et de distribution, il est particulièrement important d'être précis lors de l'élaboration du retour sur investissement dans FIJI/Image J. L'utilisation d'un atlas cérébral est fortement recommandée pour la sélection des sections et le tracé du retour sur investissement. L'utilisation du DAPI facilite également l'identification des repères neuroanatomiques. Pour éviter la variance, il est recommandé de rejeter les microglies qui ne sont que partiellement situées dans le roi-ciel, car elles peuvent différer entre leur microenvironnement. Lors du marquage des microglies pour l'analyse de la densité, le canal DAPI peut être utilisé comme critère de sélection. En comptant uniquement les microglies qui contiennent des noyaux tachés de DAPI, toutes les microglies considérées sont dans le même plan, réduisant le biais personnel lors de la sélection.
Étant donné que les mesures pour le NND, l'indice d'espacement et l'analyse des grappes sont basées sur l'emplacement des points marquant les cellules individuelles, et que les distances sont calculées par FIJI/ImageJ, il est important d'être cohérent lors du placement de ces points. Assurez-vous de placer strictement les points au centre du corps cellulaire, qui est déterminé visuellement. En outre, la taille des points doit rester cohérente tout au long de l'analyse. Cela contribuera à une meilleure représentation de la répartition spatiale de la population microgliale. Pour l'analyse des grappes, 12 m ont été sélectionnés comme seuil de distance sur la base de nos analyses précédentes. Néanmoins, s'il y a quatre cellules différentes ou plus avec un NND inférieur à 12 m, toutes ces cellules pourraient prendre une partie d'un seul cluster ou représenter deux groupes de deux cellules. Cela a rendu nécessaire le retour aux images et de confirmer le nombre réel de clusters.
Contrairement à la densité et à la distribution, dans lesquelles le retour sur investissement est déterminé par des caractéristiques neuroanatomiques à l'aide d'un atlas cérébral, la sélection des cellules microgliales pour l'analyse de la morphologie est basée sur la capacité d'analyser la cellule. Toutes les cellules qui peuvent être analysées doivent être sélectionnées pour analyse dans une pile Z avant de passer à une autre pile Z pour éviter le biais de sélection. Les raisons d'exclure les cellules comprennent les problèmes liés à l'immunostaining ou à la coupe des tissus, au traitement (p. ex., déchirure) ou au montage (p. ex., formation de bulles). Idéalement, les sections du cerveau présentant de telles questions devraient être systématiquement exclues de l'imagerie et de l'analyse. Il est également important de noter que la coloration de TMEM119 et d'IBA1 ne montre pas un chevauchement de 100 %(figure 2A-C). Étant donné que TMEM119 ne permet pas la visualisation de la continuité des processus (ainsi que de l'IBA1), il est difficile d'évaluer où une cellule se termine et où une autre commence. Ainsi, l'analyse de la morphologie se fait à l'aide du canal IBA1. En outre, toutes les traces et les points doivent être enregistrés et visualisés pour la révision future, permettant d'accroître la transparence et la reproductibilité des résultats.
Ce protocole fournit des informations précieuses sur les microglies et les macrophages infiltrants. Parmi les exemples de ses applications, mentionnons la détection de signes de neuroinflammation par des changements dans les microglies dans différentes régions du cerveau, l'étude des effets anti-inflammatoires d'un composé et l'étude des facteurs qui interfèrent avec le bon fonctionnement des microglies. Considérant que ce protocole permet la détection des macrophages infiltrants dans le cerveau et la différenciation de ces cellules à partir de microglies, d'autres applications incluent: la détermination si le recrutement de macrophages se produit dans une insulte particulière ou avec l'utilisation d'autres techniques (c.-à-d. des outils génétiques), et la confirmation et l'étude des conséquences de l'absence de macrophages périphériques dans le cerveau lors de l'insulte. Gardez à l'esprit que la microscopie de fluorescence ne suffit pas à elle seule à confirmer l'infiltration à l'intérieur du parenchyme cérébral. Lorsque les cellules IBA1MD/TMEM119 sont observées près des ventricules ou de l'espace périvasculaire, des techniques de résolution spatiale plus élevée telles que la microscopie électronique sont nécessaires pour confirmer leur localisation dans le parenchyme. Bien que les changements dans la densité, la distribution et la morphologie soient de bons indicateurs des rôles microglial et macrophage, cette approche est plus puissante lorsqu'elle est combinée avec des investigations fonctionnelles.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Nous sommes reconnaissants à Nathalie Vernoux pour ses conseils et son aide dans les expériences. Nous tenons également à remercier les Drs Emmanuel Planel et Serge Rivest pour l'utilisation de leur fluorescence et de leurs microscopes confocals, respectivement. Ces travaux ont été financés en partie par des bourses du Conseil mexicain des sciences et de la technologie (CONACYT; à F.G.I),Fondation Famille-Choquette et Centre thématique de recherche en neurosciences (CTRN; à K.P.), Du Fonds de Recherche du Québec - Santé (à M.B.), et L'Institut indo-canadien Shastri (à K.B.), ainsi qu'une subvention de découverte du Conseil canadien de recherches en sciences naturelles et en génie (CRSNG) à M.E.T. M.E.T. est titulaire d'une chaire de recherche du Canada (niveau II) sur la plasticité neuroimmune en santé et en thérapie.
matériels
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 488 donkey anti-mouse | Invitrogen/Thermofisher | A21202 | |
| Alexa Fluor 568 goat anti-rabbit | Invitrogen/Thermofisher | A11011 | |
| Biolite 24 Well multidish | Thermo Fisher | 930186 | |
| Bovine serum albumin | EMD Millipore Corporation | 2930 | |
| Citric acid | Sigma-Aldrich | C0759-500G | |
| DAPI Nuceleic acid stain | Invitrogen/Thermofisher | MP 01306 | |
| Fine Brush | Art store | ||
| Fluoromount-G | Southern Biotech | 0100-01 | |
| Gelatin from coldwater fish skin | Sigma-Aldrich | G7765 | |
| Microscope coverglass | Fisher Scientific | 1254418 | |
| Microslides positively charged | VWR | 48311-703 | |
| Monoclonal mouse Anti-IBA1 | Millipore | MABN92 | |
| Na2H2PO4·H2O | BioShop Canada Inc. | SPM306, SPM400 | |
| Na2HPO4 | BioShop Canada Inc. | SPD307, SPD600 | |
| NaBH4 | Sigma-Aldrich | 480886 | |
| NaCl | Fisher Scientific | S642500 | |
| Normal donkey serum (NDS) | Jackson ImmunoResearch laboratories Inc. | 017-000-121 | |
| Normal goat serum (NGS) | Jackson ImmunoResearch laboratories Inc. | 005-000-121 | |
| Parafilm-M | Parafilm | PM-999 | |
| Rabbit monoclonal Anti-TMEM119 | Abcam | ab209064 | |
| Reciprocal Shaking bath model 25 | Precision Scientific | - | |
| Transfer pipette | |||
| Tris buffer hydrochloride | BioShop Canada Inc. | TRS002/TRS004 | |
| Triton-X-100 | Sigma-Aldrich | T8787 | |
| Tween 20 | Sigma-Aldrich | P7949-100ML |
Références
- Lawson, L. J., Perry, V. H., Dri, P., Gordon, S. Heterogeneity in the distribution and morphology of microglia in the normal adult mouse brain. Neuroscience. 39 (1), 151-170 (1990).
- Milior, G., et al. Fractalkine receptor deficiency impairs microglial and neuronal responsiveness to chronic stress. Brain, Behavior, and Immunity. 55, 114-125 (2016).
- Nimmerjahn, A., Kirchhoff, F., Helmchen, F. Resting Microglial Cells Are Highly Dynamic Surveillants of Brain Parenchyma in Vivo. Science. 308 (5726), 1314-1318 (2005).
- Hickman, S., Izzy, S., Sen, P., Morsett, L., Khoury, J. E. Microglia in neurodegeneration. Nature Neuroscience. 21 (10), 1359(2018).
- Tay, T. L., Savage, J. C., Hui, C. W., Bisht, K., Tremblay, M. È Microglia across the lifespan: from origin to function in brain development, plasticity and cognition. The Journal of Physiology. 595 (6), 1929-1945 (2017).
- Tremblay, M. È, Lowery, R. L., Majewska, A. K. Microglial Interactions with Synapses Are Modulated by Visual Experience. PLoS Biology. 8 (11), (2010).
- Jakovljevic, M., et al. Induction of NTPDase1/CD39 by Reactive Microglia and Macrophages Is Associated With the Functional State During EAE. Frontiers in Neuroscience. 13, (2019).
- Taylor, A. M. W., et al. Microglia Disrupt Mesolimbic Reward Circuitry in Chronic Pain. The Journal of Neuroscience. 35 (22), 8442-8450 (2015).
- Poliani, P. L., et al. TREM2 sustains microglial expansion during aging and response to demyelination. The Journal of Clinical Investigation. 125 (5), 2161-2170 (2015).
- Lu, S. M., et al. HIV-1 Tat-Induced Microgliosis and Synaptic Damage via Interactions between Peripheral and Central Myeloid Cells. PLoS ONE. 6 (9), e23915(2011).
- Rodríguez, J. J., et al. Increased densities of resting and activated microglia in the dentate gyrus follow senile plaque formation in the CA1 subfield of the hippocampus in the triple transgenic model of Alzheimer's disease. Neuroscience Letters. 552, 129-134 (2013).
- Rasmussen, S., et al. Persistent activation of microglia is associated with neuronal dysfunction of callosal projecting pathways and multiple sclerosis-like lesions in relapsing-remitting experimental autoimmune encephalomyelitis. Brain. 130 (11), 2816-2829 (2007).
- Walker, F. R., et al. Dynamic structural remodelling of microglia in health and disease: a review of the models, the signals and the mechanisms. Brain, Behavior, and Immunity. 37, 1-14 (2014).
- Ohsawa, K., Imai, Y., Kanazawa, H., Sasaki, Y., Kohsaka, S. Involvement of Iba1 in membrane ruffling and phagocytosis of macrophages/microglia. Journal of Cell Science. 113 (17), 3073-3084 (2000).
- Yamasaki, R., et al. Differential roles of microglia and monocytes in the inflamed central nervous system. Journal of Experimental Medicine. 211 (8), 1533-1549 (2014).
- Wohleb, E. S., et al. Peripheral innate immune challenge exaggerated microglia activation, increased the number of inflammatory CNS macrophages, and prolonged social withdrawal in socially defeated mice. Psychoneuroendocrinology. 37 (9), 1491-1505 (2012).
- Shemer, A., et al. Engrafted parenchymal brain macrophages differ from microglia in transcriptome, chromatin landscape and response to challenge. Nature Communications. 9, (2018).
- Geissmann, F., et al. Development of monocytes, macrophages and dendritic cells. Science (New York, N.Y). 327 (5966), 656-661 (2010).
- Minogue, A. M. Role of infiltrating monocytes/macrophages in acute and chronic neuroinflammation: Effects on cognition, learning and affective behaviour. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 79, 15-18 (2017).
- Ginhoux, F., et al. Fate Mapping Analysis Reveals That Adult Microglia Derive from Primitive Macrophages. Science (New York, N.Y). 330 (6005), 841-845 (2010).
- Kierdorf, K., et al. Microglia emerge from erythromyeloid precursors via Pu.1- and Irf8-dependent pathways. Nature Neuroscience. 16 (3), 273-280 (2013).
- Bennett, M. L., et al. New tools for studying microglia in the mouse and human CNS. Proceedings of the National Academy of Sciences of the United States of America. 113 (12), E1738-E1746 (2016).
- Mizutani, M., et al. The fractalkine receptor but not CCR2 is present on microglia from embryonic development throughout adulthood. Journal of Immunology. 188 (1), 29-36 (2012).
Erratum
Formal Correction: Erratum: Immunofluorescence Staining Using IBA1 and TMEM119 for Microglial Density, Morphology and Peripheral Myeloid Cell Infiltration Analysis in Mouse Brain
Posted by JoVE Editors on 10/12/2019. Citeable Link.
An erratum was issued for: Immunofluorescence Staining Using IBA1 and TMEM119 for Microglial Density, Morphology and Peripheral Myeloid Cell Infiltration Analysis in Mouse Brain. An author name was updated.
The name was corrected from:
Maude Bordelau
to:
Maude Bordeleau
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon