Method Article
Imunofluorescência Manchausando IBA1 e TMEM119 para densidade microglial, morfologia e análise periférica de infiltração de células mieloides no cérebro do rato
Neste Artigo
Erratum Notice
Resumo
Este protocolo descreve um fluxo de trabalho passo a passo para a costainização imunofluorescente de IBA1 e TMEM119, além da análise da densidade microglial, distribuição e morfologia, bem como infiltração periférica de células mieloides no tecido cerebral do rato.
Resumo
Este é um protocolo para a visualização dupla de microglia e infiltração de macrófagos no tecido cerebral do rato. TMEM119 (que rotula microglia seletivamente), quando combinado com IBA1 (que fornece uma visualização excepcional de sua morfologia), permite a investigação de mudanças na densidade, distribuição e morfologia. Quantificar esses parâmetros é importante para fornecer insights sobre os papéis exercidos pela microglia, os macrófagos residentes do cérebro. Em condições fisiológicas normais, a microglia é regularmente distribuída em um padrão semelhante ao mosaico e apresenta uma pequena soma com processos ramificados. No entanto, como resposta a fatores ambientais (ou seja, trauma, infecção, doença ou lesão), densidade microglial, distribuição e morfologia são alterados de várias maneiras, dependendo do insulto. Além disso, o método de coloração dupla descrito permite a visualização de macrófagos infiltrados no cérebro com base em sua expressão de IBA1 e sem colocalização com TMEM119. Esta abordagem permite assim a discriminação entre microglia e macrófagos infiltrados, que é necessário para fornecer insights funcionais sobre o seu envolvimento distinto na homeostase cerebral em vários contextos de saúde e doença. Este protocolo integra os resultados os mais atrasados na neuroimunologia que pertence à identificação de marcadores seletivos. Ele também serve como uma ferramenta útil para neuroimunologistas experientes e pesquisadores que procuram integrar a neuroimunologia em projetos.
Introdução
Se aguda ou crônica, neuroinflamação é fortemente influenciada pela microglia, os macrófagos residentes do cérebro. Visualizar a microglia através da imunocoloração é valioso para o estudo da neuroinflamação com o uso de microscopia de luz, uma técnica altamente acessível. Em condições homeostáticas, a microglia é normalmente distribuída em um padrão não sobreposto, semelhante a um mosaico. Eles exibem pequenas somas que estendem os processos ramificados1, que às vezes entram em contato uns com os outros2. Os processos microgliais ramified examinam dinamicamente o parenchyma do cérebro, interagindo com os neurônios, outras pilhas gliais, e vasos sanguíneos durante circunstâncias physiological normais3. Microglia são equipados com um arsenal de receptores que lhes permitem realizar tarefas imunológicas e responder a mudanças no meio do cérebro, a morte celular, ou a danos nos tecidos. Além disso, eles exercem funções fisiológicas fundamentais, nomeadamente na formação sináptica, manutenção e eliminação4,5.
Entre os marcadores disponíveis usados para estudar a microglia, a molécula de adaptação de ligação ionizada de cálcio 1 (IBA1) é uma das mais utilizadas. Iba1 é uma proteína de ligação ao cálcio que fornece visualização excepcional da morfologia microglial, incluindo processos distais finos, como confirmado pela microscopia eletrônica6. Esta ferramenta tem sido fundamental na caracterização da transformação microglial, anteriormente chamada de "ativação", em uma vasta gama de modelos de doenças animais7,8,9. Na presença de neuroinflamação, a resposta microglial inclui: microgliosis que é definido como um aumento na densidade celular, alterações na distribuição que às vezes resultam em agrupamento, ampliação do corpo celular, bem como espessamento e espessamento e encurtamento dos processos associados com formas mais ameboid10,11,12,13.
A imunomancha é limitada pela disponibilidade de anticorpos direcionados contra marcadores específicos. Importante, IBA1 é expressa por microglia, mas também por macrófagos periféricos que se infiltram no cérebro14. Enquanto a observação de células IBA1-positivas dentro do cérebro tornou-se um marcador de microglia neste campo de pesquisa, infiltração de macrófagos periféricos tem sido relatada várias condições, mesmo marginalmente no cérebro saudável15,16 17,18. Consequentemente, o uso do IBA1 por si só não permite a visualização seletiva da microglia. Além disso, macrófagos adotar características moleculares e morfológicas da microglia residente, uma vez que se infiltraram no cérebro, impedindo assim a diferenciação19. Isso representa um desafio ao investigar a função da microglia e infiltrar macrófagos.
Enquanto microglia e macrófagos periféricos têm origens distintas (por exemplo, a partir do saco de gema embrionária e medula óssea, respectivamente20,21), há um número crescente de achados indicando que as duas populações celulares exercem diferentes papéis no cérebro19. Assim, é crucial o uso de métodos que discriminem entre essas duas populações sem manipulações invasivas (ou seja, quimeras de medula óssea ou parabiose) que possam modular sua densidade, distribuição, morfologia e função. TMEM119 emergiu como um marcador específico da microglia em condições de saúde e doença22. Quando combinado com iba1, este marcador torna-se útil para diferenciar essas células de infiltrar macrófagos, que são TMEM119-negativo e IBA1-positivo. Embora seja regulada de desenvolvimento, o TMEM119 é expresso tão cedo quanto os dias pós-natais 3 (P3) e 6 (P6), aumentando constantemente até atingir os níveis adultos entre P10 e P1422. Iba1 é expresso tão cedo quanto o dia embrionário 10.5 (E10.5)23. O protocolo de rotulagem dupla proposto é, portanto, útil para estudar essas duas populações ao longo da vida pós-parto.
Este protocolo fornece um procedimento de imunocoloração passo a passo que permite a discriminação entre microglia e macrófagos periféricos. Também explica como realizar uma análise quantitativa da densidade microglial, distribuição e morfologia, bem como a análise da infiltração periférica de macrófagos. Embora a investigação de microglia e macrófagos periféricos seja útil por si só, este protocolo permite ainda a localização de foyers neuroinflamatórios; assim, também serve como uma plataforma para identificar regiões específicas para investigar, com o uso de técnicas complementares (ainda, mais demoradas e consumidoras de recursos).
Protocolo
Todos os procedimentos experimentais foram realizados de acordo com as diretrizes dos comitês institucionais de Ética Animal, em conformidade com o Conselho Canadense de Cuidados Com Animais e o Comitê de Cuidados Com Animais da Université Laval.
1. Imunomanchas
- Selecione três seções cerebrais de camundongos contendo a região de interesse (ROI) (ou seja, o hipocampo) com a ajuda de um atlas cerebral. Coloque as seções em uma placa de plástico multi-poço e cubra-os com 350 μL de soro soro direito de fosfato (PBS) (Tabela 1).
NOTA: Para obter resultados ideais, os cérebros devem ser perfundidos com paraformaldeído de 4% e cortados a uma espessura de 50 μm com vibratome. Para uma placa de 24 multi-poço, cada poço pode armazenar até seis seções. O volume recomendado de solução para cada poço é de 350 μL (para até três seções) e 500 μL para poços contendo seis seções. Para um maior número de seções, recomenda-se usar uma placa de 12 multi-poços. Certifique-se de que o volume selecionado de solução para cada poço cobre completamente o tecido e permite que as seções flutuem. Os volumes recomendados aplicam-se a todas as soluções utilizadas no resto do protocolo. - Lave as amostras cobrindo-as com 350 μL de PBS e deixe descansar colocando a placa multi-well sobre um abanador multiuso na temperatura ambiente (RT). Retire o PBS após 5 min e substituí-lo 5x com PBS fresco.
NOTA: Para remover as soluções, recomenda-se uma pipeta de transferência. Ao derramar em qualquer solução, certifique-se de colocar a ponta da pipeta contra a parede do poço para proteger a integridade do tecido. Também certifique-se de usar uma nova pipeta para cada nova solução. - Retire pbs e adicionar 350 μL de 10 mm tampão de citrato de sódio com pH = 6,0 (Tabela 1).
- Selar a placa multi-poço com filme de parafina e deixá-lo flutuar em um banho de água previamente pré-aquecido por 40 min a 70 °C.
- Deixe a placa multi-bem esfriar por aproximadamente 15 min.
- Retire o tampão de citrato de sódio e lave as seções em PBS como feito na etapa 1.2.
- Remover PBS e adicionar 350 μL de recém-feito 0,1% NaBH4 (Tabela 1)e deixe incubar por 30 min em RT.
- Retire a solução de 0,1% NaBH4 e lave as seções em PBS como feito na etapa 1.2.
- Remover PBS e adicionar tampão de bloqueio(Tabela 1)para 1 h no RT em cima de um shaker multiuso.
NOTA: Certifique-se de preparar volumes duplicados de buffer de bloqueio, pois a mesma solução será usada na próxima etapa. - Retire o tampão de bloqueio e substitua bloqueando o buffer contendo a mistura de anticorpos primários (1:150 mouse IBA1 + 1:300 TMEM119). Selar a placa com filme de parafina e deixá-lo incubar durante a noite em 4 °C.
- No dia seguinte, amostras quentes no RT por aproximadamente 15 min.
- Lave as seções 5x para 5 min cada em PBS com tritão (PBST) (Tabela 1).
- Retire PBST e adicione o amortecedor de bloqueio contendo a mistura de anticorpos secundários (1:300 burro anti-mouse Alexa 488 para IBA1; 1:300 cabra anti-coelho Alexa 568 para TMEM119) para 1,5 h em RT. A partir deste ponto em diante, proteger as amostras da luz.
- Remover o buffer de bloqueio e lavar as seções 5x como feito na etapa 1.2, exceto desta vez com PBST.
- Retire o PBST e adicione 4′,6-diamidino-2-phenylindole (DAPI) [1:20000] por 5 min na RT.
- Retire da DAPI e lave as seções 3x para 5 min cada em tampão de fosfato (PB).
- Monte as seções em uma lâmina do microscópio. Deixe-os secar enquanto protegido da luz.
- Quando seco, adicione algumas gotas de montagem fluorescência médio e cubra com um coverslip, evitando a formação da bolha.
NOTA: Guarde os slides enquanto protegido da luz, dentro de uma caixa de slides histológica, a 4 °C. As amostras podem ser preservadas por vários meses.
2. Imagem para análise de densidade e distribuição
- Com a ajuda de um microscópio de epifluorescência de campo largo, use uma baixa ampliação e o canal DAPI para localizar o ROI (ou seja, a região CA1 do hipocampo).
- Adquirir imagens em 20x, usando uma abertura numérica (NA) de 0,5, com o DAPI, 488 e 568 canais e filtros, com resolução de 0,3 μm/pixel. Capture uma imagem em mosaico cobrindo o ROI. Alternativamente, tire fotos individuais que serão costuradas em uma imagem maior.
NOTA: Uma imagem em mosaico é uma super imagem constituída por imagens menores. As imagens do mosaico são usadas geralmente para superar a área limitada do campo-de-vista de ampliações elevadas. Alguns softwares incluem uma função de mosaico; No entanto, as imagens também podem ser costuradas manualmente com outro software de edição de fotos, costurando as imagens individuais em um. Lembre-se de adicionar as informações em escala ao arquivo. Para este tipo de análise, recomenda-se ter pelo menos 300 células microgliais imagemdas por ROI/animal (correspondente a aproximadamente 10 a 15 imagens para o hipocampo, por exemplo), com um mínimo de cinco animais por condição experimental. A Figura 1A-C mostra as imagens da microglia co-rotulada. - Salve a imagem como um arquivo TIFF.
3. Imagem para análise de morfologia
- Usando um microscópio de iluminação confocal ou estruturado, use o canal DAPI para localizar o ROI em baixa ampliação.
- Usando um objetivo 40x (ou seja, óleo NA 1.4), localizar uma célula IBA1 +/TMEM119+ dentro do ROI. Enquanto a imagem ao vivo, mova-se no eixo Z. Assim que o sinal da microglia selecionada aleatoriamente desaparece, definir este nível Z como o início da pilha Z. Mova-se ao longo do eixo Z na direção oposta até que o sinal da microglia desapareça e definir esse ponto como o fim da pilha Z.
NOTA: Figura 2A-C mostra imagens de IBA1+/TMEM119+ microglia. - Crie uma pilha Z em todos os três canais (DAPI, 488, 568) usando um intervalo Z de 0,33 μm e tamanho de pixel de 0,15 μm/pixel. Adicione as informações em escala ao arquivo.
NOTA: O intervalo Z recomendado depende do poder de resolução do objetivo (por exemplo, para um objetivo 40x como o óleo NA 1.4, é de 0,33 μm). Para análise da morfologia, recomenda-se ter pelo menos 20 células por animal com um mínimo de cinco animais por condição experimental. - Guarde o arquivo como um arquivo TIFF.
4. Análise de densidade e distribuição
- Abra FIJI/ImageJ com o plugin de distância de vizinho mais próximo (NND) instalado. Abra a imagem 20x.
NOTA: Use um motor de busca com a palavra-chave "Cálculo de distâncias vizinho mais próximo com ImageJ" para encontrar as instruções de instalação. O autor do plugin é Yuxiong Mao. - Para definir a escala manualmente com base em uma escala impressa na imagem, selecione a ferramenta de linha reta(Figura 3E),coloque o cursor na borda da escala e, ao pressionar a chave de mudança, desenhe uma linha o mais próxima possível da escala na imagem (Figura 3I), selecione Analyze | Definir escala,em seguida, digite as informações corretas(Figura 3J).
NOTA: A escala às vezes pode ser contida nos metadados do arquivo e definida automaticamente. - Selecione a imagem | Cor | Faça composto para criar uma imagem composta de todos os canais.
NOTA: Durante a aquisição de imagem, FIJI/ImageJ criará automaticamente um composto no formato RGB. - Na barra do menu, selecione Analyze | Definir medidas. Check Area, Centroide Perímetro. Na guia Redirecionar para,clique e selecione o arquivo aberto(Figura 3K).
- Ir para a imagem | Cor | Ferramenta de canal para abrir a ferramenta do canal.
NOTA: Este menu permitirá que uma cor específica seja desativada. O canal DAPI pode ser útil para identificar ROI e confirmar as células. Ele pode ser desativado para facilitar a contagem. - Desenhe um perímetro áspero do ROI com a ferramenta de seleção à mão livre (Figura 3D).
- Habilite a ferramenta de pincel de seleção clicando duas vezes na ferramenta oval na barra de ferramentas e certifique-se de que a caixa de pincel de seleção habilitar seja verificada(Figura 3G). Esta ferramenta será usada para delinear o ROI com mais precisão. Selecione um tamanho apropriado da escova entre 200−400.
- Usando o pincel de seleção, ajuste o perímetro para melhor se adequar ao ROI. Pressione T no teclado para adicionar ao gerente roi(Figura 3L).
- Selecione A análise | Medir ou pressionar a chave M, e uma janela de resultados vai aparecer. Copiar e colar os resultados em uma folha de dados, em seguida, salvar as informações sobre a área (ou seja, a área do ROI; Figura 3R).
- Depois de copiar a área do ROI, apague as informações da janela de resultados clicando nela e pressionando a chave backspace.
- Vá para a janela do gerente roi(Figura 3L),clique direito no traço ROI, alterar o nome para coincidir com o nome da imagem, em seguida, salvar.
- Clique duas vezes na ferramenta de pincel na barra de ferramentas. Selecione a cor preta e um tamanho de escova de 10. Certifique-se de que a opção Pintura de sobreposição não é controlada(Figura 3H).
- No canal TMEM119, coloque cuidadosamente um pontilhado preto no centro o soma para cada microglia TMEM119+. Coloque um ponto branco no centro das células que não são positivos para TMEM119 (para marcar macrófagos infiltrados). Repita o mesmo procedimento para todas as células contidas no ROI.
NOTA: É importante que todos os pontos (preto e branco) estão localizados no mesmo canal. A identidade do canal pode ser verificada (vermelho, azul ou verde) olhando para a cor das etiquetas da janela de imagem. - Selecione a imagem | Cor | Canal dividido. Uma janela para cada canal aparecerá. Em seguida, identifique o canal que tem as anotações de pontitura e feche as outras duas janelas.
- Redirecione a nova imagem do canal dividido. Ir para analisar | Definir medidas. Na guia Redirecionar para,clique e selecione a imagem do canal dividido (Figura 3K).
- Selecione a imagem | Tipo | 8 bits. Ir para a imagem | Ajuste e selecione o limite (Figura 3O). Para ajustar o limite, deslize o botão da segunda barra, todo o caminho para a esquerda (valor limite = 0) em ambas as barras.
NOTA: Isso vai deixar apenas os pontões pretos na imagem, aparecendo branco. - Selecione o ROI na janela do gerente do ROI. Selecione A análise | Analise a partícula (Figura 3N). Em Tamanho (inch€2): escreva 1-20. Mantenha a unidade de pixels desmarcada, verifique o Display, resumie e adicione ao gerentee pressione ok. A janela sumária vai aparecer e dar o número de pontos(Figura 3P). Copiar e colar as informações para a folha de dados.
- Selecione Plugins | NND. A janela NND vai aparecer(Figura 3T). Copiar/colar todas as informações para a folha de dados. Cada número representa a distância que cada microglia tem para a microglia vizinha mais próxima.
- Volte para a janela limiar e deslize a primeira barra até a direita (valor limite = 255 em ambas as barras), o que deixará todos os pontos brancos visíveis, aparecendo branco(Figura 3M).
- Selecione A análise | Analise a partícula. A janela sumária que fornece o número de pontos vai aparecer(Figura 3P). Copiar e colar as informações para a folha de dados.
- Vá para o gerente roi selecionar todos os pontos, clique direito, e salvar com o nome da imagem. Isso permitirá a economia de todos os pontos em um arquivo zip (Figura 3L). Selecione arquivo | Economize como,e salve o arquivo com um nome que permita a identificação da imagem analisada.
- Obtenha a densidade de microglia (para cada imagem) dividindo o número de células iba1+/TMEM119+ duplamente positivas pela área do ROI.
NOTA: Os valores para cada imagem podem ser em média para cada animal. Os dados podem então ser apresentados como média ± erro padrão da média (SEM) de todos os animais. - Determine o NND obtendo uma média por imagem dos valores NND de todas as células TMEM119+.
NOTA: Os dados podem então ser apresentados como média ± SEM de todos os animais. - Calcule o índice de espaçamento usando a fórmula: NND2 x densidade.
NOTA: Os dados podem então ser apresentados como média ± SEM de todos os animais. As unidades para esta medida serão unidades arbitrárias. - Quantificar aglomerados microgliais, identificando células que têm um NND 12 μm.
NOTA: Aqui, 12 μm são selecionados, pois é a distância aproximada entre duas células microgliais diretamente justapondo tocando umas às outras com arborizações. Se houver mais de três microglia que atendam a essa condição, retorne à imagem e verifique se essas células fazem parte de um ou vários aglomerados. - Depois de confirmar o número de clusters, escreva o número de clusters na folha de dados.
NOTA: O número de aglomerados pode ser dividido pela área de ROI para obter a densidade de células/mm2 para cada animal. Os dados podem então ser apresentados como média ± SEM de todos os animais. - Para determinar a porcentagem de infiltração periférica de células mieloides, calcule o % das células IBA1+/TMEM119- sobre o número total de células mieloides (TMEM119+/IBA1+ + TMEM119-/IBA1+) para cada animal.
NOTA: Os dados podem então ser apresentados como média ± SEM de todos os animais.
5. Análise da morfologia
- Aberto FIJI/ ImageJ.
- Abra a imagem 40x usando imagem J ou FIJI. Selecione uma janela pop-up aparecerá perguntando se as imagens devem ser abertas em uma pilha. Clique OK. Em seguida, selecione Imagem | Pilhas | Z projeto para abrir a janela Z-Projeção. Inclua todas as fatias, do primeiro até a última fatia. Certifique-se de que a intensidade máxima seja selecionada em tipo projeçãoe clique em OK
- Clique na nova janela com o projeto Z. Selecione a imagem | Cores | Canais divididos. Conduza os traços nas imagens do canal IBA1.
NOTA: Os outros canais (TMEM119 e DAPI) podem ser mantidos abertos e consultados conforme necessário durante a análise de morfologia microglial. - Na barra do menu, selecione Analyze | Definir medidas. Confira a Área, Centroide Perímetro. Na guia Redirecionar para,selecione o arquivo aberto(Figura 3K).
- Defina a escala descrita nos passos 4.2.
- Para medir o tamanho soma no canal IBA1, desenhe um perímetro áspero do soma com a ferramenta de seleção à mão livre(Figura 3D).
- Habilite a ferramenta de pincel de seleção clicando duas vezes na ferramenta oval na barra de ferramentas, seguida por verificar habilitar a caixa de pincel de seleção (Figura 3G). Selecione um tamanho de escova de seleção entre 10-20(Figura 3B).
- Usando o pincel de seleção, ajuste o rastreamento para melhor se adequar ao soma. O zoom permitirá precisão durante esta etapa (Figura 2I).
- Pressione a chave T para adicionar o rastreamento soma para o gerente roi (Figura 3L).
- Selecione A análise | Medir ou pressionar a chave M. Uma janela de resultados aparecerá. Copiar e colar os resultados em uma folha de dados(Figura 3R).
- Para salvar as informações sobre a área soma, vá para a janela do gerente roi, clique à direita no ROI, alterar o nome para coincidir com o nome da imagem, especificar que o rastreamento é para soma, em seguida, salvar o arquivo.
- Para medir a área de arborização no canal IBA1, clique em uma extremidade do processo microglial com a ferramenta de seleção de polígono, que iniciará a forma do polígono(Figura 3C).
- Seguindo as dicas dos processos microgliais, vá ao redor da microglia clicando nas pontas de cada extremidade do processo para formar um polígono que melhor representa a área coberta pelas arborizações microgliais (Figura 2D−H).
NOTA: Certifique-se de que o polígono conecta todas as extremidades do processo microglial. As linhas que formam o polígono nunca devem se cruzar. Ao clicar em torno de uma ponta de processo microglial, tenha o cuidado de evitar cortar qualquer parte do processo. Às vezes é útil adicionar pontos extras para contornar um processo. O número de pontos que formam o polígono não está diretamente ligado ao número de processos distais e, portanto, não é relevante para o estudo. - Para fechar o polígono, clique no ponto de partida do polígono.
- Pressione a chave T para adicionar o rastreamento ao gerente roi(Figura 3L). Selecione A análise | Medir ou pressionar a chave M. Uma janela de resultados aparecerá. Copiar e colar os resultados em uma folha de dados(Figura 3R).
- Para salvar as informações sobre a área de arborização, vá para a janela do gerente do ROI, clique direito no ROI, altere o nome para combinar com o nome da imagem, especificar para arborização e, em seguida, salvar o arquivo.
- Determine a área soma em média todas as áreas soma para cada animal.
NOTA: Os dados podem ser apresentados como média ± SEM de todos os animais. - Determine a área de arborização em média todas as áreas de arborização para cada animal.
NOTA: Os dados podem ser apresentados como média ± SEM de todos os animais. - Calcule o índice de morfologia usando a área de fórmula soma/área de arborização para cada célula microglial e média por animal.
NOTA: Os dados podem ser apresentados como média ± SEM de todos os animais.
Resultados
A figura 1 mostra a co-rotulagem da microglia usando IBA1 e TMEM119 em uma seção coronal do hipocampo dorsal imaged em 20x pela microscopia da fluorescência. Uma coloração bem sucedida revela corpos de células microgliais e seus processos finos (Figura 1A-C). Esta coloração permite a determinação da densidade microglial e distribuição e identificação de aglomerados microgliais(Figura 1I)e macrófagos infiltrados (Figura 1F).
A Figura 2 mostra a microglia IBA1+/TMEM119+ microglia (Figura 2A-C)em um exemplo mato do procedimento de rastreamento de arborização microglial ( Figura2D-H),bem como um exemplo de rastreamento de corpo celular (Figura 2I ), ambos imaged em 40x pela microscopia confocal.

Figura 1: IBA1 e TMEM119 mancha dupla do tecido cerebral do rato para densidade, distribuição, agrupamento e análise periférica de infiltração de células mieloides. (A-C) Distribuição microglial típica no hipocampo de um rato adulto C57BL/6. (D-F) Microglia identificada como IBA1+/TMEM119+ e macrófago infiltrado identificado como IBA1+/TMEM119 (seta branca) na amígdala de um rato macho. (G-I) Conjunto de duas microglia (quadrado branco) no hipocampo de um rato. Clique aqui para ver uma versão maior deste número.
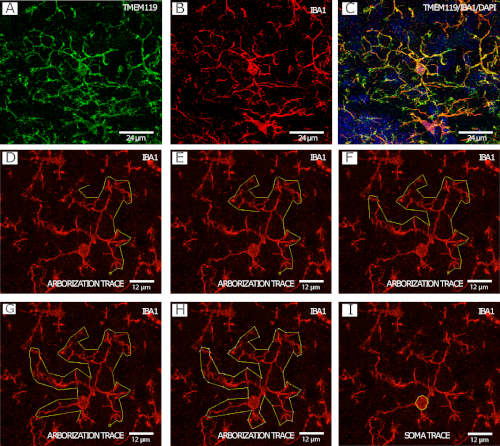
Figura 2: Mancha sumida IBA1 e TMEM119 para análise de morfologia microglial. (A-C) A Microglia. (D-I) Exemplo passo a passo de rastreamento de arborização com o canal IBA1 usando a ferramenta de polígono em FIJI/ImageJ. (J)Exemplo de microglia soma rastreamento com o canal IBA1 usando a ferramenta de seleção à mão livre em FIJI / ImageJ. Clique aqui para ver uma versão maior deste número.

Figura 3: INTERFACE FIJI/ImageJ e ferramentas para densidade microglial, distribuição, agrupamento, morfologia e análise periférica de infiltração de células mieloides. (A-R) Compilação de todas as ferramentas, menus e janelas utilizadas para as análises de densidade, cluster e morfologia. Clique aqui para ver uma versão maior deste número.
| Soluções | Preparação |
| Tampão de bloqueio | 0,5% gelatina + 5% soro de cabra natural + 5% de soro de burro natural + 0,01% Triton X-100 em TBS [0,05 M] |
| Tampão citrate | 1,92 g de ácido cítrico [10 mM], 500 μL de Tween 20 [0,05% (v/v)], 700 mL de água ultrapura, ajuste pH = 6,0 com NaOH [10 N], encher até 1 L com água ultrapura |
| NaBH 4 NaBH4 | [0,01% w/w] Disolve 0,01 g de NaBH4 em 10 mL de água ultrapura, a solução deve ser bem misturada. Esta solução cria bolha; liberar a pressão, abrindo a tampa após a mistura |
| Pb | [100 mM] Desresolver 23,48 g de Na2HPO4 e 4,8 g de NaH2PO4· H2O em 1 L de água ultrapura, em seguida, encher até 2 L, ajustar pH = 7,4 |
| Pbs | [50 mM] Desresolver 5,87 g de Na2HPO4, 1,2 g de NaH2PO4· H2O, 9 g de NaCl em 500 mL de água ultrapura, encha até 1 L com água ultrapura, ajuste pH = 7,4 |
| PBST PBST | PBS + 0,01% Triton X-100 |
| Tbs | Diluir Tris HCl [0,5 M] com água ultrapura 1:10 [0,05 M], tomar 1 L de Tris HCl [0,05 M] e adicionar 8,75 g de NaCl |
| Tris HCl Tris HCl | [0,5 M] 950 mL de água ultrapura, adicione 78,8 g de cloridrato de proteção Tris (C4H11NO3Cl) ajustar pH = 8 e encher até 1 L |
Tabela 1: Soluções utilizadas para imunocoloração.
Discussão
Este protocolo pode ser dividido em duas partes críticas: qualidade da coloração e análise. Se a coloração não for ideal, ela não representará adequadamente as células microgliais, afetando assim as medições de densidade, distribuição e morfologia. Além disso, a proporção de células mieloides periféricas de infiltração pode ser subestimada. Esta é uma versão otimizada do protocolo de coloração, mas existem vários fatores que podem resultar em imagens abaixo do ideal. Mesmo que a perfusão do animal não esteja incluída neste protocolo, se a fixação cerebral não for bem executada, a qualidade da coloração será comprometida. Além disso, é necessária perfusão suficiente para garantir a ausência de macrófagos dentro dos vasos sanguíneos que possam interferir com o estudo.
No que diz respeito à imunomancha, os detalhes mais críticos incluem a qualidade dos buffers, o bloqueio de etapas, o armazenamento adequado de anticorpos e o manuseio de amostras cerebrais. A preparação adequada dos amortecedores e do seu armazenamento tem uma influência directa na qualidade da coloração. A menos que especificado, alguns amortecedores podem ser armazenados por longos períodos, mas o uso de qualquer buffer que mostra sinais de contaminação deve ser evitado. Se os buffers forem preparados com dias ou semanas de antecedência, o pH de cada solução antes do uso deve ser verificado.
Além disso, em relação à imunocoloração, a presença de coloração em segundo plano continua sendo um dos problemas mais comuns. Coloração de fundo torna difícil analisar microglia, especialmente a sua morfologia, e, portanto, irá influenciar os resultados. Para evitar o contexto, é importante que a etapa de bloqueio seja feita corretamente. As condições de armazenamento dos anticorpos também têm efeitos diretos sobre a sua eficácia. É aconselhável seguir rigorosamente as diretrizes de armazenamento fornecidas pela empresa, bem como evitar ciclos frequentes de congelamento de descongelamento. Finalmente, durante todo o processo, é fundamental prestar atenção à integridade física das seções cerebrais. É importante ter cuidado durante cada manipulação (alterações tampão, lavares e montagem), especialmente se o experimentador não é experimentado com este procedimento. É aconselhável evitar deixar as amostras sem qualquer solução líquida ao mudar soluções ou amortecedores, as soluções para a etapa subsequente devem estar prontas para derramar no poço de antemão. A placa multi-bem deve ser selada corretamente com película da parafina durante a etapa de noite para evitar a evaporação que pode conduzir as amostras secar.
A análise quantitativa da densidade microglial, distribuição e morfologia tem várias vantagens em relação aos relatórios qualitativos. Para evitar viés, o pesquisador que realiza a análise deve ser cegado para a condição experimental. Assim, sugere-se que pessoas diferentes realizem a análise e alterem o nome dos arquivos (mantendo os nomes originais e novos em uma folha de chave). Os novos nomes não devem ter indícios da condição experimental. Toda a análise pode ser feita nesses arquivos cegos, e a identidade de imagem original é revelada somente após a compilação de dados e antes da análise estatística. Embora a cegueira já seja praticada por pesquisadores experientes, continua a ser um conselho valioso para aqueles que realizam esse tipo de análise pela primeira vez.
Controlar a região do cérebro é feito durante a seleção da seção cerebral e rastreamento do ROI durante a análise. Certifique-se de usar seções da mesma gama de níveis de Bregma em todos os animais. O mesmo ROI deve ser usado para as análises de densidade, distribuição e morfologia. Para análises de densidade e distribuição, é particularmente importante ser preciso ao desenhar o ROI em FIJI/Image J. O uso de um atlas cerebral é fortemente recomendado para seleção de seção e rastreamento de ROI. O uso do DAPI também facilita a identificação de marcos neuroanatômicos. Para evitar a variação, recomenda-se rejeitar a microglia que está apenas parcialmente localizada no ROI, pois podem diferir entre seu microambiente. Ao marcar microglia para análise de densidade, o canal DAPI pode ser usado como critério de seleção. Contando apenas microglia que contêm núcleos manchados de DAPI, todos considerados microglia estão no mesmo plano, reduzindo o viés pessoal durante a seleção.
Como as medições para o NND, o índice de espaçamento e a análise de cluster são baseados nos locais dos pontos que marcam células individuais e, uma vez que as distâncias são calculadas por FIJI/ImageJ, é importante ser consistente ao colocar esses pontos. Certifique-se de colocar estritamente os pontões no centro do corpo celular, que é determinado visualmente. Além disso, o tamanho dos pontões deve permanecer consistente ao longo da análise. Isso contribuirá para uma melhor representação da distribuição espacial da população microglial. Para análise de cluster, 12 μm foram selecionados como um limiar de distância com base em nossas análises anteriores. No entanto, se houver quatro ou mais células diferentes com um NND abaixo de 12 μm, todas essas células podem participar de um único aglomerado ou representar dois aglomerados de duas células. Isso tornou necessário retornar às imagens e confirmar o número real de clusters.
Ao contrário da densidade e distribuição, em que o ROI é determinado por características neuroanatômicas usando um atlas cerebral, a seleção de células microgliais para análise de morfologia é baseada na capacidade de analisar a célula. Todas as células que podem ser analisadas devem ser selecionadas para análise em uma pilha Z antes de se mudar para outra pilha Z para evitar viés de seleção. As razões para excluir células incluem problemas com a imunocoloração ou corte de tecidos, processamento (por exemplo, rasgos) ou montagem (por exemplo, formação de bolhas). Idealmente, as seções cerebrais com tais problemas devem ser sistematicamente excluídas da imagem e análise. Também é importante notar que a coloração para TMEM119 e IBA1 não mostra 100% de sobreposição(Figura 2A-C). Como o TMEM119 não permite a visualização da continuidade do processo (assim como o IBA1), isso dificulta a avaliação de onde uma célula termina e onde outra começa. Assim, a análise da morfologia é feita através do canal IBA1. Além disso, todos os traços e pontiriscos devem ser salvos e visualizados para revisão futura, permitindo aumentar a transparência e a reprodutibilidade dos resultados.
Este protocolo fornece informações valiosas sobre microglia e macrófagos infiltrados. Exemplos de suas aplicações incluem a detecção de sinais de neuroinflamação através de alterações na microglia em diferentes regiões do cérebro, estudando os efeitos anti-inflamatórios de um composto, e estudar fatores que interferem com a função adequada da microglia. Considerando que este protocolo permite a detecção de macrófagos infiltrados no cérebro e diferenciação dessas células da microglia, aplicações adicionais incluem: determinação se o recrutamento de macrófagos ocorre em um insulto particular ou com o uso de outras técnicas (ou seja, ferramentas genéticas), e confirmando e estudando as conseqüências da ausência de macrófagos periféricos no cérebro durante o insulto. Tenha em mente que a microscopia de fluorescência por si só não é suficiente para confirmar a infiltração dentro do parenchyma cerebral. Quando iba1+/tmem119- células são observadas perto dos ventrículos ou espaço perivascular, técnicas de maior resolução espacial, como microscopia eletrônica são necessárias para confirmar sua localização dentro do parenchyma. Embora as mudanças na densidade, distribuição e morfologia sejam bons indicadores de funções microgliais e macrófagos, essa abordagem é mais poderosa quando combinada com investigações funcionais.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Somos gratos a Nathalie Vernoux por sua orientação e assistência com os experimentos. Gostaríamos também de agradecer aos Drs. Emmanuel Planel e Serge Rivest pelo uso de sua fluorescência e microscópios confocais, respectivamente. Este trabalho foi parcialmente financiado por bolsas de estudo do Conselho Mexicano de Ciência e Tecnologia (CONACYT; a F.G.I), Fondation Famille-Choquette e Centre thématique de recherche en neurosciences (CTRN; to K.P.), Fonds de Recherche du Québec - Santé (a M.B.), e Shastri Indo-Canadian Institute (a K.B.), bem como uma concessão discovery do Natural Sciences and Engineering Research Council of Canada (NSERC) para M.E.T. M.E.T. detém uma cadeira de pesquisa do Canadá (Nível II) de Plasticidade Neuroimune em Saúde e Terapia.
Materiais
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 488 donkey anti-mouse | Invitrogen/Thermofisher | A21202 | |
| Alexa Fluor 568 goat anti-rabbit | Invitrogen/Thermofisher | A11011 | |
| Biolite 24 Well multidish | Thermo Fisher | 930186 | |
| Bovine serum albumin | EMD Millipore Corporation | 2930 | |
| Citric acid | Sigma-Aldrich | C0759-500G | |
| DAPI Nuceleic acid stain | Invitrogen/Thermofisher | MP 01306 | |
| Fine Brush | Art store | ||
| Fluoromount-G | Southern Biotech | 0100-01 | |
| Gelatin from coldwater fish skin | Sigma-Aldrich | G7765 | |
| Microscope coverglass | Fisher Scientific | 1254418 | |
| Microslides positively charged | VWR | 48311-703 | |
| Monoclonal mouse Anti-IBA1 | Millipore | MABN92 | |
| Na2H2PO4·H2O | BioShop Canada Inc. | SPM306, SPM400 | |
| Na2HPO4 | BioShop Canada Inc. | SPD307, SPD600 | |
| NaBH4 | Sigma-Aldrich | 480886 | |
| NaCl | Fisher Scientific | S642500 | |
| Normal donkey serum (NDS) | Jackson ImmunoResearch laboratories Inc. | 017-000-121 | |
| Normal goat serum (NGS) | Jackson ImmunoResearch laboratories Inc. | 005-000-121 | |
| Parafilm-M | Parafilm | PM-999 | |
| Rabbit monoclonal Anti-TMEM119 | Abcam | ab209064 | |
| Reciprocal Shaking bath model 25 | Precision Scientific | - | |
| Transfer pipette | |||
| Tris buffer hydrochloride | BioShop Canada Inc. | TRS002/TRS004 | |
| Triton-X-100 | Sigma-Aldrich | T8787 | |
| Tween 20 | Sigma-Aldrich | P7949-100ML |
Referências
- Lawson, L. J., Perry, V. H., Dri, P., Gordon, S. Heterogeneity in the distribution and morphology of microglia in the normal adult mouse brain. Neuroscience. 39 (1), 151-170 (1990).
- Milior, G., et al. Fractalkine receptor deficiency impairs microglial and neuronal responsiveness to chronic stress. Brain, Behavior, and Immunity. 55, 114-125 (2016).
- Nimmerjahn, A., Kirchhoff, F., Helmchen, F. Resting Microglial Cells Are Highly Dynamic Surveillants of Brain Parenchyma in Vivo. Science. 308 (5726), 1314-1318 (2005).
- Hickman, S., Izzy, S., Sen, P., Morsett, L., Khoury, J. E. Microglia in neurodegeneration. Nature Neuroscience. 21 (10), 1359(2018).
- Tay, T. L., Savage, J. C., Hui, C. W., Bisht, K., Tremblay, M. È Microglia across the lifespan: from origin to function in brain development, plasticity and cognition. The Journal of Physiology. 595 (6), 1929-1945 (2017).
- Tremblay, M. È, Lowery, R. L., Majewska, A. K. Microglial Interactions with Synapses Are Modulated by Visual Experience. PLoS Biology. 8 (11), (2010).
- Jakovljevic, M., et al. Induction of NTPDase1/CD39 by Reactive Microglia and Macrophages Is Associated With the Functional State During EAE. Frontiers in Neuroscience. 13, (2019).
- Taylor, A. M. W., et al. Microglia Disrupt Mesolimbic Reward Circuitry in Chronic Pain. The Journal of Neuroscience. 35 (22), 8442-8450 (2015).
- Poliani, P. L., et al. TREM2 sustains microglial expansion during aging and response to demyelination. The Journal of Clinical Investigation. 125 (5), 2161-2170 (2015).
- Lu, S. M., et al. HIV-1 Tat-Induced Microgliosis and Synaptic Damage via Interactions between Peripheral and Central Myeloid Cells. PLoS ONE. 6 (9), e23915(2011).
- Rodríguez, J. J., et al. Increased densities of resting and activated microglia in the dentate gyrus follow senile plaque formation in the CA1 subfield of the hippocampus in the triple transgenic model of Alzheimer's disease. Neuroscience Letters. 552, 129-134 (2013).
- Rasmussen, S., et al. Persistent activation of microglia is associated with neuronal dysfunction of callosal projecting pathways and multiple sclerosis-like lesions in relapsing-remitting experimental autoimmune encephalomyelitis. Brain. 130 (11), 2816-2829 (2007).
- Walker, F. R., et al. Dynamic structural remodelling of microglia in health and disease: a review of the models, the signals and the mechanisms. Brain, Behavior, and Immunity. 37, 1-14 (2014).
- Ohsawa, K., Imai, Y., Kanazawa, H., Sasaki, Y., Kohsaka, S. Involvement of Iba1 in membrane ruffling and phagocytosis of macrophages/microglia. Journal of Cell Science. 113 (17), 3073-3084 (2000).
- Yamasaki, R., et al. Differential roles of microglia and monocytes in the inflamed central nervous system. Journal of Experimental Medicine. 211 (8), 1533-1549 (2014).
- Wohleb, E. S., et al. Peripheral innate immune challenge exaggerated microglia activation, increased the number of inflammatory CNS macrophages, and prolonged social withdrawal in socially defeated mice. Psychoneuroendocrinology. 37 (9), 1491-1505 (2012).
- Shemer, A., et al. Engrafted parenchymal brain macrophages differ from microglia in transcriptome, chromatin landscape and response to challenge. Nature Communications. 9, (2018).
- Geissmann, F., et al. Development of monocytes, macrophages and dendritic cells. Science (New York, N.Y). 327 (5966), 656-661 (2010).
- Minogue, A. M. Role of infiltrating monocytes/macrophages in acute and chronic neuroinflammation: Effects on cognition, learning and affective behaviour. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 79, 15-18 (2017).
- Ginhoux, F., et al. Fate Mapping Analysis Reveals That Adult Microglia Derive from Primitive Macrophages. Science (New York, N.Y). 330 (6005), 841-845 (2010).
- Kierdorf, K., et al. Microglia emerge from erythromyeloid precursors via Pu.1- and Irf8-dependent pathways. Nature Neuroscience. 16 (3), 273-280 (2013).
- Bennett, M. L., et al. New tools for studying microglia in the mouse and human CNS. Proceedings of the National Academy of Sciences of the United States of America. 113 (12), E1738-E1746 (2016).
- Mizutani, M., et al. The fractalkine receptor but not CCR2 is present on microglia from embryonic development throughout adulthood. Journal of Immunology. 188 (1), 29-36 (2012).
Erratum
Formal Correction: Erratum: Immunofluorescence Staining Using IBA1 and TMEM119 for Microglial Density, Morphology and Peripheral Myeloid Cell Infiltration Analysis in Mouse Brain
Posted by JoVE Editors on 10/12/2019. Citeable Link.
An erratum was issued for: Immunofluorescence Staining Using IBA1 and TMEM119 for Microglial Density, Morphology and Peripheral Myeloid Cell Infiltration Analysis in Mouse Brain. An author name was updated.
The name was corrected from:
Maude Bordelau
to:
Maude Bordeleau
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados