Method Article
Sığır Diz Eksbitkilerinde Kıkırdak Remodeling Ex Vivo Doku Kültür Modeli
Bu Makalede
Özet
Burada, büyükbaş dizleri kıkırdak eksültasyonunun izole edilmesi ve kültürlenmesini açıklayan bir protokol salıyoruz. Bu yöntem, eklemi hedefleyen biyolojik uyaranlara veya yeni terapötiklere yanıt olarak doku değişikliklerini tanımlamak için kolay ve erişilebilir bir araç sağlar.
Özet
Ex vivo kültür sistemleri, doğal bir ortamda doku ve hücresel fonksiyon eğitimine adanmış çok çeşitli deneyleri kapsar. Kıkırdak sinovyal eklemin düzgün çalışması için önemli benzersiz bir dokudur ve proteoglikan ve tip II kollajen açısından zengin yoğun bir ekstrasellüler matriks (ECM) tarafından oluşturulmuştur. Kondrositler kıkırdak içinde bulunan tek hücre tipidir ve yaygın ve sayıları nispeten düşüktür. Değiştirilmiş dış uyaranlar ve hücresel sinyalizasyon ECM bileşiminde değişikliklere ve bozulmaya yol açabilir, osteoartrit gibi hastalıklarda önemli patolojik özellikleri olan (OA) ve romatoid artrit.
Ex vivo kıkırdak modelleri izin 1) kıkırdak doku ciro kondrosit aracılı değişiklikler profilleme, 2) kıkırdak ECM kompozisyongörselleştirme, ve 3) doku da doğrudan kondrosit rearrangement. Bu değişikliklerin uyaranlara veya tedavilere yanıt olarak profilleilmesi kıkırdak biyolojisinin çeşitli yönlerinde yüksek öneme sahiptir ve izole kondrositlerde in vitro deneyleri veya deneysel koşulların olduğu canlı hayvanlarda daha karmaşık modellerde in vitro deneyleri tamamlamaktadır. kontrol etmek daha zordur.
Kıkırdak eksperleri, kontrol edilebilir ortamlarda kıkırdak ECM doku remodeling değerlendirmek için bir çeviri ve kolay erişilebilir bir yöntem salar. Burada canlı büyükbaş kıkırdak ekskbitkileri izole etmek ve kültüre etmek için bir protokol uyguluyoruz. Yöntem kolayca yerel kasaplık erişilebilir sığır diz, doku kullanır. Doku cirosu, ECM bileşimi ve kondrosit fonksiyonunu araştırmak için hem ekskbitkiler hem de şartlı kültür ortamı analiz edilerek ECM modülasyonu profillenebilmiştir.
Giriş
Kondrositler kıkırdak matrisini üretir ve korurlar. Kondrositlerin biyolojisini ve onların ve çevredeki ECM'nin dış uyaranlara nasıl tepki verdiğini incelemek için, onları yerelortam1,2'desorgulamak çok önemlidir. Kıkırdak doku cirosunun incelenmesi, şu anda tedaviyi değiştiren bir hastalık bulunmayan OA gibi eklem hastalıklarında altta yatan mekanizmaların anlaşılmasını sağlamak açısından önemlidir. Sonuç olarak, daha iyi çevirimodelleri2 için önemli bir ihtiyaç vardır.
Hücre ve doku etkilerinin ex vivo karakterizasyonu kondrosit monolayer kültürler gibi in vitro, ve in vivo, cerrahi kaynaklı OA modelleri veya otoimmün kollajen kaynaklı artrit modeli (CIA) gibi diğer preklinik modelleri tamamlamak için gereklidir ). Çok sayıda çalışma hücrelerin 2D monolayer kültürlerde ve 3D yapılarda veya kendi doğal doku3,4nasıl davranışlarını arasındaki farkları vurgulamıştır. 2D tabakalardaki birçok hücre, hücre polaritesi ve doku eki farklılıkları da dahil olmak üzere doğal olmayan morfolojileri benimseyerek, doğal dokulardaki hücrelerde hem görsel hem de fonksiyonel farklılıklara yol açar5. Farklılıklar da hücrelerin işlevselliği belirgindir, hangi protein ekspresyonu kayması olabilir, derinden değişmiş farklılaşma desenleri yol, düzenleyici makine, ve hücre işlevselliği5,6,7 ,8.
Kıkırdak ECM bir matris çerçeve sağlayan tip II kollajen esas oluşur, ve aggrecan, doku içinde sıvı tutmaya yardımcı olan bir proteoglikan. Kollajen tip IV, VI, IX, X, XI, XII, fibronektin, kıkırdak oligomerik protein (COMP), biglycan, decorin ve perlecan gibi diğer matris molekülleri de mevcut9.
OA etiyolojisi belirsiz kalırken10,11, hastalığın başlangıcı doku ciro ve onarım süreçlerinde dengesizlikler neden olduğuna inanılmaktadır12,13. Eklem kıkırdağının bozulması OA'nın bir özelliğidir. Kıkırdak yerleşik kondrositler veya çevre dokularda hücreler sitokin salınımını artırmak, matris metalloproteinazlar gibi proteinlerin yüksek üretimini uyarıcı (MDP) ve aggrecanases, kıkırdak ECM bozulmasını artırmak 14. Bu bozulma, serum, idrar veya kültür ortamı15'teölçülebilen neo-epitoponlar adı verilen küçük benzersiz protein parçalarının salınımına neden olur. Kollajen oluşumu ve olgunlaşması üzerine, sözde profragments da serbest bırakılır; bu matris üretiminin bir ölçüsü olarak ölçülebilir16.
Bu protokolün amacı, stimülasyon ve/veya ilaç tedavisinin ECM doku cirosu üzerindeki etkisini karşılaştırmak için bir ex vivo kıkırdak modeli oluşturmaktır. Kıkırdak cirosu, elisa: AGNx1 (agrega aktivitesini yansıtan), C2M (matriks MMP aktivitesini yansıtan) ve ProC2 (tip II kollajeni yansıtan) kullanılarak doğrudan şartlı kültür ortamında matris kaynaklı neo-epitop biyobelirteçlerin ölçülmesiyle profillenir. oluşumu). Bulgular, ecm histolojik boyama ile doğrulanabilir, aynı zamanda bireysel ekstremite kondrosit organizasyonu görselleştirir. Açıklanan protokol kondrosit fonksiyonu ve kıkırdak ECM ciro üzerinde yeni tedavilerin etkisini test etmek için kullanılabilir. Bir dizi çalışmada, nicel histolojik veya immünhistokimyasal yaklaşımlar, mRNA, protein ekspresyonu veya proteomik ler kullanılarak biyolojik süreçleri veya müdahalenin sitokin-meydan lı ekstremiteler üzerindeki etkisini tanımlamak için kıkırdak eksplorleri kullanılmıştır2 ,17,18. Ancak, bu protokoller geçerli makalenin kapsamı dışındadır.
Protokol
1. Doku izolasyonu
- Doku kaynak
- Bir aseptik ortamda bir laminar akış başlık dışında tüm doku kaynak bölümü gerçekleştirin.
- Yerel mezbaha dan, 1.5 ve 2 yaş ları arasında buzağılardan bütün bir taze sığır tibiofemoral diz eklemi elde.
- Yavaşça ilk aşırı eti kaldırarak buzağı diz incelemek, konisileler ortaya, menisküs, tendin, ve sinovyal membran. Tendonu ve sinovyal membranı keserek eklemin parçalanmasına izin verin. Femoral kondiles ortaya çıkarmak için menisküs çıkarın.
- 3 mm biyopsi zımba layıcı kullanarak femoral konilerin yük taşıyan alanından ekskbitkileri izole edin ve subkondral kemiğe paralel ve subkondral kemiğe mümkün olduğunca yakın bir neşterle keserek eklem yüzeyinden serbest bırakın. Subkondral kemiğin sert yapısı eksektirlerin kalsifiye matris içermemesini sağlamalıdır. Tek tip yüksekliği ile explants için çalışıyoruz.
- Explants'i hemen DMEM/F12- GlutaMAX + %1 P/S kültür ortamında 50 mL'lik bir tüpveya Petri kabında saklayın ve karıştırın. Farklı dizlerinden ekseforları karıştırmayın ama her çalışma için ayrı tutun.
- Doku culturing
- Bir laminar akış kaputunda steril 96-iyi plaka eksplants aktarın.
- Ekspertizleri kültür ortamında veya PBS'de 3 kez yıkayın ve deney başlayana kadar her kuyuda 200 μL kültür ortamında kültürleyin. Biyopsi hücresel aktivite ve pasif biyomarker salınımını senkronize etmek için 1 günlük bir yıkama süresi kullanın.
- Kültür% 5 CO2ile 37 ° C inkübatör 10 haftaya kadar explants . Buharlaşmanın neden olduğu varyasyonu en aza indirmek için her grup taki tüm kopyaları çapraz olarak kültür plakasına yerleştirin. Supernatant buharlaşmasını önlemek için, kültür plakasının dış kuyularına PBS ekleyin.
2. Büyükbaş kıkırdak eksplant tedavisi ve metabolik aktivitenin değerlendirilmesi
- Kültür orta değişim ve tedavi
- Laminar akış kaputunda her 2-3 günde bir kültür ortamını değiştirin.
- Herhangi bir tedavi uyguluyorsanız, ortamı değiştirmeden önce bunları hazırlayın. Kültür ortamında seyreltme ile eksplant kuyularında istenen konsantrasyona tedavileri hazırlayın.
- Yavaşça her kuyudan supernatant çıkarın ve yeni bir 96 kuyu plaka aktarın. Doku cirosu ve protein ekspresyonunun biyomarker analizi için mühürleme bandı ile süpernatantı −20 °C'de saklayın.
- Hemen taze kültür orta veya tedavi kuyu başına 200 μL ekleyin. Eksplants orta değişim sırasında kurumasını izin vermeyin ve tüm ekstenler tamamen yeni ortamda batırılmış olduğundan emin olun.
- Resazurin boyama
- Hücre canlılığının dolaylı bir ölçümü olarak metabolik aktiviteyi haftada bir kez ölçün. Resazurin testi, eksplantların metabolik aktivitesinin hücre ölümü veya hücresel değişiklikler nedeniyle bireysel ekstryen için bozulursa değerlendirmek için kolay bir yoldur. Sadece kültür ortamındaki eksperler deney dönemi boyunca nispeten kararlı bir resazurin okumalarına sahiptir.
- % 10 resazurin ile kültür ortamı bir çözüm olun.
- Adım 2.1.3'te açıklandığı gibi supernatant hasat.
- Eksplanları 37 °C'de 3 saat veya süpernatantlar mora dönüşene kadar %10 resazurin çözeltisi içine batırın. Arka plan kontrolleri olarak explants olmadan 4 kuyu ekleyin.
- Şartlı ve arka plan kontrol resazurin çözeltisini siyah mikrotiter plakaya aktarın ve 540 nm uyarma/590 nm emisyonda floresan'ı ölçün.
- Kültür orta veya PBS iyice 3 kez yıkayın ve resazurin tamamen dağıtmak için izin 5-10 dakika boyunca yıkama ortamı ekspesleri batırın. Yeni kültür ortamı veya kullanılırsa tedaviler ekleyin.
3. Sonlandırma, fiksasyon ve numune depolama
- Kültür süresinin sona ermesi
- 2.2. adımda açıklandığı gibi metabolik aktiviteyi ölçün. Kuyu başına 200 μL PBS ekleyin.
- Fiksasyon ve depolama
- PBS çıkarın, iyi başına formaldehit 200 μL ekleyin ve oda sıcaklığında 2 saat bekletin.
- Formaldehitatın ve kuyu başına 200 μL PBS ekleyin. Plakayı sızdırmazbantla kapatın ve histokimyasal analiz için 4 °C'de saklayın. Histokimyasal analizini 3 ay içinde yapmanızı öneririz.
4. Doku ciro biyobelirteçleri (ELISA)
- Dolaylı rekabet ELISA'lar
- Coat bir streptavidin-plaka özel biyotinylated asay hedef-peptid ile 1:100 ispat tampon (iyi başına 100 μL) için 30 dakika 20 °C seyreltilmiş.
- Standart yıkama tamponu ile 5 kez yıkayın ve numune-supernatant (kuyu başına 20 μL) ile birlikte proc2 için 1:93.3 seyreltilmiş ve 1:100 AGNx1 için test tamponunda seyreltilmiş test hedef-peptid karşı birincil monoklonal antikor ile birlikte ekleyin (iyi başına 100 μL) ve 20 °C'de 2 saat için kuluçka AGNx1 için 20 °C'de ProC2 ve 3 saat için sallayarak.
NOT: Örnek hacmi doğrudan depolanan supernatant plakalardan alınır. Ölçülen konsantrasyon, titreşme aralığının dışındaysa, PBS veya sayma tamponundaki v-dipli seyreltme plakasında ki süpernatantı seyreltin. - Standart yıkama tamponu ile 5 kez yıkayın ve peroksidaz etiketli ikincil antikor ile 1:100'de 20 °C'de 1 saat boyunca test sonucu (kuyu başına 100°L) seyreltin.
- Standart yıkama tamponu ile 5 kez yıkayın ve 20 °C'de karanlıkta 15 dakika sallayarak peroksidaz substrat (kuyu başına 100 μL) olarak tetrametilbenzidin (TMB) ile yıkayın.
- Reaksiyonu standart durdurma çözeltisi olan 0,1 M H2SO4 (kuyu başına 100°L) ile sonlayın.
- Standart bir laboratuvar plakası okuyucusunda 650 nm'de referans emicilik kullanarak 450 nm emici renklendirici reaksiyonu okuyun.
- Supernatant kıkırdak doku ciroölçümü için Doğrudan Rekabetçi ELISAs
NOT: Bu C2M ölçer.- Coat bir streptavidin plakası ile spesifik biyotinylated asay hedef-peptid 20 °C'de 30 dakika boyunca 1:100'ü ispret tamponunda (kuyu başına 100°L) seyreltilmiş.
- Yıkama tamponu ile 5 kez yıkayın ve numune-supernatant ile birlikte 100 μL peroksidaz etiketli monoklonal antikor ile test hedef-peptid 1:100 test sonucu test (kuyu başına 20 μL) karşı ekleyin. 2-8 °C'de 20 saat boyunca titreyerek kuluçkaya yatın.
NOT: Örnek hacmi doğrudan depolanan supernatant plakalardan alınır. Ölçülen konsantrasyon, titreşme aralığının dışındaysa, PBS veya sayma tamponundaki v-dipli seyreltme plakasında ki süpernatantı seyreltin. - Standart yıkama tamponu ile 5 kez yıkayın ve 20 °C'de karanlıkta 15 dakika sallayarak peroksidaz substrat (kuyu başına 100 μL) olarak TMB ile yıkayın.
- Reaksiyonu standart durdurma çözeltisi olan 0,1 M H2SO4 (kuyu başına 100°L) ile sonlayın.
- Standart bir laboratuvar plakası okuyucusunda 650 nm'de referans emicilik ile 450 nm emici renklendirici reaksiyonu okuyun.
- AGNx1
- AGNx1 neo-epitop salınımını ölçerek aggrecan yıkımını ölçün. Bu dolaylı rekabetçi ELISA test, ADAMTS-4 ve 5 dekoltesi tarafından üretilen aggrecan C-terminal peptidini (NITEGE373)hedefler. Monoklonal antikor, maruz kalmış NITEGE epitopu olan tüm parçaları tanır. Tofaşın deneysel detayları başka bir yerde19olarak yayınlanmıştır.
- ProC2
- Tip II kollajen profragment salınımını ölçerek tip II kollajen oluşumunu ölçün. Bu dolaylı rekabetçi ELISA tonu, yeni sentezlenen tip II kollajenin budaşımı sırasında N-propeptidazlar tarafından oluşturulan PIIBNP propeptidin (QDVRQPG) epitopesini hedefler. T.C. denemenin deneysel detayları başka bir yerde16olarak yayınlanmıştır.
- C2M
- C2M neo-epitop parçasının salınımını ölçerek tip II kollajen yıkımını ölçün. Bu doğrudan rekabetçi ELISA MMP-cleaved C-terminal peptid tanır (KPPGRDGAAG1053). Bu teşp AGNx1 ve ProC2'den farklıdır, çünkü peroksidaz etiketli ve böylece dedektör olarak kullanılan birincil antikordur. Denemenin deneysel detayları başka bir yerde20olarak yayınlanmıştır.
5. Histolojik analiz
- Sızma, gömme ve kesme
- Sabitlenmiş eksplants yerleştirin (adım 3.2 bakınız) tek tek etiketli kasetler içine. Kimlik tespiti için hem kasete hem de etiket kasetlerine bir etiket ekleyin.
- Eksploris içeren kasetleri bir doku işlemci makinesine aktarın. Sonra dehidratasyon ve parafin infiltrasyon adımları bir dizi parafin ile explants sızma.
- Sıcaklık ayarı olmadan 90 dakika boyunca %96 etanol ile susuz kalın. Bu adımı 3 kez tekrarlayın.
- Hiçbir sıcaklık ayarı ile 90 dakika için toluen ile etanol temizleyin. Bu adımı 2 kez tekrarlayın.
- Etanol'ü toluen ile 60 °C'de 90 dk temizleyin.
- 60 °C'de 30 dk parafin balmumu ile sızın.
- 60 °C'de 60 dk parafin balmumu ile sızın.
- 60 °C'de 90 dk parafin balmumu ile sızın.
- Her adım için, 33-34 kPa altında yavaş pompa-out ve pompa-in akışları ile örnek odasına çözümleri ekleyin. Sızma işlemini maksimum vakum −65 ila −70 kPa vakumile basınç/vakum döngüsünde çalıştırın.
- Sızmayı takiben, kasetleri bir ısıtma bloğuna yerleştirin ve ekskamaların kasetten dikkatlice çıkarılmasını bekleyin. Sızmış ekspbitkileri tek tek parafin bloklarına nazikçe yerleştirin. Isıtmalı çalgılarile, eksperleri yüzeysel eklem kıkırdağı ve subkondral kemik kenarları kesme yüzeyine dik olarak yerleştirerek her numune bölümündeki farklı kıkırdak tabakalarının görüntülenmesini sağlar.
- Bir mikrotom üzerinde gömülü eksplants ile soğutulmuş parafin blokları 5 μm bölümleri kesin. Kesilen bölümleri soğuk su banyosuna aktarın. Gerekirse, kesitler neşter veya kapak camı kullanılarak ayrılabilir.
- Kaplamasız cam bir kaydırak kullanarak, bölümleri, bölümlerin açıldığı ılık su banyosuna (50 °C) aktarın. Her bölümü etiketli bir kapak kaydırağı üzerine kaldırın ve 30 dakika boyunca sıcak bir tabağa yerleştirin.
- Slaytları bir sepete yerleştirin ve 60 °C'de 1 saat kuluçkaya yatırın ve gece boyunca 37 °C'de tutun. Daha sonra, slaytları 4 °C'de kapalı kaplarda boyama kadar saklayın.
- Safranin O/Hızlı Yeşil boyama ve görselleştirme
- Bir sepete boyanacak slaytları yerleştirin ve slaytları 60 °C'de 1 saat kuluçkaya yatırın.
- 0,45 mm filtre ile tüm reaktifleri hazırlayın ve filtreleyin.
- Boyama için hazırlanırken, süzülen reaktifleri beaers'e dökün ve bu da çözeltilerin sepeti batırırken slaytları tamamen kaplamasını sağlayan bir ses eve dökün. Kullanılan gagalar slaytları kapsayacak şekilde 250 mL hacim gerektiriyor.
- Sepeti toluene iki kez, %99 etanol 2 dk iki kez, %96 etanol 2 dk iki kez ve %70 etanol 2 dk iki kez toluene batırarak erimiş slaytları deparafinize edin. Daha sonra, 2 dakika suda slaytlar nemlendirin.
- Weigert'in Demir Hematoksilin çözeltisindeki (pH 1.5) sepeti 10 dakika boyunca batırarak, %1 HCl'ye bir kez batırarak ve fazla renk yıkanana kadar akan musluk suyuyla durulayın.
- Sonra, 5 dk için % 0.05 Hızlı Yeşil çözelti (pH: 5.75), bir kez% 1 CH3COOH daldırma ve 20 dakika için% 0.1 Safranin O (pH: 6.5) leke leke.
- Dehydrate ve iki kez% 70 etanol, 2 dakika için% 96 etanol iki kez daldırma slaytlar temizleyin, 2 dk için% 99 etanol iki kez, ve toluen 2 dk iki kez.
- Histoloji slaytlarını kaplayan rekartlı orta ile kaplamasız cam slaytları monte edin.
Sonuçlar
Büyükbaş tam derinlemesine eksüleler izole edildi, kültürlendi ve 3 hafta boyunca tedavi edildi(Şekil 1). Haftada 3 kez tedavinin eklenmesiyle kültür ortamı değiştirildi. Haftalık bir kez, metabolik aktivite resazurin tsay ile ölçüldü. ECM cirobiyobelirteçleri haftada 3 kez kültür plakasından hasat supernatant ölçüldü. Eksektifler tedavi için 4 gruba ayrılmıştır: 1) Onkostatin M ve TNFα (O+T); 2) O+T + GM6001 (GM6001); 3) Büyüme Faktörü-1 (IGF-1) gibi insülin; ve 4) tedavi olmadan bir kontrol (w / o).
Metabolik aktivite.
Dört grup için metabolik aktivite 3 hafta boyunca nispeten stabildi(Şekil 2A). IGF-1'in metabolik aktiviteyi w/o grubunun biraz üzerinde arttırma ve O+T gruplarının bunu azaltma eğilimi vardı. Resazurin tayini, her ekstrandadaki kondrositlerin aktivitesini kolayca değerlendirmek ve deneyden eksplant çıkarmadan hücre canlılığını dolaylı olarak değerlendirmek için kullanılmıştır. Bir ekstryen deney sırasında metabolik aktivitede önemli bir düşüş gösterirse, ekstrbitki daha fazla analiz dışında tutulabilir.
Katabolik tedavi.
O+T, O+T aracılı kıkırdak bozulmasını araştırmak için kültür kuyularına haftada 3 kez uygulandı (Şekil 3, Şekil 4). MMP aracılı tip II kollajen yıkımı ve aggrekanaz aracılı aggrecan yıkımı C2M ve AGNx1 ELISA'lar tarafından değerlendirildi. O+T, w/o grubuna göre tip II kollajen yıkımını 7-21(Şekil 3A)ve aggrecan yıkımını 3-14(Şekil 4A)günlerine göre artırmıştır. O+T tedavisi ile birlikte GM6001 (geniş spektrumlu MMP inhibitörü) eklerken, O+T aracılı C2M salınımı engellendi(Şekil 3A,B). 3-7 gün gm6001 eklerken azalmış AGNx1 sürümü gözlenmiştir, ancak AGNx1 sürüm o +T grubuna benzer seviyelerde gün 10 zirveleri(Şekil 4A),GM6001 gösteren sadece sınırlı bir ölçüde aggrecan bozulması azalır. AGNx1 ve C2M salınımındaki bu desen, O+T ile uyarılan büyükbaş kıkırdak modelinde gözlenen genel tablodur. İlk olarak, AGNx1 yaklaşık gün 3 ve gün 10-14 zirveleri serbest bırakılır, aggrecan erken bir bozulma temsil eden. Daha sonra, O +T ile 2 haftalık kültürlenmeden sonra, C2M biyomarker ile ölçülen tip II kollajen yıkımı gözlenir.
Anabolik tedavi.
Anabolik stimülasyonun kıkırdak ECM cirosunu nasıl modüle ettiğini araştırmak için, Büyüme Faktörü-1 (IGF-1) gibi insülin, büyükbaş hayvanlara haftada 3 kez tam derin eksplinlere uygulandı. IGF-1'in kıkırdak eksperleri üzerindeki etkisi anabolik uyaranlar için beklendiği gibi ProC2 tarafından değerlendirilen tip II kollajen oluşumu ölçümleri üzerinde gözlenmiştir (Şekil 5). Bu modelde Gün 0 her zaman yüksek ProC2 ölçümleri gösterir, belki de örneklerin çıkarılması için bir tepki olarak. Bu yüksek seviyeler önemli ölçüde azalır ve 7-21 gün seviye. IGF-1 ile tedavi edilirken, ProC2 düzeyleri w/o grubunda gözlenenlerden daha az düşer, igf-1'in tip II kollajen oluşumunu uyardığını gösterir(Şekil 5B). ProC2 grafikleri de biyolojik varyasyongösterir. Bu deneylerde grup başına başına 6 eksper tazyikli bitki kullanılmıştır. İlk daha kalın kıkırdak vardı ve daha büyük eksplinler üretti, taban çizgisinde daha yüksek ProC2 düzeyleri ile sonuçlanan, ikinci ince kıkırdak ile daha küçük tükenir, taban çizgisinde daha düşük ProC2 düzeyleri ile sonuçlanan. W/o, IGF-1 ve O+T grupları için, tasvir edilen ProC2 düzeyleri her iki eksektirinin ortalamasını temsil eder, ancak GM6001 sadece daha ince eksplanda ikinci ölçüldü. Böylece, GM6001 grubu 0. ProC2 değerlerinin 0 seviyelerine normalleştirilmesi biyolojik varyansı dikkate alır ve böylece tedavinin etkinliğini gösterir (Şekil 5B,D).
Safranin O ve Hızlı Yeşil histolojik boyamalar deney boyunca eksplantın proteoglikan içeriğini ve kıkırdak yapısını görselleştirmek için yapılmıştır(Şekil 6). 0, 7, 14 ve 21 günlerinde, w/o, IGF-1 ve O+T grubundan eksültasyonlar histolojik boyama için fikse edildi(Şekil 6). W/O ve IGF-1 grubu, deney boyunca benzer Safranin O boyama yoğunluğuna sahip olarak ortaya çıkmıştır, bu da iki gruptan hiçbirinin AGNx1 salınımını artırmadığını gösteren biyomarker sonuçları ile ilişkilidir(Şekil 4). O+T ile tedavi, 7. Ayrıca, Hızlı Yeşil boyama yoğunluğu gün 14-21 azalır, C2M sonuçları ile uyum içinde bir kollajen kaybı gösteren.
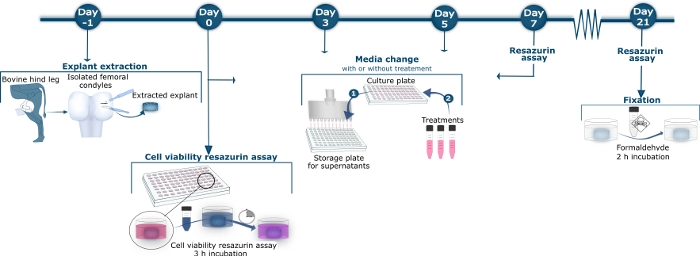
Şekil 1: Büyükbaş kıkırdak yönteminin şematik genel bakışı.
Gün −1, sığır femoral koniler arka tibiofemoral eklem izole edildi. Tam derin kıkırdak eksleyicileri neşter ve biyopsi zımba ile konilerden serbest bırakıldı. Çıkarılan eksbitkiler yıkandı ve steril 96 kuyu kültür plakasına aktarıldı. 0, 3, 5, 7, 10, 12, 14, 17, 19 ve 21 numaralı günde, süpernatant kültür plakasından hasat edildi, bir depolama plakasına aktarıldı ve Orta Değişim Adımı 1'de gösterildiği gibi −20 °C'de tutuldu. Depolanan supernatant daha sonra doku ciro biyobelirteçlerinin özel ELISA tahlilleri ile ölçülmesi için çözüldü. Orta Değişim Adım 2'de, süpernatant çıkarıldıktan sonra, farklı tedaviler içeren veya kontrol eksektif ler için hiçbir tedavi içermeyen yeni kültür ortamı uygulandı. 0, 7, 14 ve 21. %10 resazurin süpernatant, kolorimetrik reaksiyonun ölçüldüğü siyah 96 kuyulu bir plakaya transfer edildi. Kültür kuyuları, Orta Değişim Adımı 2'de gösterildiği gibi, tedavi li veya tedavisiz yeni kültür ortamı eklenmeden önce 3 kez yıkandı. 21. gün, supernatant ve resazurin ölçümü hasat sonra, ekstesme 2 saat formaldehit ile kuluçka ile fikse edildi.
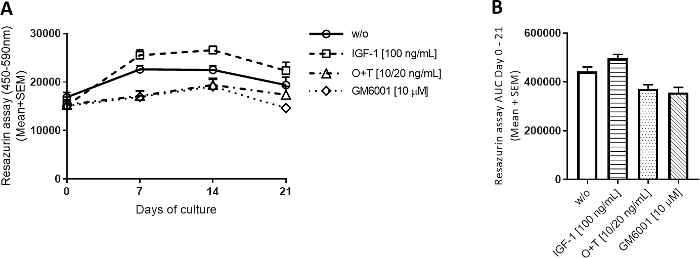
Şekil 2: Resazurin ile ölçülen metabolik aktivite.
Büyükbaş tam derinlemesine kıkırdak eksbitkisi izole edildi ve 3 hafta boyunca kültürlendi. Yeni tedavinin haftada 3 kez eklenmesiyle kültür ortamı değiştirildi (n = 2 12 eksper). Tedavi IGF-1 [100 ng/mL], OSM + TNFα (O+T) [10/20 ng/mL], O+T [10/20 ng/mL] + GM6001 (GM6001) [10 μM] idi. Tedavi edilmeden bir kontrol grubu (w/o) dahil edildi. w/o, IGF-1 ve O+T grubu için, 2 (inek başına 6 kopya) 12 kopyanın ortalama ve standart hatası gösterilir. GM6001 grubu için, ortalama ve SEM 6 1 çoğalır gösterilir. (A) Metabolik aktivite resazurin ile ölçülür. (B) Eğrinin altındaki alan (AUC)(A)ile gösterilen metabolik aktivite grafikleri için 0-21 gün arasında dır. p > 0.0001. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
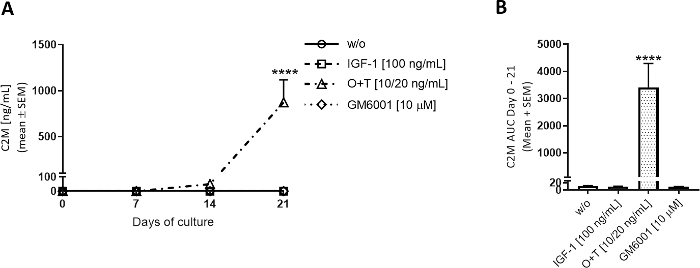
Şekil 3: Tip II kollajen yıkımı C2M ile ölçülür.
Büyükbaş tam derinlemesine kıkırdak eksbitkisi izole edildi ve 3 hafta boyunca kültürlendi. Yeni tedavinin haftada 3 kez eklenmesiyle kültür ortamı değiştirildi. Tedavi IGF-1 [100 ng/mL], OSM + TNFα (O+T) [10/20 ng/mL], O+T [10/20 ng/mL] + GM6001 (GM6001) [10 μM] idi. Tedavi edilmeden bir kontrol grubu (w/o) dahil edildi. w/o, IGF-1 ve O+T grupları için 2 (inek başına 6 kopya) 12'nin ortalama ve SEM'i gösterilir. GM6001 grubu için, ortalama ve SEM 6 1 çoğalır gösterilir. (A) C2M ölçümleri. W/o istatistiksel anlamlılık düzeyi, Sidak'ın çoklu karşılaştırma testi ile tekrarlanan ölçümler (RM) iki yönlü ANOVA ile hesaplandı. (B)(A)ile gösterilen C2M grafikleri için 0-21 gün için AUC . İstatistiksel anlamlılık Dunn'ın çoklu karşılaştırma testi ile Kruskal-Wallis testi ile hesaplandı. p > 0.0001. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: AGNx1 ile ölçülen Aggrecan bozunması.
Büyükbaş tam derinlemesine kıkırdak eksbitkisi izole edildi ve 3 hafta boyunca kültürlendi. Haftada 3 kez yeni tedavi nin eklenmesiyle kültür ortamı değiştirildi. Tedavi IGF-1 [100 ng/mL], OSM + TNFα (O+T) [10/20 ng/mL], O+T [10/20 ng/mL] + GM6001 (GM6001) [10 μM] idi. Tedavi edilmeden bir kontrol grubu (w/o) dahil edildi. w/o, IGF-1 ve O+T grubu için 2 (inek başına 6 kopya) 12'nin ortalama ve SEM'i gösterilir. GM6001 grubu için, ortalama ve SEM 6 1 çoğalır gösterilir. (A) AGNx1 ölçümleri. W/o'nun istatistiksel anlamlılık düzeyi Sidak'ın çoklu karşılaştırma testi ile RM iki yönlü ANOVA ile hesaplandı. (B) AUC gün 0-21 agnx1 grafikler için gösterilen (A). İstatistiksel anlamlılık Dunn'ın çoklu karşılaştırma testi ile Kruskal-Wallis testi ile hesaplandı. **p > 0.01, ***p > 0.001, ****p > 0.0001. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
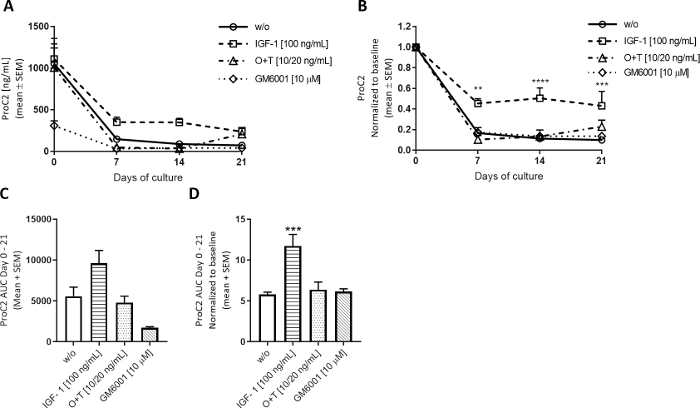
Şekil 5: ProC2 ile ölçülen Tip II kollajen oluşumu.
Büyükbaş tam derinlemesine kıkırdak eksbitkisi izole edildi ve 3 hafta boyunca kültürlendi. Yeni tedavinin haftada 3 kez eklenmesiyle kültür ortamı değiştirildi. Tedavi IGF-1 [100 ng/mL], OSM + TNFα (O+T) [10/20 ng/mL], O+T [10/20 ng/mL] + GM6001 (GM6001) [10 μM] idi. Tedavi edilmeden bir kontrol grubu (w/o) dahil edildi. w/o, IGF-1 ve O+T grubu için 2 (inek başına 6 kopya) 12'nin ortalama ve SEM'i gösterilir. GM6001 grubu için, ortalama ve SEM 6 1 yeniden çoğalır. (A) 0-21 gün proC2 ölçümleri. (B) ProC2 değerleri her bir ekstrkül için gün 0 ölçümleri normalleştirilmiş. ProC2 sonuçları genellikle gün 0 yüksek biyomarker düzeyleri tarafından gizlenmiş olabilir tedavi etkisini ortaya çıkarmak için gün 0 normalleştirme yarar. A ve B'deistatistiksel anlamlılık düzeyi Sidak'ın çoklu karşılaştırma testi ile RM iki yönlü ANOVA tarafından hesaplanmıştır. (C) AUC gün 0-21 proc2 grafikler (A)gösterilir için. (D) Gün 0-21 gün için AUC 0 normalleştirilmiş ProC2 grafikleri için gösterilen (B). C ve D'deistatistiksel anlamlılık, Dunn'ın çoklu karşılaştırma testi ile Kruskal-Wallis testi ile hesaplanmıştır. **p > 0.01, ***p > 0.001, ****p > 0.0001. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
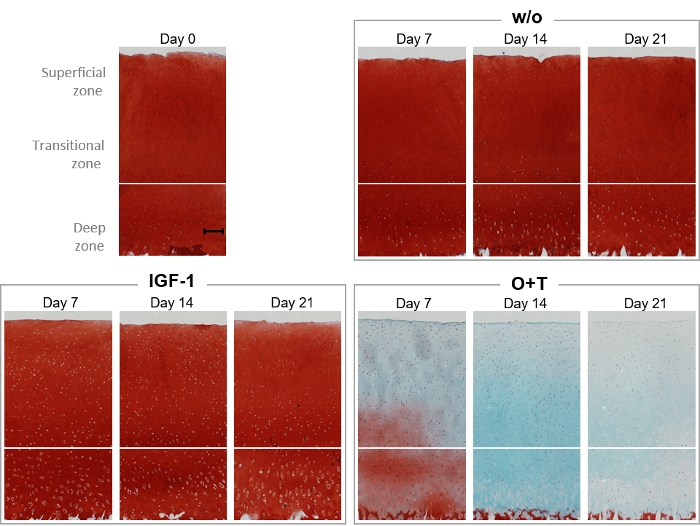
Şekil 6: Safranin O/Fast Green boyama ile proteoglikan içeriğinin histolojik görselleştirilmesi.
Büyükbaş tam derinlemesine kıkırdak eksbitkisi izole edildi ve 3 hafta boyunca kültürlendi. Yeni tedavinin haftada 3 kez eklenmesiyle kültür ortamı değiştirildi. Tedavi IGF-1 [100 ng/mL] ve OSM + TNFα (O+T) [10/20 ng/mL] idi. Tedavi edilmeden bir kontrol grubu (w/o) dahil edildi. 0, 7, 14 ve 21. Her tedavi grubu ve her zaman noktası için, temsili bir explant gösterilir. Taban çizgisi örneğinde (0. gün) gösterilen ölçek çubuğu 200 μm'yi temsil eder.
Tartışmalar
Büyükbaş kıkırdak ekskatörlerinde kıkırdak doku cirosunun profilini çıkarmak için burada sunulan protokol, inflamatuar hücre içi yolların inhibitörleri, inhibitörleri de dahil olmak üzere birçok ilaç çeşidinin tedavi edici etkilerinin karakterize edilmesinde kullanılabilir. proteolitik enzimler veya anabolik büyüme faktörleri.
Bu protokolde iki farklı kurulum tanımlanmıştır: eksplalerin insülin benzeri büyüme faktörü 1 (IGF-1) ile uyarıldığı anabolik bir kurulum ve Doku cirosunun ödenebileceği TNF-alfa ve Oncostatin M ile stimülasyondan oluşan katabolik bir kurulum geniş spektrumlu MMP inhibitörü kullanılarak inhibe. Bu yöntemdeki ana çıktı, neo-epitop biyobelirteçlerin doğrudan kültür dönemi boyunca hasat edilen koşullu ortamda ölçülmesidir. Çeşitli biyobelirteçler supernatant ölçülebilir, aynı örnekte farklı katabolik ve anabolik süreçlerin eşzamanlı profilleme için izin. Biyomarker analizinden elde edilen bulguları doğrulamak için Safranin O/Fast Green ile histolojik boyama kullanıldı. Oncostatin M, TNF-alfa ve IGF-1 protokolü tanımlamak için kullanıldı; ancak, yöntem belirli sitokin uyarıcılar ile sınırlı değildir ve bu kolayca hipotez veya test tedavisine bağlı olarak diğerleri için değiştirilebilir.
Biyomarker çıktının yorumlanması zaman içinde anabolik veya katabolik stimülasyon ile kondrosit fonksiyonu ve ekspresyon profilleridinamik değişiklikler nedeniyle zamansal bir egzersizdir. İşlenmemiş eksplanda ProC2 biyomarker ile ölçülen tip II kollajen oluşumu ilk 7-10 gün içinde hızla azalır. IGF-1 veya benzeri büyüme faktörleri ile stimülasyon, proc2 salınımını temel etekile karşılaştırılabilir bir düzeyde koşullu ortamda korur; böylece, düşüş daha kademeli ve serbest işlenmemiş explants göre artar. Bir katabolik kurulumda, pro-inflamatuar sitokinler gün 0-14 yılında kondrosit tarafından proteazların artan ekspresyonu neden; bu daha çok aggrecanases'den oluşur. Bu aggrecanaz kaynaklı protein parçaları, AGNx1 dahil olmak üzere ilk büyük artışa neden olur. Kültürün sonraki aşamalarında, kondrositler daha fazla MDP ifade, Hangi MMP oluşturulan belirteçleri serbest sürücüler, C2M gibi, gün etrafında 14 ve daha sonra. Bu nedenle, bir tedavinin etkisini profillemek için, doğru zaman aralığında biyobelirteçleri ölçmek önemlidir.
Açıklandığı gibi, O + T kokteyl gibi inflamatuar sitokinler ile tedavi zaman içinde kıkırdak dokusunun bozulmasına neden olacaktır. ECM toplam havuzu ekstrektifi boyutu ile sınırlıdır ve biyomarker profili analiz ederken dikkate alınmalıdır. Sonuç olarak, biyomarker salınımındaki ilk artıştan sonra, eksplant ECM'nin kalan miktarındaki azalma nedeniyle seviyeler zamanla düşebilir.
Daha önce, OA öncelikle eklem kıkırdağının bir hastalık olarak kabul edildi. Ancak, son çalışmalar OA tüm eklem bir hastalık olarak görülmesi gerektiğini düşündürmektedir, bireysel eklem bölmeleri erken hastalık ile ilgili değişiklikler, sinovyum, kemik, ve kıkırdak, paralel olarak meydana, ve zaman içinde eklem yetmezliği neden12 ,21. Bu nedenle bu model sistemde kıkırdağın eklemin geri kalanından izole olduğunu kabul etmek önemlidir (ve organizma), doku etkileşimi etkileri ve doku homeostazını düzenleyebilir sistemik faktörlerin etkisini sınırlayan. Bunun yerine, biyokimyasal teknikler, biyobelirteçler veya histolojik görselleştirme kullanarak dokudaki patolojik veya girişimsel değişiklikleri saptamak için deneysel olarak kontrol edilen koşulların modüle edilebildiği basitleştirilmiş tek doku kültürüdür. Kıkırdağın mimarisi nedeniyle, hücre numarası, matris bileşimi ve miktar değişimi hem eksbitkiler arasında hem de doku kaynakları arasında beklenmektedir. Biyomarker çıktısının göreli büyüklüğü denemeler arasında farklı olabileceğinden, daha iyi karşılaştırma için veri kümelerini normale döndürmeönerilir.
Mümkün olan en az varyasyon ve en iyi sonuçları sağlamak için, mümkün olduğunca taze dizlerden kıkırdak kullanmak önemlidir, tercihen arasında 1 ve 24 saat kasaplık sonra. Kıkırdak dokusunun izolasyonu homojen bir şekilde yapılmalı ve eksplants kabaca aynı kalınlıkta olmalıdır. Eksebitkiler kalın kıkırdak alanlarından izole edilmelidir, orta yakın alanlarda kaçınarak. Doku her zaman hücre ölümü ve matris ayrışmasını önlemek için nemli olmalıdır. Deneyuzunluğu 3, orta değişiklikler arasındaki zaman, sitokin stimülasyon zamanlaması, ve tedavi aralıkları bireysel bileşik veya mekanizmanın eylem varsayımsal moduuyacak şekilde ayarlanabilir.
Açıklamalar
CST, ACBJ ve MK İskandinav Biyobilim çalışanlarıdır. ACBJ ve MK, İskandinav Biyobilim'in hisselerine sahiptir. Geri kalan yazarların açıklayacak bir şeyi yok.
Teşekkürler
Yazarlar, Laboratuvar desteği için Nordic Bioscience teknik personel teşekkür yanı sıra araştırma genel destek için Danimarka Araştırma Vakfı.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 45% Iron(III) chloride solution | Sigma-Aldrich | 12322 | |
| Acetic acid | Merck | 1.00056.2500 | |
| Alamar Blue | Life tech Invitrogen | DAL1100 | |
| Biopsy processing cassettes – green | IHCWORLD | BC-0109G | |
| Biopsy punch W/Plunger (3 mm) | Scandidat | MTP-33-32 | |
| Bovine cartilage (Bovine knees) | Local slaughterhouse | ||
| C2M | Nordic Bioscience | Fee for service | |
| Corning 96-well plate | Sigma-Aldrich | CLS7007 | |
| Cover Glass Ø 13 mm | VWR | 631-0150P | |
| DMEM/F12-GlutaMAX Dulbecco's Modified Eagle Medium/Nutrient Mixture F-12) without HEPES | Gibco | 31331-028 | |
| Ethanol ≥96% | VWR | 83804.36 | |
| Ethanol absolute ≥99.5% | VWR | 83813.36 | |
| exAGNx1 | Nordic Bioscience | Fee for service | |
| exPRO-C2 | Nordic Bioscience | Fee for service | |
| Fast green | Sigma-Aldrich | F7252 | |
| Formaldehyde solution 4% | Merck | 1004965000 | |
| GM6001 | Sigma-Aldrich | M5939-5MG | |
| Hematoxylin | Sigma-Aldrich | H3136 | |
| Hydrochloric acid | Merck | 30721-M | |
| IGF-1 | Sigma-Aldrich | I3769-50UG | |
| Oncostatin M | Sigma-Aldrich | O9635-10UG | |
| Penicillin-streptomycin (P/S) | Sigma-Aldrich | P4333 | |
| Pertex (mounting medium for light microscopy) | HistoLab | 811 | |
| Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| Safranin O | Sigma-Aldrich | S2255 | |
| Sterile Standard Scalpels | Integra Miltex | 12-460-451 | |
| Sulfuric acid | Sigma-Aldrich | 30743 | |
| SUPERFROST PLUS Adhesion Microscope Slides | Thermo scientific | J1800AMNT | |
| TNF-alpha | R&D Systems | 210-TA-100 | |
| Toluene | Merck | 1.08327.2500 | |
| Vacuum Filtration "rapid"-Filtermax | TPP | 99955 |
Referanslar
- Cope, P. J., Ourradi, K., Li, Y., Sharif, M. Models of osteoarthritis: the good, the bad and the promising. Osteoarthritis and Cartilage. 27 (2), 230-239 (2018).
- Thysen, S., Luyten, F. P., Lories, R. J. U. Targets, models and challenges in osteoarthritis research. Disease Models & Mechanisms. 8 (1), 17-30 (2015).
- Reker, D., et al. Articular cartilage from osteoarthritis patients shows extracellular matrix remodeling over the course of treatment with sprifermin (recombinant human fibroblast growth factor 18). Osteoarthritis and Cartilage. 26, S43 (2018).
- Kjelgaard-Petersen, C., et al. Synovitis biomarkers: ex vivo characterization of three biomarkers for identification of inflammatory osteoarthritis. Biomarkers. 20 (8), 547-556 (2015).
- Henriksen, K., et al. A specific subtype of osteoclasts secretes factors inducing nodule formation by osteoblasts. Bone. 51 (3), 353-361 (2012).
- Gigout, A., et al. Sprifermin (rhFGF18) enables proliferation of chondrocytes producing a hyaline cartilage matrix. Osteoarthritis and Cartilage. 25 (11), 1858-1867 (2017).
- Reker, D., et al. Sprifermin (rhFGF18) modulates extracellular matrix turnover in cartilage explants ex vivo. Journal of Translational Medicine. 15 (1), 3560 (2017).
- Karsdal, M. A. Introduction. Biochemistry of Collagens, Laminins and Elastin. , (2016).
- Heinegård, D., Saxne, T. The role of the cartilage matrix in osteoarthritis. Nature Reviews Rheumatology. 7 (1), 50-56 (2011).
- Karsdal, M. A., et al. Osteoarthritis– a case for personalized health care?. Osteoarthritis and Cartilage. 22 (1), 7-16 (2014).
- Karsdal, M. A., Bay-Jensen, A. C., Henriksen, K., Christiansen, C. The pathogenesis of osteoarthritis involves bone, cartilage and synovial inflammation: may estrogen be a magic bullet?. Menopause International. 18 (4), 139-146 (2012).
- Loeser, R. F., Goldring, S. R., Scanzello, C. R., Goldring, M. B. Osteoarthritis: a disease of the joint as an organ. Arthritis and Rheumatism. 64 (6), 1697-1707 (2012).
- Goldring, M. B., Goldring, S. R. Osteoarthritis. Journal of Cellular Physiology. 213 (3), 626-634 (2007).
- Karsdal, M. A., et al. The coupling of bone and cartilage turnover in osteoarthritis: opportunities for bone antiresorptives and anabolics as potential treatments?. Annals of the Rheumatic Diseases. 73 (2), 336-348 (2014).
- Genovese, F., Karsdal, M. A. Protein degradation fragments as diagnostic and prognostic biomarkers of connective tissue diseases: understanding the extracellular matrix message and implication for current and future serological biomarkers. Expert Review of Proteomics. 13 (2), 213-225 (2016).
- Gudmann, N. S., et al. Cartilage turnover reflected by metabolic processing of type II collagen: a novel marker of anabolic function in chondrocytes. International Journal of Molecular Sciences. 15 (10), 18789-18803 (2014).
- Madej, W., van Caam, A., Davidson, E. B., Buma, P., van der Kraan, P. M. Unloading results in rapid loss of TGFβ signaling in articular cartilage: role of loading-induced TGFβ signaling in maintenance of articular chondrocyte phenotype?. Osteoarthritis and Cartilage. 24 (10), 1807-1815 (2016).
- Kjelgaard-Petersen, C. F., et al. Translational biomarkers and ex vivo models of joint tissues as a tool for drug development in rheumatoid arthritis. Arthritis & Rheumatology. 70 (9), 1419-1428 (2018).
- Wang, B., et al. Suppression of MMP activity in bovine cartilage explants cultures has little if any effect on the release of aggrecanase-derived aggrecan fragments. BMC Research Notes. 2 (4), 259 (2009).
- Bay-Jensen, A. C., et al. Enzyme-linked immunosorbent assay (ELISAs) for metalloproteinase derived type II collagen neoepitope, CIIM—Increased serum CIIM in subjects with severe radiographic osteoarthritis. Clinical Biochemistry. 44 (5-6), 423-429 (2011).
- Lories, R. J., Luyten, F. P. The bone-cartilage unit in osteoarthritis. Nature Reviews Rheumatology. 7 (1), 43-49 (2011).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır