Method Article
牛膝剥離植物における軟骨改造のEx Vivo組織培養モデル
要約
ここでは、ウシの膝からの軟骨の切除と培養を記述するプロトコルを提示する。この方法は、関節を標的とする生物学的刺激または新規治療に応答して組織の変化を記述するための容易でアクセス可能なツールを提供する。
要約
Ex vivo培養システムは、ネイティブの設定で組織と細胞機能を研究することに特化した幅広い実験をカバーしています。軟骨は、静脈関節の適切な機能のために重要なユニークな組織であり、密な細胞外マトリックス(ECM)によって構成され、プロテオグリカンとII型コラーゲンが豊富です。軟骨細胞は軟骨内に存在する唯一の細胞型であり、広範囲にわたり、比較的少ない数である。変化した外部刺激および細胞シグナル伝達は、変形性関節症(OA)および関節リウマチなどの疾患において重要な病理学的特徴であるECM組成および劣化の変化につながる可能性がある。
ex vivo軟骨モデルは、軟骨組織回転率の変化を媒介する軟骨細胞のプロファイリング、2)軟骨ECM組成物の可視化、および3)軟骨細胞転位を組織中で直接行うことを可能にする。刺激または治療に応答してこれらの変化をプロファイリングすることは、軟骨生物学の様々な側面において非常に重要であり、単離された軟骨細胞におけるインビトロ実験、または実験条件がある生きている動物におけるより複雑なモデルを補完する制御がより困難です。
軟骨剥離植物は、制御可能な設定で軟骨ECMにおける組織改造を評価するための翻訳的かつ容易にアクセス可能な方法を提示する。ここでは、生きた牛軟骨切除植物を分離および培養するためのプロトコルについて説明する。この方法は、地元の肉屋から簡単にアクセスできる牛の膝からの組織を使用しています。除植物および調節培養培地の両方を分析して、組織のターンオーバー、ECM組成物、および軟骨細胞機能を調べ、ECM変調をプロファイリングすることができる。
概要
軟骨細胞は軟骨マトリックスを産生し、維持する。軟骨細胞の生物学を研究し、それらと周囲のECMが外部刺激にどのように反応するかを研究するためには、彼らの母国環境1、2でそれらを尋問することが重要です。軟骨組織のターンオーバーを研究することは、OAなどの関節疾患の基礎的メカニズムの理解を深めるために重要であり、現在疾患改変治療がない疾患である。その結果、より良い翻訳モデル2が大きく必要になります。
細胞および組織効果のEx vivo特性評価は、軟骨細胞単層培養物などのインビトロと、手術誘発OAモデルや自己免疫コラーゲン誘発関節炎モデル(CIA)などの生体内の両方の他の前臨床モデルを補完するために不可欠である).多くの研究は、2D単層培養物と3D構造、または天然組織3、4における細胞の振る舞いの違いを強調している。2D層の多くの細胞は、細胞極性および組織結合の違いを含む不自然な形態を採用し、その結果、天然組織5内の細胞における視覚的および機能的な違いをもたらす。違いは、タンパク質発現をシフトさせる可能性のある細胞の機能性においても明らかであり、分化パターン、調節機械、および細胞機能の大幅な変化につながる5,6,7 、8.
軟骨ECMは、マトリックスフレームワークを提供するII型コラーゲンと、組織内の流体を保持するのに役立つプロテオグリカンであるアグレカンで構成されています。コラーゲンタイプIV、VI、IX、X、XI、XII、フィブロネクチン、軟骨オリゴマータンパク質(COMP)、ビッグリカン、デコリン、およびペルレカンなどの他のマトリックス分子も9に存在する。
OAの病因は不明のままであるが、10、11、この疾患の発症は、組織のターンオーバーおよび修復プロセス12、13の不均衡によって引き起こされると考えられている。関節軟骨の劣化はOAの特徴である。周囲の組織の軟骨細胞または細胞はサイトカインの放出を増加させ、マトリックスメタロプロテイナーゼ(MMP)やアグレカナーズなどのタンパク質アナーゼの産生の上昇を刺激し、軟骨ECMの分解を増加させる14.この分解は、血清、尿、または培養培地15で定量することができるネオエピトープと呼ばれる小さなユニークなタンパク質断片の放出をもたらす。コラーゲンの形成と成熟に際して、いわゆるプロフラグメントも放出される。これらは、マトリックス生産16の尺度として定量することができる。
このプロトコルの目的は、ECM組織回転率に対する刺激および/または薬物治療の効果を比較するex vivo軟骨モデルを確立することである。軟骨回転率は、ELISAを用いてコンディショニング培養培地中でマトリックス由来ネオエピトープバイオマーカーを直接測定することによってプロファイリングされる:AGNx1(アグレカナゼ活性を反映する)、C2M(マトリックスMMP活性を反映する)、およびProC2(反射型IIコラーゲン)形成)。この知見は、個々の外見における軟骨細胞の組織を可視化するECMの組織学的染色によって検証することができる。記載のプロトコルは、軟骨細胞機能および軟骨ECM回転率に対する新規治療の効果を試験するために使用することができる。多くの研究は、生物学的プロセスまたは細胞カインに挑戦した見葉植物に対する介入の効果を、定量的組織学的または免疫組織化学的アプローチ、mRNA、タンパク質発現、またはプロテオミクス2を用いて記述するために軟骨剥離植物を使用してきた。 、17、18.しかし、これらのプロトコルは、現在の原稿の範囲外です。
プロトコル
1. 組織分離
- ティッシュソーシング
- 無菌環境で層流フードの外側で組織全体の調達セクションを実行します。
- 地元の食肉処理場から、1.5歳から2歳までの子牛から新鮮なウシ脛骨大腿骨膝関節全体を得る。
- 最初に余分な肉を取り除き、凹凸、半月板、腱、およびスイノビカル膜を明らかにして、ふくらはぎの膝を穏やかに解剖します。腱とスイノブニカル膜を切断し、関節を分解できるようにします。大腿骨の結節を露出させるために半月板を取り除く。
- 3mm生検パンチャーを使用して大腿骨の耐荷重領域から除植物を分離し、可能な限り軟骨下骨に平行かつ近いメスで切断することにより、関節表面からそれらを解放します。軟骨下骨の硬い構造は、除植物が石灰化されたマトリックスを含まないことを保証する必要があります。均一な高さのエクスプラントのために努力してください。
- すぐに貯蔵し、50 mLチューブまたはペトリ皿でDMEM/F12-グルタマックス+1%P/S培養培地で植物を混合します。異なる牛の膝から交え出すのではなく、研究ごとに別々に保管してください。
- 組織培養
- 積層流のフードの無菌96ウェルプレートにエクスプラントを移します。
- 培養培地またはPBSで3回エクスプラントを洗浄し、実験開始までウェル当たり200μLの培養培地で培養する。生検細胞活性と受動バイオマーカー放出を同期させるために1日の洗い流し期間を使用してください。
- 培養は、5%CO2で37°インキュベーターで10週間まで植え付けます。蒸発によって誘発される変動を最小限に抑えるために、各グループ内のすべての複製を培養プレート内に斜めに配置します。さらに上清の蒸発を避けるために、培養プレートの外側の井戸にPBSを加える。
2. 牛軟骨剥離植物の治療と代謝活性評価
- 培養培地の変化と治療
- 層流フードで2~3日ごとに培養培地を交換します。
- 治療を適用する場合は、培地を変更する前にこれらを準備してください。培養培地中の希釈により、剥離井戸内の所望の濃度に対する処理を準備する。
- 各井戸から上清をそっと取り除き、新しい96ウェルプレートに移します。組織のターンオーバーおよびタンパク質発現のバイオマーカー分析のために、密封テープで上清を−20°Cで保管してください。
- すぐに200°Lの新鮮な培養培地またはウェルあたりの処理を追加します。培地交換中に外見植物を乾燥させず、すべての外見が新しい培地に完全に沈んでいられるようにしてください。
- レサズリン染色
- 細胞生存率の間接測定として週1回代謝活性を測定する。レサズリン試験は、細胞死または細胞変化によって個々の移植植物の代謝活性が悪化するかどうかを評価する簡単な方法である。培養培地単独のエクスプラントは、実験期間を通じて比較的安定したレサズリン読み取り値を有する。
- 10%のレサズリンで培養培地の溶液を作る。
- ステップ2.1.3に記載の上清を収穫する。
- 37°Cで3時間、または上清が紫色になるまで10%リサズリン溶液にエクスプラントを浸漬します。背景コントロールとして植え付けなしの4つの井戸を含めます。
- 条件付きおよびバックグラウンドコントロールレサズリン溶液を黒いマイクロテータープレートに移し、540 nm励起/590 nmの放出で蛍光を測定します。
- 培養培地またはPBSで3回をよく洗浄し、5〜10分間洗浄培地に沈み込み、リサズリンが完全に拡散できるようにします。新しい培養培地または治療法を追加します(使用する場合)。
3. 終了、固定、およびサンプルストレージ
- 培養期間の終了
- ステップ2.2に記載の代謝活性を測定する。井戸ごとに200°LのPBSを加えます。
- 固定とストレージ
- PBSを取り出し、ウェル当たり200μLのホルムアルデヒドを加え、室温で2時間放置します。
- ホルムアルデヒドを処分し、井戸ごとに200μLのPBSを加えます。プレートをシールテープで覆い、ヒストケミカル分析のために4°Cで保管してください。3ヶ月以内にヒストケミカル分析を行うことをお勧めします。
4. 組織回転バイオマーカー(ELISA)
- 間接競争力のあるエリサス
- ステレプトアビジンプレートを、20°Cで30分間、アッセイバッファー(ウェル当たり100μL)で1:100希釈した特異的ビオチン化アッセイターゲットペプチドでコートする。
- 標準的な洗浄バッファーで5回洗浄し、サンプル上清(ウェルあたり20°L)を加え、ProC2用のアッセイ標的ペプチド希釈1:93.3に対する一次モノクローナル抗体と、AGNx1(ウェル当たり100°Lあたり100°L)のアッセイバッファーに1:100を加え、20°Cで2時間インキュベートするAGNx1の場合はProC2と3時間の揺れを伴う。
メモ:サンプル体積は、保存された上清プレートから直接取られます。測定濃度がアッセイ測定範囲外の場合は、PBSまたはアッセイバッファー内のv底希釈板で上清を希釈する。 - 標準的な洗浄バッファーで5回洗浄し、ペルオキシダーゼ標識二次抗体をアッセイバッファー(ウェル当たり100μL)で1:100希釈して20°Cで1時間インキュベートします。
- 標準的な洗浄バッファーで5回洗浄し、ペルオキシダーゼ基質(ウェル当たり100°L)としてテトラメチルベンジジン(TMB)で20°Cの暗闇の中で15分間振とうでインキュベートします。
- 標準的な停止溶液で反応を終了し、0.1 M H2SO4(ウェル当たり100°L)。
- 標準的な実験室の版の読者の650 nmの基準吸光度を使用して450 nmの吸光度の比色反応を読み取る。
- 上清における軟骨組織回転率測定のための直接競合ELISA
注: これにより、C2M が定量化されます。- ステレプトアビジンプレートを、20°Cで30分間、アッセイバッファー(ウェル当たり100μL)で1:100希釈した特異的ビオチン化アッセイターゲットペプチドを用いてコートする。
- 洗浄緩衝液で5回洗浄し、アッセイ対象ペプチドに対するペルオキシダーゼ標識モノクローナル抗体100μLと共に試料上清をアッセイバッファー(ウェル当たり20μL)で希釈したアッセイターゲットペプチドに対して加えた。振とうで2~8°Cで20時間インキュベートします。
メモ:サンプル体積は、保存された上清プレートから直接取られます。測定濃度がアッセイ測定範囲外の場合は、PBSまたはアッセイバッファー内のv底希釈板で上清を希釈する。 - 標準的な洗浄バッファーで5回洗浄し、ペルオキシダーゼ基質としてTMB(ウェルあたり100°L)として20°Cの暗闇の中で15分間振とうでインキュベートします。
- 標準的な停止溶液で反応を終了し、0.1 M H2SO4(ウェル当たり100°L)。
- 標準的な実験室の版の読者の650 nmの参照吸光度と450 nmの吸光度の比色反応を読み取る。
- AGNx1
- AGNx1ネオエピトープの放出を測定することにより、アグレカン分解を定量化する。この間接的競合ELISAアッセイは、ADAMTS-4および5切断によって生成されたアグレカンC末端ペプチド(NITEGE373)を標的とする。モノクローナル抗体は、露出したNITEGEエピトープを有するすべての断片を認識する。アッセイの実験的な詳細は、他の場所で公開されています19.
- ProC2
- II型コラーゲンのプロフラグメントの放出を測定してII型コラーゲン形成を定量する。この間接的競合ELISAアッセイは、新たに合成されたII型コラーゲンのトリミング中にN-プロペプチダーゼによって生成されたPIIBNPプロペプチド(QDVRQPG)のエピトープを標的とする。アッセイの実験的な詳細は、他の場所で公開されています16.
- C2M
- C2Mネオエピトープ断片の放出を測定してII型コラーゲン分解を定量する。この直接競合するELISAは、MMP-切断されたC末端ペプチド(KPPGRDGAAG1053)を認識します。このアッセイは、ペルオキシダーゼ標識され、検出器として使用される一次抗体であるため、AGNx1およびProC2とは異なります。アッセイの実験的な詳細は、他の場所で公開されています20.
5. 組織学的分析
- 浸潤、埋め込み、切断
- 固定されたエクスプラント(ステップ3.2を参照)を個別にラベル付けされたカセットに入れます。識別を確実にするために、カセットとラベルカセットの両方にラベルを含めます。
- 交付物を含むカセットをティッシュプロセッサー機に移します。次いで、一連の脱水およびパラフィン浸潤工程でパラフィンで見他植物に浸潤する。
- 96%エタノールで96%のエタノールで脱水し、温度調整なしで90分間脱水します。この手順を 3 回繰り返します。
- 温度調整なしで90分間トルエンでエタノールをクリアします。この手順を 2 回繰り返します。
- 60°Cで90分間トルエンでエタノールをクリアします。
- 60°Cで30分間パラフィンワックスで浸潤する。
- 60°Cで60分間パラフィンワックスで浸潤する。
- 60°Cで90分間パラフィンワックスで浸潤する。
- 各ステップについて、33~34 kPa以下の低速ポンプアウトおよびポンプインフローを備えたサンプルチャンバーにソリューションを追加します。最大真空-65~−70 kPaの圧力/真空サイクルで浸潤プロセスを実行します。
- 浸潤後、カセットを加熱ブロックの上に置き、カセットから植物を慎重に取り除くようにします。浸潤したエクスプラントを個々のパラフィンブロックにゆっくりと埋め込みます。加熱鉗子を使用して、切断面に垂直な表面関節軟骨と軟骨下骨側を備えた除植物を配置し、各検体セクション内の異なる軟骨層の可視化を保証します。
- 冷却されたパラフィンブロックの5μmセクションを、ミクロトームに埋め込まれたエクスプラントでカットします。切り傷切り切りを冷水風呂に移します。必要に応じて、メスまたはカバーガラスのいずれかを使用して切片を分離することができます。
- コーティングされていないガラススライドを使用して、セクションを温水浴(50°C)に移し、セクションが展開します。各セクションをラベル付きカバースライドに持ち上げ、ホットプレート上に30分間置きます。
- スライドをバスケットに入れ、60°Cで1時間インキュベートし、37°Cで一晩保管します。以下、染色するまで4°Cの密閉容器にスライドを保存する。
- サフラニンO/ファストグリーン染色と可視化
- 汚すスライドをバスケットに入れ、60°Cで1時間インキュベートします。
- 0.45 mmフィルターですべての試薬を準備し、フィルター処理します。
- 染色の準備として、フィルターをかけられた試薬をビーカーに注ぎ、バスケットを水没させる際に溶液がスライドを完全に覆えるようにするボリュームにします。使用されるビーカーはスライドを覆うために250 mLの容積を要求した。
- 溶けたスライドを10分間に2回、99%エタノールを2分間、96%エタノールを2分間、70%エタノールを2回2回に浸して脱パラフィン化する。その後、2分間水でスライドを水和します。
- ヴァイガートの鉄ヘマトキシリン溶液(pH1.5)にバスケットを10分間浸漬して脱パラフィン化および水和スライドを染色し、1%HClに1回浸し、水道水を流して約5分間または余分な色が洗い流されるまですすす。
- 次に、0.05%のファストグリーン溶液(pH:5.75)で5分間染色し、1%CH3COOHに1回浸し、0.1%サフラニンO(pH:6.5)で20分間染色します。
- 脱水し、70%エタノールに2回浸漬し、96%エタノールを2分間2回、99%エタノールを2分間、トルエン2分間2回浸漬する。
- 無塗装のガラススライドに、ヒストロジースライドを覆う樹脂媒体で取り付けます。
結果
牛の全深分の植え付けを単離し、培養し、3週間処理した(図1)。培養培地は、週3回の治療を加えて変更した。週1回、代謝活性をレサズリンアッセイにより測定した。ECM回転率のバイオマーカーは、培養プレートから採取した上清で週3回測定した。エクスプラントは、治療のために4つのグループに分けられた:1)オンコスタチンMおよびTNFα(O+T);。2) O+T + GM6001 (GM6001);3) 成長因子-1のようなインスリン (IGF-1);4)処理なしのコントロール(w/o)。
代謝活性。
4つの群すべてについて、代謝活性は3週間を通して比較的安定であった(図2A)。IGF-1 は w/o グループをわずかに上回る代謝活性を増加させる傾向があり、O+T グループはそれを減少させる傾向がありました。.レサズリンアッセイは、各植物の軟骨細胞の活性を容易に評価し、実験から除植物を抽出することなく細胞生存率を間接的に評価するために使用された。実験中に代謝活性の実質的な低下を示す場合、エクスプラントはさらなる分析から除外することができる。
異化処理。
O+Tを培養井戸に週3回塗布し、O+T媒介軟骨分解を調べた(図3、図4)。MMP媒介型II型コラーゲン分解およびアグレカナゼ媒介アグレカン分解をC2MおよびAGNx1 ElISAにより評価した。O+Tは、7~21日からII型コラーゲン分解を増加させ(図3A)、アグレカン分解は3~14日(図4A)からw/o群と比較した。GM6001(広域スペクトルMMP阻害剤)をO+T処理と組み合わせて添加すると、O+T媒介C2M放出がブロックされた(図3A,B)。3~7日目にGM6001を添加するとAGNx1のリリースの減少が見られましたが、AGNx1リリースはO+T群と同様のレベルで10日目にピークを迎え(図4A)、GM6001は限られた範囲でアグレカン劣化を減少させるだけである。AGNx1およびC2M放出におけるこのパターンは、O+Tで刺激されたウシ軟骨モデルで観察される一般的な画像である。まず、AGNx1はおよそ3日目から放出され、10-14日目にピークを迎え、アグレカンの早期劣化を表します。次に、O+Tによる培養の2週間後、II型コラーゲン分解がC2Mバイオマーカーにより測定されるものとして観察される。
同化治療.
蛋白同化刺激が軟骨ECM回転を調節する方法を調べるために, 成長因子-1のようなインスリン(IGF-1)は、牛の完全な深度の植え付けに週3回適用されました.軟骨切除植物に対するIGF-1の効果は、主にII型コラーゲン形成の測定に対して観察され、ProC2によって評価され、同化刺激に対して期待される(図5)。このモデルの0日目は、サンプルの抽出に対する反応として、常に高いProC2測定値を示します。これらの高レベルは、7-21日から大幅に減少し、レベルアウトします。IGF-1で治療する場合、ProC2レベルはw/o群で観察されたものよりも低下し、IGF−1が7日目からII型コラーゲン形成を刺激することを示す(図5B)。ProC2グラフはまた、牛の生物学的変化を示しています。2頭の牛からの除植物は、これらの実験で、1群当たり6頭の交群の除植物を用いた。最初の牛は軟骨が厚く、より大きな見葉植物を生成し、ベースラインではProC2レベルが高くなり、2番目の牛はより薄い軟骨で小さく、ベースラインでProC2レベルが低くなりました。w/o、IGF-1、およびO+T群の場合、描かれているProC2レベルは両方の牛からの外植の平均を表すが、GM6001は、より薄い外植を有する第2の牛でのみ測定された。したがって、GM6001グループは、曲線(AUC)の下のProC2領域で明らかな0日目に低いProC2レベルで始まりました(図5C)。ProC2値を0日目に正規化すると生物学的分散が考慮され、治療の有効性が示されます(図5B,D)。
サフラニンOおよびファストグリーン組織学的染色は、実験全体を通して、エクスプラントのプロテオグリカン含有量および軟骨構造を可視化するために行われた(図6)。0、7、14、および21の日に、w/o、IGF-1、およびO+T基からの励起物を組織学的染色のために固定した(図6)。w/oおよびIGF-1群は、実験を通して0日目の剥離植物と同様のサフラニンO染色強度を有するように見え、これは2つのグループのいずれもAGNx1放出を増加させないことを示すバイオマーカー結果と相関している(図4)。O+Tによる治療は、7日目にプロテオグリカン含有量が大幅に失われ、21日目に完全な損失を生じた。さらに、高速グリーン染色強度は14〜21日から減少し、C2M結果と一致したコラーゲン損失を示す。
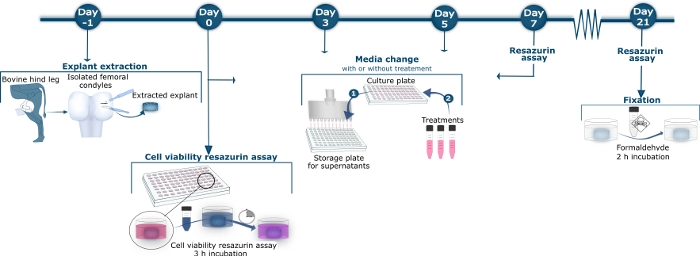
図1:ウシ軟骨法の概略概要
日−1で、ウシ大腿骨結節は後脛骨大腿関節から単離された。全深軟骨剥離植物は、メスと生検パンチャーでコンダイルから放出された。抽出した除植物を洗浄し、滅菌96ウェル培養プレートに移した。0、3、5、7、10、12、14、17、19、および21に、上清を培養プレートから収穫し、貯蔵プレートに移し、−20°Cに保った。保存された上清は、その後、特定のELISAアッセイによる組織回転バイオマーカーの測定のために解凍した。中程度変化ステップ2では、上清を除去した後、異なる処理を含む新しい培養培地、または対照除植物に対する治療を含む新しい培養培地が適用された。0、7、14、21日目に、上清を収穫した後、10%のレサズリン溶液を3時間インキュベートした。10%のレサズリン上清を黒い96ウェルプレートに移し、そこで比色反応を測定した。培養井戸を、処理の有無にかかわらず新しい培養培地を添加する前に3回洗浄した。21日目、上清とレサズリン測定の収穫後、2時間のホルムアルデヒドによるインキュベーションにより除植物を固定し、この図の大きなバージョンを見てください。
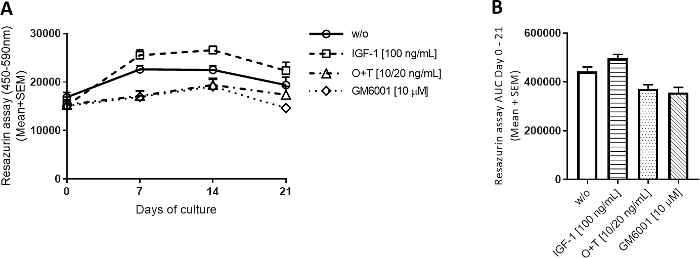
図2:レサズリンにより測定した代謝活性
牛の全深軟骨剥離を単離し、3週間培養した。培養培地は、新たな治療を週3回添加して変更した(2頭の牛からn=12の除植物)。治療は、IGF-1[100 ng/mL]、OSM + TNFα (O+T) [10/20 ng/mL]、および O+T [10/20 ng/mL] + GM6001 (GM6001) [10 μM]で構成されていました。治療を行わずに対照群(w/o)を含んだ。w/o、IGF-1、およびO+T群の場合、2頭の牛(牛当たり6回の反復)から12個の平均(SEM)の平均および標準誤差が示されている。GM6001群では、1頭の牛から6個の反復の平均とSEMが示されている。(A)レサズリンにより測定された代謝活性。(B) 曲線下の面積 (AUC) に示す代謝活性グラフの 0~ 21日。p > 0.0001.この図の大きなバージョンを表示するには、ここをクリックしてください。
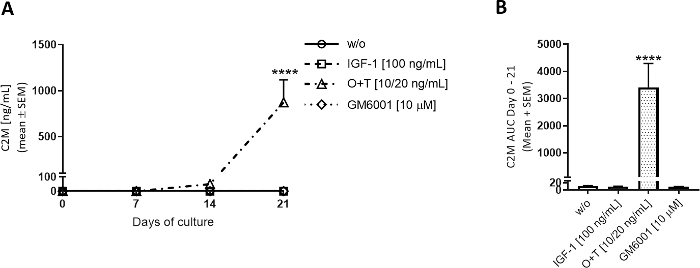
図3:C2Mで測定したII型コラーゲン分解。
牛の全深軟骨剥離を単離し、3週間培養した。培養培地は、新たな治療を週3回添加して変更した。治療は、IGF-1[100 ng/mL]、OSM + TNFα (O+T) [10/20 ng/mL]、および O+T [10/20 ng/mL] + GM6001 (GM6001) [10 μM]で構成されていました。治療を行わずに対照群(w/o)を含んだ。w/o、IGF-1、およびO+T群の場合、2頭の牛(牛当たり6回の反復)から12個の平均およびSEMが複製される。GM6001群では、1頭の牛から6個の反復の平均とSEMが示されている。(A) C2M測定。w/oの統計的有意水準は、シダックの多重比較検定を用いて反復測定(RM)双方向ANOVAによって算出された。(B) に示す C2M グラフの場合は 0 ~ 21 日の AUCを参照してください。統計的有意性は、ダンの多重比較検定でクルスカル・ウォリス検定によって計算された。p > 0.0001.この図の大きなバージョンを表示するには、ここをクリックしてください。

図4:AGNx1で測定したアグレカン劣化
牛の全深軟骨剥離を単離し、3週間培養した。培養培地は、新たな治療を週3回添加して変更した。治療は、IGF-1[100 ng/mL]、OSM + TNFα (O+T) [10/20 ng/mL]、および O+T [10/20 ng/mL] + GM6001 (GM6001) [10 μM]で構成されていました。治療を行わずに対照群(w/o)を含んだ。w/o、IGF-1、およびO+T群の場合、2頭の牛から12個の平均およびSEMが2頭の牛(牛当たり6回の反復)を複製していることが示されている。GM6001群では、1頭の牛から6個の反復の平均とSEMが示されている。(A) AGNx1測定値。w/oの統計的有意性レベルは、シダックの多重比較検定を用いてRM双方向ANOVAによって計算された。(B) A に示す AGNx1 グラフの場合は 0 ~ 21 日の AUCを参照してください。統計的有意性は、ダンの多重比較検定でクルスカル・ウォリス検定によって計算された。**p > 0.01, ***p > 0.001, ****p > 0.0001.この図の大きなバージョンを表示するには、ここをクリックしてください。
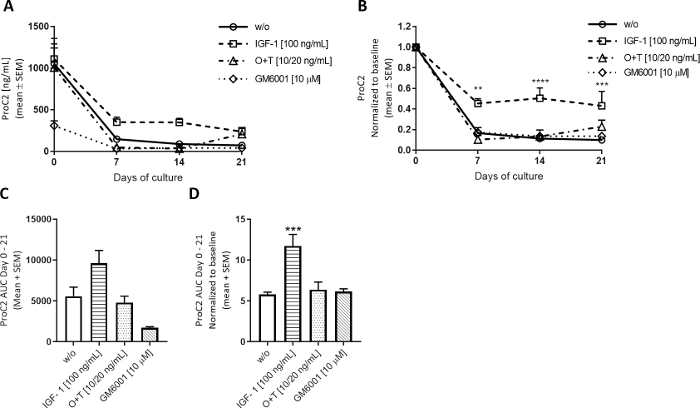
図5:ProC2により測定したII型コラーゲン形成
牛の全深軟骨剥離を単離し、3週間培養した。培養培地は、新たな治療を週3回添加して変更した。治療は、IGF-1[100 ng/mL]、OSM + TNFα (O+T) [10/20 ng/mL]、および O+T [10/20 ng/mL] + GM6001 (GM6001) [10 μM]で構成されていました。治療を行わずに対照群(w/o)を含んだ。w/o、IGF-1、およびO+T群の場合、2頭の牛から12個の平均およびSEMが2頭の牛(牛当たり6回の反復)を複製していることが示されている。GM6001群の場合、6の平均とSEMは1頭の牛から再び複製する。(A) 0~21日のProC2測定値。(B)ProC2値は、個々のエクスプラントごとに0日目の測定値に正規化された。ProC2の結果は、多くの場合、0日目の高いバイオマーカーレベルに偽装され得る治療効果を明らかにするために、0日目の正規化の恩恵を受ける。AとBでは、統計的有意水準は、シダックの多重比較検定を用いてRM双方向ANOVAによって計算されました。(C) に示す ProC2 グラフの 0 ~ 21 日の AUC (A) を参照してください。(D) AUC(B)に示す 0 日目の正規化された ProC2 グラフの日数 0 ~ 21 の場合)CとDでは、統計的有意性はダンの多重比較検定でクルスカル・ウォリス検定によって計算された。**p > 0.01, ***p > 0.001, ****p > 0.0001.この図の大きなバージョンを表示するには、ここをクリックしてください。
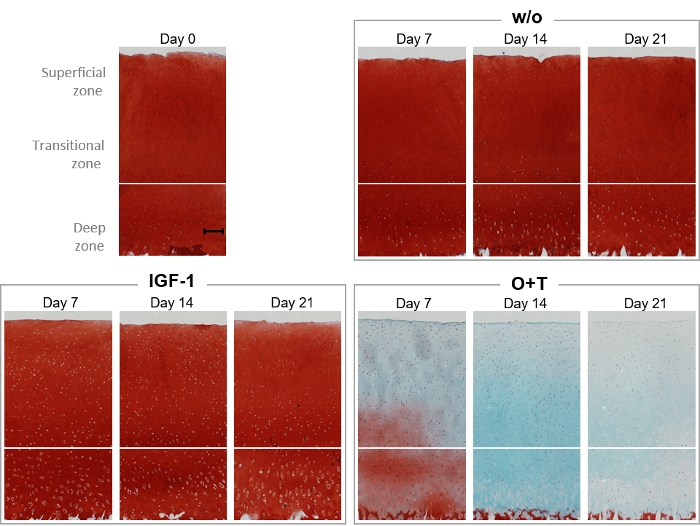
図6:サフラニンO/ファストグリーン染色によるプロテオグリカン含有量の組織学的可視化
牛の全深軟骨剥離を単離し、3週間培養した。培養培地は、新たな治療を週3回添加して変更した。治療はIGF-1[100 ng/mL]およびOSM + TNFα(O+T)[10/20 ng/mL]から成った。治療を行わずに対照群(w/o)を含んだ。0日目、7日目、14日目、21日目に、除植物を固定し、パラフィンに浸潤し、パラフィンに埋め込み、スライスし、カバースライドに置き、ヘマトキシリン、サフラニンO、およびファストグリーンで染色した。各治療群および各時点について、代表的なエクスプラントが示される。ベースラインサンプル(0日目)に示すスケールバーは200μmを表します。
ディスカッション
ここで提示されるウシ軟骨除植物における軟骨組織回転率のプロファイリングのために提示されるプロトコルは、炎症性細胞内経路の阻害剤、阻害剤を含む多くの種類の薬物の治療効果を特徴付するために使用することができるタンパク質分解酵素、または同化成長因子。
このプロトコルでは、2つの異なるセットアップが説明されました:除植物がインスリン様成長因子1(IGF-1)で刺激された同化セットアップと、組織のターンオーバーを伴うTNF-αおよびOncostatin Mによる刺激を含む異化セットアップ広域スペクトルMMP阻害剤を用いて阻害される。この方法の主な出力は、培養期間を通じて収穫される条件付き培地中のネオエピトープバイオマーカーの直接定量である。いくつかのバイオマーカーは上清で測定することができ、同じサンプル内の異種プロセスと同化プロセスの同時プロファイリングを可能にする。サフラニンO/ファストグリーンによる組織学的染色は、バイオマーカー分析からの所見を検証するために使用された。オンコスタチンM、TNF-α、およびIGF-1は、プロトコルを記述するために使用された;しかし、この方法は特定のサイトカイン刺激剤に限定されず、仮説や試験処理に応じて他のものと容易に交換することができる。
バイオマーカー出力の解釈は、軟骨細胞機能の動的変化および時間の経過に伴う同化または異化刺激を伴う発現プロファイルによる時間的運動である。未処理の見葉植物では、バイオマーカーProC2によって測定されたII型コラーゲン形成は、最初の7〜10日以内に急速に減少する。IGF-1または同様の成長因子による刺激は、ベースラインに匹敵するレベルで条件付き培地でProC2放出を維持します。したがって、減少はより緩やかで、放出は未処理の見葉植物に比べて増加する。異化セットアップでは、炎症性サイトカインは、0-14日目に軟骨細胞によるプロテアーゼの発現の増加を誘導する。これは主にアグレカナスで構成されています。これは、AGNx1を含むアグレカナゼ由来タンパク質断片の初期大きな増加を引き起こす。培養の後期段階では、軟骨細胞はより多くのMMPを発現し、C2MなどのMMP生成マーカーの放出を14日目以降に駆動する。したがって、治療の効果をプロファイルするためには、適切な時間間隔でバイオマーカーを測定することが重要である。
前述のように、O+Tカクテルのような炎症性サイトカインによる治療は、時間の経過とともに軟骨組織の分解を引き起こす。ECMの総プールは、エクスプラントのサイズによって制限され、バイオマーカープロファイルを分析する際に考慮する必要があります。その結果、バイオマーカー放出の初期増加後、植物ECMの残りの量の減少に起因する時間とともにレベルが低下する可能性がある。
以前は、OAは主に関節軟骨の疾患と考えられていた。しかし、最近の研究では、OAは関節全体の疾患とみなされるべきであり、個々の関節コンパートメント、スイノビウム、骨、軟骨の初期の疾患関連の変化が並行して起こり、時間の経過とともに関節不全12が生じることを示唆している。、21.したがって、このモデルシステムでは、軟骨が関節(および生物)の残りの部分から単離され、組織の恒常性を調節する可能性のある組織相互作用効果および全身因子の影響を制限することを認識することが重要である。代わりに、実験的に制御された条件を変調して、生化学的手法、バイオマーカー、または組織学的可視化を使用して組織に対する病理学的または介入的変化を検出することができる簡略化された単一組織培養物である。軟骨のアーキテクチャ上、細胞数、マトリックス組成、および量の変動は、交付植物間および組織源間の両方で予想されます。バイオマーカー出力の相対的な大きさは実験によって異なる場合があるため、より良い比較のためにデータセットを正規化することをお勧めします。
最小限の変動と最良の結果を確保するためには、できるだけ新鮮な膝からの軟骨を使用することが重要です, 好ましくは、ブッチャーの後に1〜24時間の間.軟骨組織の単離は、除植物がほぼ同じ厚さで均質な方法で行われるべきである。見葉植物は、中央に最も近い領域を避けて、厚い軟骨の領域から分離する必要があります。組織は、細胞死およびマトリックス分解を避けるために常に湿っている必要があります。実験3の長さは、培地変化の間の時間、サイトカイン刺激のタイミング、および治療間隔が個々の化合物または機構の仮説的な作用モードに合わせて調整することができる。
開示事項
CST、ACBJ、MKは北欧バイオサイエンスの従業員です。ACBJとMKは北欧バイオサイエンスの株式を保有しています。残りの著者は開示するものは何もない。
謝辞
著者は、北欧バイオサイエンスの技術スタッフにラボサポートを提供し、デンマーク研究財団の研究を一般的な支援に感謝しています。
資料
| Name | Company | Catalog Number | Comments |
| 45% Iron(III) chloride solution | Sigma-Aldrich | 12322 | |
| Acetic acid | Merck | 1.00056.2500 | |
| Alamar Blue | Life tech Invitrogen | DAL1100 | |
| Biopsy processing cassettes – green | IHCWORLD | BC-0109G | |
| Biopsy punch W/Plunger (3 mm) | Scandidat | MTP-33-32 | |
| Bovine cartilage (Bovine knees) | Local slaughterhouse | ||
| C2M | Nordic Bioscience | Fee for service | |
| Corning 96-well plate | Sigma-Aldrich | CLS7007 | |
| Cover Glass Ø 13 mm | VWR | 631-0150P | |
| DMEM/F12-GlutaMAX Dulbecco's Modified Eagle Medium/Nutrient Mixture F-12) without HEPES | Gibco | 31331-028 | |
| Ethanol ≥96% | VWR | 83804.36 | |
| Ethanol absolute ≥99.5% | VWR | 83813.36 | |
| exAGNx1 | Nordic Bioscience | Fee for service | |
| exPRO-C2 | Nordic Bioscience | Fee for service | |
| Fast green | Sigma-Aldrich | F7252 | |
| Formaldehyde solution 4% | Merck | 1004965000 | |
| GM6001 | Sigma-Aldrich | M5939-5MG | |
| Hematoxylin | Sigma-Aldrich | H3136 | |
| Hydrochloric acid | Merck | 30721-M | |
| IGF-1 | Sigma-Aldrich | I3769-50UG | |
| Oncostatin M | Sigma-Aldrich | O9635-10UG | |
| Penicillin-streptomycin (P/S) | Sigma-Aldrich | P4333 | |
| Pertex (mounting medium for light microscopy) | HistoLab | 811 | |
| Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| Safranin O | Sigma-Aldrich | S2255 | |
| Sterile Standard Scalpels | Integra Miltex | 12-460-451 | |
| Sulfuric acid | Sigma-Aldrich | 30743 | |
| SUPERFROST PLUS Adhesion Microscope Slides | Thermo scientific | J1800AMNT | |
| TNF-alpha | R&D Systems | 210-TA-100 | |
| Toluene | Merck | 1.08327.2500 | |
| Vacuum Filtration "rapid"-Filtermax | TPP | 99955 |
参考文献
- Cope, P. J., Ourradi, K., Li, Y., Sharif, M. Models of osteoarthritis: the good, the bad and the promising. Osteoarthritis and Cartilage. 27 (2), 230-239 (2018).
- Thysen, S., Luyten, F. P., Lories, R. J. U. Targets, models and challenges in osteoarthritis research. Disease Models & Mechanisms. 8 (1), 17-30 (2015).
- Reker, D., et al. Articular cartilage from osteoarthritis patients shows extracellular matrix remodeling over the course of treatment with sprifermin (recombinant human fibroblast growth factor 18). Osteoarthritis and Cartilage. 26, S43 (2018).
- Kjelgaard-Petersen, C., et al. Synovitis biomarkers: ex vivo characterization of three biomarkers for identification of inflammatory osteoarthritis. Biomarkers. 20 (8), 547-556 (2015).
- Henriksen, K., et al. A specific subtype of osteoclasts secretes factors inducing nodule formation by osteoblasts. Bone. 51 (3), 353-361 (2012).
- Gigout, A., et al. Sprifermin (rhFGF18) enables proliferation of chondrocytes producing a hyaline cartilage matrix. Osteoarthritis and Cartilage. 25 (11), 1858-1867 (2017).
- Reker, D., et al. Sprifermin (rhFGF18) modulates extracellular matrix turnover in cartilage explants ex vivo. Journal of Translational Medicine. 15 (1), 3560 (2017).
- Karsdal, M. A. Introduction. Biochemistry of Collagens, Laminins and Elastin. , (2016).
- Heinegård, D., Saxne, T. The role of the cartilage matrix in osteoarthritis. Nature Reviews Rheumatology. 7 (1), 50-56 (2011).
- Karsdal, M. A., et al. Osteoarthritis– a case for personalized health care?. Osteoarthritis and Cartilage. 22 (1), 7-16 (2014).
- Karsdal, M. A., Bay-Jensen, A. C., Henriksen, K., Christiansen, C. The pathogenesis of osteoarthritis involves bone, cartilage and synovial inflammation: may estrogen be a magic bullet?. Menopause International. 18 (4), 139-146 (2012).
- Loeser, R. F., Goldring, S. R., Scanzello, C. R., Goldring, M. B. Osteoarthritis: a disease of the joint as an organ. Arthritis and Rheumatism. 64 (6), 1697-1707 (2012).
- Goldring, M. B., Goldring, S. R. Osteoarthritis. Journal of Cellular Physiology. 213 (3), 626-634 (2007).
- Karsdal, M. A., et al. The coupling of bone and cartilage turnover in osteoarthritis: opportunities for bone antiresorptives and anabolics as potential treatments?. Annals of the Rheumatic Diseases. 73 (2), 336-348 (2014).
- Genovese, F., Karsdal, M. A. Protein degradation fragments as diagnostic and prognostic biomarkers of connective tissue diseases: understanding the extracellular matrix message and implication for current and future serological biomarkers. Expert Review of Proteomics. 13 (2), 213-225 (2016).
- Gudmann, N. S., et al. Cartilage turnover reflected by metabolic processing of type II collagen: a novel marker of anabolic function in chondrocytes. International Journal of Molecular Sciences. 15 (10), 18789-18803 (2014).
- Madej, W., van Caam, A., Davidson, E. B., Buma, P., van der Kraan, P. M. Unloading results in rapid loss of TGFβ signaling in articular cartilage: role of loading-induced TGFβ signaling in maintenance of articular chondrocyte phenotype?. Osteoarthritis and Cartilage. 24 (10), 1807-1815 (2016).
- Kjelgaard-Petersen, C. F., et al. Translational biomarkers and ex vivo models of joint tissues as a tool for drug development in rheumatoid arthritis. Arthritis & Rheumatology. 70 (9), 1419-1428 (2018).
- Wang, B., et al. Suppression of MMP activity in bovine cartilage explants cultures has little if any effect on the release of aggrecanase-derived aggrecan fragments. BMC Research Notes. 2 (4), 259 (2009).
- Bay-Jensen, A. C., et al. Enzyme-linked immunosorbent assay (ELISAs) for metalloproteinase derived type II collagen neoepitope, CIIM—Increased serum CIIM in subjects with severe radiographic osteoarthritis. Clinical Biochemistry. 44 (5-6), 423-429 (2011).
- Lories, R. J., Luyten, F. P. The bone-cartilage unit in osteoarthritis. Nature Reviews Rheumatology. 7 (1), 43-49 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved