Method Article
Ex Vivo Ткань Культура Модель хряща Ремоделирования в Bovine колено Explants
В этой статье
Резюме
Здесь мы представляем протокол, описывающий изоляцию и культивирование эксрастений хряща от бычьих коленей. Этот метод обеспечивает простой и доступный инструмент для описания изменений тканей в ответ на биологические стимулы или новые терапевтические средства, направленные на сустав.
Аннотация
Системы культуры Ex vivo охватывают широкий спектр экспериментов, посвященных изучению тканей и клеточной функции в родной обстановке. Хрящ является уникальной тканью, важной для правильной функции синовиального сустава и состоит из плотной внеклеточной матрицы (ECM), богатой протеогликаном и коллагеном II типа. Хондроциты являются единственным типом клеток, присутствующих в хрящевой и широко распространены и относительно низкив по количеству. Измененные внешние стимулы и клеточная сигнализация могут привести к изменениям в составе ЭКМ и ухудшению, которые являются важными патологическими признаками при таких заболеваниях, как остеоартрит (ОА) и ревматоидный артрит.
Модели хряща Ex vivo позволяют 1) профилирование хондроцитов опосредованного изменения оборота хрящевой ткани, 2) визуализации состава хряща ECM, и 3) хондроцитов перестановки непосредственно в ткани. Профилирование этих изменений в ответ на стимулы или лечения имеют большое значение в различных аспектах биологии хряща, и дополняют эксперименты in vitro в изолированных хондроцитах, или более сложные модели у живых животных, где экспериментальные условия труднее контролировать.
Хрящ explants представить переводный и легко доступный метод для оценки ткани ремоделирования в хрящеe ECM в контролируемых условиях. Здесь мы описываем протокол для изоляции и культивирования живых выемок хряща крупного рогатого скота. Метод использует ткани из бычьего колена, который легко доступен из местной бойни. Оба explants и обусловленной среды культуры можно проанализировать для того чтобы исследовать оборачиваемость ткани, состав ECM, и функцию хондроцита, таким образом профилировать модуляцию ECM.
Введение
Хондроциты производят и поддерживают матрицу хряща. Для того, чтобы изучить биологию хондроцитов и как они и окружающие ECM реагируют на внешние раздражители, очень важно, чтобы допросить их в их родной среде1,2. Изучение текучести хрящевой ткани важно для расширения понимания основных механизмов в суставных заболеваний, таких как ОА, болезнь, для которой в настоящее время нет болезни изменения лечения. Следовательно, существует значительная потребность в улучшении моделей перевода2.
Ex vivo характеристика клеточных и тканей эффекты имеет важное значение для дополнения других доклинических моделей, как в пробирке, таких как хондроцит монослой культур, и in vivo, таких как хирургия индуцированных моделей ОА или аутоиммунных коллагена индуцированной модели артрита (ЦРУ ). Многочисленные исследования выявили различия между тем, как клетки ведут себя в 2D монослойных культур и 3D структур или в их родной ткани3,4. Многие клетки в 2D слоях принимают неестественные морфологии, в том числе различия в полярности клеток и привязанности тканей, в результате чего как визуальные, так и функциональные различия в клетках в родных тканях5. Различия также проявляются в функциональности клеток, которые могут сдвинуть экспрессию белка, что приводит к глубоко измененным дифференциации моделей, регулятивного механизма и функциональности клеток5,6,7 ,8.
Хрящ ECM состоит в основном из коллагена типа II, обеспечивающего матричную основу, и аггрекан, протеогликан, который помогает удерживать жидкость в ткани. Другие молекулы матрицы, такие как коллаген типа IV, VI, IX, X, XI, XII, фибронектин, хрящ олигомерный белок (COMP), biglycan, декорин, и perlecan также присутствуют9.
Хотя этиология ОА остается неясным10,11, начало заболевания, как полагают, вызвано дисбалансом в текучести тканей и процессов ремонта12,13. Деградация суставного хряща является отличительной чертой ОА. Хондроциты или клетки в окружающих тканях увеличивают высвобождение цитокинов, стимулируя повышенную выработку протеиназов, таких как матричные металлопротеиназы (ММп) и аггреканатазы, которые усиливают деградацию хряща ECM 14. Эта деградация приводит к освобождению небольших уникальных фрагментов белка, называемых неоэпитопами, которые могут быть количественно в сыворотке, моче или культуре среды15. При формировании и созревании коллагена также высвобождаются так называемые профрагменты; они могут быть количественно как мера производства матрицы16.
Целью данного протокола является создание модели хряща ex vivo для сравнения влияния стимуляции и/или медикаментозного лечения на оборот тканей ECM. Оборот хряща профилируется путем измерения матричных биоэпитопных биомаркеров непосредственно в условной среде культуры с использованием ELISA: AGNx1 (отражающая активность аггреканазы), C2M (отражающая активность матрицы MMP) и ProC2 (отражающий коллаген II типа формирования). Выводы могут быть проверены гистологическим окрашиванием ECM, который также визуализирует организацию хондроцитов в отдельных эксцатах. Описанный протокол может быть использован для проверки влияния новых методов лечения на функцию хондроцитов и оборот хряща ECM. Ряд исследований использовали хрящевые экспланты для описания биологических процессов или влияния вмешательства на цитокин-оспоренные экспланты с использованием количественных гистологических или иммуногистохимических подходов, мРНК, экспрессии белка или протеомики2 ,17,18. Однако эти протоколы выходят за рамки текущей рукописи.
протокол
1. Изоляция тканей
- Ткань источников
- Выполните весь раздел поиска ткани за ламинарным капотом потока в асептической среде.
- С местной скотобойни, получить весь свежий бычьего тибиофеморального коленного сустава от телят в возрасте от 1,5 до 2 лет.
- Аккуратно вскрыть икроное колено, сначала удалив избыток плоти, вскрывая кондилы, мениска, сухожилий и синовиальной мембраны. Вырезать сухожилия и синовиальной мембраны, что позволяет сустава расчленить. Удалите мениск, чтобы разоблачить бедренные кондилы.
- Изолировать эксматериалы из несущей области бедренной кондилов с помощью 3 мм биопсии перфоратор и освободить их от суставной поверхности путем резки скальпелем параллельно и как можно ближе к подхондрятель кости, как это возможно. Твердая структура подхноловой кости должна гарантировать, что экспланты не содержат кальцинированную матрицу. Стремитесь к эксламтам с равномерной высотой.
- Немедленно храните и смешивайте экспланты в DMEM/F12- GlutaMAX - 1% P/S культуры среды в 50 мл трубки или Петри блюдо. Не смешивайте экспланты с разных колен коров, но держите отдельно для каждого исследования.
- Ткань культивирования
- Перенесите экспланты на стерильную 96-ну хорошую пластину в ламинарном капоте.
- Вымойте explants 3 раза в среде культуры или PBS и культуры их в 200 зЛ культуры среды в хорошо до начала эксперимента. Используйте период вымывания 1 день для синхронизации биопсии клеточной активности и пассивного высвобождения биомаркеров.
- Культура explants до 10 недель в инкубаторе 37 градусов с 5% CO2. Поместите все репликации в каждой группе по диагонали в культурной пластине, чтобы свести к минимуму изменения, вызванные испарением. Чтобы избежать испарения супернатанта, добавьте PBS к внешним колодцам культурной плиты.
2. Лечение эксплантатором хряща крупного рогатого скота и оценка метаболической активности
- Культура среднего изменения и лечения
- Изменение среды культуры каждые 2-3 дня в ламинарной капоте потока.
- При применении каких-либо процедур, подготовить их до изменения среды. Подготовьте обработки к познавательной концентрации в скважинах explant разбавлять в среде культуры.
- Аккуратно удалите супернатант из каждой скважины и перенесите его на новую пластину 96 скважин. Храните супернатант с уплотнительной лентой при 20 градусах Цельсия для анализа биомаркеров текучести тканей и экспрессии белка.
- Немедленно добавьте 200 л свежей среды культуры или лечения в скважине. Не позволяйте эксцатам высохнуть во время среднего изменения и убедитесь, что все экспланты полностью погружены в новую среду.
- Резазурин окрашивания
- Измеряйте метаболическую активность один раз в неделю как косвенное измерение жизнеспособности клеток. Тест резазурина является простым способом оценки, если метаболическая активность эксплантов ухудшается для отдельных explant из-за клеточной смерти или клеточных изменений. Высаживания только в среде культуры имеют относительно стабильное чтение resazurin на протяжении всего периода эксперимента.
- Сделать решение культуры среды с 10% resazurin.
- Урожай супернатанта, как описано в шаге 2.1.3.
- Погрузите экспланты в 10% растворина в течение 3 ч при 37 градусах по Цельсию или до тех пор, пока супернационты не повернут фиолетовыми. Включите 4 скважины без эксплансов в качестве фонового элемента управления.
- Перенесите условный и фоновой контроль растворина в черную пластину микротитера и измерьте флуоресценцию при 540 нм.
- Тщательно вымойте 3 раза в среде культуры или PBS и погрузить explants в среде мытья в течение 5-10 минут, чтобы resazurin полностью рассеять. Добавить новую среду культуры или лечения при использовании.
3. Прекращение, фиксация и хранение образцов
- Прекращение периода культивирования
- Измерьте метаболическую активность, описанную в шаге 2.2. Добавьте 200 л PBS в скважину.
- Фиксация и хранение
- Удалить PBS, добавить 200 л формальдегида в скважину, и оставить на 2 ч при комнатной температуре.
- Утилизировать формальдегид и добавить 200 Л ПБС на скважину. Накройте тарелку уплотнительной лентой и храните при 4 градусах Цельсия для гистохимического анализа. Мы рекомендуем проводить гистохимический анализ в течение 3 месяцев.
4. Биомаркеры оборота тканей (ELISA)
- Косвенные конкурентные ELISAs
- Пальто стрептавидина пластины с конкретными биоинтинилатами асссеид ный пептид разбавленный 1:100 в буфере ассеа (100 л на хорошо) в течение 30 мин при 20 градусах Цельсия.
- Вымойте 5 раз со стандартным буфером стирки и добавить образец-супернатант (20 л на скважину) вместе с первичным моноклональным антителом против ассеа целевого пептида, разбавленного 1:93.3 для ProC2 и 1:100 в буфере ассоса для AGNx1 (100 л на скважину) и инкубировать в течение 2 ч при 20 градусах Цельсия с встряхиванием для ProC2 и 3 ч при 20 кв. м для AGNx1.
ПРИМЕЧАНИЕ: Объем образца непосредственно взят из хранящихся супернатантных пластин. Если измеренная концентрация находится вне диапазона измерения, разбавьте супернатант в v-bottomed разбавленной пластине в PBS или буфере проверки. - Вымойте 5 раз со стандартным буфером стирки и инкубировать с пероксидаза помечены вторичные антитела разбавленной 1:100 в ассе-буфер (100 л на хорошо) в течение 1 ч при 20 градусов по Цельсию.
- Вымойте 5 раз со стандартным буфером стирки и инкубировать с встряхиванием в течение 15 минут в темноте при 20 градусах Цельсия с тетраметилбензидином (TMB) в качестве субстрата пероксидазы (100 л на скважину).
- Завершите реакцию стандартным стоп-шотом, 0,1 М Н2SO4 (100 л на скважину).
- Прочитайте колористетриюреакцию при абсорбции 450 нм, используя эталонную абсорбцию на уровне 650 нм на стандартном лабораторном считывателе.
- Прямые конкурентные ELISA для измерения оборота хрящевой ткани в супернатанте
ПРИМЕЧАНИЕ: Это количествли C2M.- Пальто стрептавидина пластины с конкретными биоинтинилатами асссеитария целевого пептида разбавленной 1:100 в буфере ассе (100 л на хорошо) в течение 30 мин при 20 градусах Цельсия.
- Вымойте 5 раз с мытьем буфера и добавить образец-супернатант вместе с 100 злител емким имонотальным антителом с маркировкой пероксидазы против разбавленного целевого пептида 1:100 в буфере анализов (20 л на колодец). Инкубировать в течение 20 ч при 2-8 градусов с встряхиванием.
ПРИМЕЧАНИЕ: Объем образца непосредственно взят из хранящихся супернатантных пластин. Если измеренная концентрация находится вне диапазона измерения, разбавьте супернатант в v-bottomed разбавленной пластине в PBS или буфере проверки. - Вымойте 5 раз со стандартным буфером стирки и инкубировать с встряхиванием в течение 15 минут в темноте при 20 градусах Цельсия с TMB в качестве субстрата пероксидазы (100 qL на скважину).
- Завершите реакцию стандартным стоп-шотом, 0,1 М Н2SO4 (100 л на скважину).
- Прочитайте колористетриюреакцию при абсорбции 450 нм с эталонным абсорбцией на 650 нм на стандартном лабораторном считывателе.
- AGNx1
- Количественно еггрекан деградации путем измерения выпуска AGNx1 нео-эпитопа. Этот косвенный конкурентный ассси сeaл цели аггрекан C-терминал пептид (NITEGE373) порожденных ADAMTS-4 и 5 декольте. Моноклональное антитело распознает все фрагменты с помощью обнажённых эпитопа NITEGE. Экспериментальные детали ассея были опубликованы в другом месте19.
- ProC2
- Количественное образование коллагена II типа путем измерения выпуска профрагмента коллагена II типа. Этот косвенный конкурентный обзор ELISA нацелен на эпитоп пропептида PIIBNP (DVR-PG), генерируемого N-пропептидазами во время обрезки недавно синтезированного коллагена II типа. Экспериментальные детали ассея были опубликованы в другом месте16.
- C2M
- Количественная деградация коллагена типа II путем измерения выделения фрагмента неоэпитопа C2M. Этот прямой конкурентный ELISA признает MMP-расщепляется C-терминал пептид (KPPGRDGAAG1053). Этот ассеиотличается от AGNx1 и ProC2, так как это первичное антитело, которое маркируется пероксидаза и, таким образом, используется в качестве детектора. Экспериментальные детали ассея были опубликованы в другом месте20.
5. Гистологический анализ
- Инфильтрация, встраивание и резка
- Поместите фиксированные экспланты (см. шаг 3.2) в индивидуально маркированные кассеты. Включите как этикетку в кассету, так и кассеты с этикеткой для обеспечения идентификации.
- Перенесите кассеты, содержащие экспланты, в машину для процессора тканей. Затем проникают в экстенсы с парафином в серии обезвоживания и парафиновой инфильтрации шагов.
- Обезвоживание с 96% этанола в течение 90 минут без корректировки температуры. Повторите этот шаг 3 раза.
- Очистить этанол с толуолом в течение 90 минут без корректировки температуры. Повторите этот шаг 2 раза.
- Очистить этанол с толуолом в течение 90 мин при 60 градусах По Цельсию.
- Проникать с парафиновым воском в течение 30 мин при 60 градусах Цельсия.
- Проникать с парафиновым воском в течение 60 мин при 60 градусах Цельсия.
- Проникать с парафиновым воском в течение 90 мин при 60 градусах Цельсия.
- Для каждого шага добавьте растворы в образец камеры с медленным выкачиванием и насосными потоками под 33-34 кПа. Запустите процесс инфильтрации в цикле давления/вакуума с максимальным вакуумом от 65 до 70 кПа.
- После инфильтрации поместите кассеты на нагревательный блок, чтобы обеспечить тщательное удаление вылазов из кассеты. Аккуратно встраивайтесь в проинфильтртированные экспланты в отдельные парафиновые блоки. С нагретыми щипчинками, место explants с поверхностным суставным хряща и подхналовых костных сторон перпендикулярно резки поверхности, обеспечивая визуализацию различных слоев хряща в каждом разделе образца.
- Вырезать 5 мкм разделы охлажденных парафин-блоков со встроенными эксплантированными на микротоме. Перенесите вырезанные секции на холодную ванну. При необходимости разделы можно отделить либо скальпелем, либо крышкой стекла.
- Используя непокрытую стеклянную горку тщательно, перенесите секции на теплую водяную ванну (50 градусов по Цельсию), где разворачиваются секции. Поднимите каждую секцию на маркированную крышку слайда и поместите на горячую тарелку в течение 30 минут.
- Поместите слайды в корзину и инкубировать при 60 градусах по Цельсию в течение 1 ч, а затем держать их на ночь при 37 градусах Цельсия. В дальнейшем храните слайды в закрытых контейнерах при 4 градусах Цельсия до окрашивания.
- Safranin O/Fast Green окрашивание и визуализация
- Поместите горки, чтобы быть окрашены в корзину и инкубировать слайды на 60 градусов по Цельсию в течение 1 ч.
- Приготовьте и процедите все реагенты фильтром 0,45 мм.
- При подготовке к окрашиванию, залить фильтрованные реагенты в клювах на объем, который позволяет решениям полностью покрыть слайды при погружении в корзину. Для покрытия горок использовались клювы, которые требовали объемом 250 мл.
- Депараффинизировать расплавленные горки, погрузив корзину в толуол в течение 10 минут дважды, 99% этанола в течение 2 минут дважды, 96% этанола в течение 2 минут дважды, и 70% этанола в течение 2 минут дважды. Затем увлажнить горки в воде в течение 2 мин.
- Пятно депарафинизированных и гидратированных слайдов путем погружения корзины в растворе hematoxylin в Weigert (pH 1.5) в течение 10 минут, окунуться в 1% HCl один раз, и промыть проточной водопроводной водой в течение примерно 5 мин или до тех пор, пока избыток цвета смыло.
- Далее, пятно в 0,05% Быстрый зеленый раствор (pH: 5,75) на 5 мин, окунуться в 1% CH3COOH один раз, и пятно в 0,1% Safranin O (pH: 6,5) в течение 20 мин.
- Обезвоживание и очистить слайды, окунув дважды в 70% этанола, 96% этанола в течение 2 минут дважды, 99% этанола в течение 2 минут в два раза, и толуол 2 мин в два раза.
- Смонтировать непокрытые стеклянные горки с помощью синой среды, покрывающей гистологические горки.
Результаты
Бовин полноглубинные экспланты были изолированы, культурны, и лечение в течение 3 недель(рисунок 1). Культура среда была изменена с добавлением лечения 3 раза в неделю. Однажды еженедельно метаболическая активность измерялась с помощью резазурина. Биомаркеры оборота ECM измерялись в супернатанте, собранном из культурной плиты 3 раза в неделю. Вылазоры были разделены на 4 группы для лечения: 1) Онкостатин М и ТНФЗ (ОЗТ); 2) ОСТ и GM6001 (GM6001); 3) Инсулин как фактор роста-1 (IGF-1); и 4) контроль без лечения (w/o).
Метаболическая активность.
Для всех четырех групп метаболическая активность была относительно стабильной в течение 3 недель(рисунок 2А). Была тенденция к тому, что IGF-1 увеличивает метаболическую активность чуть выше группы ж/о, а группы ОГТ уменьшают ее. Резазурин был использован для легкой оценки активности хондроцитов в каждом экспланте и косвенной оценки жизнеспособности клеток без извлечения эксрастений из эксперимента. Если эксплантирование показывает существенное снижение метаболической активности в ходе эксперимента, эксплант может быть исключен из дальнейшего анализа.
Катаболическое лечение.
ОТ применялась 3 раза в неделю к культурным скважинам для исследования деградации хряща, опосредованного ОТ(рисунок 3, рисунок 4). MMP-опосредованного типа II деградации коллагена и аггреканазы опосредованности аггрекан деградации были оценены C2M и AGNx1 ELISAs. ОЗТ увеличила деградацию коллагена II типа с 7-21 дней(рисунок 3А)и деградацию аггрекан с 3-14 дней(рисунок 4А)по сравнению с группой ж/о. При добавлении GM6001 (ингибитор ММП широкого спектра спектра) в сочетании с лечением ОЗТ, выпуск ОТ-опосредованного C2M был заблокирован(рисунок 3A,B). Снижение AGNx1 релиз наблюдался при добавлении GM6001 в дни 3-7, но AGNx1 релиз пики на день 10 на аналогичных уровнях, чтобы группа ОЗТ (Рисунок 4A), указывая НА GM6001 только уменьшает деградацию aggrecan в ограниченной степени. Эта модель в выпуске AGNx1 и C2M является общей картиной, наблюдаемой в модели хряща крупного рогатого скота, стимулируемой с помощью ОЗТ. Во-первых, AGNx1 высвобождается примерно с 3-го дня и достигает пиков в 10-14 дней, что представляет собой раннюю деградацию аггрекана. Далее, после 2 недель культивирования с Помощью ОЗТ, наблюдается деградация коллагена II типа, измеряемая биомаркером C2M.
Анаболическое лечение.
Чтобы исследовать, как анаболическая стимуляция модулирует оборот хряща ECM, инсулин, как фактор роста-1 (IGF-1) был применен 3 раза в неделю, чтобы крупной глубины explants. Влияние IGF-1 на расходные установки хряща наблюдалось в основном на измерениях образования коллагена II типа, оцениваемых ProC2, как и ожидалось для анаболических стимулов(рисунок 5). День 0 в этой модели всегда показывает высокие измерения ProC2, возможно, в качестве реакции на извлечение образцов. Эти высокие уровни существенно уменьшаются и выравниваются с 7-21 дней. При лечении IGF-1, уровни ProC2 уменьшаются меньше, чем те, которые наблюдаются в группе ж/о, что указывает на то, что IGF-1 стимулирует образование коллагена II типа с 7-го дня(рисунок 5B). Графики ProC2 также показывают биологическую вариацию коров. В этих экспериментах использовались растения двух коров с 6 эксламами на корову на группу. Первая корова имела более толстый хрящ и генерировала более крупные экспланты, что приводило к более высоким уровням ProC2 на базовом уровне, в то время как вторая корова была меньше с более тонким хрящом, что приводило к более низким уровням ProC2 на базовом уровне. Для групп w/o, IGF-1 и ОЗТ уровни ProC2 изображали среднее значение эксплансов обеих коров, но GM6001 измерялся только во второй корове с более тонкими эксрастениями. Таким образом, группа GM6001 начала с более низких уровней ProC2 в день 0, что проявляется в области ProC2 под кривой (AUC) (Рисунок 5C). Нормализация значений ProC2 до уровня 0 дней учитывает биологическую дисперсию, тем самым показывая эффективность лечения(рисунок 5В,D).
Safranin O и Fast Green гистологические пятна были выполнены для визуализации содержания протеогликана и структуры хряща explant на протяжении всего эксперимента(рисунок 6). В дни 0, 7, 14 и 21, explants от ж / о, IGF-1, и O'T группы были зациклены на гистологическое окрашивание(Рисунок 6). W / O и IGF-1 группа, как представляется, аналогичные Safranin O окрашивания интенсивности на следующий день 0 explant на протяжении всего эксперимента, который коррелирует с результатами биомаркера, показывающие, что ни одна из двух групп увеличилось AGNx1 релиз (Рисунок 4). Лечение с помощью O'T привело к существенной потере содержания протеогликана на 7-й день и полной потере на 21-й день. Кроме того, быстро зеленый окрашивания интенсивность уменьшается с дней 14-21, что свидетельствует о потере коллагена в соответствие с результатами C2M.
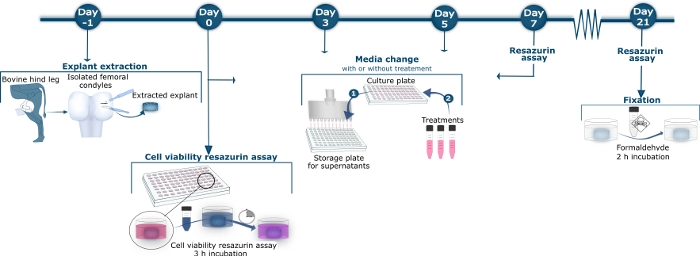
Рисунок 1: Схематический обзор метода хряща крупного рогатого скота.
В день No 1, бычьи бедренные кондилы были изолированы от заднего тибиофеморального сустава. Полноглубинные хрящевые экспланты были выпущены из кондилов с скальпелем и биопсии перфоратором. Извлеченные экспланты промывали и передавали в стерильную культурную плиту 96 колодцев. В день 0, 3, 5, 7, 10, 12, 14, 17, 19 и 21, супернатант был собран из культурной плиты, перенесен на плиту для хранения, и хранится при 20 градусах Цельсия, как показано в шаге среднего изменения 1. Сохраненный супернатант был позже разморожен для измерения биомаркеров оборота тканей конкретными анализами ELISA. В Средней Смена Шаг 2, после удаления супернатанта, новая среда культуры, содержащая различные методы лечения или нет лечения для контроля explants был применен. На день 0, 7, 14 и 21, explants были инкубированы с раствором 10% resazurin для 3 h после заготовки supernatant. 10% resazurin supernatant был перенесен в черный 96-колодец пластины, где колористетрия реакция была измерена. Культурные колодцы промывались 3 раза, прежде чем новая культурная среда с или без обработки была добавлена к вылазке, как показано в Medium Change Step 2. На 21 день, после сбора супернатанта и резазурина, экспланаторы были зациклены инкубации с формальдегидом на 2 ч. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
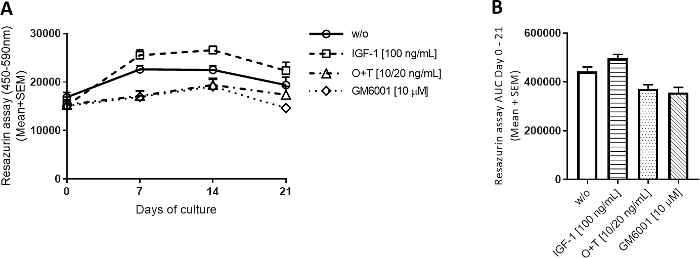
Рисунок 2: Метаболическая активность измеряется резазурином.
Крупновой полной глубины хряща explants были изолированы и культивируется в течение 3 недель. Культурная среда была изменена с добавлением нового лечения 3 раза в неделю (n no 12 explants из 2 коров). Лечение состояло из IGF-1 (100 нг/мл), ОСМ (ТНФЗ) (ОЗТ) (10/20 нг/мл) и ОЗТ (10/20 нг/мл) и GM6001 (GM6001) (GM6001) (GM6001). Была включена контрольная группа без лечения (w/o). Для группы ж/о, IGF-1 и O'T показана средняя и стандартная ошибка среднего (SEM) из 12 репликаций из 2 коров (6 реплик на корову). Для группы GM6001 показаны средние и SEM из 6 репликатов от 1 коровы. (A) Метаболическая активность измеряется resazurin. (B) Область под кривой (AUC) в течение дней 0-21 для метаболической активности графики показаны в (A). р йgt; 0.0001. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
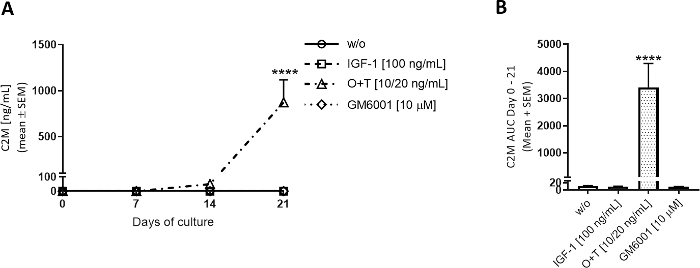
Рисунок 3: Деградация коллагена II типа, измеряемая С2М.
Крупновой полной глубины хряща explants были изолированы и культивируется в течение 3 недель. Культурная среда была изменена с добавлением нового лечения 3 раза в неделю. Лечение состояло из IGF-1 (100 нг/мл), ОСМ (ТНФЗ) (ОЗТ) (10/20 нг/мл) и ОЗТ (10/20 нг/мл) и GM6001 (GM6001) (GM6001) (GM6001). Была включена контрольная группа без лечения (w/o). Для групп w/o, IGF-1 и O'T показаны средние и SEM из 12 репликаций из 2 коров (6 реплик на корову). Для группы GM6001 показаны средние и SEM из 6 репликатов от 1 коровы. (A) C2M измерения. Уровень статистической значимости w/o был рассчитан по повторным измерениям (RM) двусторонней ANOVA с многократным сравнительный тест Сидака. (B) AUC в течение нескольких дней 0-21 для C2M графики показаны в (A). Статистическая значимость была рассчитана по тесту Крускал-Валлис с многократным сравнительным тестом Данна. р йgt; 0.0001. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 4: Aggrecan деградации измеряется AGNx1.
Крупновой полной глубины хряща explants были изолированы и культивируется в течение 3 недель. Культурная среда была изменена с добавлением нового лечения 3 раза в неделю. Лечение состояло из IGF-1 (100 нг/мл), ОСМ (ТНФЗ) (ОЗТ) (10/20 нг/мл) и ОЗТ (10/20 нг/мл) и GM6001 (GM6001) (GM6001) (GM6001). Была включена контрольная группа без лечения (w/o). Для группы ж/о, IGF-1 и O'T показаны средние и SEM из 12 репликаций из 2 коров (6 репликна на корову). Для группы GM6001 показаны средние и SEM из 6 репликатов от 1 коровы. (A) измерения AGNx1. Уровень статистической значимости w/o был рассчитан РМ двусторонним ANOVA с многократным сравнительный тест Сидака. (B) AUC в течение нескольких дней 0-21 для графиков AGNx1 показано в (A). Статистическая значимость была рассчитана по тесту Крускал-Валлис с многократным сравнительным тестом Данна. Р. р.; 0,01,р-р; 0,001, р.р.; 0,0001. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
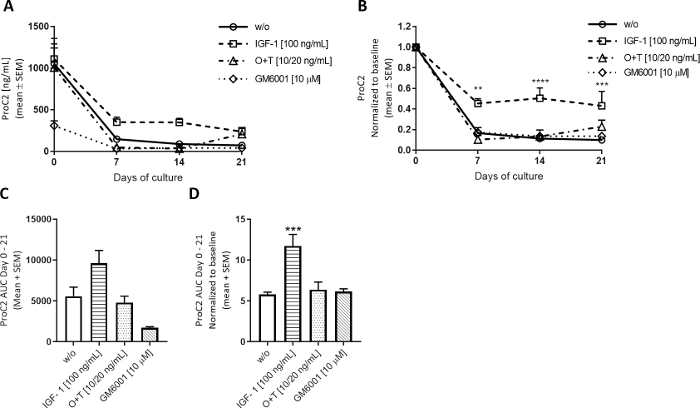
Рисунок 5: Формирование коллагена II типа, измеренное ProC2.
Крупновой полной глубины хряща explants были изолированы и культивируется в течение 3 недель. Культурная среда была изменена с добавлением нового лечения 3 раза в неделю. Лечение состояло из IGF-1 (100 нг/мл), ОСМ (ТНФЗ) (ОЗТ) (10/20 нг/мл) и ОЗТ (10/20 нг/мл) и GM6001 (GM6001) (GM6001) (GM6001). Была включена контрольная группа без лечения (w/o). Для группы ж/о, IGF-1 и O'T показаны средние и SEM из 12 репликаций из 2 коров (6 репликна на корову). Для группы GM6001, средняя и SEM 6 реплики из 1 коровы повторно показано. (A) Измерения ProC2 в дни 0-21. (B) Значения ProC2 нормализовались до дня 0 измерений для каждого отдельного explant. Результаты ProC2 часто выигрывают от нормализации дня 0, чтобы раскрыть эффект лечения, который может быть замаскирован высоким уровнем биомаркеров в день 0. В A и Bуровень статистической значимости был рассчитан РМ двусторонним ANOVA с многократным сравнительный тест Сидака. (C) AUC в течение нескольких дней 0-21 для диаграмм ProC2 показано в (A). (D) AUC в течение дней 0-21 за день 0 нормализованных ProC2 графики показаны в (B). В C и D, статистическая значимость была рассчитана по тесту Kruskal-Wallis с многократным тестом сравнения Данна. Р. р.; 0,01,р-р; 0,001, р.р.; 0,0001. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
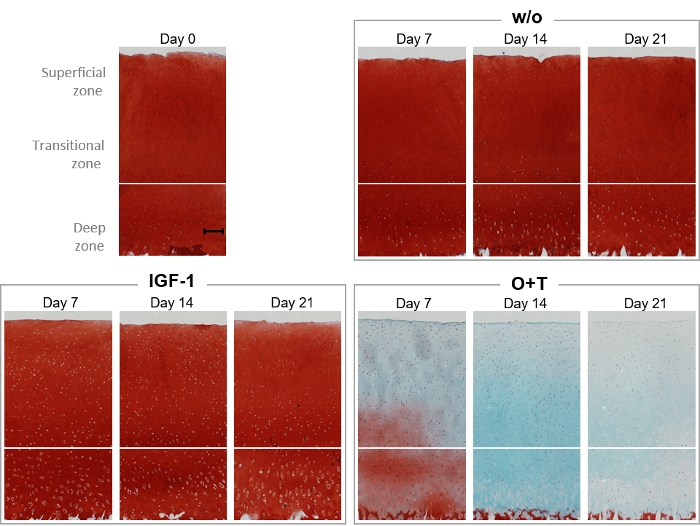
Рисунок 6: Гистологическая визуализация протеогликанного содержания Safranin O/Fast Green окрашивания.
Крупновой полной глубины хряща explants были изолированы и культивируется в течение 3 недель. Культурная среда была изменена с добавлением нового лечения 3 раза в неделю. Лечение состояло из IGF-1 (100 нг/мл) и ОСМ - ТНФЗ (ОЗТ) (О'Т) (10/20 нг/мл). Была включена контрольная группа без лечения (w/o). На день 0, 7, 14 и 21, explants были зациклены, проникли с парафином, встроенные в парафина, нарезанный, помещены на крышку слайды, и окрашенные гематоксилин, Safranin O, и Быстрый зеленый. Для каждой группы лечения и каждой временной точки отображается представительный эксплант. Шкала, показанная в базовой выборке (день 0), представляет 200 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Представленный здесь протокол для профилирования оборота хрящевой ткани в вылазках хряща крупного рогатого скота может быть использован для характеристики лечебных эффектов многих видов препаратов, включая ингибиторы воспалительных внутриклеточных путей, ингибиторы протеолитические ферменты, или анаболические факторы роста.
В этом протоколе описаны две различные установки: анаболическая установка, в которой экспланаторы стимулировались инсулиноподобным фактором роста 1 (IGF-1), и катаболическая установка, включающая стимуляцию с помощью TNF-альфа и Oncostatin M, в которой оборот тканей может быть ингибируется с использованием ингибитора ММП широкого спектра. Основным результатом этого метода является количественная оценка биомаркеров неоэпитопов непосредственно в условной среде, которая собирается на протяжении всего периода культуры. Несколько биомаркеров можно измерить в супернатанте, что позволяет одновременно профилировать различные катаболические и анаболические процессы в одном образце. Гистологическое окрашивание с Safranin O/Fast Green было использовано для проверки результатов анализа биомаркеров. Для описания протокола использовались Онкостатин М, ТНФ-альфа и IGF-1; однако, метод не ограничивается конкретными стимуляторами цитокинов, и они могут быть легко обменян на другие в зависимости от гипотезы или тест лечения.
Интерпретация выхода биомаркера является временным упражнением из-за динамических изменений функции хондроцитов и профилей экспрессии с анаболической или катаболической стимуляцией с течением времени. В необработанных эксцатах образование коллагена II типа, измеряемое биомаркером ProC2, быстро уменьшается в течение первых 7-10 дней. Стимулирование с IGF-1 или аналогичными факторами роста поддерживает выпуск ProC2 в условиях среды на уровне, сопоставимом с базовым; таким образом, снижение является более постепенным, и выпуск увеличивается по отношению к необработанным эксплантам. В катаболической установке провоспалительные цитокины вызывают повышенное выражение протеаз хондроцитом в дни 0-14; это состоит в основном из аггреканаз. Это приводит к первоначальному значительному увеличению фрагментов белка, полученных из агггггрекса, включая AGNx1. На более поздних стадиях культуры хондроциты выражают больше ММП, что приводит к выпуску mMP-генерируемых маркеров, таких как C2M, около 14-го дня и далее. Таким образом, для того, чтобы профилировать эффект лечения, важно измерить биомаркеры в нужном интервале времени.
Как описано, лечение воспалительными цитокинами, такими как коктейль ОЗТ, со временем приведет к деградации хрящевых тканей. Общий пул ECM ограничен размером экспланта и должен учитываться при анализе профиля биомаркера. Следовательно, после первоначального увеличения выпуска биомаркеров, уровни могут снижаться со временем просто из-за сокращения оставшегося количества эксплантирования ECM.
Ранее ОА в первую очередь считалось заболеванием суставного хряща. Тем не менее, последние исследования показывают, что ОА следует рассматривать как болезнь всего сустава, где ранние изменения, связанные с болезнью в отдельных суставных отсеках, синовиум, кости и хряща, происходят параллельно, и с течением времени привести к совместной недостаточности12 ,21. Поэтому важно признать, что в этой модели системы, хрящ изолирован от остальной части сустава (и организма), ограничивая влияние эффектов взаимодействия тканей и системных факторов, которые могут регулировать гомеостаз ткани. Вместо этого, это упрощенная культура одной ткани, где экспериментально контролируемые условия могут быть модулированы для обнаружения патологических или интервенционных изменений в ткани с помощью биохимических методов, биомаркеров или гистологической визуализации. Из-за архитектуры хряща, изменения в количестве клеток, матричной композиции и вариации количества, как между эксрастениями, так и между источниками ткани. Поскольку относительная величина выхода биомаркеров может отличаться между экспериментами, рекомендуется нормализовать наборы данных для лучшего сравнения.
Для обеспечения наименьших возможных изменений и наилучших результатов, важно использовать хрящ из колен, которые являются как можно более свежими, предпочтительно между 1 и 24 ч после разделки. Изоляция хрящевой ткани должна быть сделана в однородном путе с explants быть грубо такой же толщиной. Вылазки должны быть изолированы от областей толстого хряща, избегая областей, близких к середине. Ткань всегда должна быть влажной, чтобы избежать гибели клеток и разложения матрицы. Продолжительность эксперимента3, время между средними изменениями, сроки стимуляции цитокинов, и интервалы лечения могут быть скорректированы в соответствии с гипотетическим режимом действия индивидуального соединения или механизма.
Раскрытие информации
CST, ACBJ и MK являются сотрудниками Nordic Bioscience. ACBJ и MK владеет акциями Nordic Bioscience. Остальным авторам нечего раскрывать.
Благодарности
Авторы благодарят технического персонала Nordic Bioscience за лабораторную поддержку, а также Датский исследовательский фонд за общую поддержку наших исследований.
Материалы
| Name | Company | Catalog Number | Comments |
| 45% Iron(III) chloride solution | Sigma-Aldrich | 12322 | |
| Acetic acid | Merck | 1.00056.2500 | |
| Alamar Blue | Life tech Invitrogen | DAL1100 | |
| Biopsy processing cassettes – green | IHCWORLD | BC-0109G | |
| Biopsy punch W/Plunger (3 mm) | Scandidat | MTP-33-32 | |
| Bovine cartilage (Bovine knees) | Local slaughterhouse | ||
| C2M | Nordic Bioscience | Fee for service | |
| Corning 96-well plate | Sigma-Aldrich | CLS7007 | |
| Cover Glass Ø 13 mm | VWR | 631-0150P | |
| DMEM/F12-GlutaMAX Dulbecco's Modified Eagle Medium/Nutrient Mixture F-12) without HEPES | Gibco | 31331-028 | |
| Ethanol ≥96% | VWR | 83804.36 | |
| Ethanol absolute ≥99.5% | VWR | 83813.36 | |
| exAGNx1 | Nordic Bioscience | Fee for service | |
| exPRO-C2 | Nordic Bioscience | Fee for service | |
| Fast green | Sigma-Aldrich | F7252 | |
| Formaldehyde solution 4% | Merck | 1004965000 | |
| GM6001 | Sigma-Aldrich | M5939-5MG | |
| Hematoxylin | Sigma-Aldrich | H3136 | |
| Hydrochloric acid | Merck | 30721-M | |
| IGF-1 | Sigma-Aldrich | I3769-50UG | |
| Oncostatin M | Sigma-Aldrich | O9635-10UG | |
| Penicillin-streptomycin (P/S) | Sigma-Aldrich | P4333 | |
| Pertex (mounting medium for light microscopy) | HistoLab | 811 | |
| Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| Safranin O | Sigma-Aldrich | S2255 | |
| Sterile Standard Scalpels | Integra Miltex | 12-460-451 | |
| Sulfuric acid | Sigma-Aldrich | 30743 | |
| SUPERFROST PLUS Adhesion Microscope Slides | Thermo scientific | J1800AMNT | |
| TNF-alpha | R&D Systems | 210-TA-100 | |
| Toluene | Merck | 1.08327.2500 | |
| Vacuum Filtration "rapid"-Filtermax | TPP | 99955 |
Ссылки
- Cope, P. J., Ourradi, K., Li, Y., Sharif, M. Models of osteoarthritis: the good, the bad and the promising. Osteoarthritis and Cartilage. 27 (2), 230-239 (2018).
- Thysen, S., Luyten, F. P., Lories, R. J. U. Targets, models and challenges in osteoarthritis research. Disease Models & Mechanisms. 8 (1), 17-30 (2015).
- Reker, D., et al. Articular cartilage from osteoarthritis patients shows extracellular matrix remodeling over the course of treatment with sprifermin (recombinant human fibroblast growth factor 18). Osteoarthritis and Cartilage. 26, S43 (2018).
- Kjelgaard-Petersen, C., et al. Synovitis biomarkers: ex vivo characterization of three biomarkers for identification of inflammatory osteoarthritis. Biomarkers. 20 (8), 547-556 (2015).
- Henriksen, K., et al. A specific subtype of osteoclasts secretes factors inducing nodule formation by osteoblasts. Bone. 51 (3), 353-361 (2012).
- Gigout, A., et al. Sprifermin (rhFGF18) enables proliferation of chondrocytes producing a hyaline cartilage matrix. Osteoarthritis and Cartilage. 25 (11), 1858-1867 (2017).
- Reker, D., et al. Sprifermin (rhFGF18) modulates extracellular matrix turnover in cartilage explants ex vivo. Journal of Translational Medicine. 15 (1), 3560 (2017).
- Karsdal, M. A. Introduction. Biochemistry of Collagens, Laminins and Elastin. , (2016).
- Heinegård, D., Saxne, T. The role of the cartilage matrix in osteoarthritis. Nature Reviews Rheumatology. 7 (1), 50-56 (2011).
- Karsdal, M. A., et al. Osteoarthritis– a case for personalized health care?. Osteoarthritis and Cartilage. 22 (1), 7-16 (2014).
- Karsdal, M. A., Bay-Jensen, A. C., Henriksen, K., Christiansen, C. The pathogenesis of osteoarthritis involves bone, cartilage and synovial inflammation: may estrogen be a magic bullet?. Menopause International. 18 (4), 139-146 (2012).
- Loeser, R. F., Goldring, S. R., Scanzello, C. R., Goldring, M. B. Osteoarthritis: a disease of the joint as an organ. Arthritis and Rheumatism. 64 (6), 1697-1707 (2012).
- Goldring, M. B., Goldring, S. R. Osteoarthritis. Journal of Cellular Physiology. 213 (3), 626-634 (2007).
- Karsdal, M. A., et al. The coupling of bone and cartilage turnover in osteoarthritis: opportunities for bone antiresorptives and anabolics as potential treatments?. Annals of the Rheumatic Diseases. 73 (2), 336-348 (2014).
- Genovese, F., Karsdal, M. A. Protein degradation fragments as diagnostic and prognostic biomarkers of connective tissue diseases: understanding the extracellular matrix message and implication for current and future serological biomarkers. Expert Review of Proteomics. 13 (2), 213-225 (2016).
- Gudmann, N. S., et al. Cartilage turnover reflected by metabolic processing of type II collagen: a novel marker of anabolic function in chondrocytes. International Journal of Molecular Sciences. 15 (10), 18789-18803 (2014).
- Madej, W., van Caam, A., Davidson, E. B., Buma, P., van der Kraan, P. M. Unloading results in rapid loss of TGFβ signaling in articular cartilage: role of loading-induced TGFβ signaling in maintenance of articular chondrocyte phenotype?. Osteoarthritis and Cartilage. 24 (10), 1807-1815 (2016).
- Kjelgaard-Petersen, C. F., et al. Translational biomarkers and ex vivo models of joint tissues as a tool for drug development in rheumatoid arthritis. Arthritis & Rheumatology. 70 (9), 1419-1428 (2018).
- Wang, B., et al. Suppression of MMP activity in bovine cartilage explants cultures has little if any effect on the release of aggrecanase-derived aggrecan fragments. BMC Research Notes. 2 (4), 259 (2009).
- Bay-Jensen, A. C., et al. Enzyme-linked immunosorbent assay (ELISAs) for metalloproteinase derived type II collagen neoepitope, CIIM—Increased serum CIIM in subjects with severe radiographic osteoarthritis. Clinical Biochemistry. 44 (5-6), 423-429 (2011).
- Lories, R. J., Luyten, F. P. The bone-cartilage unit in osteoarthritis. Nature Reviews Rheumatology. 7 (1), 43-49 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены