Method Article
Um modelo ex vivo da cultura do tecido da cartilagem que remodela em explants bovinos do joelho
Neste Artigo
Resumo
Aqui, apresentamos um protocolo que descreve o isolamento e a culturing de explants de cartilagem de joelhos bovinos. Este método fornece uma ferramenta fácil e acessível para descrever mudanças de tecido em resposta a estímulos biológicos ou novas terapêuticas visando a articulação.
Resumo
Os sistemas de cultura Ex vivo abrangem uma ampla gama de experimentos dedicados ao estudo da função de tecido e celular em um ambiente nativo. A cartilagem é um tecido único importante para a função adequada da articulação sinovial e é constituída por uma densa matriz extracelular (ECM), rica em proteoglican e colágeno tipo II. Condrocitos são o único tipo de célula presente dentro da cartilagem e são difundidos e relativamente baixos em número. Estímulos externos alterados e sinalização celular podem levar a mudanças na composição e deterioração do CmCm, que são importantes características patológicas em doenças como osteoartrite (OA) e artrite reumatóide.
Os modelos de cartilagem ex vivo permitem 1) o perfil de alterações mediadas por condrocitos de volume de negócios de tecido de cartilagem, 2) visualizando a composição do ECM da cartilagem e 3) rearranjo de condrocito diretamente no tecido. O perfil dessas alterações em resposta a estímulos ou tratamentos são de alta importância em vários aspectos da biologia da cartilagem e complementam experimentos in vitro em condrócitos isolados ou modelos mais complexos em animais vivos onde condições experimentais são mais difíceis de controlar.
Os explants da cartilagem apresentam um método translational e facilmente acessível para avaliar a remodelação do tecido na cartilagem ECM em ajustes controláveis. Aqui, descrevemos um protocolo para isolar e cultivar explantas de cartilagem bovina viva. O método usa o tecido do joelho bovino, que é facilmente acessível a partir da carnificina local. Tanto explantas quanto o meio de cultura condicionada podem ser analisados para investigar a rotatividade de tecidos, composição de ECM e função condrocito, traçando assim o perfil da modulação do CmCM.
Introdução
Condrocitos produzem e mantêm a matriz da cartilagem. A fim de estudar a biologia dos condrócitos e como eles e o ECM circundante reagem a estímulos externos, é crucial interrogá-los em seu ambiente nativo1,2. Estudar a rotatividade de tecidos da cartilagem é importante para aumentar a compreensão dos mecanismos subjacentes em doenças articulares, como a OA, uma doença para a qual atualmente não há tratamento modificador da doença. Consequentemente, há uma necessidade significativa de melhores modelos de tradução2.
A caracterização ex vivo dos efeitos celulares e tecidos é essencial para complementar outros modelos pré-clínicos, tanto in vitro, como culturas monocamadas de condrocito, quanto in vivo, como modelos de OA induzidos por cirurgia ou o modelo de artrite induzida por colágeno autoimune (CIA ). Numerosos estudos destacaram as diferenças entre a forma como as células se comportam em culturas monocamadas 2D e estruturas 3D ou em seu tecido nativo3,4. Muitas células em camadas 2D adotam morfologias não naturais, incluindo diferenças na polaridade celular e fixação de tecidos, resultando em diferenças visuais e funcionais nas células dentro dos tecidos nativos5. As diferenças também são aparentes na funcionalidade das células, que podem mudar a expressão proteica, levando a padrões de diferenciação profundamente alterados, máquinas regulatórias e funcionalidade celular5,6,7 8.
O ECM da cartilagem consiste principalmente no colágeno tipo II que fornece uma estrutura da matriz, e do agressor, um proteoglycan que ajude a reter o líquido dentro do tecido. Outras moléculas mmatrixas como o colágeno tipo IV, VI, IX, X, XI, XII, fibronectina, proteína oligomérica da cartilagem (COMP), biglycan, decorina e perlecan também estão presentes9.
Enquanto a aetiologia da OA permanece pouco clara10,11, acredita-se que o início da doença seja causado por desequilíbrios na rotatividade de tecidos e processos de reparo12,13. A degradação da cartilagem articular é uma marca registrada da OA. Condrocitos ou células residentes em cartilagem nos tecidos circundantes aumentam a sua libertação de citocinas, estimulando a produção elevada de proteinases como metaloproteinases matricezas (MMPs) e aglomerações, que aumentam a degradação da cartilagem ECM 14.Esta degradação resulta na liberação de pequenos fragmentos de proteína única chamados neo-epítopos, que podem ser quantificados em soro, urina ou cultura média15. Após a formação e maturação do colágeno, os chamados profragmentos também são liberados; estes podem ser quantificados como uma medida da produção da matriz16.
O objetivo deste protocolo é estabelecer um modelo de cartilagem ex vivo para comparar o efeito da estimulação e/ou tratamento medicamentoso na rotatividade de tecidos ECM. A rotatividade de cartilagem é perfilada pela medição de biomarcadores neo-epitopéus derivados da matriz diretamente no meio de cultura condicionada usando ELISA: AGNx1 (refletindo a atividade da aggrecanase), C2M (atividade de MMP de matriz refletindo) e ProC2 (refletindo o colágeno tipo II formação). Os achados podem ser verificados por manchas histológicas do ECM, que também visualiza a organização de condrocitos nas explantas individuais. O protocolo descrito pode ser usado para testar o efeito de novos tratamentos sobre a função condrócito e cartilagem de volume de negócios ECM. Uma série de estudos têm usado explantas de cartilagem para descrever processos biológicos ou o efeito da intervenção em explantas desafiadas por citocina usando abordagens histológicas ou imunohistoquímicas quantitativas, mRNA, expressão proteica ou proteômica2 17,18. No entanto, esses protocolos estão fora do escopo do manuscrito atual.
Protocolo
1. Isolamento de tecidos
- Fornecimento de tecidos
- Executar toda a seção de fornecimento de tecido fora de uma capa de fluxo laminar em um ambiente asséptico.
- Do matadouro local, obtenha uma articulação do joelho tibiofemoral bovina fresca inteira de bezerros entre 1,5 e 2 anos de idade.
- Dissecar suavemente o joelho da panturrilha, removendo primeiro o excesso de carne, descobrindo os condyles, menisco, tendões e membrana sinovial. Corte os tendões e a membrana sinovial, permitindo que a junção desmembre. Retire o menisco para expor as condíles femorais.
- Isolar explantas da área de suporte de carga dos condyles femoral usando um perfurador de biópsia de 3 mm e liberá-los da superfície articular cortando com um bisturi paralelo e o mais próximo possível do osso subcondral. A estrutura dura do osso subcondral deve assegurar-se de que os explants não contenham a matriz calcificada. Esforce-se para explants com altura uniforme.
- Imediatamente armazenar e misturar as explants em DMEM/F12- GlutaMAX + 1% P / S meio de cultura em um tubo de 50 mL ou placa de Petri. Não misture explants de diferentes joelhos de vaca, mas manter separado para cada estudo.
- Cultivo de tecido
- Transfira as explantas para uma placa estéril de 96 poços em um capô de fluxo laminar.
- Lave os explants 3 vezes no meio da cultura ou PBS e cultivá-los em 200 μL de meio de cultura por poço até o início do experimento. Use um período de lavagem de 1 dia para sincronizar a atividade celular da biópsia e a liberação passiva do biomarcador.
- Cultura a explants até 10 semanas em uma incubadora de 37 °C com 5% CO2. Coloque todas as réplicas dentro de cada grupo na diagonal na placa de cultura para minimizar a variação induzida pela evaporação. Para evitar ainda mais a evaporação do supernatant, adicione PBS aos poços exteriores da placa da cultura.
2. Cartilagem bovina explante tratamento e avaliação da atividade metabólica
- Mudança e tratamento médios da cultura
- Mude o meio da cultura a cada 2-3 dias em um capô de fluxo laminar.
- Se aplicar quaisquer tratamentos, prepare-os antes de alterar o meio. Prepare os tratamentos para a concentração desejada nos poços explantpor diluição no meio da cultura.
- Retire suavemente o supernatant de cada poço e transferi-lo para uma nova placa de 96 poços. Guarde o supernatant com fita de vedação em −20 °C para análise de biomarcadores de rotatividade de tecidos e expressão de proteína.
- Adicione imediatamente 200 μL de meio de cultura fresca ou tratamento por poço. Não deixe que as explants sequem durante a mudança média e certifique-se de que todas as explants estejam completamente submersas no novo meio.
- Coloração de resazurin
- Medir a atividade metabólica uma vez por semana como uma medida indireta da viabilidade celular. O teste de resazurina é uma maneira fácil de avaliar se a atividade metabólica das explants se deteriora para uma explanta individual devido à morte celular ou alterações celulares. Explants no meio da cultura sozinho têm uma leitura relativamente estável do resazurin durante todo o período da experiência.
- Faça uma solução de meio de cultura com 10% de resazurina.
- Colher o supernatant como descrito na etapa 2.1.3.
- Mergulhe as explantas na solução de resazurin de 10% por 3 h a 37 °C ou até que as supernatantes ficam roxas. Inclua 4 poços sem explants como controles de fundo.
- Transfira a solução de resazurin de controle de fundo condicionado e de fundo para uma placa microtiter preta e meça a fluorescência a 540 nm de excitação/590 nm de emissão.
- Lave completamente 3 vezes no meio da cultura ou PBS e submergir as explantas em meio de lavagem por 5-10 min para permitir que a resazurin a difundir completamente para fora. Adicione novo meio de cultura ou tratamentos, se usado.
3. Terminação, fixação e armazenamento de amostras
- Término do período de cultivo
- Medir a atividade metabólica, conforme descrito na etapa 2.2. Adicione 200 μL de PBS por poço.
- Fixação e armazenamento
- Retire o PBS, adicione 200 μL de formaldeído por poço, e deixe para 2 h à temperatura ambiente.
- Descarte o formaldeído e adicione 200 μL de PBS por poço. Cubra a placa com fita de vedação e guarde a 4 °C para análise histoquímica. Recomendamos a realização de análise histoquímica dentro de 3 meses.
4. Biomarcadores de volume de negócios de tecidos (ELISA)
- ELISAs competitivos indiretos
- Cubra uma placa de streptavidin a placa específica de alvo-peptídeo biotinylated diluída 1:100 no amortecedor do ensaio (100 μL por poço) para 30 min em 20 °C.
- Lave 5 vezes com tampão de lavagem padrão e adicione amostra-supernatant (20 μL por poço), juntamente com anticorpo monoclonal primário contra o alvo-peptídeo de ensaio diluído 1:93.3 para ProC2 e 1:100 em buffer de ensaio para AGNx1 (100 μL por poço) e incubado por 2 h a 20 °C com agitação para ProC2 e 3 h a 20 °C para AGNx1.
NOTA: O volume da amostra é retirado diretamente das placas supernatant armazenadas. Se a concentração medida está fora da escala de medição do ensaio, diluir o supernatant em uma placa v-bottomed da diluição em PBS ou no amortecedor do ensaio. - Lave 5 vezes com tampão de lavagem padrão e incubado com anticorpo secundário rotulado por peroxidase diluído 1:100 em buffer de ensaio (100 μL por poço) por 1 h a 20 °C.
- Lave 5 vezes com tampão de lavagem padrão e incubado com agitação por 15 min no escuro a 20 °C com tetrametilbenzidina (TMB) como um substrato de peroxidase (100 μL por poço).
- Termine a reação com solução padrão de parada, 0,1 M H2SO4 (100 μL por poço).
- Leia a reação colorimétrica em 450 nm absorvente usando uma absorção de referência em 650 nm em um leitor de placa de laboratório padrão.
- ELISAs competitivos diretos para a medida do volume de negócios do tecido da cartilagem no supernatant
NOTA: Isso quantifica C2M.- Cubra uma placa de streptavidina com ensaio específico biotinylated alvo-peptídeo diluído 1:100 em buffer de ensaio (100 μL por poço) por 30 min a 20 °C.
- Lave 5 vezes com tampão de lavagem e adicione a mostra-supernatant juntamente com 100 μL de anticorpo monoclonal com rótulo peroxidase contra o alvo-peptídeo de ensaio diluído 1:100 no buffer de ensaio (20 μL por poço). Incubar por 20 h em 2-8 °C com agitação.
NOTA: O volume da amostra é retirado diretamente das placas supernatant armazenadas. Se a concentração medida está fora da escala de medição do ensaio, diluir o supernatant em uma placa v-bottomed da diluição em PBS ou no amortecedor do ensaio. - Lave 5 vezes com tampão de lavagem padrão e incubar com agitação de 15 min no escuro a 20 °C com TMB como um substrato de peroxidase (100 μL por poço).
- Termine a reação com solução padrão de parada, 0,1 M H2SO4 (100 μL por poço).
- Leia a reação colorimétrica em 450 nm absorvente com uma absorção de referência em 650 nm em um leitor de placa de laboratório padrão.
- AGNx1 AGNx1
- Quantificar a degradação do agressor medindo a liberação do neo-epitope AGNx1. Este ensaio elisa competitivo indireto tem como alvo o peptídeo do terminal C (NITEGE373)gerado pela clivagem ADAMTS-4 e 5. O anticorpo monoclonal reconhece todos os fragmentos com um epítopo NITEGE exposto. Os detalhes experimentais do ensaio foram publicados em outros lugares19.
- ProC2 ProC2
- Quantifique a formação de colágeno tipo II medindo a liberação do profragmento do colágeno tipo II. Este ensaio elisa competitivo indireto tem como alvo o epítopo do propeptídeo PIIBNP (QDVRQPG) gerado por N-propeptidases durante o corte do colágeno tipo II recém-sintetizado. Os detalhes experimentais do ensaio foram publicados em outros lugares16.
- C2M C2M
- Quantifique a degradação do colágeno tipo II medindo a liberação do fragmento de neo-epitope C2M. Esta ELISA competitiva direta reconhece o peptídeo terminal C-cmp-cleaved (KPPGRDGAAG1053). Este ensaio difere de AGNx1 e ProC2, pois é o anticorpo primário que é rotulado como peroxidase e, portanto, usado como detector. Os detalhes experimentais do ensaio foram publicados em outros lugares20.
5. Análise histológica
- Infiltração, incorporação e corte
- Coloque as explantas fixadas (ver passo 3.2) em individualmente rotulados. Inclua um rótulo dentro da fita e de rótulo para garantir a identificação.
- Transfira as contendo explants para uma máquina de processador de tecido. Em seguida, infiltrar-se as explantas com parafina em uma série de desidação e parafina etapas de infiltração.
- Desidratar com 96% de etanol por 90 min sem ajuste de temperatura. Repita este passo 3 vezes.
- Limpe o etanol com tolueno por 90 min sem ajuste de temperatura. Repita este passo 2 vezes.
- Limpe o etanol com tolueno por 90 min a 60 °C.
- Infiltrar-se com cera de parafina por 30 min a 60 °C.
- Infiltrar-se com cera de parafina por 60 min a 60 °C.
- Infiltrar-se com cera de parafina por 90 min a 60 °C.
- Para cada etapa, adicione as soluções na câmara de amostra com fluxos lentos de bombeamento e bombeamento 33-34 kPa. Executar o processo de infiltração em um ciclo de pressão / vácuo com um vácuo máximo de −65 a −70 kPa.
- Após a infiltração, coloque as fitas em um bloco de aquecimento para permitir a remoção cuidadosa das explantas do. Gentilmente incorporar os explants infiltrados em blocos de parafina individuais. Com fórceps aquecidos, coloque as explantas com a cartilagem articular superficial e os lados osso subcondrídrico perpendiculares à superfície de corte, garantindo a visualização das diferentes camadas de cartilagem dentro de cada seção do espécime.
- Corte 5 seções μm de blocos de parafina resfriados com explantas embutidas em um microtome. Transfira as seções cortadas para um banho de água fria. Se necessário, as seções podem ser separadas usando um bisturi ou um vidro de tampa.
- Usando um slide de vidro não revestido com cuidado, transfira as seções para um banho de água quente (50 °C), onde as seções se desdobram. Levante cada seção em um slide de capa rotulado e coloque em uma placa quente por 30 min.
- Coloque os slides em uma cesta e incubar a 60 °C para 1 h e, em seguida, mantê-los durante a noite em 37 °C. A partir daí, guarde slides em recipientes fechados a 4 °C até a coloração.
- Safranin O/Fast Green coloração e visualização
- Coloque os slides para ser manchado em uma cesta e incubar os slides em 60 °C para 1 h.
- Prepare e filtre todos os reagentes com um filtro de 0,45 mm.
- Em preparação para a coloração, despeje os reagentes filtrados em taças para um volume que permite que as soluções cubram completamente os slides ao submergir a cesta. Os copos usados exigiam um volume de 250 mL para cobrir os slides.
- Deparafinar os slides derretidos submergindo a cesta em tolueno por 10 min duas vezes, 99% de etanol por 2 min duas vezes, 96% de etanol por 2 min duas vezes e 70% de etanol por 2 min duas vezes. Em seguida, hidrate os toboáguas em água por 2 min.
- Manchar os slides deparafinados e hidratados submergindo a cesta na solução de Hematoxilina de Ferro de Weigert (pH 1.5) por 10 minutos, mergulhar em 1% HCl uma vez, e enxaguar com água da torneira corrente por aproximadamente 5 minutos ou até que o excesso de cor tenha lavado.
- Em seguida, mancha em 0,05% solução Verde Rápido (pH: 5,75) para 5 min, mergulho em 1% CH3COOH uma vez, e mancha em 0,1% Safranin O (pH: 6,5) para 20 min.
- Desidratar e limpar os slides mergulhando duas vezes em 70% de etanol, 96% etanol por 2 min duas vezes, 99% de etanol para 2 min duas vezes, e tolueno 2 min duas vezes.
- Monte as lâminas de vidro não revestidas com meio resinoso cobrindo os slides de histologia.
Resultados
As explantas de profundidade total bovinas foram isoladas, cultivadas e tratadas por 3 semanas(Figura 1). O meio de cultura foi alterado com a adição de tratamento 3 vezes por semana. Uma vez semanal, a atividade metabólica foi medida pelo ensaio da resazurina. Os biomarcadores da rotatividade de ECM foram medidos no supernatant colhido da placa de cultura 3 vezes por semana. As explantas foram divididas em 4 grupos para tratamento: 1) Oncostatin m e TNFα (O+T); 2) O+T + GM6001 (GM6001); 3) Insulina como fator de crescimento-1 (IGF-1); e 4) um controle sem tratamento (w/o).
Atividade metabólica.
Para todos os quatro grupos, a atividade metabólica foi relativamente estável ao longo das 3 semanas(Figura 2A). Houve uma tendência para o IGF-1 aumentar ligeiramente a atividade metabólica acima do grupo w/o e para os grupos O+T diminuí-la. O ensaio resazurin foi usado para avaliar facilmente a atividade dos condrócitos em cada explanta e para avaliar indiretamente a viabilidade celular sem extrair explantas do experimento. Se uma explanta mostra uma queda substancial na atividade metabólica durante o experimento, a explant pode ser excluída de uma análise mais aprofundada.
Tratamento catabólico.
O+T foi aplicado 3 vezes por semana aos poços de cultura para investigar a degradação da cartilagem mediada pela O+T (Figura 3, Figura 4). A degradação do colágeno tipo II mediada por MMP e a degradação do agressor mediado pela aglomerada foram avaliadas por C2M e ElISAs AGNx1. O+T aumentou a degradação do colágeno tipo II dos dias 7-21(Figura 3A)e degradação aggrecana dos dias 3-14 (Figura 4A)em comparação com o grupo w/o. Ao adicionar GM6001 (um inibidor de MMP de amplo espectro) em combinação com o tratamento O+T, a liberação C2M mediada por O+T foi bloqueada(Figura 3A,B). Uma diminuição da liberação aGNx1 foi observada ao adicionar GM6001 nos dias 3-7, mas os picos de liberação aGNx1 no dia 10 em níveis semelhantes ao grupo O +T (Figura 4A), indicando que o GM6001 só diminui a degradação aggrecan a uma extensão limitada. Este padrão na liberação AGNx1 e C2M é o quadro geral observado no modelo de cartilagem bovina estimulado com O +T. Primeiro, AGNx1 é liberado de aproximadamente dia 3 e picos nos dias 10-14, representando uma degradação precoce do agressor. Em seguida, após 2 semanas de cultivo com O+T, a degradação do colágeno tipo II é observada conforme medido pelo biomarcador C2M.
Tratamento anabólico.
Para investigar como a estimulação anabolizante modula o volume de negócios de Cartilagem ECM, insulina como fator de crescimento-1 (IGF-1) foi aplicada 3 vezes por semana para bovinos explants de profundidade total. O efeito do IGF-1 sobre as explantas da cartilagem foi observado principalmente nas medidas de formação de colágeno tipo II, avaliadas pelo ProC2, como esperado para estímulos anabolizantes (Figura 5). O dia 0 neste modelo mostra sempre medidas proc2 elevadas, talvez como uma reação à extração das amostras. Estes níveis elevados diminuem substancialmente e nivelam para fora dos dias 7-21. Ao tratar com IGF-1, os níveis de ProC2 diminuem menos do que os observados no grupo w/o, indicando que o IGF-1 estimula a formação de colágeno tipo II a partir do dia 7 (Figura 5B). Os gráficos ProC2 também mostram a variação biológica das vacas. Explantas de duas vacas foram utilizadas nesses experimentos com 6 explantas por vaca por grupo. A primeira vaca teve uma cartilagem mais grossa e gerou explants maiores, tendo por resultado uns níveis mais elevados de ProC2 na linha de base, visto que a segunda vaca era menor com cartilagem mais fina, tendo por resultado uns níveis mais baixos de ProC2 na linha de base. Para os grupos w/o, IGF-1 e O+T, os níveis de ProC2 retratados representam a média das explantas de ambas as vacas, mas gm6001 foi medido apenas na segunda vaca com explants mais finos. Assim, o grupo GM6001 começou com níveis mais baixos de ProC2 no dia 0, o que é evidente na área do ProC2 a curva (AUC) (Figura 5C). A normalização dos valores do ProC2 para os níveis do dia 0 leva em conta a variação biológica, mostrando assim a eficácia do tratamento(Figura 5B,D).
As manchas histológicas de Safranin O e Fast Green foram realizadas para visualizar o conteúdo proteoglicano e a estrutura da cartilagem da explant ao longo do experimento(Figura 6). Nos dias 0, 7, 14 e 21, as explantas do grupo w/o, IGF-1 e O+T foram fixadas para coloração histológica (Figura 6). O grupo w/o e iGF-1 parecia ter intensidade semelhante de manchas de Safranin O ao dia 0 explantao longo do experimento, o que se correlaciona com os resultados do biomarcador mostrando que nenhum dos dois grupos aumentou a liberação do AGNx1 (Figura 4). O tratamento com O+T resultou em perda substancial de conteúdo proteoglicano no dia 7 e perda completa no dia 21. Além disso, a intensidade da coloração Fast Green diminui dos dias 14-21, indicando uma perda de colágeno em alinhamento com os resultados c2m.
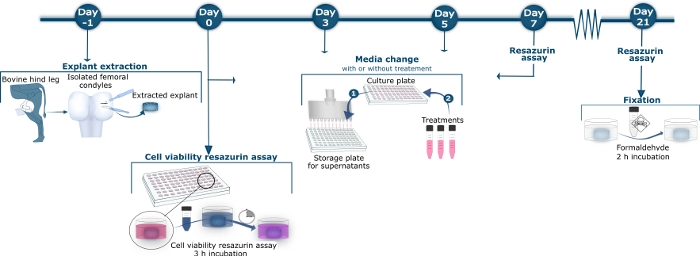
Figura 1: Visão geral esquemática do método de cartilagem bovina.
No dia −1, condyles femorais bovinos foram isolados da articulação tibiofemoral traseira. Explants de cartilagem de profundidade total foram liberados dos condyles com um bisturi e um perfurador da biópsia. As explantas extraídas foram lavadas e transferidas para uma placa estéril de 96 poços de cultura. No dia 0, 3, 5, 7, 10, 12, 14, 17, 19 e 21, o supernatant foi colhido da placa de cultura, transferido para uma placa de armazenamento e mantido a −20 °C, como ilustrado no Passo 1 da Mudança Média. O supernatant armazenado foi descongelado mais tarde para a medida dos biomarcadores do retorno do tecido por ensaios específicos de ELISA. Na Etapa 2 da Mudança Média, após a remoção do supernatant, o meio novo da cultura que contem os tratamentos diferentes ou nenhum tratamento para explants do controle foi aplicado. No dia 0, 7, 14 e 21, as explantas foram incubadas com solução de resazurin de 10% por 3 h após a colheita do supernatant. O supernatant 10% do resazurin foi transferido a uma placa preta de 96 poços onde a reação colorimetric fosse medida. Os poços da cultura foram lavados 3 vezes antes que o meio novo da cultura com ou sem tratamento estêve adicionado aos explants como mostrado na etapa média da mudança 2. No dia 21, após a colheita de medição supernatant e resazurin, as explants foram fixados pela incubação com formaldeído para 2 h. Por favor, clique aqui para ver uma versão maior desta figura.
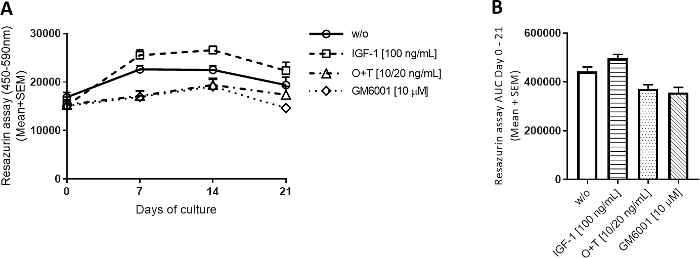
Figura 2: Atividade metabólica medida pela resazurina.
As explantas de cartilagem bovinas de profundidade total foram isoladas e cultivadas por 3 semanas. O meio de cultura foi alterado com a adição de novo tratamento 3 vezes por semana (n = 12 explants de 2 vacas). O tratamento consistiu em IGF-1 [100 ng/mL], OSM + TNFα (O+T) [10/20 ng/mL], e O+T [10/20 ng/mL] + GM6001 (GM6001] [10 μM]. Foi incluído um grupo controle sem tratamento (w/o). Para o grupo w/o, IGF-1 e O+T, o erro médio e padrão da média (SEM) de 12 réplicas de 2 vacas (6 replica por vaca) são mostrados. Para o grupo GM6001, a média e o SEM de 6 replicam de 1 vaca são mostrados. (A)Atividade metabólica medida pela resazurina. (B) Área a curva (AUC) para os dias 0-21 para gráficos de atividade metabólica mostrados em (A). p > 0,0001. Clique aqui para ver uma versão maior deste número.
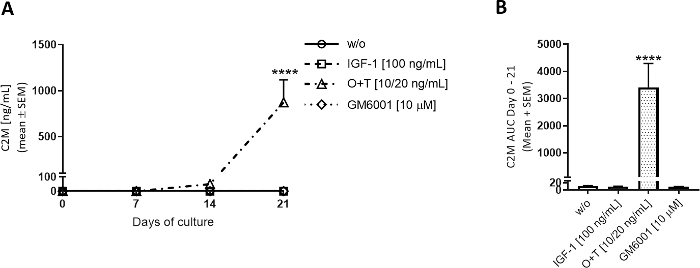
Figura 3: Degradação do colágeno tipo II medida por C2M.
As explantas de cartilagem bovinas de profundidade total foram isoladas e cultivadas por 3 semanas. O meio da cultura foi alterado com a adição de novo tratamento 3 vezes por semana. O tratamento consistiu em IGF-1 [100 ng/mL], OSM + TNFα (O+T) [10/20 ng/mL], e O+T [10/20 ng/mL] + GM6001 (GM6001] [10 μM]. Foi incluído um grupo controle sem tratamento (w/o). Para os grupos w/o, IGF-1 e O+T, são mostrados os grupos média e SEM de 12 de 2 vacas (6 replicapor vaca). Para o grupo GM6001, a média e o SEM de 6 replicam de 1 vaca são mostrados. (A)Medições C2M. O nível de significância estatística de w/o foi calculado por medidas repetidas (RM) ANOVA biviais com o teste de comparação múltipla da Sidak. (B) AUC para os dias 0-21 para gráficos C2M mostrados em (A). O significado estatístico foi calculado pelo teste de Kruskal-Wallis com o teste de comparação múltipla de Dunn. p > 0,0001. Clique aqui para ver uma versão maior deste número.

Figura 4: Degradação aggrecan medida por AGNx1.
As explantas de cartilagem bovinas de profundidade total foram isoladas e cultivadas por 3 semanas. O meio da cultura foi mudado com aadição do tratamento novo 3 vezes por a semana. O tratamento consistiu em IGF-1 [100 ng/mL], OSM + TNFα (O+T) [10/20 ng/mL], e O+T [10/20 ng/mL] + GM6001 (GM6001] [10 μM]. Foi incluído um grupo controle sem tratamento (w/o). Para o w/o, IGF-1 e O+T, o grupo média e OEM de 12 replicade 2 vacas (6 replica por vaca) são mostrados. Para o grupo GM6001, a média e o SEM de 6 replicam de 1 vaca são mostrados. (A)AGNx1 medidas. O nível de significância estatística de w/o foi calculado pela ANOVA de duas vias RM com o teste de comparação múltipla da Sidak. (B) AUC para os dias 0-21 para gráficos AGNx1 mostrados em (A). O significado estatístico foi calculado pelo teste de Kruskal-Wallis com o teste de comparação múltipla de Dunn. **p > 0,01, ***p > 0,001, ****p > 0,0001. Clique aqui para ver uma versão maior deste número.
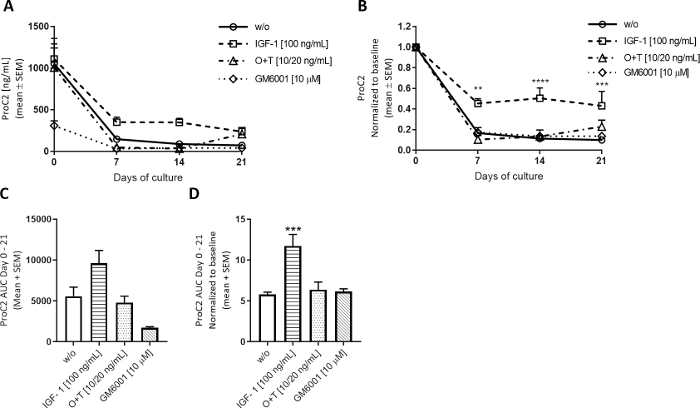
Figura 5: Formação de colágeno tipo II medida pelo ProC2.
As explantas de cartilagem bovinas de profundidade total foram isoladas e cultivadas por 3 semanas. O meio da cultura foi alterado com a adição de novo tratamento 3 vezes por semana. O tratamento consistiu em IGF-1 [100 ng/mL], OSM + TNFα (O+T) [10/20 ng/mL], e O+T [10/20 ng/mL] + GM6001 (GM6001] [10 μM]. Foi incluído um grupo controle sem tratamento (w/o). Para o w/o, IGF-1 e O+T, o grupo média e OEM de 12 replicade 2 vacas (6 replica por vaca) são mostrados. Para o grupo GM6001, a média e o SEM de 6 replicam-se de 1 vaca remostrado. (A)Medições ProC2 dos dias 0-21. (B) Valores ProC2 normalizados para o dia 0 medições para cada explant individual. Os resultados do ProC2 muitas vezes se beneficiam da normalização do dia 0 para descobrir o efeito de tratamento que pode ser disfarçado pelos altos níveis de biomarcadores no dia 0. Em A e B,o nível de significância estatística foi calculado pela RM ANOVA de duas vias com o teste de comparação múltipla da Sidak. (C)AUC para os dias 0-21 para gráficos ProC2 mostrados em (A). (D)AUC para os dias 0-21 para o dia 0 normalizado ProC2 gráficos mostrados em (B). Em C e D,o significado estatístico foi calculado pelo teste Kruskal-Wallis com o teste de comparação múltipla de Dunn. **p > 0,01, ***p > 0,001, ****p > 0,0001. Clique aqui para ver uma versão maior deste número.
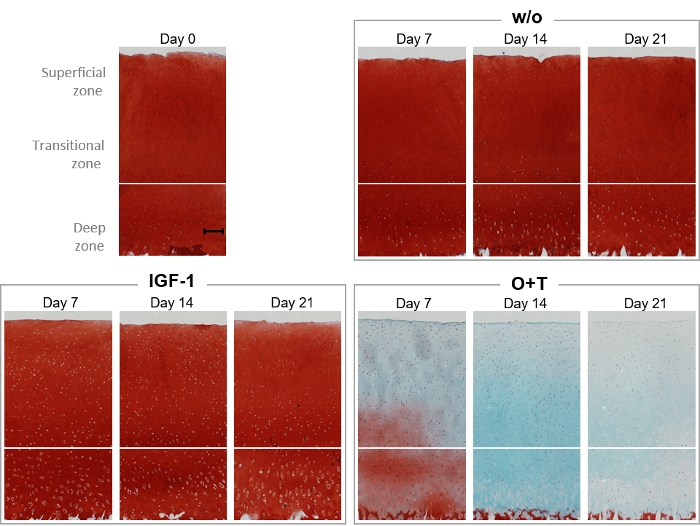
Figura 6: Visualização histológica do conteúdo proteoglicano por Manchas De Safranin O/Fast Green.
As explantas de cartilagem bovinas de profundidade total foram isoladas e cultivadas por 3 semanas. O meio da cultura foi alterado com a adição de novo tratamento 3 vezes por semana. O tratamento consistiu em IGF-1 [100 ng/mL] e OSM + TNFα (O+T) [10/20 ng/mL]. Foi incluído um grupo controle sem tratamento (w/o). No dia 0, 7, 14 e 21, explants foram fixados, infiltrados com parafina, embutidos em parafina, fatiados, colocados em toboáguas de capa e manchados com hematoxilina, Safranin O e Fast Green. Para cada grupo de tratamento e cada ponto de tempo, uma explanta representativa é mostrada. A barra de escala mostrada na amostra de base (dia 0) representa 200 μm. Por favor, clique aqui para ver uma versão maior deste número.
Discussão
O protocolo apresentado aqui para o perfil da rotatividade de tecido sino da cartilagem bovina explants pode ser usado para caracterizar os efeitos do tratamento de muitos tipos de drogas, incluindo inibidores de vias intracelulares inflamatórias, inibidores de enzimas proteolíticas, ou fatores de crescimento anabolizantes.
Duas configurações diferentes foram descritas neste protocolo: uma configuração anabolizante onde as explantas foram estimuladas com fator de crescimento semelhante à insulina 1 (IGF-1), e uma configuração catabólica composta por estimulação com TNF-alfa e Oncostatin M, em que a rotatividade de tecidos pode ser inibido usando um inibidor de MMP de amplo espectro. A principal saída neste método é a quantificação de biomarcadores neo-epítopos diretamente no meio condicionado, que é colhido durante todo o período cultural. Vários biomarcadores podem ser medidos no supernatant, permitindo o perfil simultâneo de diferentes processos catabólicos e anabolizantes na mesma amostra. A coloração histológica com Safranin O/Fast Green foi usada para validar os achados da análise de biomarcadores. Oncostatin M, TNF-alfa e IGF-1 foram usados para descrever o protocolo; no entanto, o método não se limita a estimuladores específicos de citocina e estes podem ser facilmente trocados por outros, dependendo da hipótese ou tratamento de teste.
A interpretação da saída de biomarcadores é um exercício temporal devido às mudanças dinâmicas na função condrócito e perfis de expressão com estimulação anabolizante ou catabólica ao longo do tempo. Em explantas não tratadas, a formação de colágeno tipo II medida pelo biomarcador ProC2 diminui rapidamente nos primeiros 7-10 dias. A estimulação com IGF-1 ou fatores de crescimento similares mantém a liberação de ProC2 no meio condicionado em um nível comparável à linha de base; assim, o declínio é mais gradual, e a liberação é aumentada em relação às explantas não tratadas. Em uma configuração catabólica, citocinas pró-inflamatórias induzem maior expressão de proteases pelo condrócito nos dias 0-14; Isto consiste principalmente de aglomerados. Isso causa um grande aumento inicial de fragmentos de proteína derivados da aglomerada, incluindo AGNx1. Nas fases posteriores da cultura, os condrocitos expressam mais MMPs, o que impulsiona o lançamento de marcadores gerados pelo MMP, como o C2M, por volta do dia 14 e em diante. Assim, para o perfil do efeito de um tratamento, é importante medir biomarcadores no intervalo de tempo certo.
Como descrito, o tratamento com citocinas inflamatórias, como o coquetel O +T, causará degradação do tecido da cartilagem ao longo do tempo. O pool total de ECM é limitado pelo tamanho da explanta e deve ser considerado ao analisar o perfil do biomarcador. Consequentemente, após o aumento inicial da liberação de biomarcadores, os níveis podem diminuir com o tempo simplesmente devido à redução da quantidade restante de ECM explanta.
Previamente, o OA foi considerado primeiramente uma doença da cartilagem articular. No entanto, estudos recentes sugerem que a OA deve ser vista como uma doença de toda a articulação, onde as mudanças precoces relacionadas à doença nos compartimentos articulares individuais, sínovium, osso e cartilagem ocorrem em paralelo, e ao longo do tempo resultam em falha articular12 21depessoas. Portanto, é importante reconhecer que, neste sistema modelo, a cartilagem é isolada do resto da articulação (e organismo), limitando a influência dos efeitos de interação do tecido e fatores sistêmicos que podem regular a homeostase do tecido. Em vez disso, é uma cultura de tecido único simplificada, onde as condições controladas experimentalmente podem ser moduladas para detectar alterações patológicas ou intervencionistas no tecido usando técnicas bioquímicas, biomarcadores ou visualização histológica. Devido à arquitetura da cartilagem, a variação no número celular, a composição da matriz e a variação da quantidade são esperadas tanto entre explantas quanto entre as fontes de tecido. Como a magnitude relativa da saída de biomarcadores pode ser diferente entre os experimentos, recomenda-se normalizar os conjuntos de dados para melhor comparação.
Para garantir a menor variação possível e melhores resultados, é importante usar cartilagem dos joelhos que são tão frescos quanto possível, de preferência entre 1 e 24 h após o abate. A isolação do tecido da cartilagem deve ser feita em uma maneira homogênea com explants que são aproximadamente a mesma espessura. Explants deve ser isolado das áreas da cartilagem grossa, evitando as áreas as mais próximas ao meio. O tecido deve ser sempre úmido para evitar a morte celular e decomposição da matriz. A duração do experimento3,o tempo entre as mudanças médias, o tempo de estimulação da citocina e os intervalos de tratamento podem ser ajustados para se adequar ao modo hipotético de ação do composto ou mecanismo individual.
Divulgações
CST, ACBJ e MK são funcionários da Nordic Bioscience. A ACBJ e a MK detêm ações da Nordic Bioscience. Os autores restantes não têm nada a divulgar.
Agradecimentos
Os autores agradecem ao pessoal técnico da Nordic Bioscience pelo apoio laboratorial, bem como à Danish Research Foundation pelo apoio geral da nossa investigação.
Materiais
| Name | Company | Catalog Number | Comments |
| 45% Iron(III) chloride solution | Sigma-Aldrich | 12322 | |
| Acetic acid | Merck | 1.00056.2500 | |
| Alamar Blue | Life tech Invitrogen | DAL1100 | |
| Biopsy processing cassettes – green | IHCWORLD | BC-0109G | |
| Biopsy punch W/Plunger (3 mm) | Scandidat | MTP-33-32 | |
| Bovine cartilage (Bovine knees) | Local slaughterhouse | ||
| C2M | Nordic Bioscience | Fee for service | |
| Corning 96-well plate | Sigma-Aldrich | CLS7007 | |
| Cover Glass Ø 13 mm | VWR | 631-0150P | |
| DMEM/F12-GlutaMAX Dulbecco's Modified Eagle Medium/Nutrient Mixture F-12) without HEPES | Gibco | 31331-028 | |
| Ethanol ≥96% | VWR | 83804.36 | |
| Ethanol absolute ≥99.5% | VWR | 83813.36 | |
| exAGNx1 | Nordic Bioscience | Fee for service | |
| exPRO-C2 | Nordic Bioscience | Fee for service | |
| Fast green | Sigma-Aldrich | F7252 | |
| Formaldehyde solution 4% | Merck | 1004965000 | |
| GM6001 | Sigma-Aldrich | M5939-5MG | |
| Hematoxylin | Sigma-Aldrich | H3136 | |
| Hydrochloric acid | Merck | 30721-M | |
| IGF-1 | Sigma-Aldrich | I3769-50UG | |
| Oncostatin M | Sigma-Aldrich | O9635-10UG | |
| Penicillin-streptomycin (P/S) | Sigma-Aldrich | P4333 | |
| Pertex (mounting medium for light microscopy) | HistoLab | 811 | |
| Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| Safranin O | Sigma-Aldrich | S2255 | |
| Sterile Standard Scalpels | Integra Miltex | 12-460-451 | |
| Sulfuric acid | Sigma-Aldrich | 30743 | |
| SUPERFROST PLUS Adhesion Microscope Slides | Thermo scientific | J1800AMNT | |
| TNF-alpha | R&D Systems | 210-TA-100 | |
| Toluene | Merck | 1.08327.2500 | |
| Vacuum Filtration "rapid"-Filtermax | TPP | 99955 |
Referências
- Cope, P. J., Ourradi, K., Li, Y., Sharif, M. Models of osteoarthritis: the good, the bad and the promising. Osteoarthritis and Cartilage. 27 (2), 230-239 (2018).
- Thysen, S., Luyten, F. P., Lories, R. J. U. Targets, models and challenges in osteoarthritis research. Disease Models & Mechanisms. 8 (1), 17-30 (2015).
- Reker, D., et al. Articular cartilage from osteoarthritis patients shows extracellular matrix remodeling over the course of treatment with sprifermin (recombinant human fibroblast growth factor 18). Osteoarthritis and Cartilage. 26, S43 (2018).
- Kjelgaard-Petersen, C., et al. Synovitis biomarkers: ex vivo characterization of three biomarkers for identification of inflammatory osteoarthritis. Biomarkers. 20 (8), 547-556 (2015).
- Henriksen, K., et al. A specific subtype of osteoclasts secretes factors inducing nodule formation by osteoblasts. Bone. 51 (3), 353-361 (2012).
- Gigout, A., et al. Sprifermin (rhFGF18) enables proliferation of chondrocytes producing a hyaline cartilage matrix. Osteoarthritis and Cartilage. 25 (11), 1858-1867 (2017).
- Reker, D., et al. Sprifermin (rhFGF18) modulates extracellular matrix turnover in cartilage explants ex vivo. Journal of Translational Medicine. 15 (1), 3560 (2017).
- Karsdal, M. A. Introduction. Biochemistry of Collagens, Laminins and Elastin. , (2016).
- Heinegård, D., Saxne, T. The role of the cartilage matrix in osteoarthritis. Nature Reviews Rheumatology. 7 (1), 50-56 (2011).
- Karsdal, M. A., et al. Osteoarthritis– a case for personalized health care?. Osteoarthritis and Cartilage. 22 (1), 7-16 (2014).
- Karsdal, M. A., Bay-Jensen, A. C., Henriksen, K., Christiansen, C. The pathogenesis of osteoarthritis involves bone, cartilage and synovial inflammation: may estrogen be a magic bullet?. Menopause International. 18 (4), 139-146 (2012).
- Loeser, R. F., Goldring, S. R., Scanzello, C. R., Goldring, M. B. Osteoarthritis: a disease of the joint as an organ. Arthritis and Rheumatism. 64 (6), 1697-1707 (2012).
- Goldring, M. B., Goldring, S. R. Osteoarthritis. Journal of Cellular Physiology. 213 (3), 626-634 (2007).
- Karsdal, M. A., et al. The coupling of bone and cartilage turnover in osteoarthritis: opportunities for bone antiresorptives and anabolics as potential treatments?. Annals of the Rheumatic Diseases. 73 (2), 336-348 (2014).
- Genovese, F., Karsdal, M. A. Protein degradation fragments as diagnostic and prognostic biomarkers of connective tissue diseases: understanding the extracellular matrix message and implication for current and future serological biomarkers. Expert Review of Proteomics. 13 (2), 213-225 (2016).
- Gudmann, N. S., et al. Cartilage turnover reflected by metabolic processing of type II collagen: a novel marker of anabolic function in chondrocytes. International Journal of Molecular Sciences. 15 (10), 18789-18803 (2014).
- Madej, W., van Caam, A., Davidson, E. B., Buma, P., van der Kraan, P. M. Unloading results in rapid loss of TGFβ signaling in articular cartilage: role of loading-induced TGFβ signaling in maintenance of articular chondrocyte phenotype?. Osteoarthritis and Cartilage. 24 (10), 1807-1815 (2016).
- Kjelgaard-Petersen, C. F., et al. Translational biomarkers and ex vivo models of joint tissues as a tool for drug development in rheumatoid arthritis. Arthritis & Rheumatology. 70 (9), 1419-1428 (2018).
- Wang, B., et al. Suppression of MMP activity in bovine cartilage explants cultures has little if any effect on the release of aggrecanase-derived aggrecan fragments. BMC Research Notes. 2 (4), 259 (2009).
- Bay-Jensen, A. C., et al. Enzyme-linked immunosorbent assay (ELISAs) for metalloproteinase derived type II collagen neoepitope, CIIM—Increased serum CIIM in subjects with severe radiographic osteoarthritis. Clinical Biochemistry. 44 (5-6), 423-429 (2011).
- Lories, R. J., Luyten, F. P. The bone-cartilage unit in osteoarthritis. Nature Reviews Rheumatology. 7 (1), 43-49 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados