Method Article
Sinaptik vezikül Presynaptic protein Overexpressing kültürlü nöronlarda geri dönüşüm için optik bir tahlil
Bu Makalede
Özet
Biz optik bir tahlil sinaptik vezikül (SV) kültürlü nöronlarda geri dönüşüm için açıklar. Bu iletişim kuralı bir presynaptic işaret ve protein ilgi ifade etmek için çift transfection ile birleştirerek presynaptic siteleri, onların sinaptik vezikül kapasitesi geri dönüşüm bulun ve faiz protein rolünü belirlemek için bize izin verir.
Özet
Active presynaptic sinir terminallerine sinaptik veziküller exo - ve endositoz döngüleri tabi. Geri dönüşüm sırasında luminal etki alanları SV transmembran proteinler, hücre yüzeyi maruz olur. Bu proteinler biridir Synaptotagmin-1 (Syt1). Syt1, bir kez kültür ortamına eklenen luminal etki karşı bir antikor exo-endocytotic döngüsü sırasında alınır. Bu alımı SV geri dönüşüm miktarı ile doğru orantılıdır ve ayirt sayılabilir. Burada, Syt1 antikor alımını kültürlü hipokampal nöronlar Çift Kişilik transfection ile birleştirmek. Bu bize (1) yerelleştirmek rekombinant presynaptic işaretçisi Synaptophysin ifade üzerinde temel alan presynaptic siteleri (2) Syt1 alımını kullanarak onların işlevlerini belirleyin ve karakterize (3) hedefleme ve etkileri ilgi, GFP-Rogdi bir protein sağlar.
Giriş
Presynaptic özelliklerini değiştirmek, sinaptik plastisite sırasında veya Yanıt pertürbasyon sinaptik fonksiyon olarak nasıl sinaptik vezikül geri dönüşüm eğitim belirlemede önemlidir. Synaptotagmin-1 (Syt1) eğitim antikor alımını SV geri dönüşüm miktarını ölçmenin bir yöntem sağlar. Syt1 Ca2 + sensörü davranır ve nörotransmitter1,2exocytotic serbest bırakılması için gereklidir, SV ilişkili bir proteindir. Bir C-terminal sitoplazmik etki alanı dışında ZF ve SV3içinde N-terminal luminal etki alanı ile bir transmembran proteindir. Ekzositozu sırasında Syt1 luminal etki dış ortamına maruz olur. Bu dış orta, endositoz sırasında içselleştirilmiş olur sitoplazmik etki karşı antikorlar ekleyin. Bu antikorlar da önceden fluorophores veya immunostained ile ikincil antikorlar4,5,6,7ile Birleşik olabilir. Elde edilen immunosignal floresan yoğunluğu SV geri dönüşüm miktarı orantılıdır. Bu yaklaşım, kurucu ve depolarizasyon kaynaklı ZF6,8geri dönüşüm belirlemek için kullanılabilir.
Syt1 alımını deneyleri seyrek transfection hücreleri küçük bir dizi ya da virüs-aracılı gen transferi tabak içinde hemen hemen tüm hücrelere sonra gerçekleştirilebilir. Bizim Yöntem tahlil kalsiyum fosfat9kullanarak birincil hipokampal nöronlar seyrek Çift Kişilik transfection ile birleştirir. Presynapses biriktirmek için bilinen bir rekombinant marker protein fluorescently etiketli Synaptophysin, presynaptic terminalleri bulun ve bizim protein ilgi, Rogdi overexpress için kullanıyoruz. Bu Rogdi hedefleri fonksiyonel synapses ve geri dönüşüm SV etkiler olup olmadığını test bize sağlar. Rogdi kodlama gen aslında Drosophila mutantlar Engelliler bellek10tarafından karakterize bir ekran tespit edilmiştir. İnsanlarda, Kohlschütter-Tönz sendromu denen nadir ve yıkıcı bir hastalık Rogdi gen mutasyonlar neden. Hastalar diş mine malformasyonlar, pharmacoresistant epilepsi ve psikomotor gecikmeler muzdarip; Ancak, gen ürünü hücre altı lokalizasyonu zor11kaldı. Böylece, Syt1 alımını tahlil GFP öğesini Rogdi fonksiyonel sinapslarda9lokalizasyonu için anahtar kanıt sağladı.
Bu alımı teknik birçok faydası vardır. İlk olarak, SV geri dönüşüm hem gerçek zamanlı canlı görüntüleme7,12yaparak ve sonra fiksasyon6,9 Syt1 floresan etiket floresan yoğunluğu ölçme tarafından görülebilir. Ayrıca, çeşitli Syt1 antikor türevleri geliştirilmiştir. Standart immunostaining protokol fiksasyon sonra sonrası ikincil bir antikor ile etiketli etiketsiz türevleri ve önceden eklenmiş bir floresan etiketi önceden konjuge türevleri vardır. Son olarak, floresan antikor tabanlı kullanılan piyasada bulunan ikincil veya konjuge boyalar geniş yelpazesi nedeniyle avantajlıdır.
Ne zaman tamir ve immunostaining nöronlar, ayrıca ek proteinler için leke ve colocalization analiz gerçekleştirmek mümkündür. Bu geri dönüşüm SVs ile ilgili olarak bulundukları belirlemenize yardımcı olabilir. Floresans etiket yoğunluğunu geri dönüşüm SV miktarını doğrudan ölçüsüdür. Buna ek olarak, antikorlar seçmeli olarak yüksek özgüllük ve küçük arka plan floresans4ile sonuçlanan yapıları, Syt1 içeren etiket. Farklı stimulasyon protokolleri de, depolarizasyon arabellekleri veya elektrik stimulasyon protokolleri9,12,13,14gibi kullanılabilir. Ancak, bazal SV geri dönüşüm nöronal kültürler15uyarıcı olmadan ölçülebilir.
Bizim yöntem özellikle fiksasyon sonra Syt1 antikor Anlamazdın çift transfected nöronlar ile ikincil antikor immunolabeling giderir. Ancak, tüm rutin olarak kullanılan türevleri tahlil için izleyiciler Protokolü ihtiyaçlarınıza uyum için size şans vermek amacıyla tartışma bizim bakın.
Protokol
Hiçbir canlı hayvan çalışmaları yapılmıştır. Hücre kültürleri altında onay yerel hayvan koruma yetkilileri (Tierschutzkommission der Universitätsmedizin Göttingen) tarafından onaylanmış almak için ötenazi hayvanları içeren deneyler T10/30 numara. Deneyler ile onaylanmış protokoller yapılmıştır.
1. birincil hipokampal hücre kültürü
- Embriyonik gün 1916,17fare hipokampus Disosiye hücre kültürünü hazırlayın. 12 mm coverslips 50.000-60.000 hücreler/iyi bir yoğunluğu 24-iyi yemekler polyethyleneimine (PEI) ile kaplı hücrelerdeyse plaka. Bir hücre sayım odası ve faz kontrast optik kullanarak yoğunluğu kontrol edin.
- 3 gün (gün vitro (DIV) 3) 24-şey plaka %5 CO237 ° C'de kuluçka nöronlar kültür.
- Coverslips iletilen ışık mikroskobu (Örneğin, faz kontrast optik, 10-20 X büyütme) kullanarak hücre sağlık göstergeleri için değerlendirmek. Kontrol için iyi sağlık göstergeleri aşağıdaki: bir açık faz kontrast hale, neurites boncuklu yapıları, olmadan ve hiçbir soma kümeleme veya neurite donatılacak.
2. transfection
Not: Aşağıdaki iletişim kuralı 3 kuyuları için bir çift-transfection ifade eder. Ancak, zaman 4 kuyular için yeterli miktarda hazırlanan protokol en iyi çalışır.
- Transfection arabellek (274 mM NaCl, 10 mM KCl, 1.4 mM Na2HPO4, 15 mM glikoz, 42 mM HEPES) 500 mL bir Erlenmeyer şişeye hazırlayın.
- NaCl 8.0 g, KCl 0,37 gr, 0,095 g Na2HPO4, 1.35 g glikoz ve HEPES 5.0 g 400 ml distile su içinde bir Erlenmeyer flask geçiyoruz.
- PH 6,95 için 1 M NaOH pH metre kullanarak ayarlayın.
- 500 ml distile su ile ses seviyesini ve pH metre kullanarak pH kontrol edin.
- 20-30 mL aliquots transfection arabelleği aşağıdaki pH değerleri ile pipetting 1 tarafından yapmak transfection arabelleğine M NaOH: 6,96, 6.97, 6.98, 6,99, 7,00, 7,01, 7.04, 7,05, 7,03 7,02 7.06, 7,07, 7,08, 7,09, 7.11.
Not: Transfection tampon pH transfection etkinliği için çok önemlidir. - Transfected hücre en yüksek sayısı transfection arabellek neden test etmek için 6,96 7.11 her pH değeri sınayın. 2.2-2,11 ve doğrulanmış bir plazmid GFP ifade olan transfection yöntemi kullanın. En iyi hangi arabellek çalışır coverslip değerlendirmek her transfection tampon pH değeri başına transfected hücre sayısını belirleyin.
- Aliquot 2 mL microcentrifuge tüpler içine en yüksek transfection verimliliği ile tampon donma ve tüpler-20 ° C'de depolayın
- İndirimli serum orta, hücre kültürü orta ve 37 ° c su banyosu içinde distile su önceden ısıtmak.
- 1.5 mL microcentrifuge tüp transfection karışımı hazırlayın. Steril çalışma koşulları sağlamak için laminar akış başlık altında çalışır.
- Mix 7.5 µL 4 µg her endotoksin içermeyen DNA'ın (Synaptophysin-mOrange ve mGFP/GFP-Rogdi) ile 2 M kalsiyum klorür. Toplam hacmi 1.5 mL microcentrifuge tüp içinde 60 mL ulaşmak için su ekleyin.
- Transfection arabellek 60 mL karışıma ekleyin. En iyi sonuçları elde etmek için transfection tampon dropwise DNA-mix vortex Tarih hafifçe sallayarak süre ekleyin.
- (RT) Oda sıcaklığında 20 dakika kuluçkaya. Laminar akış hood yanındaki tüp yerleştirerek kuluçka süresi sırasında kuluçka tüp sallayarak kaçının.
- Laminar akış başlık altında hücre kültür orta ("şartına orta") 1000 mL damlalıklı kullanarak kuyulardan çıkarın ve kuluçka ayrı bir kapta saklayın.
- İndirimli serum orta 500 mL her şey için ekleyin. 20 dakika kuluçka dönemi (adım 2.3.3) bitene 37 ° C ve % 5 CO2 hücreleri kuluçkaya.
- Transfection mix 30 mL birkaç damla pipetting tarafından her şey için ekleyin. Tüpün dibinde tortu atmak.
- Bütün wells transfection karışımı ile temin edildikten sonra orta transfection karışımının dağıtımını sağlamak için 24-şey plaka yavaşça salla.
- 60 dakika 37 ° C ve % 5 CO2kuyu kuluçkaya.
- Kaldırmak ve transfection mix atmak ve hücre kültür orta ile üç kez yıkayın. Her şey için hücre kültür orta 1 mL ekleyin ve onları Orta RT. kaldırmak 750 mL 30 saniye için kuluçkaya ve taze orta aynı miktarda ekleyin. Bunu üç kez tekrarlayın.
Not: Çamaşır adım önemlidir. Her şey en azından yok orta vardır zaman tutmak (i.e., çıkarma ve iyi iyi değiştirme) ve çamaşır orta yavaşça ekleyin. - Kaldırmak ve hücre kültür orta atın ve şartına orta iyi-tarafından-da 450 mL ekleyin.
- Nöronlar kuluçka DIV 10 37 ° C ve % 5 CO2 olgun izin.
3. stimülasyon ve Syt1 alımı
Not: Aşağıdaki protokol için 3 kuyu Anlamazdın uygulanır. İçin depolarizasyon kuyu diğer herhangi bir sayıda tutarları uygun şekilde ayarlayın.
- 10 x depolarizasyon arabellek (640 mM NaCl, 700 mM KCl, 10 mM MgCl2, 20 mM CaCl2, 300 mM glikoz, 200 mM HEPES, pH 7,4) bir Erlenmeyer şişesi 50 mL hazırlayın.
Not: Depolarizasyon arabellek birkaç hafta için 4 ° C'de tutulabilir. Bir sigara depolarize çözüm de kullanılırsa, bir 10 hazırlamak 1290 mM oluşan x Tyrode'nın çözüm NaCl, 50 mM KCl, 10 mM MgCl2, 20 mM CaCl2, 300 mM glikoz, 200 mM HEPES pH 7.4 karşılaştırmak üzere stimülasyon kaynaklı ile kendiliğinden geri dönüşüm geri dönüşüm. 1 x seyreltme sonra Tetradotoksin 1 µM Aksiyon potansiyeli üretimi engellemek için kullanmadan önce ekleyin.- 1.87 gram NaCl, KCl, 0.1 g MgCl2-6 H20, CaCl2-2 H2O 0,15 g ve 3.0 g glikoz-1 H2O ve HEPES 2.38 g 50 ml distile su içinde bir Erlenmeyer flask 2,61 g geçiyoruz. NaOH ve steril-filtre çözümü ile pH ayarlayın. Arabellek 1:10 1 x konsantrasyon ulaşmak için distile suda sulandırmak.
- %4 paraformaldehyde (PFA) 1 x PBS (pH 7,4) stimülasyon sonra fiksasyon için hazır olun.
- 500 mL % 4'lük için 1 x PBS, PFA çözülür paraformaldehyde 450 ml distile H2o 20 g
Not: Çözüm Isıtma eriterek kadar hızlandırabilir ancak PFA parçalanır gibi çözüm üzerinde 70 ° C, ısı değil.
Uyarı: Toksik, potansiyel olarak kanserojen ve teratojenik PFA. PFA ile çalışırken eldiven, duman başlık altında çalışmak ve sindirim kaçının. - RT için çözüm soğumaya bırakın ve 50 mL 10 x PBS stok çözeltisi ekleyin. PH 7.4 için NaOH/HCl pH metre kullanarak ayarlayın.
- 500 mL % 4'lük için 1 x PBS, PFA çözülür paraformaldehyde 450 ml distile H2o 20 g
- 1 depolarizasyon arabellek x 600 mL ve hücre kültür ortamına su banyosu 37 ° C'de 10 mL önceden ısıtmak.
- Fare anti-Syt1 antikor (klon 604.2) 1 mL 1 x depolarizasyon arabellek ve girdap 10 saniyeliğine ekleyin.
- Kaldırmak ve hücreleri hücre kültür ortamından atın. 200 mL her şey ve 37 ° C ve % 5 CO2 kuluçka makinesi'de 5 dakika kuluçkaya depolarizasyon-antikor karışımı ekleyin.
- Kaldırmak ve depolarizasyon-antikor mix atmak ve hücre kültür orta ile üç kez yıkayın. Her şey için hücre kültür orta 1 mL ekleyin ve orta RT. kaldırmak 750 mL 30 saniye için kuluçkaya ve taze orta aynı miktarda ekleyin. Üç kere tekrar edin.
- Kaldırın ve hücre kültür orta atmak ve % 4'lük 300 mL ekleyin 1 x PBS PFA. 4 ° C'de 20 dakikadır kuluçkaya
- 1 x PBS ile 5 dakika her için üç kez yıkayın.
Not: Protokol burada duraklatılmış.
4. Immunocytochemistry
- 50 mL engelleme arabelleği hazırlayın.
Not: arabellek engelleme-20 ° C'de aylarca tutulabilir.- 2.5 g sükroz ve sığır serum albumin (BSA) 1 g 5 mL 10 x PBS stok çözeltisi geçiyoruz. 1.5 mL % 10 deterjan stok çözeltisi ekleyin. Çözüm kadar tüm bileşenleri düzgün çözünmüş ve distile H2O son hacmi 50 mL erişene dek ekleyin karıştırın. Aliquot çözüm ve depolama için aliquots Don.
- (Birincil Syt1-antikor türler karşı yönetmen) ikincil, fluorophore birleşince antikor 1: 1000 seyreltme her kuyuda engelleme arabellekte 200 ml seyreltik.
- Kaldırmak ve her şey bir coverslip içeren üzerinden 1 x PBS atın.
- Arabellek-antikor karıştırmak için her şey engelleme 200 mL ekleyin ve RT. az 60 dakika boyunca kuluçkaya
Dikkat: ikincil antikorlar ışığa duyarlı olduğundan, tüm adımları ilerlemeye karanlıkta gerçekleştirilmesi gerekir. - Kuluçka sonra hücreleri üç kez için 1 mL 1 x PBS ile 5 dakika yıkayın.
- Mikroskop slaytlar üzerindeki coverslips ile gömme orta gömün.
- Mikroskop slayt ortamına katıştırma 7 mL damla ekleyin. Coverslip bir şırınga ile kaldırma ve forseps ile kapma 24-şey plaka çıkarın.
Dikkat: forseps dikkatli olmalıdır bu yüzden hücreleri coverslip yüzeyi kolayca, zarar görmüş. - Coverslip PBS kaldırmak ve dikkatli bir şekilde yumuşak bir doku için bir kenar dokunarak kuru için distile su içine daldırma.
- Böylece hücreleri taşıyan yüzey böylece hücreleri gömme orta katıştırma mikroskop slayt yüzleri coverslip gömme orta damlacık üzerine çevirmek.
- Mikroskop slayt ortamına katıştırma 7 mL damla ekleyin. Coverslip bir şırınga ile kaldırma ve forseps ile kapma 24-şey plaka çıkarın.
- Slaytlar için 1-2 h başlık altında kurumaya bırakın (ışığa maruz önlemek için kapak) ve 4 ° C'de bir mikroskop slayt kutusunda saklamak
Not: Protokol burada duraklatılmış.
5. mikroskobik analizlerin yapıldığı
- Coverslips kuru sonra onları objektif ve kamera ile mikroskop altında yerleştirin.
- Kaç piksel gri değerlerden en büyük dağıtım sağlamak için pozlanmış her kanal için çekim hızı ayarlayın.
Not: çekim hızı kanallar arasında farklı olabilir iken, coverslips arasında karşılaştırılabilir emin olmak bir kanal için sabit olmalıdır. - İlgi coverslip (ROIs) 10 bölgeler için çok kanallı görüntüler elde etmek. GFP-floresan, hangi-meli var olmak punctate kontrol ederek yatırım getirisi transfected nöron aksonal işlemlerini içerdiğini denetleyin.
6. istatistiksel analiz
- Görüntüleri .tif dosyaları olarak dışa aktarma. Yanında tıkırtı eğe OpenView18 ilgili resimleri yüklemek | Görüntü dosyasını yükle.
- Synaptophysin-mOrange görüntüsü olarak Kanal 1, Rogdi-GFP/mGFP resmi gibi 2 kanal ve Kanal 3 olarak Alexa647 floresan görüntü seçin.
- Eşik ROIs.
- Çözümleme ' yi tıklatın | Yer alan puncta üzerinde. Görsel incelenmesi üzerine, diffüz floresan, sadece punctate sinyalleri (temsil eden Synaptophysin-mOrange floresan) Kanal 1 görüntü bırakarak söz konusu değildir eşik ve Delta yoğunluk değerleri seçin. Tüm görüntüler için aynı eşik tutun.
- Bu ROIs (GFP-Rogdi/mGFP floresan) karşılık gelen kanal 2 ve 3 (Syt1-floresan) her coverslip alanının Şimdi Çalıştır' ı tıklatarak aktarın.
Not: ROIs hücre çift transfected ise sadece düşünülmelidir. Bu yöntemde, mOrange ve GFP floresans açıkça görünür olmalıdır. - Verileri günlük verilerinitıklatarak analiz günlük düzenleyicisine kaydetmek.
- Windows sekmesinin altındaki analiz günlük Düzenleyicisi'ni açın ve her kanal için değerleri kopyalayın. Değerleri ayrı kanallar için bir elektronik tabloya yapıştırabilirsiniz.
- Her iki transfection koşullarında (GFP-Rogdi ve mGFP) ROIs Syt1 kanalda ortalama floresans yoğunluğunu belirlemek.
- Önemli farkları belirlemek için bir öğrenci t-testi gibi uygun istatistiksel testler uygulanır.
Sonuçlar
Beklenen sonuç bu yaklaşımın coverslip başına yaklaşık 50 nöronlar çift transfected bir yoğunluk iyi başına 50.000 nöronların, yerini. Her nöron axon birikimi kümeleri ofSVs gösteren fluorescently öğesini Synaptophysin, birden çok etkin noktaları göstermek için bekleniyor. Fonksiyonel presynaptic siteler, rekombinant Synaptophysin sinyal punctate Syt1 floresan ile colocalizes. Çift Kişilik transfection, GFP-Rogdi ilgi (Şekil 1) protein olarak ya da mGFP denetim olarak rekombinant Synaptophysin ile birlikte ifade kullanmaktır.
Bu deneyde, GFP-Rogdi veya mGFP ifade nöronlar presynaptic sitelerdeki geri dönüşüm SV analiz. Denetim protein, mGFP, homojen bütün hücre dağıtılır, ancak ortak presynaptically zenginleştirilmiş ikinci bir protein transfect için gerekli o zaman nüfuzunu sinaptik sitelerdeki hala belirlenmesi ihtiyacı fluorescently öğesini Synaptophysin.
Daha önce açıklandığı gibi hücre depolarizasyon kaynaklı verici yayın tabi. Sonuç olarak, Orta olarak eklendi Syt1 antikorlar fonksiyonel sinapslarda kaplar. Fluorescently etiketli bir ikincil antikor ile immunolabeling Syt1 antikor sonra Syt1 Alım ölçüde son olarak immunosignal (Şekil 2) kullanarak sayısal.
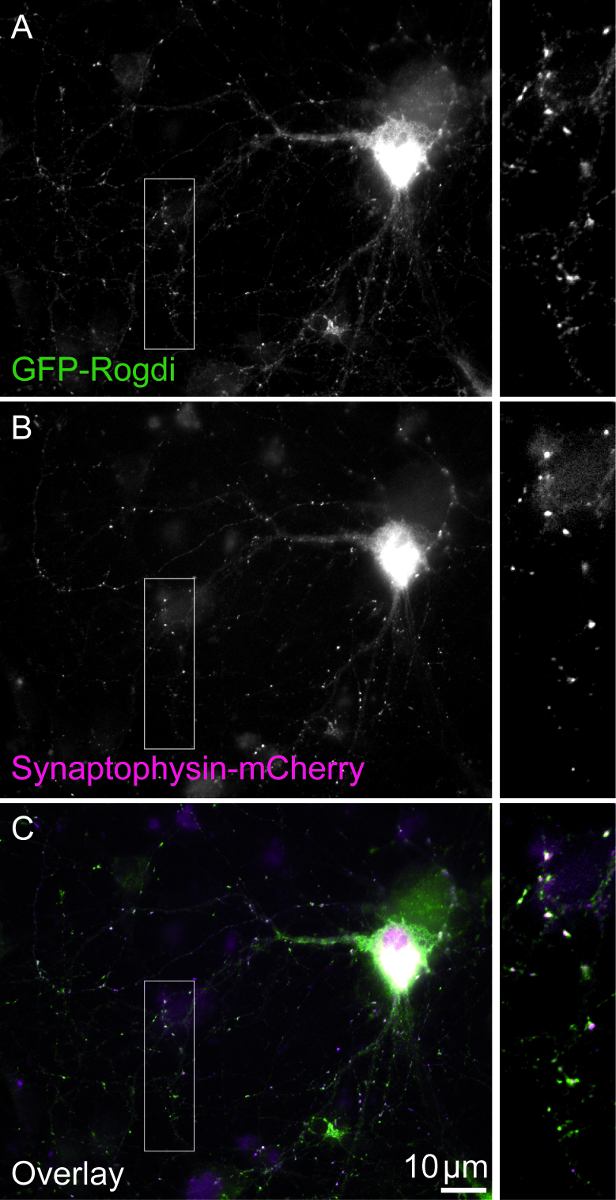
Şekil 1. Hücre çift-transfected. Görüş alanı GFP-Rogdi (A) ve Synaptophysin-mCherry (B) ifade bir çift transfected hücre gösterir. Synaptophysin bol sinaptik vezikül proteindir. Rekombinant onun değişik sinaptik boutons etiketleme için kullanılabilir. GFP-Rogdi yerelleştirme paterni, Synaptophysin-mCherry (C) benzer. Ölçek çubukları 10 mikron =. Kutuları 2.5 X büyütme göster. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Şekil 2. GFP-Rogdi, fonksiyonel sinapslarda. Canlı Syt1 alımı mGFP (yeşil) ve Synaptophysin-mOrange (kırmızı; ifade çift transfected hücrelerde gerçekleştirildi A-D) veya GFP-Rogdi (yeşil) ve Synaptophysin-mOrange (kırmızı; E-H). Syt1 antikor alımı Syt1 luminal etki alanı karşı yönettiği bir fare monoklonal antikor kullanılarak gerçekleştirildi. Sonra İngiltere'de yılın fiksasyon, hücreleri tavşan anti-GFP antikor ile lekeli. İkincil antikorlar (Anti-tavşan Alexa 488 ve anti-fare Alexa 647) GFP veya GFP-Rogdi ve Syt1, sırasıyla algılamak için eklenmiştir. Autofluorescence Synaptophysin-mOrange, presynaptic terminalleri (B ve F) tespit etmek için kullanıldı. Punctate Syt1 ayirt (mavi; geri dönüşüm vezikül siteleri gösterir C ve G). Not Syt1 etiketli sinapslarda çoğunluğu sigara transfected nöronlar için yerelleştirilmiştir. GFP-Rogdi için etkin sinapslarda hedef aldı ve geri dönüşüm (I) sinaptik vezikül değişmedi. 3 bağımsız kültür deneyler gerçekleştirilen (N = 3). Her kültür (toplam-in 10) üzerinden en az 3 coverslips analiz için kullanılmıştır. Son olarak, coverslip başına 3 alanlarda analiz edildi (n = 30). Student´s t-testi anlamlı bir fark gösterdi. Ölçek çubukları 10 mikron =. Hata çubukları ortalama (S.E.M.) standart hatasını temsil eder. "NS" anlam gösterir. Bu rakam Riemann ve ark. değiştirildi 9 Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Tartışmalar
Orada üç deneyleri rutin olarak sinaptik vezikül (SV) geri dönüşüm çalışırdım. İlk iki kullanımını içerecek bir) Floresan styryl Boyayıcılar FM1-(hangi organelleri endositoz sırasında alınır ve ekzositozu sonra yayımlanan membranlar dahil) 43 gibi; ve b) fluorescently rekombinant SV proteinler (ki, overexpression proteinaceous geri dönüşüm makineleri dahil) öğesini. Ekli fluorophores onların floresans pH bağlı olarak değiştirirseniz, bir SV asidik iç ve ekstraselüler ortamın pH arasındaki değişiklikleri izlemek için kullanılabilir. GFP ile bir pH duyarlı değişken öğesini rekombinant proteinler Phluorins adı verilir. Tartışılan iki deneyleri her ikisi de olmuştur, daha önce19,20özellikli ve artılarını ve eksilerini her gözden geçirilmiş21de olmuştur.
Burada, bir üçüncü, köklü Yöntem4,5,6,7,9,14açıklayın. SV geri dönüşüm test etmek için luminal etki alanı vezikül ilişkili protein Synaptotagmin-1 (Syt1) hücre yüzeyine ekzositozu üzerine maruz olur aslında avantajlarından yararlanın. İlk olarak, luminal etki alanı sonra tarafından vezikül SV geri dönüşüm sırasında kullanılan kültür ortamına karşı bir antikor ekleyin. Bu antikor alımı görüntülenir ve ayirt tarafından sayılabilir. Alternatif olarak, doğrudan etiketli Syt1 antikor-ebilmek var olmak kullanılmış. Etiket pH-bağımsız yerelleştirme Syt1-yerelleştirme floresans değişiklikleri tabanlı raporlama antikor iç ve dış yüzeyi SVs veya pH bağımlı, raporlama, olabilir. Ayrıca bu SV geri dönüşüm tahlil faiz, GFP-Rogdi, hedeflerin işlevsel bir protein synapses ve SV geri dönüşüm etkiler olup olmadığını test etmek için kültürlü nöronların Çift Kişilik transfection ile birleşimi açıklar. GFP-Rogdi bu yaklaşım için özeldir; Ancak, aynı soruları için ilgi herhangi bir protein saptanabilir.
Bu tahlil ilk spontan SVs4 / geri dönüşüm izlemek için 1992 yılında piyasaya sürüldü ve uyarılmış SV12geri dönüşüm izlemek için aynı grup tarafından daha da geliştirildi. Deneylerle Syt1 alımını SV ekzositozu12blok clostridial nörotoksinler için hassas kurulmuştur. Onlar da kültürler tarafından 37 ° C'de depolarizasyon uyarılması 1) kültürleri çoğu endositoz engeller, buz üzerinde tutulur ve 2) kültürler stimülasyon, olmadan 37 ° C'de inkübe göre Syt1 antikorlar içselleştirilmesi geliştirir gösterdi ki kendiliğinden geri dönüşüm için izin verir ancak geri dönüşüm12,22uyandırmak değil. Tahlil SV iki koşul arasında gibi ile ilgi bir molekül olmadan geri dönüşüm ve kolayca karşılaştırabilirsiniz. Özellikle, bu iletişim kuralını Syt1 antikor alımını bir overexpressed belirli protein eksikliği karşı huzurunda karşılaştırma üzerinde duruluyor. Yüzey-bağlama, kendiliğinden geri dönüşüm ve uyarılmış geri dönüşüm göreli katkılarıyla değerlendirilmesi gerekirse protokol genişletilebilir. Örneğin, nöron uyarımı olmadan buzda kuluçka endositoz, Syt1 antikor yüzey herhangi bir bağlama açığa engeller. Tetradotoksin ile bazal çözümde 37 ° C'de nöronlar kuluçka Aksiyon potansiyeli yayılım, kendiliğinden herhangi bir geri dönüşüm açığa engeller. Böylece, kuluçka nöronlar uyarıcı koşullar olabilir altında 37 ° C'de uyarılmış SV geri dönüşüm ölçüde ortaya koyuyor.
Canlı hücreler için ideal fizyolojik koşullar duyarlıdır; Bu nedenle, bakım, transfection ve depolarizasyon arabellekleri her zaman pH ve sıcaklık gibi fizyolojik parametreler için sınanmalıdır. PH ayarlanır sonra depolarizasyon arabellekleri steril filtrelerden geçirilebilir, transfection arabellekleri steril filtreleme için hassas vardır. Bu nedenle, biz onun pH ayarlama, almak o kadar kullanmak donmuş ve bakterileri cips için bir masa üstü santrifüje sıralayacağız. Transfection için yeterince plazmid Derneği kalsiyum fosfat kristalleri ile emin olmak için tampon karıştırmak için hayati önem taşımaktadır. Kalsiyum fosfat transfection en iyi 2-4 gün vitro üzerinde (DIV) çalışır. Tagged Synaptophysin, SV transmembran protein transfected nöronlar içinde presynaptic terminalleri tanımlamak için bir işaretleyici olarak kullanın. Etiketlenmiş sürümlerini SV2, Synapsin ve vampir/Synaptobrevin gibi diğer SV proteinler veya etkin bölge moleküllerin fagot, RIM, Munc13-1 ve döküm de kullanılabilir.
Hem mCherry hem de mOrange kırmızı floresans yayarlar. MCherry mOrange parlak olmasına rağmen mOrange daha uzun dalga boylarında, büyük emisyon vardır. Bu nedenle, GFP, kırmızı boya ve boya yayan 700 nm aralığında üç kişilik floresans görüntüleme için mCherry daha iyi bir seçenek mOrange. Ondan beri onun parlak boya GFP ve kırmızı boya ile çift floresan için mCherry olumlu olabilir. Seyrek transfection güvence altına almak için transfection mix 60 dakikadan inkübe değil. Kuluçka depolarizing arabellekte tüm veziküller ekzositozu sağlamak için doğru süreyi olması önemlidir. Ancak, genişletilmiş depolarizing arabellek maruz kaçınılmalıdır. Resim alma sırasında aynı pozlama süreleri ve deneyler farklı grupları arasında ölçülebilir karşılaştırma sağlamak için ışık yoğunluklarda uygulamak esastır.
Son olarak, görüntü analizi sırasında bizim protokol bazı noktaları içerir. Diffüz floresans hariç rekombinant Synaptophysin puncta gösterilen ilgi bir alan için daha düşük yoğunluktaki eşik ayarlanır. Ardından, bu eşiğin diğer alanları ve coverslips benzer punctate sinyalleri eklenmesi ve diffüz floresans dışlanması gözlemlemek için test edilmiştir. Uygun bir eşik değeri tanımlanmış bir kez tüm görüntüleri, punctate faiz (ROIs) bölgelerinde rekombinant (mCherry veya mOrange etiketli) Synaptophysin kanalda üreten uygulanır. Son olarak, Syt1 yoğunluk ROIs9için belirlenir.
Yaklaşımımız seyrek transfection için optimize edilmiştir. Biz karmaşık bir ortamda presynaptic işlev analiz olduğu yerde aksonlar transfected nöronların untransfected nöronlar tarafından çevrili içinde geri dönüşüm SV. Bu kurulum, Çift-transfection nöronal fonksiyon işlemek ve transfected nöronlar presynaptic terminallerinin bulmak için bize izin verir. Untransfected postsinaptik nöronlar başvurun transfected presynaptic nöronlar SV geri dönüşüm bir presynaptic nöron'ın etkileri değerlendirmede önemli bir faktör olduğunu. Bu ayar ayrıca kolayca bir postsinaptik manipülasyon presynaptic değişikliğe neden olup olmadığını test etmek için adapte edilebilir. Bu durumda, nöronların postsinaptik sitelerine hedeflenmiş bir protein ile seyrek transfection transfected nöronlar postsinaptik siteleri yerelleştirilmesine ve Syt1 alımı untransfected nöronlar sinaptik boutons belirlenebilir.
Seyrek transfection gerekmediğinde, farklı transfection iletişim kuralları uygulanır. Örneğin, transfection ile Lipofectamine DIV 7 - 8 sonuçlarında yüksek transfection oranları, ama aynı zamanda her transfected hücre9daha güçlü ifade üzerine kuruludur. Ayrıca, viral iletim ifadede kültürlü nöronlar14,23,24neredeyse % 100 neden olabilir. SV geri dönüşüm izleme amaçlayan deneyler, transfection için tek bir protein gerçekleştirilen veya tamamen yaptı. Örneğin, ne zaman genel olarak sinaptik geri dönüşüm wildtype neurons arasındaki karşılaştırıldığında ve genetiği değiştirilmiş fare bireysel nöronlar tarafından transfection etiketleme, gerekli değildir. Ayrıca, bu immunolabeling endojen proteinlerin sağlar. Transfection başarısız olursa, bu doğrulanmış bir plazmid ile transfection tampon sınamak veya bir arabellek farklı pH ile kullanmak önemlidir ( transfection arabellek hazırlanmasıkonusuna bakın). Endotoksin ücretsiz DNA hazırlıklar kullanarak da çok önemli gibi görünüyor. Immunostaining Syt1 antikorlar çalışmalarında hem İngiltere'de yılın sabit ve metanol sabit örnekleri içselleştirilmiş. Ayrıca GFP ve RFP autofluorescence metanol fiksasyon sonra kaybolur dikkat edilmelidir. GFP veya RFP metanol-sabit hücrelerde yerelleştirilmesi gereken, bu proteinler immunolabeled olması gerekir. Syt1 alımını başarısız olursa, depolarizasyon zaman ve K+ konsantrasyon depolarizasyon arabelleği buna göre değiştirilmelidir. Çok protokolü varyasyon, 90 s25 -60 dk12arasında değişen kez depolarizasyon ile ve 45 mM, 50 mM, 70 mM, 110 mM6,ve25,26 K+ konsantrasyonları ile yayınlanmıştır ,27. Ne zaman tekrarlayan faaliyet engelledi, glutamat reseptör blokerleri depolarizasyon sırasında da eklenebilir. Son olarak, yüksek K+ depolarizasyon en güçlü uyarıcı olduğu düşünülen iken, Aksiyon potansiyelleri SV daha fazla fizyolojik uyaranlar22,28geri dönüşüm tetikleyebilir. Syt1 antikor alımını etkinlik farklılıkları fare ve fare kültürde ortaya çıkabilir. Süre daha güçlü fare kültürlerde boyama poliklonal tavşan anti-Syt1 antikor (RRID:AB_11042457) üretmek daha güçlü boyama fare kültürlerde sıçan kültürde monoklonal fare anti-Syt1 klon 604.2 (RRID:AB_993036) bizim yönteminde üretir ama bir uyarı birkaç notlar aşağıda ele alınmıştır.
SVs içine alımı için anti-Synaptotagmin antikor kullanımı ile ilgili çeşitli uyarılar dikkate alınmalıdır. İlk olarak, N-glikozilasyon asparagine 24 Syt1, protein29,30endocytotic alımını teşvik etmektedir. Asparagine 24 Syt1 luminal etki alanının bir parçasıdır. Kullandığımız fare ve tavşan antikorları amino asitleri 1-12 ve 1-8, sırasıyla, Syt1 karşı yönlendirilmektedir. Onların epitopları N-glikozilasyon site ile örtüşmeyen iken, steric engel veya bunun tersi olarak, bir indüksiyon antikor bağlama tarafından alım dışarıda bırakılamaz. Syt1 N-glikozilasyon sitedeki mutasyon endositoz kinetik ve Syt1 SVs için hedefleme değiştirmez. Endositoz zayıf uyaranlara tarafından indüklenen yapılacağı dış plazma membran yüzeyinde kalan Syt1 kısmını artırır. Güçlü bir çekim gücü, yüksek K+ depolarizasyon gibi uygulandığında, hiçbir azalma olmaz Syt1 alımını30görülmektedir. Genel olarak, antikorlar N-glikozilasyon site bir şekilde müdahale Eğer onlar SV endositoz antikor-Alerjik koşullara göre bir değişiklik neden olabilir ama bu değişiklik (bizim durumumuzda GFP-Rogdi overexpression) deneme için benzer olmalıdır ve Denetim (bizim durumumuzda GFP ifade). Buna ek olarak, çünkü bir kopya sayıda antikor epitope için bağlar poliklonal antikorlar steric sorunları ve crosslinking monoklonal antikorlar, daha ikna etmek daha büyük olasılıkla olabilir. Biz mevcut antikorlar birbirleri ile karşılaştırarak sistematik çalışmaların farkında değildir; Ancak, bazı çalışmalarda belirli antikor geçerliliğini ele sahip. Monoklonal fare anti-Syt1 antikor klon 604.2 ve Synaptophluorin-floresan değişiklikleri doğrudan karşılaştırmada kullanılarak oluşturulduğunda SV geri dönüşüm kinetik probed, örneğin, benzer sonuçlar, bu antikor28kullanımını doğrulama elde edilmiştir. SVs poliklonal tavşan Syt1 antikorlar ile yükleme ve sinaptik iletimi electrophysiologically kayıt yüklü sinapslarda Syt1 bir şekilde işlev kaybı mutantlar anımsatan sinaptik iletimi azaltılmış vardı ortaya koydu. Bu nedenle, bu poliklonal antikorlar sinaptik iletimi etkilemez. Gerçek alımını spontan ve uyarılmış poliklonal antikor SV geri dönüşüm bir tur izlemek uygundur, ama sonuçları bu antikorlar31alımını sonra yorumlarken dikkatli alınmalıdır düşündüren geri dönüşüm, ortaya.
SV geri dönüşüm çalışması için rutin olarak kullanılan, membran styryl ile etiketleme dahil Phluorins, overexpression boya, ve Syt1-antikor uptake burada gerçekleştirilen üç deneyleri. Tüm üç deneyleri SV geri dönüşüm endocytotic ve exocytotic bacaklar belirlemek için kullanılabilir. Tüm üç deneyleri güçlü faydaları varken, her ayrıca ilke bilmeniz gereken vardır. FM boya tüm hücre yüzey etiket ve tüm geri dönüşüm Membranlar ile hücre içine alınır. Phluorins overexpression tarafından tanıtıldı gerekir. Syt1-antikorlar endojen protein etiket, ama bazı antikor işlevi belirli koşullar altında etkileyebilir. Ancak, her uyarı uygun şekilde ele21olabilir.
Genel olarak, Syt1 antikor alımını tahlil çeşitli amaçlara hizmet etmektedir. İlk olarak, seçmeli olarak spontan veya uyarılmış geri dönüşüm, sırasıyla28,31,32,33geçiren SVs etiketlemek için kullanıldı. İkinci olarak, bu bir ilaç ya da protein SV geri dönüşüm ölçüde üzerindeki etkisini belirlemek için kullanılan; Örneğin, BDNF6geri dönüşüm kendiliğinden ve uyarılmış SV geliştirir göstermek için. Üçüncü olarak, SVs morfolojik tanımlanmış sinapslarda34,35toplam sayısı yüzdesi olarak geri dönüşüm ile sinapslarda sayısını belirlemek için kullanıldı. Bu postsinaptik hücre adezyon molekülü Neuroligin-1 overexpressing SVs25 geri dönüşüm ile sinapslarda yüzdesini artırır ve AMPA tipi glutamat reseptörlerinin ifade azaltma yüzdesi azaltır ortaya presynaptically sessiz sinapslarda36yüzdesi artan SVs, geri dönüşüm ile sinapslarda. Ayrıca, tahlil etiketli SVs27 hareketliliğini çözümlemek ve Syt1 lokalizasyonu nanoscopy13,22,33kullanarak belirlemek için kullanıldı. Son olarak, bu yöntem hala işlevsel sinapslarda9' a bazı proteinler yerelleştirmek olup olmadığını sınamak için kullanılır. Syt1 antikor antikor nöronlarda alımını37gün için nerede kalır uzun vadeli çalışmalar için de kullanılabilir. Bu ikinci tur ayrı olarak etiketli Syt1 antikor veya farklı bir SV protein luminal etki alanı karşı yönettiği bir antikor kullanarak alım ile kombine edilebilir. Bu hangi SVs başlangıçta geri dönüşümlü ve hangi bir deney sonunda geri dönüşüm test sağlar. Bu tahlil akut dilimleri ve organotypic dilim kültürler gibi daha sağlam modeli sistemlerine uyum için ilginç olabilir. Prensip olarak, alımını tahlil wildtype dokudan karşılaştırmasını sağlar ve genetik olarak hayvanlar değiştirilmemiş veya viral teslim ya da biolistics, yaniile birlikte., "gen silah," protein ifade bu modeli sistemlerinde işlemek için. Bu tür sistemleri, bazı tedirginlikler alımını tahlil ve ağ dynamics tarafından izlenen presynaptic makine üzerinde etkisi aynı anda okudu.
Açıklamalar
Yazarlar ifşa gerek yok.
Teşekkürler
Irmgard Weiss uzman teknik destek için teşekkür ederiz. Bu eser DFG kümenin mikroskobu nanometre mesafeden için mükemmel ve moleküler fizyolojisi (CNMPB, B1-7, T.D.) beyin üzerinden tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| B27 | Gibco | 17504-044 | |
| BSA | Sigma | A7030-50g | |
| CaCl2 | Sigma-Aldrich | C3306-100g | |
| CoolSNAP HQ2 | Photometrics | ||
| dH2O | Invitrogen | 15230 | |
| DABCO | Merck | 8.03456.0100 | |
| donkey anti mouse Alexa 647 | Jackson-Immunoresearch | 715605151 | antibody |
| DMEM | Invitrogen | 41966 | |
| DPBS | Gibco | 14190 | |
| Eppendorf tubes | Eppendorf | 30120094 | |
| multiwell 24 well | Fisher Scientific | 087721H | |
| tube (50 mL) | Greiner Bio-One | 227261 | |
| FBS superior | BiochromAG | S0615 | |
| Glucose | Merck | 1,083,421,000 | |
| HBSS | Invitrogen | 14170 | |
| HEPES | Sigma | H4034-500g | |
| Hera Cell 150 (Inkubator) | ThermoElectron Corporation | ||
| KCL | Sigma-Aldrich | P9541-500g | |
| L-Glutamin | Gibco | 25030 | |
| MgCl2 | Honeywell | M0250-500g | |
| microscope slides | Fisher Scientific | 10144633CF | |
| Microsoft Excel | Microsoft | ||
| Mowiol4-88 | Calbiochem | 475904 | |
| NaCl | BioFroxx | 1394KG001 | |
| Na2HPO4 | BioFroxx | 5155KG001 | |
| Neurobasal | Invitrogen | 21103049 | |
| OpenView Experiment Analysis Application | Free software, see comments | written by Noam E. Ziv, Technion – Israel Institute of Technology, Haifa, Israel | |
| PBS (10x) | Roche | 11666789001 | |
| Optimem | Invitrogen | 31985 | |
| Penstrep | Gibco | 15140-122 | |
| PFA | Sigma | P6148-1kg | |
| safety hood | ThermoElectron | Serial No. 40649111 | |
| Sucrose | neoFroxx | 1104kg001 | |
| Synaptotagmin1 | Synaptic Systems | 105311 | mouse monoclonal; clone 604.2 |
| Triton X-100 | Merck | 1,086,031,000 | |
| Vortex Genius 3 | IKA | 3340001 | |
| Water bath | GFL | 1004 | |
| Zeiss Observer. Z1 | Zeiss |
Referanslar
- Koh, T., Bellen, H. J. Synaptotagmin I, a Ca2+ sensor for neurotransmitter release. Trends in Neurosciences. 26, 413-422 (2003).
- Chapman, E. R. How Does Synaptotagmin Trigger Neurotransmitter Release. Annual Review of Biochemistry. 77, 615-641 (2008).
- Perin, M. S., et al. Structural and Functional Conservation of Synaptotagmin (p65) in Drosophila and Humans. Journal of Biological Chemistry. 266, 615-622 (1991).
- Matteoli, M., Takei, K., Perrin, M. S., Südhof, T. C., De Camilli, P. Exo-endocytotic Recycling of Synaptic Vesicles in Developing Processes of Cultured Hippocampal Neurons. Journal of Cell Biology. 117, 849-861 (1992).
- Ko, J., et al. Neuroligin-1 performs neurexin-dependent and neurexin-independent functions in synapse validation. The EMBO Journal. 28, 3244-3255 (2009).
- Shinoda, Y., et al. BDNF enhances spontaneous and activity-dependent neurotransmitter release at excitatory terminals but not at inhibitory terminals in hippocampal neurons. Frontiers in Synaptic Neuroscience. 6, 27(2014).
- Ivanova, D., et al. Synaptic activity controls localization and function of CtBP 1 via binding to Bassoon and Piccolo. The EMBO Journal. 34, 1056-1077 (2015).
- Crawford, D. C., Ramirez, D. M. O., Trauterman, B., Monteggia, L. M., Kavalali, E. T. Selective molecular impairment of spontaneous neurotransmission modulates synaptic efficacy. Nature Communications. 8, 1-14 (2017).
- Riemann, D., Wallrafen, R., Dresbach, T. The Kohlschütter-Tönz syndrome associated gene Rogdi encodes a novel presynaptic protein. Scientific Reports. 7, (2017).
- Kim, M., et al. Rogdi Defines GABAergic Control of a Wake-promoting Dopaminergic Pathway to Sustain Sleep in Drosophila. Scientific Reports. 7, 1-14 (2017).
- Schossig, A., Wolf, N. I., Kapferer, I., Kohlschütter, A., Zschocke, J. Epileptic encephalopathy and amelogenesis imperfecta: Kohlschütter-Tönz syndrome. Euopean Journal of Medical Genetics. 55, 319-322 (2012).
- Kraszewski, K., et al. Synaptic Vesicle Dynamics in Living Cultured Hippocampal Neurons Visualized with CY3-Conjugated Antibodies Directed against the Lumenal Domain of Synaptotagmin. Journal of Neuroscience. 15, 4328-4342 (1995).
- Willig, K. I., Rizzoli, S. O., Westphal, V., Jahn, R., Hell, S. W. STED microscopy reveals that synaptotagmin remains clustered after synaptic vesicle exocytosis. Nature. 440, 935-939 (2006).
- Petkova, A., Goedecke, N., Korte, M., Dresbach, T. Neuroligins mediate presynaptic maturation through brain-derived neurotrophic factor signaling. bioRxiv. , 262246(2018).
- Fuchs, C., et al. GABA(A) receptors can initiate the formation of functional inhibitory GABAergic synapses. European Journal of Neuroscience. 38, 3146-3158 (2013).
- Dresbach, T., et al. Functional regions of the presynaptic cytomatrix protein Bassoon: Significance for synaptic targeting and cytomatrix anchoring. Molecular and Cellular Neuroscience. 23, 279-291 (2003).
- Seibenhener, M. L., Wooten, M. W. Isolation and Culture of Hippocampal Neurons from Prenatal Mice. Journal of Visualized Experiments. (65), 4-9 (2012).
- Tsuriel, S., et al. Local sharing as a predominant determinant of synaptic matrix molecular dynamics. PLOS Biology. 4, 1572-1587 (2006).
- Iwabuchi, S., Kakazu, Y., Koh, J., Goodman, K. M., Harata, N. C. Examination of Synaptic Vesicle Recycling Using FM Dyes During Evoked, Spontaneous, and Miniature Synaptic Activities. Journal of Visualized Experiments. (85), 1-10 (2014).
- Villarreal, S., Lee, S. H., Wu, L. Measuring Synaptic Vesicle Endocytosis in Cultured Hippocampal Neurons. Journal of Visualized Experiments. (127), 1-8 (2017).
- Kavalali, E. T., Jorgensen, E. M. Visualizing presynaptic function. Nature Neuroscience. 17, 10-16 (2014).
- Opazo, F., et al. Limited Intermixing of Synaptic Vesicle Components upon Vesicle Recycling. Traffic. 11, 800-812 (2010).
- Wollebo, H. S., Woldemichaele, B., White, M. K. Lentiviral transduction of neuronal cells. Methods in Molecular Biology. 1078, 141-146 (2013).
- Yang, X., Kaeser-Woo, Y. J., Pang, Z. P., Xu, W., Südhof, T. C. Complexin Clamps Asynchronous Release by Blocking a Secondary Ca2+ Sensor via Its Accessory α Helix. Neuron. 68, 907-920 (2010).
- Wittenmayer, N., et al. Postsynaptic Neuroligin1 regulates presynaptic maturation. Proceedings of the National Academy of Sciences of the United States of America. 106, 13564-13569 (2009).
- Lazarevic, V., Schone, C., Heine, M., Gundelfinger, E. D., Fejtova, A. Extensive Remodeling of the Presynaptic Cytomatrix upon Homeostatic Adaptation to Network Activity Silencing. Journal of Neuroscience. 31, 10189-10200 (2011).
- Kraszewski, K., Daniell, L., Mundigl, O., De Camilli, P. Mobility of synaptic vesicles in nerve endings monitored by recovery from photobleaching of synaptic vesicle-associated fluorescence. Journal of Neuroscience. 16, 5905-5913 (1996).
- Hua, Y., Sinha, R., Martineau, M., Kahms, M., Klingauf, J. A common origin of synaptic vesicles undergoing evoked and spontaneous fusion. Nature Neuroscience. 13, 1451-1453 (2010).
- Han, W., et al. N-Glycosylation Is Essential for Vesicular Targeting of Synaptotagmin 1. Neuron. 41, 85-99 (2004).
- Kwon, S. E., Chapman, E. R. Glycosylation is dispensable for sorting of synaptotagmin 1 but is critical for targeting of SV2 and synaptophysin to recycling synaptic vesicles. Journal of Biological Chemistry. 287, 35658-35668 (2012).
- Afuwape, O. A. T., Wasser, C. R., Schikorski, T., Kavalali, E. T. Synaptic vesicle pool-specific modification of neurotransmitter release by intravesicular free radical generation. The Journal of Physiology. 595, 1223-1238 (2017).
- Sara, Y., Virmani, T., Deák, F., Liu, X., Kavalali, E. T. An isolated pool of vesicles recycles at rest and drives spontaneous neurotransmission. Neuron. 45, 563-573 (2005).
- Wilhelm, B. G., Groemer, T. W., Rizzoli, S. O. The same synaptic vesicles drive active and spontaneous release. Nature Neuroscience. 13, 1454-1456 (2010).
- Bacci, A., et al. Chronic blockade of glutamate receptors enhances presynaptic release and downregulates the interaction between synaptophysin-synaptobrevin-vesicle-associated membrane protein 2. Journal of Neuroscience. 21, 6588-6596 (2001).
- Piccoli, G., et al. LRRK2 Controls Synaptic Vesicle Storage and Mobilization within the Recycling Pool. Journal of Neuroscience. 31, 2225-2237 (2011).
- Tracy, T. E., Yan, J. J., Chen, L. Acute knockdown of AMPA receptors reveals a trans-synaptic signal for presynaptic maturation. The EMBO Journal. 30, 1577-1592 (2011).
- Truckenbrdot, S., Viplav, A., Jaehne, S., Vogts, A., Denker, A., Wildhagen, H., Fornasiero, E. F., Rizzoli, S. O. Ageing synaptic vesicles are inactivated by contamination with SNAP25. bioRxiv. , 172239(2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır