Method Article
مقايسة ضوئية لإعادة التدوير حويصلة متشابك في الخلايا العصبية مثقف Overexpressing البروتينات Presynaptic
In This Article
Summary
يصف لنا فحص بصري لحويصلة متشابك (SV) إعادة التدوير في استزراع الخلايا العصبية. الجمع بين هذا البروتوكول مع تعداء مزدوجة للتعبير عن علامة presynaptic والبروتين من الفائدة يسمح لنا بتحديد مواقع presynaptic، حويصلة متشابك على إعادة تدوير القدرات، وتحديد دور بروتين الفائدة.
Abstract
في المحطات الطرفية النشطة الأعصاب presynaptic، حويصلات متشابك الخضوع لدورات أكسو-والالتقام. أثناء إعادة التدوير، أصبح عرضه المجالات لومينال SV transmembrane البروتينات على سطح الخلية. واحدة من هذه البروتينات هو سينابتوتاجمين-1 (Syt1). يتم أخذ جسم مضاد ضد المجال لومينال من Syt1، مرة واحدة إضافة إلى متوسط الثقافة، خلال دورة أكسو-اندوسيتوتيك. هذا الإقبال متناسباً مع مقدار SV إعادة التدوير ويمكن قياسها كمياً عن طريق الفلورة. هنا، نجمع امتصاص جسم Syt1 مع مزدوجة تعداء الخلايا العصبية هيبوكامبال المستزرعة. وهذا يسمح لنا أن (1) ترجمة مواقع presynaptic استناداً إلى التعبير عن علامة presynaptic المؤتلف سينابتوفيسين و (2) تحديد الوظائف الخاصة بهم باستخدام الامتصاص Syt1 (3) تميز استهداف وآثار من البروتين ذات الاهتمام، والتجارة والنقل-روجدي.
Introduction
تدرس إعادة التدوير حويصلة متشابك مهم في تحديد كيفية تغيير خصائص presynaptic، أثناء اللدونة متشابك أو استجابة لاضطراب وظيفة متشابك. دراسة سينابتوتاجمين-1 (Syt1) امتصاص جسم يوفر أسلوب واحد لقياس مقدار SV إعادة التدوير. Syt1 هو بروتين SV المرتبطة بمثابة Ca2 + أجهزة استشعار وضروري لإطلاق سراح اكسوسيتوتيك العصبي1،2. بروتين ترانسميمبراني مع مجال هيولى ج-طرفية خارج SV ومجال لومينال الطرفي ن داخل ال SV3. خلال الرقابة، يصبح مكشوف المجال لومينال من Syt1 إلى الوسط الخارجي. علينا أن نضيف إلى هذه الوسيلة الخارجية، الأجسام المضادة الموجهة ضد المجال هيولى، الذي يصبح استيعابه خلال الالتقام. هذه الأجسام المضادة يمكن أن تكون أما قبل مترافق مع فلوروفوريس أو إيمونوستينيد مع الأجسام المضادة الثانوية4،5،،من67. كثافة الأسفار إيمونوسيجنال الناتج متناسباً مع مقدار التدوير SV. يمكن استخدام هذا النهج لتحديد SV التأسيسي والناجمة عن ديبولاريزيشن إعادة تدوير6،8.
يمكن إجراء فحوصات امتصاص Syt1 بعد نقل الفيروس بوساطة الجينات إلى الخلايا جميعها تقريبا في الطبق أو بعد تعداء متفرق من عدد صغير من الخلايا. لدينا أسلوب يجمع بين المقايسة تعداء مزدوجة متفرق من الخلايا العصبية هيبوكامبال الأولية باستخدام فوسفات الكالسيوم9. نحن نستخدم علامة المؤتلف بروتين المعروف أن تتراكم في presynapses، سينابتوفيسين فلوريسسينتلي الموسومة، لتحديد مواقع محطات presynaptic وأوفيريكسبريس لدينا بروتين الفائدة، روجدي. وهذا يسمح لنا لاختبار أم لا روجدي الأهداف الوظيفية synapses، ويؤثر SV إعادة التدوير. تم تحديد الجينات ترميز روجدي أصلاً في شاشة لطفرات المورفولوجية التي تتميز بضعف الذاكرة10. في البشر، وتسبب طفرات في الجينات روجدي مرض نادر ومدمر يسمى متلازمة Kohlschütter-Tönz. المرضى الذين يعانون من تشوهات مينا الأسنان والصرع فارماكوريسيستانت والتأخر الحركي؛ ومع ذلك، ظلت التعريب سوبسيلولار المنتج الجيني بعيد المنال11. وهكذا، تقدم مقايسة الامتصاص Syt1 أدلة أساسية لإضفاء الطابع المحلي على روجدي معلم بروتينات فلورية خضراء في نهايات الفنية9.
هذا الأسلوب امتصاص له فوائد عدة. أولاً، إعادة تدوير SV يمكن ملاحظة في الوقت الحقيقي على حد سواء عن طريق إجراء تصوير لايف7،12، وبعد تثبيت6،9 بقياس كثافة fluorescence تسمية الأسفار Syt1. بالإضافة إلى ذلك، وضعت عدة متغيرات جسم Syt1. وهناك متغيرات غير المميزة التي يمكن تسميتها بجسم ثانوية بعد تثبيت بروتوكول قياسي immunostaining، والمتغيرات قبل مترافق مع تسمية الأسفار تعلق بالفعل. وأخيراً، fluorescence المستندة إلى جسم مفيد بسبب مجموعة كبيرة من الأصباغ الثانوية أو مترافق المتاحة تجارياً التي يمكن استخدامها.
عند تحديد وإيمونوستينينج الخلايا العصبية، من الممكن أيضا وصمة عار للبروتينات إضافية وإجراء تحليل كولوكاليزيشن. هذا يمكن أن يساعد في تحديد مكان تواجدهم فيما يتعلق بإعادة تدوير SVs. كثافة تسمية الأسفار هو التدبير المباشر لمقدار SV إعادة التدوير. وباﻹضافة إلى ذلك، تسمية الأجسام المضادة بشكل انتقائي الهياكل التي تحتوي على Syt1، مما أدى إلى خصوصية عالية والقليل من الأسفار الخلفية4. يمكن أيضا استخدام البروتوكولات التحفيز المختلفة، مثل المخازن المؤقتة depolarization أو التحفيز الكهربائي البروتوكولات9،12،،من1314. ومع ذلك، يمكن قياس تدوير SV القاعدية دون تنشيط الثقافات العصبية15.
لدينا أسلوب يتناول تحديداً امتصاص جسم Syt1 في الخلايا العصبية transfected مزدوجة مع الأجسام المضادة الثانوية إيمونولابيلينج بعد التثبيت. ومع ذلك، نشير إلى كافة المتغيرات المستخدمة بصورة روتينية للمقايسة في مناقشتنا لإعطاء المشاهدين فرصة للتكيف مع البروتوكول للاحتياجات المحددة.
Protocol
وأجريت دراسات لا مع الحيوانات الحية. ويبلغ عدد التجارب التي تنطوي على الحيوانات euthanized للحصول على خلية الثقافات أقرتها السلطات المحلية حماية الحيوانات (غوتنغن تيرشوتزكوميشن der Universitätsmedizin) تحت الموافقة T10/30. أجريت التجارب مع البروتوكولات المعتمدة.
1-الابتدائي خلية هيبوكامبال ثقافة
- إعداد ثقافة الخلية ينتابها الحصين الفئران في يوم الجنينية 1916،17. لوحة الخلايا على كوفيرسليبس 12 مم مغطاة بولييثيلينيميني (جزيرة الأمير إدوارد) في الأطباق 24-جيدا في كثافة الخلايا 50,000-60,000/جيدا. فحص كثافة استخدام خلية العد البصريات التباين الدائرة والمرحلة.
- ثقافة الخلايا العصبية لمدة 3 أيام (اليوم في المختبر (DIV) 3) في لوحة 24-جيدا في الحضانة عند 37 درجة مئوية مع شركة 5%2.
- تقييم كوفيرسليبس لمؤشرات الصحة الخلية باستخدام المجهر الخفيفة المنقولة (مثل مرحلة التباين البصريات في تكبير من 10-20 X). التحقق من المؤشرات التالية للصحة الجيدة: هالة تباين واضح مرحلة، نيوريتيس دون هياكل الخرز، ولا سوما تجميع أو تجميع نورت.
2-تعداء
ملاحظة: يشير البروتوكول التالي إلى مزدوج تعداء لآبار 3. ومع ذلك، يعمل البروتوكول بشكل أفضل عندما يتم إعداد كميات كافية للآبار 4.
- إعداد 500 مل من تعداء المخزن المؤقت (274 مم كلوريد الصوديوم، 10 مم بوكل، 1.4 مم نا2هبو4، 15 ملم الجلوكوز، 42 مم حبيس) في قارورة Erlenmeyer.
- حل ز 8.0 من كلوريد الصوديوم و 0.37 ز من بوكل، ز 0.095 غ2هبو4، ز 1.35 الجلوكوز وز 5.0 من هيبيس في 400 مل ماء المقطر في قارورة Erlenmeyer.
- قم بضبط درجة الحموضة إلى 6.95 مع 1 من هيدروكسيد الصوديوم م باستخدام مقياس الأس الهيدروجيني.
- ضبط حجم الصوت مع الماء المقطر إلى 500 مل والتحقق من الرقم الهيدروجيني باستخدام مقياس الأس الهيدروجيني.
- جعل مختبرين 20-30 مل من تعداء المخزن المؤقت مع قيم الأس الهيدروجيني التالية 1 بيبيتينج M هيدروكسيد الصوديوم إلى المخزن المؤقت تعداء: 6.96، 6.97، 6.98، 6.99، 7.00، 7.01, 7.02, 7.03، 7.04، 7.05، 7.06، 7، 07، 7.08، 7.09، 7.11.
ملاحظة: الرقم الهيدروجيني للمخزن المؤقت تعداء أمر حاسم لفعالية تعداء. - لاختبار الذي تعداء المخزن المؤقت يؤدي إلى أكبر عدد ممكن من الخلايا ترانسفيكتيد، اختبار كل قيمة pH من 6.96 7.11. استخدم الأسلوب تعداء الموصوفة في 2.2-2.11 وبلازميد المصادق عليه التعبير عن التجارة والنقل. تحديد عدد الخلايا transfected كل ساترة لكل قيمة pH المخزن المؤقت تعداء لتقييم المخزن المؤقت الذي يعمل الأفضل.
- الكوة المخزن المؤقت مع كفاءة أعلى في أنابيب ميكروسينتريفوجي 2 مل تعداء تجميد وتخزين الأنابيب عند-20 درجة مئوية.
- قبل الحارة المصل انخفاض المتوسط وخلية الثقافة المتوسطة، والماء المقطر إلى 37 درجة مئوية في حمام الماء.
- إعداد مزيج تعداء في أنبوب ميكروسينتريفوجي 1.5 مل. تعمل تحت غطاء الاندفاق الصفحي لضمان ظروف عمل عقيم.
- ميليلتر 7.5 مزيج من كلوريد الكالسيوم م 2 مع 4 ميكروغرام لكل الحمض النووي خالية من الذيفان (مورانج سينابتوفيسين ومجفب/بروتينات فلورية خضراء-روجدي). إضافة الماء تصل إلى إجمالي حجم 60 مل في أنبوب ميكروسينتريفوجي 1.5 مل.
- إضافة 60 مل من تعداء المخزن المؤقت لهذا المزيج. للحصول على أفضل النتائج، إضافة المخزن المؤقت تعداء dropwise بينما تهز الحمض النووي-المزيج بلطف في الدوامة.
- احتضان في درجة حرارة الغرفة (RT) لمدة 20 دقيقة. تجنب تهز الأنبوب الحضانة خلال فترة حضانة المرض عن طريق وضع أنبوب بجوار هود الاندفاق الصفحي.
- تحت غطاء السيارة الاندفاق الصفحي، إزالة مستنبت الخلية ("مشروطة" المتوسط) من الآبار باستخدام بيبيت 1000 مل وتخزينها في حاوية منفصلة في الحاضنات.
- إضافة 500 مل من المصل انخفاض المتوسط لكل بئر. احتضان الخلايا في 37 درجة مئوية و 5% CO2 حتى تنتهي فترة الحضانة 20 دقيقة (الخطوة 2.3.3).
- إضافة 30 مل مزيج تعداء لكل بئر من بيبيتينج عدة قطرات. تجاهل هذه البقايا في الجزء السفلي من الأنبوب.
- بعد أن تم تزويد جميع الآبار بمزيج تعداء، بلطف يهز لوحة 24-جيدا لضمان توزيع مزيج تعداء في الأجل المتوسط.
- احتضان الآبار لمدة 60 دقيقة في 37 درجة مئوية و 5% CO2.
- إزالة وتجاهل هذا المزيج تعداء وغسله ثلاث مرات مع خلية الثقافة المتوسطة. أضف 1 مل مستنبت الخلية لكل بئر واحتضانها لهم لمدة 30 ثانية في الرايت إزالة 750 مل من المتوسطة وإضافة نفس الكمية من متوسطة جديدة. كرر ذلك ثلاث مرات.
ملاحظة: أن الخطوة الغسيل الحاسمة. الحفاظ على الوقت يحتوي كل جيدا لا المتوسطة كحد أدنى (أي. وإزالة واستبدال--بئر) وإضافة المتوسطة الغسل بلطف. - إزالة وتجاهل مستنبت الخلية وإضافة 450 مل من مكيفة المتوسطة-البئر.
- واسمحوا الخلايا العصبية الناضجة في الحضانة عند 37 درجة مئوية و 5% CO2 إلى DIV 10.
3. التحفيز وامتصاص Syt1
ملاحظة: يطبق البروتوكول التالي في الإقبال على الآبار 3. ديبولاريزيشن من أي عدد من الآبار، ضبط المبالغ وفقا لذلك.
- إعداد 50 مل من 10 x depolarization المخزن المؤقت (مم كلوريد الصوديوم، 700 مم بوكل، 10 مم مجكل2، 20 مم كاكل2، الجلوكوز 300 مم، 200 مم حبيس، درجة الحموضة 7.4 من 640) في قارورة Erlenmeyer.
ملاحظة: يمكن الاحتفاظ المخزن المؤقت Depolarization عند 4 درجة مئوية لعدة أسابيع. إذا كان يستخدم أيضا حلاً غير ديبولاريزينج،، تعد من 10 x Tyrode لحل يتكون من 1290 مم كلوريد الصوديوم، 50 مم بوكل، مجكل 10 مم2، 20 مم كاكل2، 300 مم الجلوكوز، 200 ملم حبيس الأس الهيدروجيني 7.4 من أجل مقارنة التحفيز الناجم عن إعادة التدوير بعفوية إعادة التدوير. بعد التخفيف إلى 1 x، أضف 1 ميكرومتر من تيدرودوتاكسين قبل استخدامها لمنع توليد إمكانات العمل.- حل 1.87 غ من كلوريد الصوديوم، غ 2.61 من بوكل، 0.1 غرام من مجكل2-6 ح20، ز 0.15 كاكل2-2 ح2س و 3.0 غ من السكر-1 ح2س وز 2.38 من حبيس في 50 مل ماء المقطر في قارورة Erlenmeyer. قم بضبط درجة الحموضة مع هيدروكسيد الصوديوم والعقيمة تصفية الحل. تمييع في المخزن المؤقت 01:10 في الماء المقطر لتحقيق تركيز 1 x.
- إعداد بارافورمالدهيد 4% (PFA) في برنامج تلفزيوني 1 x (الرقم الهيدروجيني 7.4) للتثبيت بعد التحفيز.
- لمل 500 4% حل منهاج العمل في برنامج تلفزيوني 1 x، ز 20 من بارافورمالدهيد في 450 مل من المقطر H2o.
ملاحظة: تدفئة الحل يمكن الإسراع بحل، لكن الحرارة لا حل ما يزيد على 70 درجة مئوية، كما قد تتفكك منهاج عمل بيجين.
تنبيه: منهاج العمل السامة، ويحتمل أن تكون مسرطنة وأحداثه. ارتداء القفازات عند العمل مع منهاج عمل بيجين، والعمل تحت غطاء الدخان، وتجنب الابتلاع. - السماح لتبرد الحل إلى RT وإضافة 50 مل من 10 x برنامج تلفزيوني حل الأسهم. قم بضبط ال pH إلى 7.4 مع هيدروكسيد الصوديوم/HCl باستخدام مقياس الأس الهيدروجيني.
- لمل 500 4% حل منهاج العمل في برنامج تلفزيوني 1 x، ز 20 من بارافورمالدهيد في 450 مل من المقطر H2o.
- قبل الحارة 600 مل 1 × depolarization المخزن المؤقت و 10 مل من خلية الثقافة المتوسطة إلى 37 درجة مئوية في حمام الماء.
- أضف 1 مل أضداد المضادة Syt1 الماوس (استنساخ 604.2) إلى 1 x depolarization المخزن المؤقت ودوامه لمدة 10 ثوان.
- إزالة وتجاهل مستنبت الخلية من الخلايا. إضافة 200 مل مزيج depolarization الضد لكل خير، واحتضان لمدة 5 دقائق في 37 درجة مئوية و 5% CO2 في الحاضنة.
- إزالة وتجاهل هذا المزيج depolarization-جسم وغسله ثلاث مرات مع خلية الثقافة المتوسطة. أضف 1 مل مستنبت الخلية لكل بئر واحتضان لمدة 30 ثانية في الرايت إزالة 750 مل من المتوسطة وإضافة نفس الكمية من متوسطة جديدة. كرر ثلاث مرات.
- إزالة وتجاهل مستنبت الخلية وإضافة 300 مل 4% منهاج العمل في برنامج تلفزيوني 1 x. احتضان لمدة 20 دقيقة في 4 درجات مئوية.
- غسل ثلاث مرات لمدة 5 دقائق مع برنامج تلفزيوني 1 x.
ملاحظة: يمكن أن يكون مؤقتاً البروتوكول هنا.
4-إيمونوسيتوتشيميستري
- إعداد 50 مل من المخزن المؤقت لحظر.
ملاحظة: حجب المخزن المؤقت يمكن الاحتفاظ في-20 درجة مئوية لعدة أشهر.- حل 2.5 g من السكروز وز 1 من ألبومين المصل البقري (BSA) في 5 مل من 10 x برنامج تلفزيوني حل الأسهم. إضافة 1.5 مل من محلول مخزون مسحوق الغسيل 10%. إثارة الحل حتى تظهر كافة المكونات بشكل صحيح وقد حلت وإضافة المقطر ح2س حتى وصلت إلى وحدة تخزين نهائي من 50 مل. قاسمة الحل وتجميد مختبرين للتخزين.
- تضعف جسم الثانوية، إلى جانب فلوروفوري (الموجهة ضد الأنواع Syt1-جسم الأولية) في 200 مل من المخزن المؤقت حظر في كل بئر في إضعاف 1: 1000.
- إزالة وتجاهل برنامج تلفزيوني 1 x من كل جيد تتضمن ساترة.
- إضافة 200 مل من حجب ميكس جسم المخزن المؤقت لكل بئر واحتضان لمدة 60 دقيقة في الرايت
تنبيه: نظراً لأن الأجسام المضادة الثانوية حساسة للضوء، يجب إجراء كافة الخطوات المضي قدما في الظلام. - بعد الحضانة، غسل الخلايا ثلاث مرات لمدة 5 دقائق مع 1 مل من س 1 برنامج تلفزيوني.
- تضمين كوفيرسليبس على شرائح المجهر مع المتوسطة التضمين.
- إضافة قطره 7 مل من تضمين المتوسطة على شريحة المجهر. إزالة ساترة من لوحة 24-جيدا برفعه مع المحاقن والاستيلاء عليه بالملقط.
تنبيه: الخلايا على سطح ساترة معطوبة بسهولة، حتى الملقط يجب أن يكون التعامل معها بحذر. - تراجع ساترة في الماء المقطر إزالة برنامج تلفزيوني والجافة بعناية قبل لمس حافة واحدة لانسجة لينة.
- الوجه ساترة على تضمين الحبرية المتوسطة، حيث أن السطح تحمل الخلايا يواجه الشريحة المجهر، وبالتالي تضمين الخلايا إلى المتوسطة التضمين.
- إضافة قطره 7 مل من تضمين المتوسطة على شريحة المجهر. إزالة ساترة من لوحة 24-جيدا برفعه مع المحاقن والاستيلاء عليه بالملقط.
- اترك الشرائح لتجف تحت غطاء محرك السيارة ح 1-2 (غطاء لهم لتجنب التعرض للضوء) وتخزينها في مربع شريحة مجهر عند 4 درجة مئوية.
ملاحظة: يمكن أن يكون مؤقتاً البروتوكول هنا.
5-المجهري التحليل
- بعد الجافة كوفيرسليبس، ووضعها تحت المجهر مع الهدف والكاميرا.
- ضبط وقت التعرض لكل قناة بحيث يتم تعريض قليلة بكسل لضمان توزيع الحد الأقصى من قيم رمادية.
ملاحظة: في حين قد تختلف وقت التعرض بين القنوات، ينبغي أن يكون من المستمر لقناة واحدة لضمان إمكانية المقارنة بين كوفيرسليبس. - الحصول على صور متعددة القنوات للمناطق العشر للفائدة (رويس) كل ساترة. تحقق من أن العائد على الاستثمار يحتوي على عمليات محواري من خلية transfected عن طريق فحص بروتينات فلورية خضراء-الأسفار، التي ينبغي أن تكون الشروريه.
6. التحليل الإحصائي
- تصدير الصور كملفات.tif. تحميل الصور إلى OpenView18 بواسطة النقر فوق الملف | تحميل ملف الصورة.
- اختر صورة مورانج سينابتوفيسين كالقناة 1 والصورة روجدي-التجارة والنقل/مجفب كقناة 2 والصورة الفلورية Alexa647 كالقناة 3.
- عتبة رويس.
- انقر فوق تحليل | مساحة المكان أكثر بونكتا. اختيار قيم العتبة و كثافة الدلتا حيث عند التفتيش البصري، هو استبعاد الأسفار منتشر، تاركة فقط الشروريه الإشارات في صورة القناة 1 (يمثلون مورانج سينابتوفيسين الأسفار). الاحتفاظ بنفس الحد الأدنى لجميع الصور.
- نقل رويس هذه القناة المقابلة 2 (الأسفار بروتينات فلورية خضراء-روجدي/مجفب) و 3 (Syt1-الأسفار) لكل منطقة ساترة بواسطة النقر فوق Execute الآن.
ملاحظة: رويس ينبغي إلا يعتبر إذا كانت الخلية transfected مزدوجة. في هذا الأسلوب، الأسفار مورانج والتجارة والنقل ينبغي أن تكون واضحة للعيان. - حفظ البيانات في محرر سجل التحليل بواسطة النقر فوق بيانات السجل.
- فتح محرر سجل تحليل ضمن علامة التبويب Windows ونسخ القيم لكل قناة. لصق القيم لقنوات منفصلة في جدول بيانات.
- تحديد الأسفار متوسط كثافة Syt1-القناة في رويس في كلا الشرطين تعداء (بروتينات فلورية خضراء-روجدي ومجفب).
- تطبيق الاختبارات الإحصائية المناسبة مثل الطالب الاختبار t لتحديد الاختلافات الهامة.
النتائج
نتيجة المتوقعة من هذا النهج هو تحديد حوالي 50 مزدوج transfected الخلايا العصبية الواحدة وساترة في كثافة الخلايا العصبية 50,000 كل بئر. إكسون لكل الخلايا العصبية من المتوقع أن تظهر النقاط الساخنة متعددة من تراكم سينابتوفيسين معلم فلوريسسينتلي، مما يشير إلى مجموعات أوفسفس. وفي مواقع وظيفية presynaptic، كولوكاليزيس إشارة سينابتوفيسين المؤتلف مع الشروريه Syt1 الأسفار. استخدام تعداء مزدوجة، أما بروتينات فلورية خضراء-روجدي كالبروتين للفائدة (الشكل 1) أو مجفب كعنصر التحكم أعرب عن الاشتراك مع المؤتلف سينابتوفيسين.
في هذه التجربة، نحن نحلل SV إعادة التدوير في مواقع بريسينابتيك في الخلايا العصبية معربا عن التجارة والنقل-روجدي أو مجفب. إذا كان التحكم البروتين، مجفب، البلوتينيوم توزع في جميع أنحاء الخلية كلها، ولكن تأثيره في مواقع متشابك لا يزال يحتاج إلى دراسة، ثم من الضروري أن يشترك ترانسفيكت بروتين ثاني الذي أثري بريسينابتيكالي، فلوريسسينتلي معلم سينابتوفيسين.
كما هو موضح سابقا، الخلايا الخضوع للإفراج عن الإرسال الناجم عن ديبولاريزيشن. نتيجة لذلك تناول الاشتباكات العصبية الوظيفية أضداد Syt1 إضافة إلى المتوسط. بعد إيمونولابيلينج Syt1 جسم بجسم ثانوي مسمى فلوريسسينتلي، هو أخيرا كمياً مدى الإقبال على Syt1 باستخدام إيمونوسيجنال (الشكل 2).
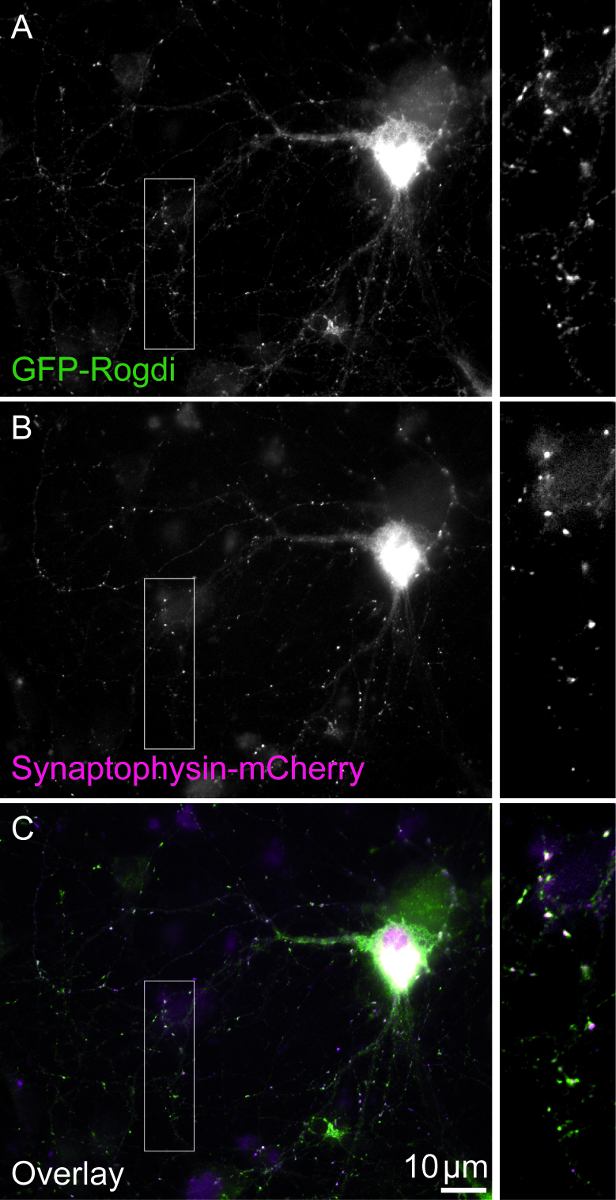
رقم 1. الخلية مزدوجة transfected- يظهر حقل الرؤية خلية transfected مزدوجة معربا عن التجارة والنقل-روجدي (A) وسينابتوفيسين-مشري (ب). سينابتوفيسين بروتين حويصلة متشابك وفيرة. يمكن استخدام البديل المؤتلف لوسم boutons متشابك. يشبه نمط التعريب للتجارة والنقل-روجدي Synaptophysin-mCherry (C). تغيير حجم أشرطة = 10 ميكرومترات. وتظهر مربعات 2.5 X التكبير. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

رقم 2. بروتينات فلورية خضراء-روجدي في الاشتباكات العصبية الوظيفية. يعيش Syt1 امتصاص أنجز في الخلايا transfected مزدوجة إذ تعرب عن مجفب (أخضر) وسينابتوفيسين-مورانجي (الأحمر؛ أما عاد) أو بروتينات فلورية خضراء-روجدي (الأخضر) وسينابتوفيسين-مورانج (الأحمر؛ آه). أجرى Syt1 جسم الامتصاص باستخدام جسم [مونوكلونل] ماوس الموجهة ضد المجال لومينال من Syt1. بعد التثبيت منهاج عمل بيجين، كانت ملطخة الخلايا بجسم الأرنب المضادة-التجارة والنقل. الأجسام المضادة الثانوية (488 أليكسا أرنب المضادة والمناهضة الماوس 647 أليكسا) أضيفت إلى الكشف عن بروتينات فلورية خضراء أو بروتينات فلورية خضراء-روجدي و Syt1، على التوالي. أوتوفلوريسسينسي سينابتوفيسين-مورانج استخدمت للكشف عن المحطات presynaptic (ب وو). الشروريه Syt1 الفلورة يشير إلى مواقع حويصلة إعادة التدوير (أزرق؛ جيم وزاي). لاحظ أن معظم نقاط الاشتباك العصبي المسمى Syt1 المترجمة إلى غير transfected الخلايا العصبية. بروتينات فلورية خضراء-روجدي كان هدفا للاشتباكات العصبية نشطة ولم يتغير حويصلة متشابك إعادة التدوير (ط). وأجريت تجارب الثقافة المستقلة 3 (N = 3). واستخدمت كوفيرسليبس 3 على الأقل من كل ثقافة (ما مجموعة 10) للتحليل. أخيرا، تم تحليل المجالات 3 كل ساترة (ن = 30). Student´s اختبار t وأظهرت لا يوجد فرق كبير. تغيير حجم أشرطة = 10 ميكرومترات. أشرطة الخطأ تمثل الخطأ المعياري للوسط (S.E.M.). "نوفاسكوتيا" يشير إلى أي أهمية. وقد تم تعديل هذا الرقم من ريمان et al. 9 الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
Discussion
وهناك ثلاثة فحوصات استخدامها بشكل روتيني لدراسة متشابك حويصلة (SV) إعادة التدوير. الأول والثاني وتشمل الاستخدام) ستيريل الفلورية الأصباغ مثل FM1-43 (والتي تدرج في الأغشية ويتم تناولها في العضيات أثناء الالتقام، وتم إصدارها بعد الرقابة)؛ وب) فلوريسسينتلي معلم المؤتلف البروتينات SV (التي، عند أوفيريكسبريشن، بإدراج إليه إعادة التدوير البروتينية). إذا كان تغيير fluorophores المرفقة بها الأسفار اعتماداً على درجة الحموضة، يمكن استخدامها لرصد التغيرات بين الداخلية SV الحمضية والرقم الهيدروجيني للوسط خارج الخلية. وتسمى البروتينات المؤتلف معلم مع متغير حساسة لدرجة الحموضة من التجارة والنقل فلورنس. فحوصات هما ناقش سواء كانت واردة سابقا19،20، وايجابيات وسلبيات كل منها تم أيضا استعراض21.
هنا، نحن وصف ثالث، طريقة راسخة4،5،،من67،9،14. لاختبار إعادة التدوير SV، علينا الاستفادة من حقيقة أن المجال لومينال البروتين المرتبط حويصلة سينابتوتاجمين-1 (Syt1) يصبح عرضه لسطح الخلية على الرقابة. أولاً، يمكننا إضافة جسم مضاد ضد المجال لومينال إلى متوسط الثقافة، التي يتم تناولها ثم قبل حويصلة أثناء إعادة التدوير SV. تصور هذا الإقبال على جسم وكمياً الفلورة. وبدلاً من ذلك، يمكن استخدام جسم Syt1 مسمى مباشرة. يمكن أن تكون التسمية مستقلة عن درجة الحموضة، الإبلاغ عن التعريب Syt1-جسم داخل وعلى السطح الخارجي ل SVs، أو تعتمد على درجة الحموضة، الإبلاغ عن التعريب استناداً إلى التغييرات الأسفار. كما يصف لنا الجمع بين هذا التحليل SV إعادة التدوير مع مزدوجة تعداء الخلايا العصبية مثقف لاختبار ما إذا كان بروتين الفائدة، التجارة والنقل-روجدي، الأهداف الوظيفية synapses، ويؤثر على إعادة تدوير SV. بروتينات فلورية خضراء-روجدي محدد لهذا النهج؛ ومع ذلك، يمكن معالجة نفس الأسئلة للبروتين أي اهتمام.
قدم لأول مرة في عام 1992 لرصد إعادة التدوير التلقائي ل SVs4 هذه المقايسة ووضعت المزيد من نفس المجموعة لرصد SV مقولة إعادة تدوير12. التجارب التي تقوم بها المنشأة أن امتصاص Syt1 حساس لاعصاب كلوستريديال، التي تمنع الرقابة SV12. كما أظهرت أن التحفيز للثقافات التي depolarization عند 37 درجة مئوية ويعزز الاستيعاب الداخلي للأجسام المضادة Syt1 مقابل 1) الثقافات التي يتم الاحتفاظ بها على الجليد، مما يمنع معظم الالتقام، وإلى 2) الثقافات المحتضنة في 37 درجة مئوية دون التحفيز، والذي يسمح بإعادة تدوير عفوية ولكن لا تثير إعادة التدوير12،22. سهولة مقارنة المقايسة SV إعادة التدوير بين هذين الشرطين، كما هو الحال مع أو بدون جزيء من الفائدة. على وجه الخصوص، يركز هذا البروتوكول على مقارنة امتصاص جسم Syt1 في الوجود مقابل غياب بروتين overexpressed معينة. ويمكن توسيع البروتوكول إذا كانت المساهمة النسبية لسطح ملزم والعفوية إعادة التدوير وإعادة تدوير مقولة بحاجة إلى تقييم. على سبيل المثال، تفرخ الخلايا العصبية على الجليد بدون تحفيز يمنع الالتقام، الكشف عن أي الربط السطحي لجسم Syt1. حضانة الخلايا العصبية في 37 درجة مئوية في حل القاعدية مع تيدرودوتاكسين يمنع نشر إمكانيات العمل، الكشف عن أي إعادة التدوير التلقائي. وهكذا، تحضين الخلايا العصبية في 37 درجة مئوية تحت تحفيز الظروف يمكن كشف مدى SV مقولة إعادة التدوير.
خلايا حية حساسة للظروف الفسيولوجية المثالية؛ ولذلك، ينبغي دائماً اختبار الصيانة وتعداء depolarization المخازن المؤقتة للمعلمات الفسيولوجية بما في ذلك درجة الحموضة ودرجة الحرارة. بينما يمكن تمرير depolarization المخازن المؤقتة من خلال مرشحات عقيمة بعد أن تم تعديل درجة الحموضة، مخازن تعداء حساسة لتصفية العقيمة. ولذلك، نحن ضبط الأس الهيدروجيني لها وإبقائها مجمدة حتى استخدام وأنها تدور في الطرد مركزي أعلى الجدول بيليه أي البكتيريا. تعداء، أنه أمر حيوي لخلط المخزن المؤقت الكافية لضمان رابطة بلازميد مع بلورات فوسفات الكالسيوم. فوسفات الكالسيوم تعداء يعمل بشكل أفضل في اليوم في المختبر (DIV) 2-4. نحن نستخدم كلمات سينابتوفيسين، بروتين SV transmembrane، كعلامة لتحديد محطات بريسينابتيك في الخلايا العصبية ترانسفيكتيد. يمكن أيضا استخدام إصدارات البروتينات SV الأخرى مثل SV2، سينابسين، والرقعة/سينابتوبريفين أو الجزيئات النشطة في المنطقة مثل عزف، ريم، Munc13-1، ويلقي كلمات.
مشري ومورانج تنبعث منها ومضان أحمر. على الرغم من أن متشيري أكثر إشراقا من mOrange، أنها أكبر الانبعاثات عند أطوال موجية طويلة من مورانجي. ولذلك، لتصوير fluorescence ثلاثية مع بروتينات فلورية خضراء، وصبغة حمراء، وصبغ تلويثاً في حدود 700 نانومتر، مورانج خيار أفضل من مشري. مشري للأسفار مزدوجة مع التجارة والنقل، وصبغة حمراء، قد تكون مواتية حيث أنها صبغة أكثر إشراقا. لضمان تعداء متفرق، ينبغي أن لا تكون المحتضنة مزيج تعداء لمدة أطول من 60 دقيقة. من المهم أيضا أن الحضانة في المخزن مؤقت ديبولاريزينج هو طول الوقت لضمان الرقابة حويصلات كل حق. ومع ذلك، يجب تجنب التعرض لمدة طويلة للمخزن المؤقت ديبولاريزينج. أثناء الحصول على الصور، كما أنها ضرورية لتطبيق نفس التعرض مرات وكثافة الضوء لضمان القياس المقارنة بين مجموعات مختلفة من التجارب.
وأخيراً، يتضمن لدينا بروتوكول أثناء تحليل الصور، عدة اعتبارات. لمنطقة واحدة لمصلحة عرض المؤتلف سينابتوفيسين بونكتا، يتم تعيين العتبة المنخفضة الكثافة حيث تستبعد fluorescence منتشر. وبعد ذلك، يتم اختبار هذه العتبة في مجالات أخرى وكوفيرسليبس لمراقبة مماثلة إدراج إشارات الشروريه والاستبعاد من الأسفار منتشر. بمجرد التعرف عتبة مناسبة، يتم تطبيقه على كل الصور، تنتج المناطق الشروريه للفائدة (رويس) في قناة سينابتوفيسين مع متشيري أو مورانجي (معلم) المؤتلف. وأخيراً، يتم تحديد كثافة Syt1 رويس9.
نهجنا هو الأمثل تعداء متفرق. نحن نحلل الدالة بريسينابتيك في وضع معقد حيث يوجد SV إعادة التدوير في محاور عصبية transfected الخلايا العصبية محاطة بالخلايا العصبية أونترانسفيكتيد. في هذا التشكيل، مزدوج-تعداء يسمح لنا بالتعامل مع وظيفة الخلايا العصبية وموقع المحطات presynaptic من transfected الخلايا العصبية. Transfected الخلايا العصبية بريسينابتيك أن الاتصال بالخلايا العصبية بوستسينابتيك أونترانسفيكتيد عامل مهم في تقييم آثار خلية بريسينابتيك على إعادة تدوير SV. يمكن أيضا تكييف الإعداد لاختبار أم لا يسبب تلاعب بوستسينابتيك presynaptic التغييرات بسهولة. في هذه الحالة، سيتم ترجمة متفرق تعداء الخلايا العصبية مع بروتين الذي يستهدف مواقع بوستسينابتيك بوستسينابتيك مواقع transfected الخلايا العصبية، ويمكن تحديد امتصاص Syt1 في بوتونس متشابك من الخلايا العصبية أونترانسفيكتيد.
عندما تعداء متفرق ليس ضروريا، يمكن تطبيق البروتوكولات تعداء مختلفة. على سبيل المثال، يستتبع تعداء مع ليبوفيكتاميني على الدرجة 7-8 النتائج في معدلات تعداء أعلى، ولكن أيضا أقوى تعبير في كل الخلية transfected9. وعلاوة على ذلك، يمكن أن يؤدي توصيل الفيروسية في التعبير في ما يقرب من 100 ٪ من الخلايا العصبية مثقف14،،من2324. في تجارب تهدف إلى رصد SV إعادة التدوير، يمكن أن يؤديها لبروتين وحيد تعداء أو مستبعدة تماما. على سبيل المثال، عند إعادة تدوير متشابك عموما هو مقارنة بين الخلايا العصبية من wildtype والكائنات المعدلة وراثيا الفئران، تسمية الخلايا العصبية الفردية من تعداء غير ضروري. بالإضافة إلى ذلك، يتيح هذا إيمونولابيلينج بروتينات الذاتية. إذا فشل تعداء، من المهم اختبار تعداء المخزن المؤقت مع بلازميد مصادق عليه أو استخدام المخزن مؤقت مع الرقم الهيدروجيني مختلفة (انظر إعداد تعداء المخزن المؤقت). استخدام الذيفان الحرة الحمض النووي الاستعدادات أيضا يبدو حاسما. استيعاب Immunostaining Syt1 الأجسام المضادة تعمل في عينات كل منهاج عمل بيجين--ثابت وثابتة من الميثانول. كما تجدر الإشارة إلى أن أوتوفلوريسسينسي التجارة والنقل، وطلب تقديم العروض يتم فقدان بعد التثبيت الميثانول. إذا بروتينات فلورية خضراء أو طلب تقديم العروض بحاجة إلى أن تكون مترجمة في خلايا الميثانول--الثابتة، يجب أن تكون هذه البروتينات إيمونولابيليد. إذا فشل في امتصاص Syt1، ديبولاريزيشن الوقت وتركيز ك+ في المخزن المؤقت depolarization يجب تغيير تبعاً لذلك. تم نشر العديد من بروتوكول الاختلافات، مع depolarization مرات تتراوح بين 90 s25 إلى 60 دقيقة12، وبتركيزات ك+ من 45 ملم، 50 ملم، 70، و 110 ملم6،25،26 ،27. عندما يجب أن تمنع نشاط متكرر، يمكن أيضا إضافة محصرات مستقبلات الغلوتامات أثناء ديبولاريزيشن. أخيرا، بينما ارتفاع ك+ ديبولاريزيشن يعتقد أن حافز أقوى، إمكانات العمل يمكن أن يستحث SV إعادة التدوير عن طريق المنبهات الفسيولوجية أكثر22،28. قد تحدث اختلافات في كفاءة امتصاص جسم Syt1 في الثقافات الجرذ والفأر. في أسلوبنا، استنساخ Syt1 مكافحة الماوس [مونوكلونل] 604.2 (RRID:AB_993036) تنتج تلطيخ أقوى في الثقافات الفئران من ثقافات الماوس، بينما تنتج الأجسام المضادة Syt1 أرنب [بولكلونل] (RRID:AB_11042457) تلطيخ أقوى في الثقافات الماوس، ولكن ترد أدناه مناقشة عدة مذكرات من الحذر.
ينبغي النظر في محاذير عدة فيما يتعلق باستخدام الأجسام المضادة سينابتوتاجمين المضادة لامتصاص إلى SVs. أولاً، جليكوسيليشن ن من الهليونين 24 من Syt1 يعزز امتصاص البروتين29،30اندوسيتوتيك. الهليونين 24 جزء من المجال لومينال من Syt1. الفأر والارنب الأجسام المضادة التي نستخدمها موجهة ضد الأحماض الأمينية 1-12 و 1-8، على التوالي، من Syt1. بينما بهم [ابيتوبس] لا تتداخل مع موقع جليكوسيليشن ن، عائق الفراغية، أو على العكس من ذلك، تحريض من امتصاص جسم ملزم لا يمكن استبعادها. طفرة موقع جليكوسيلاتيون ن في Syt1 لا يغير الحركية الالتقام واستهداف Syt1 إلى SVs. أنه يزيد من جزء صغير Syt1 المتبقية على سطح الغشاء الخارجي البلازما عند الالتقام هو الناجم عن ضعف المحفزات. عندما يتم تطبيق حوافز قوية، مثل ارتفاع ك+ ديبولاريزيشن،، يلاحظ أي انخفاض في امتصاص Syt130. عموما، إذا تدخلت الأجسام المضادة مع موقع جليكوسيليشن ن على نحو ما أنهم قد يؤدي إلى تغيير في الالتقام SV مقارنة بظروف خالية من الأجسام المضادة، ولكن هذا التغيير يجب أن تكون مماثلة للتجربة (وفي حالتنا overexpression من بروتينات فلورية خضراء-روجدي) و عنصر التحكم (في حالتنا التعبير عن التجارة والنقل). بالإضافة إلى ذلك، قد تكون [بولكلونل] أجسام أكثر احتمالاً للحث على المشاكل الفراغية وكروسلينكينج من الأجسام المضادة، لأن ربط عدد نسخ أكبر من الأجسام المضادة بيفرتون. أننا لا نعلم من دراسات منهجية المقارنة بين الأضداد المتاحة مع بعضها البعض؛ ومع ذلك، تناولت بعض الدراسات في صحة بعض الأجسام المضادة. على سبيل المثال، عندما تم سبر SV حركية إعادة التدوير باستخدام الماوس [مونوكلونل] جسم Syt1 مكافحة استنساخ 604.2 والتغييرات سينابتوفلورين-الأسفار في مقارنة مباشرة، تم الحصول على نتائج مماثلة، التحقق من صحة استخدام هذه الأجسام المضادة28. تحميل SVs مع أرنب [بولكلونل] أجسام Syt1 وتسجيل انتقال متشابك اليكتروفيسيولوجيكالي كشفت أن الاشتباكات العصبية تحميل خفضت انتقال متشابك بطريقة تذكر بطفرات خسارة للدالة Syt1. لذلك، تؤثر هذه [بولكلونل] أجسام انتقال متشابك. وكشفت الإقبال الفعلي كل عفوية وأحدثت إعادة التدوير، مما يوحي بأن جسم [بولكلونل] مناسبة لمراقبة جولة واحدة من إعادة تدوير SV، ولكن ينبغي توخي الحذر عند تفسير النتائج بعد الأخذ بهذه الأجسام المضادة31.
ثلاثة فحوصات تستخدم بشكل روتيني لدراسة إعادة التدوير SV، التي تشمل وضع العلامات الغشاء مع ستيريل الأصباغ، overexpression فلورنس، وامتصاص الأجسام المضادة Syt1 القيام بها هنا. يمكن استخدام جميع الاختبارات الثلاثة لتحديد الساقين اندوسيتوتيك واكسوسيتوتيك لإعادة التدوير SV. بينما جميع الاختبارات الثلاثة لها فوائد قوية، كل له أيضا تحذير مبدأ. صبغات FM تسمية سطح الخلية بأكملها ويتم تناولها داخل الخلية مع جميع الأغشية إعادة التدوير. يجب أن يكون عرض فلورنس أوفيريكسبريشن. تسمية Syt1-أضداد البروتين الذاتية، ولكن قد يؤثر على بعض الأجسام المضادة مهمتها بموجب شروط معينة. ومع ذلك، كل التحذير يمكن معالجتها على نحو ملائم21.
وعموما، عملت مقايسة الامتصاص جسم Syt1 مختلف الأغراض. أولاً، أنها استخدمت لتسمية بشكل انتقائي SVs تمر بعفوية أو مقولة التدوير على التوالي28،31،،من3233. وثانيا، أنه كان يستخدم لتحديد تأثير المخدرات أو البروتين على مدى SV إعادة التدوير؛ على سبيل المثال، لإظهار أن يعزز بدنف SV كل عفوية وأحدثت إعادة تدوير6. ثالثا، استخدامه لتحديد العدد من نقاط الاشتباك العصبي مع إعادة التدوير SVs كنسبة مئوية من مجموع عدد الاشتباكات العصبية محددة شكلياً34،35. هذا وكشفت أن overexpressing جزيء التصاق الخلايا بوستسينابتيك نيوروليجين-1 زيادة النسبة المئوية لنقاط الاشتباك العصبي مع إعادة التدوير SVs25 وأن الحد من التعبير عن مستقبلات الغلوتامات امبا-نوع يقلل نسبة نهايات مع إعادة التدوير SVs، زيادة النسبة المئوية لنهايات صامتة بريسينابتيكالي36. بالإضافة إلى ذلك، استخدمت في التحليل لتحليل حركة المسمى SVs27 ولتحديد توطين Syt1 باستخدام نانوسكوبي13،22،33. وأخيراً، يزال يستخدم هذا الأسلوب لاختبار أم لا تعريب بعض البروتينات إلى نهايات الفنية9. يمكن أيضا استخدام جسم Syt1 لدراسات طويلة الأجل، حيث لا يزال الضد في الخلايا العصبية للأيام التالية لاستيعاب37. وهذا يمكن أن تقترن جولة ثانية من الإقبال على استخدام جسم Syt1 مسمى بشكل منفصل أو جسم مضاد ضد المجال لومينال بروتين SV مختلفة. يسمح هذا الاختبار الذي SVs المعاد تدويرها في البداية والذي سلة في نهاية التجربة. سيكون من المثير للاهتمام أن التكيف مع هذا التحليل إلى أكثر نظم نموذجية سليمة، مثل شرائح الحادة والثقافات شريحة أورجانوتيبيك. من حيث المبدأ، مقايسة الامتصاص يسمح بمقارنة نسيج wildtype ووراثيا تعديل الحيوانات أو قد تكون جنبا إلى جنب مع التسليم الفيروسية أو الهلاميات، أي.، "بندقية جينات"، إلى التعامل مع التعبير البروتين في هذه الأنظمة النموذجية. في مثل هذه النظم، يمكن دراسة تأثير بعض الاضطرابات في الآلات presynaptic، ترصدها مقايسة الامتصاص، وديناميات الشبكة في وقت واحد.
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
ونحن نشكر ارمغارد فايس لخبراء المساعدة التقنية. وأيد هذا العمل DFG عبر الكتلة التميز للفحص المجهري في نطاق نانومتر والفيزيولوجيا الجزيئية للمخ (كنمبب، B1-7، إلى T.D.).
Materials
| Name | Company | Catalog Number | Comments |
| B27 | Gibco | 17504-044 | |
| BSA | Sigma | A7030-50g | |
| CaCl2 | Sigma-Aldrich | C3306-100g | |
| CoolSNAP HQ2 | Photometrics | ||
| dH2O | Invitrogen | 15230 | |
| DABCO | Merck | 8.03456.0100 | |
| donkey anti mouse Alexa 647 | Jackson-Immunoresearch | 715605151 | antibody |
| DMEM | Invitrogen | 41966 | |
| DPBS | Gibco | 14190 | |
| Eppendorf tubes | Eppendorf | 30120094 | |
| multiwell 24 well | Fisher Scientific | 087721H | |
| tube (50 mL) | Greiner Bio-One | 227261 | |
| FBS superior | BiochromAG | S0615 | |
| Glucose | Merck | 1,083,421,000 | |
| HBSS | Invitrogen | 14170 | |
| HEPES | Sigma | H4034-500g | |
| Hera Cell 150 (Inkubator) | ThermoElectron Corporation | ||
| KCL | Sigma-Aldrich | P9541-500g | |
| L-Glutamin | Gibco | 25030 | |
| MgCl2 | Honeywell | M0250-500g | |
| microscope slides | Fisher Scientific | 10144633CF | |
| Microsoft Excel | Microsoft | ||
| Mowiol4-88 | Calbiochem | 475904 | |
| NaCl | BioFroxx | 1394KG001 | |
| Na2HPO4 | BioFroxx | 5155KG001 | |
| Neurobasal | Invitrogen | 21103049 | |
| OpenView Experiment Analysis Application | Free software, see comments | written by Noam E. Ziv, Technion – Israel Institute of Technology, Haifa, Israel | |
| PBS (10x) | Roche | 11666789001 | |
| Optimem | Invitrogen | 31985 | |
| Penstrep | Gibco | 15140-122 | |
| PFA | Sigma | P6148-1kg | |
| safety hood | ThermoElectron | Serial No. 40649111 | |
| Sucrose | neoFroxx | 1104kg001 | |
| Synaptotagmin1 | Synaptic Systems | 105311 | mouse monoclonal; clone 604.2 |
| Triton X-100 | Merck | 1,086,031,000 | |
| Vortex Genius 3 | IKA | 3340001 | |
| Water bath | GFL | 1004 | |
| Zeiss Observer. Z1 | Zeiss |
References
- Koh, T., Bellen, H. J. Synaptotagmin I, a Ca2+ sensor for neurotransmitter release. Trends in Neurosciences. 26, 413-422 (2003).
- Chapman, E. R. How Does Synaptotagmin Trigger Neurotransmitter Release. Annual Review of Biochemistry. 77, 615-641 (2008).
- Perin, M. S., et al. Structural and Functional Conservation of Synaptotagmin (p65) in Drosophila and Humans. Journal of Biological Chemistry. 266, 615-622 (1991).
- Matteoli, M., Takei, K., Perrin, M. S., Südhof, T. C., De Camilli, P. Exo-endocytotic Recycling of Synaptic Vesicles in Developing Processes of Cultured Hippocampal Neurons. Journal of Cell Biology. 117, 849-861 (1992).
- Ko, J., et al. Neuroligin-1 performs neurexin-dependent and neurexin-independent functions in synapse validation. The EMBO Journal. 28, 3244-3255 (2009).
- Shinoda, Y., et al. BDNF enhances spontaneous and activity-dependent neurotransmitter release at excitatory terminals but not at inhibitory terminals in hippocampal neurons. Frontiers in Synaptic Neuroscience. 6, 27 (2014).
- Ivanova, D., et al. Synaptic activity controls localization and function of CtBP 1 via binding to Bassoon and Piccolo. The EMBO Journal. 34, 1056-1077 (2015).
- Crawford, D. C., Ramirez, D. M. O., Trauterman, B., Monteggia, L. M., Kavalali, E. T. Selective molecular impairment of spontaneous neurotransmission modulates synaptic efficacy. Nature Communications. 8, 1-14 (2017).
- Riemann, D., Wallrafen, R., Dresbach, T. The Kohlschütter-Tönz syndrome associated gene Rogdi encodes a novel presynaptic protein. Scientific Reports. 7, (2017).
- Kim, M., et al. Rogdi Defines GABAergic Control of a Wake-promoting Dopaminergic Pathway to Sustain Sleep in Drosophila. Scientific Reports. 7, 1-14 (2017).
- Schossig, A., Wolf, N. I., Kapferer, I., Kohlschütter, A., Zschocke, J. Epileptic encephalopathy and amelogenesis imperfecta: Kohlschütter-Tönz syndrome. Euopean Journal of Medical Genetics. 55, 319-322 (2012).
- Kraszewski, K., et al. Synaptic Vesicle Dynamics in Living Cultured Hippocampal Neurons Visualized with CY3-Conjugated Antibodies Directed against the Lumenal Domain of Synaptotagmin. Journal of Neuroscience. 15, 4328-4342 (1995).
- Willig, K. I., Rizzoli, S. O., Westphal, V., Jahn, R., Hell, S. W. STED microscopy reveals that synaptotagmin remains clustered after synaptic vesicle exocytosis. Nature. 440, 935-939 (2006).
- Petkova, A., Goedecke, N., Korte, M., Dresbach, T. Neuroligins mediate presynaptic maturation through brain-derived neurotrophic factor signaling. bioRxiv. , 262246 (2018).
- Fuchs, C., et al. GABA(A) receptors can initiate the formation of functional inhibitory GABAergic synapses. European Journal of Neuroscience. 38, 3146-3158 (2013).
- Dresbach, T., et al. Functional regions of the presynaptic cytomatrix protein Bassoon: Significance for synaptic targeting and cytomatrix anchoring. Molecular and Cellular Neuroscience. 23, 279-291 (2003).
- Seibenhener, M. L., Wooten, M. W. Isolation and Culture of Hippocampal Neurons from Prenatal Mice. Journal of Visualized Experiments. (65), 4-9 (2012).
- Tsuriel, S., et al. Local sharing as a predominant determinant of synaptic matrix molecular dynamics. PLOS Biology. 4, 1572-1587 (2006).
- Iwabuchi, S., Kakazu, Y., Koh, J., Goodman, K. M., Harata, N. C. Examination of Synaptic Vesicle Recycling Using FM Dyes During Evoked, Spontaneous, and Miniature Synaptic Activities. Journal of Visualized Experiments. (85), 1-10 (2014).
- Villarreal, S., Lee, S. H., Wu, L. Measuring Synaptic Vesicle Endocytosis in Cultured Hippocampal Neurons. Journal of Visualized Experiments. (127), 1-8 (2017).
- Kavalali, E. T., Jorgensen, E. M. Visualizing presynaptic function. Nature Neuroscience. 17, 10-16 (2014).
- Opazo, F., et al. Limited Intermixing of Synaptic Vesicle Components upon Vesicle Recycling. Traffic. 11, 800-812 (2010).
- Wollebo, H. S., Woldemichaele, B., White, M. K. Lentiviral transduction of neuronal cells. Methods in Molecular Biology. 1078, 141-146 (2013).
- Yang, X., Kaeser-Woo, Y. J., Pang, Z. P., Xu, W., Südhof, T. C. Complexin Clamps Asynchronous Release by Blocking a Secondary Ca2+ Sensor via Its Accessory α Helix. Neuron. 68, 907-920 (2010).
- Wittenmayer, N., et al. Postsynaptic Neuroligin1 regulates presynaptic maturation. Proceedings of the National Academy of Sciences of the United States of America. 106, 13564-13569 (2009).
- Lazarevic, V., Schone, C., Heine, M., Gundelfinger, E. D., Fejtova, A. Extensive Remodeling of the Presynaptic Cytomatrix upon Homeostatic Adaptation to Network Activity Silencing. Journal of Neuroscience. 31, 10189-10200 (2011).
- Kraszewski, K., Daniell, L., Mundigl, O., De Camilli, P. Mobility of synaptic vesicles in nerve endings monitored by recovery from photobleaching of synaptic vesicle-associated fluorescence. Journal of Neuroscience. 16, 5905-5913 (1996).
- Hua, Y., Sinha, R., Martineau, M., Kahms, M., Klingauf, J. A common origin of synaptic vesicles undergoing evoked and spontaneous fusion. Nature Neuroscience. 13, 1451-1453 (2010).
- Han, W., et al. N-Glycosylation Is Essential for Vesicular Targeting of Synaptotagmin 1. Neuron. 41, 85-99 (2004).
- Kwon, S. E., Chapman, E. R. Glycosylation is dispensable for sorting of synaptotagmin 1 but is critical for targeting of SV2 and synaptophysin to recycling synaptic vesicles. Journal of Biological Chemistry. 287, 35658-35668 (2012).
- Afuwape, O. A. T., Wasser, C. R., Schikorski, T., Kavalali, E. T. Synaptic vesicle pool-specific modification of neurotransmitter release by intravesicular free radical generation. The Journal of Physiology. 595, 1223-1238 (2017).
- Sara, Y., Virmani, T., Deák, F., Liu, X., Kavalali, E. T. An isolated pool of vesicles recycles at rest and drives spontaneous neurotransmission. Neuron. 45, 563-573 (2005).
- Wilhelm, B. G., Groemer, T. W., Rizzoli, S. O. The same synaptic vesicles drive active and spontaneous release. Nature Neuroscience. 13, 1454-1456 (2010).
- Bacci, A., et al. Chronic blockade of glutamate receptors enhances presynaptic release and downregulates the interaction between synaptophysin-synaptobrevin-vesicle-associated membrane protein 2. Journal of Neuroscience. 21, 6588-6596 (2001).
- Piccoli, G., et al. LRRK2 Controls Synaptic Vesicle Storage and Mobilization within the Recycling Pool. Journal of Neuroscience. 31, 2225-2237 (2011).
- Tracy, T. E., Yan, J. J., Chen, L. Acute knockdown of AMPA receptors reveals a trans-synaptic signal for presynaptic maturation. The EMBO Journal. 30, 1577-1592 (2011).
- Truckenbrdot, S., Viplav, A., Jaehne, S., Vogts, A., Denker, A., Wildhagen, H., Fornasiero, E. F., Rizzoli, S. O. Ageing synaptic vesicles are inactivated by contamination with SNAP25. bioRxiv. , 172239 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved