Method Article
Um ensaio óptico para vesícula sináptica reciclagem nos neurônios cultivados superexpressão de proteínas pré-sináptica
Neste Artigo
Resumo
Descrevemos um ensaio óptico para vesícula sináptica (SV) reciclagem em neurônios cultivados. Combinar este protocolo com duplo transfeccao de expressar uma proteína de interesse e o marcador pré-sináptica nos permite localizar sites pré-sináptica, sua vesícula sináptica, capacidade de reciclagem e determinar o papel da proteína de interesse.
Resumo
Nos terminais de nervo pré-sináptica ativo, vesículas sinápticas passam por ciclos de exo e endocitose. Durante a reciclagem, os domínios luminal de proteínas transmembrana SV tornam-se expostos na superfície da célula. Uma destas proteínas é Synaptotagmin-1 (Syt1). Um anticorpo dirigido contra o domínio luminal de Syt1, uma vez adicionado ao meio de cultura, é retomado durante o ciclo exo-endocytotic. Esta absorção é proporcional à quantidade de SV reciclagem e pode ser quantificada através de imunofluorescência. Aqui, nós combinamos Syt1 absorção de anticorpos com duplo transfeccao de neurônios hippocampal culturas. Isso permite que nós (1) localizar sites pré-sináptica baseados na expressão do marcador pré-sináptica recombinante Sinaptofisina, (2) determinar sua funcionalidade usando Syt1 absorção e (3) caracterizar a segmentação e os efeitos de uma proteína de interesse, GFP-Rogdi.
Introdução
Estudando a vesícula sináptica reciclagem é importante em determinar como alteram Propriedades pré-sináptica, durante a plasticidade sináptica, ou em resposta a perturbação da função sináptica. Estudando Synaptotagmin-1 (Syt1) captação de anticorpo fornece um método para medir a quantidade de reciclagem de SV. Syt1 é uma proteína de SV-associado que atua como um sensor de Ca2 + e é necessária para os liberação do neurotransmissor1,2. É uma proteína transmembranar com um domínio citoplasmático do C-terminal fora o SV e um domínio N-terminal do luminal dentro do SV3. Durante a exocitose, o domínio luminal de Syt1 torna-se exposto ao meio externo. Para este meio externo, acrescentamos anticorpos dirigidos contra o domínio citoplasmático, que se torna interiorizado durante a endocitose. Estes anticorpos podem ser que também pre-conjugados com fluorophores ou immunostained com anticorpos secundários4,5,6,7. A intensidade da fluorescência do immunosignal resultante é proporcional à quantidade de reciclagem de SV. Esta abordagem pode ser usada para determinar o SV constitutiva e induzida por despolarização reciclagem6,8.
Ensaios de absorção de Syt1 podem ser realizados após a transferência de genes mediada por vírus para praticamente todas as células no prato ou transfection esparso de um pequeno número de células. Nosso método combina o ensaio com esparso transfection duplo de neurônios hippocampal preliminares usando o fosfato de cálcio9. Nós usamos uma proteína recombinante marcador conhecida a acumular-se no presynapses, Sinaptofisina fluorescente etiquetada, localizar terminais pré-sináptica e overexpress nossa proteína de interesse, Rogdi. Isto permite-nos testar ou não Rogdi alvos funcionais sinapses e afeta SV reciclagem. O gene que codifica a Rogdi foi originalmente identificado em uma tela para mutantes de Drosophila, caracterizados pela memória prejudicada10. Em humanos, mutações no gene Rogdi causam uma doença rara e devastadora, chamada síndrome de Kohlschütter-Tönz. Os pacientes sofrem de malformações do esmalte dentário e pharmacoresistant epilepsia psicomotoras atrasos; no entanto, a Localização subcellular do produto gene permaneceu evasivo11. Assim, o ensaio de absorção de Syt1 forneceu evidência chave para localização de GFP-etiquetado Rogdi às sinapses funcionais9.
Esta técnica de captação tem diversos benefícios. Primeiro, SV reciclagem pode ser observado tanto em tempo real através da realização de7,de imagens ao vivo12e após fixação6,9 , medindo a intensidade da fluorescência do rótulo Syt1 fluorescência. Além disso, foram desenvolvidas diversas variantes de Syt1 anticorpo. Existem variantes sem marcas de formatação que podem ser rotuladas com um anticorpo secundário, seguindo um protocolo padrão de imunocoloração após a fixação e variantes pre-conjugadas com um rótulo de fluorescência já anexado. Finalmente, baseados em anticorpo fluorescência é vantajosa devido a grande seleção de corantes secundários ou conjugados em comercialmente disponíveis que pode ser usado.
Quando fixação e imunocoloração os neurônios, é também possível mancha para proteínas adicionais e executar análise colocalization. Isto pode ajudar a determinar onde eles estão localizados em relação à reciclagem SVs. A intensidade do rótulo da fluorescência é a medida direta da quantidade de SV reciclagem. Além disso, os anticorpos seletivamente rotulam Syt1 contendo estruturas, resultando em alta especificidade e de fluorescência do pouco fundo4. Protocolos de estimulação diferentes também podem ser usados, tais como buffers de despolarização ou estimulação elétrica protocolos9,12,13,14. No entanto, reciclagem de SV basal pode ser medida sem estimular as culturas neuronal15.
Nosso método trata especificamente a absorção de anticorpo Syt1 nos neurônios duplo-transfectadas com anticorpo secundário immunolabeling após a fixação. No entanto, nos referimos a todas as variantes rotineiramente utilizadas do ensaio em nossa discussão para dar aos espectadores a oportunidade de adaptar o protocolo para necessidades específicas.
Protocolo
Foi realizado nenhum estudo com animais vivos. Experimentos envolvendo animais sacrificados para obter culturas foram aprovadas pelas autoridades locais de proteção animal (Tierschutzkommission der Universitätsmedizin Göttingen) sob a aprovação de célula número T10/30. Os experimentos foram realizados com os protocolos aprovados.
1. primário de células Hippocampal cultura
- Prepare a cultura de células dissociadas do hipocampo rato em embrionárias dia 1916,17. As células em lamelas de 12 mm, revestidas com polyethyleneimine (PEI) em 24-bem pratos em uma densidade de 50.000-60.000 células/poço da placa. Verifique a densidade utilizando uma célula ótica de contraste de fase e câmara de contagem.
- Cultura os neurônios para 3 dias (dia em vitro (DIV) 3) em uma placa de 24 na incubadora a 37 ° C com 5% de CO2.
- Avalie as lamelas para indicadores de saúde de células usando microscopia de luz transmitida (por exemplo, fase contraste ótica em uma ampliação de 10-20 X). Verifique os seguintes indicadores de saúde: um halo de contraste de fase clara, neuritos sem estruturas frisados e não soma clustering ou agrupamento do axônio.
2. transfection
Nota: O seguinte protocolo refere-se a um dupla de Transfeccao para 3 poços. No entanto, o protocolo funciona melhor quando quantidades suficientes para 4 poços estão preparadas.
- Prepare 500 mL de tampão de transfeccao (274 mM NaCl, 10 mM KCl, 1,4 mM Na2HPO4, glicose de 15mm, 42 mM HEPES) em um Erlenmeyer.
- Dissolva 5,0 g de HEPES em 400 mL de água destilada em um Erlenmeyer, 0,37 g de KCl, 0,095 g de Na2HPO4, 1,35 g de glicose e 8,0 g de NaCl.
- Ajuste o pH a 6,95 com 1 M NaOH, usando um medidor de pH.
- Ajustar o volume com água destilada para 500 mL e verificar o pH usando um medidor de pH.
- Fazer alíquotas de 20-30 mL de tampão de transfecção com os seguintes valores de pH por pipetagem 1 M NaOH para o buffer de transfeccao: 6,96, 6.97, 6,98, 6.99, 7.00, 7.01, 7.02, 7.03, 7.04, 7.05, 7.06, 7,07, 7.08, 7.09, 7.11.
Nota: O pH do buffer do transfection é crucial para a eficácia do transfection. - Para testar o que leva de tampão de Transfeccao para o maior número de células transfectadas, teste cada valor de pH de 6,96 a 7.11. Use o método de transfeccao descrito em 2.2-2.11 e um plasmídeo validado expressando GFP. Determine o número de células transfectadas por lamela para cada valor de pH do tampão de transfeccao avaliar qual tampão funciona melhor.
- Alíquota a reserva com a mais alta eficiência de Transfeccao para tubos de 2 mL microcentrifuga congelar e armazenar os tubos a-20 ° C.
- Pré-aquecer o soro reduzida meio, meio de cultura celular e água destilada a 37 ° C em banho-maria.
- Prepare a mistura de transfeccao em um tubo de microcentrifugadora de 1,5 mL. Trabalhar sob a capa de fluxo laminar para garantir condições de trabalho estéril.
- Mix de 7,5 µ l de cloreto de cálcio 2 M com 4 µ g de cada DNA livre de endotoxinas (Sinaptofisina-mOrange e mGFP/GFP-Rogdi). Adicione água para atingir um volume total de 60 mL em um tubo de microcentrifugadora de 1,5 mL.
- Adicione 60 mL de tampão de transfeccao à mistura. Para obter os melhores resultados, adicione o buffer de transfeccao gota a gota, agitando a mistura de DNA suavemente sobre o vórtice.
- Incube a temperatura ambiente (RT) por 20 minutos. Evite agitação do tubo de incubação durante o tempo de incubação, colocando o tubo ao lado a capa do fluxo laminar.
- Sob o capô de fluxo laminar, remover o meio de cultura celular ("meio condicionado") dos poços utilizando uma pipeta de 1000 mL e armazená-lo em um recipiente separado na incubadora.
- Adicione 500 mL de soro reduzida meio a cada poço. Incube as celulas em 37 ° C e 5% de CO2 até que acabe o período de incubação de 20 minutos (etapa 2.3.3).
- Adicione 30 mL de mistura de Transfeccao para cada poço pipetando várias gotas. Descarte o resíduo no fundo do tubo.
- Depois de todos os poços foram fornecidos com a mistura de transfeccao, agite suavemente a placa de 24 para garantir a distribuição da mistura no meio do transfection.
- Incube os poços durante 60 minutos a 37 ° C e 5% de CO2.
- Remova e descarte a mistura de transfeccao e lavá-lo três vezes com meio de cultura celular. Adicione 1 mL de meio de cultura celular a cada poço e incube-os por 30 segundos a RT. remover 750 mL do meio e adicione a mesma quantidade de meio fresco. Repita isso três vezes.
Nota: A etapa de lavagem é muito importante. Manter o tempo que cada poço não tem nenhum meio de no mínimo (i. e., remover e substituir por-bem) e adicionar lentamente o meio de lavagem. - Remova e descarte o meio de cultura celular e adicionar 450 mL do condicionado médio por-bem.
- Deixe os neurônios maduros na incubadora a 37 ° C e 5% CO2 para 10 DIV.
3. estimulação e captação de Syt1
Nota: O seguinte protocolo aplica-se a absorção de 3 poços. Por despolarização de qualquer outro número de poços, ajuste os montantes em conformidade.
- Prepare-se 50 mL de tampão de despolarização 10 x (640 mM NaCl, 700 mM KCl, 10 mM MgCl2, 20mm CaCl2, glicose de 300 mM, 200 mM HEPES, pH 7,4), em um Erlenmeyer.
Nota: A reserva de despolarização pode ser mantida a 4 ° C durante várias semanas. Se uma solução não-despolarizantes também é usada, preparar um 10 solução do x Tyrode consistindo de 1290mm NaCl, 50 mM KCl, 10 mM MgCl2, 20mm CaCl2, 300 mM, glicose, pH HEPES 200mm 7.4 fim comparar estimulação induzida por reciclagem com espontânea reciclagem. Após a diluição a 1 x, adicione 1 µM de tetrodotoxina antes do uso para bloquear a geração do potencial de ação.- Dissolva 1,87 g de NaCl, 2,61 g de KCl, 0,1 g de MgCl2-6 H20, 0,15 g de CaCl2-2 H2O e 3,0 g de glicose-1 H2O e 2,38 g de HEPES em 50 mL de água destilada em um Erlenmeyer. Ajuste o pH com NaOH e estéril-filtrar a solução. Dilua o tampão 01:10 em água destilada a obter uma concentração de 1 x.
- Prepare o paraformaldeído 4% (PFA) em 1X PBS (pH 7,4) para fixação após a estimulação.
- Para 500 mL de 4% PFA em PBS 1x, dissolver 20 g de paraformaldeído em 450 mL de água destilada H2O.
Nota: A solução de aquecimento pode acelerar a dissolução, mas não aqueça a solução acima de 70 ° C, como o PFA pode desintegrar-se.
Cuidado: PFA é tóxico, potencialmente carcinogênicos e teratogênicos. Use luvas quando trabalhar com PFA, trabalhar sob a coifa e evitar a ingestão. - Deixe a solução esfriar a RT e adicionar 50 mL de solução estoque de PBS x 10. Ajuste o pH para 7,4 com NaOH/HCl usando um medidor de pH.
- Para 500 mL de 4% PFA em PBS 1x, dissolver 20 g de paraformaldeído em 450 mL de água destilada H2O.
- Pré-aqueça 600 mL de tampão de despolarização 1x e 10 mL de meio de cultura celular para 37 ° C em banho-maria.
- Adicione 1 mL de anticorpo anti-Syt1 de rato (clone 604.2) para o 1x buffer de despolarização e vortex durante 10 segundos.
- Remova e descarte o meio de cultura celular de células. Adicione 200 mL da mistura despolarização-anticorpo para cada bem e incubar por 5 minutos a 37 ° C e 5% CO2 na incubadora.
- Remova e descarte a mistura de despolarização-anticorpo e lavá-lo três vezes com meio de cultura celular. Adicione 1 mL de meio de cultura celular a cada poço e incube por 30 segundos a RT. remover 750 mL do meio e adicione a mesma quantidade de meio fresco. Repeti três vezes.
- Remova e descarte o meio de cultura celular e adicionar 300ml de 4% PFA em 1X PBS. Incubar durante 20 minutos a 4 ° C.
- Lavar três vezes por 5 minutos, cada um com PBS 1x.
Nota: O protocolo pode ser pausado aqui.
4. imunocitoquímica
- Prepare 50 mL de tampão de bloqueio.
Nota: Bloqueio de buffer pode ser mantido a-20 ° C por vários meses.- Dissolva 2,5 g de sacarose e 1 g de albumina de soro bovino (BSA) em 5 mL de solução estoque de PBS x 10. Adicione 1,5 mL da solução detergente 10%. Agite a solução até que todos os componentes corretamente se dissolveram e adicionar água destilada H2O até atingir um volume final de 50 mL. Alíquota da solução e congelar as alíquotas para armazenamento.
- Dilua o anticorpo secundário, fluoróforo acoplados (dirigido contra as espécies de Syt1-anticorpo primárias) em 200 mL de tampão de bloqueio em cada poço a uma diluição de 1: 1000.
- Remova e descarte a PBS 1x de cada bem que contém uma lamela.
- Adicionar 200 mL de mistura de tampão-anticorpo para cada poço de bloqueio e incubar durante 60 minutos a RT
Cuidado: Porque os anticorpos secundários são sensíveis à luz, todos os passos em frente devem ser realizados no escuro. - Após a incubação, lave as células três vezes por 5 minutos com 1 mL de 1X PBS.
- Incorpore as lamelas em corrediças do microscópio com o medium de incorporação.
- Adicione uma gota de 7 mL de incorporação médio da lâmina de microscópio. Remova a lamela a placa de 24 por levantá-lo com uma seringa e agarrando-o com a pinça.
Cuidado: Células na superfície da lamela são facilmente danificadas, então fórceps deve ser manuseado com cuidado. - Mergulhe a lamela água destilada para remover a PBS e seque-o cuidadosamente, tocando uma borda de um tecido mole.
- Inverter a lamela sobre a incorporação da gota média, para que a superfície carregando as células enfrenta a lâmina de microscópio, incorporando, assim, as células no meio de encastre.
- Adicione uma gota de 7 mL de incorporação médio da lâmina de microscópio. Remova a lamela a placa de 24 por levantá-lo com uma seringa e agarrando-o com a pinça.
- Deixe os slides para secar sob o capô para 1-2 h (cobri-los para evitar a exposição à luz) e armazená-los em uma caixa de slide de microscópio a 4 ° C.
Nota: O protocolo pode ser pausado aqui.
5. microscópico análise
- Depois de secam as lamelas, colocá-los sob o microscópio com o objectivo e a câmera.
- Ajuste o tempo de exposição para cada canal para que alguns pixels são superexpostas para garantir o máximo da distribuição dos valores de cinza.
Nota: Enquanto o tempo de exposição pode variar entre os canais, deve ser constante para um canal para assegurar a comparabilidade entre as lamelas. - Adquira imagens de multi-canal para 10 regiões de interesse (ROIs) por lamela. Verifique se o ROI contém processos axonal a partir de um neurônio transfectado, verificando a GFP-fluorescência, que deve ser punctate.
6. análise estatística
- Exporte as imagens como arquivos. tif. Carregar as imagens para OpenView18 clicando em arquivo | Arquivo de imagem de carga.
- Escolha a imagem Sinaptofisina-mOrange como canal 1, a imagem Rogdi-GFP/mGFP como o canal 2 e a imagem de fluorescência Alexa647 como canal 3.
- Limiar de ROIs.
- Clique em análise | Área de lugar sobre a partitura. Escolha os valores de limiar e intensidade de Delta para que após a inspeção visual, fluorescência difusa é excluída, deixando apenas punctate sinais na imagem do canal 1 (representando Sinaptofisina-mOrange fluorescência). Manter o mesmo limiar para todas as imagens.
- Transferi estes ROIs ao correspondente canal 2 (fluorescência de GFP-Rogdi/mGFP) e 3 (Syt1-fluorescência) de cada área de lamela, clicando em executar agora.
Nota: O ROIs só deve ser considerado se a célula é duplo-transfectadas. Neste método, o mOrange e GFP-fluorescência deve ser claramente visível. - Salve os dados no editor de registo de análise clicando em dados de Log.
- Abra o editor de registro de análise sob a guia do Windows e copiar os valores para cada canal. Cole os valores para os canais separados em uma planilha.
- Determine a intensidade média de fluorescência do Syt1-canal no ROIs em ambas as condições de transfeccao (GFP-Rogdi e mGFP).
- Aplica testes estatísticos adequados, tais como o teste t de Student para determinar diferenças significativas.
Resultados
Um resultado esperado desta abordagem é localizar aproximadamente 50 duplo-transfectadas neurônios por lamela em uma densidade de 50.000 neurônios por bem. O axónio de cada neurônio é esperado para mostrar vários hotspots de acumulação Sinaptofisina fluorescente etiquetado, indicando aglomerados ofSVs. Em sites pré-sináptica funcionais, o sinal de Sinaptofisina recombinante colocalizes com punctate Syt1 fluorescência. Usando a transfeccao duplo, ou GFP-Rogdi como a proteína de interesse (Figura 1) ou mGFP que o controle é co expressa com recombinante Sinaptofisina.
Neste experimento, analisamos SV reciclagem pré-sináptica locais nos neurônios expressando GFP-Rogdi ou mGFP. Se a proteína de controle, mGFP, é distribuída homogeneamente por toda a célula inteira, mas sua influência em locais sinápticos ainda precisa ser estudado, em seguida, é necessário co transfect uma segunda proteína que pré-sinapticamente é enriquecida, fluorescente etiquetado Sinaptofisina.
Conforme descrito anteriormente, as células passam por liberação induzida por despolarização do transmissor. Como resultado, sinapses funcionais ocupam Syt1 anticorpos adicionados ao meio. Após immunolabeling o Syt1 anticorpo com um anticorpo secundário fluorescente etiquetado, a extensão da absorção de Syt1 finalmente é quantificada usando o immunosignal (Figura 2).
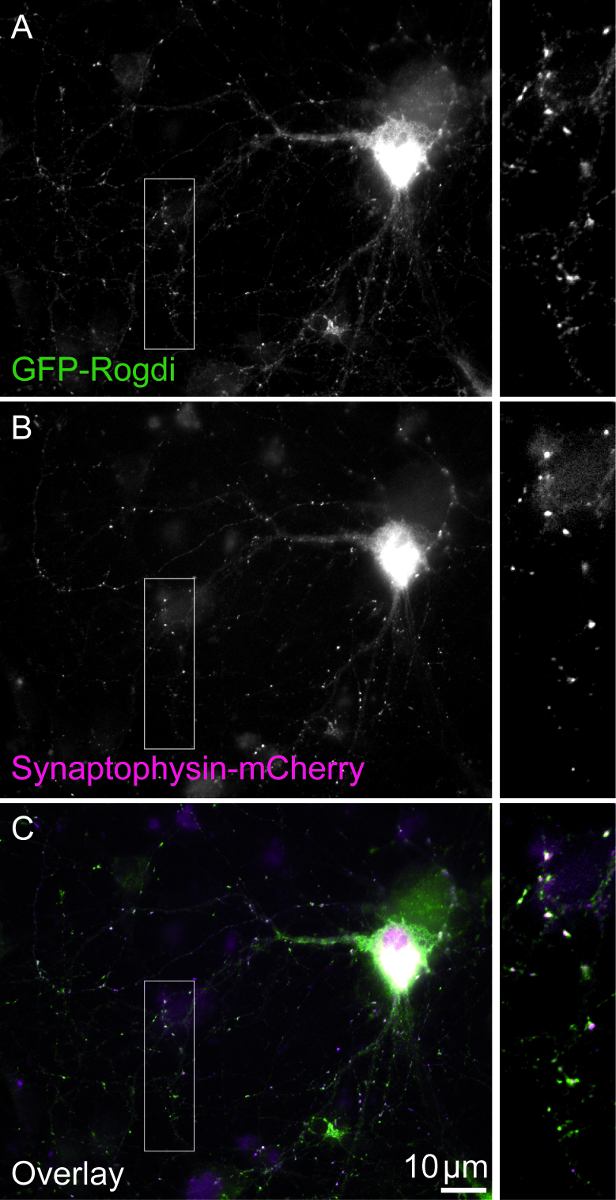
Figura 1. Célula Double-transfectadas. O campo de visão mostra uma célula duplo-transfectadas expressando GFP-Rogdi (A) e Sinaptofisina-mCherry (B). Sinaptofisina é uma proteína abundante vesícula sináptica. Sua variante recombinante pode ser usado para rotular boutons sinápticas. O padrão de localização de GFP-Rogdi se assemelha ao de Synaptophysin-mCherry (C). Barras de escala = 10 μm. Caixas mostram ampliação de X 2,5. Clique aqui para ver uma versão maior desta figura.

Figura 2. GFP-Rogdi em sinapses funcionais. Captação de Syt1 ao vivo foi realizada em células transfectadas duplo expressando ou mGFP (verde) e Sinaptofisina-mOrange (vermelho; A-D) ou GFP-Rogdi (verde) e Sinaptofisina-mOrange (vermelho; E-H). Captação de anticorpo Syt1 foi realizada usando um anticorpo monoclonal de rato dirigido contra o domínio luminal de Syt1. Após a fixação do PFA, células estavam manchadas com anticorpo de coelho anti-GFP. Anticorpos secundários (anticoelho Alexa 488 e anti-rato Alexa 647) foram adicionados para detectar GFP ou GFP-Rogdi e Syt1, respectivamente. Autofluorescência de Sinaptofisina-mOrange foi usada para detectar pré-sináptica terminais (B e F). Punctate Syt1 imunofluorescência indica sites de vesículas de reciclagem (azul; C e G). Note que a maioria das sinapses Syt1-etiquetados é localizada de neurônios não-transfectadas. GFP-Rogdi foi alvo de sinapses ativas e vesícula sináptica reciclagem (I) não se alterou. foram realizados 3 experimentos de cultura independente (N = 3). Pelo menos 3 lamelas de cada cultura (total de 10) foram utilizadas para análise. Finalmente, 3 áreas por lamela foram analisadas (n = 30). Student´s teste-t não houve diferença significativa. Barras de escala = 10 μm. Barras de erro representam o erro padrão da média (no MEV mostrou). "N.s." não indica nenhum significado. Esta figura foi modificada de Riemann et al 9 Clique aqui para ver uma versão maior desta figura.
Discussão
Existem três ensaios rotineiramente usados para estudar a vesícula sináptica (SV) reciclagem. Os dois primeiros incluem o uso de um) fluorescente styryl corantes como FM1-43 (que incorporar em membranas, são retomadas em organelas durante a endocitose e são liberados após a exocitose); e b) marcados fluorescentemente proteínas recombinantes do SV (que, em cima de superexpressão, incorporam as máquinas de reciclagem proteicas). Se o anexadas fluorophores alterar sua fluorescência dependendo do pH, pode ser usados para monitorar as alterações entre o interior de um SV ácido e o pH do meio extracelular. As proteínas recombinantes com uma variante de sensíveis ao pH do GFP são chamadas Phluorins. Os dois ensaios discutidos tem sido caracterizado anteriormente19,20, e os prós e contras de cada um foram também analisados21.
Aqui, descrevemos um terceiro método bem estabelecido4,5,6,7,9,14. Para testar o SV reciclagem, aproveitamos o facto de que o domínio luminal de proteína associada a vesículas Synaptotagmin-1 (Syt1) torna-se exposto à superfície da célula mediante exocitose. Primeiro, nós adicionamos um anticorpo dirigido contra o domínio luminal para o meio de cultura, que é depois retomado pela vesícula durante SV reciclagem. Esta absorção de anticorpo é visualizada e quantificada por imunofluorescência. Alternativamente, pode ser usado um anticorpo-Syt1 diretamente marcado. O rótulo pode ser independente de pH, relatórios de localização do Syt1-anticorpo dentro e na superfície externa da SVs, ou dependente do pH, relatórios de localização com base nas alterações de fluorescência. Também descrevemos a combinação deste teste de reciclagem de SV com duplo transfeccao de neurônios cultivados para testar ou não uma proteína de alvos de interesse, GFP-Rogdi, funcionais sinapses e afeta SV reciclagem. GFP-Rogdi é específico para esta abordagem; no entanto, as mesmas perguntas podem ser abordadas para qualquer proteína de interesse.
Este ensaio foi introduzido pela primeira vez em 1992, para monitorar a reciclagem espontânea de SVs4 e foi desenvolvido pelo mesmo grupo para monitorar SV evocado reciclagem12. Seus experimentos estabeleceram que a captação de Syt1 é sensível a clostridial neurotoxinas, que bloqueiam o SV exocitose12. Eles também mostraram que a estimulação das culturas por despolarização a 37 ° C aumenta a internalização de Syt1 anticorpos em comparação com 1) culturas que são mantidas no gelo, o que impede a maioria endocitose e a 2) culturas incubadas a 37 ° C, sem estimulação, que permite a reciclagem espontânea mas não evocar reciclagem12,22. O ensaio pode facilmente comparar SV reciclagem entre duas condições, tais como com e sem uma molécula de interesse. Em particular, este protocolo centra-se na comparação Syt1 absorção de anticorpos na presença versus ausência de uma certa proteína Blumental. O protocolo pode ser expandido se as contribuições relativas de superfície-binding, espontânea reciclagem e reciclagem evocado precisam ser avaliada. Por exemplo, incubar os neurônios no gelo sem estimulação impede endocitose, revelando qualquer superfície ligação do anticorpo Syt1. Incubar os neurônios a 37 ° C em solução basal com tetrodotoxina impede a propagação do potencial de ação, revelando qualquer reciclagem espontânea. Assim, neurônios de incubação a 37 ° C sob estimulante pode condições revelam a extensão da reciclagem de SV evocado.
Células vivas são sensíveis às condições fisiológicas ideais; Portanto, manutenção, transfecção e buffers de despolarização sempre devem ser testados para parâmetros fisiológicos, incluindo pH e temperatura. Enquanto os buffers de despolarização podem ser passados através de filtros estéreis após o pH foi ajustado, buffers de transfeccao são sensíveis à filtragem estéril. Portanto, podemos ajustar o seu pH, mantê-lo congelado até o uso e girá-lo em uma centrífuga de mesa para todas as bactérias de Pelotas. Para transfeccao, é vital para misturar o buffer adequadamente para garantir a associação o plasmídeo com os cristais de fosfato de cálcio. Fosfato de cálcio transfeccao funciona melhor em dia em vitro (DIV) 2-4. Nós usamos etiquetada Sinaptofisina, uma proteína transmembrana SV, como um marcador para a identificação de terminais pré-sináptica nos neurônios transfectados. Também podem ser usadas etiquetadas versões de outras proteínas SV como SV2, Synapsin e VAMP/synaptobrevin da ou zona ativa moléculas como fagote, RIM, Munc13-1 e elenco.
Ambos mCherry e mOrange emitem fluorescência vermelha. Embora mCherry seja mais brilhante do que o mOrange, possui maior emissão de comprimentos de onda longos do que o mOrange. Portanto, para a imagem latente de fluorescência triplo com GFP, um corante vermelho e um corante emitindo na faixa de 700 nm, mOrange é uma opção melhor do que mCherry. Para fluorescência dupla com GFP e um corante vermelho, mCherry pode ser favorável, uma vez que é o corante mais brilhante. Para garantir a transfeccao esparso, a mistura de transfeccao não deve ser incubada por mais de 60 minutos. Também é importante que a incubação em um buffer despolarizante é o comprimento certo tempo para assegurar a exocitose das vesículas de todos. No entanto, deve ser evitada a exposição prolongada para o buffer de despolarizante. Durante a aquisição de imagens, também é essencial para aplicar os mesmos tempos de exposição e intensidades luminosas para assegurar comparação quantificável entre diferentes conjuntos de experiências.
Finalmente, durante a análise de imagem, o nosso protocolo inclui várias considerações. Para uma área de interesse, mostrando recombinante Sinaptofisina partitura, o limiar de menor intensidade é definido para que fluorescência difusa é excluída. Em seguida, esse limite é testado em outras áreas e lamelas observar semelhante inclusão de sinais punctate e exclusão de fluorescência difusa. Quando um limiar é identificado, é aplicado a todas as imagens, produzindo punctate regiões de interesse (ROIs) no canal Sinaptofisina (marcado com mCherry ou mOrange) recombinante. Por último, Syt1 intensidade é determinada para o ROIs9.
Nossa abordagem é otimizada para transfeccao esparso. Analisamos a função pré-sináptica num ambiente complexo onde há SV reciclagem em axônios de neurônios transfectados rodeados pelos neurônios untransfected. Neste set-up, duplo-transfecção nos permite manipular função neuronal e localize os terminais pré-sináptica dos neurônios transfectados. Transfectadas neurônios pré-sináptica que entre em contato com untransfected neurônios pós-sinápticos é um fator importante na avaliação de efeitos de um neurônio pré-sináptica na reciclagem de SV. A configuração também pode ser facilmente adaptada para testar ou não uma manipulação pós-sináptica provoca alterações pré-sináptica. Neste caso, transfection esparsa de neurônios com uma proteína que é direcionado para sites pós-sináptico vai localizar os sites pós-sináptica dos neurônios transfectados, e captação de Syt1 pode ser determinada em boutons sinápticas dos neurônios untransfected.
Quando transfeccao esparso não é necessário, podem ser aplicados protocolos diferentes do transfection. Por exemplo, transfecção com Lipofectamine na DIV 7 - 8 resulta em maiores taxas de transfeccao, mas isso implica também a mais forte expressão em cada célula transfectadas9. Além disso, transdução viral pode resultar na expressão em quase 100% dos neurônios cultivados14,23,24. Em experimentos vistos monitorar SV reciclagem, transfecção pode ser executada por uma única proteína ou omitiu-se completamente. Por exemplo, quando reciclagem global sináptica é comparado entre os neurônios da sua e geneticamente modificado ratos, rotulando os neurônios individuais por transfecção não é necessários. Além disso, isto permite que immunolabeling de proteínas endógenas. Se falhar o transfeccao, é importante testar o buffer de transfecção com um plasmídeo validado ou usar um tampão com pH diferente (ver preparação de buffer de transfeccao). Usar preparações de DNA gratuito endotoxina também parece ser crucial. Immunostaining internalizada Syt1 obras de anticorpos em amostras tanto PFA-fixo e fixo-metanol. Também deve ser notado que a GFP e RFP autofluorescência é perdida após a fixação do metanol. Se é o que precisam ser localizadas em células fixadas em metanol a GFP ou RFP, estas proteínas devem ser immunolabeled. Se Syt1 captação falhar, tempo de despolarização e concentração de K+ no buffer de despolarização devem ser alterados em conformidade. Muitas variações de protocolo foram publicadas, com despolarização vezes variando de 90 s25 -60 min12e com concentrações de K+ de 45mm, 50mm, 70mm e 110mm6,25,26 ,,27. Quando a atividade recorrente deve ser impedida, bloqueadores dos receptores de glutamato também podem ser adicionados durante a despolarização. Finalmente, enquanto alta despolarização K+ é pensada para ser o mais forte estímulo, potenciais de ação podem induzir SV reciclagem através de mais estímulos fisiológicos22,28. Diferenças na eficácia de absorção de anticorpos de Syt1 podem ocorrer nas culturas do rato e do rato. Em nosso método, o anticorpo monoclonal de rato anti-Syt1 clone 604.2 (RRID:AB_993036) produz uma coloração mais forte em culturas de rato do que nas culturas do mouse, enquanto o anticorpo policlonal de coelho anti-Syt1 (RRID:AB_11042457) produz uma coloração mais forte em culturas de rato, mas várias notas de precaução são discutidas abaixo.
Várias advertências sobre o uso de anticorpos anti-Synaptotagmin para absorção em SVs devem ser consideradas. Primeiro, a N-glicosilação de asparagina 24 de Syt1 promove a absorção endocytotic de proteína29,30. Asparagina 24 é parte do domínio luminal de Syt1. Os anticorpos do rato e o coelho que usamos são direcionados contra aminoácidos 1-12 e 1-8, respectivamente, de Syt1. Enquanto seus resumos não se sobrepõem com o site N-glicosilação, estérico ou, inversamente, uma indução de absorção pela ligação de anticorpo não pode ser excluída. Mutação do site N-glicosilação em Syt1 não altera a cinética de endocitose e o direcionamento de Syt1 à SVs. Aumenta a fração de Syt1 remanescente na superfície externa da membrana de plasma quando endocitose é induzida por estímulos fracos. Quando fortes estímulos, tais como elevada despolarização K+ , são aplicados, sem redução na captação de Syt1 é observada30. Em geral, se os anticorpos interferiram com o site N-glicosilação de alguma forma eles podem causar uma mudança na endocitose SV comparado com anticorpo-free condições, mas essa alteração deve ser semelhante para o experimento (no nosso caso, a superexpressão de GFP-Rogdi) e o controle (no nosso caso, a expressão de GFP). Além disso, Anticorpos policlonais podem ser mais propensos a induzir problemas estéricos e reticulação de anticorpos monoclonais, porque um maior número de cópia de anticorpos vincula o epítopo. Não estamos cientes da sistemáticos estudos comparando os anticorpos disponíveis uns com os outros; no entanto, alguns estudos têm abordado a validade de certos anticorpos. Por exemplo, quando cinética reciclagem SV foram analisados usando o clone de anticorpo monoclonal de rato anti-Syt1 604.2 e alterações Synaptophluorin-fluorescência em uma comparação direta, resultados semelhantes foram obtidos, validando o uso deste anticorpo28. Carregando a SVs com coelho polyclonal Syt1 anticorpos e gravando a transmissão sináptica electrophysiologically revelaram que as sinapses carregadas tinham reduzido a transmissão sináptica em uma maneira reminiscente de perda-de-função mutantes de Syt1. Portanto, estes anticorpos policlonais afetam a transmissão sináptica. A absorção real revelou reciclagem espontânea e evocado, sugerindo que um anticorpo policlonal é adequado para acompanhar uma rodada de SV reciclagem, mas deve-se tomar cuidado ao interpretar os resultados após a absorção destes anticorpos31.
Três ensaios são rotineiramente usados para estudar a reciclagem de SV, que incluem a membrana rotulagem com styryl corantes, superexpressão de Phluorins, e a absorção de Syt1-anticorpo realizada aqui. Todos os três ensaios podem ser usados para determinar as pernas endocytotic e os de reciclagem de SV. Enquanto todos os três ensaios têm benefícios poderosos, cada um tem também uma ressalva de princípio. Corantes de FM rotular a superfície de toda a célula e são absorvidos a célula com todas as membranas de reciclagem. PHluorins deve ser introduzido pela superexpressão. Rótulo de Syt1-anticorpos da proteína endógena, mas alguns anticorpos podem afetar sua função sob certas condições. Cada advertência pode, no entanto, ser devidamente endereçado21.
Globalmente, o ensaio de absorção de anticorpos de Syt1 tem servido vários propósitos. Primeiro, foi usado para rotular seletivamente SVs passando por espontânea ou evocado reciclagem, respectivamente28,31,32,33. Em segundo lugar, foi usado para determinar o efeito de uma droga ou proteína sobre a extensão da SV reciclagem; por exemplo, para mostrar que o BDNF aumenta espontânea e evocado SV6de reciclagem. Em terceiro lugar, foi usado para determinar o número de sinapses com reciclagem SVs como uma porcentagem do número total de sinapses morfologicamente definidos34,35. Isso revelou que a superexpressão da molécula de adesão-célula pós-sináptica Neuroligin-1 aumenta a porcentagem de sinapses com reciclagem SVs25 e que reduzir o expressar dos receptores de glutamato do tipo Leandro diminui a percentagem de sinapses com reciclagem SVs, aumentando a porcentagem de sinapses pré-sinapticamente silenciosa36. Além disso, o ensaio foi usado para analisar a mobilidade dos rotulados SVs27 e determinar a localização de Syt1 usando nanoscopy13,22,33. Finalmente, este método ainda é usado para testar ou não determinadas proteínas localizar a sinapses funcionais9. O anticorpo de Syt1 também pode ser usado para estudos de longo prazo, onde o anticorpo permanece nos neurônios durante dias após absorção37. Isto pode ser combinado com uma segunda rodada de captação usando um anticorpo de Syt1 separadamente marcado ou um anticorpo dirigido contra o domínio luminal de uma proteína diferente de SV. Isso permite que o teste de que SVs reciclagem inicialmente e que reciclar até ao final do experimento. Seria interessante adaptar este ensaio para mais sistemas modelo intacto, como fatias agudas e organotypic fatia de culturas. Em princípio, o ensaio de absorção permite a comparação de tecido da sua e geneticamente modificado animais ou pode ser combinado com entrega viral ou biolistics, i. e., um injetor do gene"," para manipular a expressão da proteína nestes sistemas de modelo. Em tais sistemas, a influência de certas perturbações na maquinaria pré-sináptica, monitorado pelo ensaio de absorção e dinâmica de rede pode ser estudada simultaneamente.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Agradecemos Irmgard Weiss-assistência técnica especializada. Este trabalho foi apoiado pelo DFG através do Cluster de excelência para microscopia na escala do nanômetro e fisiologia molecular do cérebro (CNMPB, B1-7, a T.D.).
Materiais
| Name | Company | Catalog Number | Comments |
| B27 | Gibco | 17504-044 | |
| BSA | Sigma | A7030-50g | |
| CaCl2 | Sigma-Aldrich | C3306-100g | |
| CoolSNAP HQ2 | Photometrics | ||
| dH2O | Invitrogen | 15230 | |
| DABCO | Merck | 8.03456.0100 | |
| donkey anti mouse Alexa 647 | Jackson-Immunoresearch | 715605151 | antibody |
| DMEM | Invitrogen | 41966 | |
| DPBS | Gibco | 14190 | |
| Eppendorf tubes | Eppendorf | 30120094 | |
| multiwell 24 well | Fisher Scientific | 087721H | |
| tube (50 mL) | Greiner Bio-One | 227261 | |
| FBS superior | BiochromAG | S0615 | |
| Glucose | Merck | 1,083,421,000 | |
| HBSS | Invitrogen | 14170 | |
| HEPES | Sigma | H4034-500g | |
| Hera Cell 150 (Inkubator) | ThermoElectron Corporation | ||
| KCL | Sigma-Aldrich | P9541-500g | |
| L-Glutamin | Gibco | 25030 | |
| MgCl2 | Honeywell | M0250-500g | |
| microscope slides | Fisher Scientific | 10144633CF | |
| Microsoft Excel | Microsoft | ||
| Mowiol4-88 | Calbiochem | 475904 | |
| NaCl | BioFroxx | 1394KG001 | |
| Na2HPO4 | BioFroxx | 5155KG001 | |
| Neurobasal | Invitrogen | 21103049 | |
| OpenView Experiment Analysis Application | Free software, see comments | written by Noam E. Ziv, Technion – Israel Institute of Technology, Haifa, Israel | |
| PBS (10x) | Roche | 11666789001 | |
| Optimem | Invitrogen | 31985 | |
| Penstrep | Gibco | 15140-122 | |
| PFA | Sigma | P6148-1kg | |
| safety hood | ThermoElectron | Serial No. 40649111 | |
| Sucrose | neoFroxx | 1104kg001 | |
| Synaptotagmin1 | Synaptic Systems | 105311 | mouse monoclonal; clone 604.2 |
| Triton X-100 | Merck | 1,086,031,000 | |
| Vortex Genius 3 | IKA | 3340001 | |
| Water bath | GFL | 1004 | |
| Zeiss Observer. Z1 | Zeiss |
Referências
- Koh, T., Bellen, H. J. Synaptotagmin I, a Ca2+ sensor for neurotransmitter release. Trends in Neurosciences. 26, 413-422 (2003).
- Chapman, E. R. How Does Synaptotagmin Trigger Neurotransmitter Release. Annual Review of Biochemistry. 77, 615-641 (2008).
- Perin, M. S., et al. Structural and Functional Conservation of Synaptotagmin (p65) in Drosophila and Humans. Journal of Biological Chemistry. 266, 615-622 (1991).
- Matteoli, M., Takei, K., Perrin, M. S., Südhof, T. C., De Camilli, P. Exo-endocytotic Recycling of Synaptic Vesicles in Developing Processes of Cultured Hippocampal Neurons. Journal of Cell Biology. 117, 849-861 (1992).
- Ko, J., et al. Neuroligin-1 performs neurexin-dependent and neurexin-independent functions in synapse validation. The EMBO Journal. 28, 3244-3255 (2009).
- Shinoda, Y., et al. BDNF enhances spontaneous and activity-dependent neurotransmitter release at excitatory terminals but not at inhibitory terminals in hippocampal neurons. Frontiers in Synaptic Neuroscience. 6, 27(2014).
- Ivanova, D., et al. Synaptic activity controls localization and function of CtBP 1 via binding to Bassoon and Piccolo. The EMBO Journal. 34, 1056-1077 (2015).
- Crawford, D. C., Ramirez, D. M. O., Trauterman, B., Monteggia, L. M., Kavalali, E. T. Selective molecular impairment of spontaneous neurotransmission modulates synaptic efficacy. Nature Communications. 8, 1-14 (2017).
- Riemann, D., Wallrafen, R., Dresbach, T. The Kohlschütter-Tönz syndrome associated gene Rogdi encodes a novel presynaptic protein. Scientific Reports. 7, (2017).
- Kim, M., et al. Rogdi Defines GABAergic Control of a Wake-promoting Dopaminergic Pathway to Sustain Sleep in Drosophila. Scientific Reports. 7, 1-14 (2017).
- Schossig, A., Wolf, N. I., Kapferer, I., Kohlschütter, A., Zschocke, J. Epileptic encephalopathy and amelogenesis imperfecta: Kohlschütter-Tönz syndrome. Euopean Journal of Medical Genetics. 55, 319-322 (2012).
- Kraszewski, K., et al. Synaptic Vesicle Dynamics in Living Cultured Hippocampal Neurons Visualized with CY3-Conjugated Antibodies Directed against the Lumenal Domain of Synaptotagmin. Journal of Neuroscience. 15, 4328-4342 (1995).
- Willig, K. I., Rizzoli, S. O., Westphal, V., Jahn, R., Hell, S. W. STED microscopy reveals that synaptotagmin remains clustered after synaptic vesicle exocytosis. Nature. 440, 935-939 (2006).
- Petkova, A., Goedecke, N., Korte, M., Dresbach, T. Neuroligins mediate presynaptic maturation through brain-derived neurotrophic factor signaling. bioRxiv. , 262246(2018).
- Fuchs, C., et al. GABA(A) receptors can initiate the formation of functional inhibitory GABAergic synapses. European Journal of Neuroscience. 38, 3146-3158 (2013).
- Dresbach, T., et al. Functional regions of the presynaptic cytomatrix protein Bassoon: Significance for synaptic targeting and cytomatrix anchoring. Molecular and Cellular Neuroscience. 23, 279-291 (2003).
- Seibenhener, M. L., Wooten, M. W. Isolation and Culture of Hippocampal Neurons from Prenatal Mice. Journal of Visualized Experiments. (65), 4-9 (2012).
- Tsuriel, S., et al. Local sharing as a predominant determinant of synaptic matrix molecular dynamics. PLOS Biology. 4, 1572-1587 (2006).
- Iwabuchi, S., Kakazu, Y., Koh, J., Goodman, K. M., Harata, N. C. Examination of Synaptic Vesicle Recycling Using FM Dyes During Evoked, Spontaneous, and Miniature Synaptic Activities. Journal of Visualized Experiments. (85), 1-10 (2014).
- Villarreal, S., Lee, S. H., Wu, L. Measuring Synaptic Vesicle Endocytosis in Cultured Hippocampal Neurons. Journal of Visualized Experiments. (127), 1-8 (2017).
- Kavalali, E. T., Jorgensen, E. M. Visualizing presynaptic function. Nature Neuroscience. 17, 10-16 (2014).
- Opazo, F., et al. Limited Intermixing of Synaptic Vesicle Components upon Vesicle Recycling. Traffic. 11, 800-812 (2010).
- Wollebo, H. S., Woldemichaele, B., White, M. K. Lentiviral transduction of neuronal cells. Methods in Molecular Biology. 1078, 141-146 (2013).
- Yang, X., Kaeser-Woo, Y. J., Pang, Z. P., Xu, W., Südhof, T. C. Complexin Clamps Asynchronous Release by Blocking a Secondary Ca2+ Sensor via Its Accessory α Helix. Neuron. 68, 907-920 (2010).
- Wittenmayer, N., et al. Postsynaptic Neuroligin1 regulates presynaptic maturation. Proceedings of the National Academy of Sciences of the United States of America. 106, 13564-13569 (2009).
- Lazarevic, V., Schone, C., Heine, M., Gundelfinger, E. D., Fejtova, A. Extensive Remodeling of the Presynaptic Cytomatrix upon Homeostatic Adaptation to Network Activity Silencing. Journal of Neuroscience. 31, 10189-10200 (2011).
- Kraszewski, K., Daniell, L., Mundigl, O., De Camilli, P. Mobility of synaptic vesicles in nerve endings monitored by recovery from photobleaching of synaptic vesicle-associated fluorescence. Journal of Neuroscience. 16, 5905-5913 (1996).
- Hua, Y., Sinha, R., Martineau, M., Kahms, M., Klingauf, J. A common origin of synaptic vesicles undergoing evoked and spontaneous fusion. Nature Neuroscience. 13, 1451-1453 (2010).
- Han, W., et al. N-Glycosylation Is Essential for Vesicular Targeting of Synaptotagmin 1. Neuron. 41, 85-99 (2004).
- Kwon, S. E., Chapman, E. R. Glycosylation is dispensable for sorting of synaptotagmin 1 but is critical for targeting of SV2 and synaptophysin to recycling synaptic vesicles. Journal of Biological Chemistry. 287, 35658-35668 (2012).
- Afuwape, O. A. T., Wasser, C. R., Schikorski, T., Kavalali, E. T. Synaptic vesicle pool-specific modification of neurotransmitter release by intravesicular free radical generation. The Journal of Physiology. 595, 1223-1238 (2017).
- Sara, Y., Virmani, T., Deák, F., Liu, X., Kavalali, E. T. An isolated pool of vesicles recycles at rest and drives spontaneous neurotransmission. Neuron. 45, 563-573 (2005).
- Wilhelm, B. G., Groemer, T. W., Rizzoli, S. O. The same synaptic vesicles drive active and spontaneous release. Nature Neuroscience. 13, 1454-1456 (2010).
- Bacci, A., et al. Chronic blockade of glutamate receptors enhances presynaptic release and downregulates the interaction between synaptophysin-synaptobrevin-vesicle-associated membrane protein 2. Journal of Neuroscience. 21, 6588-6596 (2001).
- Piccoli, G., et al. LRRK2 Controls Synaptic Vesicle Storage and Mobilization within the Recycling Pool. Journal of Neuroscience. 31, 2225-2237 (2011).
- Tracy, T. E., Yan, J. J., Chen, L. Acute knockdown of AMPA receptors reveals a trans-synaptic signal for presynaptic maturation. The EMBO Journal. 30, 1577-1592 (2011).
- Truckenbrdot, S., Viplav, A., Jaehne, S., Vogts, A., Denker, A., Wildhagen, H., Fornasiero, E. F., Rizzoli, S. O. Ageing synaptic vesicles are inactivated by contamination with SNAP25. bioRxiv. , 172239(2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados