Method Article
Un test ottico per riciclo delle vescicole sinaptiche in colture di neuroni che Overexpressing proteine presinaptiche
In questo articolo
Riepilogo
Descriviamo un test ottico per vescicole sinaptiche (SV) riciclaggio in colture di neuroni. Combinando questo protocollo con doppia transfezione di esprimere un marcatore presinaptica e la proteina di interesse ci permette di individuare siti presinaptici, loro delle vescicole sinaptiche capacità di riciclaggio e di determinare il ruolo della proteina di interesse.
Abstract
Alle terminazioni nervose presinaptiche attivo, vescicole sinaptiche sono sottoposti a cicli di exo - ed endocitosi. Durante il riciclaggio, i luminal domini delle proteine transmembrana SV diventano esposti alla superficie delle cellule. Una di queste proteine è Synaptotagmin-1 (Syt1). Un anticorpo diretto contro il dominio luminale di Syt1, una volta aggiunto al terreno di coltura, è ripreso durante il ciclo eso-endocitotico. Questo assorbimento è proporzionale alla quantità di SV riciclaggio e possa essere quantificato mediante immunofluorescenza. Qui, uniamo l'assorbimento di anticorpo Syt1 con doppia transfezione delle colture di neuroni ippocampali. Questo ci permette di (1) localizzare siti presinaptici basati sull'espressione del marcatore presinaptica ricombinante Synaptophysin, (2) determinare la loro funzionalità mediante l'assorbimento Syt1 e (3) caratterizzare il targeting e gli effetti di una proteina di interesse, GFP-Rogdi.
Introduzione
Lo studio di riciclo delle vescicole sinaptiche è importante nel determinare come modificare proprietà presinaptici, durante plasticità sinaptica o in risposta alla perturbazione della funzione sinaptica. L'assorbimento dell'anticorpo studiando Synaptotagmin-1 (Syt1) fornisce il metodo di misurazione della quantità di riciclaggio SV. Syt1 è una SV-collegata della proteina che agisce come un sensore di Ca2 + ed è necessario per il rilascio esocitotico di neurotrasmettitore1,2. È una proteina transmembrana con un dominio citoplasmico del C-terminale fuori la SV e un dominio luminale del N-terminale all'interno delle SV3. Durante l'esocitosi, il dominio luminale di Syt1 diventa esposte al mezzo esterno. A questo mezzo esterno, aggiungiamo gli anticorpi diretti contro il dominio citoplasmatico, che diventa interiorizzato durante endocitosi. Questi anticorpi possono essere che sia pre-coniugato con fluorofori o immunostained con anticorpi secondari4,5,6,7. L'intensità di fluorescenza del immunosignal risultante è proporzionale alla quantità di riciclaggio SV. Questo approccio può essere utilizzato per determinare sia costitutiva e indotto da depolarizzazione SV riciclaggio6,8.
Saggi di Syt1 l'assorbimento possono essere eseguite dopo virus-mediata del gene transfer a virtualmente tutte le cellule nel piatto o dopo trasfezione sparse di un piccolo numero di cellule. Il nostro metodo combina il dosaggio con doppia sparsa transfezione dei neuroni hippocampal primari con fosfato di calcio9. Usiamo una proteina ricombinante marcatore conosciuta ad accumularsi in presynapses, lo Synaptophysin fluorescente contrassegnato, per individuare i terminali presinaptici e overexpress nostra proteina d'interesse, Rogdi. Questo ci permette di testare o meno Rogdi obiettivi funzionali sinapsi e colpisce SV riciclaggio. Il gene che codifica per Rogdi originalmente è stato identificato in una schermata per mutanti Drosophila caratterizzate da indebolimento della memoria10. Nell'uomo, le mutazioni nel gene Rogdi provocare una rara e devastante malattia chiamata sindrome di Kohlschütter-Tönz. I pazienti soffrono di malformazioni dello smalto dentale, Sturm epilessia e ritardo psicomotorio; Tuttavia, la localizzazione subcellulare del prodotto del gene è rimasto inafferrabile11. Così, l'analisi di assorbimento Syt1 fornito la prova chiave per la localizzazione di GFP-etichettato Rogdi alle sinapsi funzionali9.
Questa tecnica di assorbimento ha diversi vantaggi. In primo luogo, SV riciclaggio possa essere osservato sia in tempo reale eseguendo dal vivo imaging7,12e dopo fissazione6,9 misurando l'intensità della fluorescenza dell'etichetta Syt1 fluorescenza. Inoltre, sono state sviluppate diverse varianti di anticorpo Syt1. Esistono varianti senza tag che possono essere etichettati con un anticorpo secondario seguendo un protocollo standard immunostaining dopo la fissazione e varianti pre-coniugati con un'etichetta di fluorescenza già fissata. Infine, anticorpo-basato fluorescenza è vantaggioso dovuto la vasta selezione di coloranti secondari o coniugati commercialmente disponibile che può essere utilizzato.
Quando fissaggio e immunostaining i neuroni, è anche possibile macchiare per altre proteine ed eseguire analisi di colocalizzazione. Questo può aiutare a determinare dove si trovano in relazione riciclaggio SVs. L'intensità dell'etichetta fluorescenza è la misura diretta della quantità di SV riciclaggio. Inoltre, gli anticorpi etichetta selettivamente strutture contenenti Syt1, con conseguente elevata specificità e piccolo sfondo fluorescenza4. Protocolli di stimolazione differenti possono essere utilizzati, ad esempio buffer di depolarizzazione o stimolazione elettrica protocolli9,12,13,14. Tuttavia, riciclaggio di SV basale può essere misurata senza stimolare le colture neuronali15.
Il nostro metodo affronta specificamente l'assorbimento dell'anticorpo Syt1 nei neuroni double-trasfettate con anticorpo secondario immunolabeling dopo la fissazione. Tuttavia, ci riferiamo a tutte le varianti ordinariamente usate del dosaggio nella nostra discussione di dare agli spettatori l'opportunità di adattare il protocollo alle esigenze specifiche.
Protocollo
Non con gli animali vivi sono stati condotti studi. Gli esperimenti che coinvolgono animali eutanasizzati per ottenere cell culture sono state approvate dalle autorità locali di protezione animale (Tierschutzkommission der Universitätsmedizin Göttingen) sotto l'approvazione numero T10/30. Gli esperimenti sono stati condotti con i protocolli approvati.
1. primario delle cellule ippocampali cultura
- Preparare la coltura delle cellule dissociate di ippocampo del ratto del giorno embrionale 1916,17. Le cellule sulle lamelle di 12 mm rivestite con polyethyleneimine (PEI) a 24 pozzetti piatti ad una densità di 50.000-60.000 cellule/pozzetto della piastra. Controllare la densità utilizzando una cella ottica di contrasto di fase e camera di conteggio.
- I neuroni della coltura per 3 giorni (giorno in vitro (DIV) 3) in una piastra a 24 pozzetti nell'incubatore a 37 ° C con 5% CO2.
- Valutare i coprioggetti per indicatori di salute delle cellule usando la microscopia chiara trasmessa (ad es., fase ottica contrasto ad un ingrandimento di 10-20 X). Verifica per i seguenti indicatori di buona salute: un alone di contrasto di fase chiara, neurites senza strutture in rilievo e nessun soma clustering o neurite impacchettato.
2. transfezione
Nota: Il seguente protocollo si riferisce a una doppio di transfezione per 3 pozzi. Tuttavia, il protocollo funziona meglio quando gli importi sufficienti per 4 pozzetti sono preparati.
- Preparare 500 mL di buffer di transfezione (274 mM NaCl, 10 mM KCl, 1,4 mM Na2HPO4, glucosio di 15 mM, 42 mM HEPES) in un matraccio di Erlenmeyer.
- Sciogliere 8,0 g di NaCl, 0,37 g di KCl, 0,095 g di Na2HPO4, 1,35 g di glucosio e 5,0 g di HEPES in 400 mL di acqua distillata in un matraccio di Erlenmeyer.
- Regolare il pH a 6,95 con 1 M NaOH utilizzando un pH-metro.
- Regolare il volume con acqua distillata a 500 mL e controllare il pH utilizzando un pH-metro.
- Rendere le aliquote di 20-30 mL di buffer di transfezione con i seguenti valori di pH di pipettaggio 1 M NaOH al buffer di transfezione: 6,96, 6,97, 6,98, 6,99, 7.00, 7.01, 7.02, 7,03, 7.04, 7.05, 7,06, 7,07, 7,08, 7,09, 7.11.
Nota: Il pH del tampone transfezione è cruciale per l'efficacia di transfezione. - Per verificare che conduce di buffer di transfezione per il maggior numero di cellule trasfettate, test ogni valore pH da 6,96 a 7.11. Utilizzare il metodo di transfezione descritto in 2.2-2.11 e un plasmide convalidato che esprimono GFP. Determinare il numero di cellule trasfettate per vetrino coprioggetto per ogni valore di pH del tampone di transfezione valutare quali buffer funziona meglio.
- Aliquotare il buffer con la massima efficienza di trasfezione in provette microcentrifuga 2 mL congelare e conservare i capillari a-20 ° C.
- Pre-riscaldare il siero ridotto medie, mezzo di coltura cellulare e acqua distillata a 37 ° C nel bagno d'acqua.
- Preparare la miscela di transfezione in una microcentrifuga da 1,5 mL. Lavorare sotto la cappa a flusso laminare per garantire condizioni di lavoro sterile.
- Mix 7,5 µ l di cloruro di calcio di 2 M con 4 µ g di ogni DNA privo di endotossina (Synaptophysin-mOrange ed EGFP/GFP-Rogdi). Aggiungere acqua per raggiungere un volume totale di 60 mL in una provetta da microcentrifuga da 1,5 mL.
- Aggiungere 60 mL di buffer di transfezione al mix. Per ottenere i migliori risultati, aggiungere goccia a goccia il buffer di transfezione agitando delicatamente il DNA-mix il vortice.
- Incubare a temperatura ambiente (TA) per 20 minuti. Evitare di scuotere il tubo di incubazione durante il periodo di incubazione di posizionamento del tubo a fianco della cappa a flusso laminare.
- Sotto la cappa a flusso laminare, rimuovere il terreno di coltura cellulare ("medium condizionato") dai pozzi usando una pipetta da 1000 mL e conservarla in un contenitore separato nell'incubatrice.
- Aggiungere 500 mL di mezzo di riduttore del siero in ciascun pozzetto. Incubare le cellule a 37 ° C e 5% CO2 fino a quando il periodo di incubazione di 20 minuti (punto 2.3.3).
- Aggiungere 30 mL di miscela di transfezione in ciascun pozzetto pipettando alcune gocce. Scartare il residuo nella parte inferiore del tubo.
- Dopo tutti i pozzi sono stati forniti con mix di transfezione, agitare delicatamente la piastra a 24 pozzetti per assicurare la distribuzione della miscela transfezione in mezzo.
- Incubare per 60 minuti a 37 ° C e 5% CO2.
- Rimuovere e scartare il mix di transfezione e lavare tre volte con mezzo di coltura cellulare. Aggiungere 1 mL di mezzo di coltura cellulare in ciascun pozzetto e li Incubare per 30 secondi alla RT. rimuovere 750 mL di terreno e aggiungere la stessa quantità di terreno fresco. Ripetere l'operazione tre volte.
Nota: La fase di lavaggio è critica. Tenere il tempo che ciascun pozzetto non ha nessun mezzo minimo (cioè., rimuovere e sostituire ben-di-bene) e aggiungere il supporto di lavare delicatamente. - Rimuovere e scartare il mezzo di coltura cellulare e aggiungere 450 mL della condizionata media ben-di-bene.
- Lasciate che i neuroni maturi nell'incubatore a 37 ° C e 5% di CO2 -10 DIV.
3. la stimolazione e l'assorbimento di Syt1
Nota: Il seguente protocollo riguarda l'assorbimento 3 pozzi. Per depolarizzazione di qualsiasi altro numero di pozzi, regolare di conseguenza gli importi.
- Preparare 50 mL di tampone di depolarizzazione 10 x (640 mM NaCl, 700 mM KCl, 10mm MgCl2, 20mm CaCl2, glucosio di 300 mM, 200 mM HEPES, pH 7.4) in un matraccio di Erlenmeyer.
Nota: Buffer di depolarizzazione può essere conservato a 4 ° C per diverse settimane. Se una soluzione non depolarizzante è utilizzata anche, preparare un 10 soluzione di x Tyrode composta da 1290 mM NaCl, 50 mM KCl, 10mm MgCl2, 20mm CaCl2, 300 mM glucosio, pH di 200 mM HEPES 7.4 al fine di confrontare la stimolazione indotta da riciclo con spontanea riciclaggio. Dopo la diluizione a 1 x, aggiungere 1 µM di tetrodotossina prima dell'uso per bloccare la generazione di potenziali d'azione.- Sciogliere 1,87 g di NaCl, 2,61 g di KCl, 0,1 g di MgCl2-6 H20, 0,15 g di CaCl2-2 H2O e 3,0 g di glucosio-1 H2O e 2,38 g di HEPES in 50 mL di acqua distillata in un matraccio di Erlenmeyer. Regolare il pH con NaOH e filtro sterile la soluzione. Diluire il tampone 01:10 in acqua distillata per ottenere una concentrazione di 1 x.
- Preparare 4% paraformaldeide (PFA) in 1X PBS (pH 7.4) per la fissazione dopo stimolazione.
- Per 500 mL di 4% PFA in PBS 1X, sciogliere 20 g di paraformaldeide in 450 mL di acqua distillata H2O.
Nota: La soluzione di riscaldamento può accelerare la dissoluzione, ma non riscaldare la soluzione oltre i 70 ° C, come il PFA può disintegrarsi.
Attenzione: PFA è tossico, potenzialmente cancerogene e teratogene. Indossare guanti quando si lavora con PFA, lavorare sotto la cappa ed evitare l'ingestione. - Lasciare raffreddare la soluzione a RT e aggiungere 50 mL della soluzione madre PBS di 10 x. Aggiustare il pH a 7.4 con NaOH/HCl utilizzando un pH-metro.
- Per 500 mL di 4% PFA in PBS 1X, sciogliere 20 g di paraformaldeide in 450 mL di acqua distillata H2O.
- Pre-riscaldare 600 mL di tampone di depolarizzazione 1x e 10 mL di terreno di coltura cellulare a 37 ° C nel bagno d'acqua.
- Aggiungere 1 mL di anticorpo di topo anti-Syt1 (clone 604.2) a 1x buffer di depolarizzazione e vortex per 10 secondi.
- Rimuovere e gettare il mezzo di coltura cellulare dalle cellule. Aggiungere 200 mL di miscela depolarizzazione-anticorpo di ogni bene e incubare per 5 minuti a 37 ° C e 5% di CO2 nell'incubatrice.
- Rimuovere e scartare il mix di depolarizzazione-anticorpo e lavare tre volte con mezzo di coltura cellulare. Aggiungere 1 mL di mezzo di coltura cellulare ad ogni pozzetto e incubare per 30 secondi alla RT. rimuovere 750 mL di terreno e aggiungere la stessa quantità di terreno fresco. Ripetere tre volte.
- Rimuovere e scartare il mezzo di coltura cellulare e aggiungere 300 mL di 4% PFA in PBS 1X. Incubare per 20 minuti a 4 ° C.
- Lavare tre volte per 5 minuti ciascuno con PBS 1X.
Nota: Il protocollo può essere messo in pausa qui.
4. immunocitochimica
- Preparare 50 mL di tampone bloccante.
Nota: Blocco buffer può essere mantenuto a-20 ° C per diversi mesi.- Sciogliere 2,5 g di saccarosio e 1 g di albumina di siero bovino (BSA) in 5 mL di soluzione di riserva di PBS x 10. Aggiungere 1,5 mL di soluzione detergente 10%. Mescolare la soluzione fino a quando tutti i componenti siano correttamente sciolti e aggiungere acqua distillata H2O fino a raggiungere un volume finale di 50 mL. Aliquota della soluzione e congelare le aliquote per l'archiviazione.
- Diluire l'anticorpo secondario, accoppiati a fluorophore (diretto contro le specie di Syt1-anticorpo primarie) in 200 mL di tampone bloccante in ciascun pozzetto ad una diluizione di 1: 1000.
- Rimuovere e gettare il PBS 1x da ogni bene contenente un vetrino coprioggetti.
- Aggiungere 200 mL di blocco buffer-anticorpo mix ad ogni pozzetto e incubare per 60 minuti a TA.
Attenzione: Poiché gli anticorpi secondari sono sensibili alla luce, tutti i passi avanti in movimento devono essere eseguiti nel buio. - Dopo l'incubazione, lavare le cellule tre volte per 5 minuti con 1 mL di PBS 1X.
- Incorporare i coprioggetti su vetrini da microscopio con il mezzo di inclusione.
- Aggiungere una goccia di 7 mL di mezzo il vetrino del microscopio di inclusione. Rimuovere il vetrino coprioggetto dalla piastra a 24 pozzetti sollevandolo con una siringa e afferra con una pinza.
Attenzione: Le cellule sulla superficie del coprivetrino sono facilmente danneggiate, pinze devono essere maneggiate con cura. - Immergere il vetrino coprioggetto in acqua distillata per rimuovere il PBS ed asciugarla accuratamente toccando un bordo ad un tessuto morbido.
- Capovolgere il coprioggetto sull'incorporamento gocciolina medio, in modo che affronta la superficie portando le cellule al microscopio, quindi incorporare le cellule nel mezzo di incorporamento.
- Aggiungere una goccia di 7 mL di mezzo il vetrino del microscopio di inclusione. Rimuovere il vetrino coprioggetto dalla piastra a 24 pozzetti sollevandolo con una siringa e afferra con una pinza.
- Lasciare le diapositive ad asciugare sotto il cofano per 1-2 h (coprirli per evitare l'esposizione alla luce) e memorizzarli in una casella di scorrimento microscopio a 4 ° C.
Nota: Il protocollo può essere messo in pausa qui.
5. analisi microscopica
- Dopo asciugare i vetrini coprioggetti, metterli sotto il microscopio con l'obiettivo e la fotocamera.
- Regolare il tempo di esposizione per ogni canale in modo che alcuni pixel sono sovraesposte per assicurare la massima distribuzione dei valori di grigio.
Nota: Mentre il tempo di esposizione può variare tra i canali, dovrebbe essere costante per un unico canale garantire la comparabilità tra i coprioggetti. - Acquisizione di immagini multi-canale per 10 regioni di interesse (ROI) per vetrino coprioggetti. Controllare che il ROI contiene axonal processi da un neurone trasfettato controllando la fluorescenza di GFP, che dovrebbe essere punctate.
6. elaborazione statistica
- Esportare le immagini come file. TIF. Caricare le immagini in OpenView18 facendo clic su File | Carica il file immagine.
- Scegliere l'immagine di Synaptophysin-mOrange come canale 1, l'immagine di Rogdi-GFP/EGFP come canale 2 e l'immagine di fluorescenza Alexa647 come canale 3.
- Soglia la ROIs.
- Fare clic su analisi | Zona posto sopra puncta. Scegliere i valori di soglia e Delta intensità in modo che all'ispezione visiva, fluorescenza diffusa è esclusa, lasciando solo punctati segnali nell'immagine del canale 1 (che rappresentano lo Synaptophysin-mOrange fluorescenza). Mantenere la stessa soglia di tutte le immagini.
- Facendo clic su Esegui ora, trasferire questi ROIs al corrispondente canale 2 (fluorescenza GFP-Rogdi/EGFP) e 3 (Syt1-fluorescenza) di ciascuna area del vetrino coprioggetti.
Nota: Il ROIs deve essere considerato solo se la cella è doppio-transfettate. In questo metodo, mOrange - e GFP-fluorescenza dovrebbero essere chiaramente visibile. - Salvare i dati nell'editor del registro di analisi facendo clic su dati di Log.
- Aprire l'editor del registro di analisi sotto la scheda di Windows e copiare i valori per ciascun canale. Incollare i valori per i canali separati in un foglio di calcolo.
- Determinare l'intensità di fluorescenza media del Syt1-canale presso il ROIs in entrambe le condizioni di transfezione (GFP-Rogdi ed EGFP).
- Applicare appropriati test statistici quali di Student t-test per determinare le differenze significative.
Risultati
Un risultato atteso di questo approccio è l'individuazione dei circa 50 neuroni trasfettate con doppio al vetrino coprioggetti ad una densità di 50.000 neuroni per pozzetto. L'assone di ogni neurone dovrebbe mostrare più hotspot di etichetta fluorescente Synaptophysin accumulo, che indica i cluster ofSVs. A siti presinaptici funzionali, il segnale lo Synaptophysin ricombinante colocalizza con punctate Syt1 fluorescenza. Verrà co-espressi con ricombinante Synaptophysin mediante transfezione doppia, GFP-Rogdi come la proteina di interesse (Figura 1) o EGFP come il controllo.
In questo esperimento, analizziamo SV riciclaggio presso siti presinaptici nei neuroni che esprimono GFP-Rogdi o EGFP. Se la proteina di controllo, EGFP, è distribuita in modo omogeneo in tutta la cellula intera, ma la sua influenza presso siti sinaptici deve ancora essere studiato, quindi è necessario co-transfect una seconda proteina presynaptically arricchito, etichetta fluorescente Synaptophysin.
Come descritto in precedenza, le cellule subiscono rilascio indotto da depolarizzazione del trasmettitore. Di conseguenza, sinapsi funzionali occupano gli anticorpi Syt1 aggiunti al medium. Dopo immunolabeling il Syt1 anticorpo con un anticorpo secondario fluorescente identificato, l'entità dell'assorbimento di Syt1 infine è quantificato utilizzando il immunosignal (Figura 2).
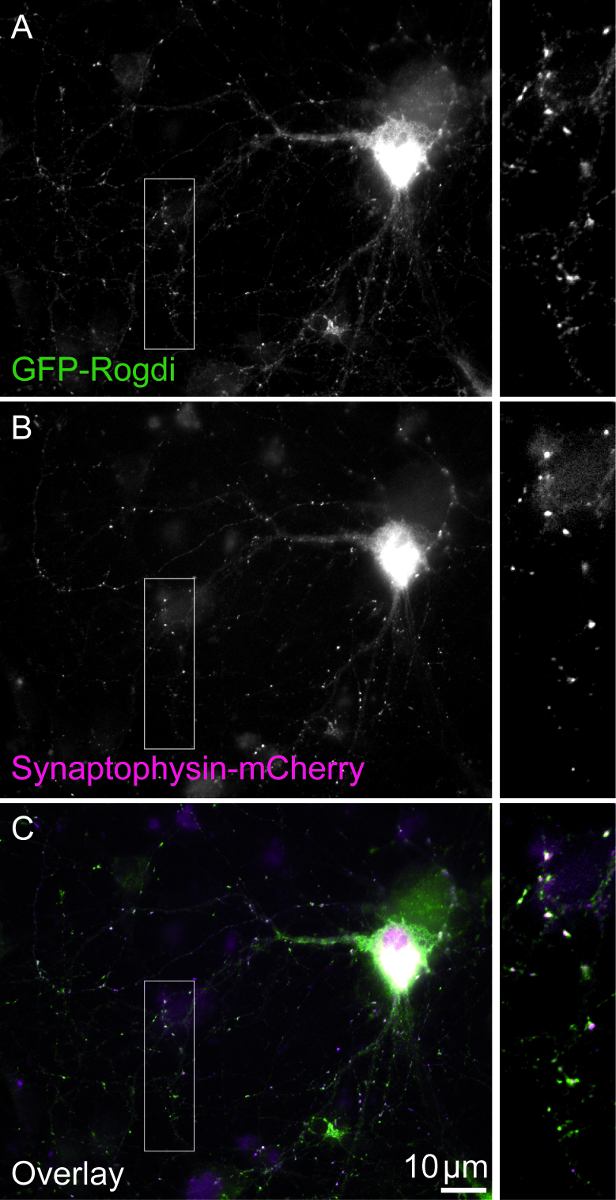
Figura 1. Matrimoniale-transfettate cellule. Il campo visivo mostra una cella doppia-transfettate che esprimono GFP-Rogdi (A) e lo Synaptophysin-mCherry (B). Lo synaptophysin è una proteina delle vescicole sinaptiche abbondanti. Sua variante ricombinante può essere utilizzato per le etichette dei boutons sinaptici. Il modello di localizzazione di GFP-Rogdi è simile a quello di Synaptophysin-mCherry (C). Barre di scala = 10 μm. Scatole Visualizza ingrandimento 2,5 X. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2. GFP-Rogdi alle sinapsi funzionali. L'assorbimento di Syt1 dal vivo è stata eseguita in cellule trasfettate con doppio esprimere EGFP (verde) e la sinaptofisina-mOrange (rosso; A-D) o GFP-Rogdi (verde) e lo Synaptophysin-mOrange (rosso; E-H). L'assorbimento di anticorpo Syt1 è stato effettuato usando un anticorpo monoclonale di topo diretto contro il dominio luminale di Syt1. Dopo la fissazione di PFA, le cellule sono state macchiate con anticorpo di coniglio anti-GFP. Anticorpi secondari (anti-coniglio Alexa 488 e anti-topo Alexa 647) sono stati aggiunti per rilevare GFP o GFP-Rogdi e Syt1, rispettivamente. Autofluorescenza di Synaptophysin-mOrange sia usato per rilevare terminali presinaptici (B e F). Punctate Syt1 immunofluorescenza indica siti della vescichetta riciclaggio (blu; C e G). Si noti che la maggior parte delle sinapsi Syt1-labeled è localizzata ai neuroni non trasfettate. GFP-Rogdi è stata mirata alle sinapsi attive e non cambia (I) di riciclaggio delle vescicole sinaptiche. 3 cultura indipendente esperimenti sono stati eseguiti (N = 3). Almeno 3 lamelle da ogni cultura (Totale 10) sono state utilizzate per l'analisi. Infine, sono stati analizzati 3 aree al vetrino coprioggetti (n = 30). Dello studente t-test ha mostrato alcuna differenza significativa. Barre di scala = 10 μm. Barre di errore rappresentano l'errore standard della media (s.e.m.). "N.s." non indica alcun significato. Questa figura è stata modificata da Riemann et al. 9 Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Ci sono tre saggi abitualmente utilizzati per lo studio delle vescicole sinaptiche (SV) riciclaggio. I primi due includono l'uso di un) styryl fluorescente tinture ad esempio FM1-43 (che incorporano nelle membrane, sono presi in organelli durante endocitosi e vengono rilasciati dopo l'esocitosi); e b) etichetta fluorescente proteine ricombinanti SV (che, al momento sovraespressione, incorporano i macchinari riciclaggio proteinico). Se i fluorophores allegata cambiare loro fluorescenza a seconda del pH, essi utilizzabile per monitorare i cambiamenti tra l'interno acida di un SV e il pH del mezzo extracellulare. Le proteine ricombinanti taggate con una variante di pH sensibili di GFP sono chiamate Phluorins. I due dosaggi discussi sono stati entrambi caratterizzato precedentemente19,20, e i pro e i contro di ciascuno è stati anche ha commentato21.
Qui, descriviamo una terza, metodo ben consolidato4,5,6,7,9,14. Per testare SV riciclaggio, approfittiamo del fatto che il dominio luminale di vescicola-collegata della proteina Synaptotagmin-1 (Syt1) diventa esposto alla superficie delle cellule al momento di esocitosi. In primo luogo, si aggiunge un anticorpo diretto contro il dominio luminale al terreno di coltura, che è poi ripreso dalla vescicola durante il riciclaggio di SV. Questo assorbimento di anticorpo è visualizzato e quantificato dall'immunofluorescenza. In alternativa, può essere utilizzato un anticorpo Syt1 marcato direttamente. L'etichetta può essere indipendente dal pH, localizzazione del Syt1-anticorpo sia all'interno che sulla superficie esterna della SVs, o pH-dipendente, segnalazione di localizzazione basato su modifiche di fluorescenza di segnalazione. Descriviamo anche la combinazione di questo test di riciclaggio SV con doppia transfezione di neuroni in coltura per testare o meno una proteina di obiettivi di interesse, GFP-Rogdi, funzionale sinapsi e colpisce SV riciclaggio. GFP-Rogdi è specifico di tale approccio; Tuttavia, le stesse domande possono essere indirizzate per alcuna proteina di interesse.
Questo test è stato introdotto nel 1992 per monitorare il riciclaggio spontanea di SVs4 e più ulteriormente è stato sviluppato dallo stesso gruppo per monitorare evocati SV riciclaggio12. I loro esperimenti stabilito che l'assorbimento Syt1 è sensibile alle neurotossine clostridiali, che bloccano SV esocitosi12. Essi hanno inoltre mostrato che la stimolazione delle culture di depolarizzazione a 37 ° C aumenta l'interiorizzazione di anticorpi Syt1 rispetto al 1) culture che si sono tenute sul ghiaccio, che impedisce la maggior parte endocitosi e 2) culture incubate a 37 ° C senza stimolazione, che per il riciclaggio spontanea ma non evocano riciclaggio12,22. Il dosaggio può facilmente confrontare SV riciclaggio tra due condizioni, come ad esempio con e senza una molecola di interesse. In particolare, questo protocollo è centrato sul confronto tra l'assorbimento dell'anticorpo Syt1 nella presenza contro l'assenza di una certa proteina overexpressed. Il protocollo può essere ampliato se i contributi relativi di superficie-associazione, spontanea di riciclaggio e riciclaggio evocati devono essere valutati. Ad esempio, incubando i neuroni sul ghiaccio senza stimolazione impedisce endocitosi, rivelando qualsiasi superficie legame dell'anticorpo Syt1. Incubando i neuroni a 37 ° C in soluzione basale con tetrodotossina impedisce la propagazione del potenziale d'azione, rivelare qualsiasi riciclaggio spontanea. Così, neuroni incubazione a 37 ° C sotto stimolante condizioni può rivelano la portata del riciclo SV evocati.
Cellule vive sono sensibili alle condizioni fisiologiche ideali; Pertanto, la manutenzione, la transfezione e depolarizzazione buffer devono essere testati sempre per parametri fisiologici tra cui pH e temperatura. Mentre depolarizzazione buffer può essere passato attraverso i filtri sterili dopo il pH è stato aggiustato, buffer di transfezione sono sensibili alla filtrazione sterile. Di conseguenza, abbiamo regolare il suo pH, tenerlo congelato fino all'utilizzo e girarla in una centrifuga di tavolo a pellet eventuali batteri. Per la transfezione, è vitale per mescolare il buffer adeguatamente per garantire associazione del plasmide con i cristalli di fosfato di calcio. Transfezione del fosfato di calcio funziona meglio su giorno in vitro (DIV) 2-4. Usiamo lo Synaptophysin taggato, una proteina transmembrana di SV, come marcatore per identificare i terminali presinaptici nei neuroni trasfettati. Utilizzabile anche con tag versioni di altre proteine SV come SV2, sinapsina e VAMP/sinaptobrevina o zona attiva molecole come fagotto, RIM, Munc13-1 e CAST.
MCherry sia mOrange emettono fluorescenza rossa. Anche se mCherry è più mOrange luminoso, ha una maggiore emissione alle lunghezze d'onda lunghe rispetto mOrange. Pertanto, per l'imaging di fluorescenza triple con GFP, una tintura rossa e un colorante che emettono nell'intervallo 700 nm, mOrange è un'opzione migliore mCherry. Per doppia fluorescenza con GFP e un colorante rosso, mCherry potrebbe essere favorevole, dal momento che è il colorante più luminoso. Per garantire la transfezione di tipo sparsa, il mix di transfezione non vanno incubato per più di 60 minuti. È anche importante che l'incubazione in un buffer di depolarizzazione è la lunghezza giusta del tempo affinché l'esocitosi delle vescicole tutti. Tuttavia, deve essere evitata l'esposizione prolungata al buffer di depolarizzazione. Durante l'acquisizione di immagini, è anche essenziale per applicare la stessa tempi di esposizione e intensità di luce affinché quantificabile confronto tra differenti set di esperimenti.
Infine, durante l'analisi di immagine, il nostro protocollo include diverse considerazioni. Per un'area di interesse mostrando ricombinante Synaptophysin puncta, la soglia di basso-intensità è impostata affinché fluorescenza diffusa è escluso. Successivamente, questa soglia è testata su altre aree e vetrini coprioggetto per osservare simile inclusione dei segnali punctati ed esclusione della fluorescenza diffusa. Una volta identificata una soglia appropriata, viene applicato a tutte le immagini, producendo punctate regioni di interesse (ROI) nel canale lo Synaptophysin (etichettato come mCherry o mOrange) ricombinante. Infine, Syt1 intensità è determinato per il ROIs9.
Il nostro approccio è ottimizzato per la transfezione di tipo sparsa. Analizziamo la funzione presinaptica in un'impostazione complessa dove c'è SV riciclaggio negli assoni dei neuroni trasfettati circondati da neuroni untransfected. In questo assetto, doppio-transfezione permette di manipolare la funzione di un neurone e individuare i terminali presinaptici dei neuroni trasfettati. Trasfettati neuroni presinaptici che contattare untransfected neuroni postsinaptici è un fattore importante per valutare gli effetti di un neurone presinaptico sul riciclaggio delle SV. L'impostazione può anche essere facilmente adattato per testare se o non una manipolazione postsinaptica provoca cambiamenti presinaptici. In questo caso, Rada transfezione dei neuroni con una proteina che si rivolge ai siti postsinaptiche localizzerà i siti post-sinaptici dei neuroni trasfettati e Syt1 l'assorbimento può essere determinato in boutons sinaptici di neuroni untransfected.
Quando Rada transfezione non è necessaria, protocolli di transfezione differenti possono essere applicati. Ad esempio, trasfezione con Lipofectamine il DIV 7 - 8 risultati in tassi più elevati di transfezione, ma comporta anche l'espressione più forte in ogni cellulari trasfettate9. Inoltre, trasduzione virale possa determinare nell'espressione in quasi il 100% di neuroni coltivati14,23,24. Negli esperimenti finalizzati al monitoraggio SV riciclaggio, transfezione può essere eseguita per una singola proteina o lasciata fuori completamente. Ad esempio, quando nel complesso sinaptica riciclaggio viene confrontato tra neuroni da wildtype e geneticamente topi, etichettatura di singoli neuroni di transfezione non sono necessari. Inoltre, in questo modo immunolabeling di proteine endogene. Se non riesce la transfezione, è importante testare il buffer di transfezione con un plasmide convalidato o utilizzare un tampone con un pH differente (Vedi preparazione del buffer di transfezione). Preparazioni di DNA libero di endotossina anche sembra essere cruciale. Immunostaining interiorizzato Syt1 opere di anticorpi in campioni sia PFA-fisso e fisso di metanolo. Si deve anche osservare che autofluorescence GFP e RFP è perso dopo la fissazione di metanolo. Se GFP o RFP devono essere localizzati in cellule fissate in metanolo, queste proteine devono essere immunolabeled. In caso di assorbimento di Syt1, depolarizzazione tempo e concentrazione di K+ nel buffer di depolarizzazione dovrebbe essere modificati di conseguenza. Molte varianti di protocollo sono stati pubblicati, con depolarizzazione tempi che vanno da 90 s25 a 60 min12e con concentrazioni di K+ di 45 mM, 50 mM, 70 mM e 110 mM6,25,26 ,27. Quando attività ricorrente deve essere evitata, bloccanti del recettore del glutammato possono essere aggiunto anche durante la depolarizzazione. Infine, mentre alta K+ depolarizzazione è pensata per essere lo stimolo più forte, può indurre i potenziali di azione SV riciclaggio attraverso più stimoli fisiologici22,28. Le differenze nell'efficacia di assorbimento dell'anticorpo Syt1 potrebbero verificarsi nelle culture di ratto e topo. Nel nostro metodo, il clone di anticorpo monoclonale murino anti-Syt1 604.2 (RRID:AB_993036) produce più forte colorazione nelle colture del ratto rispetto nelle culture del mouse, mentre l'anticorpo di anti-Syt1 policlonali di coniglio (RRID:AB_11042457) produce una colorazione più forte nelle culture del mouse, ma diverse note di cautela sono discussi di seguito.
Diversi aspetti riguardanti l'uso di anticorpi anti-Synaptotagmin per l'assorbimento in SVs dovrebbero essere considerati. In primo luogo, N-glicosilazione dell'asparagina 24 di Syt1 promuove l'assorbimento endocitosi della proteina29,30. Asparagina 24 rientra il dominio luminale di Syt1. Gli anticorpi di topo e coniglio che usiamo sono diretti contro gli aminoacidi 1-12 e 1-8, rispettivamente, di Syt1. Mentre loro epitopi non si sovrappongono con il sito di N-glicosilazione, sterico o, al contrario, un'induzione dell'assorbimento di grippaggio dell'anticorpo non può essere escluso. Mutazione del sito N-glicosilazione in Syt1 non modifica la cinetica dell'endocitosi e il targeting di Syt1 a SVs. Aumenta la frazione di Syt1 rimanendo sulla superficie esterna della membrana plasmatica quando endocitosi sono indotto da stimoli deboli. Quando forti stimoli, quali alta depolarizzazione K+ , vengono applicati, nessuna riduzione in Syt1-uptake è osservata30. Nel complesso, se gli anticorpi interferirono con il sito di N-glicosilazione in qualche modo potrebbero causare un cambiamento nell'endocitosi SV rispetto alle condizioni dell'anticorpo-libero, ma questo cambiamento dovrebbe essere simile per l'esperimento (nel nostro caso la sovraespressione di GFP-Rogdi) e il controllo (nel nostro caso l'espressione della GFP). Inoltre, gli anticorpi policlonali potrebbero essere più probabili indurre problemi di ingombro sterici e reticolazione di anticorpi monoclonali, perché un maggior numero di copia di anticorpi si lega all'epitopo. Non sono a conoscenza di studi sistematici confrontando gli anticorpi disponibili con a vicenda; Tuttavia, alcuni studi hanno affrontato la validità di alcuni anticorpi. Ad esempio, quando cinetica riciclaggio SV sono stati sondati utilizzando il clone di anticorpo monoclonale murino anti-Syt1 604.2 e modifiche Synaptophluorin-fluorescenza in un confronto diretto, risultati simili sono stati ottenuti, convalida l'uso di questo anticorpo28. SVs di caricamento con Syt1 anticorpi policlonali di coniglio e registrazione trasmissione sinaptica electrophysiologically ha rivelato che le sinapsi caricate avevano ridotto la trasmissione sinaptica in un modo che ricordano di perdita-de-funzione mutanti di Syt1. Di conseguenza, questi anticorpi policlonali influenzano la trasmissione sinaptica. L'assorbimento effettivo ha rivelato sia spontaneo ed evocato riciclaggio, suggerendo che un anticorpo policlonale è adatto per monitorare un giro di riciclaggio di SV, ma deve usare cautela nell'interpretazione dei risultati dopo l'assorbimento di questi anticorpi31.
Tre saggi sono abitualmente utilizzati per studiare SV riciclaggio, tra cui membrana etichettatura con styryl coloranti, sovraespressione di Phluorins, e l'assorbimento di Syt1-anticorpo eseguita qui. Tutti i tre saggi possono essere utilizzati per determinare gambe endocitosi ed esocitosi del riciclo di SV. Mentre tutti e tre i saggi hanno potenti benefici, ognuno ha anche un avvertimento di principio. FM coloranti etichettare la superficie intera cella e sono presi nella cella con tutte le membrane di riciclaggio. PHluorins deve essere introdotto da sovraespressione. Syt1-anticorpi etichettare la proteina endogena, ma alcuni anticorpi possono influenzare la sua funzione in determinate condizioni. Ogni avvertimento può, tuttavia, essere adeguatamente affrontato21.
Nel complesso, l'analisi di assorbimento dell'anticorpo Syt1 ha servito diversi scopi. In primo luogo, è stato usato per etichettare in modo selettivo SVs che subiscono spontanei o evocati riciclaggio, rispettivamente di28,31,32,33. In secondo luogo, è stato usato per determinare l'effetto di un farmaco o una proteina, sull'entità della SV riciclaggio; per esempio, per mostrare che il BDNF migliora sia spontaneo ed evocato SV riciclaggio6. In terzo luogo, esso è stato utilizzato per determinare il numero delle sinapsi con riciclaggio SVs come percentuale del numero totale di sinapsi morfologicamente definiti34,35. Ciò ha rivelato che sovraesprimono la molecola di adesione delle cellule postsinaptiche Neuroligin-1 aumenta la percentuale delle sinapsi con riciclaggio SVs25 e che riducendo l'espressione dei recettori del glutammato di tipo AMPA diminuisce la percentuale di sinapsi con riciclaggio SVs, aumentando la percentuale di sinapsi presynaptically silenzioso36. Inoltre, l'analisi è stata usata per analizzare la mobilità dei coniugati SVs27 e per determinare la localizzazione di Syt1 utilizzando nanoscopia13,22,33. Infine, questo metodo è ancora utilizzato per verificare o meno determinate proteine si localizzano sinapsi funzionali9. L'anticorpo di Syt1 può anche essere utilizzato per studi a lungo termine, dove l'anticorpo rimane nei neuroni per giorni che seguono l'assorbimento37. Questo può essere abbinato un secondo ciclo di assorbimento utilizzando un anticorpo Syt1 separatamente marcato o un anticorpo diretto contro il dominio luminale di un'altra proteina SV. Questo consente di testare di cui SVs riciclato inizialmente e che riciclare entro la fine di un esperimento. Sarebbe interessante adattare questo test a più sistemi di modello intatto, come fettine acute e colture organotipiche fetta. In linea di principio, l'analisi di assorbimento permette il confronto del tessuto da wildtype e geneticamente animali modificati oppure possono essere combinato con consegna virale o biolistics, vale a dire., una "pistola del gene", di manipolare l'espressione della proteina in questi sistemi modello. In tali sistemi, l'influenza di alcune perturbazioni sui macchinari presinaptici, monitorati da analisi di assorbimento e dinamiche di rete possa essere studiato simultaneamente.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Ringraziamo Irmgard Weiss per assistenza tecnica. Questo lavoro è stato supportato dal DFG tramite il Cluster di eccellenza per la microscopia a campo del nanometro e fisiologia molecolare del cervello (CNMPB, B1-7, a T.D.).
Materiali
| Name | Company | Catalog Number | Comments |
| B27 | Gibco | 17504-044 | |
| BSA | Sigma | A7030-50g | |
| CaCl2 | Sigma-Aldrich | C3306-100g | |
| CoolSNAP HQ2 | Photometrics | ||
| dH2O | Invitrogen | 15230 | |
| DABCO | Merck | 8.03456.0100 | |
| donkey anti mouse Alexa 647 | Jackson-Immunoresearch | 715605151 | antibody |
| DMEM | Invitrogen | 41966 | |
| DPBS | Gibco | 14190 | |
| Eppendorf tubes | Eppendorf | 30120094 | |
| multiwell 24 well | Fisher Scientific | 087721H | |
| tube (50 mL) | Greiner Bio-One | 227261 | |
| FBS superior | BiochromAG | S0615 | |
| Glucose | Merck | 1,083,421,000 | |
| HBSS | Invitrogen | 14170 | |
| HEPES | Sigma | H4034-500g | |
| Hera Cell 150 (Inkubator) | ThermoElectron Corporation | ||
| KCL | Sigma-Aldrich | P9541-500g | |
| L-Glutamin | Gibco | 25030 | |
| MgCl2 | Honeywell | M0250-500g | |
| microscope slides | Fisher Scientific | 10144633CF | |
| Microsoft Excel | Microsoft | ||
| Mowiol4-88 | Calbiochem | 475904 | |
| NaCl | BioFroxx | 1394KG001 | |
| Na2HPO4 | BioFroxx | 5155KG001 | |
| Neurobasal | Invitrogen | 21103049 | |
| OpenView Experiment Analysis Application | Free software, see comments | written by Noam E. Ziv, Technion – Israel Institute of Technology, Haifa, Israel | |
| PBS (10x) | Roche | 11666789001 | |
| Optimem | Invitrogen | 31985 | |
| Penstrep | Gibco | 15140-122 | |
| PFA | Sigma | P6148-1kg | |
| safety hood | ThermoElectron | Serial No. 40649111 | |
| Sucrose | neoFroxx | 1104kg001 | |
| Synaptotagmin1 | Synaptic Systems | 105311 | mouse monoclonal; clone 604.2 |
| Triton X-100 | Merck | 1,086,031,000 | |
| Vortex Genius 3 | IKA | 3340001 | |
| Water bath | GFL | 1004 | |
| Zeiss Observer. Z1 | Zeiss |
Riferimenti
- Koh, T., Bellen, H. J. Synaptotagmin I, a Ca2+ sensor for neurotransmitter release. Trends in Neurosciences. 26, 413-422 (2003).
- Chapman, E. R. How Does Synaptotagmin Trigger Neurotransmitter Release. Annual Review of Biochemistry. 77, 615-641 (2008).
- Perin, M. S., et al. Structural and Functional Conservation of Synaptotagmin (p65) in Drosophila and Humans. Journal of Biological Chemistry. 266, 615-622 (1991).
- Matteoli, M., Takei, K., Perrin, M. S., Südhof, T. C., De Camilli, P. Exo-endocytotic Recycling of Synaptic Vesicles in Developing Processes of Cultured Hippocampal Neurons. Journal of Cell Biology. 117, 849-861 (1992).
- Ko, J., et al. Neuroligin-1 performs neurexin-dependent and neurexin-independent functions in synapse validation. The EMBO Journal. 28, 3244-3255 (2009).
- Shinoda, Y., et al. BDNF enhances spontaneous and activity-dependent neurotransmitter release at excitatory terminals but not at inhibitory terminals in hippocampal neurons. Frontiers in Synaptic Neuroscience. 6, 27 (2014).
- Ivanova, D., et al. Synaptic activity controls localization and function of CtBP 1 via binding to Bassoon and Piccolo. The EMBO Journal. 34, 1056-1077 (2015).
- Crawford, D. C., Ramirez, D. M. O., Trauterman, B., Monteggia, L. M., Kavalali, E. T. Selective molecular impairment of spontaneous neurotransmission modulates synaptic efficacy. Nature Communications. 8, 1-14 (2017).
- Riemann, D., Wallrafen, R., Dresbach, T. The Kohlschütter-Tönz syndrome associated gene Rogdi encodes a novel presynaptic protein. Scientific Reports. 7, (2017).
- Kim, M., et al. Rogdi Defines GABAergic Control of a Wake-promoting Dopaminergic Pathway to Sustain Sleep in Drosophila. Scientific Reports. 7, 1-14 (2017).
- Schossig, A., Wolf, N. I., Kapferer, I., Kohlschütter, A., Zschocke, J. Epileptic encephalopathy and amelogenesis imperfecta: Kohlschütter-Tönz syndrome. Euopean Journal of Medical Genetics. 55, 319-322 (2012).
- Kraszewski, K., et al. Synaptic Vesicle Dynamics in Living Cultured Hippocampal Neurons Visualized with CY3-Conjugated Antibodies Directed against the Lumenal Domain of Synaptotagmin. Journal of Neuroscience. 15, 4328-4342 (1995).
- Willig, K. I., Rizzoli, S. O., Westphal, V., Jahn, R., Hell, S. W. STED microscopy reveals that synaptotagmin remains clustered after synaptic vesicle exocytosis. Nature. 440, 935-939 (2006).
- Petkova, A., Goedecke, N., Korte, M., Dresbach, T. Neuroligins mediate presynaptic maturation through brain-derived neurotrophic factor signaling. bioRxiv. , 262246 (2018).
- Fuchs, C., et al. GABA(A) receptors can initiate the formation of functional inhibitory GABAergic synapses. European Journal of Neuroscience. 38, 3146-3158 (2013).
- Dresbach, T., et al. Functional regions of the presynaptic cytomatrix protein Bassoon: Significance for synaptic targeting and cytomatrix anchoring. Molecular and Cellular Neuroscience. 23, 279-291 (2003).
- Seibenhener, M. L., Wooten, M. W. Isolation and Culture of Hippocampal Neurons from Prenatal Mice. Journal of Visualized Experiments. (65), 4-9 (2012).
- Tsuriel, S., et al. Local sharing as a predominant determinant of synaptic matrix molecular dynamics. PLOS Biology. 4, 1572-1587 (2006).
- Iwabuchi, S., Kakazu, Y., Koh, J., Goodman, K. M., Harata, N. C. Examination of Synaptic Vesicle Recycling Using FM Dyes During Evoked, Spontaneous, and Miniature Synaptic Activities. Journal of Visualized Experiments. (85), 1-10 (2014).
- Villarreal, S., Lee, S. H., Wu, L. Measuring Synaptic Vesicle Endocytosis in Cultured Hippocampal Neurons. Journal of Visualized Experiments. (127), 1-8 (2017).
- Kavalali, E. T., Jorgensen, E. M. Visualizing presynaptic function. Nature Neuroscience. 17, 10-16 (2014).
- Opazo, F., et al. Limited Intermixing of Synaptic Vesicle Components upon Vesicle Recycling. Traffic. 11, 800-812 (2010).
- Wollebo, H. S., Woldemichaele, B., White, M. K. Lentiviral transduction of neuronal cells. Methods in Molecular Biology. 1078, 141-146 (2013).
- Yang, X., Kaeser-Woo, Y. J., Pang, Z. P., Xu, W., Südhof, T. C. Complexin Clamps Asynchronous Release by Blocking a Secondary Ca2+ Sensor via Its Accessory α Helix. Neuron. 68, 907-920 (2010).
- Wittenmayer, N., et al. Postsynaptic Neuroligin1 regulates presynaptic maturation. Proceedings of the National Academy of Sciences of the United States of America. 106, 13564-13569 (2009).
- Lazarevic, V., Schone, C., Heine, M., Gundelfinger, E. D., Fejtova, A. Extensive Remodeling of the Presynaptic Cytomatrix upon Homeostatic Adaptation to Network Activity Silencing. Journal of Neuroscience. 31, 10189-10200 (2011).
- Kraszewski, K., Daniell, L., Mundigl, O., De Camilli, P. Mobility of synaptic vesicles in nerve endings monitored by recovery from photobleaching of synaptic vesicle-associated fluorescence. Journal of Neuroscience. 16, 5905-5913 (1996).
- Hua, Y., Sinha, R., Martineau, M., Kahms, M., Klingauf, J. A common origin of synaptic vesicles undergoing evoked and spontaneous fusion. Nature Neuroscience. 13, 1451-1453 (2010).
- Han, W., et al. N-Glycosylation Is Essential for Vesicular Targeting of Synaptotagmin 1. Neuron. 41, 85-99 (2004).
- Kwon, S. E., Chapman, E. R. Glycosylation is dispensable for sorting of synaptotagmin 1 but is critical for targeting of SV2 and synaptophysin to recycling synaptic vesicles. Journal of Biological Chemistry. 287, 35658-35668 (2012).
- Afuwape, O. A. T., Wasser, C. R., Schikorski, T., Kavalali, E. T. Synaptic vesicle pool-specific modification of neurotransmitter release by intravesicular free radical generation. The Journal of Physiology. 595, 1223-1238 (2017).
- Sara, Y., Virmani, T., Deák, F., Liu, X., Kavalali, E. T. An isolated pool of vesicles recycles at rest and drives spontaneous neurotransmission. Neuron. 45, 563-573 (2005).
- Wilhelm, B. G., Groemer, T. W., Rizzoli, S. O. The same synaptic vesicles drive active and spontaneous release. Nature Neuroscience. 13, 1454-1456 (2010).
- Bacci, A., et al. Chronic blockade of glutamate receptors enhances presynaptic release and downregulates the interaction between synaptophysin-synaptobrevin-vesicle-associated membrane protein 2. Journal of Neuroscience. 21, 6588-6596 (2001).
- Piccoli, G., et al. LRRK2 Controls Synaptic Vesicle Storage and Mobilization within the Recycling Pool. Journal of Neuroscience. 31, 2225-2237 (2011).
- Tracy, T. E., Yan, J. J., Chen, L. Acute knockdown of AMPA receptors reveals a trans-synaptic signal for presynaptic maturation. The EMBO Journal. 30, 1577-1592 (2011).
- Truckenbrdot, S., Viplav, A., Jaehne, S., Vogts, A., Denker, A., Wildhagen, H., Fornasiero, E. F., Rizzoli, S. O. Ageing synaptic vesicles are inactivated by contamination with SNAP25. bioRxiv. , 172239 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon