Method Article
Ein optischer Test zum synaptischen Vesicle Recycling in kultivierten Neuronen überexprimiert präsynaptischen Proteine
In diesem Artikel
Zusammenfassung
Wir beschreiben einen optischen Test zur synaptischen Vesikel (SV) recycling in kultivierten Neuronen. Kombinieren dieses Protokoll mit doppelten Transfektion einer präsynaptischen Marker und Protein des Interesses zum Ausdruck bringen kann wir finden präsynaptischen Websites, deren synaptischen Vesikel Recyclingkapazität, und bestimmen die Rolle des Proteins des Interesses.
Zusammenfassung
Bei aktiven präsynaptischen nervenausgänge unterziehen synaptischen Vesikel Zyklen von Exo und Endozytose. Beim recycling, der luminalen Domänen des SV transmembranen Proteine an der Zelloberfläche ausgesetzt. Eines dieser Proteine ist Synaptotagmin-1 (Syt1). Ein Antikörper gegen der luminalen Domäne der Syt1, einmal hinzugefügt, um dem Kulturmedium wird während des Exo-endocytotic Zyklus aufgegriffen. Diese Aufnahme ist proportional zur Menge des SV recycling und durch Immunfluoreszenz quantifiziert werden kann. Hier verbinden wir Syt1 Antikörper Aufnahme mit doppelten Transfektion von kultivierten hippocampal Neuronen. Dies ermöglicht uns (1) lokalisieren präsynaptischen Websites basierend auf Ausdruck der rekombinanten präsynaptischen Marker Synaptophysin, (2) bestimmen ihre Funktionalität mit Syt1 Aufnahme und (3) charakterisieren das Zielen und Wirkungen eines Proteins des Interesses, GFP-Rogdi.
Einleitung
Studium der synaptischen Vesikel recycling ist wichtig bei der Bestimmung, wie präsynaptischen Eigenschaften, während Synaptische Plastizität oder in Reaktion auf die Störung der synaptischen Funktion verändern. Antikörper-Aufnahme bietet Studium Synaptotagmin-1 (Syt1) eine Methode zur Messung der Menge von recycling-SV. Syt1 ist ein SV-assoziierten Protein, das wirkt wie ein Ca2 + Sensor und ist notwendig für steht Freisetzung von Neurotransmitter-1,-2. Es ist ein transmembranen Protein mit einer C-terminalen cytoplasmatischen Domäne außerhalb der SV und eine N-terminale luminalen Domäne innerhalb der SV3. Bei Exozytose wird das externe Medium die luminalen Domäne der Syt1 ausgesetzt. Um diese externen Medium fügen wir Antikörper gegen die cytoplasmatischen Domäne, die während der Endozytose internalisiert wird. Diese Antikörper können man entweder mit Fluorophore oder Immunostained mit Sekundärantikörper4,5,6,7Pre konjugiert. Der Fluoreszenzintensität von der daraus resultierenden Immunosignal ist proportional zur Menge des SV recycling. Dieser Ansatz lässt sich bestimmen, konstitutiven und Depolarisation-induzierte SV recycling6,8.
Syt1 Aufnahme Assays können nach Virus-vermittelte Gentransfer auf praktisch alle Zellen in der Schale oder spärlich Transfektion von einer kleinen Anzahl von Zellen durchgeführt werden. Unsere Methode verbindet den Assay mit spärlich Doppel Transfektion von primären hippocampal Neuronen mit Calcium-Phosphat-9. Wir verwenden eine rekombinante Marker Protein bekannt zu akkumulieren bei Presynapses, eindringmittel tagged Synaptophysin zu lokalisieren präsynaptischen Klemmen und overexpress unser Protein des Interesses, Rogdi. Dies ermöglicht es uns testen ob Rogdi Ziele funktionale Synapsen und wirkt sich auf SV recycling. Das Gen Kodierung Rogdi wurde ursprünglich in einem Bildschirm für Drosophila-Mutanten zeichnet sich durch Gedächtnisstörungen10identifiziert. Mutationen im Rogdi-Gen verursachen beim Menschen eine seltene und verheerende Krankheit namens Kohlschütter-Tönz-Syndrom. Patienten leiden unter Zahnschmelz Fehlbildungen, sind Epilepsie und psychomotorische Verzögerungen; jedoch blieb die subzelluläre Lokalisation des genprodukts schwer fassbaren11. Somit bot die Syt1 Aufnahme Assay wichtige Beweismittel für die Lokalisierung von GFP-markierten Rogdi auf funktionale Synapsen9.
Diese Aufnahme-Technik hat mehrere Vorteile. Erstens kann SV recycling sowohl in Echtzeit durchführen live imaging7,12, und nach Fixierung6,9 beobachtet werden durch Messung der Fluoreszenzintensität des Syt1 Fluoreszenz Label. Darüber hinaus wurden mehrere Syt1 Antikörper Varianten entwickelt. Es gibt unmarkierten, die mit einem sekundären Antikörper nach einem standard Immunostaining Protokoll nach Fixierung beschriftet werden können, und Pre-konjugierten Varianten mit einem Fluoreszenz-Label bereits angebracht. Schließlich ist die Antikörper-basierten Fluoreszenz vorteilhaft durch die große Auswahl an handelsüblichen Sekundär- oder konjugierte Farbstoffe, die verwendet werden können.
Bei der Festsetzung und Immunostaining Neuronen, es ist auch möglich, für zusätzliche Proteine zu beflecken und ns1 Analysen durchführen. Dies kann helfen, festzustellen, wo sie sich in Bezug auf recycling SVs befinden. Die Intensität der Fluoreszenz-Label ist direktes Maß für die Höhe der SV-recycling. Darüber hinaus kennzeichnen die Antikörper selektiv Syt1-haltigen Strukturen, was hohe Spezifität und wenig Hintergrund-Fluoreszenz-4. Verschiedenen Protokolle können auch verwendet werden, z. B. Depolarisation Puffer oder elektrische Stimulation Protokolle9,12,13,14. Jedoch kann basalen SV recycling ohne Stimulierung der neuronalen Kulturen15gemessen werden.
Unsere Methode befasst sich speziell mit Syt1 Antikörper Aufnahme in Doppel-transfizierten Neuronen mit Sekundärantikörper Immunolabeling nach der Fixierung. Allerdings verweisen wir auf alle routinemäßig verwendeten Varianten des Tests in unserer Diskussion um Zuschauer geben die Möglichkeit, das Protokoll auf spezifischen Bedürfnisse anzupassen.
Protokoll
Keine Studien mit lebenden Tieren wurden durchgeführt. Experimente mit euthanasierten Tiere, um die Zelle zu erhalten, die Kulturen von den lokalen Tierschutz Behörden (Tierschutzkommission der Universitätsmedizin Göttingen) unter der Zustimmung genehmigt wurden Nummer T10/30. Die Experimente wurden mit der genehmigten Protokolle geführt.
1. primäre Hippocampal Zellkultur
- Bereiten Sie die dissoziierten Zellkultur der Ratte Hippocampus am embryonalen Tag 1916,17. Die Zellen auf 12 mm Deckgläsern beschichtet mit Polyethyleneimine (PEI) in 24 Wohlen Teller bei einer Dichte von 50.000-60.000 Zellen/Well-Platte. Überprüfen Sie die Dichte mit einer Zelle zählen Industrie- und Phase Kontrast-Optik.
- Kultur der Neuronen für 3 Tage (Tag in Vitro (DIV) 3) in einer 24-Well-Platte im Inkubator bei 37 ° C mit 5 % CO2.
- Bewerten Sie die Deckgläsern für Indikatoren für die Zellgesundheit mit übertragenen Lichtmikroskopie (z. B. Phase Kontrast-Optik bei einer Vergrößerung von 10-20 X). Überprüfen Sie, ob die folgenden Indikatoren für eine gute Gesundheit: eine klare Phase Kontrast Halo, Neuriten ohne Perlen Strukturen und keine Soma clustering oder Neuriten zu bündeln.
(2) transfection
Hinweis: Das folgende Protokoll bezieht sich auf eine Doppel-Transfektion für 3 Brunnen. Allerdings funktioniert das Protokoll am besten Beträge für 4 Brunnen ausreichend vorbereitet sind.
- In einen Erlenmeyerkolben 500 mL Transfektion Puffer (274 mM NaCl, 10 mM KCl, 1,4 mM Na2HPO4, 15 mM Glukose, 42 mM HEPES) vorzubereiten.
- 8,0 g NaCl, 0,37 g KCl 0,095 g Na2HPO4, 1,35 g Glukose und 5,0 g HEPES in 400 mL destilliertem Wasser in einen Erlenmeyerkolben auflösen.
- Stellen Sie den pH-Wert auf 6,95 mit 1 M NaOH mit dem pH-Meter.
- Stellen Sie die Lautstärke mit destilliertem Wasser auf 500 mL, und überprüfen Sie den pH-Wert mit einem pH-Meter.
- Machen Sie 20-30 mL-aliquoten Transfektion Puffer mit den folgenden pH-Werten durch pipettieren 1 M NaOH auf die Transfektion Puffer: 6.96 6,97, 6,98, 6.99, 7.00, 7.01, 7.02, 7.03, 7.04, 7,05, 7.06, 7,07, 7.08, 7.09, 7.11.
Hinweis: Der pH-Wert des Puffers Transfektion ist entscheidend für die Wirksamkeit der Transfektion. - Um die Transfektion Puffer führt die höchste Zahl von transfizierten Zellen zu testen, testen Sie jede pH-Wert von 6.96 bis 7.11. Verwenden Sie die Transfektion in 2.2-2.11 und eine validierte Plasmid mit dem Ausdruck GFP beschriebene Methode. Bestimmen Sie die Anzahl von transfizierten Zellen pro Deckglas für jeden Transfektion Puffer pH Wert zu beurteilen welche Puffer am besten funktioniert.
- Aliquoten der Puffer mit dem höchsten Wirkungsgrad der Transfektion in 2 mL Mikrozentrifugenröhrchen Einfrieren und lagern die Rohre bei-20 ° C.
- Wärmen Sie reduzierte Serum Medium, Zellkulturmedium und destilliertem Wasser auf 37 ° C im Wasserbad vor.
- Bereiten Sie die Transfektion Mischung in einem 1,5 mL Microcentrifuge Schlauch. Arbeiten Sie unter der Laminar-Flow-Haube, sterile Arbeitsbedingungen zu gewährleisten.
- Mix 7,5 µL 2 M-Kalzium-Chlorid mit 4 µg pro Endotoxin-freie DNA (Synaptophysin-mOrange und mGFP/GLP-Rogdi). Fügen Sie Wasser zu einem Gesamtvolumen von 60 mL in einem 1,5 mL Microcentrifuge Schlauch zu erreichen.
- 60 mL Transfektion Puffer zur Mischung hinzugeben. Um die besten Ergebnisse zu erhalten, fügen Sie die Transfektion Puffer tropfenweise beim Schütteln der DNA-Mix vorsichtig auf den Wirbel.
- 20 Minuten bei Raumtemperatur (RT) inkubieren. Vermeiden Sie schütteln die Inkubation Röhre während der Inkubationszeit indem man das Rohr neben der Laminar-Flow-Haube.
- Entfernen Sie unter der Haube Laminar-Flow Zellkulturmedium ("konditionierten Medium") aus den Brunnen mit einer 1000 mL pipettieren zu und speichern Sie es in einem separaten Behälter im Inkubator.
- Jedes gut 500 mL reduzierte Serum Medium hinzufügen. Inkubieren Sie die Zellen bei 37 ° C und 5 % CO2 bis 20-minütigen Inkubationszeit (Schritt 2.3.3) vorbei ist.
- Geben Sie 30 mL Transfektion Mischung in jede Vertiefung durch pipettieren einige Tropfen hinzu. Entsorgen Sie die Rückstände an der Unterseite des Rohres.
- Nachdem alle Brunnen mit Transfektion Mix geliefert wurden, schütteln Sie vorsichtig 24-Well-Platte um die Verteilung der Transfektion Mischung in das Medium zu gewährleisten.
- 60 Minuten bei 37 ° C und 5 % CO2inkubieren Sie Brunnen.
- Entfernen Sie und entsorgen Sie den Transfektion Mix und waschen Sie es dreimal mit Zellkulturmedium. Fügen Sie 1 mL Zellkulturmedium in jede Vertiefung und inkubieren sie für 30 Sekunden bei RT. entfernen Sie 750 mL des Mediums und fügen Sie die gleiche Menge frisches Medium hinzu. Wiederholen Sie dies dreimal.
Hinweis: Die Waschschritt ist von entscheidender Bedeutung. Halten Sie die Zeit, die jeweils gut kein Medium im Mindestfall (i.e., entfernen und Ersetzen von Brunnen von Brunnen) und fügen Sie das waschmedium sanft. - Entfernen Sie und entsorgen Sie der Zellkulturmedium und 450 mL des konditionierten Medium gut-durch-Brunnens.
- Lassen Sie die Reifen in den Inkubator bei 37 ° C und 5 % CO2 DIV 10 Neuronen.
(3) Stimulation und Syt1 Aufnahme
Hinweis: Das folgende Protokoll gilt die Aufnahme für 3 Brunnen. Passen Sie für die Depolarisation beliebig vieler Brunnen die Mengen entsprechend an.
- 50 mL 10 X Depolarisation Puffer (640 mM NaCl, 700 mM KCl, 10 mM MgCl2, 20 mM CaCl2, 300 mM Glukose, 200 mM HEPES, pH 7,4) in einen Erlenmeyerkolben vorzubereiten.
Hinweis: Depolarisation Puffer kann für mehrere Wochen bei 4 ° C gehalten werden. Wenn eine Lösung nicht depolarisierende auch verwendet wird, bereiten Sie ein 10 X Tyrode Lösung bestehend aus 1290 mM NaCl, 50 mM KCl, 10 mM MgCl2, 20 mM CaCl2, 300 mM Glukose, 200 mM HEPES pH 7.4 um vergleichen Stimulation induzierte recycling mit spontanen das Recycling. Fügen Sie nach Verdünnung auf 1 X 1 µM von Tetrodotoxin vor Gebrauch, Aktionspotential Generation zu blockieren.- 1,87 g NaCl, KCl, MgCl2-6 H20 0,1 g, 0,15 g CaCl2-2 H2O und 3,0 g Glukose-1 H2O und 2,38 g HEPES in 50 mL destilliertem Wasser in einen Erlenmeyerkolben 2,61 g auflösen. Passen Sie den pH mit NaOH und Sterilfilter die Lösung. Verdünnen Sie den Puffer 01:10 in destilliertem Wasser, 1 X Konzentration zu erreichen.
- Fixierung nach Stimulation 4 % Paraformaldehyd (PFA) mit 1 X PBS-Puffer (pH 7,4) vorbereiten.
- Für 500 mL 4 % PFA in 1 X PBS, lösen Sie 20 g Paraformaldehyd in 450 mL destilliertem H2O.
Hinweis: Die Heizlösung können beschleunigen, auflösen, aber nicht die Lösung über 70 ° C erhitzen, wie die PFA zerfallen kann.
Achtung: PFA ist toxisch, potentiell krebserzeugend und teratogen. Tragen Sie Handschuhe bei der Arbeit mit PFA, arbeiten unter dem Abzug und Verschlucken zu vermeiden. - Lassen Sie die Lösung abkühlen, RT und 50 mL 10 X PBS-Stammlösung. Stellen Sie den pH-Wert auf 7,4 mit NaOH/HCl mit dem pH-Meter.
- Für 500 mL 4 % PFA in 1 X PBS, lösen Sie 20 g Paraformaldehyd in 450 mL destilliertem H2O.
- Vorwärmen von 1 x Depolarisation Puffer 600 mL und 10 mL Zellkulturmedium auf 37 ° C im Wasserbad.
- 1 x Depolarisation Puffer und Vortex 1 mL der Maus Anti-Syt1 Antikörper (Klon 604.2) für 10 Sekunden hinzufügen.
- Entfernen Sie und entsorgen Sie der Zellkulturmedium aus den Zellen. Fügen Sie 200 mL des Depolarisation-Antikörper-Mix, jeweils gut und 5 Minuten bei 37 ° C und 5 % CO2 im Inkubator inkubieren.
- Entfernen Sie und entsorgen Sie den Depolarisation-Antikörper-Mix und waschen Sie es dreimal mit Zellkulturmedium. Fügen Sie 1 mL Zellkulturmedium in jede Vertiefung und inkubieren Sie für 30 Sekunden bei RT. entfernen Sie 750 mL des Mediums und fügen Sie die gleiche Menge frisches Medium hinzu. Wiederholen Sie dreimal.
- Entfernen und verwerfen die Zellkulturmedium und 300 mL 4 % PFA mit 1 X PBS-Puffer. 20 Minuten bei 4 ° c inkubieren
- Drei Mal für jeweils 5 Minuten mit 1 X PBS waschen.
Hinweis: Das Protokoll kann hier angehalten werden.
(4) Immunocytochemistry
- 50 mL blockierende Puffer vorzubereiten.
Hinweis: Puffer blockiert kann bei-20 ° C mehrere Monate aufbewahrt werden.- 2,5 g Saccharose und 1 g Rinderserumalbumin (BSA) in 5 mL 10 X PBS-Stammlösung auflösen. 1,5 mL Waschmittel Stammlösung 10 % zugeben. Rühren Sie die Lösung, bis alle Komponenten ordnungsgemäß aufgelöst haben und fügen Sie destilliertes H2O, bis hin zu einem Endvolumen von 50 mL. Aliquoten die Lösung und die Aliquote zur Aufbewahrung einfrieren.
- Verdünnen Sie die sekundären, Fluorophor-gekoppelten Antikörper (gegen die primäre Syt1-Antikörper-Arten) in 200 mL blockierende Puffer in jede Vertiefung bei einer Verdünnung von 1: 1000.
- Entfernen Sie und entsorgen Sie 1 X PBS aus gut mit jeweils einem deckgläschen.
- 200 mL Puffer-Antikörper Mischung in jede Vertiefung zu blockieren und 60 Minuten bei RT inkubieren
Achtung: Da der Sekundärantikörper lichtempfindlich sind, müssen alle Schritte vorwärts in der Dunkelheit durchgeführt werden. - Waschen Sie nach der Inkubation der Zellen drei Mal für 5 Minuten mit 1 mL 1 X PBS.
- Einbetten der Deckgläsern auf Objektträger mit dem Einbetten von Medium.
- Tropfen Sie einen 7 mL Medium auf dem Objektträger einbetten. Entfernen Sie das Deckglas aus 24-Well-Platte mit einer Spritze anheben und mit der Pinzette greifen.
Achtung: Zellen an der Oberfläche das Deckglas sind leicht beschädigt, so dass Zange mit Sorgfalt behandelt werden muss. - Tauchen Sie das Deckglas in destilliertem Wasser auf die PBS zu entfernen und durch berühren einer Kante auf einem weichen Tuch trocknen.
- Drehen Sie das Deckglas auf das Einbetten von mittleren Tröpfchen, so dass die Oberfläche der Zellen tragen den Mikroskop-Objektträger, damit Einbettung der Zellen in das einbettende Medium steht.
- Tropfen Sie einen 7 mL Medium auf dem Objektträger einbetten. Entfernen Sie das Deckglas aus 24-Well-Platte mit einer Spritze anheben und mit der Pinzette greifen.
- Die Folien unter der Haube für 1-2 Std. trocknen lassen (decken, um Lichteinfall zu vermeiden) und speichern sie in einer Mikroskop-Folie-Box bei 4 ° C.
Hinweis: Das Protokoll kann hier angehalten werden.
(5) mikroskopische Analyse
- Nachdem die Deckgläsern trocken, legen Sie sie unter dem Mikroskop Objektive und Kamera.
- Passen Sie die Belichtungszeit für jeden Kanal, sodass einige Pixel überbelichtet sind, um maximale Verteilung der Grauwerte zu gewährleisten.
Hinweis: Während die Belichtungszeit zwischen den Kanälen variieren kann, sollte es für einen Kanal zur Vergleichbarkeit zwischen den Deckgläsern konstant sein. - Multi-Channel-Bilder für 10 Regionen von Interesse (ROIs) pro Deckglas zu erwerben. Überprüfen Sie, dass der ROI enthält axonalen Prozesse von transfizierten Neuron durch Prüfung GLP-Fluoreszenz, die punktförmige sein sollte.
6. statistische Analyse
- Exportieren Sie die Bilder als .tif-Dateien. Laden Sie die Bilder in OpenView18 , indem Sie auf Datei | Last-Image-Datei.
- Wählen Sie das Synaptophysin-mOrange Bild als Kanal 1, Rogdi-GLP/mGFP Bild als 2-Kanal und Alexa647 fluoreszenzbild als Kanal 3.
- Schwelle des ROIs.
- Klicken Sie auf Analyse | Ort-Bereich über Puncta. Wählen Sie Schwelle und Delta Intensität Werte, so dass bei der Sichtprüfung, diffuse Fluoreszenz ausgeschlossen wird, so dass nur punktförmige Signale in das Bild des Kanals 1 (für Synaptophysin-mOrange Fluoreszenz). Halten Sie die gleiche Schwelle für alle Bilder.
- Übertragen Sie diese ROIs auf den entsprechenden Kanal 2 (GLP-Rogdi/mGFP Fluoreszenz) und 3 (Syt1-Fluoreszenz) der einzelnen Deckglas Bereiche durch Klicken auf jetzt ausführen.
Hinweis: Der ROIs sollte nur berücksichtigt werden, wenn die Zelle doppelt transfiziert. Bei dieser Methode sollte mOrange und GFP-Fluoreszenz deutlich sichtbar sein. - Sichern Sie die Daten in die Analyse-Log-Editor, indem Sie auf Log-Daten.
- Öffnen Sie den Analyse-Log-Editor unter der Registerkarte " Windows " und kopieren Sie die Werte für jeden Kanal. Die Werte für die separate Kanäle in ein Arbeitsblatt einfügen.
- Bestimmen Sie die durchschnittliche Fluoreszenzintensität des Syt1-Kanals Rois in beide Transfektion Bedingungen (GFP-Rogdi und mGFP).
- Gelten Sie entsprechende statistische Tests wie der Student t-Test signifikante Unterschiede feststellen.
Ergebnisse
Ein erwartetes Ergebnis dieses Ansatzes ist ca. 50 Doppel-transfizierten Neuronen pro Deckglas bei einer Dichte von 50.000 Neuronen pro Bohrloch Auffinden. Das Axon jedes Neuron wird voraussichtlich mehrere Hotspots fluoreszent markiert Synaptophysin Akkumulation, Angabe Cluster OfSVs zeigen. Funktionale präsynaptischen Standorten colocalizes das rekombinante Synaptophysin Signal mit punktförmige Syt1 Fluoreszenz. Verwenden doppelte Transfektion, ist GLP-Rogdi als das Protein des Interesses (Abbildung 1) oder mGFP als das Steuerelement Co ausgedrückt mit rekombinanten Synaptophysin.
In diesem Experiment analysieren wir SV recycling am präsynaptischen Websites in Neuronen GLP-Rogdi oder mGFP zum Ausdruck zu bringen. Wenn das Steuerelement Protein, mGFP, ist die ganze Zelle homogen verteilt, aber seinen Einfluss an synaptischen Standorten muss noch untersucht werden, dann ist es notwendig, ein zweites Protein Co transfizieren, die presynaptically angereichert ist, markiert eindringmittel Synaptophysin.
Wie oben beschrieben, werden Zellen Depolarisation-induzierte Sender Freigabe unterzogen. Infolgedessen nehmen funktionale Synapsen Syt1 Antikörper hinzugefügt, um das Medium. Nach Immunolabeling der Syt1 Antikörper mit einer fluoreszent markierten Sekundärantikörper ist das Ausmaß der Syt1 Aufnahme schließlich quantifiziert mit Immunosignal (Abbildung 2).
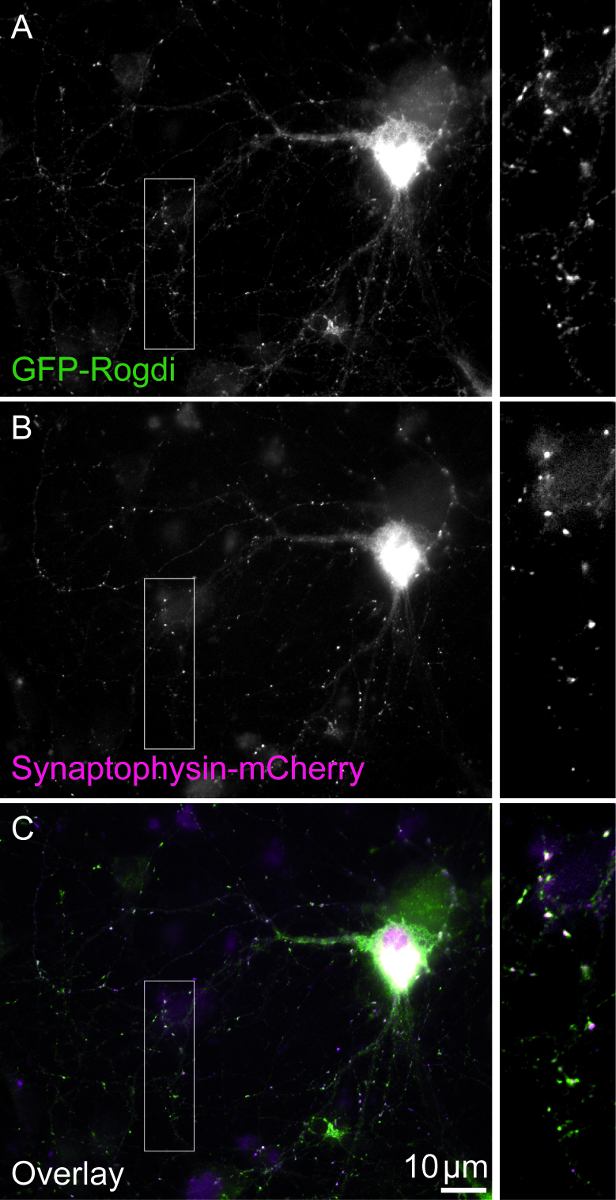
Abbildung 1: Doppel-transfizierten Zellen. Das Sichtfeld zeigt eine Doppel-transfizierten Zellen GLP-Rogdi (A) und Synaptophysin-mCherry (B) zum Ausdruck bringen. Synaptophysin ist ein reichlich synaptischen Vesikel Protein. Seine rekombinante Variante kann verwendet werden, für die Kennzeichnung der synaptischen Boutons. Die Lokalisierung Muster der GFP-Rogdi ähnelt dem des Synaptophysin-mCherry (C). Skalieren von Balken = 10 μm. Felder zeigen 2,5 X Vergrößerung. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2: GLP-Rogdi an funktionalen Synapsen. Live Syt1 Aufnahme erfolgte auf Doppel-transfizierten Zellen mit dem Ausdruck entweder mGFP (grün) und Synaptophysin-mOrange (rot; A-D) oder GLP-Rogdi (grün) und Synaptophysin-mOrange (rot; E-H). Syt1 Antikörper Aufnahme erfolgte mittels eines Maus monoklonaler Antikörpers gegen den luminalen Domäne der Syt1. Nach der Fixierung der PFA wurden Zellen mit Kaninchen Anti-GFP Antikörper gefärbt. Sekundäre Antikörper (Anti-Kaninchen Alexa 488 und Anti-Maus Alexa 647) wurden hinzugefügt, um GFP oder GLP-Rogdi und Syt1, bzw. zu erkennen. Autofluoreszenz des Synaptophysin-mOrange wurde zur präsynaptischen Terminals (B und F) zu erkennen. Punktförmige Syt1 Immunfluoreszenz zeigt Stätten der Vesicle recycling (blau; C und G). Beachten Sie, dass die Mehrheit der Syt1-Label Synapsen nicht transfizierten Neuronen lokalisiert sind. GLP-Rogdi richtete sich an den aktiven Synapsen und synaptische Vesikel recycling (I) nicht verändert. 3 unabhängige Kultur Experimente durchgeführt wurden (N = 3). Mindestens 3 Deckgläsern von jede Kultur (insgesamt 10) wurden für die Analyse verwendet. Zu guter Letzt 3 Bereiche pro Deckglas analysiert wurden (n = 30). Student t-Test zeigte keinen signifikanten Unterschied. Skalieren von Balken = 10 μm. Fehlerbalken repräsentieren den Standardfehler des Mittelwertes (SEM). "N.s." zeigt keine Bedeutung. Diese Zahl wurde von Riemann Et Al. modifiziert 9 Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Es gibt drei Tests routinemäßig zur synaptischen Vesikel (SV) recycling zu studieren. Die ersten beiden umfassen die Verwendung von einem) fluoreszierende Styryl Farbstoffe wie FM1-43 (die in Membranen zu integrieren, sind in den Organellen während Endozytose aufgenommen und werden nach Exozytose freigesetzt); und b) eindringmittel getaggt rekombinante SV-Proteine (die bei Überexpression, in die proteinhaltige recycling Maschinen integrieren). Wenn die angehängte Fluorophore ihre Fluoreszenz je nach pH-Wert ändern, dienen sie Änderungen zwischen dem sauren Innenraum von einem SV und der pH-Wert des Mediums extrazelluläre überwachen. Die rekombinante Proteine mit einer pH-Sensitive-Variante des GFP markiert werden als Phluorins bezeichnet. Die beiden Assays diskutiert wurden beide vorgestellten zuvor19,20, und die vor- und Nachteile der einzelnen wurden auch bewertete21.
Hier beschreiben wir eine dritte, etablierte Methode4,5,6,7,9,14. Um SV recycling zu testen, nutzen wir die Tatsache, dass die luminalen Domäne der Vesikel-assoziierten Protein Synaptotagmin-1 (Syt1) an der Zelloberfläche nach Exozytose ausgesetzt wird. Zuerst fügen wir einen Antikörper gegen die luminalen Domäne das Kulturmedium, die dann durch die Blase beim SV recycling aufgegriffen wird. Diese Antikörper-Aufnahme ist visualisiert und durch Immunfluoreszenz quantifiziert. Alternativ kann ein direkt beschriftete Syt1-Antikörper verwendet werden. Die Bezeichnung kann pH-unabhängige Berichterstattung Lokalisierung von der Syt1-Antikörper sowohl innerhalb als auch auf der äußeren Oberfläche des SVs oder pH-abhängig, Berichterstattung, Lokalisierung basiert auf Fluoreszenz Änderungen sein. Wir beschreiben auch die Kombination des SV recycling Assays mit doppelten Transfektion von kultivierten Neuronen zu testen, ob ein Protein von Interesse, GFP-Rogdi Zielen funktionale Synapsen und wirkt sich auf recycling-SV. GLP-Rogdi ist spezifisch für diesen Ansatz; Allerdings können die gleichen Fragen für jedes Protein des Interesses zu richten.
Dieser Test wurde erstmals 1992 zur Überwachung der spontanen recycling von SVs4 und wurde von der gleichen Gruppe, evozierte SV12recycling zu überwachen. Ihre Experimente festgestellt, dass Syt1 Aufnahme empfindlich gegen Clostridien Neurotoxine, die SV Exozytose12zu blockieren. Sie zeigte auch, dass die Stimulation der Kulturen durch Depolarisation bei 37 ° C verbessert die Internalisierung von Syt1 Antikörpern im Vergleich zu 1) Kulturen, die auf dem Eis, die meisten Endozytose verhindert gehalten werden, und (2) Kulturen inkubiert bei 37 ° C ohne Stimulation, die für spontane recycling ermöglicht aber nicht recycling12,22hervorrufen. Der Test kann leicht vergleichen SV zwischen zwei Bedingungen, wie z. B. recycling, mit und ohne ein Molekül des Interesses. Insbesondere konzentriert sich dieses Protokoll auf dem Vergleich Syt1 Antikörper Aufnahme in der Gegenwart im Vergleich zu fehlender ein bestimmtes Protein überexprimieren. Das Protokoll kann erweitert werden, wenn die relativen Beiträge der Oberfläche-Bindung, spontane recycling und recycling-evozierten müssen bewertet werden. Beispielsweise verhindert die Inkubation Neuronen auf Eis ohne Stimulation Endozytose, jede Oberfläche Bindung des Antikörpers Syt1 enthüllt. Inkubation der Neuronen bei 37 ° C in der basalen Lösung mit Tetrodotoxin verhindert Aktionspotential Vermehrung, offenbart spontane recycling. So offenbaren Inkubation Neuronen bei 37 ° C unter stimulierenden Bedingungen kann das Ausmaß der evozierten SV recycling.
Lebenden Zellen reagieren empfindlich auf physiologische Voraussetzungen; Wartung, Transfektion und Depolarisation Puffer sollte daher immer für physiologische Parameter wie pH-Wert und Temperatur getestet werden. Während der Depolarisation Puffer durch Sterilfilter übergeben werden können, nachdem der pH-Wert eingestellt hat, sind Transfektion Puffer empfindlich auf sterilen filtern. Daher stellen Sie den pH-Wert, halten Sie es bis zum ersten Gebrauch eingefroren und drehen Sie es in einer Tischplatte Zentrifuge, pellet-alle Bakterien. Zur Transfektion ist es wichtig, den Puffer ausreichend dafür Vereinigung des Plasmids mit Calcium-Phosphat-Kristallen zu mischen. Calcium-Phosphat-Transfektion funktioniert am besten bei Tag in Vitro (DIV) 2-4. Tagged Synaptophysin, ein SV transmembranen Protein verwenden wir als Marker zur Identifizierung von präsynaptischen Klemmen in den transfizierten Neuronen. Tagged Versionen von anderen SV-Proteine wie SV2, Synapsin, und VAMP/Synaptobrevin oder aktive Zone Moleküle wie Fagott, RIM, Munc13-1 und Besetzung können auch verwendet werden.
MCherry und mOrange emittieren rote Fluoreszenz. Obwohl mCherry heller als mOrange, hat es mehr Emission bei langen Wellenlängen als mOrange. Deshalb für die dreifache Fluoreszenz-Bildgebung mit GFP, einen roten Farbstoff und ein Farbstoff im Bereich von 700 nm emittieren, mOrange eine bessere Option als mCherry. Für doppelten Fluoreszenz mit GFP und einen roten Farbstoff kann mCherry günstig sein, da es die hellere Farbe ist. Um spärlich Transfektion zu gewährleisten, sollten die Transfektion Mischung nicht länger als 60 Minuten inkubiert. Es ist auch wichtig, dass die Inkubation in einem depolarisierende Puffer ist die richtige Länge der Zeit, Exozytose von allen Vesikeln zu gewährleisten. Längere Exposition gegenüber der depolarisierende Puffer muss jedoch vermieden werden. Während der Bildaufnahme ist es auch wichtig, es gelten die gleichen Belichtungszeiten und Lichtintensitäten zu quantifizierbaren Vergleich zwischen verschiedenen Experimenten zu gewährleisten.
Schließlich umfasst unser Protokoll während der Bildanalyse, mehrere Überlegungen. Für ein Gebiet von Interesse, die rekombinante Synaptophysin Puncta zeigt ist die Schwelle niedriger Intensität festlegen, so dass diffuse Fluoreszenz ausgeschlossen ist. Als nächstes wird diese Schwelle auf andere Bereiche und Deckgläsern ähnliche Aufnahme von punktförmige Signale und Ausschluss von diffusen Fluoreszenz beobachten getestet. Sobald eine geeignete Schwelle erkannt wird, wird es auf alle Bilder, Erzeugerregionen Interesse (ROIs) des rekombinanten Synaptophysin (markiert mit mCherry oder mOrange) Kanals punctata angewendet. Zu guter Letzt ist Syt1 Intensität der ROIs9bestimmt.
Unser Ansatz ist für spärlich Transfektion optimiert. Wir analysieren präsynaptischen Funktion in einer komplexen Umgebung wo es SV recycling in Axone der transfizierten Neuronen umgeben von untransfected Neuronen. In diesem Set-up ermöglicht Doppel-Transfektion neuronalen Funktion zu manipulieren, und suchen den präsynaptischen Terminals der transfizierten Neuronen. Transfizierte präsynaptischen Neuronen, die untransfected postsynaptischen Neuronen in Berührung ist ein wichtiger Faktor bei der Beurteilung eines präsynaptischen Neurons Auswirkungen auf das recycling von SV. Die Einstellung kann auch leicht angepasst werden, um zu testen, ob eine postsynaptischen Manipulation präsynaptischen Veränderungen verursacht. In diesem Fall spärlich Transfektion von Neuronen mit einem Protein, das zur postsynaptischen Websites ausgerichtet ist wird die postsynaptischen Standorte der transfizierten Neuronen zu lokalisieren, und Syt1 Aufnahme kann synaptischen Boutons untransfected Neuronen festgesetzt.
Wenn spärlich Transfektion nicht notwendig ist, können unterschiedliche Transfection Protokolle angewendet werden. Z. B. birgt Transfektion mit Lipofectamine auf DIV-7 - 8 Ergebnisse in höhere Transfection Raten, aber es auch stärker Ausdruck in jeder transfizierten Zellen9. Darüber hinaus kann virale Transduktion Ausdruck in fast 100 % der kultivierten Neuronen14,23,24resultieren. In Experimenten zur Überwachung SV recycling kann Transfektion für ein einziges Protein durchgeführt oder ganz weglassen. Zum Beispiel wenn insgesamt synaptischen recycling ist im Vergleich zwischen den Neuronen aus Wildtyp und genetisch veränderte ist Mäuse, Kennzeichnung einzelne Neuronen durch Transfektion nicht notwendig. Darüber hinaus ermöglicht das Immunolabeling von endogenen Proteinen. Wenn die Transfektion fehlschlägt, es ist wichtig, testen die Transfektion Puffer mit einem validierten Plasmid oder verwenden Sie einen Puffer mit verschiedenen pH-Werten (siehe Vorbereitung der Transfektion Puffer). Mit Endotoxin freie DNA-Präparaten scheint auch von entscheidender Bedeutung sein. Immunostaining verinnerlicht Syt1 Antikörper Werke in sowohl PFA-behoben und Methanol fixiert. Anzumerken ist, dass nach der Methanol-Fixierung GFP und RFP Autofluoreszenz verloren geht. Wenn GFP oder RFP in Methanol fixiert Zellen lokalisiert werden muss, müssen dieser Proteine Immunolabeled sein. Syt1 Aufnahme fehlschlägt, sollte Depolarisation Zeit und K+ -Konzentration in der Depolarisation Puffer entsprechend geändert werden. Viele Protokoll-Varianten wurden veröffentlicht, mit Depolarisation Zeiten von 90 s25 bis 60 min12und K+ Konzentrationen von 45 mM, 50 mM, 70 mM und 110 mM6,25,26 ,27. Wenn wiederkehrende Aktivität verhindert werden muss, können Glutamat-Rezeptor-Blocker auch bei Depolarisation hinzugefügt werden. Schließlich, während hohe K+ Depolarisation gedacht ist, um die stärksten Impulse werden Aktionspotentiale auslösen können SV recycling durch weitere physiologische Reize22,28. Unterschiede in der Syt1 Antikörper Aufnahme Wirksamkeit auftreten in Ratte und Maus Kulturen. In unserer Methode der monoklonale Maus-Anti-Syt1-Klon 604.2 (RRID:AB_993036) erzeugt stärkere Färbung in Ratte Kulturen als in Kulturen, Maus, während der polyklonalen Kaninchen-Anti-Syt1-Antikörper (RRID:AB_11042457) erzeugt stärkere Färbung in Maus-Kulturen, aber einige Hinweise zur Vorsicht werden nachfolgend erläutert.
Einige Einschränkungen bezüglich der Verwendung von Anti-Synaptotagmin Antikörper für die Aufnahme in SVs sollten berücksichtigt werden. Erstens fördert N-Glykosylierung von Asparagin 24 der Syt1 die endocytotic Aufnahme von Protein29,30. Asparagin 24 ist Bestandteil der luminalen Domäne der Syt1. Die Maus und Kaninchen Antikörper, die wir verwenden, richten sich gegen Aminosäuren 1-12 und 1-8, bzw. der Syt1. Während ihre Epitope mit der N-Glykosylierung Website nicht überschneiden, werden sterische Behinderung oder umgekehrt, eine Induktion der Aufnahme durch Antikörperbindung ausgeschlossen. Mutation der N-Glykosylierung Website in Syt1 ändert nicht die Kinetik der Endozytose und die Ausrichtung der Syt1 zum SVs. Es erhöht sich den Anteil der Syt1 noch auf die äußere Plasmamembran Oberfläche bei der Endozytose durch schwache Reize induziert wird. Wenn starke Reize, wie hohe K+ Depolarisation angewendet werden, wird keine Verringerung der Syt1-Aufnahme30beobachtet. Insgesamt, wenn die Antikörper mit der N-Glykosylierung Seite in irgendeiner Weise gestört sie könnte dazu führen, dass eine Änderung in SV Endozytose im Vergleich zu Antikörper-freien Bedingungen, aber diese Änderung sollte ähnlich für das Experiment (in unserem Fall die Überexpression des GFP-Rogdi) und das Steuerelement (in unserem Fall der Ausdruck der GLP). Darüber hinaus möglicherweise polyclonal Antikörper eher sterische Probleme und Vernetzung als monoklonale Antikörper zu induzieren, da eine größere Anzahl der Kopie der Antikörper an das Epitop bindet. Wir kennen keine systematischen Studien zum Vergleich der verfügbaren Antikörper mit einander; jedoch haben einige Studien die Wirksamkeit von bestimmten Antikörpern behandelt. Beispielsweise beim SV recycling Kinetik wurden sondiert mit monoklonalen Maus Anti-Syt1 Antikörper Klon 604.2 und Synaptophluorin-Fluoreszenz-Änderungen im direkten Vergleich, wurden ähnliche Ergebnisse validieren die Verwendung dieser Antikörper28. SVs mit polyklonalen Kaninchen Syt1 Antikörper be- und synaptische Übertragung Elektrophysiologisch Aufnahme ergab, dass die geladenen Synapsen synaptische Übertragung in einer Weise erinnert an Verlustfunktion-Mutanten von Syt1 reduziert hatte. Daher wirken diese polyclonal Antikörper synaptische Übertragung. Die tatsächliche Aufnahme ergab spontane und evozierten recycling, was darauf hindeutet, dass ein polyklonalen Antikörper geeignet ist, um eine Runde SV Recycling zu überwachen, aber Vorsicht bei der Interpretation der Ergebnisse nach Aufnahme dieser Antikörper-31.
Drei Tests werden routinemäßig zur SV recycling zu studieren, darunter die Membran Kennzeichnung mit Styryl Farbstoffe, Überexpression des Phluorins, die Syt1-Antikörper-Aufnahme durchgeführt und hier. Alle drei Tests können zur endocytotic und steht Beine SV Recycling herangezogen werden. Während alle drei Assays leistungsstarke Vorteile haben, hat jeder auch eine Einschränkung des Grundsatzes. FM-Farbstoffe kennzeichnen die gesamte Zellenoberfläche und werden in die Zelle mit allen recycling Membranen aufgegriffen. PHluorins müssen durch Überexpression eingeführt werden. Syt1-Antikörper kennzeichnen das körpereigene Protein, aber einige Antikörper können seine Funktion unter bestimmten Bedingungen beeinflussen. Jede Einschränkung kann jedoch passend angesprochenen21.
Insgesamt hat der Syt1 Antikörper Aufnahme Test verschiedenen Zwecken gedient. Erstens wurde es verwendet, um selektiv SVs unterziehen, spontane oder evozierte recycling bzw.28,31,32,33beschriften. Zum anderen diente es den Effekt eines Medikaments oder Protein über das Ausmaß der SV recycling zu bestimmen; zum Beispiel, zu zeigen, dass BDNF spontan und evozierten SV recycling6erhöht. Drittens wurde es zur bestimmen der Anzahl der Synapsen mit recycling SVs als Prozentsatz der die Gesamtzahl der morphologisch definierten Synapsen34,35. Dies ergab, dass überexprimierenden der postsynaptischen Zelle-Adhäsionsmolekül Neuroligin-1 der Prozentsatz von Synapsen mit SVs25 -recycling und reduzieren das Abpumpen der AMPA-Typ Glutamat-Rezeptoren den Anteil der sinkt Synapsen mit SVs, Erhöhung des Anteils von presynaptically stiller Synapsen36-recycling. Darüber hinaus diente der Test, die Mobilität der gekennzeichneten SVs27 zu analysieren und zu bestimmen, die Lokalisierung von Syt1 mit Nanoskopie13,22,33. Schließlich dient diese Methode noch testen, ob bestimmte Proteine zu funktionalen Synapsen9zu lokalisieren. Der Syt1-Antikörper kann auch für Langzeit-Studien, wo bleibt der Antikörper in den Neuronen innerhalb von Tagen nach Aufnahme37verwendet werden. Dies kann mit einer zweiten Runde der Aufnahme mit einer separat beschriftete Syt1 Antikörper oder ein Antikörper gegen den luminalen Domäne eines anderen SV-Proteins kombiniert werden. Damit testen die SVs zunächst recycelt und das Ende eines Experiments zu recyceln. Es wäre interessant, dieser Test mehr intakt Modellsysteme, wie akute Scheiben und organotypischen Slice Kulturen anzupassen. Im Prinzip der Aufnahme-Test ermöglicht den Vergleich von Gewebe aus Wildtyp und gentechnisch veränderte Tiere oder sind kombinierbar mit viralen Lieferung oder Biolistics, dh., "Gen-Kanone," Protein-Expression in diesen Modellsystemen zu manipulieren. In solchen Systemen kann der Einfluss von bestimmten Störungen am präsynaptischen Maschinen, von der Aufnahme-Assay und Netzwerk-Dynamik überwacht gleichzeitig untersucht werden.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Wir danken Irmgard Weiss für kompetente technische Unterstützung. Diese Arbeit wurde von der DFG über des Exzellenzclusters für Mikroskopie im Nanometerbereich und molekulare Physiologie des Gehirns (CNMPB, B1-7, T.D) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| B27 | Gibco | 17504-044 | |
| BSA | Sigma | A7030-50g | |
| CaCl2 | Sigma-Aldrich | C3306-100g | |
| CoolSNAP HQ2 | Photometrics | ||
| dH2O | Invitrogen | 15230 | |
| DABCO | Merck | 8.03456.0100 | |
| donkey anti mouse Alexa 647 | Jackson-Immunoresearch | 715605151 | antibody |
| DMEM | Invitrogen | 41966 | |
| DPBS | Gibco | 14190 | |
| Eppendorf tubes | Eppendorf | 30120094 | |
| multiwell 24 well | Fisher Scientific | 087721H | |
| tube (50 mL) | Greiner Bio-One | 227261 | |
| FBS superior | BiochromAG | S0615 | |
| Glucose | Merck | 1,083,421,000 | |
| HBSS | Invitrogen | 14170 | |
| HEPES | Sigma | H4034-500g | |
| Hera Cell 150 (Inkubator) | ThermoElectron Corporation | ||
| KCL | Sigma-Aldrich | P9541-500g | |
| L-Glutamin | Gibco | 25030 | |
| MgCl2 | Honeywell | M0250-500g | |
| microscope slides | Fisher Scientific | 10144633CF | |
| Microsoft Excel | Microsoft | ||
| Mowiol4-88 | Calbiochem | 475904 | |
| NaCl | BioFroxx | 1394KG001 | |
| Na2HPO4 | BioFroxx | 5155KG001 | |
| Neurobasal | Invitrogen | 21103049 | |
| OpenView Experiment Analysis Application | Free software, see comments | written by Noam E. Ziv, Technion – Israel Institute of Technology, Haifa, Israel | |
| PBS (10x) | Roche | 11666789001 | |
| Optimem | Invitrogen | 31985 | |
| Penstrep | Gibco | 15140-122 | |
| PFA | Sigma | P6148-1kg | |
| safety hood | ThermoElectron | Serial No. 40649111 | |
| Sucrose | neoFroxx | 1104kg001 | |
| Synaptotagmin1 | Synaptic Systems | 105311 | mouse monoclonal; clone 604.2 |
| Triton X-100 | Merck | 1,086,031,000 | |
| Vortex Genius 3 | IKA | 3340001 | |
| Water bath | GFL | 1004 | |
| Zeiss Observer. Z1 | Zeiss |
Referenzen
- Koh, T., Bellen, H. J. Synaptotagmin I, a Ca2+ sensor for neurotransmitter release. Trends in Neurosciences. 26, 413-422 (2003).
- Chapman, E. R. How Does Synaptotagmin Trigger Neurotransmitter Release. Annual Review of Biochemistry. 77, 615-641 (2008).
- Perin, M. S., et al. Structural and Functional Conservation of Synaptotagmin (p65) in Drosophila and Humans. Journal of Biological Chemistry. 266, 615-622 (1991).
- Matteoli, M., Takei, K., Perrin, M. S., Südhof, T. C., De Camilli, P. Exo-endocytotic Recycling of Synaptic Vesicles in Developing Processes of Cultured Hippocampal Neurons. Journal of Cell Biology. 117, 849-861 (1992).
- Ko, J., et al. Neuroligin-1 performs neurexin-dependent and neurexin-independent functions in synapse validation. The EMBO Journal. 28, 3244-3255 (2009).
- Shinoda, Y., et al. BDNF enhances spontaneous and activity-dependent neurotransmitter release at excitatory terminals but not at inhibitory terminals in hippocampal neurons. Frontiers in Synaptic Neuroscience. 6, 27(2014).
- Ivanova, D., et al. Synaptic activity controls localization and function of CtBP 1 via binding to Bassoon and Piccolo. The EMBO Journal. 34, 1056-1077 (2015).
- Crawford, D. C., Ramirez, D. M. O., Trauterman, B., Monteggia, L. M., Kavalali, E. T. Selective molecular impairment of spontaneous neurotransmission modulates synaptic efficacy. Nature Communications. 8, 1-14 (2017).
- Riemann, D., Wallrafen, R., Dresbach, T. The Kohlschütter-Tönz syndrome associated gene Rogdi encodes a novel presynaptic protein. Scientific Reports. 7, (2017).
- Kim, M., et al. Rogdi Defines GABAergic Control of a Wake-promoting Dopaminergic Pathway to Sustain Sleep in Drosophila. Scientific Reports. 7, 1-14 (2017).
- Schossig, A., Wolf, N. I., Kapferer, I., Kohlschütter, A., Zschocke, J. Epileptic encephalopathy and amelogenesis imperfecta: Kohlschütter-Tönz syndrome. Euopean Journal of Medical Genetics. 55, 319-322 (2012).
- Kraszewski, K., et al. Synaptic Vesicle Dynamics in Living Cultured Hippocampal Neurons Visualized with CY3-Conjugated Antibodies Directed against the Lumenal Domain of Synaptotagmin. Journal of Neuroscience. 15, 4328-4342 (1995).
- Willig, K. I., Rizzoli, S. O., Westphal, V., Jahn, R., Hell, S. W. STED microscopy reveals that synaptotagmin remains clustered after synaptic vesicle exocytosis. Nature. 440, 935-939 (2006).
- Petkova, A., Goedecke, N., Korte, M., Dresbach, T. Neuroligins mediate presynaptic maturation through brain-derived neurotrophic factor signaling. bioRxiv. , 262246(2018).
- Fuchs, C., et al. GABA(A) receptors can initiate the formation of functional inhibitory GABAergic synapses. European Journal of Neuroscience. 38, 3146-3158 (2013).
- Dresbach, T., et al. Functional regions of the presynaptic cytomatrix protein Bassoon: Significance for synaptic targeting and cytomatrix anchoring. Molecular and Cellular Neuroscience. 23, 279-291 (2003).
- Seibenhener, M. L., Wooten, M. W. Isolation and Culture of Hippocampal Neurons from Prenatal Mice. Journal of Visualized Experiments. (65), 4-9 (2012).
- Tsuriel, S., et al. Local sharing as a predominant determinant of synaptic matrix molecular dynamics. PLOS Biology. 4, 1572-1587 (2006).
- Iwabuchi, S., Kakazu, Y., Koh, J., Goodman, K. M., Harata, N. C. Examination of Synaptic Vesicle Recycling Using FM Dyes During Evoked, Spontaneous, and Miniature Synaptic Activities. Journal of Visualized Experiments. (85), 1-10 (2014).
- Villarreal, S., Lee, S. H., Wu, L. Measuring Synaptic Vesicle Endocytosis in Cultured Hippocampal Neurons. Journal of Visualized Experiments. (127), 1-8 (2017).
- Kavalali, E. T., Jorgensen, E. M. Visualizing presynaptic function. Nature Neuroscience. 17, 10-16 (2014).
- Opazo, F., et al. Limited Intermixing of Synaptic Vesicle Components upon Vesicle Recycling. Traffic. 11, 800-812 (2010).
- Wollebo, H. S., Woldemichaele, B., White, M. K. Lentiviral transduction of neuronal cells. Methods in Molecular Biology. 1078, 141-146 (2013).
- Yang, X., Kaeser-Woo, Y. J., Pang, Z. P., Xu, W., Südhof, T. C. Complexin Clamps Asynchronous Release by Blocking a Secondary Ca2+ Sensor via Its Accessory α Helix. Neuron. 68, 907-920 (2010).
- Wittenmayer, N., et al. Postsynaptic Neuroligin1 regulates presynaptic maturation. Proceedings of the National Academy of Sciences of the United States of America. 106, 13564-13569 (2009).
- Lazarevic, V., Schone, C., Heine, M., Gundelfinger, E. D., Fejtova, A. Extensive Remodeling of the Presynaptic Cytomatrix upon Homeostatic Adaptation to Network Activity Silencing. Journal of Neuroscience. 31, 10189-10200 (2011).
- Kraszewski, K., Daniell, L., Mundigl, O., De Camilli, P. Mobility of synaptic vesicles in nerve endings monitored by recovery from photobleaching of synaptic vesicle-associated fluorescence. Journal of Neuroscience. 16, 5905-5913 (1996).
- Hua, Y., Sinha, R., Martineau, M., Kahms, M., Klingauf, J. A common origin of synaptic vesicles undergoing evoked and spontaneous fusion. Nature Neuroscience. 13, 1451-1453 (2010).
- Han, W., et al. N-Glycosylation Is Essential for Vesicular Targeting of Synaptotagmin 1. Neuron. 41, 85-99 (2004).
- Kwon, S. E., Chapman, E. R. Glycosylation is dispensable for sorting of synaptotagmin 1 but is critical for targeting of SV2 and synaptophysin to recycling synaptic vesicles. Journal of Biological Chemistry. 287, 35658-35668 (2012).
- Afuwape, O. A. T., Wasser, C. R., Schikorski, T., Kavalali, E. T. Synaptic vesicle pool-specific modification of neurotransmitter release by intravesicular free radical generation. The Journal of Physiology. 595, 1223-1238 (2017).
- Sara, Y., Virmani, T., Deák, F., Liu, X., Kavalali, E. T. An isolated pool of vesicles recycles at rest and drives spontaneous neurotransmission. Neuron. 45, 563-573 (2005).
- Wilhelm, B. G., Groemer, T. W., Rizzoli, S. O. The same synaptic vesicles drive active and spontaneous release. Nature Neuroscience. 13, 1454-1456 (2010).
- Bacci, A., et al. Chronic blockade of glutamate receptors enhances presynaptic release and downregulates the interaction between synaptophysin-synaptobrevin-vesicle-associated membrane protein 2. Journal of Neuroscience. 21, 6588-6596 (2001).
- Piccoli, G., et al. LRRK2 Controls Synaptic Vesicle Storage and Mobilization within the Recycling Pool. Journal of Neuroscience. 31, 2225-2237 (2011).
- Tracy, T. E., Yan, J. J., Chen, L. Acute knockdown of AMPA receptors reveals a trans-synaptic signal for presynaptic maturation. The EMBO Journal. 30, 1577-1592 (2011).
- Truckenbrdot, S., Viplav, A., Jaehne, S., Vogts, A., Denker, A., Wildhagen, H., Fornasiero, E. F., Rizzoli, S. O. Ageing synaptic vesicles are inactivated by contamination with SNAP25. bioRxiv. , 172239(2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten