Method Article
İndüklenebilir geçici transfeksiyon yoluyla kontrol edilebilir iyon kanal İfade
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
bir heterolog ifade sistemi ile incelenmesi iyon kanalları biyomedikal araştırmalarda bir çekirdek tekniği haline gelmiştir. Bu yazıda, bir uyarılabilir promoterin kontrolü altında geçici transfeksiyon gerçekleştirerek sıkı bir şekilde kontrol iyon kanal ekspresyonunu elde etmek için bir zaman etkili bir yöntem sunmaktadır.
Özet
Transfeksiyon, bir hücre içine yabancı nükleik asitlerin ulaştırılması protein araştırmaları güçlü bir araçtır. Bu yöntem sayesinde, iyon kanalları elektrofizyolojik analizi, biyokimyasal karakterizasyonu, mutasyon çalışmaları ve hücresel süreçlerin üzerindeki etkileri yoluyla incelenebilir. Geçici nakiller protein gün birkaç saat içinde analiz için kullanılabilir hale geldiği basit bir protokol sunuyoruz. Bu yöntem nispeten basit ve etkili bir zaman protokolü sunulur, ancak önemli bir bileşendir analizi için uygun olan fizyolojik ilgili bu seviyeleri ilgi konusu genin ekspresyonunu kalibre edilir. Bu amaçla, söz konusu genin ekspresyonunu kontrol etmek olanağı sunan bir çok farklı yaklaşımlar ortaya çıkmıştır. Birkaç kararlı hücre transfeksiyon protokolleri kalıcı bir tetrasiklin kontrollü transkripsiyonu düzenlenmesi altında cep genomuna ilgilenilen geni tanıtmak için bir yol sağlartional aktivasyonu. Bu tekniğin güvenilir ifade seviyelerini üretirken, ilgi her gen bir öldürme eğrisi kalibrasyonu, hücre kolonilerinin seçimi ve genel olarak daha fazla kaynak da dahil olmak üzere vasıflı iş bir kaç hafta gerektirir. Burada iyon kanalı analizinde gerekli kontrollü bir şekilde bir proteini ifade etmek için etkili bir yol olarak indüklenebilir bir sistemde geçici reseptör potansiyel katyon kanalı alt ailesi V 1 (TRPV1) geninin geçici transfeksiyon kullanan bir protokol mevcut. Biz bu tekniği kullanarak, bir tek transfeksiyon ile veri toplama her türü için gerekli olan kontrollü kanal seviyeleri ile kalsiyum görüntüleme, tüm hücre ve tek kanallı analizi gerçekleştirmek mümkün olduğunu göstermektedir. Genel olarak, bu iyon kanalları yapı ve fonksiyon çalışma için kullanılabilir kopyalanabilir bir teknik sağlamaktadır.
Giriş
Heterolog sistemleri ifade hücresel fonksiyonları 1 çok sayıda çalışma için en yaygın kullanılan tekniklerden biridir. Onların düşük endojen protein profili, asgari bakım gereksinimleri, güvenilir büyüme ve yabancı DNA'yı almak ve ifade yeteneği, insan embriyonik böbrek (HEK293) ve biyolojik araştırmaların 2, 3 neredeyse temel Çin Hamster Yumurtalık (CHO) gibi hücre hatları yaptık. heterolog sistemler kullanılarak çalışma alanları zar proteinleri, hücre içi sinyal ve enzimatik aktivite içerir. Hücreye yabancı DNA'nın transfeksiyonu takiben, analiz, birçok farklı formları elektrofizyoloji, rasyometrik kalsiyum görüntüleme, western blot, vb 4, 5 de dahil olmak üzere, yapılabilmektedir.
heterolog sentezleme sistemleri için potansiyel uygulamalar geniş bir dizi için birçok differe nedeniylent reaktifler ve ürünleri bu hücreler ve nitelikleri 6 kullanmak için geliştirilmiştir. geçici veya kalıcı olarak eksojen proteini incelemek için hücre içine yabancı DNA'yı entegre DNA verme sistemleri, biyolojik araştırmalar için en popüler ve kullanışlı araçlarından biri haline gelmiştir. Daha özel olarak ise, bir hücre içine geçici olarak transfekte DNA, yaygın olarak nispeten daha az bir zaman ve malzeme gerektiren, basit ve yalındır işlem olarak kullanılır. Ayrıca, transfeksiyon geçmesi hücrelerin başarı oranı 7 yüksektir. Bu teknik, aynı şekilde yeşil floresan proteini (GFP) gibi bir işaretleyici gen ile birlikte ve örneğin kalsiyum görüntüleme ve elektrofizyoloji 5 gibi birçok farklı teknikleri için kullanılabilir zaman çok güvenilirdir. Ne yazık ki, olsa da, geçici konakçı hücreler içine DNA ifade etmeyen hücre başına ekspresyon seviyesi güvenilmez olduğunu en az, bazı önemli tuzaklar ile birlikte geliyor. plazmid DNA kopya sayısı u alınmışhücre başına p böylece bireysel deneyler arasındaki ifade çok 2 değişebilir, kontrol edilemez. Ya fizyolojik koşulları çoğaltmak için çalışıyoruz, ya da kesin veri toplama tekniklerini yaparken bu sorun önemli hale gelir.
Tek sağlanması ilgilenilen bir gen gibi bir tetrasiklin bastırıcı sentezleme sistemi gibi bir uyarımlı promotör, sıkı kontrol altında bir hücrenin genomu içine sokulabilir olan, kararlı transfeksiyon protokolleri tasarlanmıştır yukarıda bahsedilen komplikasyonların bir çözüm olarak, plazmidin kopyalama her bir hücrenin genomu içinde entegre olması ve yalnızca doksisiklinin varlığında, örneğin, transkripsiyon mekanizmasının indüksiyonundan sonra eksprese edilir. Bu tutarsızlık, protein sentezleme seviyeleri engeller çözer birlikte, bu yöntem, geçici transfeksiyonlar hızlı ve nispeten basit bir protokol uygun kaybeder. stabil bir hücre dizisi oluşturulması yüklenebileceğini en az bir kaç hafta sürerh bir protein ifadesini korumak ve vektör entegrasyonunu sağlamak ve ustaca seçin ve hücre kolonilerini büyümeye özel antibiyotik tarafından belirlenen bir öldürme eğrisini kalibre gerekir. Genel olarak bu alt başarı oranı 8 ile önemli ölçüde daha fazla zaman ve çaba gerektirir.
Burada, herhangi bir uyarılabilir hücre hattında ifade seviyelerini kontrol etmek için basit ve etkili bir şekilde sağlamak için popüler transfeksiyon seçeneklerinin her ikisi de güçlü üzerine çekiyor bir ara protokol tanıtmak. indüklenebilir bir tet sistemi hücreleri muhafaza ederken, geçici olarak homolog represör sistemi ile kombine bir vektör içine lige ilgi Gen, geçici reseptör potansiyel katyon kanalı alt ailesi V 1 (TRPV1), transfekte. Bu şekilde, bir gen ifade etmek başlayan olmayan hücrelere dahil edilebilir. Sadece doksisiklin ilavesi ile gen protein İfade seviyelerini kalibre etmek bize izin verdiği ifade başlar yokFizyolojik koşullarda gözlenen teknik veya düzeylerine göre Ession. Bizim protokol, aynı zamanda, bir stabil şekilde eksprese eden hücre çizgisi üreten bağlantılı uzun komplikasyonlar önlenir. Biz kalsiyum görüntülemede TRPV1 aktivasyon değişen düzeylerde göstererek başlar un kaynaklı indüksiyon ve nasıl hücre içi kalsiyum seviyesinin yükselmesi ilişkilidir dört saat boyunca. Daha sonra indüksiyon süresinin artması ile artmaktadır akımını gösteren Patch kenetleme tekniğinin tüm hücre konfigürasyonunda protokolü çoğaltmak. Son olarak, tek kanallı elektrofizyoloji kayıtların örnekler sunmakta ve proteinin tek tek birimler göre hassas veri toplama ararken bu teknik kontrollü sentezlenmesi için özellikle yararlı olduğu gösterilmiştir. böylece deneyler sağlamak ve mo arasındaki koşullarını kontrol etmek için bir yol sağlayarak, uzun hücre kültürü komplikasyonları kaçınırken bizim protokolü sayesinde, heterolog sistemlerde protein ifadesini kontrol etmek için uygun bir yol sunartekrarlanabilir sonuçlar yeniden.
Protokol
1. Vektör Baskılanabilir Site içine İlgi Gene bağlanması
- / TO gibi pcDNA5 / FRT / TO veya pcDNA4 olarak bir aşılanabilir vektör edinin.
- Siliko DNA analiz yazılımı 4 ile aynı zamanda seçilen vektörünün çok sayıda klonlama bölgesi yer almaktadır genin ortasında potansiyel olarak duyarlı restriksiyon siteleri için ilgi konusu geni analiz edin.
- Kullanma bindirici PCR teknikleri 4, (ilgili genin içinde bulunmayan) seçilen iki sınırlama enzimi tanıma mevkileri ile ilgili geni başlangıç kodonundan önce yerleştirilmiş birinci ve durdurma kodonundan sonra ikinci kanat.
- vektör hem Digest ve öz önlemek için, sadece 30 dakika boyunca vektörü reaksiyonuna bir birim dana bağırsağı fosfatazı (CİP) ilave edilir, bir saat boyunca enzimlerin çalışma sıcaklığında, önceki (adım 1.2 seçilen) restriksiyon enzimleri ile ekleme ligasyon.
- Bir% 1 agaroz jeli üzerine sindirilmiş DNA yükleyin ve elektroforez 9 parçalanabilen segmentleri ayırın.
- UV ışığı ile, bir bıçak ile vektörün istenen bölümleri içeren jel parçaları kesilmiş ve lige edilmesi yerleştirin.
- (Ticari mevcut DNA ekstraksiyon kitleri kullanılarak) agaroz jel parçalarından DNA parçalarını Özü ve 260 nm'de spektrofotometre ile nihai konsantrasyonu ölçmek.
- 20 dakika boyunca oda sıcaklığında T4 ligaz enzimi kullanılarak uyarılabilir seçilen vektör içine ilgili geni Arter. insertin 1 mol oranı l: vektör inserti vektörü ile bağlanması olasılığını artırmak amacıyla bir 3 kullanın. Kontrol için, sadece vektör içeren bir ligasyon reaksiyonu hazırlar.
- Bakteriyel transformasyon için, 50 uL E.coli içine, tek başına vektör ve vektör + geni 10 ng ekleyin. 42 ° C'de 45 saniye kuluçkaya bırakma takip 30 dakika boyunca buz üzerinde tüp inkübe edin. Hemen geri koyunİki dakika boyunca buz üzerinde ve 500 uL LB ortamında dönüştürülmüş bakteri aktarın. 220 rpm'de çalkalanarak 37 ° C'de bir saat süreyle inkübe edilir.
- Başarılı bir şekilde transforme edilmiş bakterilerin seçimi için, uygun bir antibiyotiği içeren bir hazır LB agar plakası üzerinde (1.9 de tarif edildiği gibi), her bir reaksiyonun plakası 100 uL (örneğin, 100 ug / ml ampisilin pCDNA4 / TR kullanarak).
- 37 ° C'de gece boyunca büyümeye olanak sağlar. Plakalar sıkıca plastik parafın film sarılarak iki haftaya kadar 4 ° C 'de muhafaza edilebilir.
- 10 uL ucunu kullanarak ayrı ayrı koloniler kaldırın ve 220 rpm'de çalkalanarak 37 ° C'de + Antibiyotik Orta 3 ml LB, gece boyunca büyümeye olanak sağlar. ilgi DNA Bakteriler dondurulabilir (-20 ° C) 11.000 xg'de LB ve bakteri santrifüj ve süpernatant dışarı aspire kısa süreli depolama için. Uzun süreli depolama -80 ° C'de gliserol stoklan halinde bakteri dondurma gerektirir.
- throu DNA Özügh mini hazırlık ve 260 nm 5 de spektrofotometre ile nihai konsantrasyonu ölçmek.
- Saflaştırılmış yapı 4 sıralanmasıyla ilgi konusu genin başarıyla girilmesi kontrol edin. Seçenek olarak ise, bir kısıtlama kesim parçalarını ayırmak ve varlığını değerlendirmek için elektroforez ile enzim ve uzunluğu yapının tanısal sindirimi bu son 4 yararlanılabilir.
TetR ifade 2. Kültürleme Hücre Hatları
- kendi genomik DNA içine dahil bir tet plazmid bir hücre kültürü hattı elde edilir. Burada protokol bir örnek olarak pcDNA6 / TR plazmid İnsan embriyonik böbrek 293T hücreleri (HEK-293T) kullanılarak yazılır.
- Dulbecco Modifiye Kartal Ortamı (DMEM), 100 mm doku kültürü plakasında tohum hücreleri,% 10 FBS ile takviye edilmiş,% 1 Penisilin-Streptomisin, 2 mM L-glutamin, ve 25 mM HEPES (burada: Tam DMEM), pH 7.3 ve O inkübe 37 / N# 176; C ve% 5 CO 2. hücrelerle bütün çalışmalar, steril koşullar altında, bir biyolojik başlık yapılmalıdır.
- Tet represör genin ifadesinin muhafaza ortamı aspire ve 5 mg / ml Blasticidin ile desteklenmiş tam DMEM ile değiştirmek için. 37 ° C'de ve% 5 CO2 hücreleri inkübe edin.
- Hücreler 80 ulaştıklarında -% 90 oranında konfluent, orta aspire ve yavaşça (kalsiyum ve magnezyum içermeyen) DPBS ile iki kez yıkama hücreleri, 37 ° C'ye kadar ısıtıldı.
- yavaşça, mekanik zarar vermeden hücre asansör DMEM,% 0.05 tripsin içeren kültür inkübe etmek için 1.5 dakika boyunca 37 ° C'de ısıtıldı.
- Tam DMEM eşit hacimde tripsin eylemini bloke. Yavaşça yukarı pipet ve aşağı hücreleri kaldırın ve steril bir tüpe aktarmak için.
- 5 dakika boyunca 200 x g'de santrifüjleyin hücreleri.
- Süpernatantı aspire ve 1 mL Tam DMEM ile değiştirin. Hiçbir kadar yukarı ve aşağı hücreleri ile çözüm pipetlehücre kümeleri görülebilir. Kont ve hemasitometre kullanarak hücrelerin sayısını hesaplamak.
- Tohum 1-2 x 10 5 mg / ml Blasticidin 12 ml tam DMEM içeren 100 mm doku kültürü çanağı içinde 6 hücre. onlar% 90 confluency ulaşmak olarak haftada iki kez hücreleri bölün.
3. Hücreleri içinde ilgili plazmid transfekte
- 0.9 ml tam DMEM ile hazırlanan bir 12-çukurlu plaka içindeki yuvalara yukarıda transferi hücreleri tarif edildiği gibi ayırma hücrelerin aynı yöntemi kullanarak, yeterli% 50 konfluent (~ 200,000 hücre) yapmak ve bir CO2, 37 ° C de bir gece boyunca inkübe etmek inkübatör.
- pcDNA4 bir transfeksiyon karışımı hazırlayın / ilgili geni içeren inert bir plazmid nihai hacim 100 ul olmak için (gerekirse) 1 ug, 3 uL lipit transfeksiyon reaktifı ve DMEM toplam DNA miktarı getirmek. Farklı proteinler farklı etkinlik ifade olarak kullanılmak üzere plasmid DNA optimal miktarı çok değişkendir. Elektronik içinrophysiological deneyleri, başarılı bir şekilde transfeksiyon 4 geçiren hücreler görselleştirmek için transfeksiyon kokteyl memeli sentezleme plasmidi EGFP bulunmaktadır.
- 30 dakika boyunca oda sıcaklığında transfeksiyon karışımı inkübe edin.
- 12 oyuklu plaka hücreler üzerine damla damla transfeksiyon karışımı pipetleme hücreleri transfekte DNA ve transfeksiyon reaktifi homojen bir dağılım sağlamak için kuvvetli bir şekilde plaka sallayın. Hücreler ~ transfeksiyon zamanı% 80 konfluent olmalıdır.
- 37 ° C 'de transfekte edilmiş hücrelerin O / N inkübe ve% 5 CO2.
- Hücreler başarıyla elektrofizyoloji performans ise ertesi sabah UV lamba altında EGFP floresan sinyalini gözlemleyerek transfekte olduğunu onaylayın.
Poly-D-Lizin (PDL) 4. Kaplama Hücreler Lameller / Wells
- % 70 izopropil etanol çözeltisi ile dousing 12 mm lamelleri sterilize edin. Kuru ve tek coversl koyunelektrofizyolojik kayıt için 24 oyuklu bir plakanın her bir IP.
- Bir kalsiyum görüntüleme odasının her lamel veya oyuk üzerine 0.2 mg / ml PDL çözeltisi - 0.1 bir çözelti pipetle.
- % 5 CO2 inkübatöründe 37 ° C'de 30 dakika boyunca bekletin.
- Her yıkama arasında aspire, hücre kültürü dereceli çift damıtılmış su (DDW) ile üç kez yıkanır. Nihai yıkamayı takiben, iyice kurumasını ve oda sıcaklığında bekletin.
- Elektrofizyoloji, 37 ° C'ye kadar ısıtıldı, 500 uL tam DMEM ile her bir içeren bir PDL kaplı lamel doldurun.
- yukarıda tarif edildiği gibi transfekte edilmiş hücreleri bölme aynı yöntemi gerçekleştirmek. elektrofizyoloji kayıt için her PDL kaplı lamel merkezine tripsin tedavisi ve engelleme, transfer hücreleri (veya yaklaşık 30.000 hücreleri) 80 ul aşağıdaki hücrelerin resuspending sonra. Hücreler en az 1.5 saat için oturuşmaya veya% 5 CO2 inkübatöründe 37 ° C'de gece boyunca inkübe izin verin.
- her bir PDL kaplı kalsiyum görüntüleme merkezine hücrelerinin kalsiyum görüntüleme transferi ve nokta 20 uL (yaklaşık 20.000 hücreleri) için. Hücrelerin en az 30 dakika süreyle yerleşmek ve her bir kuyu için 180 mcL tam DMEM eklemek için izin ver.
5. Endükleyen Gen İfadesi
- üreticinin talimatlarına uygun olarak DDW içinde 1 mg / mL'lik bir doksisiklin stok çözelti hazırlayın. 3 hafta boyunca 4 ° C'de ışıktan korunmuş olarak stok solüsyonu tutun. Uzun süreli depolama için -20 ° C'de doksisiklin stok solüsyonu tutun.
- Tam DMEM taze 2 ug / ml (elektrofizyoloji) ya da 3 | ig / ml (kalsiyum görüntüleme) doksisiklin çözeltisi hazırlayın ve 37 ° C'ye ısıtınız.
- Elektrofizyolojik kayıtlar, pipet için her / ml doksisiklin solüsyon 2 ug 500 uL de 1 ug / ml doksisiklin bir son konsantrasyon yapmak. kalsiyum görüntüleme için, nihai konsantrasyonunun yapmak için her bir oyuğa 3 ug / ml doksisiklin çözeltisi 100 mcL1 mcg / ml doksisiklin yon. indüksiyon saat yazınız.
- İstenen 37 ° C 'de indüksiyonu için süreyi ve% 5 CO2 inkübe edin.
Protein İfade 6. Kalibre Timeline
- Kalsiyum Görüntüleme 5, 10 ile protein ifadesini kalibre
- Ringer çözeltisi (140 mM NaCI, 2.5 mM KCI, 1.8 mM CaCl2, 2 mM NaOH ile 7.4'e ayarlanmıştır MgSO 4, 20 mM Hepes, pH) ve sıcak 37 ° C hazırlayın.
- Ringer çözeltisi kanal agonistinin doyurucu konsantrasyonlarının hazırlayın. hücreler ve hücre dışı solüsyon içeren kalsiyum görüntüleme bölmelere ilave edildiğinde agonist miktarı seyreltilir için, agonist, istenen son konsantrasyona miktarını iki katına. Bu aynı zamanda kontrol etmek için her bir kritik banyo çözeltisinin miktarını sağlar.
- D iyonik olmayan F-127 20% W / V bir çözelti hazırlayınMSO. iyonik olmayan, F-127 çözünene kadar 40 ° C çözelti ısıtılır. Oda sıcaklığında, iyonik olmayan, F-127 çözeltisi, depolama ve kullanma öncesi 40 ° C'ye ısıtın. İyonik olmayan F-127 gibi Fura-2 sulu çözeltiler içinde floresan iyon göstergelerin asetoksimetil (AM) esterleri dağıtmak yardımcı olmak için kullanılır.
- Kültür ortamı basınçla, Fura-2AM yükleme çözeltisi ile değiştirin (2 ile takviye edilmiş Ringer çözeltisi - 3 uM Fura-2AM, 0.02 mg / ml non-iyonik, F-127 ve 10 mM D-glukoz).
- karanlıkta, oda sıcaklığında 60 dakika boyunca inkübe edin.
- Ringer + 10 mM D-glukoz solüsyonu ile aspire Fura-02:00 çözümü ve yıkama hücreleri dışı boya kaldırmak için. İki kez bu adımı yineleyin.
- her bir 200 uL Ringer, 10 mM D-glikoz çözeltisi boş ve karanlıkta, oda sıcaklığında 30 dakika inkübe edilir.
- mikroskop burun parçasının üstünde sahnede odasına yerleştirin ve tutucu ile sabitleyin.
- lamba, kamera ve mikroskop açın ve 510 nm wav de emisyon tespit etmek için Fura-2 filtre seçinelength.
- İstenilen büyütme için ayarlayın ve seçilen alanda hücreleri odaklanır.
- karanlıkta arka plan ışığı çıkarmak ve pozlama süresi ayarlayın.
- 340 ve 380 nm dalga boylarında heyecanlı onlar tarafından Fura-2 yüklü hücreler istenilen hızı ve kayıt floresan tepkisi Set resim örnekleme. 340/380 sinyallerinin oranı TRPV1 faaliyeti dolayısıyla da bir hücre içi Ca2 + konsantrasyonu için gösterge ve olduğunu.
- TRPV1 ifade seviyesini değerlendirmek için 1 uM kapsaisin nihai bir doyma konsantrasyonu oluşturmak için pipetleme 200 uL Ringer çözeltisi içinde 2 uM kapsaisin ekleyin.
- indüksiyon zamana göre TRPV1 yanıtını Analiz ve ilgi protein için protokol belirler.
- Yama kelepçe tekniğiyle 4, 11, bütün hücre konfigürasyonu kullanılarak heterolog sistemlerde protein ifadesini ayarlanması.
- t hazırlayınO NaOH ile pH 7.4'e ayarlandı (mM) 140 NaCl, 2.3 KCl, 2 MgSO 4, 5 HEPES ve 5 2- (N-morfolino) etansülfonik asit (MES), bir çözelti banyosu.
- hücre dışı çözelti içinde kanal agonistinin doyurucu konsantrasyonlarının hazırlayın.
- 4 MQ - 2 bir direnç bir iç çapı 1.10 mm (ID) ve yangın cila ile cam elektrotlar çekin.
- (MM) 130 KCI, 4 NaCI, bir pipet çözeltisi hazırlayın MgSO 4 2, 0.5 CaCl2, 1, EGTA ve 10 HEPES, KOH ile pH 7.2 değerine ayarlanır. Kullanmadan önce pipet çözüm Filtre. Her deneyden önce, tek bir yangın parlatılmış cam pipet geri en az bir dakika pipet çözüm ucu daldırarak doldurulur ve daha sonra aynı pipet çözeltisi ile dolu bir şırınga ile erimiş ve gergin ucunu kullanarak doldurulur.
- Yavaşça oda sıcaklığında yaklaşık 2 mL banyo çözeltisi ile doldurulmuş 35 mm plastik petri de kaplanan hücreler, tek bir PDL kaplı lamel kaldırın. Bir ep altında gözlemlemeki-floresan mikroskop.
- epifluorescent mikroskop ile görüntülendi olarak hazırlanan lamel, bir EGFP pozitif hücre bulun ve görüntülenmiştir alanın merkezine taşıyın.
- Mikromanipülatör pipet tutucu dolu pipet takın ve hücre içi pipet çözüm kirlenmesini önlemek için sisteme pozitif basınç küçük bir miktar enjekte edin. sadece GFP Yukarıda indirin - pozitif hücre, düzgün direnç kontrol.
- Pipet hücre temas zamanda, bir cam pipet ve hücre membranı arasında bir GΩ mühür oluşturmak üzere negatif basıncın bir miktar uygulanır.
- emme kısa keskin darbe ile, pipet hücrenin hücre içeriği ile temas sağlayan hücre zarı bölünürler.
- sırasıyla, 5 kHz ve 0.5α - tüm hücreye amplifikatör moduna geçmek ve 1 ila Bessel filtre ve çıkış kazancını indirin.
- doyurma için geçerli cevabı kaydedinGerilim rampaları veya boşluk serbest protokolünü kullanarak kanal agonist konsantrasyonları.
- ifade verimlilikleri farklı proteinler arasında değiştiği için, farklı indüksiyon uzunluğu süreleri kullanarak kayıtları tekrarlayın.
- Tek kanallı kayıtları 4 için ideal bir indüksiyon süresi belirlenmesi.
- Bir pipet çözeltisi olarak, NaOH ile pH 7.4'e ayarlandı (mm) 150, Na-glukonat, 15 NaCl, 5 EGTA, 10 HEPES, içeren bir çözelti hazırlayın. banyo çözüm için adım 6.2.1 den çözümü kullanın.
- ID 0.86 mm cam pipetler 10 kadar direnç yangın cilalı kullanarak tüm hücre prosedürü tekrarlayın - 12 MQ ve mV -40 potansiyeli tutarak ayarlayın.
- daha önce açıklanan ve membran rüptür olarak membran üzerinde bir mühür oluşturun.
- Mikromanipülatör kullanarak, uzak hücreden membran yama ile pipet kaldırın.
- membran yama içeren pipet doğrudan bir sonraki perfüzyon sistemi yerleştirin.
- daha düşük Tsırasıyla, 5 kHz ve 10a skoru 2 - filtre ve çıkış kazancını Vladislav Tkachiev: Bessel.
- Yama yanıtına göre, bir ya da daha fazla kanal içeriyorsa, membran yama üzerinde agonist doyurucu konsantrasyonlarının değerlendirilmesi serpmek.
- başarıyla hücrelere uygulanan indüksiyon zamana karşı kaydedilen tek kanallı yamalar sayısını analiz edin. istenen sonuçlara göre endüksiyon süresini ayarlayın.
Sonuçlar
Hızlı bir şekilde uyarılabilir ifade modeli oluşturmak için, biz tetrasiklin bastırıcı protein (TR) ifade eden HEK293 hücrelerine kullandı (örneğin, T-Rex-293) ve CMV promoter ve çoklu klonlama sitesi arasında tetrasiklin operatör dizileri (TETO) ihtiva vektörleri (örneğin, pcDNA4 / TO). TRex-293 hücreleri içine transfekte edilmiş zaman TR teto bağlanan gibi, pcDNA4 / TO daki genin ekspresyonu, bastırılır. orta doksisiklin eklenmesi, böylece transfekte protein ekspresyonuna imkan veren, TR-teto etkileşimi engeller. Sıçan TRPV1 (rTRPV1) ifadesini kontrol etmek için ilk olarak yukarıda tarif edilen protokol kullanılarak vektöre / a pcDNA4 içine bu kanalın geni eklenir. Daha sonra, T-Rex-293 hücreleri protokol alanına 3 adımlara uygun olarak plazmid / rTRPV1- pcDNA4 ile transfekte edilmiştir. Transfeksiyondan sonra, rTRPV1 ifade (doksisiklinin varlığında inkübe edilmesi ile 1 mikron indüklenmiştirg 1 / ml) - 4 saat. Önemli bir şekilde, farklı bir doksisiklin konsantrasyonları, arzu edilen sentezleme oranı elde etmek için kullanılabilir. Biz onun agonist, kapsaisin uygulayarak her zaman bir noktada rTRPV1 ifade düzeyini değerlendirmek için elektrofizyolojik ve kalsiyum görüntüleme yöntemleri kullanılır. Canlı hücre kalsiyum görüntüleme kullanılarak, Şekil 1 'de gösterildiği gibi, kapsaisin uygulamadan sonra hücre içi kalsiyum düzeyi uzun indüksiyon kez yavaş yavaş arttırılır. indüklenmemiş hücrelerin aktivasyonu hücre ortam bileşenleri bir taban TR aktivitesi sızıntı, plazmid aşırı ekspresyonu, veya kalıntı tetrasiklin bağlı olabilir. Sonra, mV +80 -80 mV arasındaki voltaj rampaları uygulanması yama sıkıştırma tekniğinin tam hücre konfigürasyonu kullanılarak hücrelerden akımlar. Şekil 2, yüksek akım genlikleri, uzun indüksiyon süreleri ile elde edildiğini göstermektedir. 4 saat indüksiyon akım genliği doyma consiste olduğununt kalsiyum yanıt olarak görülen doygunluğu ile (Şekil 1). Son olarak, Parça sıkıştırma tekniğinin dış çıkış yapılandırmada rTRPV1 ekspresyon seviyelerini analiz edilmiştir. Tek kanallı analizi için uygun ekspresyon seviyelerine ulaşan iyon kanalı yapı-işlev okuyan büyük zorluklardan biri. Geçme üniter rTRPV1 iletkenlik 4 göre kayıtlı akım genliği eksize yama kanalların sayısını belirlemek için kullanılmıştır. Şekil 3'te gösterildiği gibi, doksisiklin inkübasyon süresi ile orantılı yama artar kanal sayısı. indüksiyon Bir saat sonra, biz (8 takım 0) herhangi bir kanal aktivitesini tespit etmek mümkün değildi. Ancak, her iki iki ve üç saatlik zaman noktalarında biz benzer başarı oranları tek kanal aktivitesini kaydedildi. iki saat içinde en yamalar yanıt vermedi iken notun, üç saat içinde en yamalar gösterdi tek için çoklu -kanal etkinliği. indüksiyon üç saat sonra, birden fazla kanal kayıt şansı, böylece, tek bir kanal sunulmaktadır koşullar altında iki ya da üç saat arasındadır güncel kayıt için en uygun indüksiyon süresi yüksektir. Birlikte bu sonuçlar iyon kanallarının sentezlenmesi sıkı bir şekilde kontrol ve protokol kullanılarak geçici transfeksiyondan sonra kontrol edilebilir olduğunu göstermektedir.

Şekil Kalsiyum Görüntüleme yoluyla görüntülendi olarak İndüksiyon Saati'ne göre TRPV1 Aktivasyon Artışlar 1. Tepki. (A) geçici ( 'Bazal') önce rTRPV1 ifade eden T-Rex-293 hücrelerinin ve (2 uM) uygulaması kapsaisin sonra Sözde renkli görüntüler. Beyaz barlar 30 um temsil etmektedir. Ölçü bar, hücre içi kalsiyum seviyelerini gösterir. Gösterildiği gibi (B) ile muamele transfekte T-Rex-293 hücrelerinde hücre içi kalsiyum düzeyi arasında zamanla değiştiğiniA. Her grafik 50 kapsaisin duyarlı hücrelerin bir ortalamasını temsil eder. indüksiyon süresi ile ilgili olarak kapsaisin yanıtlarında kademeli artışı not edin. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
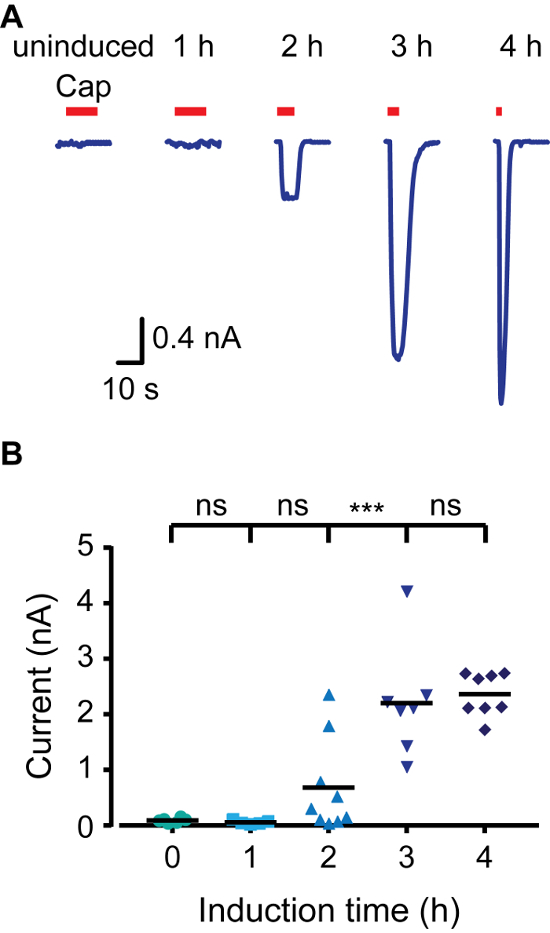
Şekil 2. TRPV1 Tüm Hücre Patch Kelepçe Kayıtlar İndüksiyon Zaman Artırılması Sonucu Güncel artırır. (A), T-Rex-293, yekpare bir hücre kayıtları geçici -40 mV bir tutma potansiyelinde rTRPV1 ile transfekte edildi. Hücreler Kapsaisin maruz sonra belirtilen süre doksisiklin (1 mcg / ml) ile uyarılan edildi ve ( 'Cap'; 1 uM; kırmızı çubuk). 11 bağımsız kayıtları - gösterilmiştir 6 temsil eden bir eser. (B) Ortalama / bütün hücre genlik temsil dağılım nokta arsa A. Statistic gösterilen uyarılmış olarak(- 11 hücreleri, n = 6) grupları arasında ark önemi *** p ≤0.001 temsil ettiği, çoklu karşılaştırmalar ile ANOVA ile belirlenmiş ve istatistiksel olarak önemli NS edildi. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.

TRPV1 Kayıtlar Tek Kanallı Patch Şekil 3. Başarı Oranı İndüksiyon Zaman Bağımlı olduğunu. (A) T-Rex-293 Outside-out kayıtları geçici 50 mV bir holding potansiyeli de rTRPV1 ile transfekte. Hücreler belirtilen süre doksisiklin (1 mcg / ml) ile uyarılan ve kapsaisin maruz bırakıldı ( 'Cap'; 1 uM; kırmızı çubuk). 9 bağımsız kayıtları - gösterilmiştir 6 temsil eden bir eser. (B) Ortalama eksize yama olarak kanal sayısını temsil eden / dağılım nokta arsa(- 9 hücreleri, n = 6) grupları arasında C. İstatistiksel önem gösterilmiştir *** p ≤0.001 temsil ettiği, çoklu karşılaştırmalar ile ANOVA ile belirlenmiş ve istatistiksel olarak önemli NS edildi. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Tartışmalar
Transfeksiyon ifade tutarlılığı ve istikrarı geliştirmek için birçok farklı varyasyonları ile protein ekspresyonu ve araştırma için yaygın olarak kullanılan bir protokoldür. Geçici transfeksiyon ayıraçları kolay, basit bir ilgi hücre ve protein transfeksiyon zaman gecede saat içinde analiz edilebilir protokolünü kullanmak için sunuyoruz. Analiz modu gibi elektrofizyoloji 2 tek kanallı kayıtları gibi protein ifadesi, tutarlı bir düzeyde gerektirir Ne yazık ki bu yaklaşım öngörülemeyen olabilir. Seçenek olarak ise, tetrasiklin bastırılabilir sentezleme sisteminde stabil hücre hatları ilgi 12 proteinin ekspresyon seviyesinin kontrol edilmesi için bir yöntem sunmak için geliştirilmiştir. Bu yaklaşım, doksisiklin gibi bir tetrasiklin türevi takviyesi tanıtımı, bir kültür içinde tüm hücrelerin tutarlı ifadesini sağlar. Bu protein düzeylerinin tutarlı ve hassas kontrolü için izin verirken, tProteinlerin 8 geniş bir yelpazede eğitim zaman o istikrarlı bir hücre hattı kurulması için gitmek zaman ve çaba uygunsuz ve dezavantajlı hale getirir.
Burada sunulan protokol sunulan mevcut transfeksiyon protokolleri orta-of-the-road çözümü sunar. uzun ve karmaşık prosedürleri kaçınarak geçici bir Tet bastırıcı sahip hücrelerin içine kontrollü bir organizatörü altında bir genin transfecting, biz kontrol ifadesini elde edebilirsiniz. Burada, kalsiyum görüntüleme ve elektrofizyoloji analizi ile non-selektif katyon kanalı TRPV1 kullanılır. 1 ug doksisiklin / ml (- 3, Şekil 1) ile 3 saat inkübe - Bu tek kanallı analizi için bu özel proteinin kontrollü sentezlenmesi için ideal bir endüksiyon süresi 2 arasında olduğu bulundu. daha geniş bir ölçekte, bu teknik, aynı zamanda ilgi herhangi bir protein için uygulanabilir. Bu protokol aynı zamanda zaman lar ifadesini kontrol için bir çözüm sunuyorFarklı proteinler veya protein dizilerinde mutasyonların GE aralığı ilgi ve her varyant için stabil bir hücre dizisi oluşturmak pratik değildir. Sonuçlar burada TRPV1 ifadesi için geçerli optimum zaman ve konsantrasyonlarını temsil ederken önemlisi, her gen kendi bireysel ve özel çeviri ve ticareti hızı, böylece her proteinin kalibrasyon ve ifade süreleri önemli ölçüde 13 farklı olacaktır vardır.
Bu teknik, kontrollü ekspresyonu için uygun bir çözüm sağlarken, bu sınırlamalar olmadan değildir. Sadece ticari Tet sistemi barındıran uygun hücre çizgileri bu özel hücre çizgileri gerçekleştirilecekse analiz tipi için uygun olmadığı için sorun teşkil eder, bu sistem ile kullanılabilir. Stabil bir biçimde transfekte hatlarına göre bir başka tuzak tüm hücreler transfeksiyon geçmesi, ve böylece tüm hücrelerin ilgi konusu proteini eksprese etmeyen olmasıdır. Genel olarak, biz, protein e kontrol etmek için uygun bir yol sunarbiyomedikal araştırmalar geniş bir dizi uygulanabilir, bir heterolog sistemde XPression.
Açıklamalar
Yazarlar ifşa hiçbir şey yok.
Teşekkürler
Bu eser (AP) İsrail Bilim Vakfı [Hibe 1721-1712, 1368-1312 ve 1444/16] tarafından desteklenmiştir. AP Brettler Merkezi ve David R. Bloom Center, Eczacılık Fakültesi, Kudüs İbrani Üniversitesi ile bağlanmıştır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| pcDNA™4/TO Mammalian Expression Vector | ThermoScientific Fisher | V102020 | |
| pcDNA™5/TO Mammalian Expression Vector | ThermoScientific Fisher | V103320 | |
| PureLink Quick PCR Purification Kit | Invitrogen | K310001 | |
| Swift™ MaxPro Thermal Cycler | Esco | n.a | |
| Restriction Enzymes | ThermoScientific Fisher | ER0501 | |
| Agarose | Lonza | 50004 | |
| PureLink Quick Gel Extraction Kit | Invitrogen | K210012 | |
| NanoDrop 2000c | ThermoScientific Fisher | ND-2000C | |
| T4 DNA Ligase | ThermoScientific Fisher | EL0011 | |
| One Shot® TOP10 Chemically Competent E. coli | ThermoScientific Fisher | C404006 | |
| Ampicillin (Sodium), USP Grade | Gold Bio | A-301-5 | |
| Tryptone for microbiology | Merck | 6.19305E+13 | |
| Yeast Extract | BD worldwide | 212750 | |
| SIF6000R Incubated Shaker | LAB COMPANION | 45H118 | |
| NucleoSpin®plasmid | Macherey Nagel | 740588.25 | |
| MS 300V Power Supply | Major Science | MP-300V | |
| Owl™ EasyCast™ B1A Mini Gel Electrophoresis System | ThermoScientific Fisher | B1A | |
| T-REx™-293 cell line | Invitrogen | R710-07 | |
| DMEM (1x), liquid (high glucose) | Gibco | 41965-039 | |
| HindIII-HF® | NEB | R3104S | |
| ApaI | NEB | R0114S | |
| CutSmart® Buffer | NEB | B7204S | |
| pcDNA™6/TR Mammalian Expression Vector | ThermoScientific Fisher | V102520 | |
| Fetal Bovine Serum (FBS), qualified, E.U.-approved, South America origin | Gibco | 10270106 | |
| HEPES Buffer Solution (1 M) | Biological Industries | 03-025-1B | |
| Penicillin-Streptomycin Solution | Biological Industries | 03-031-1B | |
| L-Alanyl-L-Glutamine (Stable Glutamine) (200 mM) | Biological Industries | 03-022-1B | |
| Heracell™ 150i CO2 Incubator | ThermoScientific Fisher | 51026406 | |
| MSC-Advantage™ Class II Biological Safety Cabinet | ThermoScientific Fisher | 51025411 | |
| Blasticidine S hydrochloride | Sigma-Aldrich | 15205-25MG | |
| Dulbecco’s Phosphate-buffered Saline (DPBS) Modified, without calcium chloride and magnesium chloride | Sigma-Aldrich | D8537-500ML | |
| Trypsin-EDTA (0.05%), phenol red | Gibco | 25300054 | |
| Double Neubauer Ruled Metallized Hemacytometer | Hausser Scientific | 31000 | |
| Opti-MEM I Reduced Serum Medium | Gibco | 31985070 | |
| TransIT®-LT1 Transfection Reagent | Mirus | MIR 2300 | |
| glass coverslips, #1 thickness, 12 mm diameter round | Knittel Glass | GG-12 | |
| BioCoat™ Poly-D-Lysine (PDL) | Corning | 354210 | |
| Water, Cell Culture Grade | Biological Industries | 03-055-1A | |
| Doxycycline hyclate | Sigma-Aldrich | D9891-1G | |
| Fura-2, AM ester | Biotium | BTM-50034 | |
| Pluronic® F-127 | Sigma-Aldrich | P2443-250G | |
| µ-Slide 8 Well | ibidi | 80826 | |
| (E)-Capsaicin | Tocris | 462 | |
| Olympus IX70 Fluorescence Microscope | Olympus | n.a | |
| Lambda DG-4 Wavelength Switcher | Sutter Instruments | n.a | |
| EXi Blue Fluorescence Microscopy Camera | QImaging | n.a | |
| MetaFluor Fluorescence Ratio Imaging Software | Molecular Devices | n.a | |
| Thin Walled Borosilicate Tubing | Sutter Instruments | B150-110-7.5HP | |
| Standard Walled Borosilicate Tubing | Sutter Instruments | B150-86-7.5HP | |
| Dimethyl sulfoxide anhydrous | Sigma-Aldrich | 276855 | |
| P1000 micropipette puller | Sutter Instruments | P-1000 | |
| MF-900 Microforge | NARISHIGE | n.a | |
| ValveBank perfusion sysytem | AutoMate Scientific | ||
| Digidata® 1440A Low-noise Data Acquisition System | Molecular Devices | n.a | |
| Axopatch 200B Amplifier | Molecular Devices | n.a | |
| pCLAMP 10.6 Software | Molecular Devices | n.a | |
| micromanipulator | Sutter Instruments | MP-225 |
Referanslar
- Ooi, A., Wong, A., Esau, L., Lemtiri-Chlieh, F., Gehring, C. A Guide to Transient Expression of Membrane Proteins in HEK-293 Cells for Functional Characterization. Frontiers in Physiology. 7, 300(2016).
- Thomas, P., Smart, T. G. HEK293 cell line: A vehicle for the expression of recombinant proteins. Journal of Pharmacological and Toxicological Methods. 51 (3), 187-200 (2005).
- Xu, X., Nagarajan, H., et al. The genomic sequence of the Chinese hamster ovary (CHO)-K1 cell line. Nature Biotechnology. 29 (8), 735-741 (2011).
- Hazan, A., Kumar, R., Matzner, H., Priel, A. The pain receptor TRPV1 displays agonist-dependent activation stoichiometry. Scientific reports. 5, 12278(2015).
- Kumar, R., Hazan, A., Basu, A., Zalcman, N., Matzner, H., Priel, A. Tyrosine Residue in the TRPV1 Vanilloid Binding Pocket Regulates Deactivation Kinetics. Journal of Biological Chemistry. 291 (26), 13855-13863 (2016).
- Kim, T. K., Eberwine, J. H. Mammalian cell transfection: the present and the future. Analytical and bioanalytical chemistry. 397 (8), 3173-3178 (2010).
- Preuss, A. K., Connor, J. A., Vogel, H. Transient transfection induces different intracellular calcium signaling in CHO K1 versus HEK 293 cells. Cytotechnology. 33 (1-3), 139-145 (2000).
- Dalton, A. C., Barton, W. A. Over-expression of secreted proteins from mammalian cell lines. Protein Science. 23 (5), 517-525 (2014).
- Lee, P. Y., Costumbrado, J., Hsu, C. -Y., Kim, Y. H. Agarose gel electrophoresis for the separation of DNA fragments. J Vis Exp. (62), e3923(2012).
- Bohlen, C. J., Priel, A., Zhou, S., King, D., Siemens, J., Julius, D. A bivalent tarantula toxin activates the capsaicin receptor, TRPV1, by targeting the outer pore domain. Cell. 141 (5), 834-845 (2010).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflügers Archiv European journal of physiology. 391 (2), 85-100 (1981).
- Jones, J., Nivitchanyong, T., et al. Optimization of tetracycline-responsive recombinant protein production and effect on cell growth and ER stress in mammalian cells. Biotechnology and Bioengineering. 91 (6), 722-732 (2005).
- Raphemot, R., Weaver, C. D., Denton, J. S. High-throughput screening for small-molecule modulators of inward rectifier potassium channels. J Vis Exp. (71), e4209(2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır