Method Article
유도 성 과도 형질을 통해 제어 이온 채널 식
요약
이종 발현 시스템을 통해 공부하는 이온 채널은 생물 의학 연구의 핵심 기술이되고있다. 이 논문에서는, 유도 성 프로모터의 조절하에 일시적인 형질 감염을 수행함으로써 엄격하게 제어 이온 채널 표현을 달성하는 시간 효율적인 방법을 제안한다.
초록
형질는 셀에 외국 핵산의 전달, 단백질 연구에 강력한 도구입니다. 이 방법으로, 이온 채널은 전기 생리 학적 분석, 생화학 적 특성화 돌연변이 연구 및 세포 과정에 미치는 영향을 조사 할 수있다. 과도 형질은 단백질이 일 몇 시간 내에 분석을 위해 사용할 수있는 간단한 프로토콜을 제공합니다. 이 방법은 비교적 간단하고 시간 효율적인 프로토콜을 제공하지만, 중요한 요소 중 하나가 분석하기에 적합한 생리 학적 관련성 레벨 또는 레벨 관심의 유전자의 발현을 교정한다. 이를 위해, 관심의 유전자의 발현을 조절하는 능력을 제공하는 여러 접근 방식이 등장했다. 여러 안정 세포 형질 감염 프로토콜 영구적 테트라 사이클린 조절 transcrip의 조절하에 세포의 게놈으로 관심의 유전자를 도입하는 방법을 제공한다적인 활성화. 이 기술은 안정적인 발현 수준을 생산하고 있지만, 관심있는 각각의 유전자는 살인 곡선의 교정, 세포 콜로니의 선택, 전체 더 많은 자원을 포함하여 숙련 된 작업의 몇 주를 필요로한다. 여기에서는, 이온 채널 분석에 필수적인 제어 된 방식으로 단백질을 발현 할 수있는 효율적인 방법으로 유도 시스템의 일시적 수용체 전위 양이온 채널 아과의 V 부재 (1) (TRPV1) 유전자의 일시적인 형질 감염을 사용하는 프로토콜을 제시한다. 우리는이 기술을 이용하여, 우리는 하나의 형질 전환과 데이터 수집의 각 유형에 필요한 제어 채널 레벨 칼슘 이미징, 전체 셀 및 단일 채널 분석을 수행 할 수 있다는 것을 보여준다. 전반적으로, 이는 이온 채널 구조 및 기능을 연구하기 위해 사용될 수있는 복제 기술을 제공한다.
서문
이종 시스템을 발현하는 세포의 기능 (1)의 다수의 연구에 가장 널리 사용되는 기술 중 하나이다. 낮은 내인성 단백질 프로파일, 최소한의 유지 보수 요구 사항, 안정적인 성장, 외국 DNA를 가지고 표현하는 능력은 인간 배아 신장 (HEK293) 및 생물학 연구 2, 3과 거의 필수 중국어 햄스터 난소 (CHO)와 같은 세포 라인을 만들었습니다. 이종 시스템을 사용하는 연구 분야는 막 단백질, 세포 내 신호 및 효소 활성을 포함한다. 세포 내로 외래 DNA의 형질 전환에 따라, 분석의 많은 다른 형태의 전기 생리학, 비율 적 칼슘 이미징, 웨스턴 블롯 등 4, 5를 포함하여 수행 될 수있다.
이종 발현 시스템에 대한 잠재적 인 응용 프로그램의 다양한에 많은 differe 인해NT 시약 및 산물이 세포 및 자질 6을 이용하도록 개발되었다. 일시적 또는 영구적으로 외래 단백질을 연구하는 세포로 외국 DNA를 통합 DNA 전달 시스템 생물학 연구를위한 가장 인기있는 유용한 도구 중 하나가되고있다. 구체적으로는, 세포에 일시적으로 형질 DNA 널리 비교적 짧은 시간 및 재료를 필요로하는 단순 직진 처리로서 사용된다. 또한, 형질 감염을 겪는 세포들의 성공률 7 높다. 이 기술은 녹색 형광 단백질 (GFP)과 같은 마커 유전자와 결합 및 칼슘 이미징 및 전기 생리학 (5)와 같은 다양한 기술을 사용할 수있는 경우 매우 안정하다. 불행하게도하지만, 일시적으로 숙주 세포에 DNA를 발현하는 것은 셀 당 발현 수준이 신뢰할 그 이상으로, 몇 가지 주요 함정이 함께 제공됩니다. 플라스미드 DNA의 카피 수는 U 촬영셀 당 p는 따라서 개별 실험의 표현은 크게 2 다를 수 있습니다, 제어 할 수없는 것입니다. 어느 생리적 조건을 복제하려고하거나 정확한 데이터 수집 기술을 수행 할 때 이러한 문제가 현저해진다.
단일 보장 관심의 유전자와 같은 테트라 사이클린 리프레 발현 시스템과 같은 유도 성 프로모터의 엄격한 제어하에 세포의 게놈 내로 삽입 될 수있는, 안정된 형질 감염 프로토콜이 설계되어 전술 한 합병증에 대한 해결책으로서, 플라스미드의 카피가 각 세포의 게놈에 통합 만 독시사이클린의 존재 하에서, 예를 들면, 전사기구의 유도 후 발현된다. 이 불일치 단백질 발현 수준 장애를 해결하지만,이 방법은 일시적 형질 빠르고 비교적 간단한 프로토콜의 편의를 잃는다. 안정적인 세포주를 수립하는 것은 whic 적어도 몇 주 소요H 하나는 단백질 발현을 유지하고 벡터의 통합을 위해 선택 솜씨 세포 콜로니를 성장 특정 항생제에 의해 설정된 사멸 곡선을 보정한다. 전반적으로이 낮은 성공률 8 훨씬 많은 시간과 노력이 필요.
여기서는 어떤 유도 세포주에서의 발현 수준을 제어하기위한 간단하고 효과적인 방법을 제공하는 대중적인 형질 전환 방법 중 모두의 장점을 그리는 중간 프로토콜을 소개한다. 유도 TET 시스템 셀을 유지하면서, 우리는 일시적 동성 리프레 시스템과 결합 할 수있는 벡터에 라이 게이션 관심 우리 유전자 일시적 수용체 전위 양이온 채널 아과의 V 부재 (1) (TRPV1)를 형질. 이러한 방식으로, 유전자를 발현하기 시작하지 않고 세포 내로 도입 될 수있다. 독시사이클린 만의 첨가로 유전자 단백질 EXPR의 레벨을 보정 할 수 있도록 허락 표현하기 시작 않는다생리적 조건에서 관찰되는 기술 또는 레벨에 따라 ession. 우리 프로토콜은 또한 안정적으로 발현하는 세포주를 생성과 관련된 긴 합병증을 피할 수있다. 우리는에서 칼슘 이미징에서 TRPV1 활성화의 변화 수준을 보여주는 것으로 시작되지 않은 유도 유도하는 방법과 세포 내 칼슘 농도의 증가는 상관 관계가 4 시간을 통해. 그런 다음 유도 시간이 증가함에 따라 증가하는 전류를 나타내는 패치 클램프 기술의 전체 셀 구성 프로토콜 중복. 마지막으로, 단일 채널 전기 생리학 기록의 예를 제시하고, 단백질의 각각의 단위에 기초하여 정확한 데이터 수집을 찾을 때이 기술은 발현 조절에 특히 유용하다 보여준다. 따라서 실험 제공 MO과 조건을 제어하는 방법을 제공하고, 긴 세포 배양 합병증을 피하면서 우리 프로토콜을 통해, 우리는 이종 시스템에서 단백질 발현을 조절하기위한 편리한 방법을 제공한다복제 결과를 다시.
프로토콜
1. 벡터의 Repressible 사이트에 관심의 유전자를 결찰
- / TO 같은 pcDNA5 / FRT / TO 또는 pcDNA4로 유도 벡터를 얻습니다.
- 실리 DNA 분석 소프트웨어 (4)에 의해 또한 선택한 벡터의 여러 복제 사이트에 등장 유전자의 중간에 잠재적으로 취약 제한 사이트에 대한 관심의 유전자를 분석 할 수 있습니다.
- 사용하여 표준 오버랩 PCR 기법 4 (목적 유전자에서 발견되지 않는) 선택된 두 개의 제한 효소 인식 부위로 관심의 유전자의 개시 코돈 앞에 삽입 제, 및 종결 코돈 이후의 두번째 측면에.
- 벡터 모두 소화 자체를 방지하기 위해 30 분 동안 벡터 반응 한 부 송아지 창자의 포스 파타 아제 (CIP)을 첨가하여 한 시간 동안 효소 "가공 온도에서, (단계 120에서 선택된) 제한 효소로 삽입 결찰.
- 1 % 아가 로스 겔상에서 분해 된 DNA를 전기로드 (9)에 의해 절단 된 부분을 분리한다.
- UV 광을 이용하여, 블레이드 벡터 원하는 세그먼트를 함유하는 겔 조각을 절단하여 라이 게이션 될 삽입한다.
- (상용 가능한 DNA 추출 키트를 사용하여) 아가로 오스 겔 조각에서 DNA 세그먼트를 추출하고 260 nm에서 분광 광도계에 의한 최종 농도를 측정한다.
- 실온에서 20 분 동안 T4 리가 아제 효소를 이용하여 유도 선택된 벡터에 목적 유전자를 결찰. 인서트 한 몰비 : 벡터 삽입은 벡터로 결찰 확률을 높이기 위해, 3을 사용한다. 제어를 위해 만 벡터를 포함하는 연결 반응을 준비합니다.
- 세균 변환의 경우, 50 μL 유능한 대장균에 혼자 벡터 및 벡터 + 유전자의 10 NG를 추가합니다. 42 ° C 45 초 인큐베이션 30 분 동안 얼음에서 인큐베이션 튜브. 즉시 다시 배치2 분 동안 얼음에 500 μL LB 배지에 형질 전환 된 박테리아를 옮긴다. 220 rpm으로 교반하면서 37 ℃에서 1 시간 동안 품어.
- 성공적으로 형질 전환 된 박테리아의 선택은 적절한 항생제를 포함하는 제조 된 LB 아가 플레이트 (1.9에 기술 된 바와 같이) 각각의 반응 플레이트 100 μL (예를 들어, 100 μg의 / ㎖ 암피실린 pCDNA4 / TR을 사용하는 경우).
- 37 ° C에서 하룻밤 성장하도록 허용합니다. 플레이트를 단단히 플라스틱 파라핀 필름을 배치하여 최대 2 주 동안 4 ℃에서 저장 될 수있다.
- 10 μL 팁을 사용하여 개별 식민지를 들어 올리고, 220 rpm으로 교반하면서 37 ° C에서 + 항생제 중 3 mL의 LB에서 하룻밤 성장 할 수 있습니다. 관심의 DNA와 박테리아가 동결 될 수있다 (-20 ° C) 11,000 XG에서 LB와 박테리아를 원심 분리하고 상층 액을 흡입에 의한 단기간의 운용합니다. 장기 보관은 -80 ° C에서 글리세롤 주식과 박테리아를 동결해야합니다.
- throu DNA를 추출GH 미니 사전, 260 nm의 5에서 분광 광도계에 의한 최종 농도를 측정한다.
- 정제 된 구조 (4)를 시퀀싱하여 관심의 유전자를 성공적으로 삽입을 확인합니다. 대안 적으로, 제한 효소 절단 세그먼트를 분리하여 이들의 존재를 평가하기 위해 전기를 사용하여 효소 길이만큼 구조체의 진단 소화 또한이 단부 (4)에 이용 될 수있다.
TetR을 표현 2. 배양 세포주
- 자신의 게놈 DNA에 통합 구정 리프레 플라스미드를 형질 세포 배양 라인을 얻습니다. 여기서 프로토콜은 예를 들어 pcDNA6 / TR 플라스미드를 품고 인간 배아 신장 293T 세포 (HEK-293T)를 사용하여 기록됩니다.
- 둘 베코의 수정 이글스 중간 (DMEM)와 100mm 조직 배양 접시에 씨앗 세포는 10 % FBS와 보충, 1 % 페니실린 - 스트렙토 마이신, 2 mM의 L- 글루타민, 25 mM의 HEPES, (이하 : 전체 DMEM)의 pH 7.3와 O를 품다 37에서 / N# 176; C, 5 % CO 2. 세포와 모든 작업은 무균 조건에서 생물학적 후드에서 수행해야합니다.
- , 테트 리프레 서 유전자의 발현을 유지 배지를 흡인 5 μg의 / ㎖의 블라스트 보충 된 완전 DMEM으로 교체하기 위하여. 37 ° C와 5 % CO 2에서 세포를 품어.
- 세포가 80에 도달하면 - 90 % 포화 상태, 배지를 흡인하고 부드럽게 (칼슘 및 마그네슘)없이 DPBS 두 번 세포를 씻어 37 ℃로 가온.
- 부드럽게, 기계적 손상을 초래하지 않고 세포를 DMEM 리프트는 0.05 % 트립신을 함유하는 배양액을 부화하기 위해 1.5 분 동안 37 ℃로 가온.
- 전체 DMEM 동량 트립신 작용을 차단. 부드럽게 피펫 아래로 셀을 들어 올려 멸균 튜브로 전송하기 위해서입니다.
- 5 분 동안 200 XG에서 세포를 원심 분리기.
- 뜨는을 대기음 1 mL의 전체 DMEM로 교체합니다. 더까지 상하 세포 용액을 피펫하지세포 덩어리를 볼 수 있습니다. 개수와 혈구를 이용하여 세포의 수를 계산한다.
- 씨앗 1-2 × 10 5 μg의 / ML의 블라스트와 12 mL의 전체 DMEM을 포함하는 100mm 조직 배양 접시에 6 셀. 그들은 90 %의 포화 상태에 도달으로 일주일에 두 번 세포를 분할합니다.
3. 세포로 관심의 플라스미드 형질 감염
- 0.9 mL의 전체 DMEM로 제조 된 12- 웰 플레이트 웰에 상기 전사 셀 바와 같이 분할 세포의 방법과 동일한 방법을 사용하여, 충분한 50 % 합류 (~ 200,000 세포)를 확인하고, CO 2, 37 ℃에서 밤새 배양 부란기.
- pcDNA4 함께 형질 감염 혼합물을 제조 / 관심의 유전자를 포함하기 위해, 불활성 플라스미드를 최종 부피 100 μL하기 위해 (필요한 경우) 1 μg의 3 μL 지질 형질 감염 시약과 DMEM에 총 DNA 량을 가지고있다. 다른 단백질은 다른 효율 표현으로 사용되는 플라스미드 DNA의 최적 량은 광범위하게 변화한다. 차기rophysiological 실험은 성공적으로 형질 4를 받아야 세포를 시각화하기 위해 형질 전환 칵테일 포유 동물 발현 플라스미드에서 EGFP를 포함한다.
- 30 분 동안 RT에서 형질 전환 혼합물을 인큐베이션.
- 12 웰 플레이트에 도금 세포에 드롭 현명 형질 전환 혼합물을 피펫 팅에 의해 세포를 형질과 DNA 및 형질 전환 시약의 균일 한 분산을 보장하기 위해 적극적으로 판 바위. 세포를 형질 ~시의 80 % 융합 성이어야한다.
- 37 ° C에서 형질 감염된 세포 O / N을 품어 5 % CO 2.
- 세포가 성공적으로 전기 생리학을 수행하는 경우 다음과 같은 아침 UV 램프에서 EGFP의 형광 신호를 관찰하여 형질 전환 된 것을 확인합니다.
폴리 - D - 라이신 (PDL) 4. 도금 세포 Coverslips는 / 웰스
- 70 % 이소 프로필 에탄올 용액으로하여 dousing 12mm 커버 슬립을 소독. 건조하고 하나의 coversl를 배치전기 생리 기록 24 웰 플레이트의 각 웰에 IP를.
- 칼슘 촬상 챔버의 각 커버 슬립 또는 웰 상에 0.2 ㎎ / ㎖ 용액 PDL - 0.1의 용액을 피펫.
- 5 % CO 2 배양기에서 37 ° C에서 30 분 동안 앉아 할 수 있습니다.
- 각 세척 사이에 흡입, 세포 배양 등급을 두 번 증류수 (DDW)로 3 회 세척한다. 최종 세척 후, 완전히 건조 및 RT에 앉아 할 수 있습니다.
- 전기 생리학의 경우, 37 ° C로 예열 500 μL 전체 DMEM과 각 웰에 포함 된 PDL 코팅 커버 슬립을 입력합니다.
- 전술 한 바와 같이 형질 감염된 세포를 분할하는 방법과 동일한 방법을 수행한다. 전기 생리학 기록 각 PDL 코팅 커버 슬립의 중심까지 트립신 처리 및 차단, 전사 셀 (또는 약 30,000 세포)의 80 μL 다음 세포를 재현 탁 후에. 세포가 적어도 1.5 시간 동안 침전 또는 5 % CO 2 배양기에서 37 ° C에서 하룻밤 배양 할 수 있습니다.
- 잘 각 PDL 코팅 된 칼슘 이미징의 중심에 세포의 칼슘 이미징 전송 및 장소 20 μL (약 20,000 세포)를 참조하십시오. 세포가 적어도 30 분 동안 정착 및 각 웰에 180 μL에게 전체 DMEM을 추가 할 수 있습니다.
5. 유도 유전자 발현
- 제조업체의 지시에 따라 DDW 1 ㎎ / ㎖의 독시사이클린 스톡 용액을 제조 하였다. 최대 3 주 동안 4 ° C에서 빛으로부터 보호 원액을 유지합니다. 장기 저장을 위해 -20 ℃에서 독시사이클린 원액을 유지한다.
- 전체 DMEM에 신선한 2 μg의 / ㎖ (전기 생리학) 또는 3 μg의 / ㎖ (칼슘 이미징) 독시사이클린 솔루션을 준비하고 37 ℃로 따뜻하게.
- 전기 생리 녹음, 피펫을 위해 각 / ML의 독시 싸이클린 솔루션 2 μg의 500 μL 잘 1 μg의 / ML의 독시 싸이클린의 최종 농도를 확인합니다. 칼슘 이미징 최종 집중하고 있도록 각 웰에 3 μg의 / ㎖의 독시사이클린 용액 100 μL를 추가1 μg의 / ML의 독시 싸이클린의 기. 유도의 시간을 기록합니다.
- 원하는 37 ° C에서 유도 시간의 양을 5 % CO 2 품어.
단백질 발현 6. 캘리브레이션 타임 라인
- 칼슘 이미징 5, 10을 통해 단백질 발현을 보정
- 링거액 (140 mM의 염화나트륨, 2.5 밀리미터의 KCl, 1.8 mM의 염화칼슘 2, 2 mM의 NaOH로 7.4로 조정 황산, 20 mM의 HEPES, 산도)과 따뜻한 37 °의 C를 준비합니다.
- 링거액에 채널 작용제의 농도를 포화 준비합니다. 세포와 세포 외 용액을 함유하는 칼슘 촬상 챔버에 첨가 될 때 효능 제의 양이 희석되기 때문에, 작용제의 원하는 최종 농도의 양을 두 배로. 이것은 또한 제어 할 각 웰 임계 목욕 액의 양을 만든다.
- D의 비 이온 F-127의 20 % W / V의 용액을 제조MSO. 비이 온성 F-127을 용해 될 때까지 40 ° C의 용액을 가열한다. RT에서 비이 온성 F-127 용액을 저장하고 사용하기 전에 40 ℃로 가온. 비 이온 F-127 등의 Fura-2 수용액 형광 이온 지표 아세 (AM) 에스테르를 분산시키는 데 사용된다.
- 대기음 매체와의 Fura-오전 2시 로딩 솔루션으로 교체 (2 보충 링거액 - 3 μM의 Fura - 오전 2시, 0.02 ㎎ / ㎖ 비 이온 F-127, 10 mM의 D-포도당).
- 어둠 속에서 실온에서 60 분 동안 품어.
- 링거 + 10 mM의 D-포도당 용액과 대기음은 Fura - 오전 2시 솔루션 및 세척 세포는 세포 외 염료를 제거합니다. 두 번이 단계를 반복합니다.
- 물론 각 200 μL 링거 + 10 mM의 D-포도당 용액을두고 어둠 속에서 실온에서 30 분 동안 품어.
- 현미경 코 조각 위의 무대에서 챔버를 놓고 홀더로 고정합니다.
- 램프, 카메라와 현미경 켜고 510 nm의 WAV에서 방출을 감지의 Fura-2 필터를 선택elength.
- 원하는 배율을 조정하고 선택한 필드에서 셀을 초점을 맞추고있다.
- 어둠 속에서, 배경 등을 빼고 노출 시간을 설정합니다.
- 340 및 380 nm의 파장에서 흥미로운 그들에 의해의 Fura-2로드 된 세포의 원하는 속도 및 기록 형광 응답에서 설정 사진 샘플링. 380분의 340 신호의 비율은 TRPV1의 활동에 따라서 또한 세포 내 칼슘 이온 농도 표시하고 있습니다.
- TRPV1의 발현 수준을 평가하기 위하여 1 μM의 캡사이신의 최종 포화 농도를 만들기 위해 피펫 200 μL 링거액 2 μM의 캡사이신을 추가한다.
- 유도 시간에 따라 TRPV1 응답을 분석하고 관심있는 단백질 프로토콜을 결정합니다.
- 패치 클램프 기술 (4) (11)의 전 세포 구성을 사용하여 이종 시스템에서 단백질 발현 조절.
- t 준비그 NaOH로 pH를 7.4로 조정 (㎜) 140의 NaCl, 2.3 KCl을 2 황산 5 HEPES, 5 2- (N- 모르 폴리 노) 에탄 설 폰산 (MES)의 용액을 목욕.
- 세포 외 용액 채널 작용제의 농도를 포화 준비한다.
- 4 MΩ - 2의 저항에 내경 1.10 mm의 (ID) 및 화재 - 폴란드어 유리 전극을 당기십시오.
- (MM) (130)의 KCl, 4 염화나트륨의 피펫 솔루션을 준비 황산 2, 0.5 염화칼슘은 2, 1 EGTA, 10 HEPES는 KOH으로 pH 7.2로 조정. 사용 전에 용액을 피펫 필터. 각 실험하기 전에, 하나, 화재 - 광택 유리 피펫 다시 적어도 분 동안 피펫 용액에 끝을 잠수하여 작성하고 같은 피펫 솔루션 가득 주사기와 용융 연신 팁을 사용하여 채워집니다.
- 부드럽게 실온에서 약 2 mL의 목욕 솔루션으로 가득 35mm 플라스틱 페트리 접시에 우물에서 도금 세포 하나 PDL 코팅 커버 슬립을 들어 올립니다. EP에에서 관찰I-형광 현미경.
- epifluorescent 현미경으로 가시화로 제조 된 커버 슬립에, EGFP 양성 세포를 찾아 시각화 분야의 중심으로 이동합니다.
- 미세 조작기의 피펫 홀더에 충전 된 피펫을 부착하고, 세포 피펫 용액의 오염을 피하기 위해 시스템에 양압 소량 주입. 바로 GFP 위로 내려 - 양성 세포를 적절한 저항을 검사.
- 피펫 셀 접촉으로 유리 피펫 및 세포막 사이 GΩ 밀봉을 생성하기 위하여 부압 소량 적용된다.
- 흡입 짧은, 예리한 펄스 피펫은 세포의 세포 내 내용물과 접촉 할 수 있도록, 세포막을 파괴.
- 각각 5 kHz 및 0.5α - 전체 셀 앰프 모드를 전환하고 1로 베셀 필터 출력 게인을 낮 춥니 다.
- 포화에 대한 전류 반응을 녹음전압 램프 또는 간극없는 프로토콜을 이용하여 채널 작용제의 농도.
- 발현 효율이 다른 단백질 사이에서 변경되기 때문에, 다른 길이의 유도 시간을 사용하여 기록을 반복한다.
- 단일 채널 녹음 4 이상적 유도 시간을 결정.
- 피펫 용액으로서, NaOH로 pH를 7.4로 조정 (MM) (150) 나 글루코 네이트, 염화나트륨 (15), EGTA (5), 10 HEPES, 용액을 준비한다. 목욕 솔루션의 단계 6.2.1에서 솔루션을 사용합니다.
- ID 0.86 mm 유리 피펫 (10)의 저항에 불을 연마하여 전체 세포의 절차를 반복 - 12 MΩ 및 MV를 -40 잠재력을 보유 설정합니다.
- 이전에 기술과 멤브레인 파열로 막에 도장을 만듭니다.
- 미세 조작기를 사용하여, 멀리 세포에서 막 패치 피펫을 들어 올립니다.
- 막 패치를 포함하는 피펫에 바로 옆에 재관류 시스템을 배치합니다.
- 낮은 t각각 5 kHz 및 10α - 그는 2 필터와 출력 게인을 베셀.
- 패치가 상기 응답에 따라 하나 이상의 채널을 포함하는 경우, 막에 패치 작용제의 농도를 포화 평가 관류.
- 성공적으로 셀에인가되는 유도 시간에 대해 기록 된 단일 채널 패치의 수를 분석한다. 원하는 결과에 따라 유도 시간을 조정한다.
결과
신속하게 유도 표현 모델을 생성하기 위해 테트라 사이클린 리프레 서 단백질 (TR)을 표현하는 HEK293 세포를 사용했다 (예를 들면, T-REX-293) 및 CMV 프로모터 및 다중 클로닝 부위 사이의 테트라 사이클린 오퍼레이터 서열 (TETO)을 함유 벡터 (예를 들어, pcDNA4 / TO). TREX-293 세포로 형질 전환 된 경우 TR은 Teto의 결합으로, pcDNA4 / TO에 대한 관심의 유전자의 발현이 억제된다. 배지에 독시사이클린 추가 따라서 형질 전환 단백질의 발현을 허용 TR-TETO 상호 작용을 방지한다. 래트 TRPV1 (rTRPV1)의 발현을 조절하려면 먼저, 상술 한 프로토콜을 이용하여 벡터에 / A pcDNA4이 채널의 유전자를 삽입했다. 다음으로, T-REX-293 세포는 프로토콜의 지점 3의 단계에 따라 플라스미드 /를 rTRPV1- pcDNA4로 형질했다. 형질 감염 후, rTRPV1 식 (독시사이클린의 존재 하에서 세포를 배양하여 1 μ를 유도g 1 / ㎖) - 4 시간. 중요한 다른 독시사이클린 농도는 표현하고자하는 속도를 달성 할 수있다. 우리는 작용제, 캡사이신을인가하여 각 시점에서 rTRPV1 발현 수준을 평가하기 위하여 전기 생리 칼슘 촬상 방법을 사용 하였다. 살아있는 세포 칼슘 이미징을 사용하여,도 1에 도시 된 바와 같이, 캡사이신 도포 후 세포 내 칼슘 수준이 더 긴 유도 시간으로 점차 증가된다. 유도되지 않은 세포의 활성화는 세포의 미디어 구성 요소에 기초 TR 활동 누출, 플라스미드의 과발현 또는 잔류 테트라 사이클린에 기인 할 수있다. 다음으로 조작량 +80 -80 MV 사이의 전압 램프를 적용 패치 클램프 기술의 전체 세포 구성을 사용하여 셀들로부터의 전류를 기록 하였다. 그림 2는 높은 전류의 진폭이 더 이상 유도 시간을 얻을 수 있습니다 보여줍니다. 4 시간 유도에서 전류 진폭의 포화 consiste입니다NT 칼슘 응답하여 본 채도 (도 1). 마지막으로 패치 - 클램프 기법의 외측 아웃 구성 rTRPV1 발현 수준을 분석 하였다. 단일 채널 분석에 적합한 발현 레벨을 도달 이온 채널 구조 - 기능 연구의 주요 문제 중 하나. 게시 단위 rTRPV1 컨덕턴스 (4)에 기초하여, 기록 전류 진폭은 적출 패치 채널의 수를 결정하는 데 사용되었다. 도 3에 도시 된 바와 같이, 독시사이클린의 배양 시간에 비례하여 증가 패치 채널의 개수. 유도 한 시간 후, (8로부터 0) 임의의 채널 활동을 검출 할 수 없었다. 그러나, 모두 2 차원 및 3 시간 시점에서 우리는 비슷한 성공률에 하나의 채널 활동을 기록했다. 2 시간 대부분의 패치가 응답하지 않았습니다 동안 참고로, 3 시간에 대부분의 패치는 보여 주었다 단일 - 투 - 멀티 채널 활동. 유도 3 시간 후, 다수의 채널을 기록하는 기회는 따라서 단일 채널이 제시 조건이 3 시간 사이에서 전류를 기록 할 수있는 최적의 유도 시간 높다. 함께 이들 결과는 이온 채널의 발현이 엄격하게 제어하고이 프로토콜을 이용하여 일시적 형질 감염 후에 조절 될 수 있음을 보여준다.

그림 칼슘 이미징을 통해 가시화로 유도 시간에 따라 TRPV1 활성화 증가 1. 응답. (A) 일시적으로 ( '기저') 전에 rTRPV1을 표현하는 T-REX-293 세포의 (2 μM) 응용 프로그램을 캡사이신 후 의사 컬러 이미지. 화이트 막대는 30 μm의를 나타냅니다. 스케일 바는 세포 내 칼슘의 수준을 나타냅니다. 도시 된 바와 같이, (B)는 처리 된 형질 T-REX-293 세포에서의 세포 내 칼슘 농도의 시간에 따른 변화A.에서 각각의 그래프 (50) 캅사이신 감수성 세포의 평균을 나타낸다. 유도 시간과 관련하여 캡사이신 응답의 단계적 증가합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
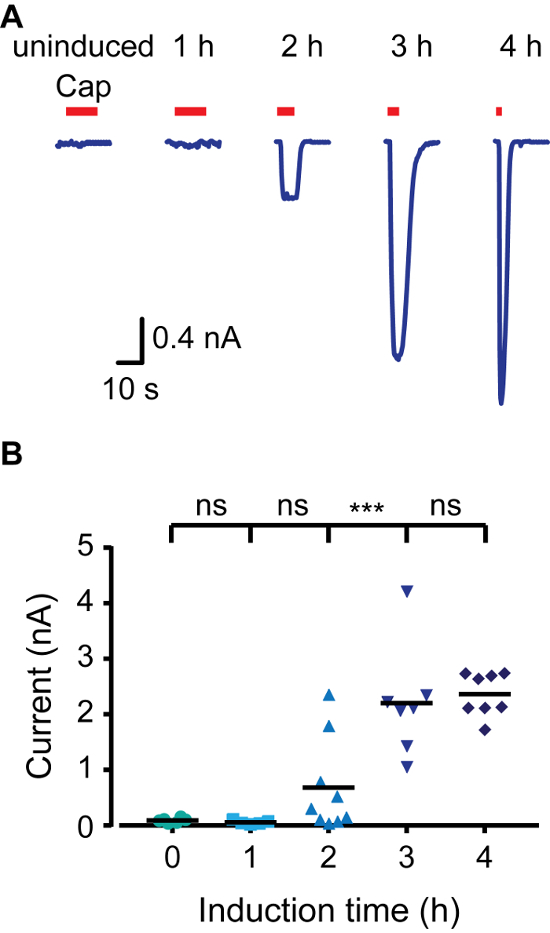
그림 2. TRPV1 전체 셀 패치 클램프 녹음에 유도 시간 증가의 결과로 현재 증가합니다. (A) T-REX-293에서 전체 셀 녹음은 일시적 -40 MV의 유지 가능성에 rTRPV1로 형질. 세포는 캅사이신에 노출 된 후 지정된 시간 동안 독시 싸이클린 (1 μg의 / mL)로 유도 하였다 ( '모자'1 μM, 빨간색 막대). 11 독립적 인 녹음 - 도시 6의 대표 추적이다. (B) 평균 / 전체 셀 크기를 나타내는 분산 형 도트 플롯 A. 통계에 도시 된 바와 같이 유발(- 11 세포 N = 6) 군 사이에 알 중요성은 *** 페이지 ≤0.001를 나타냅니다, 다중 비교와 ANOVA로 결정 통계적으로 유의하지 NS-했다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

TRPV1 녹음 단일 채널 패치 그림 3. 성공률은 유도 시간에 따라 달라집니다. (A) T-REX-293에서 외부 아웃 녹음이 일시적으로 50 MV의 유지 가능성에 rTRPV1로 형질. 세포는 지정된 시간 동안 독시 싸이클린 (1 μg의 / mL)로 유도하고, 캡사이신에 노출되었다 ( '모자'1 μM, 빨간색 막대). 9 독립적 인 녹음 - 도시 6의 대표 추적이다. (B) 평균 적출 패치 등의 채널 수를 나타내는 / 분산 도트 플롯(- 9 셀 N = 6) 그룹 사이 A. 통계적 유의성에 도시는 *** 페이지 ≤0.001를 나타냅니다, 다중 비교와 ANOVA로 결정 통계적으로 유의하지 NS-했다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
형질 발현 일관성과 안정성을 향상시키기 위해 여러 가지 변형 단백질 발현 연구에 널리 사용되는 프로토콜이다. 일시적 형질 전환 시약은 쉽고 간단한 관심 세포 단백질은 형질 감염 시간 내지 밤새 시간 이내에 분석 할 수있는 프로토콜을 사용하도록 제안한다. 분석의 모드는 전기 생리학 2의 단일 채널 녹음 등의 단백질 발현의 일관된 수준을 필요로하는 경우 불행하게도이 방법은 예측할 수 없습니다. 대안 적으로, 테트라 사이클린 repressible 발현 시스템에서 안정적인 세포주 관심 12 단백질의 발현 수준을 조절하는 방법을 제공하도록 개발되었다. 이 방법은 독시사이클린과 같은 테트라 사이클린 유도 보조제의 도입과 함께 배양 된 모든 셀의 일관된 발현을 제공한다. 이 단백질 수준의 일관되고 정확한 제어 할 수 있지만, t단백질 8의 다양한 연구 때 그가 안정한 세포주를 확립에 이동 시간과 노력이 불편하고 불리한다.
여기에 제시된 프로토콜은 제공하는 현재의 형질 전환 프로토콜에 중도 솔루션을 제공합니다. 길고 복잡한 절차를 회피하면서 과도기 테트 리프레을 갖는 세포로 제어 가능한 프로모터에 따라 유전자를 형질함으로써 제어 식을 얻을 수있다. 여기서는 칼슘 이미징 및 전기 생리학 분석 비 선택적 양이온 채널 TRPV1을 사용했다. 1 μg의 독시 싸이클린의 / ㎖ (- 3 그림 1)로 3 시간 배양 - 우리는 하나의 채널 분석이 특정 단백질의 제어 표현을위한 이상적인 유도 시간이 2 사이 것을 발견했다. 광범위한 규모에,이 기술은 또한 흥미있는 단백질에 적용될 수있다. 이 프로토콜은 또한 경우 LAR 발현을 제어하는 솔루션을 제공한다다른 단백질 또는 단백질 서열에서의 돌연변이 GE 범위가 관심있는 각각의 변형 안정적인 세포주를 만들면 비실용적이다. 결과는 여기 TRPV1 발현에 적용 할 수있는 최적의 시간과 농도를 표현하면서 중요한 것은, 각각의 유전자는 개인과 특정 번역 및 인신 매매 속도, 따라서 각 단백질의 교정 및 발현 시간은 크게 13 다를 수 있습니다.
이 기술은 제어 된 표현하는 편리한 해결책을 제공하지만, 그것은 한계가없는 것은 아니다. 단지 상업적 테트 시스템 은닉 가능한 세포주는 이들 특정 세포주 수행되는 분석의 유형에 적합하지 않은 경우에 문제가있다이 시스템에 사용될 수있다. 안정하게 형질 라인에 비해 다른 함정 모든 세포 형질 감염을 겪게하고, 따라서 모든 셀이 관심의 단백질을 발현하지 않는 것이있다. 전체적으로, 우리는 단백질 E를 제어하는 편리한 방법을 제공한다생물 의학 연구의 다양한 적용 할 수있는 이종 시스템 xpression.
공개
저자는 공개 아무것도 없어.
감사의 말
이 작품은 (AP에) 이스라엘 과학 재단 [보조금 12분의 1,721, 12분의 1,368, 및 16분의 1,444]에 의해 지원되었다. AP는 Brettler 센터와 데이비드 R. 블룸 센터, 약학 대학, 예루살렘의 히브리 대학과 연관되어있다.
자료
| Name | Company | Catalog Number | Comments |
| pcDNA™4/TO Mammalian Expression Vector | ThermoScientific Fisher | V102020 | |
| pcDNA™5/TO Mammalian Expression Vector | ThermoScientific Fisher | V103320 | |
| PureLink Quick PCR Purification Kit | Invitrogen | K310001 | |
| Swift™ MaxPro Thermal Cycler | Esco | n.a | |
| Restriction Enzymes | ThermoScientific Fisher | ER0501 | |
| Agarose | Lonza | 50004 | |
| PureLink Quick Gel Extraction Kit | Invitrogen | K210012 | |
| NanoDrop 2000c | ThermoScientific Fisher | ND-2000C | |
| T4 DNA Ligase | ThermoScientific Fisher | EL0011 | |
| One Shot® TOP10 Chemically Competent E. coli | ThermoScientific Fisher | C404006 | |
| Ampicillin (Sodium), USP Grade | Gold Bio | A-301-5 | |
| Tryptone for microbiology | Merck | 6.19305E+13 | |
| Yeast Extract | BD worldwide | 212750 | |
| SIF6000R Incubated Shaker | LAB COMPANION | 45H118 | |
| NucleoSpin®plasmid | Macherey Nagel | 740588.25 | |
| MS 300V Power Supply | Major Science | MP-300V | |
| Owl™ EasyCast™ B1A Mini Gel Electrophoresis System | ThermoScientific Fisher | B1A | |
| T-REx™-293 cell line | Invitrogen | R710-07 | |
| DMEM (1x), liquid (high glucose) | Gibco | 41965-039 | |
| HindIII-HF® | NEB | R3104S | |
| ApaI | NEB | R0114S | |
| CutSmart® Buffer | NEB | B7204S | |
| pcDNA™6/TR Mammalian Expression Vector | ThermoScientific Fisher | V102520 | |
| Fetal Bovine Serum (FBS), qualified, E.U.-approved, South America origin | Gibco | 10270106 | |
| HEPES Buffer Solution (1 M) | Biological Industries | 03-025-1B | |
| Penicillin-Streptomycin Solution | Biological Industries | 03-031-1B | |
| L-Alanyl-L-Glutamine (Stable Glutamine) (200 mM) | Biological Industries | 03-022-1B | |
| Heracell™ 150i CO2 Incubator | ThermoScientific Fisher | 51026406 | |
| MSC-Advantage™ Class II Biological Safety Cabinet | ThermoScientific Fisher | 51025411 | |
| Blasticidine S hydrochloride | Sigma-Aldrich | 15205-25MG | |
| Dulbecco’s Phosphate-buffered Saline (DPBS) Modified, without calcium chloride and magnesium chloride | Sigma-Aldrich | D8537-500ML | |
| Trypsin-EDTA (0.05%), phenol red | Gibco | 25300054 | |
| Double Neubauer Ruled Metallized Hemacytometer | Hausser Scientific | 31000 | |
| Opti-MEM I Reduced Serum Medium | Gibco | 31985070 | |
| TransIT®-LT1 Transfection Reagent | Mirus | MIR 2300 | |
| glass coverslips, #1 thickness, 12 mm diameter round | Knittel Glass | GG-12 | |
| BioCoat™ Poly-D-Lysine (PDL) | Corning | 354210 | |
| Water, Cell Culture Grade | Biological Industries | 03-055-1A | |
| Doxycycline hyclate | Sigma-Aldrich | D9891-1G | |
| Fura-2, AM ester | Biotium | BTM-50034 | |
| Pluronic® F-127 | Sigma-Aldrich | P2443-250G | |
| µ-Slide 8 Well | ibidi | 80826 | |
| (E)-Capsaicin | Tocris | 462 | |
| Olympus IX70 Fluorescence Microscope | Olympus | n.a | |
| Lambda DG-4 Wavelength Switcher | Sutter Instruments | n.a | |
| EXi Blue Fluorescence Microscopy Camera | QImaging | n.a | |
| MetaFluor Fluorescence Ratio Imaging Software | Molecular Devices | n.a | |
| Thin Walled Borosilicate Tubing | Sutter Instruments | B150-110-7.5HP | |
| Standard Walled Borosilicate Tubing | Sutter Instruments | B150-86-7.5HP | |
| Dimethyl sulfoxide anhydrous | Sigma-Aldrich | 276855 | |
| P1000 micropipette puller | Sutter Instruments | P-1000 | |
| MF-900 Microforge | NARISHIGE | n.a | |
| ValveBank perfusion sysytem | AutoMate Scientific | ||
| Digidata® 1440A Low-noise Data Acquisition System | Molecular Devices | n.a | |
| Axopatch 200B Amplifier | Molecular Devices | n.a | |
| pCLAMP 10.6 Software | Molecular Devices | n.a | |
| micromanipulator | Sutter Instruments | MP-225 |
참고문헌
- Ooi, A., Wong, A., Esau, L., Lemtiri-Chlieh, F., Gehring, C. A Guide to Transient Expression of Membrane Proteins in HEK-293 Cells for Functional Characterization. Frontiers in Physiology. 7, 300(2016).
- Thomas, P., Smart, T. G. HEK293 cell line: A vehicle for the expression of recombinant proteins. Journal of Pharmacological and Toxicological Methods. 51 (3), 187-200 (2005).
- Xu, X., Nagarajan, H., et al. The genomic sequence of the Chinese hamster ovary (CHO)-K1 cell line. Nature Biotechnology. 29 (8), 735-741 (2011).
- Hazan, A., Kumar, R., Matzner, H., Priel, A. The pain receptor TRPV1 displays agonist-dependent activation stoichiometry. Scientific reports. 5, 12278(2015).
- Kumar, R., Hazan, A., Basu, A., Zalcman, N., Matzner, H., Priel, A. Tyrosine Residue in the TRPV1 Vanilloid Binding Pocket Regulates Deactivation Kinetics. Journal of Biological Chemistry. 291 (26), 13855-13863 (2016).
- Kim, T. K., Eberwine, J. H. Mammalian cell transfection: the present and the future. Analytical and bioanalytical chemistry. 397 (8), 3173-3178 (2010).
- Preuss, A. K., Connor, J. A., Vogel, H. Transient transfection induces different intracellular calcium signaling in CHO K1 versus HEK 293 cells. Cytotechnology. 33 (1-3), 139-145 (2000).
- Dalton, A. C., Barton, W. A. Over-expression of secreted proteins from mammalian cell lines. Protein Science. 23 (5), 517-525 (2014).
- Lee, P. Y., Costumbrado, J., Hsu, C. -Y., Kim, Y. H. Agarose gel electrophoresis for the separation of DNA fragments. J Vis Exp. (62), e3923(2012).
- Bohlen, C. J., Priel, A., Zhou, S., King, D., Siemens, J., Julius, D. A bivalent tarantula toxin activates the capsaicin receptor, TRPV1, by targeting the outer pore domain. Cell. 141 (5), 834-845 (2010).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflügers Archiv European journal of physiology. 391 (2), 85-100 (1981).
- Jones, J., Nivitchanyong, T., et al. Optimization of tetracycline-responsive recombinant protein production and effect on cell growth and ER stress in mammalian cells. Biotechnology and Bioengineering. 91 (6), 722-732 (2005).
- Raphemot, R., Weaver, C. D., Denton, J. S. High-throughput screening for small-molecule modulators of inward rectifier potassium channels. J Vis Exp. (71), e4209(2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유