Method Article
Controlável Expressão Ion Canal através de transfecção transiente Induzível
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Estudar canais iônicos através de um sistema heterólogo expressar tornou-se uma técnica nuclear em pesquisa biomédica. Neste texto, apresentamos um método eficiente tempo para conseguir uma expressão de canal iónico com força controlada através da realização de transfecção transiente, sob o controlo de um promotor indutível.
Resumo
A transfecção, a entrega de ácidos nucleicos estranhos numa célula, é uma ferramenta poderosa na pesquisa de proteínas. Através deste método, os canais iónicos pode ser investigada através de análise electrofisiológica, caracterização bioquímica, estudos mutacionais, e os seus efeitos sobre os processos celulares. As transfecções transientes oferecer um protocolo simples, em que a proteína se torna disponível para análise em poucas horas ou dias. Embora este método apresenta um protocolo de tempo relativamente simples e eficiente, um dos componentes críticos é calibrar a expressão do gene de interesse a níveis fisiológicos relevantes ou níveis que são adequados para análise. Para este fim, muitas abordagens diferentes, que oferecem a capacidade de controlar a expressão do gene de interesse têm surgido. Vários protocolos de transfecção de células estáveis fornecem uma maneira de introduzir de forma permanente um gene de interesse no genoma celular sob a regulação de um transcrip controlado por tetraciclinaactivação cional. Embora essa técnica produz níveis de expressão de confiança, cada gene de interesse requer algumas semanas de trabalho qualificado, nomeadamente calibração de uma curva de morte, seleção de colônias de células e, em geral mais recursos. Aqui apresenta-se um protocolo que utiliza a transfecção transitória do canal de catiões Potencial membro da subfamília V um gene transiente do receptor (TRPV1) num sistema indutível de uma maneira eficiente para expressar uma proteína de uma forma controlada que é essencial na análise de canal iónico. Nós demonstramos que usando esta técnica, somos capazes de realizar imagem de cálcio, células inteiras, e análise único canal com os níveis dos canais controlados necessários para cada tipo de coleta de dados com uma única transfecção. No geral, esta técnica fornece uma replicáveis que podem ser usadas para estudar a estrutura e função de canais iónicos.
Introdução
Sistemas de expressão heteróloga é uma das técnicas mais amplamente utilizado para estudar uma multiplicidade de funções celulares 1. Seu perfil baixo endógena de proteína, os requisitos mínimos de manutenção, o crescimento confiável e capacidade de assumir e expressar DNA estranho fizeram linhas celulares tais como embrionárias humanas de rim (HEK293) e ovário de hamster chinês (CHO) quase essencial para a pesquisa biológica 2, 3. Áreas de pesquisa usando sistemas heterólogos incluem proteínas de membrana, sinalização intracelular e atividade enzimática. A seguir à transfecção de ADN estranho na célula, muitas formas diferentes de análise pode ser realizada, incluindo a electrofisiologia, imagem de cálcio raciométrica, western blot, etc 4, 5.
Devido à grande variedade de aplicações potenciais para sistemas de expressão heterólogos, muitos difereReagentes e produtos nt foram desenvolvidos para utilizar estas células e as suas qualidades 6. sistemas de entrega de DNA que transitoriamente ou permanentemente integrar DNA estranho em células para estudar proteína exógena tornou-se uma das ferramentas mais populares e úteis para a pesquisa biológica. Mais especificamente, a transfecção transiente de ADN para uma célula é amplamente usado como um processo para a frente simples, linear que requer relativamente pouco tempo e materiais. Além disso, a taxa de sucesso de células que sofrem transfecção é alta 7. Esta técnica é muito fiável quando combinado com um gene marcador tal como a proteína fluorescente verde (GFP), e pode ser usado para muitas técnicas diferentes, como a imagiologia de cálcio e electrofisiologia 5. Infelizmente, no entanto, que expressam transitoriamente o DNA em células hospedeiras vem com alguns dos principais armadilhas, não menos que o nível de expressão por célula não é fiável. O número de cópias do DNA de plasmídeo feita up por célula é incontrolável, assim, a expressão entre experiências individuais podem variar muito 2. Esta questão torna-se significativo quando quer tentar replicar condições fisiológicas, ou a realização de técnicas precisas de coleta de dados.
Como uma solução para as complicações acima mencionadas, os protocolos de transfecção estável foram concebidos em que um gene de interesse pode ser inserido no genoma de uma célula sob o controlo apertado de um promotor indutível, tal como um sistema de tetraciclina repressor expressão, assegurando uma única cópia do plasmídeo se integra no genoma de cada célula e só é expressa após a indução do mecanismo de transcrição, por exemplo, na presença de doxiciclina. Enquanto isso resolve os obstáculos de níveis de expressão de proteína inconsistentes, este método perde a conveniência de protocolo rápido e relativamente simples de transfecções transitórias. O estabelecimento de uma linha de células estável leva pelo menos algumas semanas em which uma necessário calibrar uma curva de morte definido por antibióticos específicos para manter a expressão da proteína e assegurar a integração do vector e habilmente seleccionar e fazer crescer colónias de células. No geral, isto leva muito mais tempo e esforço com uma menor taxa de sucesso 8.
Aqui, apresentamos um protocolo intermediário que tem por base os pontos fortes de ambas as opções de transfecção populares para fornecer uma maneira simples e eficaz para controlar os níveis de expressão em qualquer linha de células inducible. Enquanto se mantém as células com um sistema tet indutível, que transientemente transfectar nosso gene de interesse, transiente do receptor potencial canal de catião membro da subfamília V 1 (TRPV1), ligado a um vector que pode homologamente combinar com o sistema de repressor. Deste modo, o gene pode ser introduzido nas células sem começando a expressar. Apenas com a adição de doxiciclina não o gene começam a expressar, o que nos permite calibrar os níveis de proteína exprESSÃO de acordo com a técnica ou níveis observados em condições fisiológicas. Nosso protocolo também evita complicações associadas à geração de longas uma linha celular que expressa de forma estável. Começamos mostrando alteração dos níveis de ativação de TRPV1 na imagem de cálcio a partir de-un induzida através de quatro horas de indução e como o aumento dos níveis de cálcio intracelular está correlacionado. Em seguida, duplicar o protocolo em toda a configuração da célula da técnica de patch-clamp, mostrando o aumento da corrente com o tempo de indução a aumentar. Por fim, apresentamos exemplos de gravações de eletrofisiologia único canal, e mostrar que esta técnica é especialmente útil para a expressão controlada quando se olha para a coleta de dados precisos com base em unidades individuais da proteína. Através do nosso protocolo, que oferecem um modo conveniente de controlar a expressão de proteínas em sistemas heterólogos, evitando longas complicações de cultura de células, proporcionando assim uma maneira de controlar as condições de entre experiências e fornecer MOre resultados replicáveis.
Protocolo
1. ligando o gene de interesse no site reprimível da Vector
- Obter um vector indutível, como pcDNA5 / FRT / TO ou pcDNA4 / TO.
- Analisar o gene de interesse para quaisquer locais de restrição potencialmente sensíveis existentes no meio do gene que também estão presentes no local de clonagem múltiplo do vector escolhido por ADN em silico software de análise 4.
- Utilizando técnicas de PCR padrão de sobreposição 4, flanquear o gene de interesse com dois locais de reconhecimento de enzimas de restrição seleccionadas (que não são encontrados no gene de interesse), o primeiro inserido antes do codão de iniciação, e o segundo após o codão de paragem.
- Digerir tanto o vector e inserir com enzimas de restrição (seleccionadas no passo 1.2), à temperatura de trabalho dos enzimas durante uma hora, seguida pela adição de uma unidade de fosfatase de intestino de vitela (CIP) para a reacção apenas com vector durante 30 minutos a fim de evitar a auto- ligadura.
- Carregar o ADN digerido num gel de agarose a 1% e separar os segmentos clivados por electroforese 9.
- Usando luz UV, cortados com uma lâmina de os pedaços de gel contendo os desejados segmentos de vector e inserção ser ligado.
- Extrair os segmentos de DNA a partir dos pedaços de gel de agarose (utilizando kits de extração de DNA comerciais disponíveis) e medir a sua concentração final em espectrofotômetro a 260 nm.
- Ligar o gene de interesse no vector indutível seleccionado usando a enzima ligase de T4, à temperatura ambiente durante 20 minutos. A fim de aumentar a probabilidade de o inserto ligando com o vector, utilizar uma proporção de 3: 1 molar da inserção: vector. Para o controle, preparar uma reacção de ligação que inclui apenas o vector.
- Para a transformação bacteriana, adicione 10 ng de vector sozinho e vector + gene em 50 mL E. coli competente. Incubar o tubo em gelo durante 30 minutos, seguido por 45 segundos de incubação a 42 ° C. Imediatamente coloque de voltaem gelo durante dois minutos e transferir as bactérias transformadas em meio de 500 mL de LB. Incubar durante uma hora a 37 ° C sob agitação a 220 rpm.
- Para a selecção de bactérias transformadas com sucesso, a placa 100 uL de cada reacção (tal como descrito no ponto 1.9) numa placa de agar LB preparado contendo o antibiótico apropriado (por exemplo, 100 ug / mL de ampicilina ao usar pcDNA4 / TR).
- Deixa-se crescer durante a noite a 37 ° C. As placas podem ser armazenadas a 4 ° C durante até duas semanas por hermeticamente envolvendo-os em parafina filme plástico.
- Elevador de colónias individuais usando uma ponta de 10 uL, e deixa-se crescer durante a noite em 3 mL de LB + meio antibiótico a 37 ° C sob agitação a 220 rpm. As bactérias com ADN de interesse podem ser congeladas (-20 ° C) durante o armazenamento a curto prazo, por centrifugação a LB e as bactérias a 11000 xg e o sobrenadante por aspiração para fora. O armazenamento a longo prazo, exige o congelamento das bactérias como estoques de glicerol a -80 ° C.
- Extrair DNA through mini-prep e medir a concentração final em espectrofotômetro a 260 nm 5.
- Confirmar inserção bem sucedida do gene de interesse por sequenciação da construção purificada 4. Alternativamente, a digestão de diagnóstico do construto por enzimas de restrição usando electroforese para separar os segmentos de corte e de avaliar a sua presença e comprimento também pode ser utilizado para este fim 4.
2. Linhas de Células que Expressam Cultivar TetR
- Obter uma linha de cultura de células albergando um plasmídeo do repressor Tet incorporado no seu ADN genómico. Aqui, o protocolo irá ser escrito usando células 293T de rim embrionário humano (HEK-293T) albergando o plasmídeo pcADN6 / TR, tal como um exemplo.
- Semear as células em 100 milímetros placa de cultura de tecido com Dulbecco Modified Eagles Médium (DMEM) suplementado com 10% FBS, 1% de Penicilina-Estreptomicina, 2 mM de L-glutamina, e 25 mM de HEPES, pH 7,3 (aqui: DMEM completo) e incubar ó / N a 37 &# 176; C e 5% de CO 2. Todo o trabalho com células deve ser feito em uma capa biológica sob condições estéreis.
- A fim de manter a expressão do gene repressor Tet, Aspirar o meio e substitui-lo com DMEM completo suplementado com 5 ng / mL de blasticidina. Incubar as células a 37 ° C e 5% de CO 2.
- Uma vez que as células atingem 80-90% de confluência, Aspirar o meio e suavemente lavar as células duas vezes com DPBS (sem cálcio e magnésio) aquecido a 37 ° C.
- A fim de levantar suavemente as células sem causar danos mecânicos, incubar a cultura em DMEM contendo 0,05% de tripsina aquecida a 37 ° C durante 1,5 min.
- Bloquear a acção da tripsina com um volume igual de DMEM completo. Pipeta suavemente para cima e para baixo, a fim de levantar as células e transferi-los para um tubo estéril.
- Centrifugar as células a 200 xg durante 5 min.
- Aspirar o sobrenadante e substituí-lo por 1 mL completa DMEM. Pipetar a solução com as células para cima e para baixo até que nenhumaglomerados de células pode ser visto. Contagem e calcular o número de células utilizando um hemocitómetro.
- Semente 1-2 x 10 6 células em placa de cultura de tecidos de 100 mm contendo 12 ml de DMEM completo com 5 ug / ml de blasticidina. Dividir as células duas vezes por semana como se atingir 90% de confluência.
3. transfecção do plasmídeo de interesse em células
- Usando o mesmo método de divisão de células, tal como descrito acima, as células de transferência para poços de uma placa de 12 poços preparado com 0,9 mL completo DMEM, suficiente para fazer 50% confluentes (~ 200000 células) e incubar durante a noite a 37 ° C num CO 2 incubadora.
- Prepara-se uma mistura de transfecção com pcDNA4 / A contendo o gene de interesse, um plasmídeo inerte para levar a quantidade total de ADN a 1 jig (se necessário), 3 uL de reagente de transfecção de lípidos e DMEM para perfazer o volume final de 100 uL. A quantidade óptima de DNA de plasmídeo a ser usado varia amplamente como proteínas diferentes expressar na eficiência diferente. para eleitosexperimentos rophysiological, incluem EGFP no plasmídeo de expressão de mamífero no cocktail de transfecção, a fim de visualizar as células que sofrem transfecção com êxito 4.
- Incubar a mistura de transfecção à TA durante 30 min.
- Transfectar células pipetando a mistura de transfecção gota a gota sobre as células plaqueadas na placa de 12 poços e agitar a placa vigorosamente para assegurar uma dispersão homogénea de ADN e o reagente de transfecção. As células devem ser ~ 80% confluentes no momento da transfecção.
- Incubar as células transfectadas O / N a 37 ° C e 5% de CO 2.
- Confirmar que as células foram transfectadas com sucesso, observando o sinal de fluorescência de EGFP sob a lâmpada UV na manhã seguinte se realizar eletrofisiologia.
4. As células plaqueamento em Poli-D-lisina (PDL) Lamelas / Wells
- Esterilizar 12 mm lamelas por dousing com solução de etanol isopropílico a 70%. Seco e colocar um único coverslIP em cada poço de uma placa de 24 poços para o registo electrofisiológico.
- Pipetar uma solução de 0,1-0,2 mg / ml solução em cada lamela PDL ou poço de uma câmara de imagem de cálcio.
- Deixar assentar durante 30 min a 37 ° C numa incubadora de CO2 a 5%.
- Lavar com grau de cultura de células de água bidestilada (DDW), três vezes, aspirando entre cada lavagem. Após a lavagem final, seque bem e deixe descansar em temperatura ambiente.
- Para electrofisiologia, preencher cada uma das cavidades contendo uma lamela revestida PDL com 500 uL de DMEM completo aquecido a 37 ° C.
- Realizar o mesmo método de separação das células transfectadas, tal como descrito acima. Após a ressuspensão das células após o tratamento com tripsina e de bloqueio, a transferência de 80 uL de células (ou aproximadamente 30000 células) para o centro de cada lamela revestida PDL para gravação electrofisiologia. Permitir que as células assentar durante pelo menos 1,5 hora ou a incubar durante a noite a 37 ° C numa incubadora de CO2 a 5%.
- Para a transferência de imagem de cálcio e local 20 uL de células (cerca de 20000 células) para o centro de cada imagem de cálcio revestido PDL bem. Permitir que as células assentar durante pelo menos 30 min e adicionar 180 ul de DMEM completo a cada poço.
5. indução da expressão do gene
- Prepara-se uma solução estoque de doxiciclina de 1 mg / mL em DDW de acordo com as instruções do fabricante. Mantenha a solução estoque protegida da luz a 4 ° C durante até 3 semanas. Para armazenamento a longo prazo manter solução de doxiciclina a -20 ° C.
- Prepara-se uma fresco 2 ug / mL (electrofisiologia) ou / mL (imagem de cálcio) doxiciclina solução 3 ug em DMEM completo e aquecê-la a 37 ° C.
- Para registos electrofisiolicos, pipeta 500 uL de 2 ug / mL de doxiciclina solução a cada poço para fazer uma concentração final de 1 ug / mL de doxiciclina. Para imagem de cálcio, adicionar 100 uL de solução / mL de doxiciclina 3 ug a cada poço para tornar um Concentra definitivação de 1 ug / mL de doxiciclina. Anote a hora da indução.
- Incubar durante o período de tempo desejado para a indução a 37 ° C e 5% de CO 2.
6. Calibração Timeline da expressão da proteína
- Calibrar a expressão da proteína através de Imagem de cálcio 5, 10
- Preparar a solução de Ringer (NaCl 140 mM, KCl 2,5 mM, CaCl 2 1,8, 2 mM de MgSO4, 20 mM de HEPES, pH ajustado para 7,4 com NaOH) e aquecê-la a 37 ° C.
- Prepare a concentrações saturantes de um agonista de canal em solução de Ringer. Uma vez que a quantidade de agonista é diluída quando adicionado às câmaras de imagem de cálcio, contendo as células e solução extracelular, o dobro da quantidade da concentração final desejada do agonista. Isto também faz com que a quantidade de solução de banho em cada poço crítico para controlar.
- Prepara-se uma solução de n iico F-127 de 20% W / V em DMSO. Aquece-se a solução a 40 ° C até não iónico F-127 é dissolvido. Guardar a solução não iónico F-127 à TA e aquecê-la a 40 ° C antes da utilização. Não-iónico F-127 é utilizado para ajudar a dispersar os ésteres de acetoximetilo (AM) de indicadores de iões fluorescentes, tais como Fura-2 em soluções aquosas.
- Aspirar o meio e substitui-la com uma solução de Fura-02:00 de carga (solução de Ringer suplementado com 2-3 | iM de Fura-02:00, 0,02 mg / mL não iónico F-127 e D-glicose 10 mM).
- Incubar durante 60 min à temperatura ambiente no escuro.
- Aspirar Fura-2AM solução e lavar as células com uma solução de D-glicose de Ringer + 10 mM para remover o corante extracelular. Repita esta etapa duas vezes.
- Deixar a solução D-glucose de 200 uL da campainha + 10 mM em cada poço e incubar durante 30 min à temperatura ambiente no escuro.
- Coloque câmara no palco acima da parte do nariz microscópio e prenda-o com o titular.
- Acender a luz, câmera e microscópio e selecione filtro de Fura-2 para detectar emissão a 510 nm wavelength.
- Ajustar para a ampliação desejada e se concentrar células no campo selecionado.
- No escuro, subtrair a luz de fundo e definir o tempo de exposição.
- Definir amostragem imagem na resposta da frequência e fluorescência registro desejado de Fura-2 células carregadas por eles emocionante a 340 e 380 comprimentos de onda nm. A proporção de 340/380 sinais é um indicador para a concentração intracelular de Ca2 + e assim também para a actividade de TRPV1.
- Adicionar 2 uM capsaicina em solução de 200 ul da campainha por pipetagem para criar uma concentração de saturação final de 1 uM de capsaicina, a fim de avaliar o nível de expressão de TRPV1.
- Analise resposta TRPV1 de acordo com o tempo de indução e determinar o protocolo para a proteína de interesse.
- Ajustando a expressão de proteínas heterólogas em sistemas utilizando a configuração de célula inteira da técnica de patch-clamp 4, 11.
- Prepare tele em banho de gelo de (mM) NaCl 140, KCl 2,3, MgSO4 2, 5 de HEPES, 5 e 2- (N-morfolino) etanossulfónico (MES), pH ajustado para 7,4 com NaOH.
- Prepare a concentrações saturantes de um agonista de canal em solução extracelular.
- Puxe eletrodos de vidro com um diâmetro interno (ID) de 1,10 mm e fogo-polonês para uma resistência de 2-4 mohms.
- Prepara-se uma solução de pipeta (mM) 130 KCl, 4 NaCl, 2 MgSO4, 0,5 CaCl2, EGTA 1 e HEPES 10 ajustado para pH 7,2 com KOH. Filtra-se a solução da pipeta antes do uso. Antes de cada experiência, um único, pipeta de vidro polido ao fogo é preenchido por volta submergindo a ponta na solução da pipeta durante pelo menos um minuto, e, em seguida, preenchido usando ponta derretido e esticado com uma seringa cheia com a mesma solução de pipeta.
- Suavemente levantar uma única lamela PDL revestido com as células plaqueadas do poço para uma placa de Petri de plástico 35 milímetros cheio com aproximadamente 2 mL de solução de banho à TA. Observar no âmbito de um epi-microscópio fluorescente.
- Localizar uma célula positiva de EGFP, como visualizado com o microscópio de epifluorescência, sobre a lamela preparada e mover-se para o centro do campo visualizado.
- Anexar a pipeta cheia ao titular da pipeta da micromanipulador, e injectar uma pequena quantidade de pressão positiva no sistema para evitar a contaminação da solução da pipeta intracelular. Abaixá-lo para um pouco acima da GFP - celular positiva, verificando a resistência adequada.
- À medida que a pipeta toca a célula, aplicar uma pequena quantidade de pressão negativa, de modo a criar uma vedação entre o GÊ pipeta de vidro e a membrana celular.
- Com um pulso curto, afiado de sucção, quebrar a membrana celular, permitindo que a pipeta para entrar em contacto com o conteúdo intracelular da célula.
- Mude o modo de amplificador para células inteiras, e diminuir o ganho de filtro e saída de Bessel, 1 - 5 kHz e 0.5α, respectivamente.
- Grave a resposta atual para o saturanteconcentrações de agonista dos canais usando rampas de tensão ou protocolo de livre lacuna.
- Porque a eficiência de expressão alternar entre diferentes proteínas, repita as gravações usando diferentes tempos de comprimento indução.
- Determinar tempo de indução ideal para gravações de canal único 4.
- Prepara-se uma solução de (mM) 150 de Na-gluconato, 15 de NaCl, 5 EGTA, HEPES e 10, ajustado para pH 7,4 com NaOH, como uma solução pipeta. Para a solução do banho, usar a solução a partir do passo 6.2.1.
- Repita o procedimento de células inteiras usando ID 0,86 mm pipetas de vidro fogo-polido para uma resistência de 10-12 mohms e definir potencial de realização de -40 mV.
- Criar um selo sobre a membrana, tal como descrito anteriormente e a ruptura da membrana.
- Usando o micromanipulador, levantar a pipeta com o remendo de membrana afastada, a partir da célula.
- Posicione o sistema de perfusão ao lado da pipeta contendo o remendo de membrana.
- Lower tele Bessel ganho de filtro e saída para 2-5 kHz e 10α, respectivamente.
- Perfundir concentrações saturantes de um agonista para o remendo de membrana, avaliando se o adesivo contém um ou mais canais de acordo com a resposta.
- Analisar o número de manchas único canal gravados com sucesso contra o tempo de indução aplicada às células. Ajustar o tempo de indução de acordo com os resultados desejados.
Resultados
Para criar rapidamente um modelo de expressão indutível, que feita utilização de células HEK293 que expressam a proteína Tetraciclina repressor (TR) (por exemplo, T-REX-293) e vectores que contêm sequências do operador de tetraciclina (TetO) entre o promotor CMV e o local de clonagem múltipla (por exemplo, pcDNA4 / A). Quando transfectado em células TRex-293, a expressão do gene de interesse em pcDNA4 / A é reprimida, tal como a TR liga TetO. A adição de doxiciclina ao meio de interacção impede TR-TetO, permitindo assim a expressão da proteína transfectadas. Para controlar a expressão de TRPV1 rato (rTRPV1), primeiro inserido gene deste canal em um pcDNA4 / TO vetor usando o protocolo acima descrito. Em seguida, as células T-Rex-293 foram transfectadas com o rTRPV1- pcDNA4 / TO plasmídeo de acordo com os passos no ponto 3 do protocolo. A seguir à transfecção, a expressão rTRPV1 foi induzida por incubação das células na presença de doxiciclina (1 μg / mL) durante 1-4 h. Importante, diferentes concentrações de doxiciclina pode ser utilizado para atingir a taxa de expressão desejado. Nós usamos métodos de imagem eletrofisiológicos e cálcio para avaliar o nível de expressão rTRPV1 em cada ponto de tempo aplicando seu agonista, a capsaicina. Como mostrado na Figura 1, utilizando imagiologia de cálcio-de células vivas, o nível de cálcio intracelular após a aplicação de capsaicina é aumentada gradualmente com tempos de indução mais longos. A activação de células não induzidas pode ser atribuível a um vazamento da base na actividade de TR, a sobre-expressão do plasmídeo, ou tetraciclina residual nos componentes do meio de células. Em seguida, registramos correntes de células usando a configuração de célula inteira da técnica de patch-clamp aplicação de rampas de tensão entre -80 mV a +80 mV. A Figura 2 mostra que as amplitudes de corrente mais elevadas são obtidos com tempos de indução mais longos. A saturação em amplitude da corrente a 4 h de indução é consiste dont com a saturação visto na resposta de cálcio (Figura 1). Finalmente, analisou-se os níveis de expressão rTRPV1 na configuração exterior-para fora da técnica de patch-clamp. Uma das principais dificuldades em estudar estrutura-função canal iônico está a atingir níveis de expressão adequados para a análise de um único canal. Com base na condutância unitária publicada rTRPV1 4, a amplitude da corrente registada foi usada para determinar o número de canais no remendo excisada. Como mostrado na Figura 3, o número de canais no remendo aumenta proporcionalmente ao tempo de incubação doxiciclina. Após uma hora de indução, não fomos capazes de detectar qualquer atividade do canal (0 de 8). No entanto, em ambos os pontos de tempo de duas ou três horas que gravaram a atividade de canal único nas taxas de sucesso semelhantes. De nota, enquanto que em duas horas a maioria das manchas não respondeu, em três horas a maioria das manchas mostrou single-to-atividade multi-channel. As possibilidades de gravação de múltiplos canais, após três horas de indução é alta, assim, o tempo de indução óptima para gravar corrente a partir de um único canal é entre duas a três horas sob as condições apresentadas. Em conjunto, estes resultados demonstram que a expressão de canais de iões pode ser rigorosamente controlada e regulada após a transfecção transiente utilizando este protocolo.

Figura 1. Resposta de aumentos de ativação de TRPV1 de acordo com Tempo de indução, como visualizado através de Imagem de cálcio. (A) imagens Pseudo-colored de células T-Rex-293 que expressam transitoriamente rTRPV1, antes ( 'Basal') e depois capsaicina aplicação (2 M). As barras brancas representam 30 um. A barra de escala indica os níveis de cálcio intracelular. (B) muda com o tempo de níveis de cálcio intracelular em células T-Rex-293 transfectadas tratadas como mostradoem A. Cada gráfico representa uma média de 50 células sensíveis à capsaicina. Nota A progressiva aumentos nas respostas capsaicina em relação ao tempo de indução. Por favor clique aqui para ver uma versão maior desta figura.
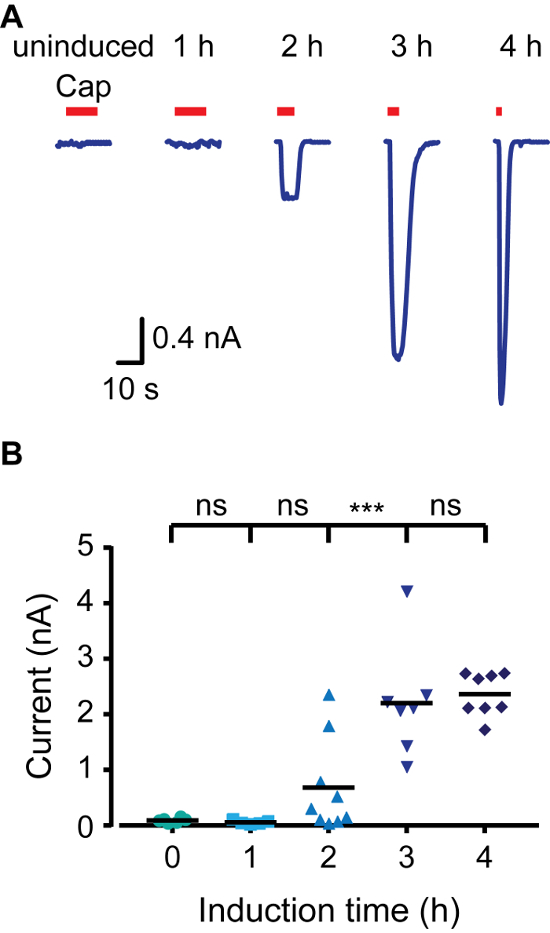
Figura 2. TRPV1 corrente aumenta como resultado do aumento da indução vez em toda celular Grampo patch Recordings. (A) gravações de célula inteira de T-Rex-293 transfectadas transitoriamente com rTRPV1 em um potencial de realização de -40 mV. As células foram induzidas com doxiciclina (1? G / mL) durante o tempo indicado e, em seguida, expostos a capsaicina ( "tampão"; barra vermelha; 1 uM). É mostrado um traço representativo de 6 - 11 gravações independentes. (B): / gráfico de dispersão-ponto que representa a amplitude de célula inteira evocado como mostrado em A. Estatísticaal significância entre grupos foi determinada com ANOVA com comparações múltiplas, onde *** representa p ≤0.001 e não NS- estatisticamente significativas (n = 6 - 11 células). Por favor clique aqui para ver uma versão maior desta figura.

Figura 3. Taxa de sucesso de patch de canal único no TRPV1 Recordings é dependente Tempo de indução. (A) gravações de fora para fora de T-Rex-293 transfectadas transitoriamente com rTRPV1 em um potencial de realização de 50 mV. As células foram induzidas com doxiciclina (1? G / mL) durante o tempo indicado e foram expostos a capsaicina ( "tampão"; barra vermelha; 1 uM). É mostrado um traço representativo de 6 - 9 gravações independentes. (B) Média trama / scatter-ponto que representa o número de canais no remendo excisada comomostrado em A. A significância estatística entre os grupos foi determinada utilizando-se ANOVA com comparações múltiplas, em que *** representa p ≤0.001 NS- e não estatisticamente significativos (n = 6 - 9 células). Por favor clique aqui para ver uma versão maior desta figura.
Discussão
Transfecção é um protocolo amplamente utilizado para a expressão da proteína e da pesquisa, com muitas variações diferentes para melhorar a consistência e a estabilidade de expressão. reagentes de transfecção transitória oferecer um método simples, fácil de usar o protocolo em que a célula e a proteína de interesse pode ser analisado dentro de horas ou durante a noite a partir do momento da transfecção. Infelizmente, esta abordagem pode ser imprevisível quando o modo de análise requer um nível consistente de expressão de proteínas, tais como gravações de canal único em eletrofisiologia 2. Em alternativa, linhas de células estáveis sob o sistema reprimível da tetraciclina expressão têm sido desenvolvidos para oferecer uma maneira de controlar o nível da proteína de interesse 12 de expressão. Esta abordagem oferece uma expressão consistente de todas as células de uma cultura com a introdução de um suplemento tetraciclina derivada, tal como doxiciclina. Enquanto isto permite o controle consistente e precisa de níveis de proteína, tele tempo e esforço que ir para estabelecer uma linha celular estável faz com que seja inconveniente e desvantajoso quando se estuda uma grande variedade de proteínas 8.
O protocolo aqui apresentado oferece uma solução de meio-de-o-road aos protocolos de transfecção atuais oferecidos. Por transitoriamente transfecção de um gene sob um promotor controlável em células que possuem um repressor Tet, podemos alcançar expressão controlável, evitando procedimentos morosos e complicados. Aqui, usamos o TRPV1 canal de cátions não seletivos com imagem de cálcio e análise de eletrofisiologia. Verificou-se que o tempo de indução ideal para a expressão controlada de esta proteína específico para análise de canal único foi entre 2 - 3 h de incubação com 1 ug / ml de doxiciclina (Figuras 1 - 3). Numa escala mais ampla, esta técnica também pode ser aplicada a qualquer proteína de interesse. Este protocolo também oferece uma solução para o controlo da expressão quando um LarGE gama de diferentes proteínas ou de mutações em sequências de proteínas são de interesse e a criação de uma linha de células estável para cada variante é impraticável. Importante, enquanto os resultados aqui representam o tempo ideal e concentrações aplicáveis para a expressão TRPV1, cada gene tem sua individual e tradução e tráfico específica ritmo, assim, os tempos de calibração e de expressão de cada proteína irá diferir muito 13.
Embora esta técnica oferece uma solução conveniente para expressão controlada, não é sem limitações. Apenas as linhas celulares disponíveis comercialmente que albergam o sistema Tet podem ser utilizados com este sistema, o que apresenta um problema se estas linhas de célula particular não são adequados para o tipo de análise que está a ser executada. Outra armadilha comparado com linhas transfectadas de forma estável é que nem todas as células sofrem transfecção, e, portanto, nem todas as células expressam a proteína de interesse. No geral, nós oferecemos uma forma conveniente de controlar proteínas eXpression num sistema heterólogo que possa ser aplicado a uma grande variedade de investigação biomédica.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi apoiado pelo Israel Science Foundation [Grants 1721/12, 1368/12 e 1444/16] (para o AP). AP é afiliado com Brettler Center e David R. Bloom Center, Escola de Farmácia, Universidade Hebraica de Jerusalém.
Materiais
| Name | Company | Catalog Number | Comments |
| pcDNA™4/TO Mammalian Expression Vector | ThermoScientific Fisher | V102020 | |
| pcDNA™5/TO Mammalian Expression Vector | ThermoScientific Fisher | V103320 | |
| PureLink Quick PCR Purification Kit | Invitrogen | K310001 | |
| Swift™ MaxPro Thermal Cycler | Esco | n.a | |
| Restriction Enzymes | ThermoScientific Fisher | ER0501 | |
| Agarose | Lonza | 50004 | |
| PureLink Quick Gel Extraction Kit | Invitrogen | K210012 | |
| NanoDrop 2000c | ThermoScientific Fisher | ND-2000C | |
| T4 DNA Ligase | ThermoScientific Fisher | EL0011 | |
| One Shot® TOP10 Chemically Competent E. coli | ThermoScientific Fisher | C404006 | |
| Ampicillin (Sodium), USP Grade | Gold Bio | A-301-5 | |
| Tryptone for microbiology | Merck | 6.19305E+13 | |
| Yeast Extract | BD worldwide | 212750 | |
| SIF6000R Incubated Shaker | LAB COMPANION | 45H118 | |
| NucleoSpin®plasmid | Macherey Nagel | 740588.25 | |
| MS 300V Power Supply | Major Science | MP-300V | |
| Owl™ EasyCast™ B1A Mini Gel Electrophoresis System | ThermoScientific Fisher | B1A | |
| T-REx™-293 cell line | Invitrogen | R710-07 | |
| DMEM (1x), liquid (high glucose) | Gibco | 41965-039 | |
| HindIII-HF® | NEB | R3104S | |
| ApaI | NEB | R0114S | |
| CutSmart® Buffer | NEB | B7204S | |
| pcDNA™6/TR Mammalian Expression Vector | ThermoScientific Fisher | V102520 | |
| Fetal Bovine Serum (FBS), qualified, E.U.-approved, South America origin | Gibco | 10270106 | |
| HEPES Buffer Solution (1 M) | Biological Industries | 03-025-1B | |
| Penicillin-Streptomycin Solution | Biological Industries | 03-031-1B | |
| L-Alanyl-L-Glutamine (Stable Glutamine) (200 mM) | Biological Industries | 03-022-1B | |
| Heracell™ 150i CO2 Incubator | ThermoScientific Fisher | 51026406 | |
| MSC-Advantage™ Class II Biological Safety Cabinet | ThermoScientific Fisher | 51025411 | |
| Blasticidine S hydrochloride | Sigma-Aldrich | 15205-25MG | |
| Dulbecco’s Phosphate-buffered Saline (DPBS) Modified, without calcium chloride and magnesium chloride | Sigma-Aldrich | D8537-500ML | |
| Trypsin-EDTA (0.05%), phenol red | Gibco | 25300054 | |
| Double Neubauer Ruled Metallized Hemacytometer | Hausser Scientific | 31000 | |
| Opti-MEM I Reduced Serum Medium | Gibco | 31985070 | |
| TransIT®-LT1 Transfection Reagent | Mirus | MIR 2300 | |
| glass coverslips, #1 thickness, 12 mm diameter round | Knittel Glass | GG-12 | |
| BioCoat™ Poly-D-Lysine (PDL) | Corning | 354210 | |
| Water, Cell Culture Grade | Biological Industries | 03-055-1A | |
| Doxycycline hyclate | Sigma-Aldrich | D9891-1G | |
| Fura-2, AM ester | Biotium | BTM-50034 | |
| Pluronic® F-127 | Sigma-Aldrich | P2443-250G | |
| µ-Slide 8 Well | ibidi | 80826 | |
| (E)-Capsaicin | Tocris | 462 | |
| Olympus IX70 Fluorescence Microscope | Olympus | n.a | |
| Lambda DG-4 Wavelength Switcher | Sutter Instruments | n.a | |
| EXi Blue Fluorescence Microscopy Camera | QImaging | n.a | |
| MetaFluor Fluorescence Ratio Imaging Software | Molecular Devices | n.a | |
| Thin Walled Borosilicate Tubing | Sutter Instruments | B150-110-7.5HP | |
| Standard Walled Borosilicate Tubing | Sutter Instruments | B150-86-7.5HP | |
| Dimethyl sulfoxide anhydrous | Sigma-Aldrich | 276855 | |
| P1000 micropipette puller | Sutter Instruments | P-1000 | |
| MF-900 Microforge | NARISHIGE | n.a | |
| ValveBank perfusion sysytem | AutoMate Scientific | ||
| Digidata® 1440A Low-noise Data Acquisition System | Molecular Devices | n.a | |
| Axopatch 200B Amplifier | Molecular Devices | n.a | |
| pCLAMP 10.6 Software | Molecular Devices | n.a | |
| micromanipulator | Sutter Instruments | MP-225 |
Referências
- Ooi, A., Wong, A., Esau, L., Lemtiri-Chlieh, F., Gehring, C. A Guide to Transient Expression of Membrane Proteins in HEK-293 Cells for Functional Characterization. Frontiers in Physiology. 7, 300(2016).
- Thomas, P., Smart, T. G. HEK293 cell line: A vehicle for the expression of recombinant proteins. Journal of Pharmacological and Toxicological Methods. 51 (3), 187-200 (2005).
- Xu, X., Nagarajan, H., et al. The genomic sequence of the Chinese hamster ovary (CHO)-K1 cell line. Nature Biotechnology. 29 (8), 735-741 (2011).
- Hazan, A., Kumar, R., Matzner, H., Priel, A. The pain receptor TRPV1 displays agonist-dependent activation stoichiometry. Scientific reports. 5, 12278(2015).
- Kumar, R., Hazan, A., Basu, A., Zalcman, N., Matzner, H., Priel, A. Tyrosine Residue in the TRPV1 Vanilloid Binding Pocket Regulates Deactivation Kinetics. Journal of Biological Chemistry. 291 (26), 13855-13863 (2016).
- Kim, T. K., Eberwine, J. H. Mammalian cell transfection: the present and the future. Analytical and bioanalytical chemistry. 397 (8), 3173-3178 (2010).
- Preuss, A. K., Connor, J. A., Vogel, H. Transient transfection induces different intracellular calcium signaling in CHO K1 versus HEK 293 cells. Cytotechnology. 33 (1-3), 139-145 (2000).
- Dalton, A. C., Barton, W. A. Over-expression of secreted proteins from mammalian cell lines. Protein Science. 23 (5), 517-525 (2014).
- Lee, P. Y., Costumbrado, J., Hsu, C. -Y., Kim, Y. H. Agarose gel electrophoresis for the separation of DNA fragments. J Vis Exp. (62), e3923(2012).
- Bohlen, C. J., Priel, A., Zhou, S., King, D., Siemens, J., Julius, D. A bivalent tarantula toxin activates the capsaicin receptor, TRPV1, by targeting the outer pore domain. Cell. 141 (5), 834-845 (2010).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflügers Archiv European journal of physiology. 391 (2), 85-100 (1981).
- Jones, J., Nivitchanyong, T., et al. Optimization of tetracycline-responsive recombinant protein production and effect on cell growth and ER stress in mammalian cells. Biotechnology and Bioengineering. 91 (6), 722-732 (2005).
- Raphemot, R., Weaver, C. D., Denton, J. S. High-throughput screening for small-molecule modulators of inward rectifier potassium channels. J Vis Exp. (71), e4209(2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados