Method Article
Steuerbare Ionenkanal-Expression durch induzierbare Transiente Transfektion
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Studieren Ionenkanäle durch ein heterolog exprimierenden System hat eine Kerntechnik in der biomedizinischen Forschung. In diesem Manuskript stellen wir eine zeiteffiziente Methode streng kontrollierten Ionenkanal-Expression durch Durchführung transienter Transfektion unter der Kontrolle eines induzierbaren Promotors zu erzielen.
Zusammenfassung
Transfektion die Abgabe fremder Nukleinsäuren in eine Zelle, ist ein leistungsfähiges Werkzeug in der Proteinforschung. Durch dieses Verfahren können Ionenkanäle durch elektrophysiologische Analyse biochemische Charakterisierung, Mutationsstudien untersucht werden, und ihre Auswirkungen auf zelluläre Prozesse. Transienten Transfektionen bieten ein einfaches Protokoll, in dem das Protein für die Analyse innerhalb von wenigen Stunden bis Tagen verfügbar wird. Obwohl dieses Verfahren eine relativ einfache und zeitspar Protokoll stellt eine der kritischen Komponenten kalibriert wird, die Expression des Gens von Interesse zu physiologisch relevanten Niveaus oder Ebenen, die für die Analyse geeignet sind. viele verschiedene Ansätze zu diesem Zweck, die die Fähigkeit bieten, die Expression des Gens von Interesse zu steuern entstanden. Mehrere stabile Zelltransfektion Protokolle bieten eine Möglichkeit, um dauerhaft ein Gen von Interesse in das zelluläre Genom unter der Regulierung eines Tetracyclin-kontrollierten TRANSCRIP einführentionalen Aktivierung. Während diese Technik zuverlässig Expressionsniveaus erzeugt, erfordert jedes Gen von Interesse ein paar Wochen der Facharbeit einschließlich Kalibrierung eines Tötungskurve, die Auswahl der Zellkolonien und mehr Ressourcen insgesamt. Hier stellen wir ein Protokoll, das die transiente Transfektion des Transient Receptor Potential Kationenkanal-Unterfamilie V Element 1 (TRPV1) -Gens in einem induzierbaren System als eine effiziente Weise verwendet ein Protein, das in einer kontrollierten Weise zu exprimieren, die in Ionenkanalanalyse wesentlich ist. Wir zeigen, dass mit Hilfe dieser Technik können wir Kalzium-Imaging, ganze Zelle, und Einkanal-Analyse mit gesteuerten Kanalpegel für jede Art der Datensammlung mit einem einzigen Transfektion erforderlich sind. Insgesamt stellt dies eine replizierbare Technik, die verwendet werden können Ionenkanäle Struktur und Funktion zu untersuchen.
Einleitung
Heterolog Systeme exprimierenden ist eines der am häufigsten verwendeten Techniken 1 eine Vielzahl von Zellfunktionen zu untersuchen. Ihre geringe endogene Proteinprofil, minimale Wartungsanforderungen, zuverlässige Wachstum und die Fähigkeit zur Aufnahme und zum Ausdruck bringen Fremd - DNA haben Zelllinien wie menschliche embryonale Nieren (HEK293) und chinesischen Hamsters (CHO) hergestellt fast wesentlich für die biologische Forschung 2, 3. Forschungsbereiche mit heterologe Systeme umfassen Membranproteine, intrazelluläre Signal und enzymatische Aktivität. Nach der Transfektion von Fremd - DNA in die Zelle, kann viele verschiedene Formen der Analyse durchgeführt werden, einschließlich der Elektrophysiologie, ratiometrisch Calcium Imaging, Western Blot, etc. 4, 5.
Aufgrund der Vielzahl von Anwendungsmöglichkeiten für die heterologe Expressionssysteme, viele different Reagenzien und Produkte wurden 6 dieser Zellen und ihre Qualitäten zu verwenden , entwickelt. DNA-Abgabesysteme, die vorübergehend oder dauerhaft von Fremd-DNA in die Zellen integrieren exogene Protein zu untersuchen hat für die biologische Forschung eine der beliebtesten und nützlichsten Werkzeuge geworden. Genauer gesagt transient in einer Zelle Transfizieren DNA wird als einfache, gerade nach vorne Prozess, der erfordert relativ wenig Zeit und Materialien verwendet. Darüber hinaus ist die Erfolgsrate der Zellen , die die Transfektion unterzogen 7 hoch. Diese Technik ist sehr zuverlässig , wenn sie mit einem Markergen , wie grün fluoreszierendes Protein (GFP) kombiniert wird , und kann für viele verschiedene Techniken , wie Calcium Abbildungs- und Elektrophysiologie 5 verwendet werden. Doch leider kommt mit einigen großen Gefahren DNA in Wirtszellen transient exprimieren, nicht im geringsten, dass das Expressionsniveau pro Zelle unzuverlässig ist. Die Anzahl der Kopien von Plasmid-DNA u gemachtp pro Zelle ist unkontrollierbar, so der Ausdruck zwischen den einzelnen Versuchen 2 stark variieren kann. Dieses Problem wird bedeutsam, wenn entweder versuchen, physiologischen Bedingungen zu replizieren, oder präzise Techniken der Datenerhebung durchführen.
Als Lösung für die erwähnt haben Komplikationen oben stabile Transfektion Protokolle entwickelt worden, bei dem ein Gen von Interesse in das Genom einer Zelle unter der strengen Kontrolle eines induzierbaren Promotors eingesetzt werden kann, wie beispielsweise einem Tetracyclin-Repressor-Expressionssystem, gewährleistet eine einzige Kopie des Plasmids integriert in das Genom von jeder Zelle und wird erst nach Induktion des Transkriptionsmechanismus, beispielsweise in Gegenwart von Doxycyclin ausgedrückt. Während dies die Hindernisse inkonsistenter Proteinexpressionsniveaus löst, verliert diese Methode, um die Bequemlichkeit der schnellen und relativ einfaches Protokoll von transienten Transfektionen. eine stabile Zelllinie zur Festlegung dauert wenigstens einige Wochen in which muss man eine Tötung Kurve gesetzt durch spezifische Antibiotika kalibrieren die Proteinexpression zu erhalten und die Integration des Vektors sicherzustellen und geschickt wählen und Zellkolonien wachsen. Insgesamt dauert dies deutlich mehr Zeit und Aufwand mit einer niedrigeren Erfolgsquote 8.
Hier stellen wir ein Zwischenprotokoll, das auf den Stärken der beiden bekannten Transfektion Optionen zieht eine einfache und effektive Möglichkeit zur Verfügung zu stellen, um die Expressionsniveaus in jeder induzierbaren Zelllinie zu steuern. Während Zellen, die mit einem induzierbaren Tet-System beibehalten wird, transfizieren wir transient unsere Gen von Interesse, Transient Receptor Potential Kationenkanal-Unterfamilie V Element 1 (TRPV1), in einen Vektor ligiert, der homolog mit dem Repressor-System zu kombinieren. Auf diese Weise kann das Gen in die Zellen eingeführt werden, ohne zu exprimieren beginnen. Nur mit der Zugabe von Doxycyclin beginnt das Gen zu exprimieren, uns erlaubt, die Mengen an Protein expr zu kalibrierenITZUNG nach der Technik oder in physiologischen Bedingungen beobachtet Ebenen. Unser Protokoll vermeidet auch langwierige Komplikationen im Zusammenhang mit einer stabil exprimierenden Zelllinie zu erzeugen. Wir beginnen mit den wechselnden Ebenen der TRPV1-Aktivierung in Kalzium-Imaging von nichtinduzierten über vier Stunden Induktion zeigt und wie der Anstieg der intrazellulären Kalziumspiegel korreliert. Wir dupliziert dann das Protokoll in der gesamten Zellkonfiguration der Patch-Clamp-Technik, zeigt die zunehmende Strom mit der Zeit der Induktion erhöht wird. Schließlich präsentieren wir Beispiele für Einkanal Elektro Aufnahmen und zeigen, dass diese Technik für kontrollierte Expression besonders nützlich ist, wenn für eine genaue Datenerfassung auf Basis von einzelnen Einheiten des Proteins suchen. Durch unser Protokoll, bieten wir eine bequeme Möglichkeit, Protein-Expression in heterologen Systemen zu steuern, während lange Zellkultur Komplikationen vermieden werden, so dass ein Weg, um Bedingungen zwischen den Experimenten zu steuern und bieten mowieder reproduzierbare Ergebnisse.
Protokoll
1. Ligieren des Gens von Interesse in die Reprimierbare Site of Vector
- Erhalten Sie induzierbaren Vektors wie pcDNA5 / FRT / TO oder pcDNA4 / TO.
- Analyse das Gen von Interesse für alle potentiell anfällig Restriktionsstellen in der Mitte des Gens, der auch in der multiplen Klonierungsstelle des ausgewählten Vektor 4 durch in silico DNA - Analyse - Software gezeigt werden.
- Unter Verwendung von Standard Überlappungs - PCR - Techniken 4, flankieren das Gen von Interesse mit zwei ausgewählten Restriktionsenzym - Erkennungsstellen (die in dem Gen von Interesse zu finden sind), die erste vor dem Startcodon eingeführt ist , und das zweite nach dem Stopp - Codon.
- Digest sowohl den Vektor und Insert mit Restriktionsenzymen (ausgewählt in Schritt 1.2) bei Arbeitstemperatur "Enzyme für eine Stunde, gefolgt von der Zugabe einer Einheit Kalbsdarm-Phosphatase (CIP), um den Vektor Reaktion nur 30 Minuten, um sich selbst zu vermeiden, Ligation.
- Laden die verdaute DNA auf ein 1% iges Agarosegel und trennen die abgespaltenen Segmente durch Elektrophorese 9.
- Mit UV-Licht, Schnitt mit einem Messer die Stücke des Gels die gewünschten Segmente des Vektors enthält, und fügen Sie ligiert werden.
- Extrahieren, um die DNA-Segmente aus dem Agarosegel Stücke (kommerziell erhältliche DNA-Extraktion Kits) und messen ihre Endkonzentration von Spektrophotometer bei 260 nm.
- Ligieren des Gens von Interesse in den ausgewählten induzierbaren Vektors bei Raumtemperatur für 20 Minuten unter Verwendung von T4-Ligase-Enzym. Um die Wahrscheinlichkeit des Einsatzes Ligieren mit dem Vektor zu erhöhen, verwenden Sie einen 3: 1-Molverhältnis des Einsatzes: Vektor. Zur Kontrolle bereiten eine Ligatur Reaktion, die nur den Vektor umfasst.
- Bei bakteriellen Transformation, mit 10 ng Vektor allein und Vektor + Gen in 50 & mgr; l kompetente E. coli. Inkubieren der Röhrchen auf Eis für 30 Minuten, gefolgt von 45 Sekunden Inkubation bei 42 ° C. Ab sofort setzen zurückauf Eis für zwei Minuten und die transformierten Bakterien auf 500 & mgr; l LB-Medium übertragen. bei 220 rpm bei 37 ° C unter Rühren eine Stunde lang inkubieren.
- Zur Selektion erfolgreich transformierter Bakterien, Platte 100 ul jeder Reaktion auf einem vorbereiteten LB Agarplatte (wie in 1.9 beschrieben) , um das geeignete Antibiotikum (beispielsweise 100 & mgr; g / ml Ampicillin bei Verwendung pcDNA4 / TR).
- Erlauben über Nacht bei 37 ° C wachsen. Platten können sie in Kunststoffparaffinfilm durch dicht für bis zu zwei Wochen bei 4 ° C gelagert werden Umhüllen.
- Heben einzelne Kolonien eine 10 ul Spitze verwenden, und ermöglichen über Nacht in 3 ml LB + Antibiotika-Medium bei 37 ° C unter Rühren bei 220 Upm wachsen. Bakterien, die mit DNA von Interesse eingefroren werden können (-20 ° C) für die kurzfristige Lagerung durch den LB und Bakterien bei 11.000 xg zentrifugiert und der Überstand abgesaugt werden. Langzeitlagerung erfordert bei -80 ° C die Bakterien als Glycerinstamm einfriert.
- Extrakt DNA through mini-prep und die Endkonzentration von Spektrophotometer bei 260 nm 5 messen.
- Bestätigen des erfolgreichen Einsetzen des Gens von Interesse durch Sequenzierung des gereinigten Konstrukt 4. Alternativ diagnostischer Verdau des Konstrukts durch Restriktionsenzyme Elektrophorese der Schnittsegmente und bewerten ihre Präsenz und Länge können auch zu diesem Zweck verwendet werden , 4 zu trennen , verwenden.
2. Anzucht Zelllinien TetR Ausdruck
- Besorgen Sie sich eine Zellkulturlinie ein Tet-Repressor-Plasmid in ihre genomische DNA eingebaut beherbergen. Hierin wird das Protokoll unter Verwendung von humanen embryonalen Nierenzellen 293T (HEK-293T) beherberge pcDNA6 / TR Plasmid als Beispiel geschrieben werden.
- Seed Zellen in 100 mm Gewebekulturplatte mit Dulbeccos Modified Eagles Medium (DMEM), ergänzt mit 10% FBS, 1% Penicillin-Streptomycin, 2 mM L-Glutamin und 25 mM HEPES, pH 7,3 (hierin: Voll DMEM) und inkubiere O / N bei 37 &# 176; C und 5% CO 2. Alle Arbeiten mit Zellen sollten in einer biologischen Haube unter sterilen Bedingungen durchgeführt werden.
- Um die Expression von Tet-Repressor-Gen absaugen Medium und ersetzen Sie es mit Voll DMEM, ergänzt mit 5 ug / ml Blasticidin zu halten. Inkubiere Zellen bei 37 ° C und 5% CO 2.
- Sobald Zellen 80 erreichen - 90% Konfluenz, aspirieren das Medium und die Zellen vorsichtig zweimal mit DPBS waschen (ohne Calcium und Magnesium) erwärmt auf 37 ° C.
- Um ohne dass eine mechanische Beschädigung die Zellen vorsichtig heben, brüten die Kultur in DMEM mit Trypsin 0,05% erwärmt auf 37 ° C für 1,5 min.
- Blockieren Sie die Trypsin Aktion mit einem gleichen Volumen von Voll DMEM. Pipette vorsichtig nach oben und unten, um die Zellen zu heben und sie in ein steriles Röhrchen übertragen.
- Zentrifugieren der Zellen bei 200 xg für 5 min.
- Den Überstand aspirieren und ersetzen Sie es mit 1 ml Voll DMEM. Pipette, um die Lösung mit den Zellen auf und ab, bis keinZellklumpen zu sehen. Zählen und Berechnen der Anzahl der Zellen unter Verwendung eines Hämozytometers.
- Samen von 1 bis 2 x 10 6 Zellen in 100 mm Gewebekulturschale mit 12 ml Voll DMEM mit 5 ug / ml Blasticidin. Teilen Sie die Zellen zweimal in der Woche, da sie 90% Konfluenz erreichen.
3. Transfektion der Plasmid von Interesse in Zellen
- Unter Verwendung des gleichen Verfahrens von Teilen von Zellen , wie oben beschrieben, Übertragungszellen in die Vertiefungen in einer 12-Well - Platte , hergestellt mit 0,9 ml Voll DMEM, ausreichend 50% konfluent zu machen (~ 200.000 Zellen) und Inkubation über Nacht bei 37 ° C in einem CO 2 Inkubator.
- Bereiten Sie eine Transfektionsgemischs mit pcDNA4 / an das Gen von Interesse enthält, ein inertes Plasmid, das die Gesamt-DNA-Menge auf 1 & mgr; g zu bringen (falls nötig), 3 ul Lipid Transfektionsreagenz und DMEM auf das endgültige Volumen von 100 & mgr; l zu machen. Die optimale Menge an Plasmid-DNA verwendet werden, variiert stark, wie unterschiedliche Proteine in unterschiedlichen Effizienz exprimieren. Für electphysiologische Experimente, umfassen EGFP in Säugetier - Expressions Plasmid in der Cocktail - Transfektion , um Zellen sichtbar zu machen , die erfolgreich Transfektion 4 unterziehen.
- Inkubiere das Transfektionsgemisch bei RT für 30 min.
- Transfektion von Zellen durch Pipettieren der Transfektionsgemisch tropfenweise auf den plattierten Zellen in 12-Well-Platte und Rock die Platte kräftig eine homogene Dispersion von DNA und Transfektionsreagenz zu gewährleisten. Zellen sollten zum Zeitpunkt der Transfektion ~ 80% konfluent sein.
- Inkubieren der transfizierten Zellen O / N bei 37 ° C und 5% CO 2.
- Bestätigen Sie, dass die Zellen durch die Beobachtung des Fluoreszenzsignals von EGFP unter UV-Lampe am nächsten Morgen erfolgreich transfiziert wurden, wenn die Elektrodurchführen.
4. Überzug Zellen auf Poly-D-Lysine (PDL) Deckgläser / Wells
- Sterilisieren 12 mm Deckgläser durch mit 70% Isopropyl Ethanollösung Begießen. Trockene und legen Sie eine einzelne coverslip in jede Vertiefung einer 24-Well-Platte für elektrophysiologische Aufzeichnung.
- Pipette eine Lösung von 0.1 - 0.2 mg / ml PDL-Lösung auf jedes Deckglas oder auch eines Kalzium-Imaging-Kammer.
- Man lässt 30 min bei 37 ° C in einem 5% CO 2 Inkubator zu sitzen.
- Waschen Sie mit Zellkultur doppelt destilliertem Wasser (DDW) dreimal, zwischen jedem Wasch Absaugen. Nach dem letzten Waschen gründlich trocknen und lassen bei RT zu sitzen.
- Für die Elektro füllen jede Vertiefung mit einem PDL beschichtet Deckglas mit 500 & mgr; l Voll DMEM auf 37 ° C erwärmt.
- Führen Sie die gleiche Methode, um die transfizierten Zellen spalten, wie oben beschrieben. Nach Resuspendieren der Zellen nach der Trypsin-Behandlung und Blockierung, die Übertragung 80 & mgr; l Zellen (oder ca. 30.000 Zellen) zu der Mitte jedes PDL beschichteten Deckglas für die Elektro Aufnahme. Lassen Sie Zellen für mindestens 1,5 Stunden absetzen oder über Nacht in einem 5% CO 2 Inkubator bei 37 ° C inkubiert.
- Für Calcium Imaging Transfer und Stelle 20 & mgr; l Zellen (etwa 20.000 Zellen) in die Mitte jedes Kalzium PDL beschichtet Bildgebung gut. Lassen Sie Zellen für mindestens 30 Minuten absetzen und fügen 180 ul Voll DMEM in jede Vertiefung.
5. Induzierende Genexpression
- Bereiten Sie eine Doxycyclin Stammlösung von 1 mg / ml in DDW gemäß den Anweisungen des Herstellers. Halten Sie Stammlösung vor Licht geschützt bei 4 ° C für bis zu 3 Wochen. Für die langfristige Lagerung halten Doxycyclin Stammlösung bei -20 ° C.
- Bereiten Sie eine frische 2 ug / ml (Elektrophysiologie) oder 3 ug / ml (Kalzium-Imaging) Doxycyclin-Lösung in Full DMEM und warm es auf 37 ° C.
- Für elektrophysiologischen Ableitungen, Pipette 500 ul von 2 pg / ml Doxycyclin-Lösung in jede Vertiefung eine endgültige Konzentration von 1 ug / ml Doxycyclin zu machen. Für Calcium Imaging, 100 & mgr; l von 3 ug / ml Doxycyclin-Lösung in jede Vertiefung eine endgültige Konzen zu machention von 1 & mgr; g / ml Doxycyclin. Schreiben Sie die Stunde der Induktion nach unten.
- Inkubieren Sie für die gewünschte Zeitdauer für die Induktion bei 37 ° C und 5% CO 2.
6. Kalibrieren Chronologie der Proteinexpression
- Kalibrieren Proteinexpression durch Calcium Imaging 5, 10
- Bereiten Ringerlösung (140 mM NaCl, 2,5 mM KCl, 1,8 mM CaCl 2, 2 mM MgSO 4, 20 mM HEPES, pH eingestellt auf 7,4 mit NaOH) und erwärmen auf 37 ° C.
- Bereiten Konzentrationen von Kanal-Agonisten in Ringer-Lösung zu sättigen. Da die Menge des Agonisten verdünnt wird, wenn sie den Calcium-Bildgebungskammern mit den Zellen und der extrazellulären Lösung, die doppelte Menge der gewünschten Endkonzentration des Agonisten zugegeben. Dies macht auch die Menge an Badlösung in jeder Vertiefung kritisch zu steuern.
- Eine Lösung aus nichtionischen F-127 20% W / V in DMSO. Die Lösung wird auf 40 ° C bis nichtionogene F-127 gelöst ist. Bewahren Sie die nicht-ionischen F-127-Lösung bei RT und erwärmen auf 40 ° C vor dem Gebrauch. Nichtionogene F-127 wird verwendet dispergieren acetoxymethyl (AM) Ester von fluoreszierenden Ionenindikatoren wie Fura-2 in wässrigen Lösungen zu helfen.
- Absaugen Medium und ersetzen Sie es mit Fura-02.00 Ladelösung (Ringer-Lösung, ergänzt mit 2 - 3 uM Fura-02.00, 0,02 mg / ml nicht-ionisches F-127 und 10 mM D-Glucose).
- Inkubieren für 60 min bei RT im Dunkeln.
- Absaugen Fura-02.00 Lösung und waschen Sie die Zellen mit Ringer + 10 mM D-Glucose-Lösung extrazelluläre Farbstoff zu entfernen. Zweimal wiederholen Sie diesen Schritt.
- Lassen Sie 200 ul Ringer + 10 mM D-Glucose-Lösung in jede Vertiefung und Inkubation für 30 min bei RT im Dunkeln.
- Legen Kammer auf der Bühne über dem Mikroskop Nasenstück und befestigen Sie es mit Halter.
- Schalten Sie die Lampe, Kamera und Mikroskop und wählen Sie Fura-2-Filter-Emission bei 510 nm wav zu erkennenelength.
- Stellen Sie für die gewünschte Vergrößerung und Fokussierung Zellen im ausgewählten Bereich.
- Im Dunkeln, Hintergrundlicht subtrahieren und Belichtungszeit einstellen.
- Festlegen der Bild Sampling mit der gewünschten Geschwindigkeit und Rekordfluoreszenzantwort von Fura-2 beladenen Zellen durch Anregen sie bei 340 und 380 nm Wellenlänge. Das Verhältnis von 340/380 Signale ist ein Indikator für die intrazelluläre Ca 2+ -Konzentration und damit auch für TRPV1 Aktivität.
- In 2 uM Capsaicin in 200 & mgr; l Ringer-Lösung durch Pipettieren eine endgültige sättigenden Konzentration von 1 & mgr; M Capsaicin zu schaffen, um die Expression von TRPV1 zu bewerten.
- Analysieren TRPV1 Reaktion gemäß Induktionszeit und bestimmen Protokoll für das Protein von Interesse.
- Einstellen Protein Expression in heterologen Systemen die gesamte Zellkonfiguration der Patch - Clamp - Technik unter Verwendung von 4, 11.
- bereiten ter Badlösung aus (mM) 140 NaCl, 2,3 KCl, 2 MgSO 4, 5 HEPES und 5 2- (N-Morpholino) ethansulfonsäure (MES), eingestellt auf pH 7,4 mit NaOH.
- Bereiten Konzentrationen von Kanal-Agonisten in der extrazellulären Lösung zu sättigen.
- Ziehen Glaselektroden mit einem Innendurchmesser (ID) von 1,10 mm und Feuerpolitur auf einen Widerstand von 2 bis 4 MOhm.
- Bereiten einer Pipettenlösung (mM) 130 KCl, 4 NaCl, 2 MgSO 4, 0,5 CaCl 2, 1 EGTA und 10 HEPES , eingestellt auf pH 7,2 mit KOH. Filtern Sie die Pipettenlösung vor der Verwendung. Vor jedem Versuch, eine einzelne, feuerpolierte Glaspipette durch Eintauchen der Spitze in der Pipettenlösung für mindestens eine Minute lang gefüllt ist zurück, und dann geschmolzen und gedehnt Spitze mit einer Spritze mit der gleichen Pipettenlösung gefüllt werden.
- Heben Sie vorsichtig mit einem einzigen PDL beschichtet Deck mit den plattierten Zellen aus dem Bohrloch zu einer 35 mm Petrischale aus Kunststoff mit etwa 2 ml Badlösung bei RT gefüllt. Beachten Sie unter epi-Fluoreszenzmikroskop.
- Suchen Sie ein EGFP positive Zelle, wie mit dem epifluoreszenten Mikroskop sichtbar gemacht, auf dem vorbereiteten Deckglas und dem Zentrum der visualisierten Bereich bewegen.
- Bringen Sie die gefüllte Pipette auf die Pipettenhalter des Mikromanipulators und Injizieren einer kleinen Menge von Überdruck in das System Kontamination der intrazellulären Pipettenlösung zu vermeiden. Senken sie knapp über dem GFP - positive Zelle, für die richtige Widerstand zu prüfen.
- Da die Pipette in die Zelle berührt, eine kleine Menge von Unterdruck, um eine GOhm Dichtung zwischen der Glaspipette und Zellmembran zu schaffen anzuwenden.
- Mit einer kurzen, scharfen Impuls der Saug-, brechen die Zellmembran, so dass die Pipette in Kontakt mit den intrazellulären Inhalt der Zelle zu kommen.
- Schalten Sie den Verstärker-Modus ganze Zelle, und senken Sie die Bessel-Filter und Ausgangsverstärkung auf 1 - 5 kHz und 0.5α sind.
- Notieren Sie sich die aktuelle Antwort auf die sättigendenKonzentrationen von Kanal-Agonisten durch Spannungsrampen oder spaltfreie Protokoll.
- Da die Expression Effizienz zwischen verschiedenen Proteinen verändern, wiederholen Sie die Aufnahmen unterschiedliche Induktions Länge Zeiten.
- Die Bestimmung ideale Induktionszeit für einzelne Kanalaufnahmen 4.
- Eine Lösung aus (mM) 150 Na-Gluconat, 15 NaCl, 5 EGTA, und 10 HEPES, eingestellt auf pH 7,4 mit NaOH, als Pipettenlösung. Für die Bad-Lösung, verwenden Sie die Lösung aus Schritt 6.2.1.
- Wiederholen ganze Zelle Verfahren unter Verwendung von ID 0,86 mm Glaspipetten feuerpoliert auf einen Widerstand von 10 bis 12 M & Omega; und legen Potential halten mV bis -40.
- Erstellen Sie eine Dichtung auf der Membran wie zuvor beschrieben, und die Membran bersten.
- Mit dem Mikromanipulator, heben Sie die Pipette mit der Membranfleck weg von der Zelle.
- Positionieren Sie das Perfusionssystem direkt neben der Pipette mit dem Membran-Patch.
- Lower tBessel er Filter und Ausgangsverstärkung auf 2 - 5 kHz und 10α sind.
- Perfundieren Konzentrationen von Agonisten auf die Membranscheibe sättigt, Auswerten, ob der Patch einen oder mehrere Kanäle enthält gemäß der Antwort.
- Analysieren Sie die Anzahl der Einzelkanal-Patches erfolgreich gegen die Induktionszeit auf Zellen angewendet aufgezeichnet. Stellen Sie die Induktionszeit entsprechend den gewünschten Ergebnissen.
Ergebnisse
Um schnell eine induzierbare Expression Modell zu erstellen, haben wir den Einsatz von HEK293 - Zellen , die Tetracyclin - Repressor - Protein (TR) exprimieren (zB T-Rex-293) und Vektoren , die Tetracyclin - Operatorsequenzen (TetO) zwischen dem CMV - Promotor und die multiple Klonierungsstelle enthalten (beispielsweise pcDNA4 / TO). Wenn transfizierte in TReX-293-Zellen wird die Expression des Gens von Interesse in pcDNA4 / TO drückt, als TR an tetO bindet. Hinzufügen von Doxycyclin zu dem Medium verhindert TR-TetO Wechselwirkung, so dass die Expression des transfizierten Protein. Zur Steuerung der Expression von Ratten TRPV1 (rTRPV1) wir eingefügt erste dieses Gen des Kanals in einen pcDNA4 / TO Vektor, der die oben beschriebenen Protokoll. Als nächstes wurden die T-Rex-293-Zellen mit dem rTRPV1- pcDNA4 transfiziert / nach 3 des Protokolls in Punkt zu den Schritten, um das Plasmid. Nach der Transfektion wurde rTRPV1 Expression durch Inkubation der Zellen in Gegenwart von Doxycyclin (1 μ induzierteg / ml) für 1 - 4 h. Wichtig ist, können unterschiedliche Konzentrationen verwendet werden Doxycyclin gewünschten Expressionsrate zu erreichen. Wir verwendeten elektrophysiologischen und Kalzium-Imaging-Methoden rTRPV1 Expressionsniveau zu jedem Zeitpunkt zu bewerten, durch seine Agonisten Anwendung Capsaicin. Wie in Abbildung 1 dargestellt ist , wird nach und nach mit längeren Induktionszeiten erhöht lebenden Zellen Kalzium - Imaging, intrazellulären Calciumspiegel nach der Capsaicin - Anwendung. Aktivierung von nicht-induzierten Zellen können zu einem basalen Leck in der TR-Aktivität, eine Überexpression des Plasmids oder Rest Tetracyclin in den Zellen Medienkomponenten zurückzuführen sein. die Gesamtzellkonfiguration der Patch-Clamp-Technik Anlegen von Spannungsrampen zwischen -80 mV bis +80 mV nächsten verzeichneten wir Ströme von Zellen. 2 zeigt , dass höhere Stromamplituden mit längeren Induktionszeiten erhalten. Die Sättigung der Stromamplitude bei 4 h Induktion ist consistent mit der Sättigung in Calcium - Reaktion zu sehen (Abbildung 1). Schließlich haben wir analysiert, rTRPV1 Expressionsniveaus in der Outside-out-Konfiguration der Patch-Clamp-Technik. Eine der Hauptschwierigkeiten Ionenkanalstruktur-Funktion in das Studium ist einkanaligen Analyse Expressionsniveaus geeignet für das Erreichen. Basierend auf der veröffentlichten unitären rTRPV1 Leitwert 4 wurde die aufgezeichnete Stromamplitude verwendet , um die Anzahl von Kanälen in dem exzidierten Patch zu bestimmen. Wie in 3 gezeigt, wenn die Anzahl von Kanälen in den Patch steigt proportional zur Doxycyclin inkubiert. Nach einer Stunde der Induktion waren wir jede Kanalaktivität (0 von 8) zu erfassen, nicht in der Lage. Doch in beiden Zwei- und Drei-Stunden-Zeitpunkten aufgezeichnet wir einzelne Kanalaktivität in ähnliche Erfolgsraten. Zu beachten ist, während in zwei Stunden die meisten Patches nicht, reagieren in drei Stunden die meisten Flecken zeigten Single-to-Multi-Kanal-Aktivität. Die Chancen für die Aufnahme mehrerer Kanäle nach drei Stunden Induktion hoch ist, damit die optimale Induktionszeit aufzuzeichnen Strom von einem einzelnen Kanal zwischen zwei bis drei Stunden unter den dargestellten Bedingungen. Zusammen zeigen diese Ergebnisse, dass die Expression von Ionenkanälen können dicht nach transienter Transfektion unter Verwendung dieses Protokoll gesteuert und geregelt werden.

Abbildung 1. Antwort von TRPV1 - Aktivierung Erhöht nach Induktionszeit, wie durch Calcium Imaging visualisiert. (A) Pseudo-farbige Bilder von T-Rex-293 - Zellen rTRPV1 transient exprimieren, vor ( 'Basal') und nach dem Capsaicin (2 uM) Anwendung. Weiße Balken repräsentieren 30 um. Maßstabsbalken zeigt Ebenen der intrazellulären Kalzium. (B) mit der Zeit ändert der intrazellulären Calciumspiegel in transfizierten T-REx-293 - behandelten Zellen , wie gezeigtJeder Graph in A. stellt einen Mittelwert von 50 Capsaicin empfindliche Zellen. Beachten Sie die schrittweise Erhöhung der Capsaicin-Antworten in Bezug auf Induktionszeit. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
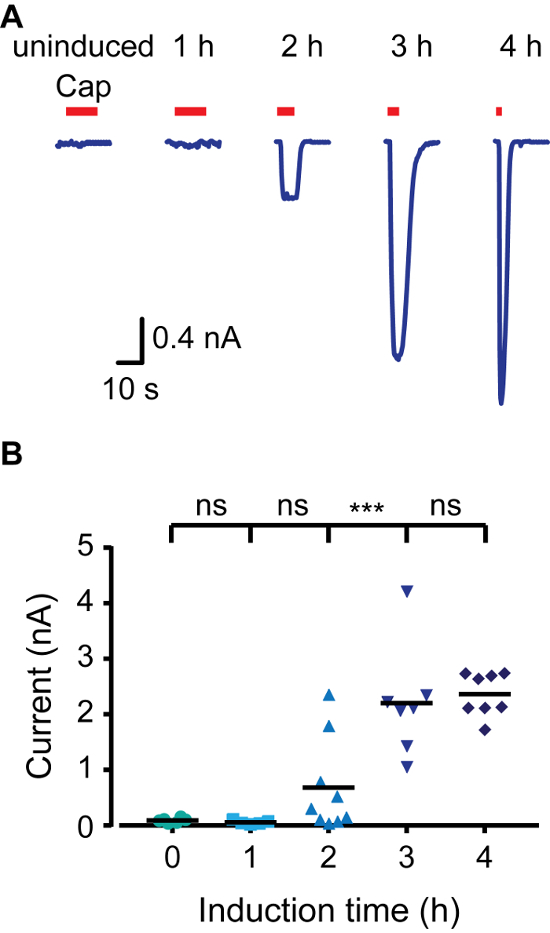
Abbildung 2. TRPV1 Strom erhöht sich infolge der Erhöhung der Induktionszeit in Whole Cell - Patch - Clamp - Aufnahmen. (A) Ganzzellableitungen von T-Rex-293 vorübergehend bei einem Haltepotential von -40 mV mit rTRPV1 transfiziert. Die Zellen wurden mit Doxycyclin (1 ug / ml) für die angegebene Zeit induziert und dann auf Capsaicin ausgesetzt ( 'Cap'; 1 & mgr; M; roter Balken). Dargestellt ist eine repräsentative Spur von 6-11 unabhängige Aufnahmen. (B) Mittlere / Scatter-Punkt - Diagramm , die die Ganzzell Amplitude evozierten wie in A. Statistik gezeigtal Signifikanz zwischen den Gruppen wurde mit ANOVA mit multiple Vergleiche bestimmt, wobei *** p darstellt ≤0.001 und ns- statistisch nicht signifikant (n = 6-11 Zellen). Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.

Abbildung 3. Erfolgsrate von Single Channel - Patch in TRPV1 Recordings ist abhängig von Induktionszeit. (A) Outside-out - Aufnahmen von T-Rex-293 vorübergehend bei einem Haltepotential von 50 mV mit rTRPV1 transfiziert. Die Zellen wurden mit Doxycyclin (1 ug / ml) für die angegebene Zeit induziert und wurden auf Capsaicin ausgesetzt ( 'Cap'; 1 & mgr; M; roter Balken). Dargestellt ist eine repräsentative Spur von 6 - 9 unabhängige Aufnahmen. (B) Mittlere / Scatter-Punkt - Diagramm, das die Anzahl von Kanälen in dem ausgeschnittenen Patch alsgezeigt, wurde in A. Die statistische Signifikanz zwischen den Gruppen mit ANOVA mit multiple Vergleiche bestimmt, wobei *** p darstellt ≤0.001 und ns- statistisch nicht signifikant (n = 6 - 9 Zellen). Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Diskussion
Transfection ist ein weit verbreitetes Protokoll für die Proteinexpression und Forschung, mit vielen verschiedenen Variationen Ausdruck Konsistenz und Stabilität zu verbessern. Transient Transfektionsreagentien bieten eine einfache, leicht zu verwendende Protokoll, wo die Zelle und Protein von Interesse innerhalb weniger Stunden analysiert werden können, um über Nacht aus der Zeit der Transfektion. Leider kann dieser Ansatz unberechenbar sein , wenn die Art der Analyse 2 ein einheitliches Niveau der Proteinexpression, wie einzelne Kanal - Aufnahmen in der Elektro erfordert. Alternativ stabilen Zelllinien unter dem Tetracyclin reprimierbare Expressionssystem entwickelt worden , eine Möglichkeit zu bieten die Expressionsniveau des Proteins von Interesse 12 zu steuern. Dieser Ansatz gewährleistet eine konstante Expression aller Zellen in einer Kultur mit der Einführung eines Tetracyclin abstammt ergänzen, wie Doxycyclin. Während dies für eine konsistente und genaue Kontrolle der Protein-Ebene ermöglicht, ter Zeit und Mühe , die gehen in eine stabile Zelllinie zu etablieren ist es unbequem und von Nachteil , wenn eine Vielzahl von Proteinen 8 studieren.
Das Protokoll hier vorgestellten bietet eine middle-of-the-Road-Lösung für die aktuellen Transfektionsprotokolle angeboten. Durch transiente eines Gens unter einem regulierbaren Promotor in Zellen Transfizieren eines Tet-Repressor besitzen, können wir kontrollierbare Expression erreichen, während langwierige und komplizierte Verfahren zu vermeiden. Hier verwendeten wir das nicht-selektiven Kationenkanal TRPV1 mit Calcium Abbildungs- und elektrophysiologischen Analyse. Wir fanden , dass die ideale Induktionszeit für die kontrollierte Expression dieses spezifische Protein zur Analyse einzelner Kanal zwischen 2 war - 3 h Inkubation mit 1 & mgr; g / ml Doxycyclin (Figuren 1 - 3). Auf einer breiteren Skala kann diese Technik auch auf jedes Protein von Interesse angewendet werden. Dieses Protokoll bietet auch eine Lösung Ausdruck zu steuern, wenn ein large Reihe von verschiedenen Proteinen oder Mutationen in Proteinsequenzen sind von Interesse und für jede Variante eine stabile Zelllinie zu schaffen ist nicht praktikabel. Wichtig ist , dass, während die Ergebnisse hier die optimale Zeit und Konzentrationen anwendbar für TRPV1 - Expression darstellen, hat jedes Gen seine individuelle und spezifische Übersetzung und -handel Tempo, so dass die Kalibrierung und die Expression Zeiten jedes Protein wird erheblich 13 unterscheiden.
Während diese Technik eine praktische Lösung für kontrollierte Expression bietet, ist es nicht ohne Einschränkungen. Nur handelsübliche Zelllinien das Tet-System beherbergen können mit diesem System verwendet werden, was ein Problem darstellt, wenn diese bestimmte Zelllinien für die Art der Analyse ungeeignet sind, die durchgeführt werden soll. Ein weiterer pitfall Vergleich zu stabil transfizierten Linien besteht darin, daß nicht alle Zellen durchlaufen Transfektion und somit nicht alle Zellen exprimieren das Protein von Interesse. Insgesamt bieten wir eine bequeme Möglichkeit, Protein e zu steuernxpression in einem heterologen System, das auf einer Vielzahl von biomedizinischen Forschung angewandt werden kann.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Diese Arbeit wurde von der Israel Science Foundation [Grants 1721/12, 1368/12 und 1444/16] (AP). AP ist mit Brettler Center und David R. Bloom Center, School of Pharmacy, The Hebrew University of Jerusalem angeschlossen.
Materialien
| Name | Company | Catalog Number | Comments |
| pcDNA™4/TO Mammalian Expression Vector | ThermoScientific Fisher | V102020 | |
| pcDNA™5/TO Mammalian Expression Vector | ThermoScientific Fisher | V103320 | |
| PureLink Quick PCR Purification Kit | Invitrogen | K310001 | |
| Swift™ MaxPro Thermal Cycler | Esco | n.a | |
| Restriction Enzymes | ThermoScientific Fisher | ER0501 | |
| Agarose | Lonza | 50004 | |
| PureLink Quick Gel Extraction Kit | Invitrogen | K210012 | |
| NanoDrop 2000c | ThermoScientific Fisher | ND-2000C | |
| T4 DNA Ligase | ThermoScientific Fisher | EL0011 | |
| One Shot® TOP10 Chemically Competent E. coli | ThermoScientific Fisher | C404006 | |
| Ampicillin (Sodium), USP Grade | Gold Bio | A-301-5 | |
| Tryptone for microbiology | Merck | 6.19305E+13 | |
| Yeast Extract | BD worldwide | 212750 | |
| SIF6000R Incubated Shaker | LAB COMPANION | 45H118 | |
| NucleoSpin®plasmid | Macherey Nagel | 740588.25 | |
| MS 300V Power Supply | Major Science | MP-300V | |
| Owl™ EasyCast™ B1A Mini Gel Electrophoresis System | ThermoScientific Fisher | B1A | |
| T-REx™-293 cell line | Invitrogen | R710-07 | |
| DMEM (1x), liquid (high glucose) | Gibco | 41965-039 | |
| HindIII-HF® | NEB | R3104S | |
| ApaI | NEB | R0114S | |
| CutSmart® Buffer | NEB | B7204S | |
| pcDNA™6/TR Mammalian Expression Vector | ThermoScientific Fisher | V102520 | |
| Fetal Bovine Serum (FBS), qualified, E.U.-approved, South America origin | Gibco | 10270106 | |
| HEPES Buffer Solution (1 M) | Biological Industries | 03-025-1B | |
| Penicillin-Streptomycin Solution | Biological Industries | 03-031-1B | |
| L-Alanyl-L-Glutamine (Stable Glutamine) (200 mM) | Biological Industries | 03-022-1B | |
| Heracell™ 150i CO2 Incubator | ThermoScientific Fisher | 51026406 | |
| MSC-Advantage™ Class II Biological Safety Cabinet | ThermoScientific Fisher | 51025411 | |
| Blasticidine S hydrochloride | Sigma-Aldrich | 15205-25MG | |
| Dulbecco’s Phosphate-buffered Saline (DPBS) Modified, without calcium chloride and magnesium chloride | Sigma-Aldrich | D8537-500ML | |
| Trypsin-EDTA (0.05%), phenol red | Gibco | 25300054 | |
| Double Neubauer Ruled Metallized Hemacytometer | Hausser Scientific | 31000 | |
| Opti-MEM I Reduced Serum Medium | Gibco | 31985070 | |
| TransIT®-LT1 Transfection Reagent | Mirus | MIR 2300 | |
| glass coverslips, #1 thickness, 12 mm diameter round | Knittel Glass | GG-12 | |
| BioCoat™ Poly-D-Lysine (PDL) | Corning | 354210 | |
| Water, Cell Culture Grade | Biological Industries | 03-055-1A | |
| Doxycycline hyclate | Sigma-Aldrich | D9891-1G | |
| Fura-2, AM ester | Biotium | BTM-50034 | |
| Pluronic® F-127 | Sigma-Aldrich | P2443-250G | |
| µ-Slide 8 Well | ibidi | 80826 | |
| (E)-Capsaicin | Tocris | 462 | |
| Olympus IX70 Fluorescence Microscope | Olympus | n.a | |
| Lambda DG-4 Wavelength Switcher | Sutter Instruments | n.a | |
| EXi Blue Fluorescence Microscopy Camera | QImaging | n.a | |
| MetaFluor Fluorescence Ratio Imaging Software | Molecular Devices | n.a | |
| Thin Walled Borosilicate Tubing | Sutter Instruments | B150-110-7.5HP | |
| Standard Walled Borosilicate Tubing | Sutter Instruments | B150-86-7.5HP | |
| Dimethyl sulfoxide anhydrous | Sigma-Aldrich | 276855 | |
| P1000 micropipette puller | Sutter Instruments | P-1000 | |
| MF-900 Microforge | NARISHIGE | n.a | |
| ValveBank perfusion sysytem | AutoMate Scientific | ||
| Digidata® 1440A Low-noise Data Acquisition System | Molecular Devices | n.a | |
| Axopatch 200B Amplifier | Molecular Devices | n.a | |
| pCLAMP 10.6 Software | Molecular Devices | n.a | |
| micromanipulator | Sutter Instruments | MP-225 |
Referenzen
- Ooi, A., Wong, A., Esau, L., Lemtiri-Chlieh, F., Gehring, C. A Guide to Transient Expression of Membrane Proteins in HEK-293 Cells for Functional Characterization. Frontiers in Physiology. 7, 300 (2016).
- Thomas, P., Smart, T. G. HEK293 cell line: A vehicle for the expression of recombinant proteins. Journal of Pharmacological and Toxicological Methods. 51 (3), 187-200 (2005).
- Xu, X., Nagarajan, H., et al. The genomic sequence of the Chinese hamster ovary (CHO)-K1 cell line. Nature Biotechnology. 29 (8), 735-741 (2011).
- Hazan, A., Kumar, R., Matzner, H., Priel, A. The pain receptor TRPV1 displays agonist-dependent activation stoichiometry. Scientific reports. 5, 12278 (2015).
- Kumar, R., Hazan, A., Basu, A., Zalcman, N., Matzner, H., Priel, A. Tyrosine Residue in the TRPV1 Vanilloid Binding Pocket Regulates Deactivation Kinetics. Journal of Biological Chemistry. 291 (26), 13855-13863 (2016).
- Kim, T. K., Eberwine, J. H. Mammalian cell transfection: the present and the future. Analytical and bioanalytical chemistry. 397 (8), 3173-3178 (2010).
- Preuss, A. K., Connor, J. A., Vogel, H. Transient transfection induces different intracellular calcium signaling in CHO K1 versus HEK 293 cells. Cytotechnology. 33 (1-3), 139-145 (2000).
- Dalton, A. C., Barton, W. A. Over-expression of secreted proteins from mammalian cell lines. Protein Science. 23 (5), 517-525 (2014).
- Lee, P. Y., Costumbrado, J., Hsu, C. -. Y., Kim, Y. H. Agarose gel electrophoresis for the separation of DNA fragments. J Vis Exp. (62), e3923 (2012).
- Bohlen, C. J., Priel, A., Zhou, S., King, D., Siemens, J., Julius, D. A bivalent tarantula toxin activates the capsaicin receptor, TRPV1, by targeting the outer pore domain. Cell. 141 (5), 834-845 (2010).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflügers Archiv European journal of physiology. 391 (2), 85-100 (1981).
- Jones, J., Nivitchanyong, T., et al. Optimization of tetracycline-responsive recombinant protein production and effect on cell growth and ER stress in mammalian cells. Biotechnology and Bioengineering. 91 (6), 722-732 (2005).
- Raphemot, R., Weaver, C. D., Denton, J. S. High-throughput screening for small-molecule modulators of inward rectifier potassium channels. J Vis Exp. (71), e4209 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten