Method Article
ביטוי ערוץ יון לשליטה באמצעות Transfection ועין מתנהל חלוף
In This Article
Summary
תעלות יוני לימוד באמצעות מערכת להביע heterologously הפכו טכניקת ליבה במחקר ביו. בכתב היד הזה, אנו מציגים שיטה יעילה זמן כדי להשיג ביטוי ערוץ יון תחת פיקוח הדוק על ידי ביצוע transfection חולף בשליטת האמרגן מושרה.
Abstract
Transfection, המסירה של חומצות גרעין זרים לתא, הוא כלי רב עוצמה במחקר חלבון. באמצעות שיטה זו, ניתן לחקור תעלות יונים באמצעות ניתוח אלקטרו, אפיון ביוכימי, מחקרים מוטאציות, והשפעתם על תהליכים תאיים. transfections חלוף להציע פרוטוקול פשוט שבו החלבון הופך המנותחת תוך מספר שעות עד ימים. אמנם שיטה זו מציגה פרוטוקול יחסי פשוט זמן יעיל, אחד המרכיבים הקריטיים הוא לכיול הביטוי של הגן של ריבית לרמות נהוגות פיסיולוגיות רלוונטיות או רמות שאינן מתאימים לניתוח. לשם כך, גישות שונות רבות המציעות את היכולת לשלוט על הביטוי של הגן של עניין צמחו. מספר פרוטוקולי התא transfection היציבים לספק דרך להציג גן של עניין לצמיתות לגנום התא תחת הרגולציה של transcrip טטרציקלין שבשליטההפעלה תזונתית. אמנם שיטה זו מייצרת רמות ביטוי אמינות, כל גן של עניין דורש כמה שבועות של עבודה המיומנת כולל כיול עקום הרג, בחירה של מושבות תאים, ובסך הכילו יותר משאבים. כאן אנו מציגים פרוטוקול המשתמשת transfection חולף של V subfamily ערוץ קטיון פוטנציאל חלוף קולטן חבר 1 (TRPV1) גנים מערכת מושרה כדרך יעילה להביע חלבון באופן מבוקר שהוא חיוני בניתוח ערוץ יון. אנו מראים כי באמצעות טכניקה זו, אנו מסוגלים לבצע הדמיה סידן, התא כולו, וניתוח ערוץ אחד עם רמות ערוץ נשלט הנדרש לכל סוג של איסוף נתונים עם transfection יחיד. בסך הכל, זה מספק טכניקה לשכפול, שניתן להשתמש בהם כדי לחקור את המבנה תעלות יונים ותפקוד.
Introduction
Heterologously להביע מערכות היא אחת הטכניקות המקובלות ביותר ללמוד מספר רב של פונקציות הסלולר 1. פרופיל חלבון אנדוגני הנמוך שלהם, דרישות תחזוקה מינימאליות, צמיחה אמינה, והיכולת תופסת ולהביע דנ"א זר הפכו שורות תאים כגון כליה העוברית האנושי (HEK293) וסינית אוגר שחלה (CHO) כמעט חיונית למחקר ביולוגי 2, 3. תחומי מחקר באמצעות מערכות Heterologous כוללים חלבונים בממברנה, איתות תאית, ואת פעילות האנזימטית. בעקבות transfection של דנ"א זר לתוך התא, צורות שונות של ניתוח יכול להתבצע, לרבות אלקטרופיזיולוגיה, הדמיה סידן ratiometric, כתם המערבי, וכו '4, 5.
בשל המגוון הרחב של יישומים פוטנציאליים למערכות ביטוי Heterologous, differe רבריאגנטים ומוצרים NT פותחו לנצל תאים אלה והאיכויות שלהם -6. מערכות משלוח דנ"א זמני או לצמיתות לשלב דנ"א זר לתאים ללמוד חלבון אקסוגני הפך לאחד הכלים הפופולריים ביותר ושימושי למחקר ביולוגי. באופן ספציפי יותר, זמני DNA transfecting לתא נעשה שימוש נרחב כתהליך פשוט, ישר קדימה הדורש מעט זמן יחסית וחומרים. יתר על כן, שיעור תאי ההצלחה לעבור transfection הוא גבוה 7. טכניקה זו היא מאוד אמינה כאשר הוא משולב עם גן סמן כגון חלבון פלואורסצנטי ירוק (GFP), וניתן להשתמש בו עבור טכניקות שונות כגון הדמית סידן אלקטרופיזיולוגיה 5. למרבה הצער, אם כי, זמני להביע דנ"א לתוך תאי מארחים מגיע עם כמה מלכודות גדולות, לא כהוא זה כי רמת הביטוי לכל תא אינה מהימנה. מספר העותקים של ה- DNA פלסמיד נלקח up לכל תא הוא בלתי נשלט, ולכן הביטוי בין ניסויים בודדים יכול להשתנות במידה רבה 2. סוגיה זו מקבלת משמעותי כאשר אחד מנסה לשכפל מצבים פיזיולוגיים, או ביצוע טכניקות אוסף נתונים מדויקים.
כפתרון הסיבוכים הנ"ל, פרוטוקולי transfection יציבים עוצבו שבו גן של עניין יכול להיות מוכנס לתוך הגנום של תא תחת הפיקוח ההדוק של אמרגן מושרה, כגון מערכת ביטוי המדכא טטרציקלין, הבטחה יחידה עותק של פלסמיד משתלב בגנום של כל תא ובא לידי ביטוי רק לאחר גיוס של מנגנון שעתוק, למשל, בנוכחות דוקסיציקלין. אמנם זה פותר את המכשולים של רמות ביטוי חלבון עולות בקנה אחד, שיטה זו מאבדת את הנוחות של פרוטוקול מהיר ויחסית פשוט של transfections חולף. הקמת קו תאים יציבות לוקח לפחות כמה שבועות which יש לכייל עקומת הרג שקבע אנטיביוטיקה ספציפית כדי לשמור על ביטוי החלבון ולהבטיח שילוב של וקטור ובמיומנות לבחור ולגדול מושבות תאים. בסך הכל זה לוקח הרבה יותר זמן ומאמץ עם שיעור הצלחה נמוך 8.
הנה, אנחנו מציגים פרוטוקול ביניים שמושך על נקודות החוזק של שתי אפשרויות transfection הפופולריות לספק דרך פשוטה ויעילה לשלוט ברמות ביטוי בכל שורת תאים מושרה. תוך שמירת תאים עם מערכת ט מושרה, אנו transfect הגן שלנו זמני של עניין, ערוץ קטיון פוטנציאל חלוף קולטן V subfamily חבר 1 (TRPV1), ligated לתוך וקטור כי ניתן לשלב homologously עם המערכת המדכאת. בדרך זו, הגן יכול להיות מוחדר לתאים ללא מתחילים להביע. רק עם התוספת של דוקסיציקלין אין הגן מתחיל להביע, מה שמאפשר לנו לכייל את רמות expr החלבוןession פי הטכניקה או הרמות שנצפו בתנאים פיסיולוגיים. הפרוטוקול שלנו גם ימנע סיבוכים ארוכים לפריסת יצירת קו תא להביע ביציבות. אנחנו מתחילים על ידי הצגת הרמות המשתנות של הפעלת TRPV1 בתחום הדמית סידן בלתי להתהוות מתוך ארבע שעות של אינדוקציה ואיך עליית רמות סידן תאי בקורלציה. לאחר מכן, אנו לשכפל את פרוטוקול בתצורת התא כולו של הטכניקה מהדק תיקון, מראה הזרם הגובר עם הגדלת זמן של אינדוקציה. לבסוף, אנו מציגים דוגמאות של קלטות אלקטרופיזיולוגיה ערוץ אחד, ונראה כי טכניקה זו שימושית במיוחד עבור ביטוי מבוקר כאשר מחפשים אוסף נתונים מדויק על בסיס של יחידת פרט של החלבון. באמצעות הפרוטוקול שלנו, אנו מציעים דרך נוחה לשלוט ביטוי חלבון במערכות Heterologous תוך הימנעות סיבוכי תרבית תאים ממושכים, ובכך לספק דרך לשלוט בתנאים בין ניסויים ולספק מומחדש תוצאות לשכפול.
Protocol
1. ligating הגן של עניין אל אתר Repressible של וקטור
- קבל וקטור מושרה כגון pcDNA5 / FRT / או pcDNA4 / TO.
- נתח את הגן של עניין לכל אתרי הגבלה רגישים פוטנציאל באמצע הגן מופיע גם באתר השיבוט המרובה של הווקטור נבחר על ידי תוכנת ניתוח דנ"א סיליקון 4.
- באמצעות חפיפת תקן טכניקות PCR 4, לאגף את הגן של עניין עם שני אתרי הכרת אנזים הגבלה נבחרים (שאינו נמצאים בגן של עניין), הראשון מוכנס לפני קודון ההתחלה, והשני לאחר קודון העצירה.
- תקציר הוא הווקטור וכנס עם אנזימי הגבלה (שנבחרו בשלב 1.2) בטמפרטורת העבודה של האנזימים עבור שעה אחת, ואחריו תוספת של phosphatase מעי אחד יחידת עגל (CIP) תגובת הווקטור רק במשך 30 דקות על מנת למנוע עצמי קשירה.
- טען את ה- DNA מתעכל על ג'ל 1% agarose ולהפריד המגזרים ביקע ידי אלקטרופורזה 9.
- באמצעות אור UV, לחתוך בסכין פיסות ג'ל המכילות מגזרים הרצויים של וקטור וכנס להיות ligated.
- חלץ את מקטעי הדנ"א מן חלקי ג'ל agarose (באמצעות ערכות מיצוי DNA מסחריות זמינות) ולמדוד הריכוז הסופי שלהם על ידי ספקטרופוטומטר ב 260 ננומטר.
- ולקשור את הגן של עניין לתוך וקטור שנבחרו מושרה באמצעות אנזים האנזים T4 בטמפרטורת החדר למשך 20 דקות. על מנת להגדיל את ההסתברות של הכנס ligating עם הווקטור, להשתמש יחס 3: 1 טוחן של הכנס: וקטור. לקבלת שליטה, להכין תגובת קשירה הכוללת רק את הווקטור.
- לטרנספורמציה בקטריאלי, להוסיף 10 ng של וקטור לבד וקטור + הגן לתוך 50 μL E. coli המוסמכת. דגירת הצינור על קרח למשך 30 דקות ואחריו דגירת 45 שניות על 42 מעלות צלזיוס. מיד למקום בחזרהעל קרח למשך שתי דקות ולהעביר את החיידקים שינו 500 בינוני μL LB. דגירה עבור שעה אחת ב 37 ° C תחת תסיסה ב 220 סל"ד.
- בכדי לבחור חיידקים טרנספורמציה בהצלחה, צלחת 100 μL של כל תגובה (כמתואר 1.9) על צלחת אגר מוכנה LB המכילה את האנטיביוטיקה המתאימה (למשל, 100 מיקרוגרם / מיליליטר אמפיצילין בעת שימוש pCDNA4 / TR).
- אפשר לגדול בין לילה ב 37 מעלות צלזיוס. צלחות עשויות להיות מאוחסן על 4 מעלות צלזיוס למשך עד שבועות על ידי עטיפתם בחוזקה בסרט פרפין פלסטיק.
- הרם מושבות בודדים באמצעות טיפ 10 μL, ולאפשר לגדול לילה 3 מ"ל LB + בינוני אנטיביוטי ב 37 ° C תחת תסיסה ב 220 סל"ד. חיידקים עם DNA של עניין עשוי להיות קפוא (-20 ° C) עבור אחסון לטווח קצר על ידי צנטריפוגה LB וחיידקים על 11,000 XG ו aspirating את supernatant. אחסון לטווח ארוך דורש הקפאת חיידקים כמו מניות גליצרול ב -80 מעלות צלזיוס.
- תמצית ה- DNA throuGH מיני-prep ולמדוד את הריכוז הסופי על ידי ספקטרופוטומטר ב 260 5 ננומטר.
- אשר הכניסה המוצלחת של הגן של עניין על ידי רצף לבנות מטוהרים 4. לחלופין, עיכול אבחון של המבנה על ידי אנזימי הגבלה באמצעות אלקטרופורזה להפריד בין מגזרים לחתוך ולהעריך נוכחות אורכם יכול גם להיות מנוצל עד הסוף 4 זו.
2. שורות תאי Culturing בעת TetR
- השג קו תרבית תאים מחסה פלסמיד מדכא ט משולב לתוך הדנ"א הגנומי שלהם. בזאת הפרוטוקול ייכתב באמצעות תאים 293T כליה עובריים אנושיים (HEK-293T) מחסה pcDNA6 / TR פלסמיד כדוגמה.
- תאי זרע בצלחת תרבות 100 מ"מ רקמת עם בינוני הנשרים Modified של Dulbecco (DMEM) בתוספת 10% FBS, 1% פניצילין, סטרפטומיצין, 2 מ"מ L- גלוטמין, ו 25 מ"מ HEPES, pH 7.3 (להלן: DMEM מלאה) דגירה O / N ב 37 &# 176; C ו 5% CO 2. כל העבודה עם תאים צריך להיעשות במנדף ביולוגי בתנאים סטריליים.
- על מנת לשמור על הביטוי של גני מדכאי ט, לשאוב את המדיום ולהחליף אותו עם DMEM המלא בתוספת 5 מיקרוגרם / מיליליטר blasticidin. דגירת תאים ב 37 מעלות צלזיוס, 5% CO 2.
- לאחר התאים מגיעים 80 - 90% confluency, לשאוב את המדיום בעדינות לשטוף את התאים פעמיים עם DPBS (ללא סידן ומגנזיום) חימם עד 37 מעלות צלזיוס.
- על מנת להסיר את התאים בעדינות מבלי לגרום נזק מכני, דגירה תרבות DMEM המכיל טריפסין 0.05% מחומם ל -37 מעלות צלזיוס במשך 1.5 דקות.
- חוסם את פעולת טריפסין עם נפח שווה של שליטת DMEM. פיפטה בעדינות מעלה ומטה כדי להרים את התאים ולהעבירם צינור סטרילי.
- צנטריפוגה התאים ב XG 200 במשך 5 דקות.
- לשאוב supernatant ולהחליפה 1 מ"ל מלאה DMEM. פיפטה הפתרון עם התאים למעלה ולמטה עד איןניתן לראות גושי תאים. לספור ולחשב את מספר התאים באמצעות hemocytometer.
- זרע 1 - 2 x 10 6 תאים 100 מ"מ רקמת תרבות צלחת המכילה 12 מ"ל מלא DMEM עם 5 מיקרוגרם / מ"ל blasticidin. פיצול התאים פעמיים בשבוע כפי שהם מגיעים 90% confluency.
3. Transfecting פלסמיד עניין לתאים
- שימוש באותה שיטה של תאים פיצול כמתואר לעיל, העברת התאים בארות צלחת 12 גם מוכן עם 0.9 מ"ל מלא DMEM, מספיק כדי להפוך 50% ומחוברות (~ 200,000 תאים) ו דגירה לילה ב 37 מעלות צלזיוס CO 2 מַדגֵרָה.
- הכינו תערובת transfection עם pcDNA4 / TO המכיל את הגן של עניין, פלסמיד אינרטי להביא את כמות ה- DNA הכולל עד 1 מיקרוגרם (במידת הצורך), 3 μL מגיב transfection שומנים DMEM להפוך את נפח סופי 100 μL. את הכמות האופטימלית של DNA פלסמיד לשמש משתנה מאוד כמו חלבונים שונים להביע יעילות שונה. לקבלת נבחרניסויים rophysiological, כוללים EGFP ב פלסמיד ביטוי יונקים את קוקטייל transfection כדי לחזות תאים שעוברים בהצלחה transfection 4.
- דגירה את תערובת transfection ב RT במשך 30 דקות.
- Transfect התאים על ידי pipetting את תערובת transfection ירידה מבחינת אל התאים המצופים בצלחת 12-היטב לטלטל את הצלחת במרץ על מנת להבטיח פיזור הומוגני של דנ"א מגיב transfection. תאים צריכים להיות ~ 80% ומחוברות בזמן של transfection.
- דגירה התאים transfected O / N ב 37 מעלות צלזיוס, 5% CO 2.
- ודא התאים היו transfected בהצלחה על ידי התבוננות אות הקרינה של EGFP תחת מנורת UV למחרת בבוקר אם ביצוע אלקטרופיזיולוגיה.
4. תאי ציפוי על Poly-D- ליזין (PDL) Coverslips / ולס
- לעקר 12 מ"מ coverslips ידי dousing עם 70% אתנול פתרון איזופרופיל. ניקוי ומקום coversl יחידIP בכל טוב של צלחת 24 גם עבור הקלטת אלקטרו.
- פיפטה פתרון של 0.1 - 0.2 מ"ג / מ"ל פתרון PDL על כל coverslip או גם של תא הדמיה סידן.
- אפשר לשבת במשך 30 דקות ב 37 מעלות צלזיוס חממה 2 5% CO.
- לשטוף עם מים מזוקקים פעמיים כיתה תרבית תאים (DDW) שלוש פעמים, aspirating בין כל שטיפה. בעקבות לשטוף האחרון, להתייבש היטב ולאפשר לשבת ב RT.
- לקבלת אלקטרופיזיולוגיה, למלא בכל טוב המכיל coverslip מצופה PDL עם 500 μL מלא DMEM חימם עד 37 מעלות צלזיוס.
- בצע באותה השיטה של פיצול תאי transfected כמתואר לעיל. לאחר resuspending את התאים לאחר טיפול טריפסין וחסימה, העברה 80 μL של תאים (או כ -30,000 תאים) למרכז של כל coverslip מצופה PDL להקלטת אלקטרופיזיולוגיה. אפשר תאים להסתפק לפחות 1.5 שעות או דגירה לילה ב 37 מעלות צלזיוס חממה 2 5% CO.
- עבור העברת הדמיה סידן במקום 20 μL של תאים (כ 20,000 תאים) למרכז של כל הדמיה סידן מצופה PDL היטב. אפשר תאים להסתפק לפחות 30 דקות ולהוסיף 180 μL מלא DMEM זה היטב.
ביטוי 5. ג'ין התרמה
- הכן פתרון המניות דוקסיציקלין של 1 מ"ג / מ"ל ב DDW פי הוראות היצרן. שמור פתרון המניות מוגן מפני אור על 4 מעלות צלזיוס עד 3 שבועות. עבור אחסון לטווח ארוך לשמור פתרון המניות דוקסיציקלין ב -20 ° C.
- הכן פתרון 2 מיקרוגרם / מ"ל (אלקטרופיזיולוגיה) או 3 מיקרוגרם / מ"ל (הדמיה סידן) דוקסיציקלין טרי מלא DMEM ולחמם אותו עד 37 מעלות צלזיוס.
- עבור הקלטות אלקטרו, פיפטה 500 μL של 2 מיקרוגרם / מ"ל פתרון דוקסיציקלין היטב כל לעשות לריכוז סופי של דוקסיציקלין 1 מיקרוגרם / מ"ל. עבור הדמיה סידן, להוסיף 100 μL של 3 מיקרוגרם / מ"ל פתרון דוקסיציקלין היטב כל לעשות Concentra הסופיtion של דוקסיציקלין 1 מיקרוגרם / מ"ל. רשום את שעת אינדוקציה.
- דגירה עבור פרק הזמן הרצוי לזירוז ב 37 מעלות צלזיוס, 5% CO 2.
6. ציר כיול של ביטוי חלבון
- כיול ביטוי חלבון באמצעות סידן הדמיה 5, 10
- הכן פתרון רינגר (140 mM NaCl, KCl 2.5 מ"מ, 1.8 מ"מ CaCl 2, 2 מ"מ 4 MgSO, 20 HEPES מ"מ, pH מותאם 7.4 עם NaOH) ולחמם אותו עד 37 מעלות צלזיוס.
- הכן להרוות ריכוזי אגוניסט ערוץ בתמיסת רינגר. משום שכמות אגוניסט היא מדוללת כאשר הוסיפו לתאי הדמית סידן המכילים את תאי פתרון תאי, להכפיל את הכמות לריכוז הסופי הרצוי של אגוניסט. זה גם הופך את כמות פתרון אמבטיה בכל טוב קריטי לשלוט.
- כן פתרון של אי-יוני F-127 20% W / V ברהMSO. מחממים את הפתרון 40 ° C עד שאינם יוניים מתמוסס F-127. אחסן את הפתרון הלא יוני F-127 ב RT ולחמם אותו עד 40 ° C לפני השימוש. ללא יוניים F-127 משמש כדי לסייע לפזר acetoxymethyl (AM) אסטרים של אינדיקטורים יון ניאון כגון פורעה-2 בתמיסות מימיות.
- לשאוב בינוני ולהחליפו פתרון הטעינה פורעה-02:00 (בתמיסת רינגר השלימו עם 2 - 3 מיקרומטר פורעה-02:00, 0.02 מ"ג / מ"ל הלא יוניים F-127 ו -10 מ"מ D- גלוקוז).
- דגירה של 60 דקות ב RT בחושך.
- לשאוב פורעה-02:00 פתרון ולשטוף תאים עם + רינגר 10 מ"מ פתרון D- גלוקוז להסיר צבע תאיים. חזור על פעולה זו פעמיים.
- השאירו 200 של μL רינגר + 10 מ"מ פתרון D- גלוקוז בכל טוב דגירה במשך 30 דקות ב RT בחושך.
- מניחים קאמריים על במה מעל פיסת האף המיקרוסקופ לאבטח אותו עם בעל.
- הפעל את המנורה, מצלמת מיקרוסקופ ובחר מסנן פורעה-2 כדי לזהות פליטה ב 510 ננומטר wavelength.
- כוונן עבור ההגדלה הרצויה ולהתמקד תאים בתחום הנבחר.
- בחושך, לחסר אור הרקע ולהגדיר זמן חשיפה.
- דגימת תמונת גדר על תגובת קרינת השיעור ולהקליט רצוי של תאים טעונים פורעה-2 על ידי מרגשים אותם ב 340 ו 380 אורכי גל nm. יחס 340/380 אותות הוא אינדיקטור עבור ריכוז תאיים Ca 2 + וכך גם לפעילות TRPV1.
- מוסיפים 2 קפסאיצין מיקרומטר 200 הפתרון של μL רינגר ידי pipetting ליצור ריכוז להרוות סופי של 1 מיקרומטר קפסאיצין כדי להעריך את רמת הביטוי של TRPV1.
- לנתח בתגובה TRPV1 בהתאם לזמן אינדוקציה ולקבוע פרוטוקול עבור החלבון של עניין.
- התאמת ביטוי חלבון במערכות Heterologous באמצעות תצורת התא כולו של טכניקת צמד תיקון 4, 11.
- כן tהוא לרחוץ פתרון של (מ"מ) 140 NaCl, KCl 2.3, 2 MgSO 4, 5 HEPES, ו -5 2- (N-morpholino) חומצה ethanesulfonic (MES), מותאם pH 7.4 עם NaOH.
- הכן להרוות ריכוזי אגוניסט ערוץ פתרון תאי.
- משוך אלקטרודות זכוכית בקוטר פנימי (ID) של 1.10 מ"מ ו-פולנית אש התנגדות של 2 - MΩ 4.
- הכן פתרון פיפטה של (מ"מ) 130 KCl, NaCl 4, 2 MgSO 4, 0.5 CaCl 2, 1 ו -10 EGTA HEPES מותאם 7.2 pH עם KOH. סנן פתרון פיפטה לפני השימוש. לפני כל ניסוי, טפטף זכוכית יחידה, מלוטש אש מלא בחזרה על ידי השריית הקצה בפתרון פיפטה לפחות דקה, ולאחר מכן מלאתי באמצעות טיפ מומס ומתח עם מזרק המלא עם פתרון פיפטה אותו.
- רם בעדינות coverslip יחיד PDL מצופה עם התאים המצופים מן הבאר אל צלחת פטרי פלסטיק 35 מ"מ מלא כ פתרון אמבטיה 2 מיליליטר ב RT. שימו לב תחת EPi-ניאון מיקרוסקופ.
- איתור תאי EGFP חיובי, כמו דמיינו עם מיקרוסקופ epifluorescent, על coverslip המוכן לעבור למרכז השדה דמיין.
- צרף את פיפטה המלא לבעל פיפטה של micromanipulator, להזריק כמות קטנה של לחץ חיובי לתוך המערכת כדי למנוע זיהום של פתרון פיפטה התאי. מנמיך אותו בדיוק מעל GFP - תא חיובי, בדיקת התנגדות ראויה.
- כמו פיפטה נוגעת התא, למרוח כמות קטנה של לחץ שלילי כדי ליצור חותם GΩ בין פיפטה זכוכית קרום תא.
- עם פעימה קצרה, חדה של יניקה, לשבור את קרום התא, וכך מתאפשר פיפטה לבוא במגע עם התוכן התאי של התא.
- לעבור את מצב מגבר התא כולו, ולהפחית את הרווח המסנן ופלט Bessel ל 1 - 5 kHz ו 0.5α, בהתאמה.
- רשום את התגובה הנוכחית אל להרוותריכוזי אגוניסט ערוץ באמצעות רמפות מתח או פרוטוקול חינם פער.
- בגלל יעילות ביטוי לשנות בין חלבונים שונים, לחזור על ההקלטות באמצעות פעמים אורך אינדוקציה שונות.
- קביעת זמן אינדוקציה אידיאלי להקלטות ערוץ אחד 4.
- כן פתרון של (מ"מ) 150-גלוקונאט Na, 15 NaCl, 5 EGTA, ו -10 HEPES, מותאם pH 7.4 עם NaOH, כפתרון פיפטה. לקבלת פתרון האמבטיה, השתמש הפתרון משלב 6.2.1.
- חזור על הליך תא כולו באמצעות טפטפות זכוכית מזהה 0.86 מ"מ אש מלוטשות התנגדות של 10 - 12 MΩ ולהגדיר מחזיק פוטנציאל ל -40 mV.
- צור חותם על הממברנה כפי שתואר לעיל ו לקרוע את הקרום.
- שימוש micromanipulator, להרים את פיפטה עם תיקון קרום מן התא.
- מקם את מערכת זלוף הבאה ישירות פיפטה המכיל את התיקון הממברנה.
- תחתון tהוא בסל מסנן ופלט רווח - 2 5 kHz ו 10α, בהתאמה.
- Perfuse להרוות ריכוזיים אגוניסט לרחבת הקרום, הערכה אם התיקון מכיל ערוץ אחד או יותר על פי התגובה.
- נתח את מספר תיקוני ערוץ היחידים נרשמו בהצלחה נגד זמן האינדוקציה להחיל תאים. התאם את זמן הגיוס על פי התוצאות הרצויות.
תוצאות
כדי ליצור במהירות מודל ביטוי מושרה, עשינו שימוש HEK293 תאי מבטאי חלבון טטרציקלין מדכא (TR) (למשל, T-REX-293) ו וקטורים המכילים רצפים מפעילים טטרציקלין (TETO) בין אמרגן CMV ואת אתר השיבוט המרובה (למשל, pcDNA4 / TO). כאשר transfected לתאי Trex-293, הביטוי של הגן של עניין pcDNA4 / TO שמודחק, כמו TR נקשר TETO. הוספת דוקסיציקלין למדיום מונע אינטראקציה TR-TETO, ובכך מאפשר את הביטוי של חלבון transfected. כדי לשלוט על הבעת TRPV1 חולדה (rTRPV1) אנו הראשון שהוכנס הגן של ערוץ זה לתוך pcDNA4 / כדי וקטור באמצעות פרוטוקול המתואר לעיל. לאחר מכן, T-REX-293 תאים היו transfected עם rTRPV1- pcDNA4 / TO פלסמיד פי הצעדים בנקודה 3 של הפרוטוקול. בעקבות transfection, ביטוי rTRPV1 הושר על ידי דוגרי התאים בנוכחות דוקסיציקלין (1 μg / מ"ל) עבור 1 - ג 4. חשוב לציין, ריכוזי דוקסיציקלין שונים שניתן להשתמש בהם כדי להשיג שיעור הביטוי הרצוי. השתמשנו בשיטות הדמיה אלקטרו וסידן כדי להעריך את רמת הביטוי rTRPV1 בכל נקודת זמן על ידי יישום אגוניסט שלה, קפסאיצין. כפי שניתן לראות בתרשים 1, באמצעות הדמיה סידן לחיות תאים, רמת סידן תאיים לאחר יישום קפסאיצין הוא גדל בהדרגה עם פעמים אינדוקציה יותר. הפעלה של תאי uninduced ניתן לייחס דליפת הבזליים בפעילות TR, ביטוי יתר של פלסמיד, או טטרציקלין שייר רכיבי תקשורת תאים. לאחר מכן, הקלטנו זרמים מתאיים באמצעות התצורה כל התא של טכניקת צמד תיקון החלת רמפות מתח בין -80 mV ל +80 mV. איור 2 מראה כי אמפליטודות הנוכחי גבוה מתקבלים עם פעמים אינדוקציה יותר. הרוויה משרעת הנוכחי אינדוקציה ג 4 הוא consisteNT עם הרוויה לראות בתגובת סידן (איור 1). לבסוף, ניתחנו את רמת הביטוי rTRPV1 בתצורת מחוץ-אאוט של הטכניקה תיקון- clamp. אחד הקשיים העיקריים בלימוד מבנה-תפקוד ערוץ יון הוא להגיע לרמות הביטוי מתאימות ניתוח חד ערוצים. בהתבסס על מוליכות rTRPV1 יחידתי פרסמו 4, משרעת הנוכחית רשמה שמשה כדי לקבוע את מספר ערוצי בחלקת הניכרת. כפי שניתן לראות בתרשים 3, מספר ערוצי עליות תיקון יחסי זמן דגירת דוקסיציקלין. לאחר שעה של אינדוקציה, לא הצלחנו לזהות כל פעילות ערוץ (0 מתוך 8). עם זאת, בשני מועדים לפי שעון שתיים או שלוש שעות הקלטנו פעילות ערוץ יחידה בשיעורי הצלחה דומים. מן ראוי לציין כי בעוד שעות ביותר הטלאים לא הגיבו, בתוך שלוש שעות ביותר הטלאים הראו אחת ל-רבת פעילות -channel. הסיכויים של הקלטת ערוצים מרובים לאחר שלוש שעות של אינדוקציה הוא גבוהים, ולכן זמן אינדוקציה האופטימלי להקליט נוכחי מאותו ערוץ הוא בין שעות עד שלוש שעות בתנאים שהוצגו. יחד תוצאות אלו מראות כי ביטוי של תעלות יונים יכול להיות תחת פיקוח הדוק ומוסדר לאחר transfection חולף תוך שימוש בפרוטוקול זה.

איור 1. תגובת מגדילה הפעלת TRPV1 פי אינדוקציה זמן, כמו דמיינו באמצעות סידן הדמיה. (א) תמונות פסאודו בצבע של תאי T-REX-293 להביע זמני rTRPV1, לפני ( 'בסל') ואחרי קפסאיצין (2 מיקרומטר) יישום. ברים לבנים מייצגי 30 מיקרומטר. בר סולם עולה רמות של סידן תוך תאי. (ב) משתנה עם הזמן של רמות סידן תאיים ב T-REX-293 תאים transfected מטופלים כמתוארגרף א 'מייצג ממוצע של תאים רגישים 50 קפסאיצין. הערת עליות בשלבים בתגובות קפסאיצין ביחס לזמן אינדוקציה. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
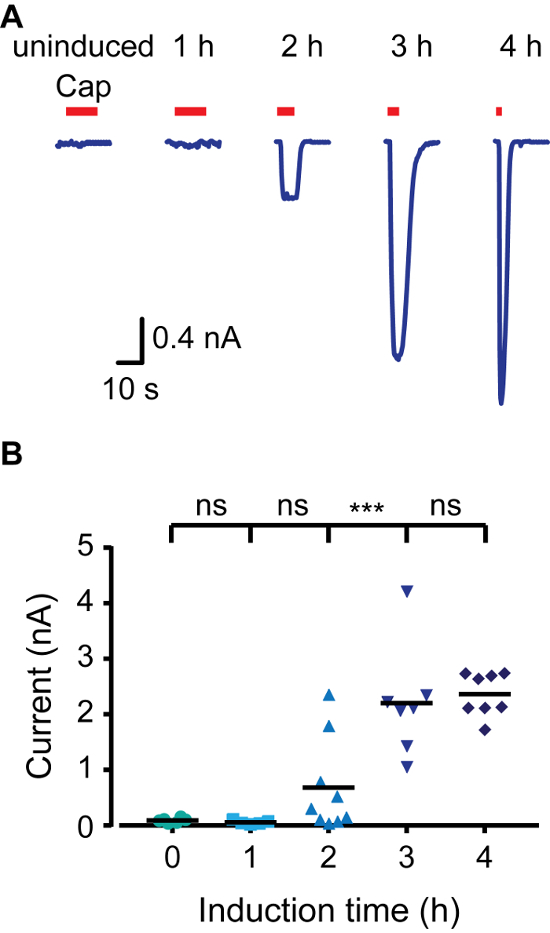
TRPV1 איור 2. מגדילה נוכחית כתוצאה של הגדלת אינדוקצית שעת שלמות תא צמד תיקון הקלטות. (א) הקלטות Whole-cell מ- T-Rex-293 transfected זמני עם rTRPV1 בבית פוטנציאל החזקת -40 mV. תאים היו מושרים עם דוקסיציקלין (1 מיקרוגרם / מיליליטר) בפעם המצוינת ולאחר מכן נחשפו קפסאיצין ( 'קאפ'; 1 מיקרומטר; פס אדום). המוצג הוא זכר נציג 6 - 11 הקלטות עצמאיות. (ב) הממוצע / פיזור-נקודת עלילה המייצגת את המשרעת כל התא עורר כפי שמוצגת א סטטיסטיקהמשמעות אל בין קבוצות נקבע עם ANOVA עם השוואות מרובות, שם *** מייצג p ≤0.001 ו ns- אינם מובהקים סטטיסטית (n = 6 - 11 תאים). אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 3. שיעור הצלחה של יחיד ערוץ תיקון ב TRPV1 הקלטות תלוי אינדוקצית זמן. (א) הקלטות-אאוט מחוץ מ- T-Rex-293 transfected זמני עם rTRPV1 בבית פוטנציאל החזקת +50 mV. תאים היו מושרים עם דוקסיציקלין (1 מיקרוגרם / מיליליטר) בפעם המצוינת ונחשפו קפסאיצין ( 'קאפ'; 1 מיקרומטר; פס אדום). המוצג הוא זכר נציג 6 - 9 הקלטות עצמאיות. (ב) ממוצע / פיזור-נקודת עלילה המייצגת את המספר של ערוצי בחלקת הניכרת כמומוצגי משמעות סטטיסטית א בין הקבוצות נקבעו עם ANOVA עם השוואות מרובות, שם *** מייצג p ≤0.001 ו ns- אינו מובהקים סטטיסטי (n = 6 - 9 תאים). אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Discussion
Transfection הוא פרוטוקול בשימוש נרחב עבור ביטוי חלבון ומחקר, עם וריאציות שונות כדי לשפר את עקביות ביטוי ויציבות. ריאגנטים transfection החולפים מציעים פשוט, קל לשימוש פרוטוקול שבו התא לחלבון של עניין ניתן לנתח בתוך שעות הלילה מהרגע של transfection. למרבה הצער גישה זו יכולה להיות בלתי צפויה כאשר אמצעי ניתוח דורש רמה עקבית של ביטוי חלבון, כגון קלטות ערוץ יחידות ב אלקטרופיזיולוגיה 2. לחלופין, שורות תאים יציבות תחת מערכת ביטוי repressible טטרציקלין פותחו כדי להציע דרך לשלוט על רמת הביטוי של החלבון של עניין 12. גישה זו מספקת ביטוי עקבי של כל תאי תרבות עם ההקדמה של תוסף נגזר טטרציקלין, כגון דוקסיציקלין. אמנם זה מאפשר שליטה עקבית ומדויקת של רמות חלבון, tהוא הזמן והמאמץ כי נכנס להקמת שורת תאים יציבה עושים את זה לא נוח ולא נח כאשר לומדים מגוון רחב של חלבונים 8.
הפרוטוקול המובא כאן מציע פתרון באמצע of-the-הדרך אל פרוטוקולי transfection הנוכחיים המוצעים. על ידי transfecting גן זמני תחת אמרגן לשליטה לתאים בעלת מדכא ט, אנחנו יכולים להשיג ביטוי לשליטה תוך הימנעות נהלים ארוכים ומסובכים. הנה, השתמשנו TRPV1 ערוץ קטיון הלא סלקטיבי עם הדמיה סידן וניתוח אלקטרופיזיולוגיה. מצאנו כי זמן האינדוקציה האידיאלי עבור הביטוי המבוקר של חלבון מסוים זה לניתוח ערוץ אחד היה בין 2 - דגירת h 3 עם 1 מיקרוגרם / מיליליטר של דוקסיציקלין (איורי 1 - 3). בקנה מידה רחב יותר, טכניקה זו יכולה לחול גם על כל חלבון של עניין. פרוטוקול זה גם מציע פתרון שליטת ביטוי כאשר Large מגוון של חלבונים או מוטציות שונות רצפי חלבונים הם בעלי עניין ויצירת שורת תאים יציבה עבור כל חלופה אינה מעשית. חשוב לציין, בעוד התוצאות כאן מייצגות את הזמן האופטימלי וריכוז החלים לביטוי TRPV1, כל גן יש תפישה וקצב תרגום וסחר ספציפי, ולכן פעמי הכיול וביטוי של כל חלבון תהיינה שונות מאוד 13.
אמנם שיטה זו מציעה פתרון נוח ביטוי בשליטה, זה לא בלי מגבלות. רק מסחרי שורות תאים זמינות מחסה במערכת ט ניתן להשתמש עם מערכת זו, אשר מהווה בעיה אם שורות תאים אלה בפרט אינן מתאימות לסוג הניתוח כי יש לבצעם. עוד מכשול לעומת קווי transfected ביציבות הוא שלא כל התאים עוברים transfection, ולכן לא כל התאים מבטאים את החלבון של עניין. בסך הכל, אנו מציעים דרך נוחה לשלוט דואר חלבוןxpression במערכת Heterologous שניתן ליישם במגוון רחב של המחקר הביו-רפואי.
Disclosures
החוקרים אין לי מה לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי הקרן הלאומית למדע [מענקי 1721/12, 1368/12, 1444/16 ו] (כדי AP). AP מזוהה עם Brettler מרכז ודוד ר בלום מרכז, בית הספר לרוקחות, האוניברסיטה העברית בירושלים.
Materials
| Name | Company | Catalog Number | Comments |
| pcDNA™4/TO Mammalian Expression Vector | ThermoScientific Fisher | V102020 | |
| pcDNA™5/TO Mammalian Expression Vector | ThermoScientific Fisher | V103320 | |
| PureLink Quick PCR Purification Kit | Invitrogen | K310001 | |
| Swift™ MaxPro Thermal Cycler | Esco | n.a | |
| Restriction Enzymes | ThermoScientific Fisher | ER0501 | |
| Agarose | Lonza | 50004 | |
| PureLink Quick Gel Extraction Kit | Invitrogen | K210012 | |
| NanoDrop 2000c | ThermoScientific Fisher | ND-2000C | |
| T4 DNA Ligase | ThermoScientific Fisher | EL0011 | |
| One Shot® TOP10 Chemically Competent E. coli | ThermoScientific Fisher | C404006 | |
| Ampicillin (Sodium), USP Grade | Gold Bio | A-301-5 | |
| Tryptone for microbiology | Merck | 6.19305E+13 | |
| Yeast Extract | BD worldwide | 212750 | |
| SIF6000R Incubated Shaker | LAB COMPANION | 45H118 | |
| NucleoSpin®plasmid | Macherey Nagel | 740588.25 | |
| MS 300V Power Supply | Major Science | MP-300V | |
| Owl™ EasyCast™ B1A Mini Gel Electrophoresis System | ThermoScientific Fisher | B1A | |
| T-REx™-293 cell line | Invitrogen | R710-07 | |
| DMEM (1x), liquid (high glucose) | Gibco | 41965-039 | |
| HindIII-HF® | NEB | R3104S | |
| ApaI | NEB | R0114S | |
| CutSmart® Buffer | NEB | B7204S | |
| pcDNA™6/TR Mammalian Expression Vector | ThermoScientific Fisher | V102520 | |
| Fetal Bovine Serum (FBS), qualified, E.U.-approved, South America origin | Gibco | 10270106 | |
| HEPES Buffer Solution (1 M) | Biological Industries | 03-025-1B | |
| Penicillin-Streptomycin Solution | Biological Industries | 03-031-1B | |
| L-Alanyl-L-Glutamine (Stable Glutamine) (200 mM) | Biological Industries | 03-022-1B | |
| Heracell™ 150i CO2 Incubator | ThermoScientific Fisher | 51026406 | |
| MSC-Advantage™ Class II Biological Safety Cabinet | ThermoScientific Fisher | 51025411 | |
| Blasticidine S hydrochloride | Sigma-Aldrich | 15205-25MG | |
| Dulbecco’s Phosphate-buffered Saline (DPBS) Modified, without calcium chloride and magnesium chloride | Sigma-Aldrich | D8537-500ML | |
| Trypsin-EDTA (0.05%), phenol red | Gibco | 25300054 | |
| Double Neubauer Ruled Metallized Hemacytometer | Hausser Scientific | 31000 | |
| Opti-MEM I Reduced Serum Medium | Gibco | 31985070 | |
| TransIT®-LT1 Transfection Reagent | Mirus | MIR 2300 | |
| glass coverslips, #1 thickness, 12 mm diameter round | Knittel Glass | GG-12 | |
| BioCoat™ Poly-D-Lysine (PDL) | Corning | 354210 | |
| Water, Cell Culture Grade | Biological Industries | 03-055-1A | |
| Doxycycline hyclate | Sigma-Aldrich | D9891-1G | |
| Fura-2, AM ester | Biotium | BTM-50034 | |
| Pluronic® F-127 | Sigma-Aldrich | P2443-250G | |
| µ-Slide 8 Well | ibidi | 80826 | |
| (E)-Capsaicin | Tocris | 462 | |
| Olympus IX70 Fluorescence Microscope | Olympus | n.a | |
| Lambda DG-4 Wavelength Switcher | Sutter Instruments | n.a | |
| EXi Blue Fluorescence Microscopy Camera | QImaging | n.a | |
| MetaFluor Fluorescence Ratio Imaging Software | Molecular Devices | n.a | |
| Thin Walled Borosilicate Tubing | Sutter Instruments | B150-110-7.5HP | |
| Standard Walled Borosilicate Tubing | Sutter Instruments | B150-86-7.5HP | |
| Dimethyl sulfoxide anhydrous | Sigma-Aldrich | 276855 | |
| P1000 micropipette puller | Sutter Instruments | P-1000 | |
| MF-900 Microforge | NARISHIGE | n.a | |
| ValveBank perfusion sysytem | AutoMate Scientific | ||
| Digidata® 1440A Low-noise Data Acquisition System | Molecular Devices | n.a | |
| Axopatch 200B Amplifier | Molecular Devices | n.a | |
| pCLAMP 10.6 Software | Molecular Devices | n.a | |
| micromanipulator | Sutter Instruments | MP-225 |
References
- Ooi, A., Wong, A., Esau, L., Lemtiri-Chlieh, F., Gehring, C. A Guide to Transient Expression of Membrane Proteins in HEK-293 Cells for Functional Characterization. Frontiers in Physiology. 7, 300(2016).
- Thomas, P., Smart, T. G. HEK293 cell line: A vehicle for the expression of recombinant proteins. Journal of Pharmacological and Toxicological Methods. 51 (3), 187-200 (2005).
- Xu, X., Nagarajan, H., et al. The genomic sequence of the Chinese hamster ovary (CHO)-K1 cell line. Nature Biotechnology. 29 (8), 735-741 (2011).
- Hazan, A., Kumar, R., Matzner, H., Priel, A. The pain receptor TRPV1 displays agonist-dependent activation stoichiometry. Scientific reports. 5, 12278(2015).
- Kumar, R., Hazan, A., Basu, A., Zalcman, N., Matzner, H., Priel, A. Tyrosine Residue in the TRPV1 Vanilloid Binding Pocket Regulates Deactivation Kinetics. Journal of Biological Chemistry. 291 (26), 13855-13863 (2016).
- Kim, T. K., Eberwine, J. H. Mammalian cell transfection: the present and the future. Analytical and bioanalytical chemistry. 397 (8), 3173-3178 (2010).
- Preuss, A. K., Connor, J. A., Vogel, H. Transient transfection induces different intracellular calcium signaling in CHO K1 versus HEK 293 cells. Cytotechnology. 33 (1-3), 139-145 (2000).
- Dalton, A. C., Barton, W. A. Over-expression of secreted proteins from mammalian cell lines. Protein Science. 23 (5), 517-525 (2014).
- Lee, P. Y., Costumbrado, J., Hsu, C. -Y., Kim, Y. H. Agarose gel electrophoresis for the separation of DNA fragments. J Vis Exp. (62), e3923(2012).
- Bohlen, C. J., Priel, A., Zhou, S., King, D., Siemens, J., Julius, D. A bivalent tarantula toxin activates the capsaicin receptor, TRPV1, by targeting the outer pore domain. Cell. 141 (5), 834-845 (2010).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflügers Archiv European journal of physiology. 391 (2), 85-100 (1981).
- Jones, J., Nivitchanyong, T., et al. Optimization of tetracycline-responsive recombinant protein production and effect on cell growth and ER stress in mammalian cells. Biotechnology and Bioengineering. 91 (6), 722-732 (2005).
- Raphemot, R., Weaver, C. D., Denton, J. S. High-throughput screening for small-molecule modulators of inward rectifier potassium channels. J Vis Exp. (71), e4209(2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved