Method Article
Управляемая Expression ионного канала через Индуцибельные временная трансфекция
В этой статье
Резюме
Изучение ионных каналов через гетерологично, выражающей системы стало основной техникой в области биомедицинских исследований. В этой рукописи, мы представляем эффективный метод времени для достижения экспрессии канала жестко контролируемой ионной путем выполнения временной трансфекции под контролем индуцируемого промотора.
Аннотация
Трансфекция, поставка зарубежных нуклеиновых кислот в клетку, является мощным инструментом в исследованиях белка. С помощью этого метода, ионные каналы могут быть исследованы через электрофизиологического анализа, биохимических характеристик, мутационных исследований, а также их влияние на клеточные процессы. Переходные трансфекцию предлагают простой протокол, в котором белок становится доступным для анализа в течение нескольких часов до нескольких дней. Хотя этот метод представляет относительно простой и эффективный протокол времени, одним из важнейших компонентов калибровки экспрессии представляющего интерес гена в физиологических соответствующих уровней или уровней, которые пригодны для анализа. С этой целью, множество различных подходов, которые предлагают возможность контролировать экспрессию представляющего интерес гена появились. Несколько устойчивых протоколов трансфекции клеток обеспечивают способ постоянно введения гена интереса в клеточный геном под регуляции тетрациклином контролируемой transcripной активации. Хотя этот метод производит надежные уровни экспрессии, каждый ген интерес требует нескольких недель квалифицированной работы, включая калибровку кривой убийства, выбор клеточных колоний, и в целом больше ресурсов. Здесь мы приводим протокол, который использует переходную трансфекцию потенциал катиона канала члена подсемейства V 1 (TRPV1) гена рецептора Переходный в индуцируемого системе как эффективный способ для экспрессии белка контролируемым способом, который имеет важное значение при анализе ионных каналов. Показано, что с помощью этой техники, мы способны выполнить визуализацию кальция, целых клеток, а также анализ одного канала с помощью контролируемых уровней каналов, необходимых для каждого типа сбора данных с одной трансфекции. В целом, это обеспечивает воспроизводимый метод, который может быть использован для изучения структуры и функции ионных каналов.
Введение
Гетерологично экспрессирующих систем является одним из наиболее широко используемых методов для изучения множества клеточных функций 1. Их низкая эндогенный белковый профиль, минимальные требования к техническому обслуживанию, надежный рост, и способность принимать и экспрессии чужеродной ДНК сделали клеточные линии , такие как эмбриональной почки человека (HEK293) и яичника китайского хомячка (СНО) почти существенное значение для биологических исследований , 2, 3. Направления исследований с использованием систем гетерологичной включают мембранные белки, внутриклеточный сигнализацию и ферментативную активность. После трансфекции чужеродной ДНК в клетку, множество различных форм анализа могут быть выполнены, в том числе и электрофизиологических, логометрической визуализации кальция, вестерн - блоттинга и т.д. 4, 5.
Благодаря широкому спектру потенциальных приложений для гетерологичных систем экспрессии, многие differeнт реагенты и продукты были разработаны , чтобы использовать эти клетки и их свойства 6. Системы доставки ДНК, которая транзиторно или постоянно интегрируют чужеродной ДНК в клетки для изучения экзогенный белок стал одним из самых популярных и полезных инструментов для биологических исследований. Более конкретно, скоротечно трансфекцию ДНК в клетку широко используется в качестве простой, прямой процесс, который требует относительно мало времени и материалов. Кроме того, вероятность успеха клеток , которые подвергаются трансфекции высок 7. Этот метод очень надежным в сочетании с маркерным геном , такие как зеленый флуоресцентный белок (GFP), и может быть использован для множества различных методов , таких как изображения кальция и электрофизиологических 5. К сожалению, хотя, скоротечно экспрессии ДНК в клетки-хозяева приходит с некоторыми крупными ловушками, ни в малейшей степени, что уровень экспрессии в клетке является недостоверной. Число копий ДНК плазмиды взяты Uр на одну клетку неуправляема, таким образом , выражение между отдельными экспериментами может сильно различаться 2. Эта проблема становится существенной, когда либо пытается повторить физиологические условия, или при выполнении точных методов сбора данных.
В качестве решения осложнений, упомянутых выше, стабильные протоколы трансфекции были разработаны, в котором ген, представляющий интерес может быть вставлена в геном клетки под жестким контролем индуцируемого промотора, такого как система экспрессии репрессор тетрациклина, что обеспечивает единый копия плазмиды интегрирует в геном каждой клетки и выражается только после индукции механизма транскрипции, например, в присутствии доксициклина. В то время как это решает препятствия непоследовательных уровней экспрессии белка, этот метод теряет удобство быстрой и относительно простой протокол переходных трансфекциях. Создание стабильной клеточной линии занимает по меньшей мере несколько недель в whicч необходимо откалибровать кривую убийства набор специфическими антибиотиками, чтобы поддерживать экспрессию белка и обеспечивают интеграцию вектора и умело выбирать и выращивать клеточные колонии. В целом , это занимает значительно больше времени и усилий с более низкой вероятностью успеха 8.
Здесь мы вводим промежуточный протокол, который опирается на сильные стороны обоих популярных вариантов трансфекции, чтобы обеспечить простой и эффективный способ контролировать уровни экспрессии в любой индуцируемого клеточной линии. Сохраняя клетки с индуцибельной системой ТЕТ мы скоротечно трансфекцию наш интерес ген, потенциальные катиона канала подсемейства V элемент 1 (TRPV1) Переходный рецепторной лигируют в вектор, который может гомологичной в сочетании с системой репрессора. Таким образом, ген может быть введен в клетки, не имеющие начала выражать. Только с добавлением доксициклин делает ген начинают выражать, что позволяет калибровать уровни белка выражession в соответствии с методикой, или уровней, наблюдаемое в физиологических условиях. Наш протокол также позволяет избежать длительных осложнений, связанных с формированием стабильно экспрессирующей клеточной линии. Мы начинаем показывать изменяющиеся уровни активации TRPV1 в визуализации кальция из ун-индуцированных через четыре часа индукции и, как повышение уровня внутриклеточного кальция коррелирует. Затем мы дублируем протокол в конфигурации всей ячейки техники патч зажима, показывающий увеличением тока с увеличением времени индукции. И, наконец, мы приводим примеры отдельных записей электрофизиологических канала, и показывают, что эта методика особенно полезна для контролируемого выражения при поиске точного сбора данных на основе отдельных единиц белка. С помощью нашего протокола, мы предлагаем удобный способ контролировать экспрессию белка в гетерологичных системах, избегая длительных осложнений культивирования клеток, обеспечивая тем самым способ контролировать условия между экспериментами и обеспечить моповторно воспроизводимые результаты.
протокол
1. лигирования представляющего интерес гена в репрессируемый Сайт Vector
- Получить индуцируемый вектор, такой как pcDNA5 / FRT / TO или pcDNA4 / TO.
- Анализ интересующего гена для любых потенциально восприимчивых сайтов рестрикции в середине гена , который также представлен в сайт множественного клонирования выбранного вектора с помощью программного обеспечения для анализа в силикомарганца ДНК 4.
- При использовании стандартного перекрытия методов ПЦР 4, обрамляют интерес ген с двумя выбранными сайтами узнавания ферментов рестрикции (которые не встречаются в гене интереса), первый вставляется перед стартовым кодоном, а второй после стоп - кодона.
- Дайджест как вектор и вставки с ферментами рестрикции (выбранный на шаге 1.2) при рабочей температуре ферментов "в течение одного часа, с последующим добавлением одной единицы фосфатазы кишечника теленка (МЦК) к вектору реакции только в течение 30 минут, чтобы избежать само- лигирование.
- Нагрузка расщепленной ДНК на агарозном геле 1% и отделяют Расщепленный сегменты с помощью электрофореза в 9.
- Использование УФ-светом, срезанные с лезвием кусочки геля, содержащие требуемые сегменты вектора и вставки для лигирования.
- Извлечение сегментов ДНК из агарозного геля штук (с использованием коммерческих доступных наборов экстракции ДНК) и измеряют их конечную концентрацию с помощью спектрофотометра при 260 нм.
- Лигирования представляющего интерес гена в индуцируемой выбранный вектор с использованием лигазы Т4 фермента при комнатной температуре в течение 20 минут. Для того, чтобы увеличить вероятность вставки лигирования с вектором, используйте 3: 1 молярное отношение вставки: вектор. Для контроля, подготовить реакцию лигирования, которая включает в себя только вектор.
- Для бактериальной трансформации, добавить 10 нг только вектора и вектора + гена в 50 мкл компетентной E.coli. Инкубируйте пробирку на льду в течение 30 минут, а затем 45 секунд инкубации при 42 ° C. Сразу же место назадна льду в течение двух минут и переносят трансформированных бактерий в 500 мкл среды LB. Инкубируют в течение одного часа при 37 ° С при перемешивании со скоростью 220 оборотов в минуту.
- Для селекции успешно трансформированных бактерий, пластина 100 мкл каждой реакционной смеси (как это описано в пункте 1.9) на подготовленную чашку с агаром LB , содержащей подходящий антибиотик (например, 100 мкг / мл ампициллина при использовании pCDNA4 / TR).
- Разрешить расти в течение ночи при 37 ° С. Пластины могут храниться при температуре 4 ° С в течение двух недель с плотно оборачивать их в пластиковом парафиновой пленки.
- Lift отдельных колоний с использованием наконечника 10 мкл, и дают расти в течение ночи в 3 мл LB + среда антибиотик при температуре 37 ° С при перемешивании со скоростью 220 оборотов в минуту. Бактерии с представляющую интерес ДНК могут быть заморожены (-20 ° С) для кратковременного хранения при центрифугировании LB и бактерии при 11000 х г и аспирационного из надосадочной жидкости. Длительное хранение требует замораживания бактерии как запасов глицерина при -80 ° С.
- Извлечение ДНК throuГ.Х. мини-Prep и измерить конечную концентрацию спектрофотометрически при 260 нм 5.
- Подтверждение успешного введение гена путем секвенирования очищенного построить 4. В качестве альтернативы, диагностическое переваривание конструкции с помощью ферментов рестрикции с использованием электрофореза для разделения сегментов вырезать и оценить их присутствие и длины также могут быть использованы для этой цели 4.
2. Культивирование клеточные линии, экспрессирующие тетр
- Получить культуры клеток линии укрывательство Tet репрессора плазмиды включены в их геномной ДНК. При этом протокол будет записан с использованием эмбриональной почки человека 293T клетки (НЕК-293Т) укрывательство pcDNA6 / TR плазмиды в качестве примера.
- Семенной клеток в 100 мм планшет для тканевых культур с Дульбекко Modified орлов Medium (DMEM), дополненной 10% FBS, 1% пенициллина-стрептомицина, 2 мМ L-глутамина и 25 мМ HEPES, рН 7,3 (в данном описании: Полный DMEM), и инкубировать O / N при 37 &# 176; С и 5% СО 2. Вся работа с клетками должно быть сделано в биологической капот в стерильных условиях.
- Для того, чтобы поддерживать экспрессию гена репрессора Tet, аспирация среды и заменить ее с полной DMEM с добавлением 5 мкг / мл бластицидин. Инкубируйте клетки при 37 ° С и 5% CO 2.
- После того, как клетки достигают 80 - 90% слитности, аспирация среды и осторожно промыть клетки дважды с ДЗФР (без кальция и магния) нагревают до 37 ° С.
- Для того, чтобы аккуратно приподнять клетки, не вызывая механических повреждений, инкубацию культуры в среде DMEM, содержащей 0,05% трипсина нагревали до 37 ° С в течение 1,5 мин.
- Блокировать действие трипсина с равным объемом полного DMEM. Аккуратно пипеткой вверх и вниз, чтобы поднять клетки и передавать их в стерильную пробирку.
- Центрифуга клетки при 200 мкг в течение 5 мин.
- Аспирируйте супернатант и заменить его на 1 мл полной DMEM. не Пипетировать раствор с клетками вверх и вниз до тех пор, нетсгустки клеток можно увидеть. Граф и рассчитать количество клеток с использованием гемоцитометра.
- Семенной 1 - 2 × 10 6 клеток в 100 мм блюдо культуры ткани , содержащей 12 мл Полный DMEM с добавлением 5 мкг / мл бластицидин. Разделите клетки два раза в неделю, как они достигают 90% слитности.
3. трансфекцию интересующую плазмиду в клетки
- Используя тот же метод разделения клеток , как описано выше, клетки передачи в лунки в 12-луночный планшет , приготовленной с 0,9 мл полного DMEM, достаточно , чтобы сделать 50% сплошности (~ 200000 клеток) и инкубируют в течение ночи при 37 ° С в СО 2 инкубатор.
- Готовят смесь с трансфекционной pcDNA4 / К, содержащий интересующий ген, инертную плазмида, чтобы довести общее количество ДНК в концентрации 1 мкг (при необходимости), 3 мкл липидного реагента трансфекции и DMEM, чтобы конечный объем 100 мкл. Оптимальное количество плазмидной ДНК для использования колеблется в широких пределах, как различные белки выражают в разной эффективностью. Для избранныхrophysiological эксперименты, включают EGFP в плазмиде экспрессии млекопитающих в трансфекции коктейле для визуализации клеток , которые успешно претерпевают трансфекцию 4.
- Выдержите смесь для трансфекции при КТ в течение 30 мин.
- Трансфекции клеток с помощью пипетки для трансфекции смеси по каплям на посеянных клеток в 12-луночный планшет и раскачивать пластину энергично, чтобы обеспечить однородную дисперсию ДНК и реагента для трансфекции. Клетки должны быть ~ 80% сплошности во время трансфекции.
- Инкубируйте трансфицированных клеток O / N при температуре 37 ° С и 5% СО 2.
- Убедитесь, что клетки были успешно трансфицированы путем наблюдения флуоресценции сигнал EGFP под ультрафиолетовой лампой на следующее утро, если выполнение электрофизиологии.
4. Покрытие Клетки поли-D-лизин (PDL) Покровные / Wells
- Стерилизовать 12 мм покровные путем обливания 70% -ным раствором изопропилового этанола. Сухие и поместите один coverslIP в каждую лунку 24-луночного планшета для электрофизиологические записи.
- Капают раствор 0,1 - 0,2 мг / мл раствора PDL на каждом покровном или лунку изображения камеры кальция.
- Позвольте сидеть в течение 30 мин при 37 ° С в 5% СО 2 инкубатора.
- Смойте класса культуры клеток дважды дистиллированной воды (DDW) три раза, аспирационных между каждым мытьем. После последней промывки, тщательно высушить и позволить сидеть при комнатной температуре.
- Для электрофизиологических, заполнить каждую лунку, содержащую покровное покрытую PDL с 500 мкл полной среды DMEM нагревали до 37 ° С.
- Выполните один и тот же метод разделения трансфектированных клеток, как описано выше. После ресуспендирования клеток после обработки трипсином и блокировании передачи 80 мкл клеток (или приблизительно 30 000 клеток) в центре каждого покровное PDL покрытием для записи электрофизиологической. Разрешить клетки оседать в течение не менее 1,5 ч , или инкубировать в течение ночи при 37 ° С в атмосфере 5% СО 2 инкубаторе.
- Для передачи изображения кальция и пятно 20 мкл клеток (приблизительно 20 000 клеток) в центр каждой покрытой визуализации кальция PDL скважины. Разрешить клетки урегулировать в течение не менее 30 мин и добавляют 180 мкл полной DMEM в каждую лунку.
5. Индуцирование экспрессии генов
- Подготовить доксициклин исходного раствора 1 мг / мл в DDW в соответствии с инструкциями изготовителя. Хранить исходный раствор защищенном от света месте при температуре 4 ° С в течение до 3-х недель. При длительном хранении держать доксициклин маточный раствор при -20 ° C.
- Свежеприготовленной 2 мкг / мл (электрофизиологии) или 3 мкг / мл (визуализации кальция) раствор доксициклина в полной DMEM и подогреть до 37 ° С.
- Для Электрофизиологические записи, пипеткой 500 мкл 2 мкг / мл раствора доксициклина в каждую лунку, чтобы получить конечную концентрацию 1 мкг / мл доксициклина. Для визуализации кальция, добавляют 100 мкл 3 мкг / мл раствора доксициклина в каждую лунку, чтобы сделать окончательный Concentraние 1 мкг / мл доксициклина. Запишите час индукции.
- Выдержите в течение требуемого количества времени , для индукции при 37 ° С и 5% CO 2.
6. Calibrating Хронология экспрессии белка
- Калибровка экспрессии белка через визуализации кальция 5, 10
- Приготовьте раствор Рингера (140 мМ NaCl, 2,5 мМ KCl, 1,8 мМ CaCl 2, 2 мМ MgSO 4, 20 мМ HEPES, рН доводили до 7,4 с помощью NaOH) и нагревают его до 37 ° C.
- Подготовить насыщающих концентраций агониста канала в растворе Рингера. Поскольку количество агониста разбавляют при добавлении в камерах обработки изображений, содержащих кальций клетки и внеклеточный раствор, удвоить количество требуемой конечной концентрации агониста. Это также делает количество раствора ванны в каждую лунку решающее значение для управления.
- Готовят раствор неионогенного F-127 20% в / в DMSO. Раствор нагревают до 40 & deg; С до неионогенные F-127 растворяется. Хранить неионогенного раствора F-127 при комнатной температуре и нагреть его до 40 ° С перед использованием. Неионный F-127 используется, чтобы помочь рассеять ацетоксиметиловые (AM) сложные эфиры флуоресцентных индикаторов ионов, таких как Fura-2 в водных растворах.
- Отберите среда и заменить его фура-2 утра погрузочной раствор (раствор Рингера с добавлением 2 - 3 мкМ фура-2 утра, 0,02 мг / мл неионогенные F-127 и 10 мМ D-глюкозы).
- Инкубировать в течение 60 мин при комнатной температуре в темноте.
- Отберите Фура-2Ат раствор и промыть клетки с раствором D-глюкозы Рингера + 10 мМ для удаления внеклеточный краситель. Повторите этот шаг дважды.
- Оставьте раствор D-глюкозы 200 мкл Рингера + 10 мМ в каждую лунку и инкубировать в течение 30 мин при комнатной температуре в темноте.
- Поместите камеру на ступень выше носовой части микроскопа и закрепите его с держателем.
- Включите лампу, камеры и микроскопа и выберите Fura-2 Фильтр для обнаружения излучения на длине волны 510 нм WAVelength.
- Регулировка для требуемого увеличения и фокус ячейки в выбранном поле.
- В темноте, вычитают фоновый свет и установить время экспозиции.
- Установить выборки изображение с желаемой скоростью и запись флуоресцентного отклика фура-2 нагруженных клеток путем их возбуждения при 340 и 380 нм длины волны. Отношение 340/380 сигналов является показателем концентрации внутриклеточного Са 2+ и , таким образом , также для TRPV1 активности.
- Добавить 2 мкМ капсаицина в растворе 200 мкл раствора Рингера с помощью пипетки, чтобы создать конечную концентрацию насыщающего 1 мкМ капсаицина, чтобы оценить уровень экспрессии TRPV1.
- Анализ реакции TRPV1 в соответствии с временем индукции и определить протокол для белка, представляющего интерес.
- Регулировка экспрессии белка в гетерологичных системах с использованием конфигурации всей ячейки метода патч зажим 4, 11.
- Приготовьте тон ванны раствором (мм) 140 NaCl, 2,3 KCl, 2 MgSO 4, 5 HEPES и 5 2- (N-морфолино) этансульфоновой кислоты (MES), доводили до рН 7,4 с помощью NaOH.
- Подготовить насыщающих концентраций агониста канала в внеклеточный раствор.
- Вытащите стеклянные электроды с внутренним диаметром (ID) 1,10 мм и огненного полируют сопротивлению 2 - 4 МОм.
- Приготовьте пипеток раствора (мМ) 130 KCl, 4 NaCl, 2 MgSO 4, 0,5 CaCl 2, 1 и 10 EGTA в HEPES , рН доводили до 7,2 с помощью КОН. Фильтр решение пипетки перед использованием. Перед каждым экспериментом один, противопожарная полированное стекло пипетки обратно заполнен погружая кончик в раствор пипеткой, по крайней мере, одну минуту, а затем заполнить при помощи растопленного и растянутый наконечник с помощью шприца, наполненного тем же раствором пипеткой.
- Осторожно поднимите одного покровное PDL, покрытый высевания клеток от скважины до 35 мм пластиковые чашки Петри заполнены приблизительно 2 мл раствора ванны при комнатной температуре. Соблюдайте под еря-флуоресцентный микроскоп.
- Найдите положительную клетку EGFP, как и визуализировали с эпифлуоресцентной микроскопом, на подготовленном покровным и двигаться к центру выведенной поля.
- Прикрепите заполненную пипетку к держателю пипетки в микроманипулятора и вводят небольшое количество положительного давления в системе, чтобы избежать загрязнения внутриклеточного раствора пипеткой. Опустите его чуть выше GFP - положительных клеток, проверка правильности установки сопротивления.
- По мере того как пипетка касается ячейки, нанесите небольшое количество отрицательного давления для того, чтобы создать ГОм уплотнение между стеклянной пипеткой и клеточной мембраны.
- С коротким, резким импульсом всасывания, разорвать клеточную мембрану, позволяя пипетка вступать в контакт с внутриклеточными содержимое ячейки.
- Переключение режима усилителя для целой клетки, и опустите фильтр и выходной коэффициент усиления Бесселя 1 - 5 кГц и 0.5α соответственно.
- Запись текущего ответа на насыщаяКонцентрации канала агониста с помощью пандусов напряжения или свободный протокол зазора.
- Поскольку эффективность экспрессии переключения между различными белками, повторяют записи, используя разные времена индукции длины.
- Определение идеального времени индукции для одиночных записей канала 4.
- Готовят раствор (мМ) 150 Na-глюконат, 15 NaCl, 5 EGTA и 10 HEPES, рН которого доводили до 7,4 с помощью NaOH, в качестве раствора пипеткой. Для решения ванны, используйте раствор со стадии 6.2.1.
- Повторите процедуру Цельноклеточные с помощью ID 0,86 мм стеклянные пипетки пожарно-отполирована до сопротивления 10 - 12 МОм и установить холдинг потенциал -40 мВ.
- Создание уплотнение на мембране, как описано ранее, и привести к разрыву мембраны.
- Использование микроманипулятора, поднимите пипетку с мембраной пластыря от клетки.
- Расположите систему перфузионного непосредственно рядом с пипеткой, содержащей мембраны патч.
- Нижняя тон фильтр Бесселя и выходной коэффициент усиления до 2 - 5 кГц и 10α, соответственно.
- Заливать насыщающих концентраций агониста на мембрану пластыря, оценку, если патч содержит один или несколько каналов, в соответствии с ответом.
- Анализ количества отдельных патчей канала успешно записанных против времени индукции приложенного к клеткам. Отрегулировать время индукции в соответствии с желаемыми результатами.
Результаты
Для того, чтобы быстро создать индуцируемый модель экспрессии, мы использовали клетки НЕК293 , которые выражают Тетрациклин белок - репрессор (TR) (например, T-REX-293) и векторы, содержащие последовательности оператора тетрациклина (Teto) между промотором CMV и сайт множественного клонирования (например, pcDNA4 / TO). Когда трансфицировали в клетки TRex-293, экспрессия представляющего интерес гена в pcDNA4 / TO подавлено, а ТР связывается с Teto. Добавление доксициклин к среде предотвращает взаимодействие ТР-Teto, тем самым позволяя экспрессию трансфицированных белка. Для того, чтобы контролировать экспрессию крысы TRPV1 (rTRPV1) мы сначала вставить ген этого канала в pcDNA4 / TO вектор с использованием описанного выше протокола. Затем клетки T-REX-293 были трансфицированы с rTRPV1- pcDNA4 / плазмидной в соответствии с этапами в пункте 3 протокола. После трансфекции экспрессия rTRPV1 индуцировали инкубацией клеток в присутствии доксициклина (1 мкмг / мл) в течение 1 - 4 ч. Важно отметить, что различные концентрации доксициклина могут быть использованы для достижения желаемой скорости экспрессии. Мы использовали электрофизиологические и кальция методов визуализации для оценки уровня экспрессии rTRPV1 в каждый момент времени путем применения его агониста, капсаицина. Как показано на фиг.1, с помощью визуализации кальция живых клеток, внутриклеточный уровень кальция после применения капсаицин постепенно увеличивается с более продолжительными индукционными раза. Активация неиндуцированных клеток может быть связано с базальной утечки в TR активности, избыточной экспрессии плазмиды или остаточной тетрациклина в компонентах клетки СМИ. Далее, мы записали токи от клеток с использованием конфигурации целой клетки в технике патч зажим применения пандусы напряжения от -80 мВ до +80 мВ. На рисунке 2 показано , что более высокие амплитуды тока получаются с более длительными индукционными раза. Насыщение в амплитуде тока через 4 часа индукции consisteнт с насыщением видели в ответ кальция (рис 1). Наконец, мы проанализировали уровни экспрессии rTRPV1 в снаружи из конфигурации метода пэтч-кламп. Одна из главных трудностей в изучении ионных каналов структуры-функции достигает уровней экспрессии, пригодные для анализа одноканальной. На основании опубликованных унитарной rTRPV1 кондактансе 4, записанная амплитуда тока была использована для определения количества каналов в вырезанной пластыря. Как показано на рисунке 3, количество каналов в пластыре , возрастает пропорционально времени доксициклин инкубации. Через один час индукции, мы не смогли обнаружить какой-либо активности канала (0 из 8). Тем не менее, в обоих двух- и трехчасовой моменты времени мы записали активность одного канала в аналогичных показателей успешности. Следует отметить, что в то время как в течение двух часов большинство патчей не ответили, в течение трех часов большинство патчей показали сингл к мульти двухканальному деятельности, Шансы на запись нескольких каналов по истечении трех часов индукции высока, таким образом, оптимальное время индукции для записи ток от одного канала составляет от двух до трех часов в представленных условиях. В совокупности эти результаты показывают, что экспрессия ионных каналов может быть жестко контролируется и регулируется после временной трансфекции с использованием этого протокола.

Рисунок 1. Реакция TRPV1 активации увеличивается по времени индукции, а через Визуализация визуализации кальция. (A) Псевдо-цветные изображения клеток T-REX-293 скоротечно , выражающих rTRPV1, до ( «базальной») и после капсаицина применения (2 мкМ). Белые полосы составляют 30 мкм. Шкала масштаба показывает уровни внутриклеточного кальция. (B) Изменения со временем внутриклеточных уровней кальция в трансфицированных Т-REX-293 клеток , обработанных , как показанов А. Каждый график представляет среднее число 50 капсаицин чувствительных клеток. Обратите внимание на скачкообразные увеличение в ответах капсаицина по отношению к времени индукции. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
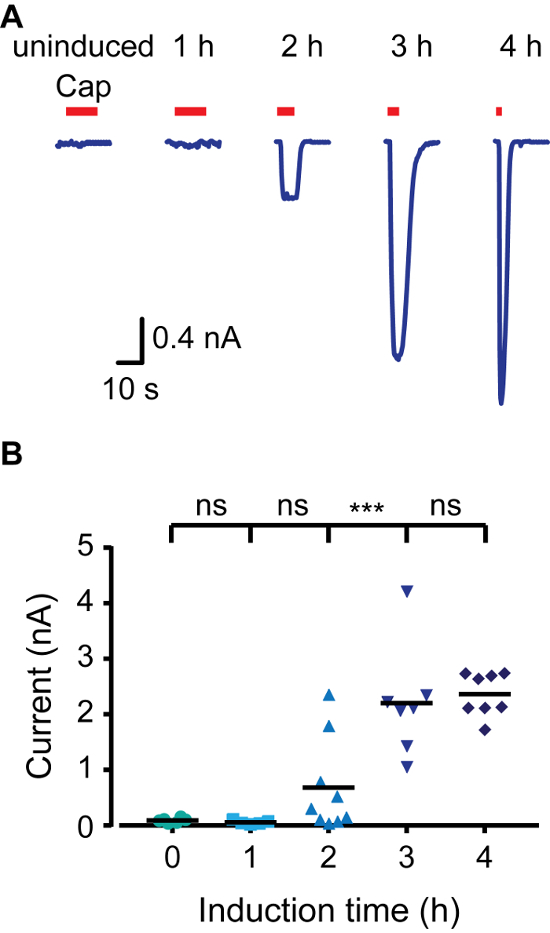
Рисунок 2. TRPV1 ток увеличивается в результате увеличения времени индукции в Цельноклеточные Patch Clamp Recordings. (A) записи цельноклеточная от T-REX-293 трансфицированы с rTRPV1 в холдинговую потенциале -40 мВ. Клетки индуцировали доксициклин (1 мкг / мл) в течение указанного времени, а затем подвергается воздействию капсаицина ( 'Cap'; 1 мкМ; красная полоса). Показана представитель след 6 - 11 независимых записей. (B) Среднее / разброс точек участок , представляющий амплитуду цельноклеточная Вызванные , как показано на А. Statisticаль значение между группами определяли с помощью ANOVA с множественными сравнениями, где *** представляет р ≤0.001 и NS- не являются статистически значимыми (n = 6 - 11 ячеек). Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 3. Успех Скорость одиночного канала Patch в TRPV1 записей зависит от времени индукции. (A) снаружи из записей с T-REX-293 трансфицированы с rTRPV1 в холдинговую потенциала +50 мВ. Клетки индуцировали доксициклин (1 мкг / мл) в течение указанного времени, и подвергали воздействию капсаицина ( 'Cap'; 1 мкМ; красная полоса). Показана представитель след 6 - 9 независимых записей. (В) Среднее / разброс точек график , представляющий число каналов в вырезанной патчепоказано А. Статистическая значимость между группами определяли с помощью ANOVA с множественными сравнениями, где *** представляет р ≤0.001 и NS- не являются статистически значимыми (n = 6 - 9 ячеек). Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Обсуждение
Трансфекция широко используемый протокол для экспрессии белка и исследования, с множеством различных вариаций для улучшения консистенции и стабильности экспрессии. Переходные трансфекции реагенты предлагают простой, легкий в использовании протокол, в котором клетка и интерес белок может быть проанализирован в течение нескольких часов, чтобы в течение ночи с момента трансфекции. К сожалению , этот подход может быть непредсказуемым , когда режим анализа требует соответствующего уровня экспрессии белка, таких как отдельные записи канала в электрофизиологии 2. В качестве альтернативы, стабильные клеточные линии под тетрациклинового системы репрессируемый экспрессии были разработаны , чтобы предложить способ управления уровня экспрессии белка , представляющего интерес 12. Такой подход обеспечивает последовательное выражение всех клеток в культуре с введением тетрациклина производным добавки, такие как доксициклин. В то время как это позволяет последовательное и точное управление уровней белка, тон время и усилия , которые идут в к созданию стабильной клеточной линии делает его неудобным и невыгодным при изучении широкого спектра белков 8.
Протокол, представленные здесь, предлагает центристский решение текущих трансфекцию протоколов, предлагаемых. По скоротечно трансфекцию гена под контролируемым промотором в клетках, обладающих репрессор Tet, мы можем добиться контролируемого выражения, избегая длительных и сложных процедур. Здесь мы использовали неселективный TRPV1 катиона канала с помощью визуализации кальция и анализа электрофизиологии. Мы обнаружили , что идеальное время индукции для контролируемой экспрессии этого специфического белка для одного анализа канала составляет от 2 - 3 ч инкубации с 1 мкг / мл доксициклина (рисунки 1 - 3). В более широком масштабе, этот метод также может быть применен к любому интересующему белку. Этот протокол также предлагает решение контролировать экспрессию, когда ларGE диапазон различных белков или мутации в последовательности белка представляют интерес и создание стабильной клеточной линии для каждого варианта является непрактичным. Важно отметить, что в то время как результаты здесь представляют оптимальное время и концентрации , применимые для экспрессии TRPV1, каждый ген имеет свой индивидуальный и конкретный перевод и незаконный оборот темп, таким образом, калибровка и экспрессии раз каждого белка будет в значительной степени 13 отличаются.
В то время как этот метод предлагает удобное решение для контролируемой экспрессии, не без ограничений. Только коммерчески доступные клеточные линии, несущие систему Tet можно использовать с этой системой, которая представляет собой проблему, если эти специфические клеточные линии являются неподходящими для вида анализа, который должен быть выполнен. Еще одной ловушкой, по сравнению с стабильно трансфицированных линий, что не все клетки подвергаются трансфекции, и, таким образом, не все клетки экспрессируют белок, представляющий интерес. В целом, мы предлагаем удобный способ контролировать белок ЕXpression в гетерологичной системе, которые могут быть применены к широкому спектру биомедицинских исследований.
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Эта работа была поддержана Израильского научного фонда [гранты 1721/12, 1368/12 и 1444/16] (АП). AP является филиалом Brettler Центра и Дэвид Р. Блум центр, школа фармации, Еврейский университет в Иерусалиме.
Материалы
| Name | Company | Catalog Number | Comments |
| pcDNA™4/TO Mammalian Expression Vector | ThermoScientific Fisher | V102020 | |
| pcDNA™5/TO Mammalian Expression Vector | ThermoScientific Fisher | V103320 | |
| PureLink Quick PCR Purification Kit | Invitrogen | K310001 | |
| Swift™ MaxPro Thermal Cycler | Esco | n.a | |
| Restriction Enzymes | ThermoScientific Fisher | ER0501 | |
| Agarose | Lonza | 50004 | |
| PureLink Quick Gel Extraction Kit | Invitrogen | K210012 | |
| NanoDrop 2000c | ThermoScientific Fisher | ND-2000C | |
| T4 DNA Ligase | ThermoScientific Fisher | EL0011 | |
| One Shot® TOP10 Chemically Competent E. coli | ThermoScientific Fisher | C404006 | |
| Ampicillin (Sodium), USP Grade | Gold Bio | A-301-5 | |
| Tryptone for microbiology | Merck | 6.19305E+13 | |
| Yeast Extract | BD worldwide | 212750 | |
| SIF6000R Incubated Shaker | LAB COMPANION | 45H118 | |
| NucleoSpin®plasmid | Macherey Nagel | 740588.25 | |
| MS 300V Power Supply | Major Science | MP-300V | |
| Owl™ EasyCast™ B1A Mini Gel Electrophoresis System | ThermoScientific Fisher | B1A | |
| T-REx™-293 cell line | Invitrogen | R710-07 | |
| DMEM (1x), liquid (high glucose) | Gibco | 41965-039 | |
| HindIII-HF® | NEB | R3104S | |
| ApaI | NEB | R0114S | |
| CutSmart® Buffer | NEB | B7204S | |
| pcDNA™6/TR Mammalian Expression Vector | ThermoScientific Fisher | V102520 | |
| Fetal Bovine Serum (FBS), qualified, E.U.-approved, South America origin | Gibco | 10270106 | |
| HEPES Buffer Solution (1 M) | Biological Industries | 03-025-1B | |
| Penicillin-Streptomycin Solution | Biological Industries | 03-031-1B | |
| L-Alanyl-L-Glutamine (Stable Glutamine) (200 mM) | Biological Industries | 03-022-1B | |
| Heracell™ 150i CO2 Incubator | ThermoScientific Fisher | 51026406 | |
| MSC-Advantage™ Class II Biological Safety Cabinet | ThermoScientific Fisher | 51025411 | |
| Blasticidine S hydrochloride | Sigma-Aldrich | 15205-25MG | |
| Dulbecco’s Phosphate-buffered Saline (DPBS) Modified, without calcium chloride and magnesium chloride | Sigma-Aldrich | D8537-500ML | |
| Trypsin-EDTA (0.05%), phenol red | Gibco | 25300054 | |
| Double Neubauer Ruled Metallized Hemacytometer | Hausser Scientific | 31000 | |
| Opti-MEM I Reduced Serum Medium | Gibco | 31985070 | |
| TransIT®-LT1 Transfection Reagent | Mirus | MIR 2300 | |
| glass coverslips, #1 thickness, 12 mm diameter round | Knittel Glass | GG-12 | |
| BioCoat™ Poly-D-Lysine (PDL) | Corning | 354210 | |
| Water, Cell Culture Grade | Biological Industries | 03-055-1A | |
| Doxycycline hyclate | Sigma-Aldrich | D9891-1G | |
| Fura-2, AM ester | Biotium | BTM-50034 | |
| Pluronic® F-127 | Sigma-Aldrich | P2443-250G | |
| µ-Slide 8 Well | ibidi | 80826 | |
| (E)-Capsaicin | Tocris | 462 | |
| Olympus IX70 Fluorescence Microscope | Olympus | n.a | |
| Lambda DG-4 Wavelength Switcher | Sutter Instruments | n.a | |
| EXi Blue Fluorescence Microscopy Camera | QImaging | n.a | |
| MetaFluor Fluorescence Ratio Imaging Software | Molecular Devices | n.a | |
| Thin Walled Borosilicate Tubing | Sutter Instruments | B150-110-7.5HP | |
| Standard Walled Borosilicate Tubing | Sutter Instruments | B150-86-7.5HP | |
| Dimethyl sulfoxide anhydrous | Sigma-Aldrich | 276855 | |
| P1000 micropipette puller | Sutter Instruments | P-1000 | |
| MF-900 Microforge | NARISHIGE | n.a | |
| ValveBank perfusion sysytem | AutoMate Scientific | ||
| Digidata® 1440A Low-noise Data Acquisition System | Molecular Devices | n.a | |
| Axopatch 200B Amplifier | Molecular Devices | n.a | |
| pCLAMP 10.6 Software | Molecular Devices | n.a | |
| micromanipulator | Sutter Instruments | MP-225 |
Ссылки
- Ooi, A., Wong, A., Esau, L., Lemtiri-Chlieh, F., Gehring, C. A Guide to Transient Expression of Membrane Proteins in HEK-293 Cells for Functional Characterization. Frontiers in Physiology. 7, 300(2016).
- Thomas, P., Smart, T. G. HEK293 cell line: A vehicle for the expression of recombinant proteins. Journal of Pharmacological and Toxicological Methods. 51 (3), 187-200 (2005).
- Xu, X., Nagarajan, H., et al. The genomic sequence of the Chinese hamster ovary (CHO)-K1 cell line. Nature Biotechnology. 29 (8), 735-741 (2011).
- Hazan, A., Kumar, R., Matzner, H., Priel, A. The pain receptor TRPV1 displays agonist-dependent activation stoichiometry. Scientific reports. 5, 12278(2015).
- Kumar, R., Hazan, A., Basu, A., Zalcman, N., Matzner, H., Priel, A. Tyrosine Residue in the TRPV1 Vanilloid Binding Pocket Regulates Deactivation Kinetics. Journal of Biological Chemistry. 291 (26), 13855-13863 (2016).
- Kim, T. K., Eberwine, J. H. Mammalian cell transfection: the present and the future. Analytical and bioanalytical chemistry. 397 (8), 3173-3178 (2010).
- Preuss, A. K., Connor, J. A., Vogel, H. Transient transfection induces different intracellular calcium signaling in CHO K1 versus HEK 293 cells. Cytotechnology. 33 (1-3), 139-145 (2000).
- Dalton, A. C., Barton, W. A. Over-expression of secreted proteins from mammalian cell lines. Protein Science. 23 (5), 517-525 (2014).
- Lee, P. Y., Costumbrado, J., Hsu, C. -Y., Kim, Y. H. Agarose gel electrophoresis for the separation of DNA fragments. J Vis Exp. (62), e3923(2012).
- Bohlen, C. J., Priel, A., Zhou, S., King, D., Siemens, J., Julius, D. A bivalent tarantula toxin activates the capsaicin receptor, TRPV1, by targeting the outer pore domain. Cell. 141 (5), 834-845 (2010).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflügers Archiv European journal of physiology. 391 (2), 85-100 (1981).
- Jones, J., Nivitchanyong, T., et al. Optimization of tetracycline-responsive recombinant protein production and effect on cell growth and ER stress in mammalian cells. Biotechnology and Bioengineering. 91 (6), 722-732 (2005).
- Raphemot, R., Weaver, C. D., Denton, J. S. High-throughput screening for small-molecule modulators of inward rectifier potassium channels. J Vis Exp. (71), e4209(2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены