Method Article
Contrôlable Expression Ion canal par transfection transitoire inductible
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Étudier les canaux ioniques à travers un système exprimant de manière hétérologue est devenue une technique de base dans la recherche biomédicale. Dans ce manuscrit, nous présentons une méthode efficace de temps pour obtenir l'expression du canal ionique étroitement contrôlé en effectuant une transfection transitoire sous le contrôle d'un promoteur inductible.
Résumé
La transfection, la délivrance d'acides nucléiques étrangers dans une cellule, est un puissant outil pour la recherche de protéines. Grâce à cette méthode, les canaux ioniques peuvent être étudiés par analyse électrophysiologique, la caractérisation biochimique, des études mutationnelles et leurs effets sur les processus cellulaires. Des transfections transitoires proposent un protocole simple dans lequel la protéine est disponible pour l'analyse au bout de quelques heures à quelques jours. Bien que cette méthode présente un protocole efficace relativement simple et le temps, l'un des éléments essentiels est l'étalonnage de l'expression du gène d'intérêt à des niveaux pertinents physiologiques ou des niveaux qui sont adaptés à l'analyse. A cet effet, de nombreuses approches différentes qui offrent la possibilité de contrôler l'expression du gène d'intérêt sont apparus. Plusieurs protocoles de transfection de cellules stables constituent un moyen d'introduire de façon permanente un gène d'intérêt dans le génome cellulaire sous la régulation d'une transcriptase tétracycline contrôléeactivation tional. Bien que cette technique produit des niveaux d'expression fiables, chaque gène d'intérêt nécessite quelques semaines de travail qualifié y compris l'étalonnage d'une courbe de mise à mort, la sélection des colonies de cellules, et dans l'ensemble plus de ressources. Ici, nous présentons un protocole utilisant une transfection transitoire de l'élément de potentiel sous-famille V du canal de cation 1 (TRPV1), le gène transitoire de récepteur dans un système inductible comme un moyen efficace pour exprimer une protéine de manière contrôlée ce qui est essentiel dans l'analyse du canal ionique. Nous démontrons que l'utilisation de cette technique, nous sommes en mesure d'effectuer l'imagerie calcique, cellules entières, et l'analyse de canal unique avec des niveaux de canaux contrôlés requis pour chaque type de collecte de données avec une seule transfection. Dans l'ensemble, cela fournit une technique réplicable qui peut être utilisée pour étudier les canaux ioniques structure et fonction.
Introduction
Systèmes exprimant hétérologue est l' une des techniques les plus couramment utilisées pour étudier une multitude de fonctions cellulaires 1. Leur faible profil endogène des protéines, un minimum d'entretien, la croissance fiable, et la capacité de prendre et d' exprimer l' ADN étranger ont fait des lignées cellulaires telles que rein embryonnaire humain (HEK293) et ovaire de hamster chinois (CHO) presque indispensable à la recherche biologique 2, 3. Les domaines de recherche en utilisant des systèmes hétérologues comprennent des protéines membranaires, la signalisation intracellulaire, et l'activité enzymatique. Après la transfection d'ADN étranger dans la cellule, de nombreuses formes différentes d'analyse peuvent être effectués, y compris l' électrophysiologie, l' imagerie calcique ratiométrique, western blot, etc. 4, 5.
En raison de la vaste gamme d'applications potentielles pour les systèmes d'expression hétérologues, beaucoup différedes réactifs et des produits nt ont été développés pour utiliser ces cellules et leurs qualités 6. systèmes de délivrance d'ADN qui transitoirement ou définitivement intégrer l'ADN étranger dans des cellules pour étudier la protéine exogène est devenu l'un des outils les plus populaires et utiles pour la recherche biologique. Plus précisément, la transfection transitoire d'ADN dans une cellule est largement utilisé comme un processus simple et directe qui nécessite relativement peu de temps et de matériaux. En outre, le taux de succès des cellules qui subissent une transfection 7 est élevée. Cette technique est très fiable lorsqu'elle est associée à un gène marqueur tel que la protéine fluorescente verte (GFP), et peut être utilisé pour de nombreuses techniques différentes telles que l' imagerie du calcium et 5 électrophysiologie. Malheureusement, cependant, exprimant de manière transitoire l'ADN dans des cellules hôtes est livré avec quelques écueils majeurs, pas le moins que le niveau d'expression par cellule est peu fiable. Le nombre de copies d'ADN de plasmide prise up par cellule est incontrôlable, donc l'expression entre les expériences individuelles peut varier considérablement 2. Cette question devient importante lorsque l'essayer de reproduire les conditions physiologiques, ou d'effectuer des techniques de collecte de données précises.
En tant que solution aux complications mentionnées ci-dessus, des protocoles de transfection stables ont été conçues dans lesquelles un gène d'intérêt peut être inséré dans le génome d'une cellule sous le contrôle étroit d'un promoteur inductible, tel qu'un système de tetracycline répresseur de l'expression, assurant une seule copie du plasmide intègre dans le génome de chaque cellule et est exprimé uniquement après l'induction du mécanisme de transcription, par exemple, en présence de doxycycline. Bien que cela résout les obstacles de niveaux d'expression de protéines incompatibles, cette méthode perd la commodité du protocole rapide et relativement simple de transfections transitoires. L'établissement d'une lignée cellulaire stable prend au moins quelques semaines à which on doit étalonner une courbe de mise à mort fixé par des antibiotiques spécifiques pour maintenir l'expression de protéines et d'assurer l'intégration du vecteur et habilement sélectionner et cultiver des colonies de cellules. Dans l' ensemble cela prend beaucoup plus de temps et d' effort avec un taux de réussite inférieur 8.
Ici, nous présentons un protocole intermédiaire qui appuie sur les points forts des deux options de transfection populaires pour fournir un moyen simple et efficace pour contrôler les niveaux d'expression dans toute lignée cellulaire inductible. Tout en conservant les cellules avec un système Tet inductible, nous transfecter transitoirement notre gène d'intérêt, le récepteur transitoire canal cationique sous-famille V membre potentiel 1 (TRPV1), ligaturé dans un vecteur qui peut se combiner avec l'homologue système répresseur. De cette manière, le gène peut être introduit dans les cellules sans commencer à exprimer. Seulement avec l'ajout de doxycycline ne le gène commence à exprimer, ce qui nous permet d'étalonner les niveaux de protéines expression selon la technique ou à des niveaux observés dans des conditions physiologiques. Notre protocole permet également d'éviter de longues complications associées à la génération d'une lignée cellulaire exprimant de manière stable. Nous commençons par montrer l'évolution des niveaux d'activation de TRPV1 en imagerie de calcium à travers quatre heures d'induction et comment la hausse des taux de calcium intracellulaire est corrélée induite non. Nous avons ensuite dupliquer le protocole dans la configuration cellule entière de la technique du patch clamp, montrant le courant augmente avec le temps de l'induction de plus en plus. Enfin, nous présentons des exemples d'enregistrements individuels d'électrophysiologie de canal, et de montrer que cette technique est particulièrement utile pour l'expression contrôlée lors de la recherche pour la collecte de données précises sur la base de différentes unités de la protéine. Grâce à notre protocole, nous offrons un moyen pratique pour contrôler l'expression des protéines dans des systèmes hétérologues, tout en évitant de longues complications de culture cellulaire, fournissant ainsi un moyen de contrôler les conditions entre les expériences et fournir des more des résultats reproductibles.
Protocole
1. ligaturer le gène d'intérêt dans le site répressible de Vector
- Obtenir un vecteur inductible tel que pcDNA5 / FRT / TO ou pcDNA4 / TO.
- Analyser le gène d'intérêt pour tous les sites de restriction potentiellement sensibles dans le milieu du gène qui sont également dans le site de clonage multiple du vecteur choisi par un logiciel d'analyse d'ADN silico 4.
- Des techniques utilisant de chevauchement PCR standard 4, flanquent le gène d'intérêt avec les deux sites de reconnaissance d'enzymes de restriction choisies (qui ne figurent pas dans le gène d'intérêt), le premier inséré avant le codon d'initiation, et la seconde après le codon d'arrêt.
- Digest à la fois le vecteur et l'insert avec des enzymes de restriction (choisis à l'étape 1.2), à la température de travail d'enzymes pendant une heure, suivi par l'addition d'une unité d'intestin de veau phosphatase (CIP) à la réaction de vecteur seul pendant 30 minutes, afin d'éviter l'auto- ligature.
- Charger l'ADN digéré sur un gel d'agarose à 1% et on sépare les segments clivés par électrophorèse 9.
- Utilisation de la lumière UV, avec une lame les morceaux de gel contenant les segments souhaités de vecteur et d'insérer à ligaturer.
- Extraire les segments d'ADN à partir des morceaux de gel d'agarose (en utilisant les kits d'extraction d'ADN commerciales) et de mesurer leur concentration finale par spectrophotomètre à 260 nm.
- Ligaturer le gène d'intérêt dans le vecteur sélectionné en utilisant la ligase T4 inductible enzyme à la température ambiante pendant 20 minutes. Afin d'augmenter la probabilité de l'insert ligaturant avec le vecteur, utilisez un rapport de 3: 1 molaire de l'insert: vecteur. Pour le contrôle, préparer une réaction de ligature qui ne comprend que le vecteur.
- Pour la transformation bactérienne, ajouter 10 ng de vecteur seul et vecteur + gène dans 50 ul compétentes E. coli. Incuber le tube sur la glace pendant 30 minutes, puis 45 secondes d'incubation à 42 ° C. Immédiatement placer dossur de la glace pendant deux minutes et transférer les bactéries transformées à 500 ul de milieu LB. Incuber pendant une heure à 37 ° C sous agitation à 220 tours par minute.
- Pour la sélection des bactéries transformées avec succès, la plaque 100 pl de chaque réaction (comme décrit au point 1.9) sur une plaque de gélose LB préparée contenant l'antibiotique approprié (par exemple, 100 pg / ml d' ampicilline pour l'utilisation pcDNA4 / TR).
- Laisser croître une nuit à 37 ° C. Les plaques peuvent être conservées à 4 ° C pendant jusqu'à deux semaines par bien les envelopper dans un film de paraffine plastique.
- Soulever colonies individuelles en utilisant une pointe de 10 pi, et laisser croître pendant une nuit dans 3 ml LB + de milieu antibiotique à 37 ° C sous agitation à 220 tours par minute. Les bactéries avec de l'ADN d'intérêt peuvent être congelés (-20 ° C) pour le stockage à court terme par centrifugation de la LB et les bactéries à 11.000 xg et aspirer le surnageant. Le stockage à long terme, il faut geler les bactéries que les stocks de glycérol à -80 ° C.
- Extraire l'ADN through mini-prep et mesurer la concentration finale par spectrophotomètre à 260 nm 5.
- Confirmer l' insertion réussie du gène d'intérêt par séquençage de la construction purifiée 4. En variante, la digestion de diagnostic de la construction par des enzymes de restriction par électrophorèse pour séparer les segments de découpe et d' évaluer la présence et la longueur peut également être utilisé à cette fin 4.
2. Lignes de culture de cellules exprimant TetR
- Obtenir une ligne de culture de cellules hébergeant un plasmide Tet répresseur incorporé dans leur ADN génomique. Ici, le protocole sera écrit en utilisant des cellules de rein embryonnaires humaines 293T (cellules HEK-293T) hébergeant pcDNA6 / TR plasmide à titre d'exemple.
- cellules de semences de 100 mm plaque de culture de tissu avec Eagles modifié de Dulbecco (DMEM) additionné de 10% de FBS, 1% de pénicilline-streptomycine, 2 mM de L-glutamine et 25 mM de HEPES, pH 7,3 (ci-après: DMEM complet) et incuber O / N à 37 &# 176; C et 5% de CO 2. Tous les travaux avec des cellules doit être fait dans une hotte biologique dans des conditions stériles.
- Afin de maintenir l'expression du gène répresseur Tet, aspirer le milieu et le remplacer par du DMEM complet additionné de 5 pg / ml de blasticidine. Incuber les cellules à 37 ° C et 5% de CO 2.
- Une fois que les cellules atteignent 80-90% de confluence, aspirer le milieu et laver délicatement les cellules deux fois avec DPBS (sans calcium et magnésium) chauffé à 37 ° C.
- Afin de soulever délicatement les cellules sans causer de dommages mécaniques, incuber la culture dans DMEM contenant 0,05% de trypsine chauffé à 37 ° C pendant 1,5 min.
- Bloquer l'action de la trypsine avec un volume égal de Full DMEM. pipette doucement vers le haut et vers le bas afin de soulever les cellules et de les transférer dans un tube stérile.
- Centrifuger les cellules à 200 xg pendant 5 min.
- Aspirer le surnageant et le remplacer par 1 mL complet DMEM. Pipeter la solution avec les cellules vers le haut et vers le bas jusqu'à ce qu'il n'yamas cellulaires peuvent être vus. Compter et calculer le nombre de cellules en utilisant un hémocytomètre.
- Semences 1 - 2 x 10 6 cellules à 100 mm boîte de culture de tissu contenant 12 ml de DMEM complet avec 5 ug / ml de blasticidine. Diviser les cellules deux fois par semaine comme ils atteignent 90% de confluence.
3. transfectant le plasmide d'intérêt dans les cellules
- En utilisant le même procédé de fractionnement de cellules , comme décrit ci - dessus, les cellules de transfert à des puits dans une plaque à 12 puits préparée avec 0,9 ml complet DMEM suffisante pour faire 50% de confluence (~ 200.000 cellules) et incuber une nuit à 37 ° C dans un CO 2 incubateur.
- Préparer un mélange de transfection avec pcDNA4 / TO contenant le gène d'intérêt, un plasmide inerte pour amener la quantité totale d'ADN à 1 pg (si nécessaire), 3 pi de réactif de transfection lipidique et DMEM pour rendre le volume final de 100 pi. La quantité optimale d'ADN de plasmide à utiliser varie largement différentes protéines expriment l'efficacité différente. Pour élusrophysiological expériences comprennent l' EGFP dans le plasmide d'expression mammalien dans le cocktail de transfection afin de visualiser les cellules qui subissent avec succès la transfection 4.
- Laisser incuber le mélange de transfection à la température ambiante pendant 30 minutes.
- Transfecter des cellules par pipetage le mélange de transfection goutte à goutte sur les cellules ensemencées dans la plaque 12 puits et la plaque de roche vigoureusement pour assurer une dispersion homogène de l'ADN et un réactif de transfection. Les cellules doivent être ~ 80% de confluence au moment de la transfection.
- Incuber les cellules transfectées O / N à 37 ° C et 5% de CO 2.
- Confirmer que les cellules ont été transfectées avec succès, en observant le signal de fluorescence de l'EGFP sous la lampe UV, le lendemain matin, si l'exécution électrophysiologie.
4. Les cellules de placage sur Poly-D-Lysine (PDL) Lamelles / Wells
- Stériliser à 12 mm avec des lamelles en aspergeant une solution d'éthanol isopropylique à 70%. Sec et placer un seul coverslip dans chaque puits d'une plaque de 24 puits pour l'enregistrement électrophysiologique.
- Pipeter une solution de 0,1 à 0,2 mg / ml de solution PDL sur chaque lamelle couvre-objet ou bien d'une chambre d'imagerie du calcium.
- Laisser reposer pendant 30 min à 37 ° C dans un incubateur à CO 2 de 5%.
- Laver avec le grade de culture cellulaire de l'eau distillée deux fois (DDW) trois fois, entre l'aspiration à chaque lavage. Après le dernier lavage, sécher et laisser reposer à température ambiante.
- Pour électrophysiologie, remplir chaque puits contenant une lamelle revêtue PDL avec 500 ul pleine DMEM réchauffé à 37 ° C.
- Effectuez la même méthode de diviser les cellules transfectées comme décrit ci-dessus. Après remise en suspension des cellules après traitement à la trypsine et le blocage, le transfert de 80 ul de cellules (soit environ 30 000 cellules) au centre de chaque lamelle couvre-objet revêtues de PDL pour l'enregistrement électrophysiologique. Laisser les cellules sédimenter pendant au moins 1,5 heures ou incuber une nuit à 37 ° C dans un incubateur à CO 2 de 5%.
- Pour le transfert du calcium d'imagerie et place 20 pi de cellules (environ 20 000 cellules) au centre de chaque image de calcium revêtu PDL puits. Laisser les cellules sédimenter pendant au moins 30 minutes et ajouter 180 ul pleine DMEM à chaque puits.
5. Induire Expression génique
- Préparer une solution doxycycline stock de 1 mg / ml dans DDW selon les instructions du fabricant. Gardez solution stock protégé de la lumière à 4 ° C pendant 3 semaines. Pour le stockage à long terme tenir une solution de doxycycline à -20 ° C.
- Préparer un nouveau 2 pg / mL (électrophysiologie) ou / mL (imagerie de calcium) solution de doxycycline 3 pg en Full DMEM et chauffer à 37 ° C.
- Pour les enregistrements électrophysiologiques, la pipette 500 ul de 2 pg / ml de doxycycline solution à chaque puits pour obtenir une concentration finale de 1 pg / mL de doxycycline. Pour l'imagerie de calcium, ajouter 100 ul de 3 pg / ml de doxycycline solution de chaque puits pour effectuer une concentration finaletion de 1 pg / ml de doxycycline. Notez l'heure de l'induction.
- Incuber pendant la durée souhaitée pour l' induction à 37 ° C et 5% de CO 2.
6. Calibrage Chronologie de l'expression des protéines
- Calibrage expression de protéines par Imagerie calcique 5, 10
- Préparer une solution de Ringer (NaCl 140 mM, 2,5 mM de KCl, 1,8 mM de CaCl2, 2 mM MgSO4, 20 mM HEPES, pH ajusté à 7,4 avec du NaOH) et chauffer à 37 ° C.
- Préparer des concentrations saturantes d'agoniste des canaux dans une solution de Ringer. Parce que la quantité d'agoniste est dilué quand il est ajouté à la chambre d'imagerie de calcium contenant les cellules et la solution extracellulaire, soit deux fois la quantité de la concentration finale souhaitée de l'agoniste. Cela rend également la quantité de solution de bain dans chaque puits critique à contrôler.
- Préparer une solution non ionique F-127 20% P / V in DMSO. Chauffer la solution à 40 ° C jusqu'à ce que la non-ionique F-127 est dissous. Conserver la solution non-ionique F-127 à TA et chauffer à 40 ° C avant utilisation. -Actif non ionique F-127 est utilisé pour aider à disperser acétoxyméthyle (AM) des esters d'indicateurs d'ions fluorescents tels que Fura-2 dans des solutions aqueuses.
- milieu de Aspirer et de le remplacer par une solution Fura-2 heures de chargement (la solution de Ringer complété avec 2 - 3 uM Fura-2 heures, 0,02 mg / ml non ionique F-127 et 10 mM D-glucose).
- Incuber pendant 60 min à température ambiante dans l'obscurité.
- Aspirer Fura-2AM solution et laver les cellules avec + 10 mM D-glucose de la solution de Ringer pour éliminer le colorant extracellulaire. Répéter deux fois cette étape.
- Laissez + 10 mM D-glucose de la solution de 200 ul Ringer dans chaque puits et incuber pendant 30 min à température ambiante dans l'obscurité.
- Placer la chambre sur scène au-dessus du nez pièce de microscope et le fixer avec support.
- Allumez la lampe, caméra et microscope et sélectionnez Fura-2 filtre pour détecter l'émission à 510 nm wavelength.
- Réglez le grossissement souhaité et concentrer les cellules dans le champ sélectionné.
- Dans l'obscurité, la lumière et soustraire fond régler le temps d'exposition.
- image Réglez l'échantillonnage au taux et enregistrer la fluorescence réponse souhaitée de Fura-2 cellules chargées en les excitant à 340 et 380 nm longueurs d'onde. Le rapport des signaux 340/380 est un indicateur de la concentration intracellulaire de Ca2 + et donc également une activité TRPV1.
- Ajouter 2 uM de capsaïcine dans une solution de 200 ul Ringer par pipetage pour créer une concentration saturante finale de 1 uM de capsaïcine afin d'évaluer le niveau de TRPV1 d'expression.
- Analyser la réponse TRPV1 en fonction du temps d'induction et de déterminer le protocole pour la protéine d'intérêt.
- Ajuster l' expression de protéines hétérologues dans des systèmes utilisant la configuration de cellule entière de la technique patch-clamp 4, 11.
- Préparer til baignent solution de (mM) 140 NaCl, 2,3 KCl, 2 MgSO 4, 5 HEPES et 5 l' acide 2- (N-morpholino) éthanesulfonique (MES), ajusté à pH 7,4 avec NaOH.
- Préparer des concentrations saturantes de canal agoniste en solution extracellulaire.
- Tirez des électrodes de verre avec un diamètre intérieur (ID) de 1,10 mm et le feu-polish à une résistance de 2-4 MQ.
- Préparer une solution de pipette (mM) 130 KCl, NaCl 4, 2 MgSO4, 0,5 CaCl2, 1 EGTA et 10 HEPES ajusté à pH 7,2 avec du KOH. Filtrer la solution de la pipette avant utilisation. Avant chaque expérience, un seul, pipette en verre poli au feu est de retour rempli en immergeant la pointe dans la solution de la pipette pendant au moins une minute, puis rempli en utilisant la pointe fondue et étirée avec une seringue remplie de la même solution de pipette.
- Soulevez doucement une seule lamelle revêtue PDL avec les cellules étalées du puits à un plat en plastique de Pétri de 35 mm rempli d'environ 2 ml solution de bain à la température ambiante. Observer sous un epi microscope fluorescent.
- Localiser une cellule positif EGFP, comme visualisés au microscope à épifluorescence, sur la lamelle préparée et se déplacer vers le centre du champ visualisé.
- Attacher la pipette remplie au support de pipette du micromanipulateur et injecter une petite quantité de pression positive dans le système afin d'éviter la contamination de la solution de la pipette intracellulaire. Abaisser à juste au-dessus de la GFP - cellulaire positive, la vérification de la résistance appropriée.
- Comme la pipette touche la cellule, appliquez une petite quantité de pression négative afin de créer un joint entre la GQ pipette en verre et la membrane cellulaire.
- Avec une impulsion courte, forte d'aspiration, briser la membrane cellulaire, permettant à la pipette pour entrer en contact avec le contenu intracellulaire de la cellule.
- Changez le mode de l'amplificateur à cellules entières, et abaisser le filtre et le gain de sortie Bessel 1 - 5 kHz et 0.5α, respectivement.
- Notez la réponse actuelle à l'saturanteconcentrations de canal agoniste en utilisant des rampes de tension ou de protocole sans écart.
- Parce que l'efficacité d'expression changent entre les différentes protéines, répéter les enregistrements en utilisant différents temps de longueur d'induction.
- Détermination du temps d'induction idéal pour les enregistrements à canal unique 4.
- Préparer une solution de (mM) 150 Na-gluconate, le 15 NaCl, 5 EGTA et 10 HEPES, pH ajusté à 7,4 avec NaOH, une solution de la pipette. Pour la solution de bain, utiliser la solution de l'étape 6.2.1.
- Répétez la procédure de cellules entières en utilisant ID 0,86 mm pipettes en verre poli feu à une résistance de 10-12 MQ et définir le potentiel de maintien de -40 mV.
- Créer un joint d'étanchéité sur la membrane comme décrit précédemment et la rupture de la membrane.
- Utilisation du micromanipulateur, soulevez la pipette avec le patch de membrane loin de la cellule.
- Positionner le système de perfusion directement à côté de la pipette contenant la pièce de membrane.
- Basse-til Bessel gain de filtre et de sortie à 2 - 5 kHz et 10α, respectivement.
- Perfuser des concentrations saturantes d'agoniste sur la pièce de membrane, en évaluant si le patch contient un ou plusieurs canaux en fonction de la réponse.
- Analyser le nombre de correctifs de canal unique enregistré avec succès contre le temps d'induction appliquée aux cellules. Ajuster le temps d'induction en fonction des résultats souhaités.
Résultats
Pour créer rapidement un modèle d'expression inductible, nous avons utilisé des cellules HEK293 qui expriment la protéine tétracycline répresseur (TR) (par exemple, T-REx-293) et des vecteurs qui contiennent des séquences d'opérateur de tétracycline (TetO) entre le promoteur CMV et le site de clonage multiple (par exemple, pcDNA4 / TO). Lorsqu'il est transfecté dans des cellules 293-trex, l'expression du gène d'intérêt dans pcDNA4 / TO est réprimée, TR se lie à TetO. L'addition de doxycycline au milieu empêche l'interaction TR TetO, permettant ainsi l'expression de la protéine transfectée. Pour contrôler l'expression de rat TRPV1 (rTRPV1) nous avons inséré le gène de ce canal dans un pcDNA4 / TO vecteur en utilisant le protocole décrit ci-dessus. Ensuite, T-REx-293 cellules ont été transfectées avec le rTRPV1- pcDNA4 / TO plasmide selon les étapes au point 3 du protocole. Après la transfection, l'expression rTRPV1 a été induite par incubation des cellules en présence de doxycycline (1 μg / ml) pendant 1-4 heures. Surtout, différentes concentrations de doxycycline peuvent être utilisés pour atteindre le taux d'expression souhaité. Nous avons utilisé des méthodes d'imagerie électrophysiologiques et de calcium pour évaluer rTRPV1 niveau d'expression à chaque point de temps en appliquant son agoniste, la capsaïcine. Comme on le voit sur la figure 1, en utilisant l' imagerie calcique des cellules vivantes, le taux de calcium intracellulaire après l' application de la capsaicine est augmentée graduellement avec de plus longs temps d'induction. L'activation des cellules non induites peut être attribuable à une fuite de base de l'activité de RT, la surexpression du plasmide, ou à la tetracycline résiduel dans les cellules des composants multimédias. Ensuite, nous avons enregistré des courants à partir de cellules en utilisant la configuration de cellule entière de la technique du patch clamp appliquant des rampes de tension entre -80 mV à +80 mV. La figure 2 montre que les amplitudes de courant élevées sont obtenues avec de plus longs temps d'induction. La saturation de l'amplitude de courant à 4 h d'induction est Consistent à la saturation vu dans la réponse au calcium (figure 1). Enfin, nous avons analysé les niveaux d'expression rTRPV1 dans la configuration de sortie à l'extérieur de la technique de patch-clamp. L'une des difficultés majeures dans l'étude de canal ionique structure-fonction est d'atteindre des niveaux appropriés pour l'analyse à canal unique expression. En fonction de la conductance unitaire rTRPV1 publié 4, l'amplitude du courant nominal est utilisé pour déterminer le nombre de canaux dans le patch excisé. Comme on le voit sur la figure 3, le nombre de canaux dans le patch augmente proportionnellement au temps d'incubation de la doxycycline. Après une heure d'induction, nous ne sommes pas en mesure de détecter toute activité de canal (0 sur 8). Cependant, dans les deux points dans le temps de deux ou trois heures, nous avons enregistré une activité de canal unique dans les taux de succès similaires. Il faut noter que tandis que dans les deux heures la plupart des taches ne répondent pas, en trois heures, la plupart des patchs ont montré unique à multi-activité -channel. Les chances de l'enregistrement de plusieurs canaux, après trois heures d'induction est élevé, donc le temps d'induction optimale pour enregistrer le courant d'une seule voie est de deux à trois heures dans les conditions présentées. Ensemble, ces résultats démontrent que l'expression de canaux ioniques peut être étroitement contrôlée et régulée après transfection transitoire en utilisant ce protocole.

Figure 1. Réponse des augmentations d'activation TRPV1 selon Induction Time, comme visualisés par Imagerie calcique. (A) images pseudo-couleur de T-REx-293 cellules exprimant transitoirement rTRPV1, avant ( «Basal») et après capsaïcine (2 uM) application. Les barres blanches représentent 30 um. La barre d'échelle indique les niveaux de calcium intracellulaire. (B) change avec le temps des taux de calcium intracellulaire dans transfectées T-rex-293 cellules traitées comme indiquéen A. Chaque graphique représente une moyenne de 50 cellules sensibles à la capsaïcine. Notez les pas à pas l'augmentation des réponses de la capsaïcine en fonction du temps d'induction. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
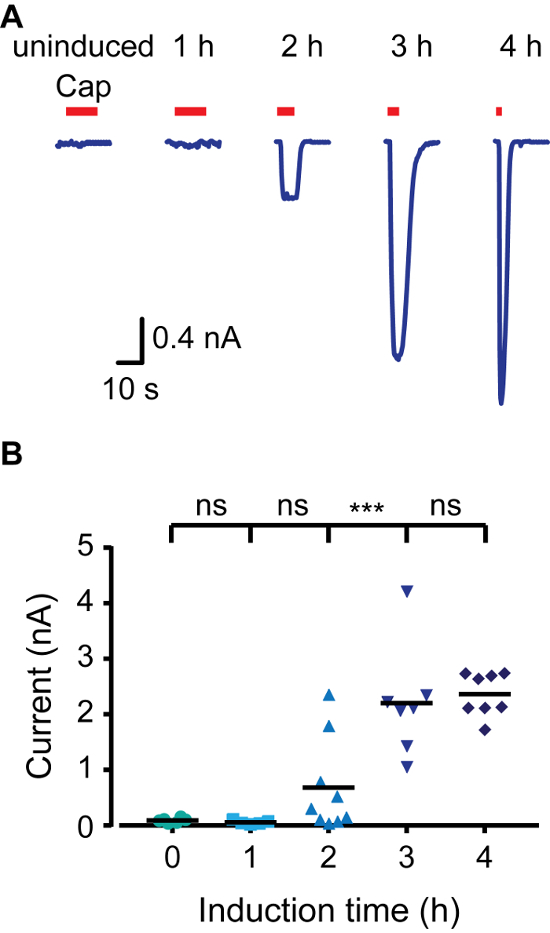
Figure 2. TRPV1 de courant augmente en tant que résultat de l' augmentation Induction Temps cellule entière patch clamp Recordings. (A) des enregistrements de cellules entières de T-REx-293 transitoirement transfectées avec rTRPV1 à un potentiel de maintien de -40 mV. Les cellules ont été induites avec la doxycycline (1 pg / ml) pendant le temps indiqué, puis exposé à la capsaïcine ( 'Cap'; barre rouge; 1 uM). Montré est une trace représentative de 6 - 11 enregistrements indépendants. (B) Moyenne / nuage de points-point représentant l'amplitude de cellule entière évoquée comme indiqué dans A. La statistiqueal signification entre les groupes a été déterminée par analyse de variance avec des comparaisons multiples, où p représente *** ≤0.001 et NS- pas statistiquement significatives (n = 6 - 11 cellules). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 3. Taux de réussite de Single Channel Patch en TRPV1 Recordings dépend Induction Time. (A) outside-out des enregistrements de T-REx-293 transitoirement transfectées avec rTRPV1 à un potentiel de maintien de +50 mV. Les cellules ont été induites avec de la doxycycline (1 ug / ml) pendant le temps indiqué et ont été exposés à la capsaïcine ( «cap»; barre rouge; 1 pM). Montré est une trace représentative de 6 - 9 enregistrements indépendants. (B) Moyenne / nuage de points-point représentant le nombre de canaux dans le patch excisée commemontré dans A. La signification statistique entre les groupes a été déterminée par analyse de variance avec des comparaisons multiples, où p représente *** ≤0.001 et NS- pas statistiquement significatives (n = 6 - 9 cellules). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
Transfection est un protocole largement utilisé pour l'expression des protéines et de la recherche, avec de nombreuses variantes différentes pour améliorer la cohérence et la stabilité expression. réactifs de transfection transitoire offrent un moyen simple, facile à utiliser le protocole où la cellule et la protéine d'intérêt peuvent être analysés dans les heures durant la nuit à partir du moment de la transfection. Malheureusement , cette approche peut être imprévisible lorsque le mode d'analyse requiert un niveau constant de l' expression des protéines, tels que les enregistrements de canal unique en électrophysiologie 2. Alternativement, les lignées cellulaires stables dans le système d'expression répressible tétracycline ont été développés pour offrir un moyen de contrôler le niveau de la protéine d'intérêt 12 d'expression. Cette approche permet l'expression cohérente de toutes les cellules dans une culture avec l'introduction d'un supplément de tétracycline dérivés, tels que la doxycycline. Bien que cela permet un contrôle constant et précis des teneurs en protéines, tIl temps et les efforts qui vont à l'établissement d' une lignée cellulaire stable, il est peu pratique et désavantageux lors de l' étude d' une grande variété de protéines 8.
Le protocole présenté ici offre une solution moyenne-of-the-route des protocoles de transfection actuellement offerts. Par transfecter transitoirement un gène sous un promoteur contrôlable dans les cellules possédant un répresseur Tet, nous pouvons obtenir une expression contrôlable tout en évitant des procédures longues et compliquées. Ici, nous avons utilisé le TRPV1 non sélectif canal cationique avec l'imagerie de calcium et de l'analyse de l'électrophysiologie. Nous avons constaté que le temps d'induction idéale pour l'expression contrôlée de cette protéine spécifique pour l' analyse d' un seul canal est comprise entre 2 à 3 heures d' incubation avec 1 ug / ml de doxycycline (figures 1 - 3). Sur une plus grande échelle, cette technique peut également être appliquée à toute protéine d'intérêt. Ce protocole offre également une solution pour contrôler l'expression quand un large gamme de protéines différentes ou des mutations dans des séquences protéiques sont d'intérêt et en créant une lignée cellulaire stable pour chaque variante est peu pratique. Il est important, alors que les résultats représentent ici le temps optimal et concentrations d' application pour l' expression de TRPV1, chaque gène a sa personne et à la traduction et à la traite rythme spécifique, ainsi les heures d'étalonnage et d' expression de chaque protéine diffèrent grandement 13.
Bien que cette technique offre une solution pratique pour l'expression contrôlée, il ne va pas sans limitations. Seulement des lignées cellulaires commercialement disponibles hébergeant le système Tet peuvent être utilisés avec ce système, ce qui pose un problème si ces lignées cellulaires particulières ne sont pas appropriées pour le type d'analyse qui doit être réalisée. Un autre piège par rapport aux lignées transfectées de façon stable est que toutes les cellules ne subissent pas la transfection, et par conséquent toutes les cellules expriment pas la protéine d'intérêt. Dans l'ensemble, nous offrons un moyen pratique pour contrôler la protéine expression dans un système hétérologue qui peut être appliquée à un large éventail de la recherche biomédicale.
Déclarations de divulgation
Les auteurs n'ont rien à dévoiler.
Remerciements
Ce travail a été soutenu par la Fondation Israël Sciences [Subventions 1721/12, 1368/12 et 1444/16] (AP). AP est affilié à Brettler Center et David R. Bloom Centre, Faculté de Pharmacie, Université hébraïque de Jérusalem.
matériels
| Name | Company | Catalog Number | Comments |
| pcDNA™4/TO Mammalian Expression Vector | ThermoScientific Fisher | V102020 | |
| pcDNA™5/TO Mammalian Expression Vector | ThermoScientific Fisher | V103320 | |
| PureLink Quick PCR Purification Kit | Invitrogen | K310001 | |
| Swift™ MaxPro Thermal Cycler | Esco | n.a | |
| Restriction Enzymes | ThermoScientific Fisher | ER0501 | |
| Agarose | Lonza | 50004 | |
| PureLink Quick Gel Extraction Kit | Invitrogen | K210012 | |
| NanoDrop 2000c | ThermoScientific Fisher | ND-2000C | |
| T4 DNA Ligase | ThermoScientific Fisher | EL0011 | |
| One Shot® TOP10 Chemically Competent E. coli | ThermoScientific Fisher | C404006 | |
| Ampicillin (Sodium), USP Grade | Gold Bio | A-301-5 | |
| Tryptone for microbiology | Merck | 6.19305E+13 | |
| Yeast Extract | BD worldwide | 212750 | |
| SIF6000R Incubated Shaker | LAB COMPANION | 45H118 | |
| NucleoSpin®plasmid | Macherey Nagel | 740588.25 | |
| MS 300V Power Supply | Major Science | MP-300V | |
| Owl™ EasyCast™ B1A Mini Gel Electrophoresis System | ThermoScientific Fisher | B1A | |
| T-REx™-293 cell line | Invitrogen | R710-07 | |
| DMEM (1x), liquid (high glucose) | Gibco | 41965-039 | |
| HindIII-HF® | NEB | R3104S | |
| ApaI | NEB | R0114S | |
| CutSmart® Buffer | NEB | B7204S | |
| pcDNA™6/TR Mammalian Expression Vector | ThermoScientific Fisher | V102520 | |
| Fetal Bovine Serum (FBS), qualified, E.U.-approved, South America origin | Gibco | 10270106 | |
| HEPES Buffer Solution (1 M) | Biological Industries | 03-025-1B | |
| Penicillin-Streptomycin Solution | Biological Industries | 03-031-1B | |
| L-Alanyl-L-Glutamine (Stable Glutamine) (200 mM) | Biological Industries | 03-022-1B | |
| Heracell™ 150i CO2 Incubator | ThermoScientific Fisher | 51026406 | |
| MSC-Advantage™ Class II Biological Safety Cabinet | ThermoScientific Fisher | 51025411 | |
| Blasticidine S hydrochloride | Sigma-Aldrich | 15205-25MG | |
| Dulbecco’s Phosphate-buffered Saline (DPBS) Modified, without calcium chloride and magnesium chloride | Sigma-Aldrich | D8537-500ML | |
| Trypsin-EDTA (0.05%), phenol red | Gibco | 25300054 | |
| Double Neubauer Ruled Metallized Hemacytometer | Hausser Scientific | 31000 | |
| Opti-MEM I Reduced Serum Medium | Gibco | 31985070 | |
| TransIT®-LT1 Transfection Reagent | Mirus | MIR 2300 | |
| glass coverslips, #1 thickness, 12 mm diameter round | Knittel Glass | GG-12 | |
| BioCoat™ Poly-D-Lysine (PDL) | Corning | 354210 | |
| Water, Cell Culture Grade | Biological Industries | 03-055-1A | |
| Doxycycline hyclate | Sigma-Aldrich | D9891-1G | |
| Fura-2, AM ester | Biotium | BTM-50034 | |
| Pluronic® F-127 | Sigma-Aldrich | P2443-250G | |
| µ-Slide 8 Well | ibidi | 80826 | |
| (E)-Capsaicin | Tocris | 462 | |
| Olympus IX70 Fluorescence Microscope | Olympus | n.a | |
| Lambda DG-4 Wavelength Switcher | Sutter Instruments | n.a | |
| EXi Blue Fluorescence Microscopy Camera | QImaging | n.a | |
| MetaFluor Fluorescence Ratio Imaging Software | Molecular Devices | n.a | |
| Thin Walled Borosilicate Tubing | Sutter Instruments | B150-110-7.5HP | |
| Standard Walled Borosilicate Tubing | Sutter Instruments | B150-86-7.5HP | |
| Dimethyl sulfoxide anhydrous | Sigma-Aldrich | 276855 | |
| P1000 micropipette puller | Sutter Instruments | P-1000 | |
| MF-900 Microforge | NARISHIGE | n.a | |
| ValveBank perfusion sysytem | AutoMate Scientific | ||
| Digidata® 1440A Low-noise Data Acquisition System | Molecular Devices | n.a | |
| Axopatch 200B Amplifier | Molecular Devices | n.a | |
| pCLAMP 10.6 Software | Molecular Devices | n.a | |
| micromanipulator | Sutter Instruments | MP-225 |
Références
- Ooi, A., Wong, A., Esau, L., Lemtiri-Chlieh, F., Gehring, C. A Guide to Transient Expression of Membrane Proteins in HEK-293 Cells for Functional Characterization. Frontiers in Physiology. 7, 300(2016).
- Thomas, P., Smart, T. G. HEK293 cell line: A vehicle for the expression of recombinant proteins. Journal of Pharmacological and Toxicological Methods. 51 (3), 187-200 (2005).
- Xu, X., Nagarajan, H., et al. The genomic sequence of the Chinese hamster ovary (CHO)-K1 cell line. Nature Biotechnology. 29 (8), 735-741 (2011).
- Hazan, A., Kumar, R., Matzner, H., Priel, A. The pain receptor TRPV1 displays agonist-dependent activation stoichiometry. Scientific reports. 5, 12278(2015).
- Kumar, R., Hazan, A., Basu, A., Zalcman, N., Matzner, H., Priel, A. Tyrosine Residue in the TRPV1 Vanilloid Binding Pocket Regulates Deactivation Kinetics. Journal of Biological Chemistry. 291 (26), 13855-13863 (2016).
- Kim, T. K., Eberwine, J. H. Mammalian cell transfection: the present and the future. Analytical and bioanalytical chemistry. 397 (8), 3173-3178 (2010).
- Preuss, A. K., Connor, J. A., Vogel, H. Transient transfection induces different intracellular calcium signaling in CHO K1 versus HEK 293 cells. Cytotechnology. 33 (1-3), 139-145 (2000).
- Dalton, A. C., Barton, W. A. Over-expression of secreted proteins from mammalian cell lines. Protein Science. 23 (5), 517-525 (2014).
- Lee, P. Y., Costumbrado, J., Hsu, C. -Y., Kim, Y. H. Agarose gel electrophoresis for the separation of DNA fragments. J Vis Exp. (62), e3923(2012).
- Bohlen, C. J., Priel, A., Zhou, S., King, D., Siemens, J., Julius, D. A bivalent tarantula toxin activates the capsaicin receptor, TRPV1, by targeting the outer pore domain. Cell. 141 (5), 834-845 (2010).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflügers Archiv European journal of physiology. 391 (2), 85-100 (1981).
- Jones, J., Nivitchanyong, T., et al. Optimization of tetracycline-responsive recombinant protein production and effect on cell growth and ER stress in mammalian cells. Biotechnology and Bioengineering. 91 (6), 722-732 (2005).
- Raphemot, R., Weaver, C. D., Denton, J. S. High-throughput screening for small-molecule modulators of inward rectifier potassium channels. J Vis Exp. (71), e4209(2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon