Method Article
Recording Hücre içi Gerilim Yanıtları için Elektrofizyolojik Yöntem
Bu Makalede
Özet
Sharp microelectrodes enable accurate electrophysiological characterization of photoreceptor and visual interneuron output in living Drosophila. Here we show how to use this method to record high-quality voltage responses of individual cells to controlled light stimulation. This method is ideal for studying neural information processing in insect compound eyes.
Özet
Voltage responses of insect photoreceptors and visual interneurons can be accurately recorded with conventional sharp microelectrodes. The method described here enables the investigator to measure long-lasting (from minutes to hours) high-quality intracellular responses from single Drosophila R1-R6 photoreceptors and Large Monopolar Cells (LMCs) to light stimuli. Because the recording system has low noise, it can be used to study variability among individual cells in the fly eye, and how their outputs reflect the physical properties of the visual environment. We outline all key steps in performing this technique. The basic steps in constructing an appropriate electrophysiology set-up for recording, such as design and selection of the experimental equipment are described. We also explain how to prepare for recording by making appropriate (sharp) recording and (blunt) reference electrodes. Details are given on how to fix an intact fly in a bespoke fly-holder, prepare a small window in its eye and insert a recording electrode through this hole with minimal damage. We explain how to localize the center of a cell's receptive field, dark- or light-adapt the studied cell, and to record its voltage responses to dynamic light stimuli. Finally, we describe the criteria for stable normal recordings, show characteristic high-quality voltage responses of individual cells to different light stimuli, and briefly define how to quantify their signaling performance. Many aspects of the method are technically challenging and require practice and patience to master. But once learned and optimized for the investigator's experimental objectives, it grants outstanding in vivo neurophysiological data.
Giriş
Meyve sineği (Drosophila melanogaster) bileşik göz sinir görüntü örnekleme ve işleme için fotoreseptör ve interneuron dizilerin fonksiyonel organizasyonunu araştırmak için büyük bir model sistem ve hayvan vizyonu için. Sistem en eksiksiz bağlantı şemasını 1,2 sahiptir ve genetik manipülasyonlar ve 3-10 (yüksek sinyal-gürültü oranı ve zaman çözünürlük) doğru sinirsel aktivite izleme sevimli.
Drosophila gözü hep birlikte başının etrafında hemen hemen her yönünü kapsayan panoramik görüş alanını uçmak sağlayan ommatidia denilen ~ 750 görünüşte normal lens kapaklı yapılar içeren, modüler olduğunu. Birimler kendi rhabdomeric fotoreseptör 7,8,11 olan örnekleme gözün birincil bilgi. Her ommatidium aynı faset lens paylaşırlar, fakat yedi farklı yönlere hizalanır sekiz fotoreseptör hücreleri (R1-R8) içerir. Dış fotoreseptörlerin R1-R6, ar ikene mavi-yeşil ışığa en duyarlı, aynı yönde birbirlerini ve nokta üstünde yalan, iç hücrelerin R7 ve R8, spektral duyarlılık, sergi üç ayrı alt tipi: soluk sarı ve dorsal rim alanı (DRA) 12- 15.
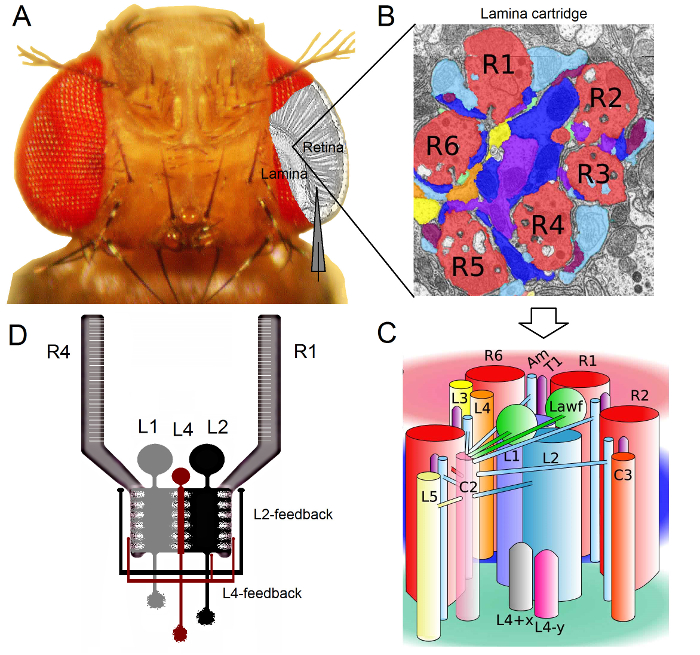
Şekil 1. Drosophila Eye Fonksiyonel organizasyonu. (A) ilk iki optik ganglionlar, retina ve lamina, sinek gözün içine gri vurgulanır. Retina R1-R6 fotoreseptör ve lamina Büyük Monopolar Hücreleri (LMCs: L1-L3) geleneksel keskin mikroelektrot kayıtlarına in vivo kolayca erişilebilir. şematik elektrot retinada R1-R6 kayıt normal yolu vurgulamaktadır. lamina içinde LMCs kayıt için bir yol sola paralel elektrot kaydırmaya olduğunu. (B) tabakanın retinotopically organının bir matristirGörsel alan belirli bir küçük bir alanda bilgi işleme nöronlarla paketlendi her biri özelleşmiş kartuşları. Nöral süperpozisyon nedeniyle, farklı komşu ommatidia altı fotoreseptör L1-L3 ve amacrine hücresi (Am) için histaminerjik çıkış sinaps oluşturarak, aynı lamina kartuşun kendi aksonlar (R1-R6) gönderin. (C) R1-R6 akson terminalleri ve lamina kartuş karmaşık iç, (L4, L5, Lawf, C2, C3 ve T1 dahil) görsel internöronlar arasındaki nöral bilgilerin yayılması. (D) R1-R6 fotoreseptör aksonları L2 ve L4 monopolar hücrelerden sinaptik geri dönüşler alıyorsunuz. Rivera-alba ark 2 değiştirilmiş (B) ve (C). Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Drosophila göz sinir süperpozisyon tip 16 olduğunu. Bu t anlamına gelirlamina ve medulla: şapka uzayda aynı noktada bakmak ommatidia komşu yedi ait sekiz fotoreseptör, nöral sinyaller, önümüzdeki iki neuropils tek sinir kartuşun birlikte bir araya getirilmiştir. Altı dış fotoreseptör lamina sinir sütunlara akson terminalleri R1-R6 projesi (Şekil 1), R7 ve R8 hücreleri bu katman atlamak ve onların medulla sütunu 17-19 karşılık gelen sinaptik temas yaparken. Bu tam kablo bağlantıları her lamina (Şekil 1A-C) bunun üzerine, sinek erken görme retinotopic haritalama için nöral substratı üreten ve medulla kolon (kartuş) uzayda tek bir noktayı temsil etmektedir.
Lamina 1,2,20 ve amacrine Celi (AM) R1-R6, fotoreseptör direkt giriş büyük monopolar uydulara (L1, L2 ve L3 LMCs) tarafından alınır. Bunların dışında, L1 ve L2 önemli bilgi yolları (Şekil 1D) aracılık büyük hücreler, WHI vardırch yanıt içi ve kenarları Off-hareket ve böylece hareket dedektörü 21,22 hesaplama temelini oluşturur. L2 hücreleri 23,24 L1 'de-ön arka-ön-arkaya: Davranışsal deneyler orta aksine de, iki yol zıt yönlerde hareket algısını kolaylaştırmak olduğunu göstermektedir. Bağlantı ayrıca L4 nöronlar komşu kartuşları 25,26 arasında yanal iletişimde kritik bir rol oynayabileceğini ima eder. Karşılıklı sinaps L2 ve L4, aynı yer alan hücreler ve iki komşu kartuşları arasında bulunmuştur. Mansap, her L2 hücre ve üç ilişkili L4 hücreleri ortak bir hedefe kendi aksonlarını, komşu kartuşlardan girdiler inanılan medulla içinde Tm2 nöron ön-arka hareket 27 işlenmesi için entegre edilmesi. L1 nöronlar hem gap junction ve sinapsların üzerinden aynı kartuşu L2S girdi alırsınız, ancak doğrudan L4s ve dolayısıyla komşu lamina kartuşları bağlı değildir.
R1-R6 fotoreseptör aksonlar için Synaptic geri bildirimler L2 / L4 devreleri ait nöronlar tarafından sadece sağlanmaktadır değil L1 yolu 1,2 (Şekil 1D). Aynı kartuş bağlantıları R1 ve R2 için L2 ve L4 R5 seçici iken, tüm R1-R6 fotoreseptör birinin L4 veya her ikisini komşu kartuşlardan sinaptik geri bildirim almak. Ayrıca, R1, R2, R4 ve R5 Am güçlü sinaptik bağlantıları vardır, ve glia hücreleri de sinaptik ağa bağlı ve bu nedenle sinir görüntü işleme 6 katılabilir. Son olarak, lamina R1-R6 ve R6 ve R7 / R8 arasındaki fotoreseptör komşu bağlayan aksonal boşluk kavşaklar, her bir kartuş 14,20,28 asimetrik bilgi temsili ve işlenmesine katkıda bulunur.Neredeyse sağlam Drosophila bireysel fotoreseptör ve görsel internöronlar hücre içi gerilim kayıtları yüksek sinyal-gürültü r sağlamakBağlı nöronlar arasındaki hızlı sinirsel hesaplamaların içyüzü için gerekli olan alt milisaniye çözünürlük 3,5,7-10,29 en ATIO veri. 100 milisaniye çözünürlük - bu kesinlik düzeyi önemli ölçüde gürültüsü ve genellikle 10 çalışmasına mevcut optik görüntüleme teknikleri ile mümkün değildir. elektrotlar çok küçük ve keskin ipucu var çünkü Dahası, yöntem hücre gövdeleri ile sınırlı değildir, ama küçük aktif nöral yapıların doğrudan kayıtları sağlayabilir; Böyle yama-kelepçe elektrotların çok daha büyük ipuçları ile erişilemez LMCs 'dendritik ağaçlar ya da fotoreseptör akson gibi. Önemlisi, yöntem aynı zamanda en yama-kelepçe uygulamalarında daha yapısal az invaziv ve zararlı olduğunu ve bu yüzden daha az çalışılan hücrelerin hücre içi ortamı ve bilgi örnekleme etkiler. Böylece, geleneksel keskin mikroelektrot teknikleri katkıda ve nöral infor içine temel buluşlar ve orijinal fikir katkıda bulunmaya devam varuygun zaman ölçeğinde mation işleme; vizyon 3-10 bizim mekanistik anlayış geliştirmek.
Drosophila R1-R6 fotoreseptör ve LMCs gelen vivo hücre içi kayıtlarda Juusola laboratuvarında yapılmaktadır nasıl Bu makalede anlatılmaktadır. Bu protokol, uygun bir elektrofizyoloji teçhizat nasıl oluştuğunu açıklamak sinek hazırlamak ve kayıtları seslendirecek. Bazı temsilci veriler sunulmuştur ve bazı ortak sorunları ve olası çözümleri bu yöntemi kullanırken karşılaşılan olabileceğini tartışılmıştır.
Protokol
Aşağıdaki protokol Sheffield Üniversitesi ve Pekin Normal Üniversitesi tüm hayvan bakımı kurallarına uygundur.
1. Reaktifler ve Ekipmanları Hazırlık
- Kayıt ve Işık Uyarım Ekipmanları Kurulumu
- düzenlenmiş nem ile klima bulunmaktadır ve karanlık kayıt koşulları sağlamak anlamına gelir bir odada elektrofizyolojik deneyler için en az 2.5 x 2.5 m kayıt alanını seçin. tüm içinde kapalı, teçhizat iki kaz boyunlu, Stereomikroskopta ve soğuk ışık kaynağı [stimülasyon ve kayıt cihazı sinek] evler (i) 1 x 1 m titreşim izolasyonu tablosu: Bu alanda rahatça sığacak kadar büyük olduğundan emin olun büyük> 180 cm boyunda Faraday kafesi; (Ii) konut için 38U ekipman rafı düz bir LCD monitör, mikroelektrot amplifikatör, LED sürücüler, filtreler, sıcaklık kontrol üniteleri, osiloskop ve diğer gerekli elektrikli cihazlar ile kişisel bilgisayar; ve (iii)Küçük bir masa ve araştırmacı için bir sandalye.
- uzakta bu tür buzdolapları, santrifüjler ve asansörler gibi elektrikli ve mekanik gürültü kaynaklarından teçhizat yerleştirin. Şebeke meydana gelen voltaj yükselmelerinin platformun elektrikli cihazları korumak için ayrı dalgalanma koruyucuları kullanın. İdeal olarak, gürültüyü en aza indirmek için kendi kesintisiz güç kaynağı (UPS akü) ile teçhizat bağlayın.
- Pirinç ve siyah plastik (Şekil 2) dışarı konik sinek tutucu oluşturun. dış jant daralmasına ~ (tipik bir sinek toraks genişliği eşleşen) 0.8 mm çaplı pirinç birimi aracılığıyla küçük sivri delik delin.
Not: Bu delik daha büyük bir hava akımı tarafından aşağıdan tahmin edilmektedir ortalama Drosophila, daha sıkışmış omuz derin üst kenarının alacağı böylece sinek tutucu ucuna doğru konik gerekiyor. - Tasarım ve sinek, mekanik sağlam, henüz kesin stimülasyon ve kayıt cihazı (Şekil 3) oluşturmak. o dışarı inşagömülü bilyalı rulmanlar f alüminyum veya pirinç (yüksek iletkenlik metaller) bir sinek hazırlık platformu kutup ve çevresinde bir Kardan-kol sistemi, düzgün ve doğru x, y-konumlandırma ve hafif uyaran kilitlenmesini sağlamak.
Not: Bu entegre kompozit tasarım aksi çalışılan hücreden dışarı kayıt elektrot ucu yerinden olabilir mekanik titreşimleri en aza indirir. Ayrıca sinaptik devre hesaplamaları 9,30 değerlendirmek için, bu tür shibire TS olarak ısıya duyarlı genetik yapıları, kullanmak için araştırmacılar sağlayan bir Peltier elemanı tabanlı kapalı döngü sıcaklık kontrol sistemi dahil edebilirsiniz. aparat anotlamak veya siyah ışık uyaran saçılımına en aza indirmek için boya.- titreşim önleyici tablonun breadboard sinek stimülasyon ve kayıt cihazı Fix; M6 cıvataları, örneğin onun metrik vida deliklerini kullanarak. Deneyler sırasında ışık yayılımı en aza indirmek için siyah kumaş ile siyah breadboard kullanın ya da kapsamaktadır.
- position ve kilit bir Kardan-kol sisteminin merkezinde dikey olarak ayarlanabilir sinek hazırlık platformu kutup (bir kilitleme vidasını kullanarak). Kardan kol bağlı ışık kaynağı radyal sineğin başının işaret böylece sinek hazırlık yerleştirin platformu kutup (sinek tutucu içinde, adım 2'ye bakınız). sinek gözlerin merkezi (0, 0) Kardan-kol x ve y eksenleri, bu içinde herhangi bir noktaya doğru x, ışık uyaran y konumlandırma sağlar gibi sinek kesişim noktasında tam olduğundan emin olun görsel alan.
Not: Bu işlevsellik, belirli göz yerlere tek tek hücrelerin tepkisi özelliklerini haritalama için gerekli olan; örneğin, artan hassasiyet veya çözünürlüğü, sırasıyla 31 gösterecektir böyle parlak veya akut bölgeleri gibi yapısal uyarlamalar, için elektrofizyolojik delil ararken.
- titreşim önleyici masaya sinek stimülasyon arkasında Stereomikroskopta ve kayıt cihazı monte böyleceuçucu gözün rahat yüksek büyütme görüntüleme sağladığını.
- Işık kaynağının çift kafa yarı sert boynu ışık kılavuzları sinek hazırlık tutucu aşağı doğru bakacak şekilde mikroskop üstündeki soğuk ışık kaynağı monte edin. Serbestçe hareket edebilen iki ışın aydınlatma sinek göz içine küçük bir delikten onu sürüş daha kolay kayıt elektrot ucu görselleştirmek için yapar.
- M6 cıvataları veya manyetik kullanarak, sinek stimülasyon ve kayıt cihazının sağ tarafında, kayıt elektrot ve anti-vibrasyon masaya baş aşaması için (kaba ve ince) uygun bir x, y, z-mikromanipülatör seti takın duruyor.
Not: Juusola laboratuarda, farklı kuleleri farklı manipülatörler ile donatılmıştır; Ayrıntılar için Malzeme ve Reaktifler Tablo bakınız. Bunların hepsi yüksek kaliteli hücre içi kayıtları sağlar. - Yüksekliği ayarlanabilen f referans elektrot tutucu için küçük bir el ile 3-eksenli mikromanipülatör monte edinly hazırlık platformu kutup. uçucu hazırlık doğru bakacak şekilde referans elektrot yönlendirmek.
- dış elektromanyetik girişimi önlemek için, sinek stimülasyon ve kayıt cihazı çevreleyen anti-vibrasyon masa etrafında çelik paneller dışında bir serbest duran ışık korumalı Faraday kafesi inşa. deneyler için sinek hazırlık taşımak için erişim sağlayan kafes açıkken ön bırakın. gürültü ve ışık kalkan ön (topraklama için içlerinde implante bakır olan veya alüminyum-örgü) siyah kumaş perdeler takın. ışık yayılımı en aza indirmek ve titreşimleri engellemek için zemin kafesinin ayaklarını cıvata kafes siyah iç boyayın.
- BNC-kabloları kullanarak iki ayrı low-pass filtre (Bessel veya benzeri) girişlerine gerilim ve yüksek empedanslı hücre içi mikroelektrot amplifikatör mevcut çıkışlarını bağlayın. Aynı şekilde, AD-konnektör blo uygun kanallara filtre çıkışlarını bağlamakcks / veri toplama sistemi (DA / AD kartları) ve kurulları. tedarikçisi kullanma kılavuzlarına göre, uzman kablolarla bir kişisel bilgisayar haline DA / AD kart (lar) bağlayın.
- kişisel bilgisayarda tercih veri toplama sistemine uygun toplama yazılımı yükleyin. veri toplama sürücüleri kişisel bilgisayarda işletim sistemiyle uyumlu olduğundan emin olun.
- Zemin elektriksel sinek stimülasyon ve kayıt cihazları, Faraday kafesi, (perdeleri içinde) bakır örgü, mikroskop, mikromanipülatörler, soğuk ışık kaynağı, bütün enstrümanları ile 38U ekipman rafı (hücre içi amplifikatör, filtreler, sıcaklık kontrol ünitesi, bilgisayar ve LCD monitör vb) ekipman topraklama teli ve M6 halka topraklama uçları kıvrım kullanarak tek bir merkezi zemin noktasına. tüm parçaları aynı zeminde olduğunu test etmek için bir elektrik multimetreyi kullanın.
Not: Mümkün olan en iyi düşük gürültü kayıt koşullarını elde etmek için, topraklama yapılandırmaları tipik fro değişirBaşka m bir set-up.- Gerekirse, bina yere daha merkezi zemin noktasını bağlamak ve / veya mikroelektrot amplifikatörün merkez zemin. Gerçek elektrofizyolojik deneyler sırasında tam olarak işleyen bir sistemin test ettikten sonra, kayıtlarda gürültüyü en aza indirmek için gerektiği gibi topraklama yapılandırmasını değiştirmek için hazırlıklı olun.
- Sinyal filtreleme (hem R1-R6 ve LMC veri için uygundur 500 Hz, set tipik alçak geçiren filtreler), ve örnekleme oranı (en az 1 KHz) - yazılım amplifikasyon (10X 1) yapılandırın. Ayarlar Nyquist-Shannon örnekleme teoremi 32 itaat emin olun; verileri satın alırken, örneğin, 500 Hz, düşük süzülmüş-pass yumuşatma etkilerini en aza indirmek için 1 kHz veya daha yüksek bir örnekleme frekansını kullanın.
- 65 mV ve LMCs 20 olanlar - - R1-R6 fotoreseptör karakteristik gerilim yanıtları 40 olarak 45 mV, amplifikasyon ayarlamak ve ekran yüksek çözünürlüklü sampli etkinleştirmek için buna göre ölçeklerng ve veri görselleştirme.

Şekil 2. Konik Fly-tutucu sinek tutucu iki parça dışında yapılır. Merkez pirinç ünitesi ve konik siyah plastik kaplama. Pirinç ünitesinin içindeki merkezi delik zar zor yoluyla sinek sağlayan küçük çapa incelir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.

Elektrofizyolojik Rig Şekil 3. bakış. Set-up bakır veya bir serbest duran ışık korumalı Faraday kafesi, titreşim önleyici tablo, sinek stimülasyon ve kayıt cihazı ve siyah kumaş perdeler içeren içeride alüminyum-örgü topraklama. instrument raf elektrikle Faraday kafesi içindeki tüm donanımları ile aynı merkez toprağa bağlıdır. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
- Mikroelektronlar imalatı
- filamented borosilikat referans mikroelektrot çekin (dış çapı: 1,0 mm; iç çapı 0,6 mm) veya kuvars cam (dış çap: 1.0 mm; iç çapı 0.5, 0.6 ya da 0.7 mm) bir pipet çektirmenin aleti kullanılarak tüp. Kısa bir kademeli konik elde etmek için çalışın.
Not: pipet çektirmenin programının tam ayarları enstrümana cihazdan değişir; Malzemelerin ve vekili Tablo daha fazla detay. Referans elektrot ucu uçucu preparasyonu içine yerleştirilmeden önce kırılacak için ucundaki gözenek boyutu önemli değildir. - filamented borosilikat (dış çaptan kayıt mikroelektrot çekin: 1,0 mm; iç çap 0.6 mm) veya kuvars cam (dış çap: 1.0 mm; bir pipet çektirmenin aleti kullanılarak tüp iç çapı 0.5, 0.6 ya da 0.7 mm). ince kademeli konik - (15 mm 10) uzun ulaşmak için çalışın.
- kayıt elektrotları doğru daralan göstermek bir ışık mikroskobu ile kontrol edin. moldable yapıştırıcı ile bir cam slayt elektrot montaj ve ucu incelemek için 40X hava objektif kullanın.
Not: İyi bir elektrot sürekli paralel karanlık ve aydınlık girişim desenleri görülebilir hangi etrafında görünmez küçük ucu kadar sorunsuz incelir. Bazı çektirme ayarlar ipuçları "trompet" benzer çünkü başarılı hücre penetrasynların verim olamaz yüksek direnç elektrotlar oluşturmak. Bu durumda, elektrot görsel kontrol önemlidir. - elektrofizyoloji teçhizat için güvenli tutmak ve taşıma için kil modelleme (veya benzeri moldable yapıştırıcı) ile büyük bir Petri-tabağına yatay elektrotlar takın. Emin olun elektrot ipuçlarıHavada her zaman yeniden ve yanlışlıkla bir şey dokunmadan değil.
- Sadece uygun tuz çözeltisi ile deneyden önce-arkaya doldurmak kayıt ve referans elektrotlar. (Örneğin, bir Microloader gibi) ince bir plastik ucu küçük bir parçacık filtresine bağlı küçük bir 5 mi şırınga kullanın.
- Bu çözelti, kaydedilen gerilime sıvı bağlantı potansiyel etkisini en aza indirir olarak fotoreseptörler deneyler için, 3 M KCl tam kadar kayıt elektrotu (geniş ucunda bir damlacık formlar) doldurun.
- Bu çözüm hücrenin klorid pil daha az etkiye sahip olarak klorür iletkenlik değişikliklerle R1-R6 fotoreseptör sinaptik giriş yanıt histaminerjik LMCs, araştırmak için, 3 M potasyum asetat ve 0.5 mM KCl ile kayıt elektrotları doldurun. MM olarak ihtiva eden uçucu Ringer referans elektrot doldurma: 120 NaCl, 5 KCl, 10 TES (Cı 6H 15 NO 6 s), 1.5 CaCl2, 4 MgCl2 ve 30 sukroz
5 yukarı.
kayıt sisteminde yeni çekilmiş bir kayıt elektrot direnci test.- elektrot sahiplerinin içinde gümüş teller eşit gümüş klorür ile kaplanmış olduğundan emin olun (mor-gri görünen değil - parlak simli) (örneğin kavşak potansiyeli sürüklenme gibi) kayıt eserler en aza indirmek için. Aksi takdirde, uygun bir şekilde chloridized teller ile değiştirin.
- Gerekirse, yeni gümüş teller chloridize. Dikkatle bu renkte parlak gümüş görünmesini sağlayacak şekilde (hızlı bir şekilde alev geçirerek) telleri temizleyin. AgCl eşit bir katman üzerinde yatırmak için, parmaklarınızla onları dokunmaktan kaçının. onlar mor-gri renk görünene kadar 30 dakika - 15 tam mukavemet çamaşır suyu teller bekletin. Yeterli kaplanmış kadar 15 saniye - Alternatif olarak, 10 (3 M KCl ihtiva eden bir çözelti ile ilgili olarak olumlu hale 1 mA yüzey alanının / cm2 arasında bir oranda içinden geçen akım ile) her bir tel elektrolizle.
- onların elektrot-sahiplerine geri dolu kayıt ve referans elektrotlar bağlayın. Yüksekliği ayarlanabilen sinek hazırlık platformu kutup küçük bir Ringer solüsyonu banyo yerleştirin. Ringer çözeltisi içine elektrot uçları Sürücü ve kayıt elektrot ucu direncini ölçün.
Not: yeni bir cam borunun toplu, ya da yineleme yoluyla mikroelektrot çektirmenin enstrüman programları optimize çekilir elektrotlar, rezistif özelliklerini test Bu adım yalnızca gereklidir. - Direnç ölçümleri yapmadan önce, uygun ölçüm ayarları için amplifikatör üreticinin kılavuzdaki yönergeleri okuyun. 220 MQ - İyi bir kayıt elektrot için, ~ 100 bir ucu direncine sahiptir.
- filamented borosilikat referans mikroelektrot çekin (dış çapı: 1,0 mm; iç çapı 0,6 mm) veya kuvars cam (dış çap: 1.0 mm; iç çapı 0.5, 0.6 ya da 0.7 mm) bir pipet çektirmenin aleti kullanılarak tüp. Kısa bir kademeli konik elde etmek için çalışın.
2. Drosophila Hazırlık
(Eclosion sonra) 10 gün eski sinek ve st içeren temiz bir sinek tüp koyun - 5 toplayınandard yiyecek. Genç dahi "yenidoğanlarda" dan da uçar dan iyi kayıtları elde etmek mümkündür; ancak onların yumuşak gözlerin, kayıt elektrot için kornea açıklığı kesme daha zordur.(Şekil 4) standı bir sinek yakalamak tüpü ve bir sinek hazırlık yaparız. Bu self-made araçları birlikte bindirildi nasıl genel bir fikir için Şekil 4'e bakınız.- Bir sinek yakalamak tüp yapmak için, 50 ml plastik santrifüj tüpünün konik alt ucunu kesti. Sonra, eklemek ve bu yeni açılış 1 ml pipet büyük ucunu yapıştırın.
- Son olarak, hali hazırda bir sinek yürüyelim sağlayan bir boyuta pipet küçük ucunu kesti. 2-eksen dönme ve farklı pozisyonlarda sinek tutucu kilitleme sağlayan küçük bir sinek hazırlık aşamasını monte mekanik servise başvurun.

Figüre 4. Araçlar ve tasarlar Fly Hazırlık yapmak için gerekli. yakalamak tüpü 50 ml'lik plastik santrifüj tüpüne 1 ml plastik pipet yapıştırma yapılır Fly. Ismarlama uçucu hazırlanması standı sinek hazırlanması için tercih edilen bir pozisyonda serbest dönme ve uçucu taşıyıcının kilitleme sağlar. sinek elektrikli balmumu ısıtıcı kullanılarak, balmumu ile sabittir. Vazelin bir sap üzerinde kalın bir tür saç bağlayarak yapılan küçük bir aplikatör ile uygulanır. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
ancak aracılığıyla uygun bir sinek sağlayan 1 ml pipet, içinde deney için bir sinek toplayın. sinek tüp, üzerinde pipet ile, tüp alıcı sinek takın. Bir sinek hakim, pipet içine yukarı doğru (antigravitaxis) tırmanmaya kendi içsel bir eğilim yararlanmak. Tercihen, boyut meselesi olarak büyük kadın seçinelektrofizyoloji s.
Not: Yüksek kaliteli intraselüler kayıtlar için şansını kendi hücreleri daha büyük, sinek büyük ve daha iyi. Küçük sinekler (kadın ve erkek her ikisi de) de mükemmel kayıtları sağlayabilir, ancak hazırlık yapmak daha zordur. Sinek büyük bir pipet sıkışıp sonra, kaçan diğer sinekler durdurmak için sinek tüpü kapatmayı unutmayın.pipet büyük açılış için esnek bir plastik hortum ile 100 ml şırınga bağlayın - o hala sinek.Sinek tutucu alt açılması, sadece üzerinden bir Drosophila izin büyütülür büyük pipet, dar ucu yerleştirin ve sinek-tutucu içine sinek çıkarmak için şırınga hava küçük bir hacim sıkmak .- stereomikroskop bakmak ve sineğin kafası sinek tutucu konik ucundan çıkıntılı kadar yavaşça daha fazla hava yönetmek. Sinek sıkıca küçük ope onun göğüs dan sıkışıp emin olunsinek tutucu üstüne ning.
sinek tutucu olan "omuzlarında" dan balmumu ile sinek tutturmak için bir mum ısıtıcı kullanın. Henüz temiz mum eritme mümkün olduğunca düşük olması balmumu ısıtıcı sıcaklığını ayarlar.
Not: Sıcaklık doğru olduğunda, balmumu şeffaf görünür. Bir sıcaklık çok yüksek mum "yakıp" yapar; çok düşük balmumu sert tutar. sinek sabitlerken, doğru ve zarar verebilir uzun süre ısıya maruz kadar kısa olabilir. ışıkla sertleşen diş yapıştırıcı kullanarak uygulama çok yavaş olarak burada tavsiye edilmez.

İn Vivo Deneyler için Fly hazırlanması Şekil 5.. Bir Drosophila 'nın baş sinek tutucu düz yerleştirilmiş ve ısıtılacak olan sinek tutucu olan burnumun sağ göz ve omuzlardan sabittir, Soleswax. Sağ, küçük bir açılış keskin bir jilet kenarı kullanarak, sadece ekvator ve uzak arka manikür sadece birkaç ommatidia üzerinde, gözün en kalın kısmı kesilir. Korneanın bir parçası nazikçe çıkarılır ve delik kurumasını önlemek için göz vazelin ile mühürlenir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Sineğin kafasını hareketsiz. , Probosis (Şekil 5) ve sağ gözün köşesine balmumu uygulayın kornea kaçınarak, ve sinek-sahibine bu noktalardan başını düzeltmek.Bir mikro-bıçak üretin. İki bıçak tutucu olmayan bir paslanmaz çelik jilet kelepçe / kesiciler (her ikisi de düz kavrama ile) ve onun keskin kenarın küçük bir şerit çatlak. sağlığı ve güvenliği için, (o jilet kırık olduğunda parçalar sekerek olacağını son derece düşüktür olsa bile) Göz koruması için gözlük kullanın. İdeal olarak,Bir sivri benzer keskin bir jilet kenar üretirler. Bu "sivri" sıkıca bıçak tutucu takılı olduğundan emin olun, ancak herhangi bir öz-yaralanmayı önlemek için dikkatli olun!kayıt mikroelektrot için geçişi sağlamak için sadece gözün ekvator üzerinde dorsal manikür 5 ommatidia - yaklaşık 4 - Mikro-bıçak kullanarak, sineğin sol gözünde birkaç ommatidia küçük bir açılış boyutu hazırlamak. yüksek büyütme ile hazırlık görüntüleme, bir stereomikroskop altında gerçekleştirin.
Not: sinek göz sondalama elastik ve dayanıklı hisseder, çünkü delik "sivri" -knife ile en iyi kesilir. kesim tekniği oldukça zorlu, bu nedenle video gösterimi yakın ilgi. (Sinek hazırlık stand) belirli yönlerde sinek tutucu tutulması diseksiyon kolaylaştırabilir. Başlangıçta, mikrocerrahi öğrenmek zor hissedebilirsiniz, fakat işlenen bir kez, nöral adaptasyon yavaş yavaş araştırmacının 3D-algı ve maharet geliştirir.Raldır sadece altında retina açığa kesildi açıklıktan korneanın dikkatlice küçük bir parça. Hızla vazelin uygulayıcının ince saç kullanarak vazelin küçük bir damla ile göz deliği kapsamaktadır.
Not: Vazelin burada birden fazla rol vermektedir. Bu doku dehidratasyon ve eklenen kayıt elektrot kıracak hemolimf pıhtılaşmasını önler. onun intramural kapasitans azaltarak aynı zamanda tesadüfen mont mikroelektrot. Bu kayıt sisteminin frekans tepki geliştirmek ve kayıtlı nöral sinyallerin bu kadar zamansal çözünürlük yapabilirsiniz. Bu optik bulanıklaştırır olarak gözün geri kalanı üzerinde vazelin bulaşması kaçının.
R1-R6, fotoreseptör veya LMCs 3. Kayıt
(Faraday kafesi veya anti-vibrasyon tablonun metal yüzeyine dokunarak örneğin) mikroelektrot amplifikatör çalıştırırken bu yanlışlıkla teslim birini engeller her zaman olduğu gibi, topraklıdevrelerine zarar verebilir kafa sahnede, bir statik yük ing.Sinek tutucu yakın görsel kontrol altında tercih pozisyonda kutup yerleştirilir böylece (Faraday kafesi içinde soğuk ışık kaynağı ile) iki kaz-boyun ışık kılavuzları (Şekil 6A) tarafından yukarıdan sinek hazırlık platformu kutup aydınlatın .
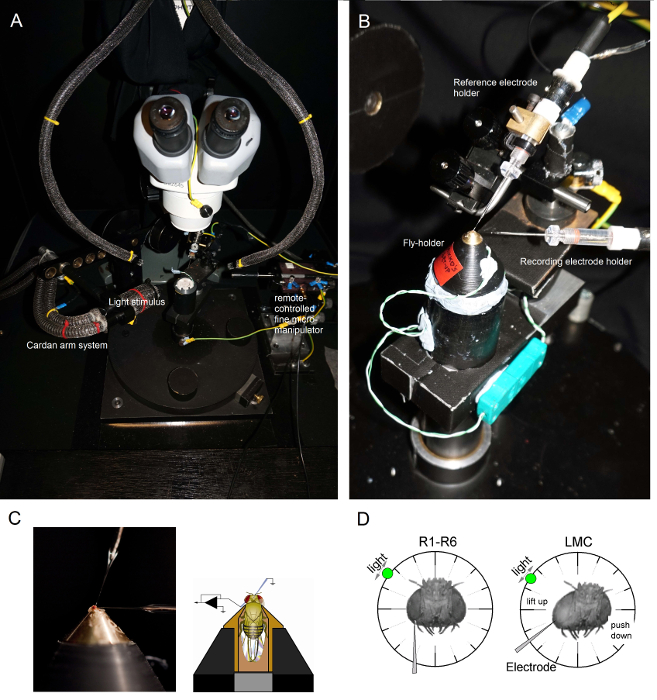
Şekil 6. Konumlandırma Fly-tutucu ve Deney için elektrotlar (AB) sinek tutucu bir Peltier elemanı (A: merkezinde beyaz yuvarlak platformu) üzerinden sıcaklık kontrolü sağlar kayıt platformu üzerine yerleştirilir.. Kardan-kol doğrudan göze işaret ışık kaynağı (bir sıvı veya kuvars fiber optik demeti sonu) ile anında etrafında (x, y-dönüş yoluyla) eşit uzaklıkta ışık uyaran tam olarak konumlandırılmasını mümkün kılar. ou çoğundar kulesi, ışık uyarımı (doğrusal akım sürücüleri ile) ya da bir monokromatör ile LED'ler tarafından oluşturulur. (Ayrı nötral yoğunluk filtreleri tarafından zayıflatılmış gibi) 6 günlük yoğunluğu birim aralığı - Böylece, uyaranlara 300 arasında seçilen bir spesifik (bant-pass) spektral içeriği taşır - 740 nm ve 4 kapsamaktadır. Ayrı Mikromanipülatörler tarafından kontrol (C) İki Mikroelektronlar, sinek kafası konumlandırılmış: ocelli ile referans elektrodu (yukarıda); Sol gözünde küçük açıklıktan kayıt elektrot (solda). Fotoreseptör kayıtların maksimum sayıda elde etmek için (D), kayıt mikroelektrot deliğe sürülür, hortum-ocellus eksenine paralel uzanmaktadır. Bir fotoreseptör elektrot ucu nüfuz ve mühürler, serbestçe dönebilir ışık kaynağı hücre belirli bir ışık uyarısına maksimum gerilim tepkisi üreten konuma sabitlenir. Uzayda Bu nokta hücrenin açık alanın merkezinde yatıyor. delik i iseLMC girmeler daha bu aynı elektrot açısı (solda) ile yakın manikür elde edilebilir s. Delik daha manikür ise, başka yararlı elektrot yaklaşma açısı (sağ) de gösterilen LMC kayıtları elde etmek. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
sinek hazırlık platformu kutup sinek tutucu (o sinek ile!) monte edin. Sineğin sol göz doğrudan araştırmacı (Şekil 6B) bakacak şekilde sinek tutucu döndürün.Stereomikroskopta (Şekil 6C) aracılığıyla hazırlık izlerken küçük bir kaba mikromanipülatör kullanarak baş kapsülü içine sinek occelli yoluyla nazikçe künt referans elektrot yerleştirin. Bu sinek beyin zarar verebileceği, çok derin elektrot itmeyin.- Alternatif olarak, toraks arkasına referans elektrot eklemek. Her zaman, sinek (kendi antenleri hareket eder) heathy görünür ve gözleri sağlam olduğundan emin olun; yanlışlıkla zarar değil. Hazırlık tertemiz az görünüyorsa, deneyler için yeni bir sinek hazırlayın.
vazelin ile sol gözünün içine keskin kayıt mikroelektrot Sürücü önceden hazırlanmış küçük açılış kaplı. stereomikroskopta yüksek büyütme kullanın ve elektrot ucu konumu, yansıma desenleri ile 3D belirgin hale gelir, böylece ışık kılavuzları ve odak düzlemi hareket ettirin.
Not: Şekil 6D sinek kafası fotoreseptör ve LMC kayıtları için (kayıt mikroelektrot göz girer açı açısından) farklı hafifçe yerleştirilmelidir gösterir. Bunu kırmadan göz içine elektrot Sürüş deney en zor aşamasıdır. elektrot ucu küçük göz açıklığı, kornea isabet kaçırırsa, genellikle keser.mikroelektrot amplifikatör açmaher iki elektrot kez sineğinin vücut sıvıları ile elektriksel temas içinde Preparasyon içinde sıkı bir şekilde bulunmaktadır.(Faraday kafesi içinde) soğuk ışık kaynağı kapatın ve şebeke bağlantısını kesin. zemin döngü elektriksel gürültü kaynaklı en aza indirmek ve Kardan-kol sistemi serbestçe sinek etrafında hareket edebilir ve böylece uzak kaz-boyun ışık kılavuzları taşımak için merkezi zemine onun takın. sinek hazırlık göreceli karanlıkta şimdi olduğundan emin olmak için oda ışıkları kapatın.gözde kayıt elektrot (amplifikatörün kullanıcı kılavuzunda anlatıldığı gibi) direncini ölçün. 250 MQ - direnci 100 olduğu, sadece kayıt elektrotları kullanın.
Not: <70 M? Elektrot tarafından yüksek kalitede hücre içi kayıtları elde etmek neredeyse imkansızdır. Direnç <80 M? ise, elektrot ucu kırık olasıdır. Bu durumda, amplifikatör kapatın ve kayıt elektrot değiştirin.- elektrodun kezdeğiştirilir ve gözde, direncini ölçmek için amplifikatör devreye girer. bu doku girerken Bazen, elektrot ucu bazı döküntü ile bloke olabilir. Bu amplifikatörün kapasitif vızıltı ve akım darbesi işlevlerini kullanarak çözülebilir hızlı resonation veya itme ile tipik açık söyledi.
akım-kelepçe (CC) veya köprü kayıt moduna amplifikatör ayarlayın. her ikisi de şimdi sıfıra sinyali offset (kayıt gerilimi) ayarlayarak, elektriksel birbirine dışı alanda dinlenme gibi, kayıt ve referans elektrotlar arasında herhangi bir keyfi gerilim farkı iptal edin. amplifikatörün ekran okuma veya osiloskop ekranını kullanarak sinyali offset değişiklikleri takip edin.uçucu göz için 2-3 dakika bekleyin koyu adapte.küçük 0,1-1 mikron adımlarla göz içine yavaş yavaş derin kayıt elektrot ucu sürün. uzaktan kumandalı bir mikromanipülatör veya B, bir x-ekseni, piezo-step ile fazlasıy nazikçe manuel manipülatör ince çözünürlük düğmesini çevirerek.kayıt elektrot dokusunda ileri ediliyor gibi - (10 milisaniye 1) ışığı yanıp kısa sinek gözü uyarır.
Not: kayıt elektrot retinada konumlandırılmış ve göz fonksiyonları normal, her ışık flaş geriliminin kısa bir ve küçük düşmesine neden olacaksa (0,2-5 mV hiperpolarizasyon), elektroretinogram (ERG) denir. ekstraselüler boşluk alan potansiyeli bu değişiklik ışığa retina hücrelerinin toplu tepki neden olur. elektrot ucu lamina girer Ancak, bir kez LMCs kapanış, ERG depolarize tepkiler göstererek, tersine çevirir.Kardan kol sistemini kullanarak sinek göz çevresinde ışık kaynağı hareket ettirin ve ışık büyük ERG tepki uyandıran pozisyon bulmak.
Not: Bu pozisyon görsel alanda küçük alanı işaretler nerede kayıt elektrot ucu yanında bulunan fotoreseptör (veya LMCs),, Onların ışık girişini örnek.kayıt elektrot ile bir hücre nüfuz eder.
penetrasyon kendiliğinden oluşabilir, ya da elektrot olduğunda ileri mikro-çıktı: Not. Ayrıca hafifçe mikromanipülatör sistemi dokunarak veya amplifikatör vızıltı-işlevi kullanılarak kolaylaştırılabilir; bu eylemler dokuda elektrot ucu yankı. elektrot fotoreseptör membran impales zaman, hücre içi alan, kayıt ve referans elektrot arasındaki gerilim farkını girerek aniden düşer 0 mV mV ~ -65 (-55 ile -75 mV arasında); LMC sızmalar sırasında ise, bu damla (-30 ve -50 mV arasında) genellikle azdır. Bu gerilim farklılıkları verilen hücrelerin olumsuz dinlenme potansiyelleri temsil etmektedir. kayıt elektrot (onun keskinliği) ve nüfuz hücresel sürecin kalitesine bağlı olarak, kayıt elektrot gerilim okuma, hücre zarının olarak, dinlenme potansiyeli hızla ya da yavaş yavaş stabilizeelektrodun dış katmana mühürler. penetrasyon sadece kısmi ya da kötü olup olmadığını ancak, elektrot, genellikle geri sıfıra doğru kaydedilen potansiyel tırmanışı ile hücre dışına kayıyor.elektrot düzgün bir şekilde kapatılmış görünür olduğunda kararlı membran potansiyelini (koyu dinlenme potansiyeli) gösteren nüfuz hücrenin açık alanın merkezinin yerinin. ışık flaş hücrenin maksimum gerilim tepki uyandıran görsel uzayda noktasını bulmak için, Kardan kol sistemini kullanarak, sinek göz çevresinde yanıp sönen bir ışık uyaran taşıyın. Işık uyaran doğrudan (noktalar) karşı karşıya olduğunda açık alan merkezi Kardan-kol kilitleyin.
Not: Karanlıkta, Drosophila fotoreseptör 40 ile parlak ışık darbeleri yanıt - kararlı LMC kayıtları 20 ila 45 mV hiperpolarizan yanıtları 9,10,14 gösterirken, 65 mV depolarizan gerilim yanıtları 4,5. Glia penetrasyonlar <-80 mV dinlenme potansiyelleri ve çok daha yavaş gösterilen, nadiren ortaya çıkabilirve daha küçük (~ 5 mV) ışık kaynaklı depolarizasyonu doymuş. Bu beyaz-göz 7 ve cinnabar olarak farklı göz pigmentasyonlar ile Drosophila Fotoreseptörler, vahşi tip ile karşılaştırılabilir yanıt boyutları göstermektedir.zar şarj sırasında kayıt eserler en aza indirmek için çalışılan hücreye - (200 msn'den 100) akım darbeleri amplifikatörün akım kelepçe (CC) modunu kullanarak, küçük 0.1 nA ve kısa enjekte ederek kayıt elektrot kapasitans telafi eder.
Not: Bu önemli bir prosedür amplifikatörün kullanım el kitabında ayrıntılı olarak açıklanmaktadır, ve gerçek deney önünde bir elektrik hücresi modeli ile uygulanmalıdır.Işık bakliyat ve diğer ilgi uyaranlara, rekor gerilim yanıtları (örneğin doğal ışık yoğunluğu zaman serisi veya rasgele kontrast desenler gibi) değişen istatistiksel veya fiziksel özelliklere sahip. Testi, kaydedilen tepkiler ışık veya koyu-adaptasyonu ile nasıl değiştiğini, örneğin, için.
Not: Bir li doğru olabilirışık yolu 4,5 üzerinde nötral yoğunluk filtreleri eklenerek önceden seçilmiş yoğunlukta sürekli ışık tarafından incelenmiştir hücre GHT-adapte. Alternatif olarak, uzun süreli karanlık adaptasyonu için belirli bir süre için hafif bir uyarıcı kapatın. Çünkü kayıt sisteminin mekanik stabilite, kayıt elektrotları yüksek kalite ve hazırlık intakt, kararlı kayıt koşulları bazen saatlerce sürebilir. Böylece, iyi bir gününde, tek bir hücreden farklı adapte şartlarında büyük bir veri miktarı toplamak mümkündür. elektrot hücre dışına kayar, kaydedilen tepkiler azalır ve ortalama gerilim sıfıra yaklaşırken başlar.elektrot temas eder ve bir sonraki hücreye nüfuz kadar (bu genellikle en yakın sinir komşusu) dikkatli mikromanipülatör ince x ekseni kontrolü ile kayıt elektrodu ilerlemek. Bu manevralar pl "elektrot yapmak gibi y veya z ekseni boyunca elektrot hareket etmiyordokuda ough "yanlara, göz yapılara zarar!
Not: iyi elektrot ve sağlıklı bir preparasyon ile, bir kaç saat arasında bir süre boyunca, aynı sinek (birçok LMCs nadiren fakat) birçok fotoreseptör yüksek kaliteli yanıt kaydedebilir; bazen açık bir sinyal bozulmadan tam çalışma günü (> 8 saat) üzerinde.periyodik olarak bu tarihten, genotip ve kaydedilen hücre tipi olarak, tanımlayıcı bilgiler ile veri dosyaları kaydedin. Çünkü başarılı bir kayıt oturumda toplanabilir veri büyük miktarda, gelecekteki veri analizi için bir laboratuvar-kitap iyi yazılı kayıtlarını tutmak.
Sonuçlar
Drosophila göz için buraya uyarlanmış keskin mikroelektrot kayıt yöntemi, güvenilir onları 4,5,7,8,10,33 arasında sinirsel bilgi örnekleme ve işleme retina ve lamina hücrelerinde ve iletişim ölçmek için kullanılabilir. Farklı vahşi tip hisse senetleri, mutantların veya genetik mühendisliği sinek suşları kodlama incelemek için kullanarak, yöntem değerini kanıtlamıştır; sadece bir mutasyonun, sıcaklık, beslenme ya da seçilen ifade 3,4,6,9,10,14,30,34 etkilerinin miktarının, aynı zamanda değiştirilmiş görsel davranışlar 14,34 için mekanik nedenler ortaya çıkarmakta. Yöntem aynı zamanda neuroethological görme çalışmalarını güçlendirerek diğer böcek hazırlıkları 35,36, kolayca uygulanabilir. Sonraki biz başarılı uygulamalar birkaç örnek vitrin.

Şekil 7. GerilimIşık 20 ° C'de Pulse ve bir Meyve Sineği R1-R6 fotoreseptör Cevapları 25 o keskin mikroelektrot girmeler genellikle çok kararlı olduğundan C, en belirli bir ışık uyarısına aynı R1-R6 fotoreseptör gerilim yanıtları kaydetmek mümkündür ısınma veya fly soğutma farklı ortam sıcaklıkları. Bizim set-up, sinek tutucu bir kapalı döngü Peltier elemanı tabanlı sıcaklık kontrol sistemi yerleştirilir. Bu saniye içinde sineğin kafası sıcaklığını değiştirmek için bize sağlar. Daha yüksek sıcaklık gerilim yanıtları hızlandırır ve karakteristik (kırmızı oklarla gösterildiği gibi) R1-R6 fotoreseptör dinlenme potansiyelini düşürür. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Fotoreseptör Çıktı Sıcaklığın Etkisi incelenmesi
ile iyi tasarlanmış ve titreşim izole kayıt sistemi, yöntem ısınmanın tek bir hücrenin sinir çıkış üzerine sıcaklığın etkisini ölçmek veya fly soğutma için kullanılabilir. Verilen örnek 20 ve 25 ° C (Şekil 7) aynı R1-R6, fotoreseptör kaydedilen parlak 10 msn uzun bir pals, voltaj tepkilerini gösterir. 4,9 önce sayısal olarak, ısınma karanlıkta bir fotoreseptör dinlenme potansiyelini düşürür ve onun gerilim yanıtları hızlandırır.
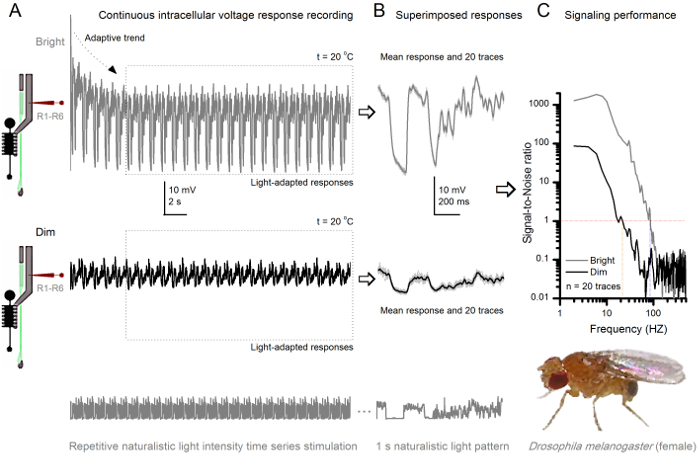
Şekil 8. Sinyal Performansı bir Meyve Sineği R1-R6 fotoreseptör Işık Şiddeti ile Geliştirdi (A) fotoreseptör çıkışı (aşağıda) loş ve parlak. (Yukarıda 10,000 kat daha parlak ışık) aynı mikroelektrot tarafından kaydedilen natüralist ışık yoğunluğu zaman serisini tekrarlanan20 o C'de aynı hücrede Onlar daha fazla numune, tek fotonlar 4,5,7,8 ilköğretim yanıtları (diken) entegre çünkü parlak uyarana Cevapları, büyüktür. (B) 20 ardışık bir saniyelik uzun gerilim yanıtları bindirilmiş. Bireysel tepkiler (açık gri) (A ok) adaptif eğilimleri sonra alınmıştır (A noktalı kutu) gerilemiştir almıştı. İlgili tepki araçları (sinyaller) koyu izleri vardır. sinyal ve bireysel tepkiler arasındaki fark gürültüdür. (C) hücreleri standart yöntemler 4,5,7,8 kullanarak Sinyal-Gürültü Oranları (SNR) 'sinyal performans kayıtlarıyla ölçüldü.' Fotoreseptör çıkış s ile, '(20 Hz kadar, Dim ≥1 SNR) dim olduğundan daha (Parlak ≥1, en fazla 84 Hz parlak stimülasyon güvenilir sinyalizasyon yaklaşık 64 Hz geniş yelpazede SNR)' vardırignal-gürültü oranı büyük ölçüde iyileştirilmesi; SNR Dim MAX = SNR Parlak MAX 87 = 1.868 den. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Tekrarlanan Uyarım tarafından Uyum ve Sinir Kodlama incelenmesi
Retina ve lamina yapıları nispeten daha az hasara neden yöntemin girişimsel, in vivo olarak yakın doğal fizyolojik durumu farklı ışık uyaranlara tek tek hücrelerin sinyal performansını incelemek için idealdir. 8 gösteren bir R1- gerilim yanıtları Şekil 20 o C'de loş ve parlak tekrarlanan doğal ışık yoğunluğu zaman serisi uyarana R6 fotoreseptör Şekil 9 ise 25 o C sıcaklıkta farklı bir doğal uyarana başka R1-R6 fotoreseptör ve LMC tepkilerini gösterir Aynı sinek iki keskin Mikroelektronlar, retinada birinde ve lamina diğer eş zamanlı hücre içi kayıtları, 30 yaşayabilir olması çok zor, çünkü öncesi ve postsinaptik kayıtları iki farklı sinekler ayrı yapıldı.
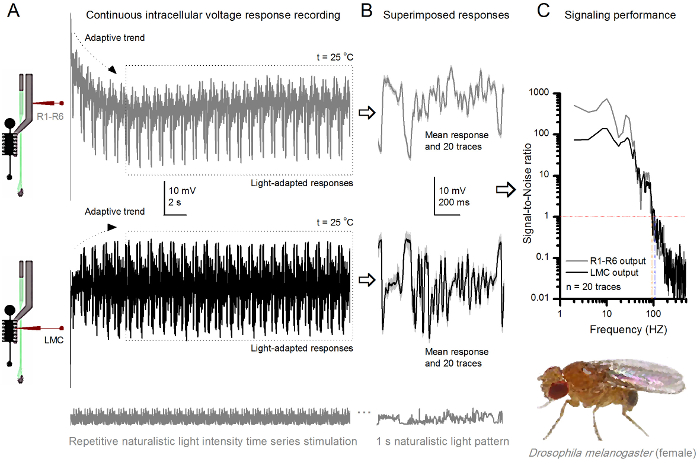
25 o C (A) (gri) R1-R6 ve LMC (siyah) Tekrarlanan Doğal Stimülasyon bir Meyve Sineği R1-R6 fotoreseptör ve LMC Şekil 9. Gerilim Yanıtları farklı sinekler farklı Mikroelektronlar tarafından kaydedilen çıkışları. (B) ışık gösterilen tamamen ışık adapte ardışık 20 ön- (edilmiş) ve tek tek yanıtları aynı doğal teşvik desenine postsinaptik (aşağıda) tepkileri, bir grikoyu izleri olarak d ilgili yanıt araçları (sinyaller). sinyal ve bireysel tepkiler arasındaki fark gürültüdür. (C) hücreleri Sinyal-Gürültü Oranları (SNR) 'sinyal performans kayıtlarıyla ölçüldü.' LMC çıkış '(en fazla 94 Hz R ≥1, SNR) R1-R6 çıkışı daha (104 Hz kadar LMC ≥1, SNR)' güvenilir sinyal yaklaşık 10 Hz geniş bir alanı vardır. Her iki sinyal-gürültü oranı (SNR LMC MAX = 142, SNR R MAX = 752) yüksek ve kayıt gürültü düşük olduğu gibi, aralarındaki farklılıkları hücreler arasındaki gerçek kodlama farklılıkları yansıtacak. Büyük halini görmek için tıklayınız bu figür.
uyaranın başlangıcından sonra, kayıtları tipikly hızlı büyük ölçüde 5-6 saniye içinde azalır eğilimleri adapte göstermektedir. O andan itibaren, hücreler her 1 sn uzun uyaran tanıtımı için son derece tutarlı tepkiler (her noktalı kutu bunlardan 20 saran) üretirler. Bu (Şekil 8B ve Şekil 9B) üst üste zaman yanıtların tekrarlanabilirlik belirginleşmektedir. Bireysel tepkiler ince gri izleri vardır ve onların kalın koyu iz anlamına gelir. Sinir Gürültü ortalama ve her bir tepkisi 4,5,9,37,38 arasındaki fark ise, ortalama tepki sinir sinyali olarak alınır. Frekans alanında, ilgili bir sinyal-gürültü oranı (Şekil 8C ve Şekil 9), elektrikli spektrumları halinde sinyal ve ses veri parçaları Fourier dönüştürme ve karşılık gelen ortalama gürültü gücü spektrumunun 4 ortalama sinyal güç spektrumu bölünmesiyle elde edilmiştir 5,9,37,38. Karakteristik olarak, yüksek bir sinyal-gürültü oranı Onatüralist uyarıya kaydedilen sinir çıkışlar (100 - 1000) yüksek f >> değerlere ulaşabilir ve çok düşük kayıt gürültü ile en istikrarlı hazırlıkları 1000 (örneğin, Şekil 8C.). Uyarı Ayrıca ısınma hücrelerin genişletiyor 'sinyal güvenilir bant genişliği 4 (SNR' Parlak ≥ 1); Örneğin, Şekil 8 ve 9, iki R1-R6-S arasındaki nispi farkı sırasıyla, 10 Hz (84 de 20 ° C ve 94 Hz, 25 o C'de) 'dir.
Bir daha Shannon denklemi 32, kullanarak veya üçlü ekstrapolasyon yöntemiyle 39 ile CEVAPLAR 'entropi ve gürültü entropi oranları arasındaki farkı hesaplayarak kendi sinyal-gürültü oranı bilgi transferi her hücrenin oranını tahmin edebilirsiniz. Daha fazla bilgi kuramsal analizler hakkında ayrıntılar ve bunların kullanımı ve sınırlamaözellikle, bu yöntemle daha önceki yayınlarda 7,8,39 verilmiştir s.
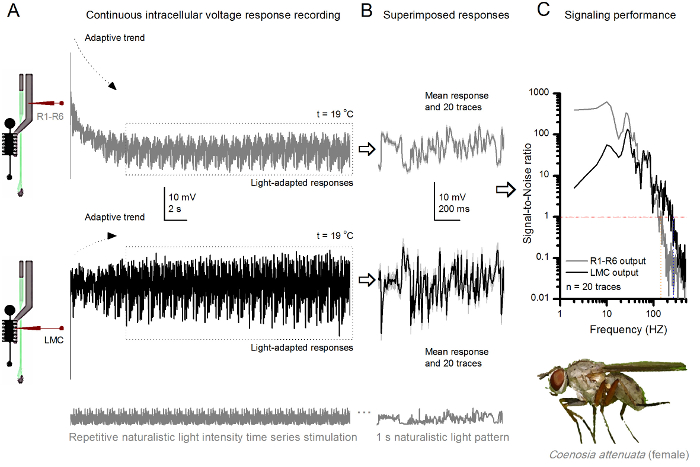
19 o C (A) R1-R6 (gri) ve LMC (siyah) aynı sinek aynı mikroelektrot tarafından kaydedilen çıkışlar da tekrarlanan Doğal Stimülasyon a Killer Fly R1-R6 fotoreseptör ve LMC Şekil 10. Gerilim Tepkiler; Elektrot göz ileri gibi, daha sonra, ilk presynaptically postsynaptically ve. Aynı doğal teşvik desene (B) (yukarıda), 20 üst üste öncesi ve postsinaptik (aşağıda) cevaplar (açık gri izleri) başlangıçtaki uyarlama (A noktalı kutu) sonra ele geçirildi. Bireysel yanıtları kendi farklılıkları gürültü verirken kendi araçları, sinyalleri (üstte koyu izleri) bulunmaktadır. (C) karşılık gelen SignaL-gürültü oranı (SNR) Şekiller 8C ve 9C'deki gibi hesaplanmıştır. LMC çıkış '(134 Hz kadar R MAX ≥1 SNR) R1-R6 çıkışı daha (en fazla 234 Hz LMC MAX ≥1, SNR)' güvenilir sinyalizasyon 100 Hz daha geniş hakkında sahiptir. Her iki sinyal-gürültü oranı (SNR LMC MAX = 137, SNR R MAX = 627) yüksek ve aynı mikroelektrot kayıtlarında kullanılan gibi, aralarındaki farklılıkları öncesi ve postsinaptik nöral çıkışları gerçek farklılıkları yansıtmaktadır. Bu sonuçlar kayıt sistemi, düşük gürültü vardı ve analizler üzerindeki etkisi marjinal oldu. Ima bu rakamın daha büyük bir versiyonunu görmek için lütfen buraya tıklayınız.
Neuroethological Vizyon Çalışmaları
Yöntem aynı zamanda görsel bilgi işleme karşılaştırmalı neuroethological çalışmalar izin, farklı böcek türlerinin 7,8,35,36 bileşik göz (Şekil 10) den öncesi ve postsinaptik gerilim yanıtları kaydetmek için kullanılabilir. sunulan kayıt sistemi için, sadece gerekli adaptasyon çalışılan türler için uygun bir büyüklükte açılması ile yeni hazırlık sahipleri, her biri. Bu örnek kayıtlar bir kadın katil sinek (Coenosia attenuata) uzaklık vardır. Onlar Şekil 9'da Drosophila meslektaşları için kullanıldığı gibi, aynı tekrarlayan ışık uyarısına bir R1-R6 fotoreseptör ve LMC hücre içi gerilim tepkileri gösterir, ancak 19 o C sıcaklıkta Bu durumda, ön-ve postsinaptik veriler aynı sinek kaydedildi; bir birinci yanal lamina boyunca ilerleyen (3 M KCl ile dolu) aynı kayıt elektrodu ile, diğer daha önce girdikten sonraFrontal retina ing. Hatta soğutucu sıcaklığı - - 25 o C, Coenosia veri Drosophila verilerine kıyasla daha hızlı dinamikleri ile tepkilerini gösterir; güvenilir sinyalizasyon (sinyal-gürültü oranı >> 1) daha geniş bir frekans aralığında aralığını genişletiyor. Natüralist uyaranlara nöral kodlama Böyle fonksiyonel uyarlamalar hızlı hava av davranışları ulaşmak için yüksek hassasiyetli zamanmekansal bilgi gerektiren Coenosia 'ın yırtıcı yaşam tarzı 36, tutarlıdır.
Tartışmalar
We have presented the basic key steps of how to use sharp conventional microelectrodes to record intracellular responses of R1-R6 photoreceptors and LMCs in intact fly eyes. This method has been optimized, together with bespoke hardware and software tools, over the last 18 years to provide high-quality long-lasting recordings to answer a wide range of experimental questions. By investing time and resources to construct robust and precise experimental set-ups, and to produce microelectrodes with favorable electrical properties, high-quality recordings can become the norm in any laboratory working on Drosophila visual neurophysiology. Whilst well-designed recording and light stimulation systems are important for swift execution of different experimental paradigms, there are three procedural steps that are even more critical to achieving successful recordings: (i) to make the fly preparation with minimal eye damage, (ii) to pull microelectrodes with the right electrical properties, and (iii) to drive the recording electrode into the eye without breaking its tip. Ultimately, to record meaningful data, the investigator has to understand the physical basis of electrophysiology and how to fabricate suitable microelectrodes for the targeted cell-types.
Therefore, the limitations of this technique are primarily set by the patience, experience and technical ability of the investigator. Because this technique can take a long time to master for small Drosophila cells, it is advisable for trainee electrophysiologists to first practice with larger insect eyes, such as the blowfly36 or locust35, using the same rig. Once performing high-quality intracellular recordings from the larger photoreceptors and interneurons becomes routine, it is time to move on to the Drosophila eye. Another limitation of the technique concerns cellular identification. Penetrated Drosophila cells can be loaded electrophoretically with dyes, including Lucifer yellow or neurobiotin. However, because of the small tip size of the microelectrodes, electrophoresis works less efficiently than with lower resistance electrodes, such as patch-electrodes. Furthermore, the dye-filled microelectrodes characteristically have less favorable electrical properties, making it much harder to record high-quality responses with them from Drosophila photoreceptors and LMCs.
A technical problem that occurs sometimes is unstable input signal, or a complete lack of it. This is often associated with the voltage signal being either constantly drifting or higher/lower than the amplifier's recording range. On most occasions, this behavior is caused by the recording electrode being blocked (or its tip being too fine - having too high a resistance or intramural capacitance - to properly conduct fast signal changes). Although one can try to unblock the tip by buzzing the electrode capacitance, which sometimes works, often the situation is best resolved by simply changing the recording electrode. This may further require parameter adjustments in the microelectrode puller instrument to lower the tip resistance of the new electrodes. The electrode tip can also become blocked in preparations, for which it took too much time to cover the corneal hole by petroleum jelly. Prolonged air-contact can dry up the freshly exposed retinal tissue, turning its surface layer into a glue-like substance. If this is the case, the investigator typically sees a red blob of tissue stuck on the recording electrode when pulling it out of the eye. The only solution here is to make a new preparation. Petroleum jelly may provide many benefits for electrophysiological recordings: (i) it prevents the coagulation of the hemolymph that could break the electrode tip; (ii) it coats the electrode tip reducing its intramural capacitance, which lowers the electrode's time constant, and thus has the potential to improve the temporal resolution of the recorded neural signals40,41; (iii) it keeps the electrode tip clean, facilitating penetrations; and after penetration, (iv) it may even help to seal the electrode tip to the cell membrane42.
The signal can further be unstable or lost when the silver-chloride wire of the electrode-holder is broken or dechloridized; in which case just replace or rechloridize the old wire. The missing signal can also result from one (or both) of the electrode-holders not being securely connected to their jacks. However, it is extremely unusual that a piece of equipment would be malfunctioning. If signal is undetectable and all other possibilities have been exhausted, test that each part of the recording apparatus, including the headstage, amplifier, low-pass filters and AD/DA-converters, are connected properly and functioning normally. One way to achieve this is to replace each instrument with another from a rig that is known to operate normally. Alternatively, use a signal generator to check the performance of the electronic components one by one.
But perhaps the most common technical problem facing the electrophysiologist is that of recording noise. Broadly, recording noise is the observed electrical activity other than the direct neuronal response to a given stimulus. Because the fly preparation, when properly done, is very stable, the observed noise (beyond the natural variably of the responses) most often results from ground-loops in the recording equipment, or is picked up from nearby electrical devices. Such noise is typically 50/60 Hz mains hum and its harmonics; but sometimes composed of more complex waveforms. To work out the origin of the noise, remove the fly preparation holder from the set-up, connect the recording and reference electrodes through a drop of fly Ringer (or place them in a small Ringer's solution bath; see step 1.2.6) and record the signal in CC- or bridge-mode. If noise is observable on the recorded signal, this likely means that the noise is external to the fly preparation.
Another good test for identifying the origin of noise is to replace the electrode-holders with an electric cell model connected to the amplifier. In an ideally configured and grounded set-up, the recorded signal should now be practically noise-free, showing only stochastic bit-noise from the AD-converter (in the best case not even that!). If noise is still present, then recheck that all rig equipment is properly grounded. A convenient approach to detect ground-loops is to: (i) disconnect all the grounding wires from all the parts within the rig; (ii) ensure that, after doing this, every single part is actually isolated from ground, by means of an ohm-meter; (iii) connect the parts, one by one, to the central ground directly, not through any other part of the rig. Try also changing the equipment configurations. For example, sometimes moving the computer and monitor further away from the rig can reduce noise; yet at other times, moving the computer inside the equipment rack reduces noise. It is also worth unplugging nearby equipment to see if noise is reduced, or shield additional components. Furthermore, try unplugging or replacing different components of the recording equipment, especially BNC cables (which can have faulty ground connections). If only bit-noise is observed when using the cell model, the initial noise source is either the electrodes or the fly preparation itself. For example, it could be that the reference electrode is inadvertently touching a motor nerve or active muscle fibers inside the head capsule (or disturbing flight muscles in the thorax - if placed there). It is usually simplest to prepare a new fly for recording, taking care to minimize damage to the fly. But if the noise persists and is broadband, it is likely that the electrodes are suboptimal for the experiments; too sharp/fine (hence too noisy) or just wrong for the purpose; we have even seen quartz-electrodes acting as antennas - picking up faint broadcasting signals! Although iteration of the puller-instrument parameter settings to generate the just right microelectrodes for consistent high-quality recordings from specific cell-types can take a lot of effort, it is worth it. Once the recording electrodes are well-tailored for the experiments, they can provide long-lasting recordings of outstanding quality.
Sharp microelectrode recording techniques can be similarly applied to study neural information processing in multitude of preparations, including different processing layers in the insect eyes and brain43,44. Because the microelectrode tips can be made very fine, these typically damage the studied cells less than most patch-clamp applications. Importantly, the modern sample-and-hold microelectrode amplifiers enable good control of the tips' electrical properties40,45-47. Thus, when correctly applied, this technique can provide reliable data from both in vivo3,5,7-10,44 or in vitro48 preparations with high signal-to-noise ratio at sub-millisecond resolution. Such precision would be impossible with today's optical imaging techniques, which are noisier and slower. Moreover, the method can be used to characterize small cells' electrical membrane properties both in current- and voltage-clamp configurations5,29,33,36,40-42,49, providing valuable data for biophysical and empirical modeling approaches7,8,11,33,49-54 that link experiments to theory.
Açıklamalar
The authors have nothing to disclose
Teşekkürler
The authors thank Mick Swann, Chris Askham and Martin Gautrey for their important contributions in designing and building many electrical and mechanical components of the rigs. MJ's current research is supported by the Biotechnology and Biological Sciences Research Council (BBSRC Grant: BB/M009564/1), the State Key Laboratory of Cognitive Neuroscience and Learning open research fund (China), High-End Foreign Expert Grant (China), Jane and Aatos Erkko Foundation Fellowship (Finland), and the Leverhulme Trust grant (RPG-2012-567).
Malzemeler
| Name | Company | Catalog Number | Comments |
| Stereo Zoom Microscope for making the fly preparation | Olympus | SZX12 DFPLFL1.6x PF eyepieces: WHN30x-H/22 | Capable of ~150X magnification with long working distance; bespoke heavy steel table mount stand |
| Stereomicroscope in the intracellular set-up | · Olympus | Olympus SZX7; eyepieces: WHN30x-H/22 | 30X eyepieces are needed for seeing the electrode tip reflections well when driving it through the small corneal hole into the eye |
| Nikon microscope | Nikon SMZ645; eyepieces: C-W30x/7 | ||
| Anti-vibration Table | Melles Griot | With metric M6 holes on the breadboard | Our bespoke rigs have a large hole drilled through the thick breadboard that lets in the fly preparation platform pole (houses a copper heatsink with electronics) from below |
| Newport | |||
| Micromanipulators | Narishige | Narishige NMN-21 | In our intracellular set-ups, different micromanipulator systems are used for driving the shap recording electrodes into the fly eye. All the listed manipulators are succesfully providing long-lasting stable recordings from Drosophila photoreceptors and LMCs. |
| Huxley Bertram | Huxley xyz-axis with fine manual control | ||
| Sensapex | Sensapex triple axis | ||
| Märzhäuser | Märzhäuser DC-3K with additional x-axis piezo stepper and MS 314 controller | ||
| Magnetic Stands | Any magnetic base with on/off switch will do | For example, to manage cables inside the Faraday cage | |
| Electrode Holders | Harvard Apparatus | ESP/W-F10N | |
| Silver Wire | World Precision Instruments | AGW1510 | 0.3 - 0.5 mm diameter; needs to be chloridized for the electrode holders |
| Fiber Optic Light Source | Many different, including Olympus | ||
| Fiber Optic Bundles | UltraFine Technology | To deliver the LED light stimulus to the Cardan arm system. We use both liquid and quartz light guides (range from UV to IR) | |
| Thorn Labs | |||
| Fly Cathing Tube | P80-50P 50ml Cent. Tube PP., Pack of 100 Pcs | Cut the conical bottom off from 50 ml Plastic Centrifuge Tube and glue a 1 ml pipette tip on it. | |
| Digital Acquisition System | National Instruments | ||
| Single-electrode current/voltage-clamp microelectrode amplifier | npi SEC-10LX | http://www.npielectronic.de/products/amplifiers/sec-single-electrode-clamp/sec-10lx.html | Outstanding performer! |
| Head-stage | Standard (+/- 150 nA) | For npi SEC-10LX | |
| LED light sources and drivers | 2-channel OptoLED (Cairn Research Ltd., UK) | Many of our stimulus systems are in-house built | |
| Self-designed and constructed | |||
| Acquisition and Analyses Software | Many companies to choose from | Biosyst; custom written Matlab-based system for experimental and theoretical work in the Juusola laboratory | |
| Personal Computer or Mac | Ensure that PC or Mac is compatible with data acquisition system and software | ||
| Cardan arm system | Self-designed and constructed | Providing accurate x,y,z-positioning of the light stimuli | |
| Peltier temperature control system | Self-designed and constructed | ||
| Faraday Cage | Self-constructed | Electromagnetic noise shielding | |
| Filamented Borosilicate Glass Capillaries | Outer diameter: 1 mm | ||
| Inner diameter: 0.5 - 0.7 mm | |||
| Filamented Quartz Glass Capillaries | Outer diameter: 1 mm | ||
| Inner diameter: 0.5 - 0.7 mm | |||
| Pipette Puller | Sutter Instrument Company | Model P-2000 laser Flaming/Brown Micropipette Puller | For borosilicate reference electrodes, use the preset program #11 (patch electrodes): Heat = 350; Filament = 4; Velocity 36; Delay = 200).1.2.1). For borosilicate recording electrodes, use the preset program #12 (this typically pulls good conventional sharps for photoreceptor recordings): Heat = 355; Filament = 4; Velocity 50; Delay = 225; Pull = 150. For LMC recordings, which require electrodes with finer tips, these values need to be adjusted. For pulling quartz capillaries, P-2000 manual suggests programs for fine tipped microelectrodes. These programs’ preset parameters serve as useful starting points for systematic modifications to generate electrodes with good penetration success and low recording noise. |
| Extracellular Ringer Solution for the reference electrode | Chemicals from Fisher Scientific | 10326390, NaCl 10010310, KCl 10147753, TES 10161800, CaCl2 10159872, MgCl2 10000430, sucrose | See the recipe in the protocol section |
| 3 M KCl solution for filling the filamented recording microelectrode | Salts from Fisher Scientific | 10010310, KCl | |
| Petroleum jelly | Vaselin | ||
| Non-stainless steel razor blades | |||
| Blade holder/breaker | Fine Science Tools By Dumont | 10053-09 | 9 cm |
| Blu-tack | Bostik | Alternatively, use molding clay | |
| Forceps | Fine Science Tools By Dumont | 11252-00 | #5SF (super-fine tips) |
Referanslar
- Meinertzhagen, I. A., O'Neil, S. D. Synaptic Organization of Columnar Elements in the Lamina of the Wild-Type in Drosophila-Melanogaster. J Comp Neurol. 305, 232-263 (1991).
- Rivera-Alba, M., et al. Wiring Economy and Volume Exclusion Determine Neuronal Placement in the Drosophila Brain. Curr Biol. 21, 2000-2005 (2011).
- Abou Tayoun, A. N., et al. The Drosophila SK Channel (dSK) Contributes to Photoreceptor Performance by Mediating Sensitivity Control at the First Visual Network. J Neurosci. 31, 13897-13910 (2011).
- Juusola, M., Hardie, R. C. Light adaptation in Drosphila photoreceptors: II. Rising temperature increases the bandwidth of reliable signaling. J Gen Physiol. 117, 27-41 (2001).
- Juusola, M., Hardie, R. C. Light adaptation in Drosophila photoreceptors: I. Response dynamics and signaling efficiency at 25 degrees. C. J Gen Physiol. 117, 3-25 (2001).
- Pantazis, A., et al. Distinct roles for two histamine receptors (hclA and hclB) at the Drosophila photoreceptor synapse. J Neurosci. 28, 7250-7259 (2008).
- Song, Z., Juusola, M. Refractory sampling links efficiency and costs of sensory encoding to stimulus statistics. J Neurosci. 34, 7216-7237 (2014).
- Song, Z., et al. Stochastic, Adaptive Sampling of Information by Microvilli in Fly Photoreceptors. Curr Biol. 22, 1371-1380 (2012).
- Zheng, L., et al. Feedback network controls photoreceptor output at the layer of first visual synapses in Drosophila. J Gen Physiol. 127, 495-510 (2006).
- Zheng, L., et al. Network Adaptation Improves Temporal Representation of Naturalistic Stimuli in Drosophila Eye I Dynamics. Plos One. 4, (2009).
- Hardie, R. C., Juusola, M. Phototransduction in Drosophila. Curr opin neurobiol. 34, 37-45 (2015).
- Clandinin, T. R., Zipursky, S. L. Making connections in the fly visual system. Neuron. 35, 827-841 (2002).
- Wernet, M. F., et al. Homothorax switches function of Drosophila photoreceptors from color to polarized light sensors. Cell. 115, 267-279 (2003).
- Wardill, T. J., et al. Multiple Spectral Inputs Improve Motion Discrimination in the Drosophila Visual System. Science. 336, 925-931 (2012).
- Hardie, R. C., Ottoson, D. . Progress in Sensory Physiology. 5, 1-79 (1985).
- Borst, A. Drosophila's View on Insect Vision. Curr Biol. 19, 36-47 (2009).
- Kirschfeld, K. Die Projektion Der Optischen Umwelt Auf Das Raster Der Rhabdomere Im Komplexauge Von Musca. Exp Brain Res. 3, 248-270 (1967).
- Morante, J., Desplan, C. Photoreceptor axons play hide and seek. Nat Neurosci. 8, 401-402 (2005).
- Fischbach, K. F., Hiesinger, P. R. Optic lobe development. Adv Exp Med Biol. 628, 115-136 (2008).
- Shaw, S. R. Early Visual Processing in Insects. J Exp Biol. 112, 225-251 (1984).
- Joesch, M., Schnell, B., Raghu, S. V., Reiff, D. F., Borst, A. ON and OFF pathways in Drosophila motion vision. Nature. 468, 300-304 (2010).
- Clark, D. A., Bursztyn, L., Horowitz, M. A., Schnitzer, M. J., Clandinin, T. R. Defining the Computational Structure of the Motion Detector in Drosophila. Neuron. 70, 1165-1177 (2011).
- Rister, J., et al. Dissection of the peripheral motion channel in the visual system of Drosophila melanogaster. Neuron. 56, 155-170 (2007).
- Vogt, N., Desplan, C. The first steps in Drosophila motion detection. Neuron. 56, 5-7 (2007).
- Strausfeld, N. J., Braitenberg, V. Compound Eye of Fly (Musca-Domestica) - Connections between Cartridges of Lamina Ganglionaris. Z Vergl Physiol. 70, 95-104 (1970).
- Strausfeld, N. J., Campos-Ortega, J. L4-Monopolar Neuron - Substrate for Lateral Interaction in Visual System of Fly Musca-Domestica (L). Brain Res. 59, 97-117 (1973).
- Takemura, S. Y., et al. Cholinergic Circuits Integrate Neighboring Visual Signals in a Drosophila Motion Detection Pathway. Curr Biol. 21, 2077-2084 (2011).
- Shaw, S. R., Frohlich, A., Meinertzhagen, I. A. Direct Connections between the R7/8 and R1-6 Photoreceptor Subsystems in the Dipteran Visual-System. Cell Tissue Res. 257, 295-302 (1989).
- Wolfram, V., Juusola, M. Impact of rearing conditions and short-term light exposure on signaling performance in Drosophila photoreceptors. J Neurophysiol. 92, 1918-1927 (2004).
- Nikolaev, A., et al. Network Adaptation Improves Temporal Representation of Naturalistic Stimuli in Drosophila Eye II Mechanisms. Plos One. 4, (2009).
- Land, M. F. . Compound eye structure: Matching eye to environment. Adaptive Mechanisms in the Ecology of Vision. , (1999).
- Shannon, C. E. A Mathematical Theory of Communication. At&T Tech J. 27, 379-423 (1948).
- Niven, J. E., et al. The contribution of Shaker K+ channels to the information capacity of Drosophila photoreceptors. Nature. 421, 630-634 (2003).
- Randall, A. S., et al. Speed and sensitivity of phototransduction in Drosophila depend on degree of saturation of membrane phospholipids. J Neurosci. 35, 2731-2746 (2015).
- Faivre, O., Juusola, M. Visual Coding in Locust Photoreceptors. Plos One. 3, e2173 (2008).
- Gonzalez-Bellido, P. T., Wardill, T. J., Juusola, M. Compound eyes and retinal information processing in miniature dipteran species match their specific ecological demands. P Natl Acad Sci USA. 108, 4224-4229 (2011).
- Juusola, M., Kouvalainen, E., Järvilehto, M., Weckström, M. Contrast Gain, Signal-to-Noise Ratio, and Linearity in Light-Adapted Blowfly Photoreceptors. J Gen Physiol. 104, 593-621 (1994).
- Juusola, M., Uusitalo, R. O., Weckstrom, M. Transfer of Graded Potentials at the Photoreceptor Interneuron Synapse. J Gen Physiol. 105, 117-148 (1995).
- Juusola, M., de Polavieja, G. G. The rate of information transfer of naturalistic stimulation by graded potentials. J Gen Physiol. 122, 191-206 (2003).
- Weckstrom, M., Kouvalainen, E., Juusola, M. Measurement of Cell Impedance in Frequency-Domain Using Discontinuous Current Clamp and White-Noise-Modulated Current Injection. Pflug Arch Eur J Phy. 421, 469-472 (1992).
- Juusola, M. Measuring Complex Admittance and Receptor Current by Single Electrode Voltage-Clamp. J Neurosci Meth. 53, 1-6 (1994).
- Juusola, M., Seyfarth, E. A., French, A. S. Rapid coating of glass-capillary microelectrodes for single-electrode voltage-clamp. J Neurosci Meth. 71, 199-204 (1997).
- Haag, J., Borst, A. Neural mechanism underlying complex receptive field properties of motion-sensitive interneurons. Nat Neurosci. 7, 628-634 (2004).
- Rien, D., Kern, R., Kurtz, R. Synaptic transmission of graded membrane potential changes and spikes between identified visual interneurons. Eur J Neurosci. 34, 705-716 (2011).
- Muller, A., et al. Switched single-electrode voltage-clamp amplifiers allow precise measurement of gap junction conductance. Am J Physiol-Cell Ph. 276, C980-C987 (1999).
- Polder, H. R., Swandulla, D., Konnerth, A., Lux, H. D. An Improved, High-Current Single Electrode Current Voltage Clamp System. Pflug Arch Eur J Phy. 402, R35-R35 (1984).
- Richter, D. W., Pierrefiche, O., Lalley, P. M., Polder, H. R. Voltage-clamp analysis of neurons within deep layers of the brain. J Neurosci Meth. 67, 121-131 (1996).
- Juusola, M., French, A. S. The efficiency of sensory information coding by mechanoreceptor neurons. Neuron. 18, 959-968 (1997).
- Vähäsöyrinki, M., Niven, J. E., Hardie, R. C., Weckström, M., Juusola, M. Robustness of neural coding in Drosophila photoreceptors in the absence of slow delayed rectifier K+ channels. J Neurosci. 26, 2652-2660 (2006).
- Friederich, U., Coca, D., Billings, S., Juusola, M. Data Modelling for Analysis of Adaptive Changes in Fly Photoreceptors. Lect Notes Comput Sc. 5863, 34-48 (2009).
- Asyali, M. H., Juusola, M. Use of Meixner functions in estimation of Volterra kernels of nonlinear systems with delay. Ieee T Bio-Med Eng. 52, 229-237 (2005).
- French, A. S., et al. The Dynamic Nonlinear Behavior of Fly Photoreceptors Evoked by a Wide-Range of Light Intensities. Biophys J. 65, 832-839 (1993).
- Juusola, M., French, A. S. Visual acuity for moving objects in first- and second-order neurons of the fly compound eye. J Neurophysiol. 77, 1487-1495 (1997).
- Juusola, M., Weckstrom, M., Uusitalo, R. O., Korenberg, M. J., French, A. S. Nonlinear models of the first synapse in the light-adapted fly retina. J Neurophysiol. 74, 2538-2547 (1995).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır